-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sirolimus – alternativa pro léčbu autoimunitní hemolytické anémie způsobené tepelnými protilátkami (WAIHA)
Sirolimus – alternative treatment for warm antibody hemolytic anaemia (WAIHA)
Autoimmune haemolytic anaemia caused due to accelerated destruction of red cells by warm IgG auto-antibodies and activated complement is a rare disease in the paediatric population. It can be life-threatening if resistant to treatment. Corticosteroids lead to complete remission in 80 % of children. Sirolimus is a recently available second-line therapeutic option. We describe the case reports of three patients with autoimmune haemolytic anaemia and warm antibodies in whom sirolimus had a very good effect.
Keywords:
body mass index – WAIHA – sirolimus
Autoři: V. Fiamoli 1; J. Blatný 1; A. Pejchalová 2; O. Zapletal 1; S. Köhlerová 1
Působiště autorů: Oddělení dětské hematologie DN FN Brno 1; Transfuzní a tkáňové oddělení FN Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. 3, p. 264-268.
Kategorie: Kazuistiky
Souhrn
Autoimunitní hemolytická anémie provázená zvýšenou destrukcí erytrocytů vyvolaná tepelnými protilátkami IgG a aktivovaným komplementem je u dětí sice vzácná, ale v případě rezistence na léčbu může být až život ohrožující. U 80 % pacientů vedou k navození remise kortikosteroidy. Sirolimus patří mezi recentně zmiňovanou terapii druhé linie. V článku popisujeme kazuistiky tří pacientů se závažným průběhem autoimunitní hemolytické anémie s tepelnými protilátkami, u kterých měl sirolimus velmi dobrý efekt.
Klíčová slova:
deti – WAIHA – sirolimus
ÚVOD
WAIHA – autoimunitní hemolytická anémie provázená zvýšenou destrukcí erytrocytů vyvolanou IgG protilátkami reagujícími optimálně při teplotě 37 °C a aktivovaným komplementem je v pediatrické populaci vzácné onemocnění. I přes nízkou incidenci, pouze 1 na 100 000 dětí a rok [1], je u dětských pacientů nejčastější příčinou extravaskulární hemolýzy [2], která probíhá zejména ve slezině [3]. U 37 % pacientů se jedná o primární formu, v 53 % je asociovaná s dalšími onemocněními včetně očkování [4, 5] a autoimunitního lymfoproliferativního syndromu [6]. Mezi nejčastější klinické symptomy patří ikterus a únava, z laboratorních parametrů je typická retikulocytóza, pokles hemoglobinu (Hb), vzestup bilirubinu a laktát dehydrogenázy (LDH) [7]. Pro potvrzení diagnózy je třeba vyšetřit krevní obraz včetně retikulocytů, bilirubin, LDH, haptoglobin, přímý (PAT) a nepřímý (NAT) antiglobulinový test, včetně stanovení chladových protilátek proti erytrocytům a komplement C3 [8]. U pacientů s AIHA lze při podezření na lymfoproliferativní onemocnění vyšetřit například i mutaci genu pro cytotoxický T lymfocytární antigen-4 [9] a v současné době nově mutace v genu TLR8 [10], které se zdají být možnou příčinou tohoto patologického stavu. Léčbou první linie jsou steroidy v dávce 1–2 mg/kg/den. Přestože je odpověď na léčbu steroidy u WAIHA horší než u ostatních typů autoimunitních hemolytických anémií a navíc se může vůči nim vyvinout rezistence či závislost na jejich vysokých dávkách [11, 12], vedou steroidy asi u 80 % pacientů k navození remise [13]. V případě jejich selhání jsou dalšími možnostmi léčby rituximab či jiné imunosupresivní léky jako mycofenolát mofetil nebo cyklosporin, splenektomie, eventuálně lze v jistých případech přistoupit i k transplantaci kostní dřeně [14, 15].
Mezi nové léčebné možnosti WAIHA patří sirolimus – makrolidové antibiotikum rapamycin, izolované z aktinomycety Streptomyces hygroscopicus nalezené v polovině 70. let ve vzorcích půdy na Velikonočním ostrově Rapa-Nui [16, 17].
Sirolimus inhibuje proteinkinázu mTOR (mammalian target of rapamycin), která reguluje buněčný růst, proliferaci, motilitu, přežití, syntézu proteinů, autofagocytózu a transkripci. Sirolimus se pro své imunosupresivní, antimykotické a protinádorové účinky [18] primárně používá pro prevenci odhojení transplantované ledviny či k potažení koronárních stentů. Mezi jeho nejčastější nežádoucí účinky patří hepatoxicita, rozvrat tukového metabolismu či bolesti břicha, podrobně viz tabulka 1 [19]. Žádný z nich není ale příliš častý (podle SPC nad 10 %) [18]. Při léčbě sirolimem je nutné monitorovat KO + diff + retikulocyty, ureu, kreatinin, jaterní testy, LDH, glykemii, Na, K, Cl, Ca, P, triacylglyceroly, cholesterol, moč + sediment a plazmatickou hladinu sirolimu [19], jejíž referenční rozmezí je 4–9 μmol/l [20]. Publikovaná doporučená dávka u WAIHA je 2–3 mg/m2 při plazmatických hladinách sirolimu 4–12 ng/ml, kdy cílová optimální plazmatická hladina je 9 ng/ml [6].
Tab. 1. Sirolismus – nežádoucí účinky 
V České republice je sirolimus dostupný ve formě 1 - či 2miligramových tablet a pro menší děti ve formě sirupu 1 mg/1ml.
KAZUISTIKA 1
V září 2014 byl přijat do Dětské nemocnice FN Brno tříměsíční doposud zdravý chlapec s výrazným ikterem a nízkou hladinou Hb.
Několik dní před přijetím byl u dětského praktického lékaře očkován druhou dávkou hexavakcíny (INFANRIX hexa®, GlaxoSmithKline Inc., a Prevenarem /Synflorix®/). Podle maminky byl chlapec pět dní před vakcinací unavený a lehce ikterický. I přesto byl naočkován a teprve následně mu byl odebrán krevní obraz. Pro hodnotu Hb 56 g/l byl odeslán k hospitalizaci do místní okresní nemocnice a záhy přeložen na naše pracoviště. Při přijetí byla hladina Hb 56 g/l, retikulocyty 24,85 %, bilirubin 123,5 μkat/l, LDH 10,6 μkat/l. Značné množství IgG protilátek, které spolu s komplementem opsonizovaly pacientovy erytrocyty, neumožňovalo sérologicky určit erytrocytární antigeny včetně AB0 antigenů; stanovení krevních skupin vyžadovalo použití molekulárně genetické metody. Protilátky byly přítomny i na retikulocytech (obr. 1) a byla aktivována C3 složka komplementu. To vše vedlo k nutnosti podání transfuze inkompatibilních (neshodných s ohledem na přítomnost protilátek v plazmě pacienta) erytrocytů. Dále byla zahájena léčba steroidy i. v. – 15 mg/kg methylprednisolonu tři po sobě následující dny, na což navazovala per os kúra prednisonem. Pro vyšetření lékového typu AIHA lze omezeně použít některé imunohematologické metody, které mohou pomoci stanovit, zda se lék může podílet na vzniku autoimunitní odpovědi. Hexavakcína stejné šarže, kterou byl chlapec očkován, použitá v těchto testech, nevylučovala podíl očkování na vyprovokování autoimunitní reakce. Limitace tohoto vyšetření byla způsobena nutností použití již předem připravené vakcíny ve stříkačce, tudíž nebylo možno určit, která část vakcíny se podílela na hemolýze. Aby se docílilo snížení vysokého titru protilátek, byly chlapci podány i intravenózní imunoglobuliny. Během následujícího roku obdržel chlapec pro neefektivní kortikoterapii, opakované transfuze a pokles Hb až na 31 g/l dvě kúry rituximabu v dávce 375 mg/m2/týden čtyři po sobě jdoucí týdny. První kúra rituximabu vedla k vymizení aktivace komplementu a krátkodobé remisi. Druhá kúra rituximabem byla již bez efektu. K udržení dostatečné hladiny Hb bylo nutné chlapce opět léčit steroidy. V lednu a únoru 2016 chlapec opakovaně vyžadoval podání transfuze, proto jsme se rozhodli zahájit léčbu sirolimem v dávce 2 mg/m2. Prvních 14 dní nebyla chlapci, pro jeho výraznou nespolupráci, rodiči podávána adekvátní dávka sirolimu a v kombinaci s horečnatou infekcí došlo opět k poklesu Hb na 23 g/l. Měsíc po této epizodě na již správné dávce léku došlo k vzestupu Hb na normální hodnoty. Ukázalo se, že efekt léčby je dostatečný pouze při plazmatických hladinách sirolimu nad 6 μg/l, při nižších hladinách docházelo k reaktivaci hemolýzy. Na léčbě sirolimem došlo u chlapce k přechodnému mírnému zvýšení transamináz, triacylglycerolu (TG) a cholesterolu. Jiné nežádoucí účinky jsme nezaznamenali. Vzhledem k možné asociaci očkování a rozvoji WAIHA podstoupil chlapec imunologické vyšetření, které vyloučilo běžnou variabilní imunodeficienci. Hodnoty Hb se nyní u chlapce pohybují kolem 110–120 g/l a Karnofsky-Lansky skóre má 100 %. Febrilní infekce vedou převážně jen k mírným poklesům Hb a za 3,5 roku léčby sirolimem bylo nutné podat transfuzi při infekci pouze 1krát. I přes dobrý klinický stav však nedošlo ke změně titru antierytrocytárních protilátek.
Obr. 1. PAT/NAT u pacienta 1
A – PAT, retikulocyty, periferní krev
B – PAT, erytrocyty periferní krev
C – NAT, plazma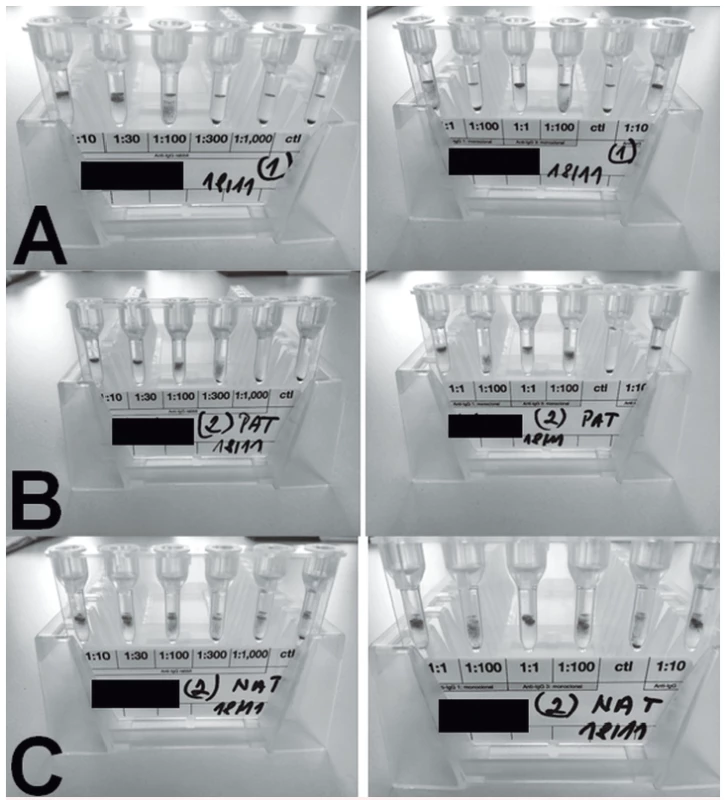
KAZUISTIKA 2
Na začátku září 2015 byl do DN FN Brno přijat devítiměsíční kojenec pro suspektní Evansův syndrom provázený těžkou trombocytopenii (PLT 0 x 109/l) a středně těžkou neutropenii (ANC 0,74 x 109/l). Po podání 2 g/kg intravenózních gamaglobulinů (IvIg) došlo k vzestupu trombocytů (PLT) na 45 x 109/l a chlapec byl propuštěn. Za týden po propuštění byly hodnoty PLT opět 0 x 109/l a neutropenie mírně progredovala (ANC 0,67 x 109/l). Po léčbě vysokodávkovaným prednisonem (4 mg/kg 4 dny) nedošlo k žádnému vzestupu PLT. V tu dobu se u chlapce začal rozvíjet i atopický ekzém. Bylo provedeno vyšetření kostní dřeně (KD), ve které byla lehce zmožená erytropoéza, utlumená granulopoéza, ale počet megakaryocytů a lymfocytů byl dostatečný. Pro dobrý efekt IvIg (1 g/kg) podaných před aspirací kostní dřeně, byla chlapci podána ještě jedna dávka a pacient byl s hodnotami PLT 87 x 109/l a ANC 2,87 x 109/l propuštěn domů. V listopadu téhož roku došlo u pacienta k poklesu trombocytů i neutrofilů na nulové hodnoty. Vyšetření WASP genu vyloučilo Wiskottův-Aldrichův syndrom. Dále byla zvažována diagnóza autoimunitní lymfoproliferativního syndromu, ale ani ta se nepotvrdila. V rámci prevence pneumocystové pneumonie byl chlapci nasazen Biseptol po 2 dny v týdnu a zahájila se pravidelná aplikace IvIg k udržení dostatečné hladiny trombocytů. V prosinci 2015 začala u hocha pomalu klesat hladina Hb, imunohematologickým vyšetřením byla potvrzena WAIHA. Na začátku ledna 2016 měl chlapec hladinu Hb pouze 57 g/l a rozvíjela se splenomegalie. Během ledna a února obdržel chlapec tři transfuze erytrocytů, hladiny PLT byly opakovaně pod 10 x 109/l a ANC stále nula. Antierytrocytární a vázané protilátky proti trombocytům byly pozitivní, protilátky proti leukocytům byly v tu dobu negativní. V polovině února 2016 byla zahájena per os léčba prednisonem v dávce 1 mg/kg, během 3 týdnů došlo k normalizaci hladin trombocytů i neutrofilů. Nicméně pro přetrvávající hemolýzu vyžadující další transfuze byl v polovině března chlapci nasazen sirolimus v dávce 2 mg/kg a pomalu vysazován prednison. Během 5 týdnů se hladina Hb zcela normalizovala a léčba sirolimem byla pro velmi dobrý efekt po 8 měsících ukončena. Od té doby je pacient bez potíží a má fyziologický krevní obraz. Z možných nežádoucích účinků jsme zaznamenali pouze mírné zvýšení transamináz a TG.
KAZUISTIKA 3
V květnu 2016 byl do DN FN Brno přijat dvanáctiletý hoch pro ikterus (bilirubin 201 μkat/l) a hladinu Hb 56 g/l. Pozitivita testu PAT/NAT potvrdila diagnózu WAIHA. Vzhledem k vysokému titru antierytrocytárních protilátek byly chlapci během prvního týdne hospitalizace opakovaně podávány transfuze inkompatibilních erytrocytů, byl léčen pulsy steroidů a následně steroidy per os. Pro vysoký titr protilátek mu byly podány i IvIg. V červnu, v době vysazování prednisonu, se u chlapce rozvinula cholangoitida, pro kterou musel být hospitalizován. Nicméně po jejím odeznění byla hladina Hb v normě. Na konci července došlo při febrilní infekci k výraznému poklesu Hb na 43 g/l. Vzhledem k nutnosti opakovaných transfuzí po tomto relapsu a nedostatečnému efektu monoterapie steroidy byl chlapci v srpnu 2016 nasazen sirolimus v kombinaci s nízkou dávkou prednisonu, který však mohl být během dvou měsíců vysazen. V listopadu 2016 byl přijat pro enteritidu, která vedla k další hemolytické atace, ale již bez nutnosti transfuze. Pro trvající hemolýzu a žlučové kameny byla chlapci v prosinci 2016 provedena endoskopická retrográdní cholangiopankreatikografie. Na začátku března 2017 došlo k normalizaci bilirubinu a od konce března 2017 má chlapec i normální hladiny Hb. Jediným nežádoucím účinkem léčby byla dočasně mírně zvýšená hladina TG. Bohužel i přes dlouhodobou imunosupresivní léčbu, dobrý klinický stav i laboratorní parametry, stále přetrvává pozitivní přímý i nepřímý antiglobulinový test svědčící pro přítomnost tepelné autoprotilátky.
DISKUSE A ZÁVĚR
Ačkoli WAIHA není provázena fatální hemolýzou tak často, jako AIHA s chladovými protilátkami [2], může být u pacientů rezistentních na první linii léčby letálním onemocněním, což potvrzuje i opakovaný pokles hemoglobinu na život ohrožující hladiny u pacienta v první kazuistice. Podle publikovaných dat má sirolimus dobrý efekt u dětí s AIHA asociovanou s autoimunitním lymfopoliferativním syndromem, solidními tumory a transplantací kostní dřeně, stejně tak jako u primární AIHA [21–24]. Nutnost navýšení iniciální dávky sirolimu u všech tří pacientů minimálně o 0,5 mg/m2, podobně jako v publikované literatuře [6], svědčí o tom, že nejlepšího léčebného efektu lze dosáhnout při dávce, která odpovídá plazmatické hladině vyšší než 6 μg/l, tj. v horní polovině rozmezí. Miano hodnotí efekt terapie sirolimem po 3 měsících léčby. U těch, kteří mají dobrou odpověď, pokračuje v plné dávce po dobu 2 let a následně během 6 měsíců dávku postupně vysazuje [6]. U dvou z našich pacientů nelze pro stále vysoký titr antierytrocytárních protilátek nijak predikovat, kdy – a zda vůbec – bude moci být léčba ukončena. Naopak u pacienta v druhé kazuistice, byl nástup efektu léčby sirolimem včetně vymizení protilátek tak rychlý, že jsme léčbu úplně ukončili již po necelém roce. A přesto má chlapec od vysazení sirolimu normální hladiny hemoglobinu a remise trvá již 2,5 roku. Lze tedy spekulovat, že u tohoto chlapce se jednalo o prostou WAIHA, zatímco u druhých dvou dětí je možno uvažovat o složitější dysregulaci imunitního systému, přestože se konkrétní porucha zatím nepotvrdila, proto jsme vzorky všech tří pacientů recentně zaslali k celogenomové sekvenaci.
Stran nežádoucích účinků jsme zaznamenali jen nepatrnou přechodnou elevaci jaterních testů u dvou pacientů a u všech pacientů mírnou rozladu v lipidovém metabolismu.
Těmito jednotlivými kazuistikami bychom chtěli poukázat na to, že sirolimus může být jednou z efektivních léčebných alternativ WAIHA, která je sice u dětí vzácné onemocnění, ale v některých případech s nejasnou prognózou a s nejistou odpovědí na standardní léčbu [11].
Také bychom rádi upozornili, že očkování může být, i když raritně, jedním ze spouštěcích faktorů WAIHA [25], tak jak tomu bylo u pacienta v první kazuistice. Proto by měli být očkováni pouze pacienti bez zjevných klinických příznaků (včetně ikteru a anémie). V ostatních případech je pravděpodobně bezpečnější očkování odložit.
Použité zkratky
AIHA – autoimunitní hemolytická anémie
ANC – absolutní počet neutrofilů
DN FN – Dětská nemocnice Fakultní nemocnice
Hb – hemoglobin
IvIg – intravenózní imunoglobuliny
KD – kostní dřeň
LDH – laktátdehydrogenáza
mTOR – mammalian target of rapamycin
NAT – nepřímý antiglobulinový test
PAT – přímý antiglobulinový test
PLT – platelets, trombocyty
TG – triacylglycerol
WAIHA – autoimunitní hemolytická anémie s tepelnými protilátkami
Podíl autorů na přípravě rukopisu
VF – napsala rukopis
JB, SK, OZ – byli ošetřujícími lékaři zmíněných pacientů a podíleli se na revizích rukopisu
AP – prováděla imunohematologická vyšetření a podílela se na revizích rukopisu
Všichni autoři schválili finální verzi rukopisu.
Čestné prohlášení
Autoři prohlašují, že nemají žádný konflikt zájmů.
Do redakce doručeno dne 10. 12. 2018.
Přijato po recenzi dne 1. 4. 2019
MUDr. Veronika Fiamoli, Ph.D.
Oddělení dětské hematologie DN FN Brno
Černopolní 9
613 00 Brno
e-mail: fiamoli.veronika@fnbrno.cz
Zdroje
1. Silberstein LE, Cunningham MJ. Autoimmune hemolytic anemias. In: Hillyer, Christopher D. Blood banking and transfusion medicine: basic principles & practice. Philadelphia, PA: Churchill Livingstone/Elsevier, 2007 : 557–570.
2. Aladjidi N, Leverger G, Leblanc T, et al. New insights into childhood autoimmune haemolytic anemia: a French national observational study of 265 children. Haematologica 2011;96 : 655–663.
3. Vagace JM, Bajo R, Gervasini G. Diagnostic and theurapeutic challenges of primary autoimmune haemolytic anemia in children. Arch Dis Child 2014;99 : 668–673.
4. Chen RT, Pless R, Destefano F. Epidemiology of autoimmune reactions induced vaccination. J Autoimmun 2001;16(3):309–318.
5. Zanella A, Barcellini W. Treatment of autoimmune hemolytic anemias. Haematologica 2014;99(10):1547–1554.
6. Miano M. How I manage Evans syndrome and AIHA cases in children. Br J Haematol 2016;172(4):524–534.
7. Buliková A. Extrakorpuskulární hemolytické anemie. In: Penka M, Bulikova A a kolektiv. Neonkologická hematologie, 2. doplněné a zcela přepracované vydání. Praha, Grada 2009;78–91.
8. Mathew P, Chen G, Wang W. Evans syndrome: results of a national survey. J Pediatr Hematol Oncol 1997;19(5):433–437.
9. Seidel GM. Autoimmune and other cytopenias in primary immunodeficiencies: pathomechanism, novel differential diagnoses, and treatment. Blood 20014;124 : 2337–2344.
10. Svaton M, Sukova M, Hložková K. Imunitní dysregulace a imunitní cytopenie na podkladě vrozené mutace v TLR8. XXVIII. konference dětských hematologů a onkologů České a Slovenské republiky. Sborník abstrakt 2018;47.
11. Heisel MA, Ortega JA. Factors influencing prognosis in childhood autoimmune hemolytic anemia. Am J Pediatr Hematol Oncol 1983;5(2):147–152.
12. Zecca M, Nobili B, Ramenghi U, et al. Rituximab for the treatment of refractory autoimmune hemolytic anemia in children. Blood 2003;101(10):3857–3861.
13. King KE, Ness PM. Treatment of autoimmune hemolytic anemia. Semin Hematol 2005;42 : 131–136.
14. Norton A, Roberts I. Management of Evans syndrome. Br J Haematol 2006;132(2):125–137.
15. Michel M. Classification and therapeutic approaches in autoimmune hemolytic anemia: an update. Expert Rev Hematol 2011;4(6):607–618.
16. Seto B. Rapamycin and mTOR: a serendipitous discovery and implications for breast cancer. Clin Translat Med; 2012;1 : 29. Publikováno elektronicky 15 listopadu 2012; doi:10.1186/2001-1326-1-29.
17. Pritchard DI. Sourcing a chemical succession for cyclosporin from parasites and human pathogens. Drug Discovery Today 2005;10(10):688–691.
18. Zhan P, TEY SK, Koyama M, et al. Induced regulatory T cells promote tolerance when stabilized by Rapamycin and IL-2 in vivo. Immunology 2013;191 : 5291–5303.
19. http://www.sukl.cz/modules/medication/detail.php?code=0027243&tab=texts
20. http://iweb3.fnusa.cz/wp-content/uploads/2018/05/Laboratorni_prirucka_LOKB_verze_12_2018_vytisk_c4.pdf
21. Miano M, Calvillo M, Palmisani E, et al. Sirolimus for the treatment of multi-resistant autoimmune haemolytic anaemia in children. Br J Haematol 2014;167(4):571–574.
22. Miano M, Scalzone M, Perri K, et al. Mycophenolate mofetil and Sirolimus as second or further line treatment in children with chronic refractory Primitive or Secondary Autoimmune Cytopenias: a single centre experience. Br J Haematol 2015;171(2):247–253.
23. Valentini R, Imam A, Warrier I, et al. Sirolimus rescue for tacrolimus-associated post-transplant autoimmune hemolytic anemia. Ped Transplant 2006;10(3):358–361.
24. Park JA, Lee HH, Kwon HS, et al. Sirolimus for refractory autoimmune hemolytic anemia after allogeneic hematopoietic stem cell transplantation: a case report and literature review of the treatment of post-transplant autoimmune hemolytic anemia. Transfus Med Rev 2016;30(1):6–14.
25. Seltsam A, Shukry-Schulz S, Salama A. Vaccination-associated immune hemolytic anemia in two children. Transfusion 2000;40(8):907–909.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2019 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Klinické obrazy histiocytózy z Langerhansových buněk v dospělosti
- Farmakokinetika v léčbě hemofilie
- Osteonekróza čelisti, atypické fraktury kostí a další méně časté nežádoucí účinky bisfosfonátů
- Nábor dárců krvetvorných buněk do Českého národního registru dárců dřeně v letech 2013–2017 (demografická data)
- Externí hodnocení kvality stanovení CD34+ buněk v České a Slovenské republice – dlouhodobé zkušenosti z osmiletého období
- Sirolimus – alternativa pro léčbu autoimunitní hemolytické anémie způsobené tepelnými protilátkami (WAIHA)
- Revakcinace dospělých pacientů po alogenní transplantaci krvetvorných buněk: doporučení České leukemické skupiny – pro život
- Monografie profesora Adama a kolektivu: Maligní onemocnění, psychika a stres
- Profesor MUDr. Jaroslav Čermák, CSc., 65letý
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Osteonekróza čelisti, atypické fraktury kostí a další méně časté nežádoucí účinky bisfosfonátů
- Revakcinace dospělých pacientů po alogenní transplantaci krvetvorných buněk: doporučení České leukemické skupiny – pro život
- Farmakokinetika v léčbě hemofilie
- Profesor MUDr. Jaroslav Čermák, CSc., 65letý
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



