-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Třetí celostátní protokol léčby dětské akutní lymfoblastické leukemie znamenal další zlepšení výsledků. Studie ALL-BFM 95 u dětí v České republice 1995-2002
Third consecutive national study ALL-BFM 95 improved the outcome of acute lymphoblastic leukemia in children in the Czech Republic
Treatment of childhood acute lymphoblastic leukemia (ALL) according to the protocol ALL-BFM 95 was performed at 8 departments of pediatrics between 1996–2002 in the Czech Republic. Patients were stratified into 3 risk groups (standard risk-SR, medium risk-MR and high risk-HR) according to the early treatment response, age, initial WBC and the finding of translocations t(9;22) or t(4;11). Total duration of treatment was 2 years except for boys of SR for whom it was three years. 386 children were enrolled into the study and the treatment results were evaluable in 380 patients with a median follow-up of 8.2 years. Complete remission (CR) was achieved in 95.5% pts, 3.9% children died in CR. Stratification into the risk groups was as follows: SR 32.4%, MR 53.7% and HR 13.9%. 69 children (19%) suffered from relapse, isolated CNS relapse has been diagnosed only in 1.1%. Two children (0.6%) developed secondary cancer. Event-free survival (EFS) is 73.1% and overall survival (OS) 80.8%. The results improved in comparison with previous study ALL-BFM 90 (EFS 71.3%; OS 76.4%) despite treatment reduction for 2/3 of patients. EFS/OS were in SR 84.5/93.2%, MR 74/82.1% and HR 43.1/47.1%. The prognosis of T-ALL (EFS 64.8%) was significantly worse in comparison with BCP-ALL (EFS 75.8%). Only 7 children underwent stem cell transplantation in the first CR. Survival of children with ALL in the Czech Republic exceeded 80%. Significant improvement was particularly achieved in HR group (EFS in previous study only 28.2%).
Key words:
acute lymphoblastic leukemia, children, chemotherapy, protocol ALL-BFM 95, relapse
Autoři: J. Starý 1; P. Gajdoš 1; H. Hrstková 2; L. Kopečná 2; J. Štěrba 3; D. Dembická 3; D. Mendelová 3; D. Pospíšilová 4; M. Hajdúch 4
; B. Blažek 5; H. Ptoszková 5; J. Hak 6; K. Toušovská 6; D. Procházková 7; Z. Černá 8; Y. Jabali 9; P. Timr 9; P. Smíšek 1; V. Vávra 1; K. Zdráhalová 1; P. Sedláček 1; L. Šrámková 1; V. Komrska 1; E. Mejstříková 1; A. Vrzalová 1; K. Kramarzová 1; K. Michalová 10; Z. Zemanová 10; M. Jarošová 11; J. Housková 12; J. Zuna 1; O. Hrušák 1; J. Trka 1; V. Mihál 4
Působiště autorů: Klinika dětské hematologie a onkologie UK 2. LF a FN Motol, Praha, 2I. dětská interní klinika LF MU a FN Brno, 3Klinika dětské onkologie FN Brno, 4Dětská klinika LF UP a FN Olomouc, 5Klinika dětského lékařství FN Ostrava, 6Dětská klinika FN Hradec Králové 1
Vyšlo v časopise: Transfuze Hematol. dnes,14, 2008, No. 3, p. 102-109.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Léčba dětské ALL podle protokolu ALL-BFM 95 byla v osmi pediatrických klinikách České republiky zahájena 1. 6. 1996 a příjem pacientů byl ukončen 31. 10. 2002. Jedno centrum zahájilo pilotní studii léčby svých pacientů již na podzim 1995. Do studie byly zařazeny děti ve věku 0–18 let, kojenci byli od roku 1999 léčeni v mezinárodní studii Interfant 99. Pacienti byli podle časné odpovědi na léčbu, věku, iniciálního počtu leukocytů a nálezu translokace t(9;22)/BCR-ABL nebo t(4;11)/MLL-AF4 řazeni do skupiny standardního (SR), středního (MR) a vysokého (HR) rizika a léčeni odlišně. Protokol ALL-BFM 95 snížil ve srovnání s předchozí léčbou ALL-BFM 90 u všech pacientů dávku l-asparaginázy v indukční fázi léčby, SR pacientům redukoval dávku daunorubicinu v indukci na polovinu, s výjimkou T-ALL vypustil preventivní ozáření CNS v MR skupině, kde naopak byla udržovací léčba MTX+6-MP posílena pulzy vinkristinu a dexametazonu formou randomizované studie. Léčba dětí HR byla posílena zařazením protokolu II a zvýšením dávky alkylačních cytostatik. Celková doba léčby byla 2 roky, chlapci SR byli léčeni 3 roky. Do studie bylo zařazeno 386 dětí a léčba byla k 31. 7. 2007 hodnotitelná s mediánem sledování 8,2 roku (4,8–11,9) u 380 z nich. Kompletní remise dosáhlo 95,5 % pacientů, 3,9 % zemřelo v remisi. V SR bylo léčeno 32,4 %, v MR 53,7 % a HR 13,9 % dětí. Relaps prodělalo 69 (19 %) dětí, izolovaný CNS relaps pouze 4 (1,1 %) pacienti. Dvě děti (0,6 %) vyvinuly sekundární malignitu. Pravděpodobnost přežití do selhání (EFS) je 73,1% a celkového přežití (OS) 80,8 %, což znamená zlepšení výsledků léčby ve srovnání s ALL-BFM 90 (EFS 71,3 %; OS 76,4 %). EFS/OS dětí standardního rizika bylo 84,5/93,2 %, MR 74/82,1 % a HR 43,1/47,1 %. Prognóza dětí starších 10 let (n = 117; EFS 62,4%) byla signifikantně horší než dětí mladších. Velmi dobrou prognózu měly děti s TEL/AML1+ALL (n = 85; OS 91,1 %) a děti s významnou hyperdiploidií (n = 57; OS 96,5 %). Naproti tomu prognóza pacientů s Ph1+ALL byla velmi špatná (n = 9; EFS/OS 11/33%). Děti s T-ALL (EFS 64,8 %) měly signifikantně horší prognózu než pacienti s BCP-ALL (EFS 75,8 %). Sedm dětí podstoupilo transplantaci kostní dřeně v první remisi, tři prodělaly relaps, 4 žijí v CR1. Šance na vyléčení dětské ALL přesáhla v České republice 80 %. Významné zlepšení výsledků bylo dosaženo zejména ve skupině dětí vysokého rizika (EFS na předchozím protokolu 28,2 %). Redukce léčebných postupů zvyšujících riziko pozdních následků léčby nezhoršila celkové výsledky.
Klíčová slova:
akutní lymfoblastická leukemie, děti, chemoterapie, protokol ALL-BFM 95, relapsV období 1990–1996 byly děti s akutní lymfoblastickou leukemií (ALL) v České republice léčeny podle německého protokolu ALL-BFM 90. V průběhu 6 let bylo v ČR diagnostikováno 366 dětí s ALL a kritéria hodnocení studie splnilo 352 dětí. Děti byly léčeny v 10 centrech. Procento dosažených remisí činilo 94,3 % a 7letý EFS byl 71,3 %, což znamenalo signifikantní zlepšení proti předchozímu protokolu ALL-BFM 83, používanému v ČR v druhé polovině 80. let (1, 2). Léčba dětské ALL podle nového protokolu ALL-BFM 95 byla v osmi pediatrických klinikách České republiky zahájena 1. 6. 1996 a příjem pacientů byl ukončen 31. 10. 2002. Jedno centrum zahájilo pilotní studii léčby svých pacientů již na podzim 1995. Do studie byly zařazeny děti ve věku 1–18 let, kojenci mladší jednoho roku byli od roku 1996 léčeni nejdříve americkým protokolem POG 9407, od roku 1999 v mezinárodní prospektivní studii Interfant 99 (3). Cílem této multicentrické kooperativní studie bylo zařazení moderních metod diagnostiky a zlepšení výsledků léčby dětí s ALL v České republice. Etické komise jednotlivých nemocnic vyslovily souhlas s provedením studie.
Pacienti a metody
Diagnóza ALL byla stanovena v lokálním centru morfologickým a cytochemickým hodnocením nátěrů kostní dřeně a periferní krve. Zařazení pacientů do studie na základě morfologických a cytochemických vyšetření bylo potvrzeno při pravidelných schůzkách „Pracovní skupiny pro dětskou hematologii České republiky“. Podmínkou diagnózy ALL byl nález 25 % a více lymfoblastů v kostní dřeni. Leukemická infiltrace mozku byla definována jako nález 5/μl jaderných buněk v mozkomíšním moku při současném nálezu lymfoblastů v nátěru z cytospinu.
Imunofenotypizace byla provedena v imunologických laboratořích na průtokovém cytometru s využitím širokého panelu komerčně dosažitelných monoklonálních protilátek. 327 (86%) z 380 pacientů zařazených do studie bylo vyšetřeno v referenční laboratoři průtokové cytometrie ve FN Motol s využitím dvoubarevné cytometrie. Vyšetřování všech dětí s ALL z České republiky bylo v této laboratoři zahájeno v roce 1997. Monoklonální protilátky byly přímo konjugovány s fluorescein isothiocyanátem a phycoerythrinem (4). Kritéria pozitivity byla definována podle doporučení mezinárodní skupiny BFM (5). Povrchové antigeny byly vyšetřeny ve vzorcích kostní dřeně a/nebo periferní krve a byly hodnoceny jako pozitivní, byly-li vyjádřeny na 20% leukemických buněk s více než 98% intenzitou fluorescence ve srovnání s negativními kontrolami. TdT a cytoplazmatické (cy) antigeny byly hodnoceny jako pozitivní za předpokladu, že více než 10% buněk vykazovalo jadernou nebo cytoplazmatickou fluorescenci. Imunologické podskupiny byly definovány podle kritérií EGIL následovně: Pro-B ALL: TdT+, CD19+, CD10-, cyIgM-, sIg-; common (c) ALL: TdT+, CD19+, CD10+, cyIgM-, sIg-; pre-B ALL: TdT+, CD19+, CD10+/-, cyIgM+, sIg-; T-ALL: TdT+, cyCD3+, CD7+ (6).
Karyotyp leukemických buněk byl hodnocen v cytogenetických laboratořích fakultních nemocnic v Praze, Plzni, Hradci Králové, Olomouci a Brně s využitím standardních technik (7). Prospektivní screening k detekci fúzních genů BCR/ABL, MLL/AF4 a TEL/AML1 byl prováděn v laboratoři molekulární genetiky II. dětské kliniky FN Motol (později Kliniky dětské hematologie a onkologie)(8). Vyšetření bylo provedeno u 359 (94 %) dětí z 380 pacientů zařazených do studie.
Kritéria hodnocení léčebné odpovědi
Kompletní remise byla definována jako nepřítomnost leukemických blastů v krvi a mozkomíšním moku, méně než 5 % blastů v kostní dřeni a nepřítomnost lokální nádorové masy. Relaps byl definován jako znovuobjevení se ≥ 25 % blastů v kostní dřeni nebo lokalizovaných leukemických infiltrátů kdekoliv.
Rozdělení pacientů do rizikových skupin a léčba
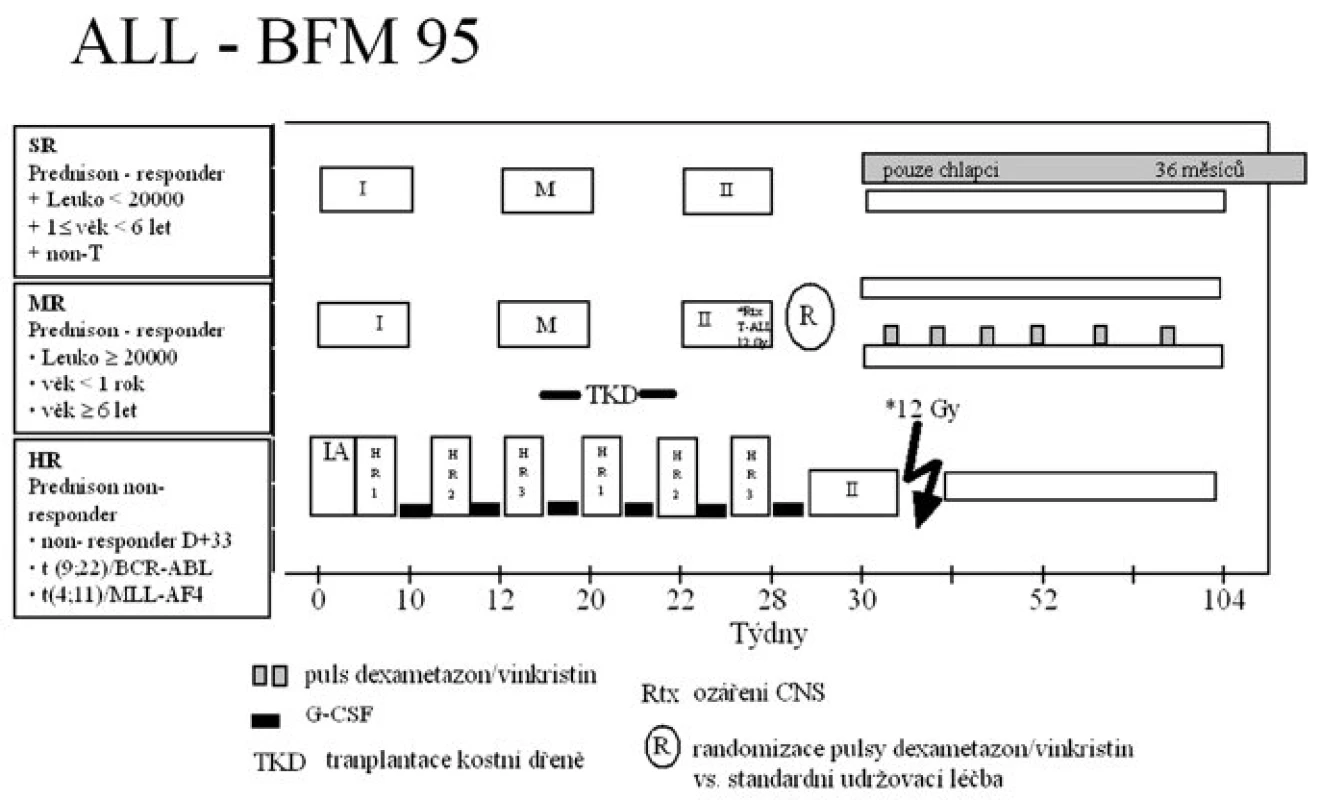
Protokol ALL-BFM 95 a jeho jednotlivé fáze jsou znázorněny na obrázku 1.
Stručná charakteristika protokolu: Pacienti byli rozděleni do skupiny standardního rizika (SR), středního rizika (MR) a vysokého rizika (HR). Hlavními kritérii rozdělení do rizikových skupin byly odpověď na prednizonovou předfázi a dosažení remise den 33 léčby, počet leukocytů v periferní krvi, věk, T imunofenotyp a nepříznivý genotyp Ph1/BCR-ABL a t(4;11)/MLL-AF4.
Všichni pacienti zahájili léčbu sedmidenní prednizonovou předfází. Dobrá odpověď na prednizon (PGR = prednison good responder) byla definována jako pokles blastů >1000/μl v periferní krvi osmý den léčby kortikoidy a jednou intratekální injekcí metotrexátu (IT-MTX). Pro diagnózu špatné odpovědi na prednizonovou předfázi (PPR – prednison poor responder) byl požadován nález více než 1000 blastů/μl v periferní krvi.
Na základě výsledku prednizonové předfáze byli pacienti zařazeni do rizikových skupin:
SR: PGR + leukocyty < 20 x 109/l + 1≤ věk < 6 let + non-T ALL
MR: PGR a leukocyty ≥ 20 x 109/l a/nebo věk < 1 rok a/nebo věk ≥6 let
HR: PPR a/nebo non-responder po skončení indukce (protokol IA) a/nebo Ph1/BCR-ABL a/nebo t(4;11)/MLL-AF4
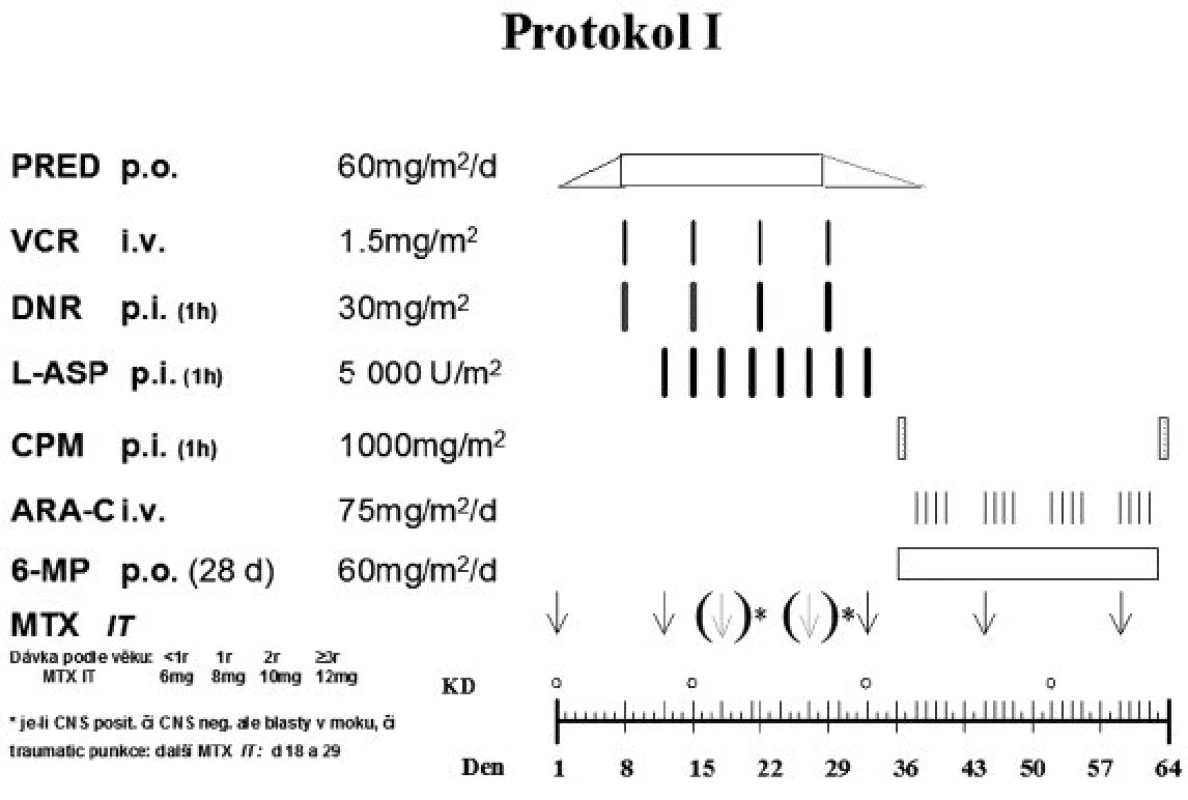
Indukční fáze léčby (protokol IA) následovala po týdenní prednizonové předfázi a skládala se z 5 léků podaných v průběhu 4 týdnů: denně podávaný prednizon, intratekální metotrexát (IT-MTX) ve dnech 12 a 33, 4x po týdnu aplikovaný vinkristin a daunorubicin (u SR podány pouze 2 dávky daunorubicinu) a každý třetí den asparagináza v dávce 5000 IU/m2 (v předchozím protokolu ALL-BFM 90 byla dávka 10 000 IU/m2). Následná terapie (protokol IB) sestávala pro pacienty SR a MR z denního podání merkaptopurinu (6-MP) po 4 týdny, cyklofosfamidu ve dny 36 a 64, cytosin arabinosidu (Ara-C) 4x týdně/4 týdny a IT-MTX ve dnech 45 a 59. Protokol I je zobrazen na obrázku 2.
Konsolidační fáze pro rizikové skupiny SR a MR (protokol M) sestávala z 8týdenního podání 6-MP a 4 dávek vysoce dávkovaného MTX (HD MTX) v dávce 5 g/m2/24 hodin. První dávka leukovorinu 15 mg/m2 byla podána 42 hodin od začátku infuze, dvě následné dávky 15 mg/m2 byly podány 48 a 54 hodin po začátku infuze. Další leukovorin byl podán pouze v situaci, kdy hladina MTX byla 54. hodinu ≥ 0,25 μmol/l. Pozdní intenzifikace (protokol II) sestávala ze 4 týdnů dexametasonu, po týdnu podávaného vinkristinu a doxorubicinu, 4 dávek asparaginázy následované cyklofosfamidem v den 36, dvěma týdny 6-thioguaninu (6-TG), Ara-C 4x týdně/2 týdny a IT-MTX ve dnech 38 a 45.
U pacientů vysokého rizika následovala po 4týdenní indukci intenzivní konsolidace sestávající z šesti 6denních bloků obsahujících kombinaci dexametazon, vinkristin/vindesin, 6-TG/6-MP, asparagináza, daunorubicin, cyklofosfamid, ifosfamid, etoposid, IT-MTX/Ara-C/metylprednizolon, HD MTX a HD Ara-C. Mezi cykly chemoterapie dostávali pacienti preventivně G-GSF. Po skončení bloků následoval protokol II ve stejném složení jako u pacientů SR a MR.
Preventivní ozáření mozku v dávce 12 Gy bylo provedeno pouze u pacientů skupiny rizika HR a u dětí s T-ALL po skončení konsolidační léčby. V případě iniciální infiltrace CNS byla dávka kraniálního ozáření 18 Gy s redukcí závisející na věku a byly navíc aplikovány dvě injekce IT-MTX v protokolu I a II pacientům všech rizikových skupin. Pacienti HR skupiny dostali navíc 1 dávku triplet-IT (MTX/Ara-C/metylprednizolon) v průběhu konsolidace. V situaci, když byl mozkomíšní mok v diagnostické punkci kontaminován krví, dostali pacienti dvě další injekce IT-MTX v průběhu indukční léčby. Po každé intratekální aplikaci byli pacienti v Trendelenburgově pozici po dobu 2 hodin.
Intenzivní léčba byla u pacientů všech rizikových skupin následována udržovací terapií sestávající z denně podávaného 6-MP a týdně MTX per os. Ve skupině MR byla prováděna randomizace výše uvedené udržovací léčby versus 6-MP a MTX posílené o 6týdenních pulzů dexametazonu a 2 dávek vinkristinu každý 9. týden léčby. Studijní centrála pro randomizaci byla ve FN Motol. Celková doba léčby byla 2 roky pro všechny pacienty skupiny rizika MR a HR a dívky ze skupiny rizika SR a 3 roky pro chlapce zařazené do SR skupiny.
K transplantaci krvetvorných buněk (SCT) od HLA identického sourozence byli indikováni pacienti vysokého rizika s nálezem:
- Ph1/BCR-ABL+ ALL
- t(4;11)/MLL-AF4+ ALL
- ≥ 5 % blastů v kostní dřeni po skončení indukce (den 33) a pacienti se špatnou odpovědí na prednizonovou předfázi (PPR) a alespoň jedním z následujících kritérií:
- T-ALL
- pro-B ALL
- leukocyty ≥ 100 x 109/l
Statistická analýza: Křivky přežití byly konstruovány podle metody Kaplana-Meiera a rozdíly byly počítány pomocí testu log-rank (9, 10). Pro stanovení přežití do selhání (EFS = event-free-survival) byly jako selhání hodnoceny smrt v indukci, nedosažení remise (non-responder), smrt v remisi, relaps nebo sekundární malignita.
Výsledky léčby byly vyhodnoceny k 31. 7. 2007, minimální doba sledování byla 4,8 roku.
Výsledky
Do studie bylo zařazeno 386 dětí a léčba byla k 31. 7. 2007 hodnotitelná s mediánem sledování 8,2 r (4,8–11,9 r) u 380 z nich. Šest dětí (1,5 %) bylo vyřazeno ze studie z následujících důvodů: smrt před zahájením léčby (n = 2), odmítnutí léčby (n = 1), ALL byla sekundární malignitou (n = 1), významné porušení protokolu (n = 2). Tři ze 6 vyřazených dětí žijí v remisi. Sedm dětí souboru mělo Downův syndrom. Charakteristika souboru pacientů zařazených do studie je v tabulce 1.
Tab. 1. Charakteristika souboru (N = 380). 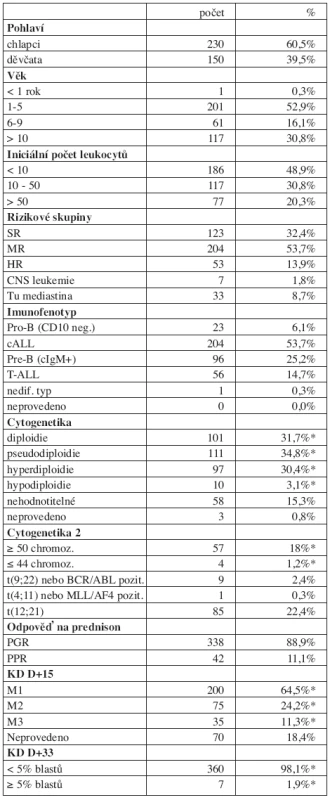
*Procento pacientů se zjištěnou informací Výsledky léčby
Pravděpodobnost přežití do selhání (EFS) je pro celou skupinu 380 dětí 73,1 % (SE 2 %), pravděpodobnost celkového přežití (OS) je 80,8 % (SE 2 %) (graf 1).
Graf 1. Event-free survival a celkové přežití (OS) 380 dětí s non-B ALL léčených ve studii ALL-BFM 95. 
Sedmiletý EFS je pro skupinu pacientů SR 84,5 % (SE 3 %), 74,0 % (SE 3 %) pro MR a 43,1 % (SE 7 %) pro vysoké riziko (HR) (graf 2). Výsledky léčby dětí standardního rizika jsou signifikantně lepší než dětí středního rizika (p = 0,019) a prognóza pacientů v obou skupinách je významně lepší než u pacientů zařazených do vysokého rizika (p = 0,0001).
Graf 2. Event-free survival pacientů v protokolu ALL-BFM 95 podle rizikových skupin. *= dva pacienti byli vyřazeni – chybné zařazení do HR 
Sedm dětí podstoupilo alogenní SCT v první remisi. Indikací bylo nedosažení remise po skončení indukce (n = 1), T-ALL + PPR (n = 2), PPR + leukocyty > 100 x 109/l (n = 2), t(4;11) (n = 1) a Ph1+ALL + NRd33 (n = 1). Tři z nich prodělaly relaps leukemie po transplantaci a čtyři žijí v první remisi.
Patnáct dětí (4 %) zemřelo v indukci před dosažením remise: na infekci (n = 9), krvácení do mozku (n = 2), pankreatitidu (n = 1), trombózu mozkových žilních splavů (n = 1), multiorgánové selhání (n = 2). Dva pacienti měli rezistentní nemoc (non-responder) a zemřeli (jeden v průběhu léčby na toxicitu, druhý s Ph1+ALL dosáhl remise na léčbě imatinibem, byl transplantován v první remisi od nepříbuzného dárce a zemřel na potransplantační relaps).
Z 363 (95,5 %) dětí, které dosáhly remisi po skončení indukce, zemřelo 14 (3,9 %) v kompletní remisi: na infekci (n = 10) a multiorgánové selhání v důsledku toxicity léčby (n = 4).
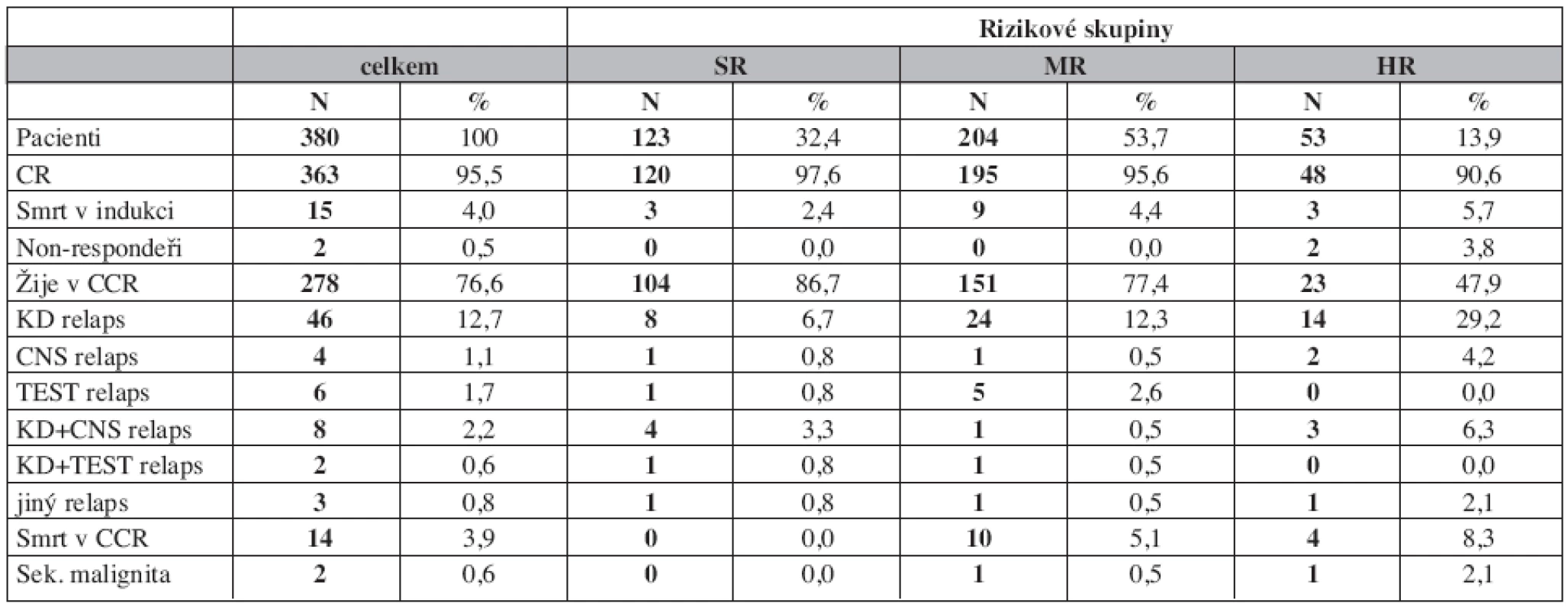
Relapsy
Relaps postihl 69 pacientů (19 %) (tab. 2). Časný relaps (do 6 měsíců od skončení léčby) postihl 39 dětí (56,5 % všech relapsů), z toho v 21 případech v prvních 18 měsících od diagnózy. Nejčastějším typem relapsu byl izolovaný dřeňový relaps (12,7 %), kombinovaný nebo izolovaný relaps v CNS postihl 3,3 % pacientů. Testikulární relaps postihl 3,6 % chlapců, kteří dosáhli remise.
Sekundární malignita byla diagnostikována u dvou dětí (AML a histiocytární sarkom).
Prognostické faktory
Stejně jako v protokolu ALL-BFM 90 byla časná odpověď na léčbu významným prognostickým faktorem: 42/380 (11,1 %) pacientů mělo špatnou odpověď na iniciální prednizonovou předfázi (PPR) a dosáhlo EFS 47,6 %. EFS skupiny PGR byl 76,3 % (p < 0,0001). Pacienti s ≥ 25 % blasty v kostní dřeni odebrané 2 týdny od zahájení léčby (9,2 % vyšetřených dětí) měli EFS 54,3 %, zatímco EFS dětí s M1/M2 dření byl 79,2 % (p < 0,0001). Z 35 dětí s M3 (≥ 25 % blastů) KD d15 bylo 17 dětí zařazeno do rizikové skupiny HR, 11 dětí do MR a 7 dětí do SR skupiny.
Děti s T-ALL (n = 54; EFS 64,8 %) měly signifikantně horší výsledky léčby než děti s leukemií z B prekurzorů (n = 310; EFS 75,8 %; p = 0,04). Pacienti s T-ALL se rozdělili na dvě skupiny podle časné odpovědi na léčbu. Pacienti s T-ALL + PPR (22 %) dosáhli významně horšího výsledku léčby s EFS 33,3% ve srovnání se skupinou T-ALL + PGR (EFS 73,8 %; p = 0,008). Ve skupině ALL z prekurzorů B lymfocytů (BCP-ALL) byla skupina PPR podstatně menší (9,6 %) ve srovnání s T-ALL. I tyto děti ale měly horší prognózu (EFS 53,3 %) ve srovnání se skupinou PGR (EFS 78,2 %; p = 0,0002).
Vliv některých klinických a laboratorních prognostických faktorů na výsledek léčby je uveden v tabulce 3. Do studie byl zařazen pouze jeden kojenec mladší 1 roku života. Věk ≥10 let při diagnóze, leukocytóza ≥ 50 x 109/l a T-ALL jsou v jednorozměrné analýze nepříznivými prognostickými faktory ovlivňujícími EFS. Význam časné odpovědi na léčbu pro prognózu pacientů dokládá nepříznivý osud dětí s PPR, KD d15 M3 a více než 5% blastů v kostní dřeni po skončení indukce (d33).
Děti s hyperdiploidií ≥ 50 chromozomů v leukemickém klonu (n = 57) a děti s TEL/AML1 pozitivní leukemií (n = 85) mají excelentní výsledky léčby s EFS přesahujícím 80 % a OS 90 % (tab. 3). Děti s Ph1+ALL (n = 9) měly špatnou prognózu. Relaps prodělalo 8 z nich, žijí pouze 3 (2 po SCT v 2. remisi). Srovnání výsledků léčby podle genotypu ukazuje graf 3.
Tab. 3. Prognostické faktory a event-free survival (EFS). 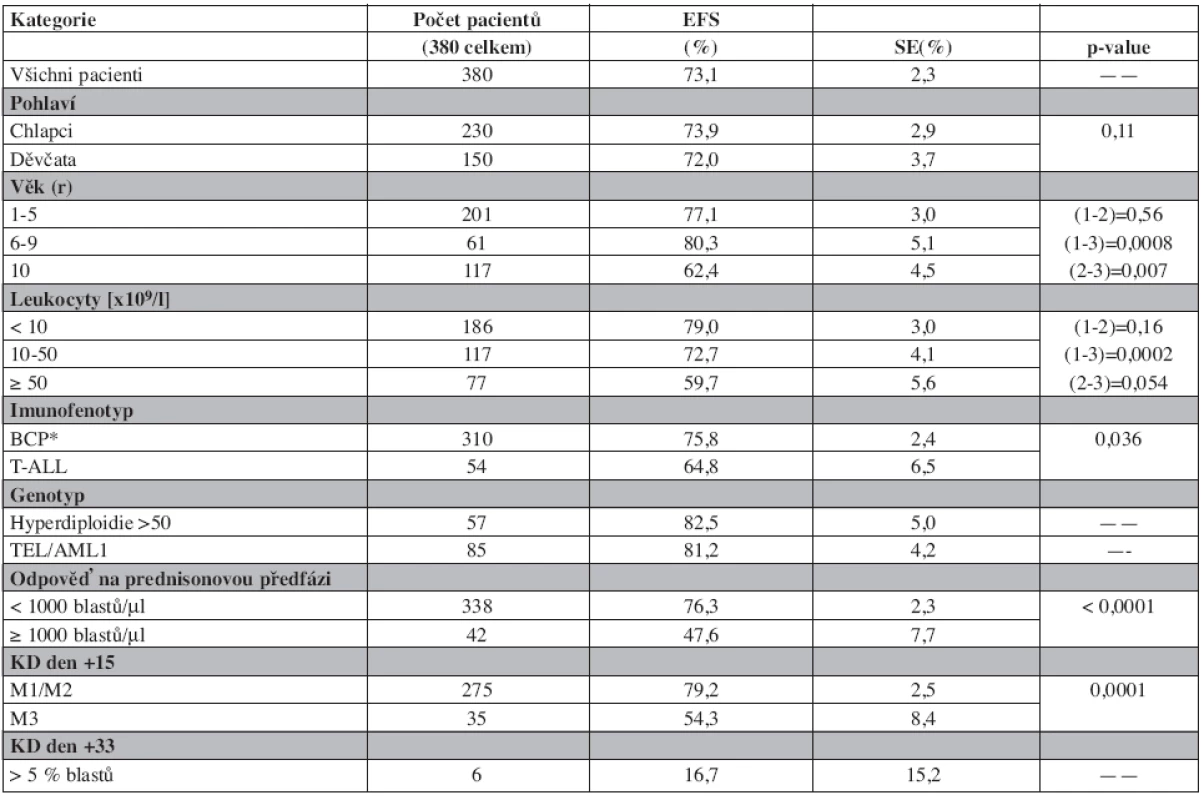
*obsahuje cALL, pro-B a pre-B ALL Graf 3. Event-free survival podle genotypu. 
Diskuse
Ve srovnání s předchozím protokolem ALL-BFM 90 došlo v protokolu ALL-BFM 95 k redukci léčby dětí standardního a středního rizika a posílení léčby pacientů vysokého rizika. Dávka asparaginázy v indukci byla u všech pacientů redukována z 10 000 IU/m2 na polovinu, počet dávek se nezměnil. Děti standardního rizika měly v indukci redukován počet dávek antracyklinů ze čtyř na dvě, léčba chlapců byla prodloužena ze dvou na tři roky (za účelem snížení výskytu pozdních relapsů, které postihovaly v předchozím protokolu chlapce častěji než děvčata). Děti středního rizika s výjimkou T-ALL nebyly preventivně zářeny na kranium, v udržovací léčbě byla randomizovanou studií srovnána standardní léčba 6-MP a MTX s pulzy dexametazonu a VCR. Děti vysokého rizika měly zařazenu pozdní intenzifikaci v podobě protokolu II v kombinaci s 6 HR bloky (v ALL-BFM 90 byly léčeny 9 bloky chemoterapie bez protokolu II) a byla zvýšena kumulativní dávka alkylačních agens (cyklofosfamid a ifosfamid) a antracyklinů. Přesto, že tedy byla léčba redukována pro 2/3 pacientů, nedošlo k zhoršení výsledků léčby. EFS ALL-BFM 95 73,1 % byl shodný s ALL-BFM 90 (n = 352; EFS 71,3 %; p = 0,35) a byl trend k lepšímu přežití ve srovnání s předchozím protokolem (OS 80,8 % vs. 76,4 %; p = 0,08). Kritéria stratifikace pacientů do SR a MR nebyla v obou studiích totožná (ALL-BFM 90 dle leukocytózy, velikosti jater a sleziny, ALL-BFM 95 dle leukocytózy a věku, pro oba protokoly dobrá časná odpověď na léčbu), proto je přímé srovnání výsledků obtížné. Přežití dětí skupiny SR přesáhlo 90 % (OS 93,2 % vs. 84,1 % v BFM 90) a v MR 80 % (82,1 % vs. 79,6 % v BFM 90). Kritéria řazení pacientů do skupiny vysokého rizika (pomalá odpověď na iniciální léčbu a nepříznivý genotyp) se v obou protokolech nezměnila. Posílení léčby v současném protokolu zvýšilo EFS na 43,1 % (n = 51) ve srovnání s EFS 28 % (n = 39) na BFM 90. Malý počet pacientů v obou skupinách se podílí na zjištění, že tyto rozdíly v přežití nejsou významné (p = 0,3). Počet relapsů se nezvýšil (BFM 90 : 17,8%; BFM 95 19%), přibylo relapsů v CNS (BFM 90 : 1,2 %; BFM 95 : 3,3 %). Skupina dětí středního rizika, kde byla ve srovnání s BFM 90 profylaxe CNS leukemie ozářením krania vynechána, měla ale výskyt této komplikace pouze u 1% pacientů. Časné relapsy tvořily 56,5 % všech relapsů (39/69), zatímco v předchozím protokolu BFM 90 tvořily 73 %. Vzhledem k malé úspěšnosti léčby časného relapsu ve srovnání s relapsem pozdním je tento fakt jistě jedním z vysvětlení zlepšení celkového přežití v současné studii. Posílení intenzity udržovací léčby dětí středního rizika pulzy dexametazonu a vinkristinu nepřineslo zlepšení jejich prognózy. Výsledky léčby našich pacientů byly hodnoceny v kontextu veliké mezinárodní prospektivní randomizované studie, do níž bylo zařazeno 3 109 dětí (11).
Významným úspěchem současné studie je snížení počtu toxických smrtí v remisi ve srovnání s předchozím protokolem (BFM 90 : 5,7 %, BFM 95 : 3,9 %). Úspěšnost v dosažení remise se zvýšila z 94,3 % (BFM 90) na 95,4 % (BFM 95), procento časných smrtí v indukci zůstává v obou studiích stejné (4 %). Zlepšení těchto výsledků jistě odráží narůstající zkušenost s touto náročnou léčbou v jednotlivých centrech, nicméně rozhodně existuje prostor pro další zlepšení v následujících studiích.
Výsledky léčby chlapců se ve srovnání s předchozím protokolem zlepšily (BFM 90: EFS 66,2 %; BFM 95 : 73,9 %) a neliší se od výsledků léčby u děvčat, zatímco na předchozím protokolu byly významně horší (děvčata BFM 90 : 77,5 %; BFM 95 : 72 %). Podílí se na tom nejen prodloužení léčby chlapců SR, ale i zlepšení prognózy dětí HR, kde mají chlapci výraznou převahu. Děti a dospívající starší 10 let a pacienti s významnou nádorovou masou při diagnóze (leukocytóza ≥ 50 000/μl) mají stejně jako v předchozí studii horší výsledky léčby než děti mladší či děti s menší nádorovou masou. Děti s pomalou odpovědí na iniciální léčbu jsou kandidáty relapsů. Platí to pro děti špatně odpovídající na prednizonovou předfázi (EFS 47,6 %) i děti s M3 dření 15. den léčby (EFS 54,3 %). V novém protokolu ALL IC-BFM 2002 používaném v současné době v České republice jsou děti s M3 dření d15 přeřazeny do vyššího rizika a léčeny intenzivněji včetně indikace k SCT u dětí HR skupiny s M3 dření.
Na rozdíl od BCP-ALL se nepříznivou prognózu dětí s T-ALL nepodařilo ve srovnání s předchozí studií změnit (EFS BFM 90 : 64,4 %; BFM 95 : 64,8 %). Srovnání výsledků léčby dětí s T-ALL a BCP ALL přináší tabulka 4. Tabulka odhaluje odlišnou biologii obou nemocí. Děti s T-ALL mají nižší úspěšnost v dosažení remise pro vyšší riziko časné smrti, pomaleji odpovídají na iniciální léčbu, celkový počet relapsů se ale neliší. Odlišný je interval mezi diagnózou a relapsem. U T-ALL dominují relapsy velmi časné a časné, jejichž léčba selhává, zatímco u BCP-ALL je zastoupení časných a pozdních relapsů vyrovnané a významné procento dětí s relapsem se daří vyléčit.
Tab. 4. T-ALL vs. BCP-ALL. 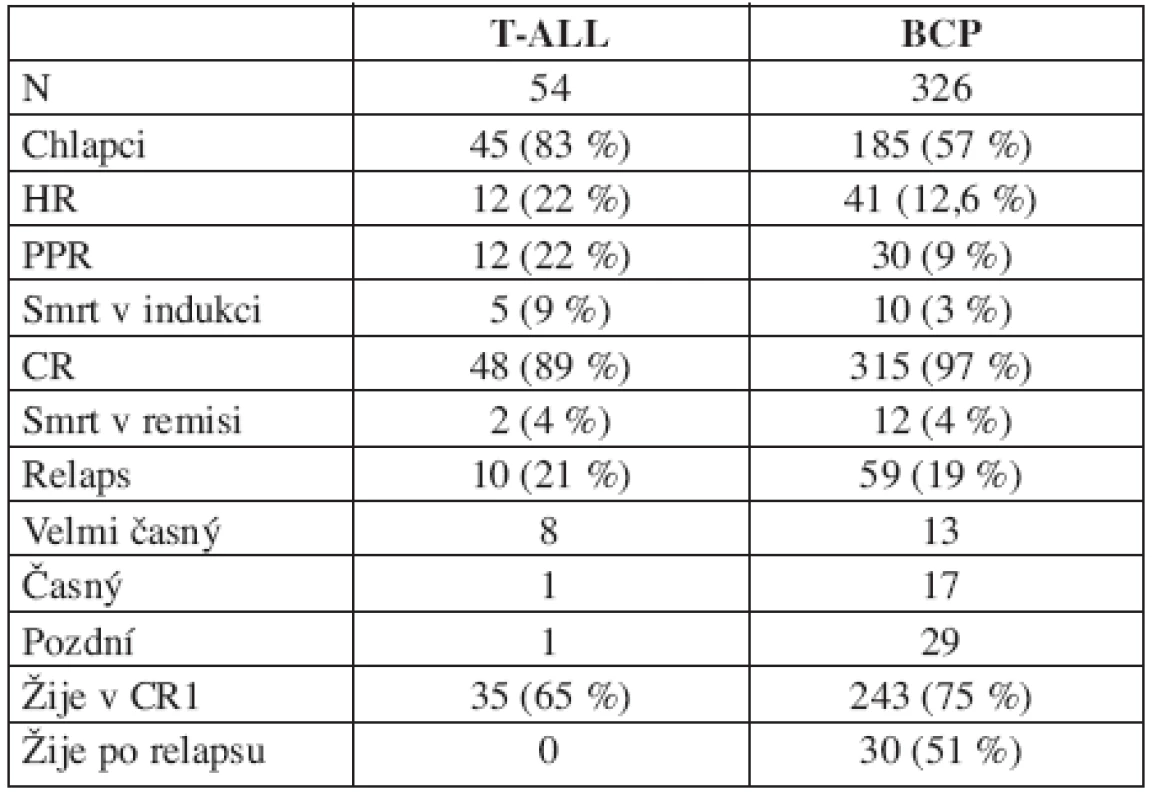
Vysvětlivky: BCP = ALL z prekurzorů B řady, PPR = prednison poor responder, CR = dosažení kompletní remise. CR1 = první kompletní remise Genotyp leukemie je významný rizikový faktor. Nejčastější chromozomální změnou byla v našem souboru translokace t(12;21) produkující fúzní gen TEL/AML1 (22,4 % dětí souboru). Tito pacienti mají příznivou prognózu (EFS 81,2 %; OS 91,1 %) v důsledku příznivé biologie nemoci (PPR pouze 3,5 %, HR 3,5 %, CR 99 %, relaps 15 %, dominuje pozdní) (12, 13). Druhou nejčastější chromozomální změnou byla významná hyperdiploidie nad 50 chromozomů v leukemickém klonu (18 % z úspěšně cytogeneticky vyšetřených pacientů). Výsledky léčby této skupiny jsou rovněž velmi dobré (EFS 82,5 %; OS 96,5 %), rovněž v důsledku příznivé biologie nemoci (HR 3,5 %, CR 98 %, relaps 14 %, dominuje pozdní). Tyto dva genotypy se vyskytují u 50 % dětí mezi 1–6 lety, které tvořily v našem souboru 53 % všech pacientů. Jejich dobrá prognóza zásadním způsobem ovlivňuje celkové výsledky léčby dětí s leukemií. Naopak výsledky léčby dětí s Ph1+ALL jsou velmi špatné, neliší se od výsledků dospělých, nicméně vzhledem k tomu, že tito pacienti tvořili pouhá 2 % dětí souboru, jejich neúspěch léčby celkové výsledky neovlivnil. Zařazení imatinibu do kombinovaných protokolů léčby Ph1+ALL je šancí na zlepšení výsledků nejen dospělých, ale i dětských pacientů (14).
Alogenní transplantaci kostní dřeně v první remisi podstoupila pouhá 2 % pacientů souboru. Dárcem byl HLA identický sourozenec, ve dvou případech nepříbuzný dárce z registru. Transplantace kostní dřeně je u dětí indikována u cca 5–8 % pacientů s vysoce rizikovou leukemií, ve srovnání s chemoterapií zlepšuje výsledky této skupiny a v příštích protokolech se její podíl pravděpodobně zvýší větším rozšířením transplantací od nepříbuzných dárců (15).
Ve srovnání s předchozím protokolem byly ve studii ponechány děti s Downovým syndromem a ALL (n = 7). Leukemie postihuje 1 % dětí s Downovým syndromem a výsledky její léčby jsou v případě ALL horší než výsledky léčby zdravých dětí. Děti s Downovým syndromem mají většinou diploidní leukemii s příznivou odpovědí na iniciální léčbu, procento relapsů je stejné jako u zdravých dětí, ale riziko toxických komplikací léčby a toxické smrti je významně zvýšené. Děti s Downovým syndromem hůře tolerují některá cytostatika, jako například vysokodávkovaný MTX (16). V naší studii jsme těmto pacientům redukovali dávku HD-MTX na 2 g/m2. Ze sedmi dětí dosáhly všechny remise, dvě zemřely v remisi na toxicitu, jedno prodělalo relaps a 4 děti žijí v první remisi.
Sekundární zhoubný nádor vyvinulo pouze 0,5 % pacientů. Kvalita života naprosté většiny dětí po skončení léčby je velmi dobrá.
Originální německo-rakousko-švýcarská studie dosáhla u 2169 pacientů 6letý EFS 79,6 % a přežití 87 % (17). Úspěšnost v dosažení remise byla 99,1 %, 2,1 % dětí zemřelo v remisi na toxické komplikace léčby a 16,2 % pacientů prodělalo relaps. Srovnáním s historickou skupinou se potvrdilo, že redukce dávky antracyklinů v indukci standardního rizika nezhoršila výsledky léčby a prodloužení délky léčby chlapců na tři roky neznamenalo zlepšení jejich prognózy. Pacienti středního rizika zaznamenali po vynechání preventivního ozáření CNS signifikantní nárůst izolovaných relapsů v CNS. Šance na vyléčení pacientů vysokého rizika ve srovnání s předchozí studií významně stoupla.
Závěr
Léčba dětí s ALL v České republice podle protokolu ALL-BFM 95 znamenala další zlepšení jejich prognózy. Šance na vyléčení přesáhla pro celou skupinu 80 %. Léčba v následujících studiích bude mít za cíl další zvýšení úspěšnosti v dosažení remise, snížení výskytu toxických smrtí a zlepšení prognózy podskupin pacientů jako jsou T-ALL nebo Ph1+ALL.
Poděkování
Děkujeme pracovníkům laboratoří morfologie, průtokové cytometrie a cytogenetickým laboratořím jednotlivých nemocnic za provedení vstupních vyšetření při diagnóze a v relapsu. Rovněž děkujeme lékařům a sestrám jednotlivých center za péči o dětské pacienty a spolupráci při získávání klinických a laboratorních dat. Studie byla částečně podpořena výzkumnými záměry MSM 0021620813, MSM 6198959216 a MZO 00064203/6719.
Prof. MUDr. Jan Starý, DrSc.
Klinika dětské hematologie a onkologie UK 2. LF a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: jan.stary@lfmotol.cuni.cz
Došlo do redakce: 19. 3. 2008
Přijato: 15. 6. 2008
Zdroje
1. Starý J, Gajdoš P, Blažek B, et al. Zlepšení výsledků léčby dětí s akutní lymfoblastickou leukemií podle protokolu ALL-BFM 90 v České republice. Čas Lék čes 2003; 142 : 404–409.
2. Starý J a Pracovní skupina pro dětskou hematologii České republiky. Léčba dětí s akutní lymfoblastickou leukemií v České republice podle protokolu ALL-BFM 83. Čs Pediatr 1993; 48 : 391–397.
3. Starý J, Gajdoš P, Trka J, et al. Akutní lymfoblastická leukemie u kojenců. Transfuz Hemat dnes 2002; 8 : 47–54.
4. Hrušák O, Trka J, Zuna J, et al. Aberrant expression of KOR-SA3544 antigen in childhood acute lymphoblastic leukemia predicts TEL-AML1 negativity. Leukemia 1998; 12 : 1064–1070.
5. van-der-Does van-den-Berg A, Bartram CR, Basso G, et al. Minimal requirements for the diagnosis, classification, and evaluation of the treatment of childhood acute lymphoblastic leukemia (ALL) in the „BFM Family“ Cooperative Group. Med Pediatr Oncol 1992; 20 : 497–505.
6. European group for the immunological characterisation of leukaemias (EGIL), Bene MC, Castoldi G, Knapp W, et al. Proposals for the immunological classification of acute leukaemias. Leukemia 1995; 9 : 1783–1786.
7. Zemanová Z, Michalová K, Šindelářová L, et al. Prognostic value of structural chromosomal rearrangements and small cell clones with high hyperdiploidy in children with acute lymphoblastic leukemia. Leuk Res 2005; 29 : 273–281.
8. Trka J, Zuna J, Haškovec C, et al. Detekce hybridních genů BCR/ABL, MLL/AF4 a TEL/AML1 a sledování minimální residuální nemoci u dětských pacientů s akutní lymfoblastickou leukemií. Čas Lék čes 1999; 138 : 12–17.
9. Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. J Am Stat Assoc 1958; 53 : 457–481.
10. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep 1966; 50 : 163–170.
11. Conter V, Valsecchi MG, Silvestri D, et al. Pulses of vincristine and dexamethasone in addition to intensive chemotherapy for children with intermediate-risk acute lymphoblastic leukaemia: a multicentre randomised trial. Lancet 2007; 369 : 123–31.
12. Zuna J, Hrušák O, Kalinová M, et al. Significantly lower relapse rate for TEL/AML1-positive ALL. Leukemia 1999; 13 : 1633–38.
13. Seeger K, Buchwald D, Taube T, et al. TEL-AML1 positivity in relapsed B cell precursor acute lymphoblastic leukemia in childhood. Leukemia 1999; 13 : 1469–1470.
14. De Labarthe A, Rousselot P, Huguet-Rigal F, et al. Imatinib combined with induction or consolidation chemotherapy in patiens with de novo Philadelphia chromosome-positive acute lymphoblastic leukemia: results of the GRAAPH-2003 study. Blood 2007; 109 : 1408–1413.
15. Balduzzi A, Valsecchi MG, Uderzo C, et al. Chemotherapy versus allogeneic transplantation for very-high risk childhood acute lymphoblastic leukaemia in first complete remission: comparison by genetic randomisation in an international prospective study. Lancet 2005; 366 : 635–642.
16. Whitlock JA, Sather HN, Gaynon P, et al Clinical characteristics and outcome of children with Down syndrome and acute lymphoblastic leukemia: a Children’s Cancer Group study. Blood 2005; 106 : 4043–4049.
17. Möricke A, Reiter A, Zimmermann M, et al. Risk-adjusted therapy of acute lymphoblastic leukemia can decrease treatment burden and improve survival: treatment results of 2169 unselected pediatric and adolescent patiens enrolled in the trial ALL-BFM 95. Blood 2008; 111 : 4477–89.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2008 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Třetí celostátní protokol léčby dětské akutní lymfoblastické leukemie znamenal další zlepšení výsledků. Studie ALL-BFM 95 u dětí v České republice 1995-2002
- Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u nehodgkinských lymfomů Část I. Určení stadia a postižení jednotlivých orgánů
- Změny v diagnostických kritériích a kritériích léčebné odpovědi u mnohočetného myelomu
- Minimální reziduální nemoc u chronické lymfocytární leukemie: metody stanovení a klinický význam
- Prof. BLAHOŠ – důstojník Řádu Čestné legie
- Burkittův lymfom: přehled patofyziologie, diagnostiky a terapie
- Vzdělávací akce IPVZ
- XXII. Olomoucké hematologické dny – kvalita, inovace, tradice a „genius locí“
- PRODUKCE ZAŘÍZENÍ TRANSFUZNÍ SLUŽBY V ČR 2007
- Nové karty členů ČLS J.E.P.
- Cena České hematologické společnosti za nejlepší publikace v oboru hematologie v roce 2007.
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Burkittův lymfom: přehled patofyziologie, diagnostiky a terapie
- Třetí celostátní protokol léčby dětské akutní lymfoblastické leukemie znamenal další zlepšení výsledků. Studie ALL-BFM 95 u dětí v České republice 1995-2002
- Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u nehodgkinských lymfomů Část I. Určení stadia a postižení jednotlivých orgánů
- Minimální reziduální nemoc u chronické lymfocytární leukemie: metody stanovení a klinický význam
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání