-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u nehodgkinských lymfomů Část I. Určení stadia a postižení jednotlivých orgánů
The role of positron emission tomography and combined positron emission tomography with computed tomography in staging and response assessment in patients with non-Hodgkin’s lymphoma
2-[fluorin-18] fluoro-2-deoxy-D-glucose (18F-FDG) positron emission tomography (PET) is a noninvasive, 3-dimensional imaging modality sufficiently reliable for the initial diagnosis and staging, for the evaluation of therapeutic response and for the detection of recurrence of various type of non-Hodgkin’s lymphoma (NHL). 18F-FDG PET has been demonstrated more sensitive and specific than either 67scintigraphy or computed tomography (CT) and generally offers more than 88% of sensitivity and 94% of specificity in the diagnosis of NHL. However, 18F-FDG PET may not precisely anatomically localize pathological lesions in the human body. Actually, combined PET and CT – PET/CT system - has developed into the fastest growing imaging modality worldwide and the integration of PET and CT provides precise localization of the lesions on the 18F-FDG PET scans within the anatomic reference frame provided by CT, thereby increasing specificity of the examination. Some authors founded that high glycolytic rates, determined by 18FDG uptake, are associated predominantly with high-grade lymphoma, and low-grade and certain other lymphoma subtypes (e.g., peripheral T-cell NHL) have low 18F-FDG uptake that can result in negative scans. Others founded no significant difference between low-grade and high-grade NHL or B - and T-cell NHL in this respect, suggesting that the diagnostic accuracy of PET is not affected by tumor subtype or grade. In fact, a large overlap may exist between the metabolic/glycolytic activity of various lymphoma entities. On the other hand, hypermetabolic conditions (sarcoidosis, tuberculosis, fungal infections, inflammation, etc.) may be a source of “false-positive” 18F-FDG PET scans and integrated PET-CT system can help improve the specificity of the findings and our differential diagnostic accuracy in these situations.
Key words:
18F - FDG PET, PET/CT, lymphoma, staging
Autoři: T. Papajík 1; M. Mysliveček 2; E. Buriánková 2; M. Skopalová 3; A. Malán 4; V. Koza 5; M. Trněný 6; P. Koranda 2; J. Ptáček 2; K. Indrák 1
Působiště autorů: Hemato-onkologická klinika FNO a LF UP v Olomouci, 2Klinika nukleární medicíny FNO a LF UP v Olomouci, 3PET centrum Nemocnice na Homolce, 4Oddělení nukleární medicíny FN Plzeň, 5Hematologicko-onkologické oddělení FN Plzeň, 6I. interní klinika VFN Praha 1
Vyšlo v časopise: Transfuze Hematol. dnes,14, 2008, No. 3, p. 110-118.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Pozitronová emisní tomografie (PET) s použitím 2-[fluorin-18] fluoro-2-deoxy-D-glukózy (18F-FDG) představuje neinvazivní trojrozměrnou vyšetřovací metodu vhodnou k vstupní diagnostice a stážování nehodgkinských lymfomů (NHL), stejně tak jako k hodnocení léčebné odpovědi či k ověření relapsu choroby. Bylo prokázáno, že 18F-FDG PET je senzitivnější a specifičtější než 67galliová scintigrafie a počítačová tomografie (CT) a při stážování NHL poskytuje zhruba 88% citlivost a 94% specificitu. Je ovšem třeba podotknout, že sám 18F-FDG PET nemá příliš dobrou schopnost přesně anatomicky lokalizovat patologické léze v jednotlivých orgánech či prostorách lidského těla. I z tohoto důvodu se v dnešní době na celém světě prudce rozvíjí a stále častěji používá kombinovaná PET/CT metodika. Integrace PET a CT umožňuje přesné určení topografie 18F-FDG PET pozitivní léze na pozadí anatomické informace získané CT, což zvyšuje specificitu vyšetření. Někteří autoři nalezli vztah mezi vysokou glykolytickou aktivitou/utilizací FDG a NHL s vysokou proliferační aktivitou, zatímco u NHL s nízkou proliferační aktivitou a některých ostatních typů lymfomů (periferní T-buněčné NHL) může nízké vychytávání 18F-FDG znamenat výslednou negativitu 18F-FDG PET vyšetření. Jiní autoři nenalezli významný vztah mezi těmito skupinami NHL a předpokládají, že diagnostická výtěžnost PET není v přímé souvislosti s typem či stupněm lymfomu. To znamená, že uvnitř různých typů NHL je možné najít různý stupeň metabolické a glykolytické aktivity jednotlivých případů. Na druhé straně mohou být stavy spojené s hypermetabolismem (sarkoidóza, tuberkulóza, mykotické infekty, záněty, aj.) zdrojem „falešně“ pozitivních nálezů při samotném 18F-FDG PET a kombinované PET/CT vyšetření může v takových situacích pomoci zlepšit specificitu nálezu a diferenciálně diagnostickou přesnost.
Klíčová slova:
18F-FDG PET, PET/CT, lymfom, stážováníÚvod
Zobrazovací techniky hrají velmi důležitou roli v diagnostice a léčbě nádorových chorob. Stanovení rozsahu a šíření nádoru v organismu, resp. postižení jednotlivých orgánů a tkání spolu s pečlivým zhodnocením individuálních prognostických parametrů představuje základní krok k výběru adekvátní protinádorové terapie. Zásadní přínos poskytují zobrazovací techniky při hodnocení léčebné odpovědi a eventuálním rozhodování o dalším léčebném postupu při zjištění zbytkové choroby v organismu.
Nehodgkinské lymfomy (NHL) představují relativně rozšířené a zároveň velmi dobře léčitelné nádory lidské patologie. I když jde o heterogenní skupinu onemocnění s různými biologickými charakteristikami a pestrým klinickým obrazem, společným cílem terapie všech těchto nádorů je dosažení kompletní remise choroby (CR). CR choroby je základním předpokladem dlouhodobého přežití, resp. možnosti vyléčení lymfomu. Proto má pečlivé určení rozsahu a stadia choroby pro stanovení léčebné odpovědi naprosto zásadní význam (1). Standardním zobrazovacím vyšetřením pro určení rozsahu postižení lymfomem, zvláště v oblasti hrudníku, břicha, retroperitoneálního prostoru a pánve, se stala výpočetní tomografie (CT), která při použití perorálních a nitrožilních kontrastních látek dokáže přesně popsat anatomické (strukturální) změny ve zmíněných oblastech (2). CT vyšetření je přínosné zejména při popisu uzlinového postižení lymfomem a v detekci ložiskových změn většiny orgánů. Limitací CT vyšetření je poměrně nízká schopnost detekce difuzního postižení mimouzlinových tkání a rozhodnutí o tom, zda jsou zmnožené uzliny hraniční velikosti infiltrovány lymfomem či nikoliv. CT také nedokáže rozlišit, zda zbytková tkáň nalezená na tomografických snímcích po léčbě představuje pouhé fibrotické reziduum nebo zda jde o stále aktivní nádorovou masu. Ve všech zmíněných případech potřebujeme další doplňující informaci, jež s vysokou pravděpodobností rozhodne o tom, zda je tkáň či orgán infiltrován buňkami lymfomu či nikoliv. Takovou informaci může přinést pozitronová emisní tomografie (PET) s použitím analogu glukózy značeného izotopem fluoru - 2-[fluorin-18] fluoro-2-deoxy-D-glukózy (18F-FDG) (3). Metoda využívá toho, že nádorové buňky většiny NHL mají významně zvýšený metabolický obrat glukózy (zvýšenou glykolýzu) a proto ve zvýšené míře zpracovávají i podanou 18F-FDG. Citlivý PET systém posléze zpracuje a vyhodnotí metabolickou aktivitu tkání a pomůže rozhodnout, zda je tkáň infiltrovaná lymfomem. 18F-FDG není nádorově specifická látka a může být zvýšeně fyziologicky metabolizována i některými tkáněmi (mozková, srdeční, střevní) nebo také v oblasti zánětu či jiného poškození organizmu (4). Ke snížení počtu „falešně“ pozitivních výsledků pomáhá jejich přesná anatomická lokalizace a korelace se strukturálním obrazem, který poskytuje CT vyšetření. Proto se v posledních letech integrují obě modality do jednoho „hybridního“ přístrojového PET/CT systému, který dokáže precizně anatomicky i funkčně lokalizovat patologickou lézi a zvýšit tím výrazně specificitu vyšetření (5). Význam 18F-FDG PET a PET/CT vyšetření pro stážování a stanovení léčebné odpovědi shrnuje tento článek.
Principy18F-FDG PET vyšetření
PET jako zobrazovací metoda byla vyvinuta před 30 lety. Až do poloviny 90. let však byla využívána jako experimentální vyšetřovací metoda ve specializovaných ústavech zkoumajících fyziologii a patofyziologii mozku a myokardu. PET metoda k těmto studiím využívala radioizotopy přirozených prvků, jež emitují pozitrony – 11C, 13N, 15O a 18F (6). Spojením některých izotopů s látkami, jež se blíží přirozeným molekulám využívaným v organismu a konstrukcí nové generace přístrojů, se možnosti PET vyšetření výrazně rozšířily a nabídly využití i v klinické praxi. Od konce 90. let dramatický narostl zájem o PET vyšetření zejména v onkologii, a to díky dvěma hlavním aspektům. Za prvé to bylo potvrzení, že molekula 18F-FDG je zvýšeně utilizována většinou lidských nádorů a za druhé, že PET detekční přístroje dovolují provést v krátkém čase celotělové vyšetření.
Použití 18F-FDG pro zobrazení nádorové tkáně vychází z pozorování O. Warburga z poloviny 50. let, že zvýšené metabolické nároky rychle se dělících nádorových buněk vyžadují dostatek adenosin-trifosfátu, který získávají glykolýzou (7). Další pozorování vedla k objevu zvýšeného výskytu glukózového transportního proteinu na povrchu nádorových buněk a zvýšené exprese některých buněčných glykolytických enzymů, zejména hexokinázy, které vedou k transportu a využití analogu glukózy (FDG) těmito buňkami (8). Spojením radioizotopu 18F a molekuly FDG vznikl výborný indikátor výše uvedeného procesu detekovatelný PET metodou a využitelný v klinické praxi. 18F-FDG se po transportu do nádorové buňky přeměňuje pomocí hexokinázy na 18F-FDG-6-fosfát, který je jen pomalu defosforylován a proto zůstává dlouhou dobu uvnitř buňky, resp. se intracelulárně akumuluje v závislosti na míře glykolýzy. Izotop 18F má navíc výhodný fyzikální poločas přeměny (110 minut), což umožňuje komerční přípravu 18F-FDG mimo zdravotnické zařízení a poskytuje optimální čas pro vyšetření pacienta. 18F-FDG PET vyšetření vyžaduje, aby byl pacient minimálně 6 hodin před aplikací přípravku lačný, protože při samotném vyšetření by měla být fyziologická (resp. nízká) sérová hodnota glukózy a inzulinu. Zároveň je pacientovi doporučeno omezení fyzické námahy 24 hodin před vyšetřením, aby nedošlo ke zvýšenému vychytávání látky kosterním svalstvem. Nicméně i přes tato opatření je 18F-FDG hojně metabolizována v orgánech fyziologicky utilizujících glukózu jako jsou mozek, myokard, játra a trávící trakt (zejména žaludek a cékum) a její metabolity jsou vylučovány močovými cestami. Proto je detekce abnormální aktivity v těchto oblastech omezená a může činit diferenciálně diagnostické potíže. Stejně tak oblast hnědého tuku, zánětlivá a infekcí napadená tkáň či místo reparace a hojení jsou lokalitami zvýšeného metabolismu 18F-FDG a odlišení těchto fokusů od ložisek nádoru velmi často vyžaduje další morfologické a klinické informace (9). A právě z tohoto hlediska se jeví integrace PET a CT do jednoho přístroje a současné provedení obou metod, resp. jejich následná obrazová fúze jako velmi účelná. První prototypy kombinovaných PET/CT skenerů byly testovány na konci 90. let, v roce 2000 byly publikovány první zprávy o možném využití systému v onkologii a první PET/CT přístroj pracující v rutinním klinickém provozu byl spuštěn v březnu 2001 ve švýcarském Zurichu (5, 10, 11). Brzy byly zveřejněny pilotní práce potvrzující výhody integrovaného PET/CT vyšetření u nádorů, zejména možnost precizní lokalizace PET-pozitivní léze a popis její struktury pomocí CT obrazu (12, 13). Integrovaná PET/CT metoda se díky svým výhodám stala v posledních letech nejrychleji rostoucí zobrazovací metodou v onkologii.
Role 18F-FDG PET ve stážování NHL
Stanovení rozsahu choroby a popis postižení jednotlivých orgánů lymfomem představuje jednu ze základních informací pro stanovení prognostického rizika a optimálního léčebného postupu u pacienta s NHL. Stážování lymfomů dodnes probíhá podle systému navrženého v roce 1971 v Ann Arbor původně pro Hodgkinův lymfom (HL), jež byl akceptován také pro většinu subtypů NHL. Stážovací systém zohledňuje počet a lokalizaci infiltrovaných uzlin, postižení extranodálních orgánů a přítomnost či nepřítomnost systémových příznaků onemocnění. Nicméně tento stážovací systém má u NHL řadu omezení, které vyplývají z jejich tendence šířit se v organismu zejména hematogenně a postihovat nesouvisející a vzdálené lymfatické uzliny a další extralymfatické orgány. Z tohoto pohledu se jeví jako nutné neinvazivně zobrazit všechny lymfatické uzliny, které nejsou dostupné běžnému fyzikálnímu vyšetření, stejně jako další orgány hrudního koše, břišní dutiny a retroperitoneálního prostoru. Zlatým standardem zobrazovacích metod se stalo CT vyšetření, které přináší strukturální informaci s vysokou rozlišovací schopností (15). CT však nedokáže odlišit infiltraci nezvětšených či hraničně zvětšených lymfatických uzlin nebo počínající difuzní postižení řady mimolymfatických orgánů buňkami lymfomu. Tato informace však může výrazným způsobem ovlivnit výsledné stadium NHL a vést k výběru intenzivnějšího léčebného režimu.
Obr. 1. Snímky výpočetní tomografie (CT), pozitronové emisní tomografie (PET) a PET/CT u nemocného s difuzním B-velkobuněčným lymfomem a postižením lymfatických uzlin ve všech oddílech mediastina, perikardiálně a v okolí břišní aorty. 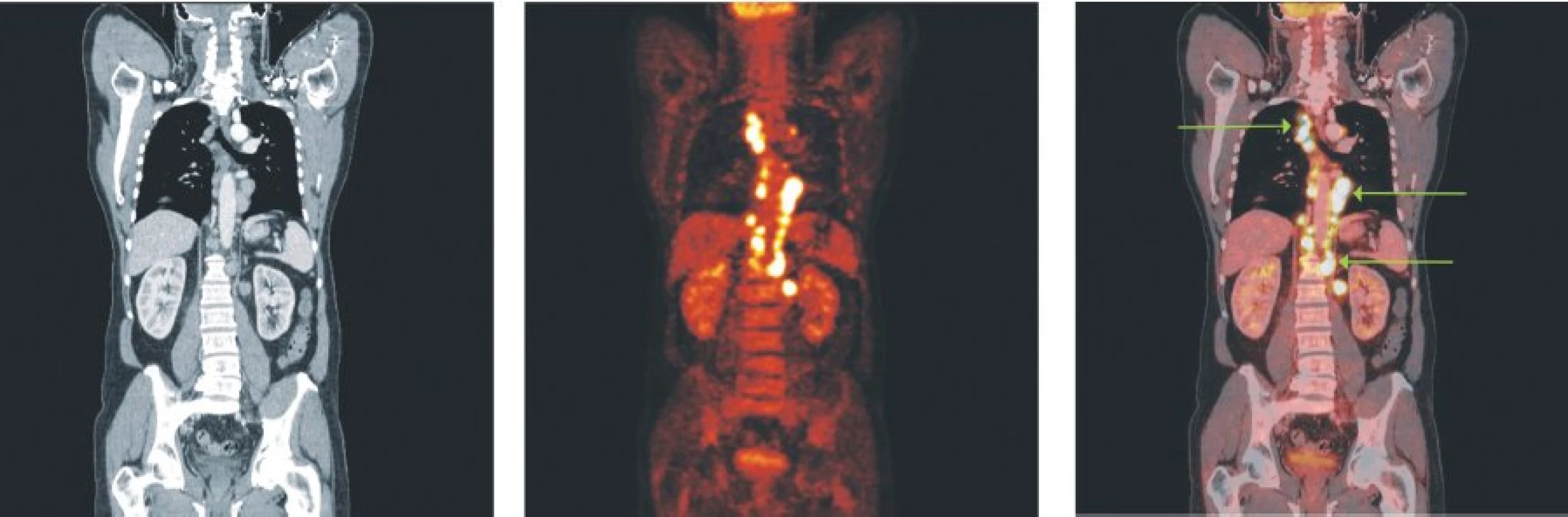
Obr. 2. Snímky výpočetní tomografie (CT), pozitronové emisní tomografie (PET) a PET/CT u nemocného s difuzním B-velkobuněčným lymfomem. Mnohočetné zvětšené lymfatické uzliny v mezenteriu vykazují hypermetabolismus glukózy. 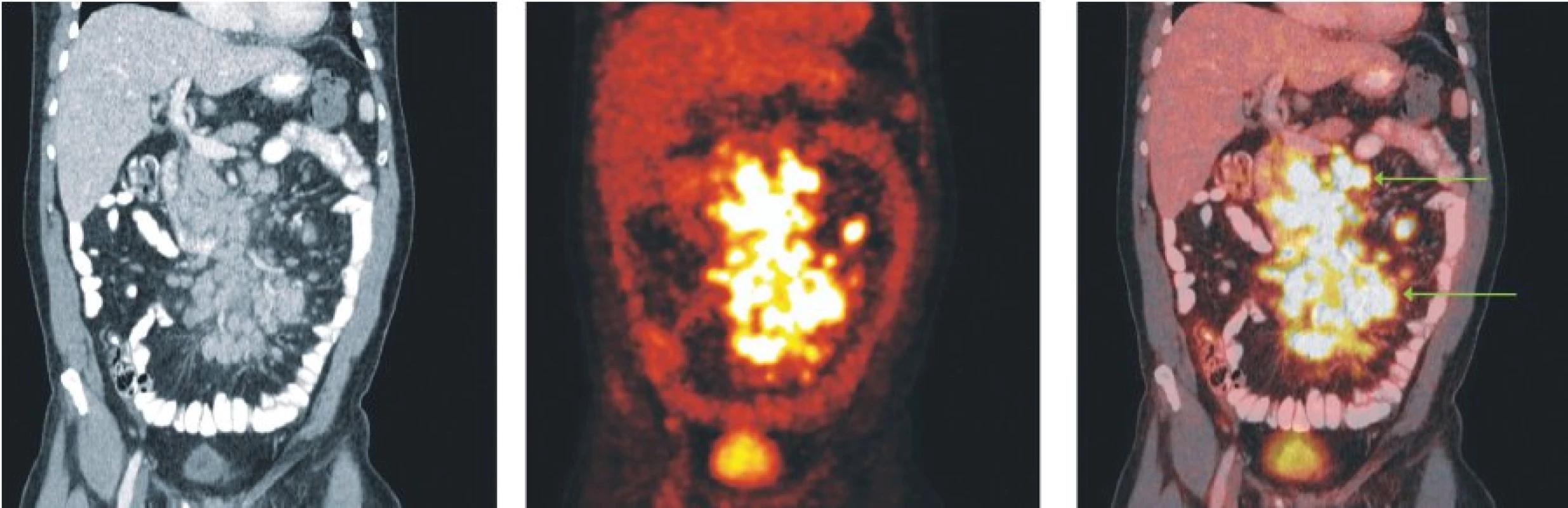
Obr. 3. Snímky výpočetní tomografie (CT), pozitronové emisní tomografie (PET) a PET/CT u nemocného s difuzním B-velkobuněčným lymfomem. Zvýšená akumulace FDG v lymfatických uzlinách v levém nadklíčku, v paketu uzlin levé axily, paraaortálně a v mnohočetných ložiscích ve výrazně zvětšené slezině a játrech. 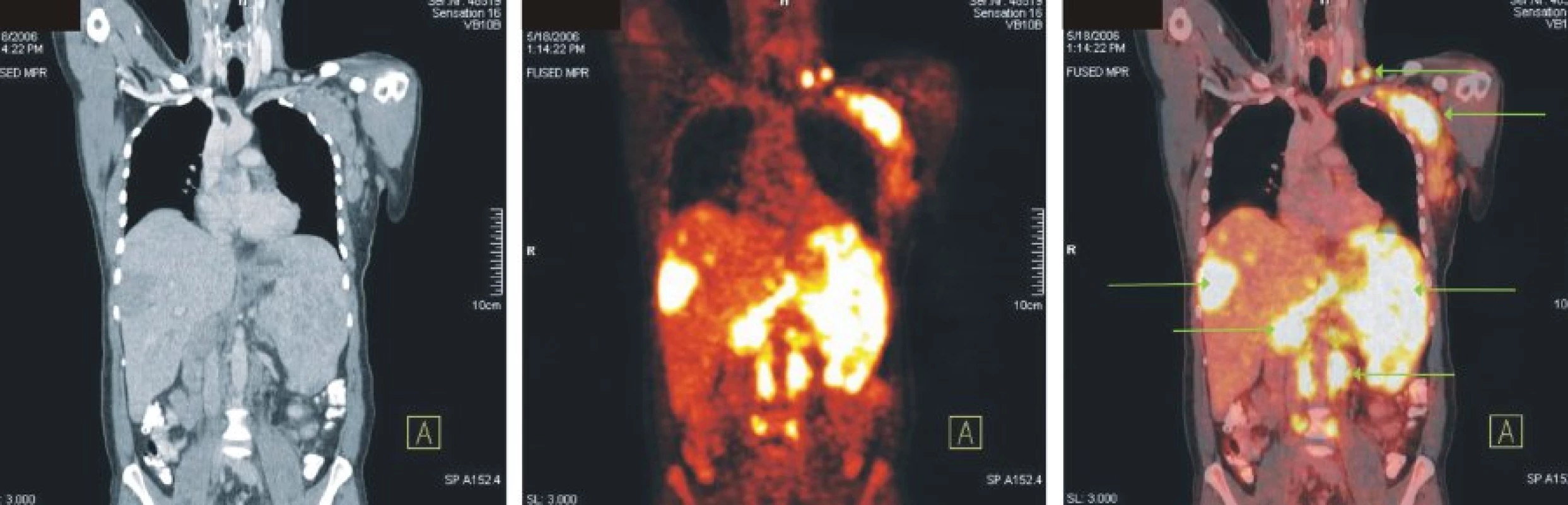
Obr. 4. Snímky výpočetní tomografie (CT), pozitronové emisní tomografie (PET) a PET/CT u nemocného s folikulárním lymfomem stupně 3b a postižením lymfatických uzlin mediastina, skeletu páteře a pánve. 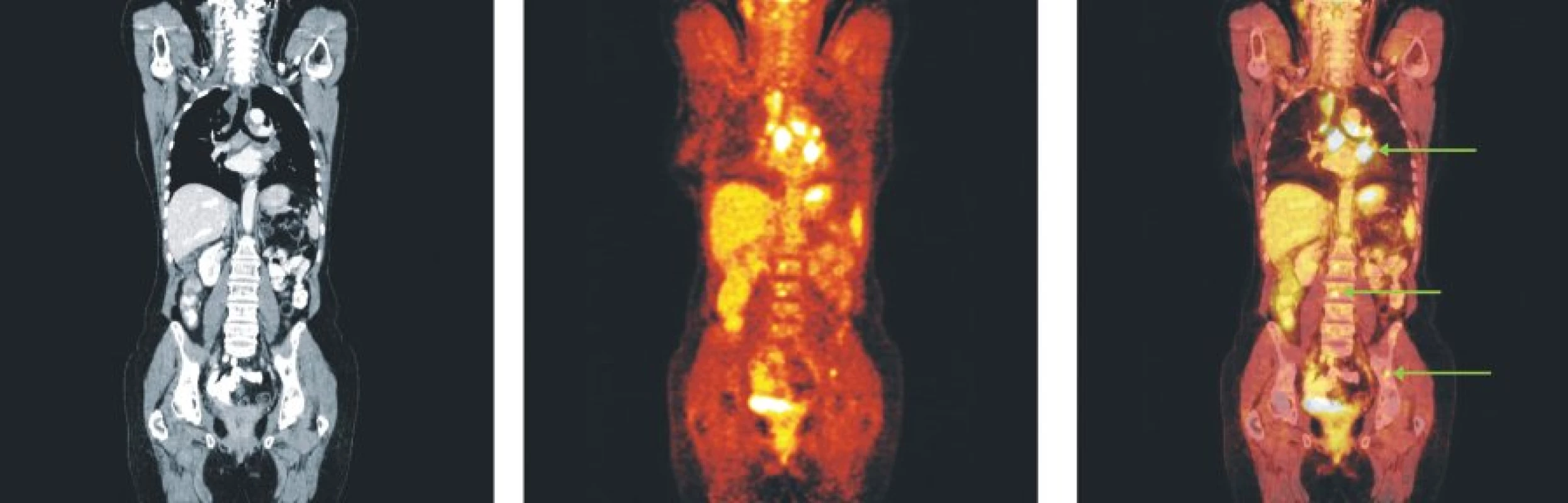
Obr. 5. Snímky výpočetní tomografie (CT), pozitronové emisní tomografie (PET) a PET/CT u nemocného s folikulárním lymfomem stupně 2 a postižením lymfatických uzlin retroperitonea, mezenteria a pánve. 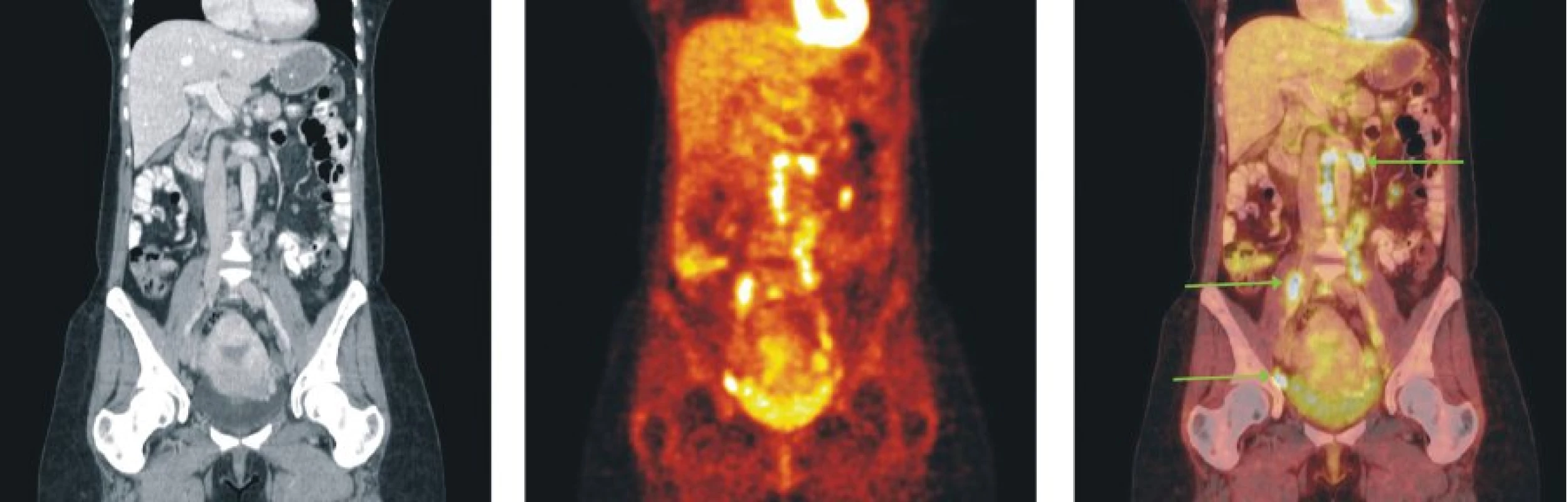
Obr. 6. Snímky výpočetní tomografie (CT), pozitronové emisní tomografie (PET) a PET/CT u nemocného s periferním T-buněčným lymfomem. Hypermetabolismus glukózy v oblasti nazofaryngu a orofaryngu, v paketech lymfatických uzlin oboustranně na krku a ve zvětšených lymfatických uzlinách levé axily. 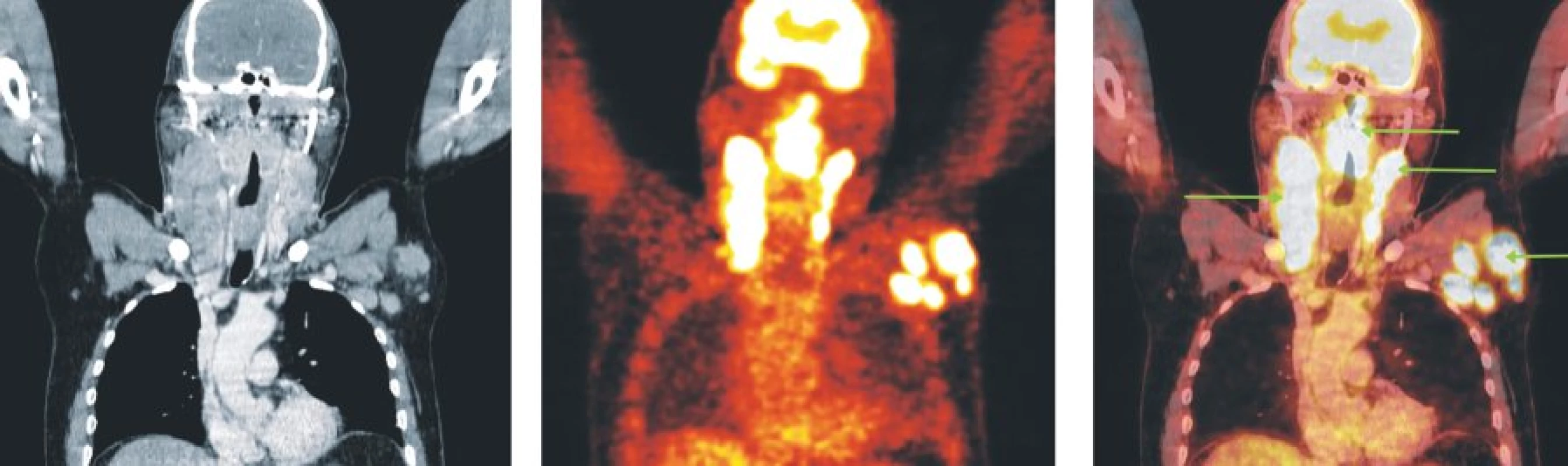
Obr. 7. Snímky výpočetní tomografie (CT), pozitronové emisní tomografie (PET) a PET/CT u nemocné s MZL MALT lymfomem žaludku. Na CT skenech je nepravidelně infiltrovaná a zesílená stěna žaludku zejména v oblasti fundu a velké kurvatury, která vykazuje mírně zvýšenou akumulaci FDG. 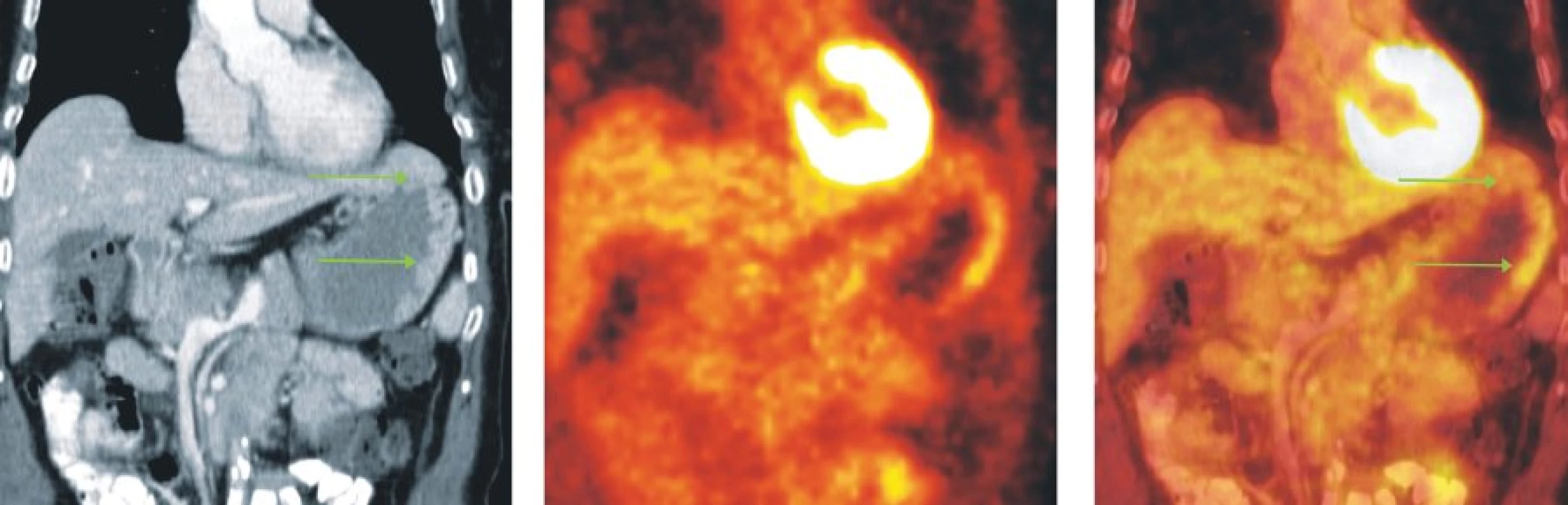
Obr. 8. Snímky výpočetní tomografie (CT), pozitronové emisní tomografie (PET) a PET/CT u nemocné s nově zjištěnou diagnózou chronické B-lymfocytární leukemie a genetickou abnormalitou 17p-. Zvýšená akumulace 18F-FDG ve splývajících lymfatických uzlinách na krku, v lymfatických uzlinách supra- i infraklavikulárně, v obou axilách, ve všech oddílech mediastina, v rozsáhlé měkkotkáňové mase sahající od jater a sleziny až ke dnu malé pánve, ve které jsou zavzaty všechny cévní svazky, aorta i dolní dutá žíla a také v lymfatických uzlinách obou třísel, které nejsou na zobrazených řezech patrné. 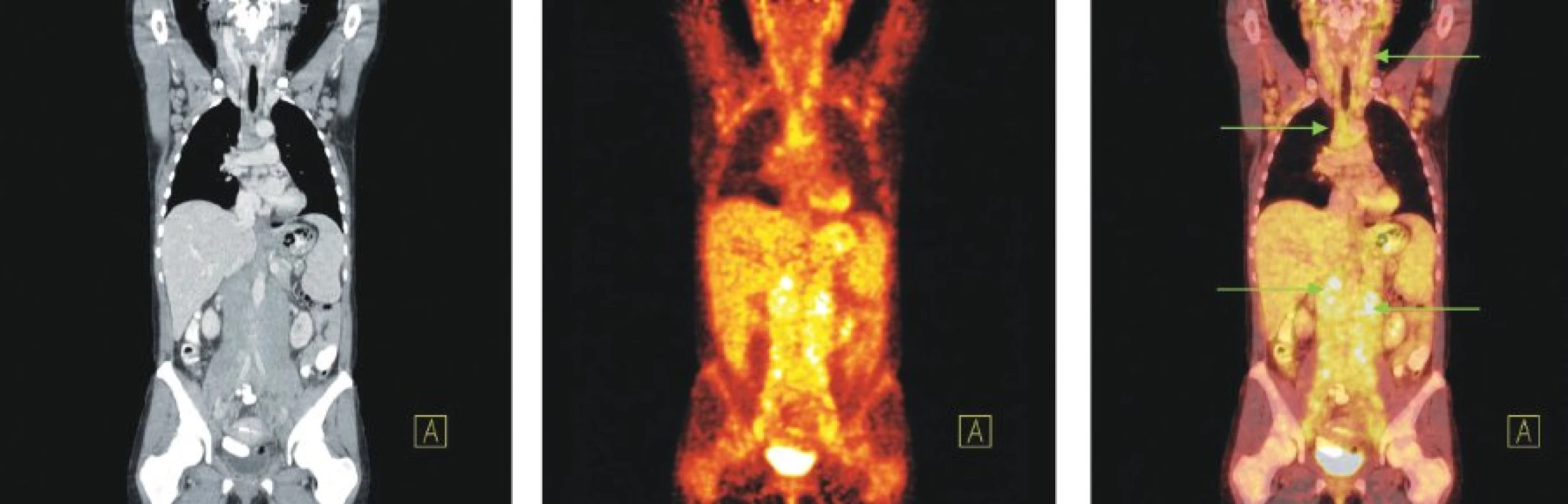
Obr. 9. Snímky výpočetní tomografie (CT), pozitronové emisní tomografie (PET) a PET/CT u nemocné s nově zjištěnou diagnózou chronické Blymfocytární leukemie a genetickou abnormalitou 11q-. Na CT lze diferencovat zvětšené lymfatické uzliny na krku a v tříslech, paraaortálně vlevo pod odstupem renální tepny jsou až pakety uzlin. Žádná z uvedených lymfatických uzlin ani uzlinové pakety nevykazují zvýšenou konzumpci glukózy. Tři hypodenzní ložiska charakteru cyst v játrech. Relativně vyšší akumulace FDG v nezvětšené slezině. 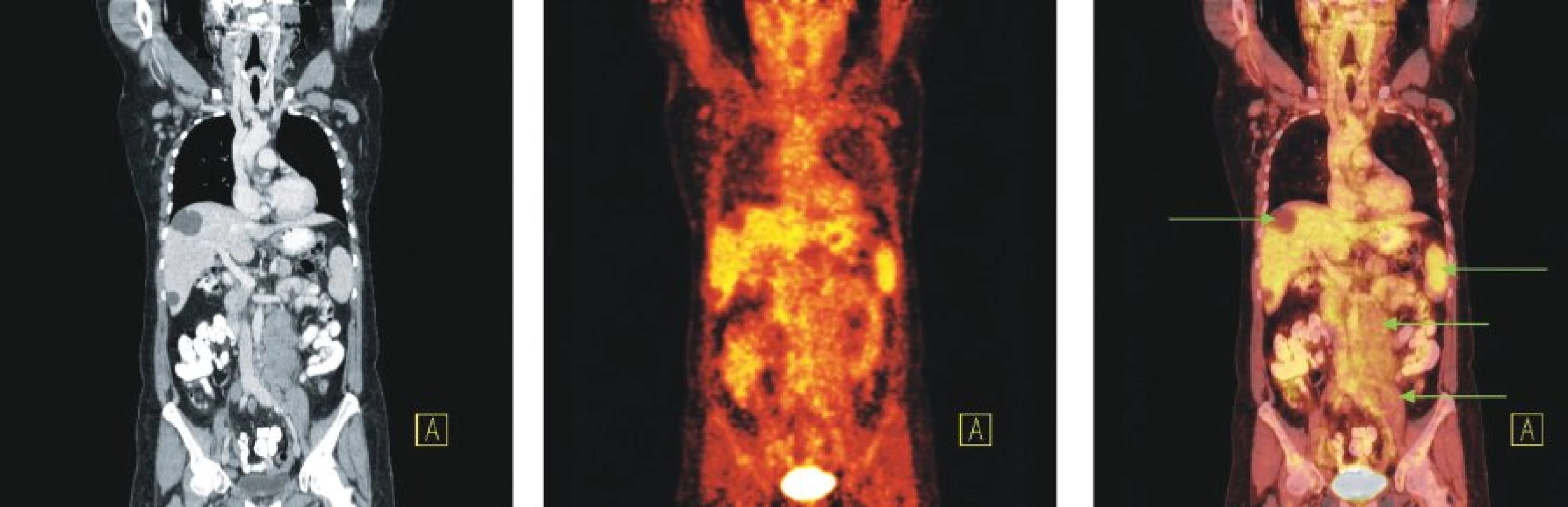
18F-FDG PET vyšetření výrazně zlepšuje možnosti detekce okultního postižení sleziny, dokáže identifikovat maligní kostní léze a snáze odhalí malá ložiska lymfomu. Systematická meta-analýza 20 reprezentativních studií u nemocných s maligními lymfomy zjistila, že medián senzitivity 18F-FDG PET vyšetření u NHL je 87,5 % a medián specificity 93,8 %. Studie se také zabývala počty falešně pozitivních výsledků a dokumentovala jich celkem 11,4 % ze všech vyšetření (1). Srovnávací práce prokázaly lepší citlivost PET oproti klasickým scintigrafickým vyšetřením a CT (17–21). V retrospektivním hodnocení 27 pacientů (s NHL a HL) nalezl Thill s kolegy zhruba stejnou citlivost 18F-FDG PET a CT vyšetření v oblasti krčních uzlin a plicních lézí, zatímco PET lokalizovala o 23 % více patologických ložisek v játrech a slezině (20). Moog prokázal, že 18F-FDG PET zvýšila stadium onemocnění u 8 % ze 60 pacientů s lymfomy, 2 PET pozitivní nálezy byly falešně pozitivní (biopticky prokázána zánětlivá léze) (21). Jerusalem konstatoval, že citlivost 18F-FDG PET a CT je při detekci rozsahu postižení orgánů lymfomem o něco vyšší než u CT (a to jak u agresivních, tak i u indolentních NHL), stadium choroby však PET metoda změnila jen u 2 z 60 vyšetřených nemocných (22). Delbeke ve svém souboru dospěla k výraznějším rozdílům, když 18F-FDG PET vedla ke změně stadia u 16 % nově diagnostikovaných nemocných a u 13 % dokonce ke změně léčebného přístupu (23). Na druhé straně 3 nemocní (7 %) měli falešně negativní PET vyšetření (2 pacienti s nízce maligními lymfomy a 1 pacient s HL). V práci Buchmanna a kolegů změnil výsledek PET vyšetření léčebnou strategii u 8 % pacientů (17). Jak už bylo řečeno, výraznou předností 18F-FDG PET metody je schopnost odhalení infiltrace extranodálních orgánů lymfomem, zejména pak jater a sleziny, kde se citlivost CT pohybuje mezi 20–40 %. Práce Mooga, která se zaměřila právě na otázku srovnání citlivosti obou metod u extranodálních ložisek lymfomu, zjistila výrazně vyšší senzitivitu 18F-FDG PET. Na základě této informace došlo ke změně stadia choroby u 13 z 81 (16 %) nemocných (24). Další práce potvrdily dobrou rozlišovací schopnost 18F-FDG PET i pro maligní lymfomy CNS a pro detekci postižení kostní dřeně agresivními lymfomy (25). Skupina kolem Mooga popsala vysokou citlivost 18F-FDG PET při stanovení postižení kostní dřeně lymfomem. Citlivost dosahovala 81 %, specificita vyšetření byla 100 % (26). Všechny nálezy byly porovnávány s biopsií kostní dřeně. U 5 % pacientů autoři konstatovali falešnou negativitu 18F-FDG PET vyšetření, u 13 % nemocných naopak 18F-FDG PET ukazovala na postižení kostní dřeně aniž by patolog v první biopsii objevil nádorové elementy. Až teprve následná vyšetření kostní dřeně potvrdila u těchto nemocných infiltraci lymfomem. Podobně i Carr nalezl 78% shodu mezi 18F-FDG PET vyšetřením a výsledkem biopsie kostní dřeně (27). Jiné práce tato optimistická data úplně nepotvrdila. Například Kostakoglu a kolegové popsali pozitivní prediktivní hodnotu 18F-FDG PET vyšetření kostní dřeně ve výši 67 % a negativní prediktivní hodnotu 84 % (28). Zvláště u nemocných s počínající infiltrací kostní dřeně (do 25 % patologických buněk) bývá 18F-FDG PET detekce téměř vždy negativní. Lymfomy centrálního nervového systému jsou pomocí 18F-FDG PET dobře vizualizované a toto vyšetření je dokáže dobře odlišit od jiných nenádorových procesů jako je například toxoplazmóza. To je důležité zejména u nemocných s AIDS, kde toto rozlišení nabývá na významu díky relativně vysokému výskytu obou procesů (29).
Z rozboru publikovaných prací vyplývá, že celková citlivost 18F-FDG PET vyšetření je v průměru o 15 % vyšší než u CT, specificita obou vyšetření je zhruba na stejné úrovni. Na druhou stranu je nutno podotknout, že ne všechny patologické léze zjištěné CT vyšetřením se daří detekovat PET metodou. Senzitivita 18F-FDG PET vyšetření je nižší v podbrániční oblasti, a to zejména z důvodu fyziologicky zvýšeného metabolismu glukózy v některých částech gastrointestinálním traktu a vylučování metabolitů 18F-FDG močovými cestami (17). Zde je role obou metod nutně komplementární a stala se racionálním důvodem pro integraci obou metod v jednom PET/CT systému.
Přínos PET/CT ke stážování NHL
Myšlenka integrace 18F-FDG PET a CT vyšetření byla založena na zjištění výše uvedené synergie a určité komplementarity obou metod. Integrovaná PET/CT metoda dokáže precizně zobrazit strukturu a lokalizaci patologické léze utilizující 18F-FDG a zvýšit celkovou specificitu vyšetření oproti samostatnému PET a CT. Hardwarově přesně fúzované obrazy jsou k dispozici bezprostředně při ukončení vyšetření pacienta, CT data navíc slouží ke korekci PET obrazů na zeslabení záření tkáněmi pacienta (13). Díky těmto skutečnostem roste použití PET/CT v onkologii vysokým tempem, i když zatím existuje poměrně omezené množství publikací dokumentující jeho přínos ke stážování maligních lymfomů.
Schaefer s kolektivem popsal 94 % citlivost PET/CT u postižení lymfatických uzlin maligním lymfomem oproti 88 % citlivosti CT s použitím kontrastní látky, specificita byla potvrzena ve 100 % PET/CT vyšetření oproti 86 % CT vyšetření (30). Pokud se autoři zaměřili na popis extranodálních ložisek, pak rozdíly v citlivosti PET/CT oproti CT se dramaticky zvýšily – 88 % oproti 50 %! Specificita PET/CT vyšetření přitom zůstala 100 % oproti 90 % u CT. V jiné studii Hernandes-Maraverová hodnotila prospektivně CT, PET a PET/CT nálezy u 47 nově diagnostikovaných nemocných s NHL a HL (31). Při srovnání metodik nalezla jednoznačnou výhodu PET/CT oproti samostatnému CT, resp. PET vyšetření a konstatovala, že PET/CT zvýšil stadium onemocnění u 11 z 47 nemocných (23 %; u 10 NHL a 1 HL, p = 0,012). Na základě těchto zjištění byla změněna léčebná strategie u 7 pacientů (15 %). K odlišnému názoru dospěl kolektiv německých autorů vedených la Fougerem (32). Ti dokumentovali výhodu PET oproti CT vyšetření (senzitivita 98 % oproti 87 %, specificita 99 % oproti 80 %), ale neprokázali další přínos integrovaného PET/CT (senzitivita 98 % a specificita 99 %). Je nutné zdůraznit, že soubory byly ve všech případech nesourodé z hlediska diagnóz lymfomů (různé entity NHL a HL), německá studie zahrnovala nemocné nově diagnostikované i relabované, část údajů byla hodnocena jak při iniciálním stážování, tak i při restážování po léčbě. Proto je důležité ověřit přínos PET/CT metody v prospektivně vedených studiích u jasně definovaných subpopulací maligních lymfomů a navíc v přesně vymezené situaci (iniciální vyšetření, restážování). Jen tak můžeme dosáhnout opravdu validních a nezpochybnitelných dat, která budou mít dopad na klinickou péči o nemocné.
Citlivost18F-FDG vyšetření u různých podtypů NHL
Většina hlavních podtypů NHL je tzv. 18F-FDG-avidní, mají tedy schopnost vychytávat a zpracovávat ve svých buňkách radioaktivně značenou molekulu FDG, což je základním předpokladem možnosti zobrazení ložisek lymfomu pomocí PET. Na druhé straně existují lymfomy, jež FDG neakumulují/neutilizují a PET vyšetření u nich není prospěšné, resp. může být popsáno jako „falešně“ negativní. V minulosti bylo obecně konstatováno, že agresivní NHL a HL utilizují 18F-FDG konstantně v daleko vyšší míře než lymfomy nízce maligní (indolentní). Dále byly publikovány zprávy o tom, že T-buněčné NHL jsou obecně nejméně schopné metabolizovat 18F-FDG a PET vyšetření u nich má nejvyšší počet negativních obrazů (33, 34). Teprve s rozšířením PET přístrojů, upřesněním metodiky a nedávno publikovanými daty začíná být jasnější jaká je reálná senzitivita 18F-FDG PET vyšetření u jednotlivých podtypů NHL. Jerusalem s kolegy hodnotil přínos 18F-FDG PET vyšetření u nízce maligních B-lymfomů (42 pacientů) a potvrdil přínos této metody u folikulárních lymfomů (FL), kde detekovala až o 40 % více postižených uzlin než konvenční metodiky (35). Na druhou stranu u pacientů s malobuněčným B-lymfocytárním lymfomem (SLL) PET metoda selhávala, když zobrazila o 58 % méně patologických oblastí lymfatických uzlin než standardní stážovací techniky. Elstromová publikovala v roce 2003 studii popisující roli 18F-FDG PET vyšetření u jednotlivých podtypů NHL utříděných podle WHO klasifikace lymfoidních nádorů (36). Vyšetření detekovalo onemocnění u 161 nemocných ze 172 vyšetřených (94 %), u 11 pacientů bylo negativní. 100% pozitivita ve všech vyšetřených případech byla nalezena u difuzního B-velkobuněčného lymfomu (DLBCL) a lymfomu z plášťových buněk (MCL), pokud budeme brát jednotky zastoupené 5 a více hodnocenými případy. V 98% byl pozitivní PET nález u HL a FL, lymfom marginální zóny (MZL) byl detekovatelný u 67% jedinců, zatímco periferní T-buněčný lymfom (PTCL) jen u 2 z 5 vyšetřených (40 %). Elstromová dále konstatovala, že přínos PET vyšetření není optimální z hlediska stanovení postižení kostní dřeně u žádného ze sledovaných podtypů NHL a trepanobiopsie a následné histologické vyšetření vzorku zůstává i nadále zlatým standardem stážovací procedury. Podobné výsledky publikovali i Karam a kolektiv, senzitivita PET byla 94 % u FL, 71 % pro MZL a 53 % pro SLL (37). Wöhrer i Bishu se ve svých studiích shodli na tom, že u FL nejsou rozdíly v míře detekce utilizace 18F-FDG, které by závisely na patologickém stupni, resp. podílu větších buněk ve vzorku (stupeň 1 a 2, resp. 3 FL) (38, 39). Senzitivita v obou pracích byla vysoká (98 % a 95 %), stejně tak i specificita (94 % a 88 %). Situace u T-buněčných lymfomů zůstává méně přehledná. Zatímco senzitivita 18F-FDG PET vyšetření je velmi dobrá u anaplastických velkobuněčných T-lymfomů (ALCL), u PTCL a kožních forem T-NHL zůstává poměrně nízká (40, 41). Některé studie, které toto rozdělení nerespektují, docházejí k nepřesným závěrům, které pak nejsou v praxi potvrzeny (41). Na CT, FDG PET a FDG PET/CT skenech ilustrujeme možnosti zobrazení jednotlivých podtypů NHL (obr. 1–9). Snímky pocházejí z archivu Kliniky nukleární medicíny FNO A LF UP v Olomouci.
Význam zhodnocení intenzity utilizace 18F-FDG u jednotlivých typů NHL
V současné době je doporučované pouze vizuální hodnocení PET skenů a určení, zda jde o pozitivní nebo negativní PET nález (42). Vizuální hodnocení je založeno na porovnání intenzity nálezu vychytávání FDG patologickou tkání k intenzitě zjištěné v mediastinálních krevních strukturách. Ze získaných obrazů však můžeme kvantitativně určit míru utilizace glukózy nádorovou tkání a popsat tak aktivitu onemocnění, resp. jeho agresivitu a také porovnat PET nález před léčbou a po ní. Na základě takovéhoto měření dokážeme teoreticky odlišit také některé léze nenádorové povahy od ložisek tumoru. Nejčastěji používanou metodou k hodnocení stupně utilizace FDG tkáněmi je výpočet tzv. SUV (standardized uptake value). Hodnota SUV se vypočítává jako poměr aktivity radiofarmaka vztažené k objemu tkáně a podané aktivity radiofarmaka vztažené na tělesnou hmotnost:
A (kBq x cm-3) je objemová aktivita tkáně, D (kBq) je aplikovaná aktivita radiofarmaka. A a D musí být obojí korigovány na fyzikální poločas přeměny 18F a přepočítány ke stejnému času.
V měření a výpočtu SUV existují určité metodologické překážky, resp. nepřesnosti. Jde například o hladinu glukózy v krvi nebo velikost léze, ale řada prací na toto téma potvrdila, že kvantitativní měření vychytávání FDG nádorem u neléčených pacientů je poměrně přesné s koeficientem variace do 10 % (43). Prvotní studie zabývající se vztahem hodnoty SUV a podtypem lymfomu demonstrovaly poměrně významné překrytí míry utilizace FDG mezi agresivními a indolentními lymfomy (44, 45). Novější práce tato pozorování zčásti potvrdily, ale také prokázaly, že při použití určitých hraničních hodnot je možné s vysokou pravděpodobností od sebe indolentní a agresivní lymfomy odlišit. Kolektiv autorů kolem Schödera popsal rozmezí hodnot SUV u indolentních NHL mezi 2,3 a 13,0, u agresivních NHL se hodnoty pohybovaly mezi 3,2 a 43,0 (46). Rozdíl průměrných hodnot mezi indolentními a agresivními lymfomy byl statisticky významný (7,0 ± 3,1 versus 19,6 ± 9,3; p = 0,01) a všechny indolentní NHL měly hodnotu SUV pod 13,0. Podobný rozdíl našli i kanadští autoři, když i jimi nalezený rozdíl mezi indolentními a agresivními lymfomy byl statisticky významný (5,9 ± 2,9 versus 15,7 ± 10,2; p = 0,0005) (47). Nejnižší hodnoty u indolentních lymfomů pozoroval Karam a kol. u lymfomu marginální zóny (MZL) a u lymfomu z malých lymfocytů/B-chronické lymfatické leukemie (SLL/CLL) (37). Zároveň autoři podotkli, že významný nárůst SUV u prospektivně sledovatelného nemocného s indolentním lymfomem může znamenat transformaci v agresivní NHL. Teprve další studie s větším počtem nemocných a standardizace metodiky v budoucnu rozhodne, zda vizuální hodnocení PET skenů u maligních lymfomů bude nahrazeno kvantitativním hodnocením míry utlizace FDG vyjádřeným pomocí SUV.
Limity a úskalí PET vyšetření v iniciální diagnostice NHL
18F-FDG je v současnosti nejlepší indikátorovou molekulou pro PET vyšetření u NHL. I když jde o látku s vysokou afinitou k lymfomové tkáni, přesto je i tato utilizována ve zvýšené míře některými tkáněmi a orgány, resp. nenádorovými procesy, jež mohou v organismu probíhat. Na druhé straně řada lymfomů nemusí 18F-FDG utilizovat a PET vyšetření u nich může být „falešně“ negativní. Díky uvedeným limitacím se relativně často dostáváme do situací, kdy lymfom při PET vyšetření nemusíme vůbec detekovat nebo může být maskován fyziologickou distribucí 18F-FDG nebo jiný proces, který vykazuje zvýšený metabolismus glukózy, může patologickou lymfomovou tkáň napodobit (mimikovat) (4, 9, 48, 49).
Nedetekovaný lymfom. Jak bylo uvedeno výše, existuje řada podtypů lymfomů, u nichž je 18F-FDG avidita nízká či v řadě případů nulová. Jde o zejména o T-NHL, SLL nebo MZL. Také malé nádorové infiltráty (pod 1,0 cm) u jinak PET-avidních NHL nemusí být detekovány. Kontrast jejich obrazu je ovlivněn efektem částečného objemu („partial volume effect“), neboť jsou menší než 3–4násobek prostorového rozlišení PET systému. V důsledku tohoto jevu se objekty se stejnou objemovou aktivitou zobrazují tím hůře, čím je jejich rozměr menší. Zjednodušeně řečeno, obraz menšího objektu bude méně jasný než obraz většího objektu, přestože mají stejnou objemovou aktivitu. Lymfom nemusí být detekován také vlivem příliš časného provedení vyšetření po aplikaci 18F-FDG, tzn. v době, kdy akumulace látky v lymfomu ještě nedosáhla potřebné úrovně.
Maskovaný lymfom. Vysoká fyziologická akumulace 18F-FDG v některých orgánech může maskovat lymfomovou lézi a znemožnit tak její PET detekci. Jde zejména o tkáň mozku, myokardu, části gastrointestinálního systému (kolon a cékum) a vývodné močové cesty, protože FDG není reabsorbována ledvinnými tubuly.
Mimikovaný lymfom. U některých mladých lidí může být zvýšená akumulace 18F-FDG přítomna také v tonzilách, thymu a slinných žlázách. Někdy bývá akumulace FDG vyšší ve svalech krku a paravertebrálních svalech horní hrudní páteře a také v oblasti výskytu tzv. hnědého tuku, jež leží mezi oběma lopatkami. Nenádorové procesy se zvýšeným metabolismem glukózy (infekční a zánětlivá ložiska, autoimunitní procesy, granulomatózní choroby, ale i drobná traumata) mohou být při PET vyšetření jen velmi těžce odlišitelné od nádorové infiltrace a mohou se u pacientů s lymfomy vyskytovat souběžně. Aplikace intramuskulárních injekcí může vést k aktivaci lymfatické uzliny drénující příslušnou oblast a k jejímu PET pozitivnímu obrazu.
Závěr
18F-FDG PET vyšetření představuje výrazný pokrok v diagnostice a stážovaní NHL. Integrace PET a CT metodiky v jednom hybridním přístroji umožňuje rychlé vyšetření s přesným popisem struktury a glukózového metabolismu abnormální tkáně a orgánu a zvyšuje tak přesnost a diferenciálně-diagnostickou užitečnost vyšetření. 18F-FDG není radiofarmakem specifickým pro zobrazování lymfomů a jiných nádorů a řada nenádorových procesů se zvýšeným metabolismem glukózy může vykazovat PET pozitivitu. Důkladná analýza CT skenů, důkladná anamnéza, fyzikální vyšetření a další informace získané ostatními vyšetřovacími metodami umožní jejich odlišení od lymfomové tkáně. V řadě případů však pomůže až biopsie a histopatologické posouzení podezřelé tkáně.
Práce byla podpořena grantem IGA MZ ČR No. NR/9502-3
MUDr. Tomáš Papajík, CSc.
Hemato-onkologická klinika LF UP a FN Olomouc
I. P. Pavlova
775 20 Olomouc
e-mail: tomas.papajik@fnol.cz
Doručeno do redakce: 9. dubna 2008.
Přijato do tisku: 14. července 2008
Zdroje
1. Cheson BD, Pfistner B, Juweid ME, et al. Revised response criteria for malignant lymphoma. J Clin Oncol 2007; 25 : 579–586.
2. Barentsz J, Takahashi S, Oyen W, et al. Commonly used imaging techniques fo diagnosis and staging. J Clin Oncol 2006; 24 : 3234–3244.
3. Jhanwar YS, Straus DJ. The role of PET in lymphoma. J Nucl Med 2006; 47 : 1326–1334.
4. Barrington SF, O’Doherty MJ. Limitations of PET for imaging lymphoma. Eur J Nucl Med Mol Imaging 2003; 30 (Suppl 1): 117–127.
5. Schulthess GK, Steinert HC, Hany TF. Integrated PET/CT: Current applications and future directions. Radiology 2006; 238 : 405–422.
6. Phelps ME. Inaugural article: Positrone emission tomography provides molecular imaging of biological processes. Proc Natl Acad Sci U. S. A. 2000; 97 : 9226–9233.
7. Warburg O. On the origin of cancer cells. Science 1956; 123 : 309–314.
8. Aloj L, Caracao C, Jagoda E, et al. Glut-1 and hexokinase expression: Relationship with 2-fluoro-2-deoxy-D-glucose uptake in A431 and T47D cells in culture. Cancer Res 1999; 59 : 4709–4714.
9. Bakheet SM, Powe J. Benign causes of 18-FDG uptake on whole body imaging. Semin Nucl Med 1998; 28 : 352–358.
10. Kinahan PE, Townsend DW, Beyer T, Sashin D. Attenuation correction for a combined 3D PET/CT scanner. Med Phys 1998; 25 : 2046–2053.
11. Beyer T, Townsend DW, Brun T, et al. A combined PET/CT scanner for clinical oncology. J Nucl Med 2000; 41 : 1369–1379.
12. Lardinois D, Weder W, Hany TF, et al. Staging of non-small cell lung cancer with integrated positron-emission tomography and computed tomography. N. Engl J Med 2003; 348 : 2500–2507.
13. Hany TF, Steinert HC, Goerres G.W, et al. PET diagnostic accuracy: improvement with in-line PET-CT system: initial results. Radiology 2002; 225 : 575–581.
14. Carbone P. Kaplan H, Musshoff K, et al. Report of the Committee on Hodgkin’s disease staging. Cancer Res 1971; 31 : 1860–1861.
15. Cheson BD, Pfistner B, Juweid ME, et al. Revised response criteria for malignant lymphoma. J Clin Oncol 2007; 25 : 579 – 86.
16. Isasi CR, Lu P, Blaufox MD. A metaanalysis of 18F-2-deoxy-2-fluoro-D-glucose positron emission tomography in the staging and restaging of patients with lymphoma. Cancer 2005; 104 : 1066–1074.
17. Buchmann I, Reinhardt M. Elsner K, et al. 2-(Fluorine-18)fluoro-2-deoxy-D-glucose positron emission tomography in the detection and staging of malignant lymphoma. A bicenter trial. Cancer 2001; 91 : 889–899.
18. Kostakoglu L, Leonard JP, Kuji I, et al. Comparison of fluorine-18 fluorodeoxyglucose positron emission tomography and Ga-67 scintigraphy in evaluation of lymphoma. Cancer 2002; 94 : 879–888.
19. Wirth A, Seymour JF, Hicks RJ, et al. Fluorine-18 fluorodeoxyglucose positron emission tomography, gallium-67 scintigraphy and conventional staging for Hodgkin’s disease and non-Hodgkin’s lymphoma. Am J Med 2002; 112 : 262–268.
20. Thill R, Neuerburg J, Fabry U, et al. Comparison of findings with 18-FDG PET and CT in pretherapeutic staging of malignant lymphoma. Nuklearmedizin 1997; 36 : 234–239.
21. Moog F, Bangerter M, Diederichs CG, et al. Lymphoma: role of whole body 2-deoxy-2-(F-18) fluoro-D-glucose (FDG) PET in nodal staging. Radiology 1997; 203 : 795–800.
22. Jerusalem G, Warland V, Najjar F, et al. Whole-body 18F-FDG PET for the evaluation of patient with Hodgkin’s disease and non-Hodgkin’s lymphoma. Nucl Med Commun 1999; 20 : 13–20.
23. Delbeke D, Martin WH, Morgan DS, et al. 2-deoxy-2-(F-18) fluoro-D-glucose imaging with positron emission tomography for initial staging of Hodgkin’s disease and lymphoma. Mol Imaging Biol 2002; 4 : 105–114.
24. Moog F, Bangerter M, Diederichs CG. Extranodal malignant lymphoma: detection with FDG PET versus CT. Radiology 1998; 2006 : 475–481.
25. Kostakoglu L, Goldsmith S. Fluorine-18 fluorodeoxyglucose positron emission tomography in the staging and follow-up of lymphoma: is it time to shift gears? Eur J Nucl Med 2000; 27 : 1564–1578.
26. Moog F, Bangerter M, Kotzerke J, et al. 18-F-fluorodeoxyglucose-positron emission tomography as a new approach to detect lymphomatous bone marrow. J Clin Oncol 1998; 16 : 603–609.
27. Carr R, Barrington SF, Madan B, et al. Detection of lymphoma in bone marrow by whole-body positron emission tomography. Blood 1998; 91 : 3340–3346.
28. Kostakoglu L, Leonard JP, Kuji I, et al. Evaluation of FDG-PET in the detection of bone marrow involvement in lymphoma. J Nucl Med 2000; 41 : 71p.
29. Heald AE, Hoffman JM, Bartlett JA, Waskin HA. Differentiation of central nervous system lesions in AIDS patients using positron emission tomography (PET). Int J Std AIDS 1996; 7 : 337–346.
30. Schaefer NG, Hany TF, Taverna C, et al. Non-Hodgkin lymphoma and Hodgkin disease: coregistered FDG PET and CT at staging and restaging – do we need contrast-enhanced CT? Radiology 2004; 232 : 823–829.
31. Hernandez-Maraver D, Hernandez-Navarro F, Gomez-Leon N, et al. Positron emission tomography/computed tomography: diagnostic accuracy in lymphoma. Br J Haematology 2006; 135 : 293–302.
32. la Fougere C, Hundt W, Bröckel N, et al. Value of PET/CT versus PET and CT performed as separate investigations in patients with Hodgkin’s disease and non-Hodgkin’s lymphoma. Eur J Nucl Med Mol Imaging 2006; 33 : 1417–1425.
33. Israel O, Keidar Z, Bar-Shalom R. Positron emission tomography in the evaluation of lymphoma. Sem Nucl Med 2004; 24 : 166–179.
34. Friedberg JW, Chengazi V. PET scans in the staging of lymphoma. Oncologist 2003; 8 : 438–447.
35. Jerusalem G, Beguin Y, Najjar F, et al. Positron emission tomography (PET) with 18F-fluorodeoxyglucose (18FDG) for the staging of low-grade non-Hodgkin’s lymphoma (NHL). Ann Oncol 2001; 12 : 825–830.
36. Elstrom R, Guan L. Baker G, et al. Utility of FDG-PET scanning in lymphoma by WHO classification. Blood 2003; 101 : 3875–3876.
37. Karam M, Novak L, Cyriac J, et al. Role of fluorine-18 fluoro-deoxyglucose positron emission tomography scan in the evaluation and follow-up of patients with low-grade lymphomas. Cancer 2006; 107 : 175–183.
38. Wöhrer S, Jaeger U, Kletter K, et al. 18fluoro-deoxy-glucose positron emission tomography (18F-FDG-PET) visualizes follicular lymphoma irrespective of grading. Ann Oncol 2006; 17 : 780–784.
39. Bishu S, Quigley J, Bishu SR, et al. Predictive value and diagnostic accuracy of F-18-fluoro-deoxy-glucose positron emission tomography treated grade 1 and 2 follicular lymphoma. Leuk Lymphoma 2007; 48 : 1548–1555.
40. Quigley JM, Bishu S, Hankons J, Armitage JO. FDG-PET in peripheral T-cell lymphoma. Blood 2006; 108 : 5499a.
41. Bishu S, Quigley JM, Schmitz J, et al. F-18-fluoro-deoxy-glucose positron emission tomography in the assesment of peripheral T-cell lymphomas. Leuk Lymphoma 2007; 48 : 1531–1538.
42. Juweid ME, Stroobants S, Hoekstra OS, et al. Use of positron emission tomography for response assessment of lymphoma: Consensus of the imaging subcommittee of Internal harmonization Project in lymphoma. J Clin Oncol 2007; 25 : 571–578.
43. Weber W.A, Ziegler S.I, Thodtmann R, et al. Reproducibility of metabolic measurements in malignant tumors using FDG PET. J Nucl Med 1999; 40 : 1771–1777.
44. Rodriguez M, Rehn S, Ahlstrom H, et al. Predicting malignancy grade with PET in non-Hodgkin’s lymphoma. J Nucl Med 1995; 1790–1796.
45. Lapela M, Leskinen S, Minn H.R, et al. Increased glucose metabolism in untreated non-Hodgkin’s lymphoma: A study with positron emission tomography and fluorine-18-fluorodeoxyglucose. Blood 1995; 86 : 3522–3527.
46. Schöder H, Noy A, Gönen M, et al. Intensity of 18fluorodeoxyglucose uptake in positron emission tomography distinguishes between indolent and agressive non-Hodgkin’s lymphoma. J Clin Oncol 2005; 23 : 4643–4651.
47. Wong CO, Thie J, Parling-Lynch KJ, et al. Glucose-normalized standardized uptake value from 18F-FDG PET in classifying lymphomas. J Nucl Med 2005; 46 : 1659–1663.
48. Strauss LG. Fluorine-18 deoxyglucose and false-positive results: a major problem in the diagnostic of oncological patients. Eur J Nucl Med 1996; 23 : 1409–1415.
49. Kazama T, Faria SC, Varavithya V, et al. FDG PET in the evaluation of treatment for lymphoma: clinical usefulness and pitfalls. Radiographics 2005; 25 : 191–207.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2008 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Třetí celostátní protokol léčby dětské akutní lymfoblastické leukemie znamenal další zlepšení výsledků. Studie ALL-BFM 95 u dětí v České republice 1995-2002
- Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u nehodgkinských lymfomů Část I. Určení stadia a postižení jednotlivých orgánů
- Změny v diagnostických kritériích a kritériích léčebné odpovědi u mnohočetného myelomu
- Minimální reziduální nemoc u chronické lymfocytární leukemie: metody stanovení a klinický význam
- Prof. BLAHOŠ – důstojník Řádu Čestné legie
- Burkittův lymfom: přehled patofyziologie, diagnostiky a terapie
- Vzdělávací akce IPVZ
- XXII. Olomoucké hematologické dny – kvalita, inovace, tradice a „genius locí“
- PRODUKCE ZAŘÍZENÍ TRANSFUZNÍ SLUŽBY V ČR 2007
- Nové karty členů ČLS J.E.P.
- Cena České hematologické společnosti za nejlepší publikace v oboru hematologie v roce 2007.
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Burkittův lymfom: přehled patofyziologie, diagnostiky a terapie
- Třetí celostátní protokol léčby dětské akutní lymfoblastické leukemie znamenal další zlepšení výsledků. Studie ALL-BFM 95 u dětí v České republice 1995-2002
- Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u nehodgkinských lymfomů Část I. Určení stadia a postižení jednotlivých orgánů
- Minimální reziduální nemoc u chronické lymfocytární leukemie: metody stanovení a klinický význam
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




