-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKaposiho sarkom po alogenní transplantaci periferních krvetvorných buněk s nemyeloablativní přípravou – kazuistika
Kaposi’s sarcoma after non-myeloablative allogeneic peripheral stem cell transplantation – case report
The iatrogenic subtype of Kaposi‘s sarcoma (KS) is extremely rare after stem cell transplantation. We present here the first case report in the Czech Republic, in a 58-year-old woman with acute B-lymphoblastic leukemia (B-ALL), who had developed KS in the period of days 90 to 120 after sibling donor allogeneic peripheral stem cell transplantation. KS spontaneously and gradually regressed within days 270 to 390 post-transplant, when no clinically important infections were more evident, and intensive immunosuppressive treatment given for acute graft versus host disease (GvHD) was markedly reduced.
Key words:
Kaposi’s sarcoma, secondary malignancy, acute lymphoblastic leukemia, allogeneic stem cell transplantation
Autoři: S. Vokurka 1; D. Kazakov 2; V. Koza 1; K. Pizinger 3; V. Vozobulová 1; M. Švojgrová 1
Působiště autorů: Hematologicko-onkologické oddělení, Fakultní nemocnice v Plzni 1; Patologicko-anatomický ústav, Fakultní nemocnice v Plzni 2; Dermatovenerologická klinika, Fakultní nemocnice v Plzni 3
Vyšlo v časopise: Transfuze Hematol. dnes,13, 2007, No. 1, p. 32-34.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Rozvoj iatrogenního podtypu Kaposiho sarkomu (KS) po transplantaci krvetvorných buněk je extrémně vzácný. Je prezentován první případ výskytu u české 58leté, HIV negativní ženy s akutní B-lymfoblastickou leukemií (B-ALL), u které došlo k rozvoji KS ve dnech 90 až 120 po sourozenecké alogenní transplantaci periferních krvetvorných buněk s nemyeloablativní přípravou. Sarkom spontánně a pozvolna ustupoval v rozsahu dní 270 až 390 po transplantaci, kdy již nedocházelo k výskytu žádných významných infekcí a původně intenzivní imunosupresivní léčba pro akutní reakci štěpu proti hostiteli (GvHD) byla silně redukována.
Klíčová slova:
Kaposiho sarkom, sekundární malignita, akutní lymfoblastická leukemie, alogenní transplantace krvetvorných buněkÚvod
Kaposiho sarkom (KS) se typicky manifestuje v podobě vícečetných hyperpigmentovaných, až sytě fialových kožních papul a plaků. Postihovat může i sliznici dutiny ústní, gastrointestinální trakt, lymfatické uzliny a plíce.
Histologicky je KS reprezentován proliferací neoplastických vřetenovitých endotelií vytvářejících nepravidelné abnormální cévy. V patologické tkáni jsou pak pravidelně detekovány sekvence DNA lidského herpetického viru 8 (Human herpesvirus 8, HHV-8), který je mimo jiné zodpovědný za kódování genů stimulujících angiogenezi.
Prevalence KS u pacientů po transplantaci ledvin se blíží 4 % (6). Na druhé straně, u pacientů po transplantacích krvetvorných buněk je KS raritní, ačkoliv HHV-8 séropozitivita je v této populaci obecně vysoká – 12 % kanadských a 18 % francouzských pacientů (7, 8). Doposud, podle dostupných literárních sdělení, bylo popsáno pouze pět případů výskytu KS po alogenní transplantaci krvetvorných buněk po myeloablativní nebo nemyeloablativní přípravě, přičemž žádný zatím v České republice (9–13).
Případ
V únoru 2004 byla na našem oddělení u zdravé, 58leté a HIV negativní pacientky diagnostikována akutní B-lymfoblastická leukemie s přítomností Ph-1 chromozomu a pozitivitou fúzního genu bcr-abl. Indukční léčbou (prednison, vinkristin, idarubicin) bylo dosaženo hematologické kompletní remise. V dubnu 2004 po nemyeloablativní přípravě s fludarabinem a melfalanem (Fludara 30 mg/m2 v den -5 až -2, Alkeran 140 mg/m2 v den -1 před převedením štěpu) podstoupila pacientka transplantaci periferních krvetvorných buněk od HLA-identického bratra. Kompletní molekulární remise a plný dárcovský chimérismus byl dosažen ve 30. dni (den +30) od transplantace. Pro rozvoj akutní reakce štěpu proti hostiteli (GvHD) s postižením kůže, st. II dle Glucksberga, bez histologické verifikace, bylaode dne +23 po transplantaci doplněna původní imunosupresivní léčba s cyklosporinem A o metylprednisolon v dávce 2 mg/kg/den s postupnou redukcí v následném období. V den +120 byla léčba cyklosporinem A ukončena a dávka kortiko-idu v té době již snížena na 4 mg ob den. Pro nový rozvoj histologicky verifikované GvHD od dne +140 s postižením kůže, střevní sliznice a jater byla původní kombinovaná imunosuprese opět ode dne +150 plně obnovena. V potransplantačním období do dne +160 proběhly u pacientky opakované infekční komplikace včetně invazivní aspergilové plicní infekce a enterkolitidy s pozitivitou Clostridium difficile, Pseudomonas aeruginosa, methicilin-rezistentní Staph. aureus (MRSA) a Candida albicans a celkem 5x byla metodikou PCR-DNA prokázána reaktivace cytomegalovirové (CMV) infekce s dosažením clearance viru při „preemptivní léčbě“ (léčba při prvních známkách počínající CMV infekce) s ganciclovirem nebo foscavirem.
V průběhu dní +90 až +120 se postupně na končetinách, trupu a hlavě pacientky rozvinuly vícečetné tmavší, až sytě fialové, nebolestivé, 3-10 mm veliké papuly s hladkým lesklým povrchem (obr. 1). Histologické vyšetření nodulu prokázalo proliferaci vřetenovitých, atypických endotelií s přítomností PAS pozitivních globulů, přítomnost abnormálních cév, depozita hemosiderinu a extravazáty erytrocytů. Molekulárně-geneticky PCR analýzou byly v tkáni prokázány DNA sekvence HHV-8 viru s použitím primeru Kaposi’s Sarcoma-associated Herpesvirus (KSHV-1 a KSHV-2) (14). Hladiny imunoglobulinů se u pacientky v té době pohybovaly na hodnotách IgG 4,0 g/l, IgA 0,3 g/l and IgM 0,2 g/l. Počet CD4 pozitivních lymfocytů (T-pomocné lymfocyty) byl 133/μl, CD8 (T-supresorové lymfocyty) 93/μl, CD-19 (B-lymfocyty) 8/μl, CD-16 a CD-56 (NK buňky) 78/μl.
Obr. 1. Nodulus Kaposiho sarkomu (1cm), horní končetina. 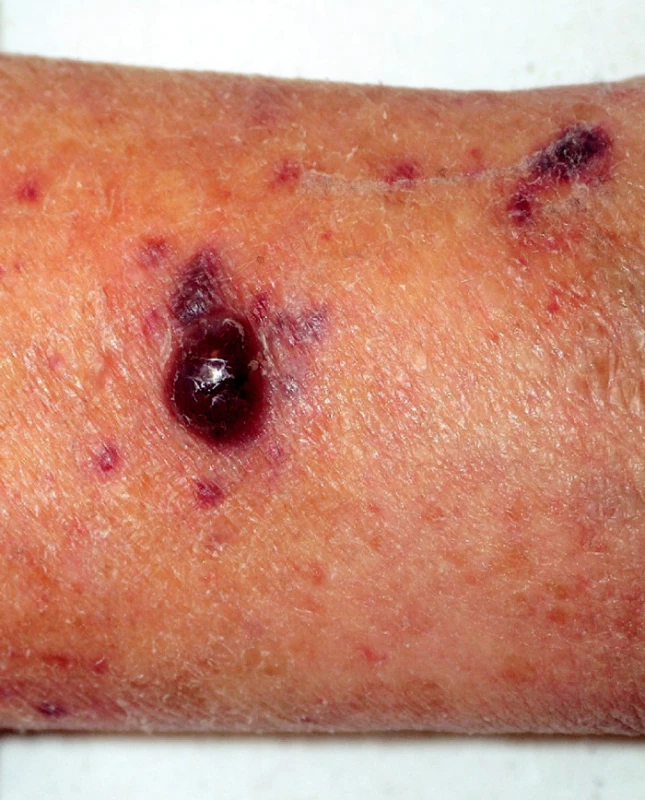
V období dní +180 až 350 byla vybraná ložiska KS na hlavě a končetinách ošetřována bariovým laserem (595nm, Candela) s efektem v podobě částečné regrese ošetřovaných ložisek. Přibližně ode dne +270, kdy již nedošlo k výskytu žádné významné infekce a imunosupresivní léčba s metylprednisolonem byla redukována na 4 mg ob den, začalo docházet k pozvolné spontánní regresi KS. Počet CD4 pozitivních lymfocytů se pohyboval nad 240/μl. Od dne +390 zůstaly v místě původních postižení již jen reziduální pigmentace. V den +780 v červnu 2006 přetrvává u pacientky kompletní remise ALL a KS.
Diskuse
Podle současných poznatků není zatím zcela jasné, zda řadit KS mezi pravé malignity nebo jen hyperplázie, když navíc studie klonality zde odhalují jak monoklonální, tak polyklonální rysy (1–4). Celá řada faktorů a interakcí může hrát roli v patofyziologii a epidemiologii KS, když glukokortikoidy využívané při imunosupresivní léčbě přímo podporují růst buněčných linií sarkomu (5) a souběžně probíhající infekce pravděpodobně rovněž mají význam v jeho etiopatogenezi (1, 15, 16). Spontánní regrese KS se mohou objevit, obzvláště u iatrogeního podtypu sarkomu, který je vztahován na pacienty léčené imunosupresivy a po transplantacích orgánů.
Postižení pacientky KS je v tomto případě s ohledem na klinicko-patologické charakteristiky nezpochybnitelné. Vedle těžké potransplantační imunodeprivace, jako potenciálně primární příčiny podporující rozvoj KS, zde stojí za povšimnutí především souběh manifestace KS s výskytem závažných infekcí, včetně CMV, které mohou podle některých autorů (1, 15, 16) pravděpodobně potencovat vývoj tohoto sarkomu, např. podporou aktivity viru HHV-8. Nicméně v tomto případě může souběh manifestace KS se závažnými infekcemi (včetně opakované reaktivace CMV) vyplývat právě z těžkého imunodeficitu u této pacientky s ALL, po alogenní transplantaci krvetvorných buněk a GvHD postižením vyžadujícím kombinovanou imunosupresivní léčbu a dlouhodobé užívání kortikoidu. A naopak, KS regredoval, stejně jako se již neobjevily závažné infekce až s odstupem řady měsíců po transplantaci při redukci a vysazování imunosupresiv.
Tento případ současně podporuje pozorování, která neprokázala efekt antivirové léčby s ganciclovirem nebo foscavirem na potlačení KS u transplantovaných pacientů, i když tato virostatika, včetně cidofoviru, mají potenciál inhibovat replikaci viru HHV-8 in vitro (1).
Bohužel sérum pacientky ani dárce nebylo testováno na přítomnost HHV-8 DNA sekvencí nebo HHV-8 protilátek a tak cesta přenosu viru HHV-8 (štěp, transfuze nebo endogenní reaktivace) zůstává neznámá.
Sledování dalších případů pacientů s KS po transplantacích a podpora výzkumu etiopatogeneze a epidemiologie jsou nadále nezbytné pro bližší pochopení podstaty této komplikace.
MUDr. Samuel Vokurka
Fakultní nemocnice v Plzni
Hematologicko-Onkologické oddělení
Alej Svobody 80
304 60 Plzeň
e-mail: vokurka@fnplzen.cz
Došlo do redakce: 24. 7. 2006
Přijato: 3. 11. 2006
Zdroje
1. Francés C. Kaposi’s sarcoma after renal transplantation. Nephrol Dial Transplant 1998; 13 : 2768-2773.
2. Moosa MR. Kaposi’s sarcoma in kidney transplant recipients: a 23-year experience. QJM 2005; 98 : 205–214.
3. Delabesse E, Oksenhendler E, Lebbe C, et al. Molecular analysis of clonality in Kaposi’s sarcoma. J Clin Pathol 1997; 50 : 664–668.
4. Rabkin CS, Bedi G, Musaba E, et al. AIDS-related Kaposi’s sarcoma is a clonal neoplasm. Clin Cancer Res 1995; 1 : 257–260.
5. Cai J, Zheng T, Lotz M, et al. Glucocorticoids induce Kaposi’s sarcoma cell proliferation through the regulation of transforming growth factor-beta. Blood 1997; 89 : 1491–1500.
6. Cattani P, Capuano R, Raffeo R, et al. Kaposi’s sarcoma associated with previous human herpesvirus 8 infection in kidney transplant recipients. J Clin Microbiol 2001; 39 : 505–508.
7. Sergerie Y, Abed Y, Roy J, et al. Comparative evaluation of three serological methods for detection of human herpesvirus 8-specific antibodies in Canadian allogeneic stem cell transplant recipients. J Clin Microbiol 2004; 42 : 2663–2667.
8. Rosenzwajg M, Fery N, Bons V, et al. Human herpesvirus-8 (HHV8) serology in allogeneic bone marrow transplant recipients. Bone Marrow Transplant 1999; 24 : 351–354.
9. Medeiros BC, Rezuke WN, Ricci A, et al. Kaposi’s sarcoma following allogeneic hematopoietic stem cell transplantation for chronic myelogenous leukemia. Acta hematol 2000; 104 : 115–118.
10. Helg C, Adatto M, Salomon D, et al. Kaposi’s sarcoma following allogeneic bone marrow transplantation. Bone Marrow Transplant 1994; 14 : 999–1001.
11. Erer B, Angelucci E, Muretto P, et al. Kaposi’s sarcoma after allogeneic bone marrow transplantation. Bone Marrow Transplant 1997; 19 : 629–631.
12. Bruno B, Sorasio R, Barozzi P, et al. Kaposi’s sarcoma triggered by endogenous HHV-8 reactivation after non-myeloablative allogeneic hametopoietic transplantation. Eur J Haematol 2006; 76 : 358–359.
13. Palencia S, Rodriguez-Peralto J, Castano E, et al. Kaposi’s sarcoma after allogeneic peripheral blood stem cell transplantation. Intern J Dermatol 2003; 42 : 647–649.
14. Serfling U, Lukowsky A, Audring HW, et al. Search for Kaposi’s sarcoma-associated virus DNA in hemangioproliferative disorders and cutaneous malignant lymphoma. J Cutan Pathol 1997; 24 : 298–304.
15. Sleiman C, Mal H, Roue C, et al. Bronchial Kaposi’s sarcoma after single lung transplantation. Eur Respir J 1997; 10 : 1181–1183.
16. Siegal B, Levinton-Kriss S, Schiffer A, et al. Kaposi’s sarcoma in immunosuppression. Possibly the result of a dual viral infection. Cancer 1990; 65 : 492–498.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2007 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Definice a klasifikace chronického onemocnění ledvin dle KDIGO
-
Všechny články tohoto čísla
- Vztah sérových hladin volných lehkých řetězců imunoglobulinu ke stupni pokročilosti mnohočetného myelomu
- Zprávy o knihách
- Porucha v regulácii chromatínu ako molekulárny mechanizmus MLL-ENL leukemogenézy
- Výsledky a komplikace splenektomie u pacientů s těžkou trombocytopenií při ITP rezistentní na úvodní konzervativní léčbu – zkušenosti centra
- Zprávy o knihách
- Od monitorovania hladiny fúzneho génu Bcr/Abl u pacienta s chronickou myeloidnou leukémiou k odhaľovaniu rezistencie k imatinibu – kazuistika
- ÚVODNÍK
- Kaposiho sarkom po alogenní transplantaci periferních krvetvorných buněk s nemyeloablativní přípravou – kazuistika
- 4. ČESKO – SLOVENSKÁ MEZIOBOROVÁ KONFERENCE LÉKAŘSKÉ MYKOLOGIE
- Doporučení Sesterské sekce České Hematologické Společnosti ČSL JEP na obsazení hematologických jednotek intenzivní péče, respektive center pro transplantace krvetvorných buněk, nelékařským personálem.
- Zprávy o knihách
- K osmdesátinám prof. MUDr. Ladislava Chrobáka, CSc.
- Novinky v terapii folikulárního lymfomu
- Dr. Adolf Georg Gadhof, Frankfurt am Main
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Výsledky a komplikace splenektomie u pacientů s těžkou trombocytopenií při ITP rezistentní na úvodní konzervativní léčbu – zkušenosti centra
- Vztah sérových hladin volných lehkých řetězců imunoglobulinu ke stupni pokročilosti mnohočetného myelomu
- Od monitorovania hladiny fúzneho génu Bcr/Abl u pacienta s chronickou myeloidnou leukémiou k odhaľovaniu rezistencie k imatinibu – kazuistika
- Novinky v terapii folikulárního lymfomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



