-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaOd monitorovania hladiny fúzneho génu Bcr/Abl u pacienta s chronickou myeloidnou leukémiou k odhaľovaniu rezistencie k imatinibu – kazuistika
From the monitoring of Bcr/Abl fusion gene level in patient with chronic myeloid leukemia to the imatinib resistance detection – case report
There is the case report of 63-years old patient with Ph1 positive chronic myeloid leukaemia (CML) who is treated with 400 mg of imatinib daily. It is because of the secondary cytogenetic resistance to interferon alpha after two years from diagnosis. After initial cytogenetic response (10 % Bcr/Abl positive cells detected by bone marrow interphase FISH examination after 3 months and 1 log decrease in quantitative RT-PCR after 6month of treatment) there is the cytogenetic progression in one year with failure of the response to the escalated dosage 800 mg daily. It leads to the suspicion of imatinib resistance. In vitro tests confirm it: there is a high expression of WT1 gene, the presence of phosphorylated CRKL and detection of T315I mutation in Abl kinase domain. This article is aimed at detection of imatinib resistance in case of suspicion and should also show the review of the new treatment modalities. The resistance detection is important from clinical point of view. It allows to stop the therapy which is not useful and economically demanding, on the other side it moves it to the application of the new tyrosine kinase inhibitors, allogenic stem cell transplantation or to experimental treatment.
Key words:
Bcr/Abl fusion gene, WT1 gene, quantitative RT-PCR, tyrosine kinase inhibitors, T315I mutation
Autoři: P. Rohoň 1; E. Faber 1; J. Naušová 2; R. Solná 2; Š. Rožmanová 1; R. Plachý 1; M. Brejcha 3; M. Jarošová 1; V. Divoký 2; K. Indrák 1
Působiště autorů: Hemato-onkologická klinika FN Olomouc a LF UP v Olomouci 1; Ústav biologie LF UP v Olomouci 2; Onkologické centrum J. G. Mendela, Nový Jičín 3
Vyšlo v časopise: Transfuze Hematol. dnes,13, 2007, No. 1, p. 27-31.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Popisujeme kazuistiku 63-ročného pacienta s Ph1 pozitívnou chronickou myeloidnou leukémiou (CML), u ktorého bola pre sekundárnu cytogenetickú rezistenciu na interferón alfa po dvoch rokoch od stanovenia diagnózy indikovaná liečba imatinibom v dávke 400 mg denne. Po iniciálnej cytogenetickej odpovedi (10 % Bcr/Abl pozitívnych buniek pri vyšetrení kostnej drene metódou interfázovej FISH po 3 mesiacoch a pokles o 1 log v kvantitatívnej RT-PCR po šiestich mesiacoch liečby) dochádza po roku liečby k cytogenetickej progresii s nedostatočnou odpoveďou i na eskalovanú dávku imatinibu 800 mg denne. To vedie k podozreniu na rezistenciu k imatinibu. In vitro testy to potvrdzujú: vysoká expresia WT1 génu, pozitivita testu na fosforylovaný CRKL a odhalenie mutácie T315I v oblasti ABL kinázovej domény. Cieľom článku je načrtnúť kroky, ktoré by mali nasledovať pri podozrení na rezistenciu k imatinibu a poskytnúť prehľad ďalších liečebných možností. Určenie rezistencie má klinický význam, pretože na jednej strane umožňuje včas ukončiť ďalej neprínosnú a ekonomicky náročnú liečbu a na druhej strane ju posúva k aplikácii nových inhibítorov tyrozínových kináz, k alogénnej transplantácii krvotvorných buniek či k experimentálnym postupom.
Kľúčové slová:
Bcr/Abl fúzny gén, WT1 gén, kvantitatívna RT-PCR, inhibítory tyrozínových kináz, mutácia T315IÚvod
Chronická myeloidná leukémia je myeloproliferatívnym ochorením charakterizovaným prítomnosťou Ph1 chromozómu, ktorý vzniká recipročnou translokáciou t(9;22)(q34;q11). Dôsledkom tejto cytogenetickej zmeny je vznik fúzneho génu Bcr/Abl. Ten kóduje chimérický proteín s konštitutívne zvýšenou tyrozínkinázovou aktivitou (1). Jeho podiel na patogenéze CML a výslednom leukemickom fenotype buniek je v súčasnosti považovaný za kľúčový. Zásadný prielom v liečbe CML znamenalo zavedenie imatinibu. Liek účinkuje pomocou interakcie s proteínom Bcr/Abl (p210) v mieste väzby ATP, pričom stabilizuje celý proteín, pozastavuje autofosforyláciu tyrozínových zvyškov, čo napokon vedie k zablokovaniu fosforylácie proteínov signálnych dráh podieľajúcich sa na leukemickom fenotype bunky (2). Pre sledovanie odpovede na liečbu má rozhodujúci význam metóda kvantitatívnej RT-PCR, ktorá ako jedna z najcitlivejších dostupných metód umožňuje posudzovať množstvo prítomného transkriptu Bcr/Abl (3). Zachytáva tiež pacientov, ktorí sa pri liečbe imatinibom stávajú k tomuto preparátu rezistentnými a iniciuje vyšetrovanie, ktoré smeruje k odhaľovaniu jej príčin. Je to predovšetkým skríning na mutácie ABL kinázovej doméne, detekcia fosforylačného stavu proteínu CRKL a ďalšie testy, napríklad expresný profil génu WT1 (Wilmsov tumor) (4, 5). V neposlednom rade sem patrí aj stanovenie prídavných cytogenetických zmien (napr. duplikácie Ph1 chromo - zómu), ktoré sa môžu objaviť počas liečby.
V našom príspevku je popísaná kazuistika 63-ročného chorého s Ph1 pozitívnou CML, u ktorého došlo k rozvoju cytogenetickej rezistencie na imatinib. Jej príčinou bola mutácia ABL kinázovej domény T315I. Dokumentujeme tak validnosť pátrania po príčinách rezistencie na imatinib umožňujúc tak správne rozhodovať o ďalšom liečebnom postupe.
Metódy
V predloženej kazuistike sú analyzované vzorky z periférnej krvi v časovom odstupe zodpovedajúcom štandardom monitorovania CML. Diagnóza CML bola potvrdená prítomnosťou Ph1 chromozómu a Bcr/Abl fúzneho génu.
In vitro kultivácia leukocytov s imatinibom,vyšetrenie fosforylácie Crkl proteínu, expresia WT1 génu
Leukocyty izolované z periférnej krvi pacienta sú kultivované in vitro s imatinibom (10 ∝M) alebo bez jeho prítomnosti. Po 1 hodine inkubácie sú bunky zlyzované v tzv. IP pufri s prídavkom inhibítorov fosfatáz a proteáz. Proteínové lyzáty sú napokon podrobené elektroforéze (SDS-PAGE) a metóde Western blottingu s imunodetekciou (7).
Pre kvantitatívne stanovenie expresie WT1 génu sú bunky kultivované in vitro s imatinibom s koncentráciou 1 a 5 ∝M alebo bez neho počas 24 hodín (5). Expresný profil WT1 genu je stanovený pomocou Q-RT-PCR po extrakcii RNA z leukocytov a prepise do cDNA.
Extrakcia RNA a prepis do cDNA
Celková RNA je izolovaná z leukocytov periférnej krvi pomocou trizolovej extrakcie po lýze červených krviniek podľa štandardného protokolu. Množstvo výťažku je zmerané spektrofotometricky. Reverzná transkripcia do cDNA sa realizuje pomocou kitu (Transcriptor Reverse Transcriptase, Roche Diagnostics, Manheim, Germany).
Q-RT-PCR
Kvantitatívna real-time polymerázová reťazová reakcia je realizovaná na prístroji LightCycler Instrument (Roche Diagnostics, Manheim, Germany), využíva sa princíp relatívnej kvantifikácie, kde ako referenčný gén (housekeeping) slúži ABL. Kvantifikácia Bcr/Abl fúzneho génu je odvodená z EAC protokolu (6). Reakčné podmienky sú identické pre fúzny gén i ABL. Stručný postup: 5 μl c DNA sa pridáva do 20 μl cieľového objemu s obsahom 2 μl Master Mix-u (LightCycler FastStart DNA Master Hybridization Probes; Roche Diagnostics, Manheim, Germany), 4 mM MgCl2, 300 nM primerov (Bcr/Abl) ENF5015‘-TCCGCTGACCATCAATAAGGA-3‘, ENR561 5‘-CACTCAGACCC TGAGGCTCAA-3‘, 200nM sondy ENP541 BHQ1-CCCTTCAGCGGCCAGT AGCAT-CTGA-FAM a 300 nM primerov (Abl) ENF1003 5‘-TGGAGATAA CACTCTAAGCATAACTAAAGGT-3, ENR1063 5‘-GATGTAGTTGCTTGGAC CCA-3, 200nM sondy ENP 1043 BHQ1-CCATTTTTGGTTTGGGCTT-CACA CCATT-FAM. Teplotný profil PCR zahŕňa denaturáciu 10 min. pri 95 °C a 50 cyklov (95 °C, 10 s, 20 °C/s)/ /(60 ľC, 30 s, 20 °C/s). Fúzny i referenčný gén sú vyšetrované v dvojici. Kalibračná krivka je zostrojená pomocou plazmidového štandardu so známou koncentráciou sledovaného génu i housekeepingu (Ipsogen, Marseille, France). Kvantifikácia WT1 génu využíva ako referenčný gén Abl, celý postup prebieha podľa návodu výrobcu (WT1 Profile Quant kit, Ipsogen, Marseille, France).
Sekvenačná analýza Abl kinázovej domény a restrikčné štiepenie
Úsek Abl kinázovej domény (tzv. ATP binding pocket) je získaný pomocou dvojkolovej PCR a priamo sekvenovaný na analyzátore ABI 3100 Genetic Analyzer (Applied Biosystems, USA). V prvom kole sa syntetizuje fúzna oblasť Bcr/Abl s dĺžkou 3374 bp pomocou špecifických primerov pre túto oblasť: B2A (5‘-TTCAGAA-GCTTCTCCCTGACAT-3‘) a BcrAblR (5‘-CTTCT-CTAGCAGC TCATACACC-3‘), v druhom kole pomocou primerov AblATPF (5‘-TCACCAT GAAG-CACAAGCTG-3‘) a AblATPR (5‘-TCAGGTAGT-CCAGGAGGTTC-3‘) úsek zahŕňajúci oblasť ATP binding pocket v dĺžke 257 bp s cyklovaním: 95 °C (3 min.); 35 cyklov (95 °C-35 s, 56 °C (1. kolo)/54 °C (2. kolo) - -40 s); 72 °C-45 s. Reakčná zmes obsahuje 2 μl cDNA v 50 μl 1xPCR pufru s výslednou koncentráciou 0,7 U Pfu polymerázy, 1 U Taq polymerázy, 2 mM MgCl2, 0,2 mM dNTPs a 20 pM primerov.
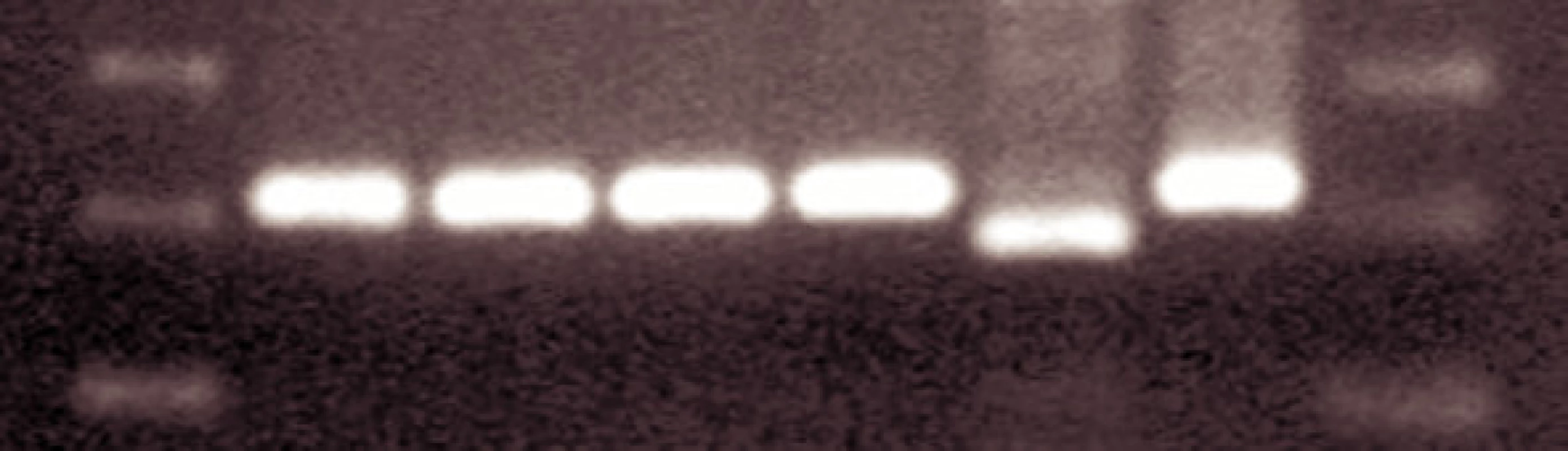
Overenie mutácie T315I je realizované restrikčnou analýzou PCR produktu s použitím endonukleázy DdeI. Produkt je analyzovaný na 1,5% agarózovom gele.
Popis prípadu
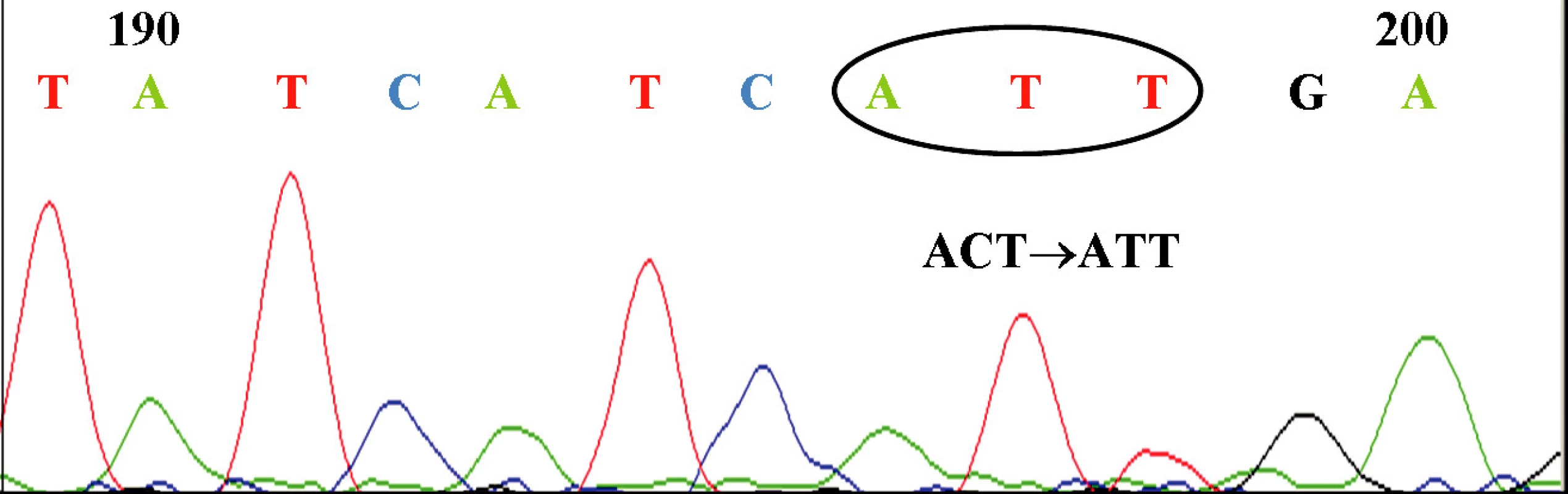
U 63-ročného pacienta s anamnézou obezity a hypertenzie zistenej v roku 2002 sa v septembri toho istého roku potvrdila diagnóza Ph1 pozitívnej CML vo včasnej chronickej fáze. Chorý bol podľa hodnôt prognostických indexov v strednej rizikovej skupine (Sokal 0,9, Euro skóre 1152). Osobná i rodinná anamnéza bola bez pozoruhodností. V úvode liečby bol podávaný Litalir v dávke 1,5 g denne. Po dosiahnutí hematologickej remisie bol od novembra 2002 nasadený interferón až do dávky 10 MIU denne. Táto liečba bola komplikovaná trombocytopéniou a podnietila redukciu dávky na 2,5 MIU obdeň. Cytogenetické vyšetrenie v novembri 2003 ukázalo prítomnosť 49 % buniek s pozitivitou Ph1chromozómu. Od tohto obdobia bol pacient liečený dávkou 2,5 MIU interferónu denne, ktorá bola dobre tolerovaná. Kontrolné cytogenetické vyšetrenie v novembri 2004 metódou interfázovej FISH ukázalo nedostatočnú cytogenetickú odpoveď k liečbe (42 % Bcr/Abl pozitívnych buniek). Terapia interferónom sa ukončila s tým, že obdobie do nasadenia imatinibu bolo preklenuté hydroxyureou v dávke 1,5g denne. V decembri 2004 bola zahájená liečba imatinibom v dávke 400 mg denne s nasledujúcim pravidelným sledovaním hladín Bcr/Abl transkriptu na úrovni kvantitatívnej RT-PCR. Vedľajším účinkom bola retencia tekutín a edémy dolných končatín, ktoré vyžadovali nasadenie účinnejšieho diuretika (furosemid 40 mg/denne). Pri započatí liečby imatinibom chorý užíval: metoprolol 2x50 mg/deň, enalapril 2,5 mg/deň, furosemid 40 mg/deň a chlorid draselný 1g/deň. Po 3 mesiacoch liečby (marec 2005) bola dosiahnutá veľká cytogenetická odpoveď (MCR) – 10% Bcr/Abl transkriptu detekovanej pomocou interfázovej FISH a o 6 mesiacov (jún) pokles o 1 log v kvantitatívnej RT-PCR. Od novembra 2005 (po necelom roku liečby) bola eskalovaná dávka imatinibu na 800 mg denne z dôvodu molekulovo-genetickej progresie ochorenia (tab. 1). Výsledky kvantitatívnej RT-PCR podnietili zahájenie diagnostického algoritmu detekcie rezistencie. In vitro testy potvrdili podozrenie z rezistencie k imatinibu. Vyšetrením fosforylačného stavu Crkl proteínu v leukocytárnom lyzáte bola potvrdená prítomnosť oboch foriem Crkl, fosforylovanej aj nefosforylovanej (obr. 1) a to i pri koncentrácii 10 μM, ktorá zodpovedá 10x vyššej koncentrácii imatinibu v porovnaní s dosahovanou terapeutickou hladinou pri štandardnom dávkovaní (tj. 400 mg denne). Vzhľadom k tomu, že sa pomer fosforylovanej a nefosforylovanej formy Crkl po inkubácii leukocytov v médiu s imatinibom prakticky nezmenil, je možné predpokladať, že Bcr/Abl tyrozínová kináza je na imatinib kompletne rezistentná. Taktiež sledovaním koncentrácie WT1 génu v závislosti na vzostupnej koncentráci imatinibu (0, 1, 5 μM) bolo dokázané, že in vitro nedochádzalo k poklesu expresie génu pri narastajúcej koncentrácii imatinibu (tab. 2). Sekvenčnou analýzou úseku Abl kinázovej domény bola potvrdená mutácia T315I (obr. 2), ktorá bola overená restrikčným štiepením pomocou endonukleázy DdeI (obr. 3) rozpoznávajúcej miesto 5’...CTNAG...3’, ktoré je v prípade tejto mutácie zrušené (ACT→ATT).
Tab. 1. Vývoj v hladinách fúzneho génu Bcr/Abl v sledovanom období 2004–2006 počas liečby imatinibom. 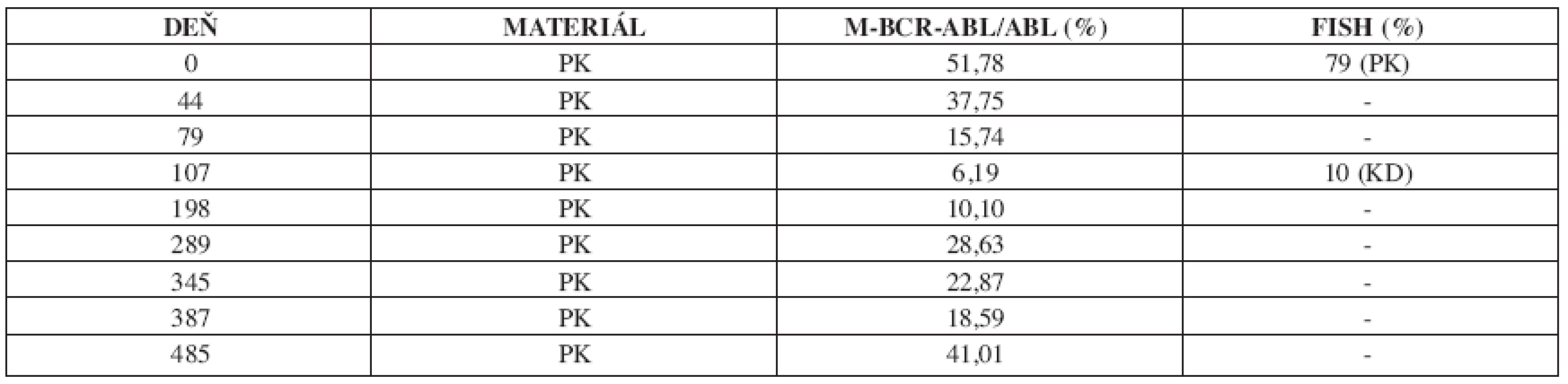
PK – periférna krv, KD – kostná dreň Obr. 1. a) negatívna kontrola b) pacient c) pozitívna kontrola 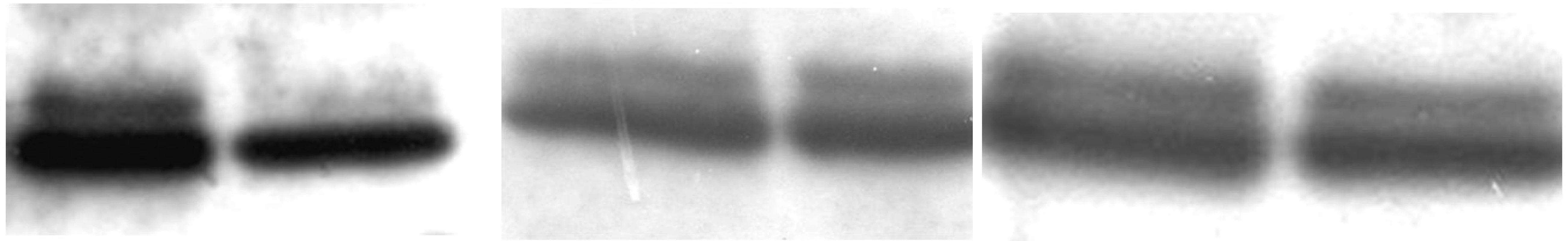
Tab. 2. Stanovenie expresného profilu génu WT1 v kultivácii leukocytov s imatinibom. 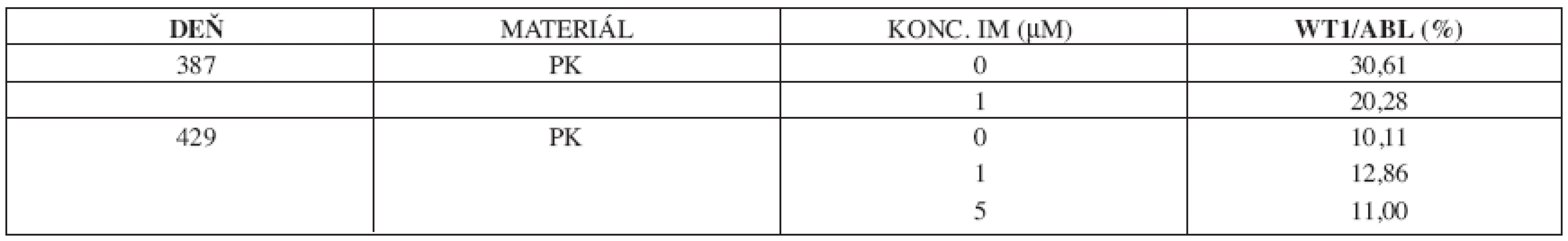
PK – periférna krv Vzhľadom na vek a komorbiditu nebolo možné indikovať alogénnu transplantáciu hemopoetických kmeňových buniek. Prítomnosť T315I mutácie vylúčila možnost podania nových inhibítorov tyrozínových kináz (dasatinib, nilotinib). U chorého bola preto zahájená paliatívna liečba perorálnou chemoterapiou (hydroxyureou).
Diskusia
Imatinib je selektívny, kompetitívny inhibítor tyrozínových kináz, ktorý získal jednoznačné miesto lieku prvej línie v liečbe dospelých pacientov s Ph1 pozitívnou CML. Po 6 rokoch žije 90 % chorých, u ktorých bola liečba zahájená vo včasnej chronickej fáze v rámci štúdie IRIS, pričom chorí s kompletnou cytogenetickou odpoveďou (pokles BCR/ABL o viac ako 3 log) majú 97 % pravdepodobnosť prežitia bez progresie (9). Žiaľ, u časti chorých vzniká k imatinibu rezistencia, ktorá môže byt primárna alebo sekundárna. Najčastejšou príčinou primárnej rezistencie je porucha v efluxných systémoch bunky podieľajúcich sa na tzv. multidrug resistance. Mutácie získané počas liečby imatinibom majú komplexnejšie príčiny – i/ amplifikácie Bcr/Abl génu, ii/ suboptimálna inhibícia chimérického proteínu Bcr/Abl a selekcia klonov s rastovou výhodou, iii/mutácie v Abl kinázovej doméne (katalytická oblasť). Mutácie sa podieľajú až na 90 % doposiaľ zaznamenaných rezistencií. (10). Pri uvažovaní o ďalších mechanizmoch rezistencie treba zohľadniť alebo vyšetriť aj ďalšie parametre: sérovú hladinu imatinibu, excesívnu hmotnosť pacienta alebo iné vplyvy na farmakokinetiku a farmakodynamiku spomínaného liečiva (8).
U pacientov v chronickej fáze CML je behom liečby nevyhnutné molekulové monitorovanie pomocou kvantitatívnej PCR. Umožňuje sledovať dynamiku zmien v hladinách fúzneho génu Bcr/Abl a zároveň veľmi presne odhadnúť obdobie vzniku rezistencie k liečbe. Pri rezistencií je možné doplniť kvantifikáciu fúzneho génu Bcr/Abl o expresný profil WT1 génu alebo analýzu fosforylačného stavu CRKL proteínu. Sú to pomocné ukazovatele pre podozrenie na vznik rezistencie k imatinibu. Gén WT1 je zaraďovaný medzi tumorsupresorové gény, je lokalizovaný v oblasti 11p13. WT1 proteín je zvýšene exprimovaný počas embryogenézy (hemopoetické tkanivo, urogenitálny systém). V jednotlivých fázach CML má odlišnú expresiu - chronická fáza – nízka expresia (0-50 kópii), akcelerovaná fáza – nárast o 1 log, blastická kríza – opätovný nárast o 1 log. Imatinib pri účinnej liečbe znižuje expresiu WT1. U pacientov s CML v kompletnej cytogenetickej remisii navodenej imatinibom bola pozorovaná znížená expresia WT1 génu (5). To predstavuje veľmi užitočný nástroj v odhade prvotnej odpovede na imatinib u pacientov s CML (11).
Crkl je adaptorová molekula, ktorá sa zúčastňuje na bunkovej signalizácii spustenej rôznymi cytokínmi a rastovými faktormi. Je konštitutívne fosforylovaná Bcr/Abl tyrozínovou kinázou v neutrofiloch pacientov s CML, v prípade zdravého jedinca k fosforylácii nedochádza. Pokiaľ je Bcr/Abl tyrozínová kináza účinne inhibovaná (napr. imatinibom) nie je fosforylovaná forma Crkl vôbec detekovaná. Definitívnym potvrdením rezistencie k imatinibu je nález mutácie v Abl kinázovej doméne (obr. 4). Za mutácie spôsobujúce rezistenciu k imatinibu sa považujú predovšetkým T315I a Y253H v oblasti imatinibového väzbového miesta (8).
Je otázkou, ako postupovať v liečbe pacientov, ktorí nie sú schopní podstúpiť alogénnu transplantáciu hemopoetických kmeňových buniek a zároveň sú nositeľmi mutácií v Abl kinázovej doméne spôsobujúcich rezistenciu k imatinibu. Alternatívnymi možnosťami môže byť podanie vyšších dávok imatinibu, kombinácia interferónu s nízkymi dávkami cytozínarabinozidu a tiež nové inhibítory tyrozínových kináz (dasatinib a nilotinib). Dasatinib je thiazolkarboxamidový derivát viažúci sa k ABL kinázovej doméne v aktívnej (open) konformácii inhibuje tiež SRC kinázovú rodinu. V preklinickom skúšaní bol tento preparát asi 300-násobne účinnejší ako imatinib. Prvé výsledky liečby sú u chorých v chronickej fáze CML s hematologickou rezistenciou alebo intoleranciou k imatinibu. Chorí s potvrdenou mutáciou T315I boli pri liečbe dasatinibom bez objektívnej odpovede (11, 12). Nilotinib je aminopyrimidínový derivát štrukturálne podobný imatinibu. Tak ako imatinib, nilotinib sa viaže k ABL kinázovej doméne v inaktívnej konformácii, ale asi 25 krát pevnejšie ako imatinib. Je účinný k väčšine mutácii v ABL kinázovej doméne, neinhibuje však rodinu SRC kináz. Skúša sa u pacientov s imatinib rezistentnouCML v akcelerovanej fáze alebo v blasickej kríze a u Ph-pozitívnychALL. Nebola zaznamenaná žiadna odpoveď u pacientov s T315I mutáciou (13–15).
Ďalšou možnosťou budú pravdepodobne liekové kombinácie. Mnohé molekuly účinkujú in vitro synergicky s imatinibom: ihibítory RAF, farnezylovej trans-ferázy,mTOR a cyklín-dependentných kináz (16). Sú v štádiu klinického testovania. Ďalší výskum je zameraný na hľadanie inhibítorov pre chimérický proteín s T315I mutáciou. Bol objavený preparát VX-680, ktorý blokuje okrem iného i formy s T315I mutáciou. V in vitro testoch ukazuje vyššiu efektivitu ako dasatinib. To, že sa táto látka vyhýba „priehlbni” v Ablkinázovej doméne a špecificky interaguje s tyrozínkinázou v aktívnej konformácii, vysvetľuje jej účinok i na mutované formy ABL (17). Vývoj nových inhibítorov tyrozínových kináz predstavuje rozšírenie spektra liečebných možností u pacientov s CML.
Záver
Predložená kazuistika s mutáciou T315I ukazuje v súčasnosti v rámci Českej republiky zriedkavo diagnostikovaný prípad chorého so získanou rezistenciou k imatinibu. Vzhľadom k narastajúcemu počtu pacientov liečených imatinibom je však zrejmé, že táto skupina chorých bude predstavovať významný terapeutický problém. V článku sú načrtnuté niektoré možnosti identifikácie mutácii a liečebné postupy smerujúce k prekonaniu rezistencie.
Podporené grantami IGA MZ ČR č. NR 7870-3, GAČR 301/04/1239 a MSM 6198959205.
MUDr. Peter Rohoň
Hemato-onkologická klinika FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: peter.rohon@centrum.cz
Poďakovanie
Rád by som poďakoval Ing. E. Otáhalovej z ÚHKT v Prahe a RNDr. M. Kalinovej a doc. J. Trkovi z KDO FN Motol v Prahe, ktorí mi výrazne pomohli pri zavádzaní metodiky kvantifikácie WT1 génu.
Došlo do redakce: 22. 9. 2006
Přijato: 15. 1. 2007
Zdroje
1. Deininger MWN, Goldman JM, Melo JV. The molecular biology of chronic myeloid leukemia, Blood 2000; 96(10): 3343–3356.
2. Deininger MWN, Druker BJ. Specific Targeted Therapy of Chronic Myelogenous Leukemia with Imatinib, Pharmacol Rev 2003; (55): 401–423.
3. Moravcová J, Brdička R. Deset let molekulárního monitorování chronické myeloidní leukémie metodou kvantitativní RT-PCR. Čas Lék čes 2005; 144 : 32–37.
4. Trka J, Kalinová M, Hrušák O, Zuna J, Krejčí O, Madžo J, Sedláček P, Vávra V, Michalová K, Jarošová M, Starý J. Czech Paediatric Haematology Working Group Real-Time Quantitative PCR detection of WT1 gene expression in children with AML: prognostic significance, correlation with disease status and residual disease detection by flow cytometry, Leukemia 2002; 16(7):1381–1389.
5. Cilloni D, Messa F, Gottardi E, Fava M, Arruga F, Defilippi I, Carturan S, Messa E, Morotti A, Giugliano A, Rege-Cambrin G, Alberti D, Baccarani M, Saglio G. Sensitivity to imatinib therapy may be predicted by testing Wilms tumor gene expression and colony growth after a short in vitro incubation, Cancer 2004; 101(5): 979–988.
6. Gabert J, Beillard E, van der Velden VHJ, Bi W, Grimwade D, Pallisgaard N, et al. Standardization and quality control studies of „real-time“ quantitative reverse transcriptase polymerase chain reaction of fusion gene transcripts for residual disease detection in leukemia – A Europe Against Cancer Program. Leukemia 2003; 17 : 2318–2357.
7. Naušová J, Priwitzerová M, Jarošová M, Indrák K, Faber E, Divoký V. Chronická myeloidní leukemie – rezistence na imatinib mesylát (Glivec®) – přehled literatury a vlastní zkušenosti.
8. Baccarani M, Saglio G, Goldman JM, et al. Evolving concepts in the management of chronic myeloid leukemia. Recommendations from an expert panel on behalf of the European LeukemiaNet. Blood 2006 May 18; [Epub ahead of print] PMID: 16709930.
9. Simonsson B. On behalf of the IRIS (International Randomized IFN vs STI571) Study Group. Beneficial effects of cytogenetic and molecular response on long-term outcome in patients with newly diagnosed chronic myeloid leukemia in chronic phase (CML-CP) treated with imatinib (IM): update from the IRIS study. Blood 2005; 106 : 166.
10. Christophe BP, Reiffers VM, Mahon FX. Roots of Clinical Resistance to STI-571 Cancer 2001; 293 : 2163.
11. Shah NP, Tran C, Lee FY, Chen P, Norris D, Sawyers CL. Overriding imatinib resistance with a novel ABL kinase inhibitor. Science 2004; (305):399–401.
12. Faber E. Dasatinib. Farmakoterapie 2006; 2 : 135–137.
13. O’Hare T, Walters DK, Stoffregen EP, et al. In vitro activity of Bcr-Abl inhibitors AMN107 and BMS-354825 against clinically relevant imatinib-resistant Abl kinase domain mutants. Cancer Res 2005; 65 : 4500–4505.
14. Weisberg E, Manley PW, Breitenstein W, et al. Characterization of AMN107, a selective inhibitor of native and mutant Bcr-Abl. Cancer Cell 2005; 7 : 129–141.
15. Kantarjian H, Ottmann O, Cortes J, et al. AMN107, a novel aminopyrimidine inhibitor of Bcr-Abl, has significant activity in imatinib-resistant bcr-abl positive chronic myeloid leukemia (CML). J Clin Oncol 2005; 16 : 195.
16. Mayerhofer M, Aichberger KJ, Florian S, Krauth M, Hauswirth A, Derdak S, Sperr W, Esterbauer H, Wagner O, Marosi CH, Pickl W, Deininger M, Weisberg E, Druker BJ, Griffin JD, Sillaber C, Valent P. Identification of mTOR as a novelbifunctional target in chronic myeloid leukemia: dissection of growth-inhibitory and VEGF-suppressive effects of rapamycin in leukemic cells, The FASEB Journal ExpressArticledoi:10.1096/fj.04-1973 fje Published online March 22, 2005.
17. Matthew A. Young, Neil P. Shah, Luke H. Chao, Markus Seeliger, Zdravko V. Milanov, William H. Biggs, III, Daniel K. Treiber, Hitesh K. Patel, Patrick P. Zarrinkar, David J. Lockhart, Charles L. Sawyers, John Kuriyan. Structure of the Kinase Domain of an Imatinib-Resistant Abl Mutant in Complex with the Aurora Kinase Inhibitor VX-680. Cancer Research 2006, 1007–1014.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2007 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Definice a klasifikace chronického onemocnění ledvin dle KDIGO
-
Všechny články tohoto čísla
- Vztah sérových hladin volných lehkých řetězců imunoglobulinu ke stupni pokročilosti mnohočetného myelomu
- Zprávy o knihách
- Porucha v regulácii chromatínu ako molekulárny mechanizmus MLL-ENL leukemogenézy
- Výsledky a komplikace splenektomie u pacientů s těžkou trombocytopenií při ITP rezistentní na úvodní konzervativní léčbu – zkušenosti centra
- Zprávy o knihách
- Od monitorovania hladiny fúzneho génu Bcr/Abl u pacienta s chronickou myeloidnou leukémiou k odhaľovaniu rezistencie k imatinibu – kazuistika
- ÚVODNÍK
- Kaposiho sarkom po alogenní transplantaci periferních krvetvorných buněk s nemyeloablativní přípravou – kazuistika
- 4. ČESKO – SLOVENSKÁ MEZIOBOROVÁ KONFERENCE LÉKAŘSKÉ MYKOLOGIE
- Doporučení Sesterské sekce České Hematologické Společnosti ČSL JEP na obsazení hematologických jednotek intenzivní péče, respektive center pro transplantace krvetvorných buněk, nelékařským personálem.
- Zprávy o knihách
- K osmdesátinám prof. MUDr. Ladislava Chrobáka, CSc.
- Novinky v terapii folikulárního lymfomu
- Dr. Adolf Georg Gadhof, Frankfurt am Main
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Výsledky a komplikace splenektomie u pacientů s těžkou trombocytopenií při ITP rezistentní na úvodní konzervativní léčbu – zkušenosti centra
- Vztah sérových hladin volných lehkých řetězců imunoglobulinu ke stupni pokročilosti mnohočetného myelomu
- Od monitorovania hladiny fúzneho génu Bcr/Abl u pacienta s chronickou myeloidnou leukémiou k odhaľovaniu rezistencie k imatinibu – kazuistika
- Novinky v terapii folikulárního lymfomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání