-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Analýza mikrobiálních nálezů z peritoneální tekutiny pacientů s perforovaným peptickým vředem – retrospektivní observační studie
Microbiological analysis of peritoneal fluid samples from patients with perforated peptic ulcer – retrospective observational study
Introduction: Peritonitis due to perforated peptic ulcer (PPU) is a surgical emergency associated with high mortality. Preoperative management includes immediate initiation of broad-spectrum antimicrobial therapy. The objective of this study was to assess the spectrum of microbial pathogens in peritoneal fluid.
Methods: Retrospective observational study of patients who underwent surgery for PPU at the 1st Department of Surgery – Thoracic, Abdominal and Injury Surgery, General University Hospital in the period 2015–2020. Analysis of the microbiological analytical results of peritoneal fluid.
Results: The microbiological profile of PPU-associated peritonitis is somewhat different from microbial pathogens involved in secondary peritonitis due to bowel perforation. A high rate of negative culture findings, high incidence of Candida spp. and low incidence of anaerobic bacteria are characteristic for PPU-associated peritonitis. Negative culture from the peritoneal fluid collected during surgery was identified in 42% of the patients. A total of 66 isolates of microbial pathogens were identified, including Candida spp. (42.5%), aerobic gram-positive bacteria (30.3%), aerobic gram-negative bacteria (22.7%) and anaerobic bacteria (4.5%). Candida albicans and Candida glabrata represented the most common species. Decreased susceptibility to fluconazole and resistance to itraconazole was associated with all Candida glabrata isolates.
Conclusion: Although PPU-associated peritonitis is mostly of community origin, we confirmed a significant incidence of Candida spp. with decreased azole susceptibility. The choice of antifungal therapy should always be based on local epidemiology.
Keywords:
antifungal susceptibility – antifungal therapy – perforated peptic ulcer – Candida spp.
Autoři: J. Ulrych 1; V. Adámková 2
; M. Hostačná 1
Působiště autorů: I. chirurgická klinika – hrudní, břišní a úrazové chirurgie, Všeobecná fakultní nemocnice a 1. lékařská fakulta Univerzity Karlovy v Praze 1; Klinická mikrobiologie a ATB centrum, Ústav lékařské biochemie a laboratorní diagnostiky, Všeobecná fakultní nemocnice, Praha 2
Vyšlo v časopise: Rozhl. Chir., 2022, roč. 101, č. 7, s. 312-317.
Kategorie: Původní práce
doi: https://doi.org/10.33699/PIS.2022.101.7.312–317Souhrn
Úvod: Peritonitida v důsledku perforace peptického vředu (PPV) je chirurgická náhlá příhoda břišní provázená vysokou letalitou. Součástí předoperačního managementu je i rychlé zahájení širokospektré antibiotické léčby. Cílem studie bylo zhodnotit mikrobiální profil u tohoto typu peritonitidy.
Metody: Retrospektivní observační studie pacientů operovaných pro PPV v období 2015–2020 na I. chirurgické klinice VFN. Analýza mikrobiálních nálezů z peritoneální tekutiny.
Výsledky: Mikrobiální profil peritonitidy v důsledku PPV se poněkud liší od sekundární peritonitidy v důsledku perforace střeva. Charakteristickými jevy jsou vysoká četnost negativních kultivačních nálezů a častý výskyt kvasinek, respektive nízký výskyt anaerobních bakterií. Negativní výsledek kultivace mělo v našem souboru 42 % pacientů. Celkem bylo identifikováno 66 izolátů mikrobiálních původců zahrnujících kvasinky (42,5 %), aerobní grampozitivní bakterie (30,3 %), aerobní gramnegativní bakterie (22,7 %) a anaerobní bakterie (4,5 %). Nejčastějšími kvasinkami byly Candida albicans a Candida glabrata. Všechny kmeny Candida glabrata měly sníženou citlivost na flukonazol a byly rezistentní na itrakonazol.
Závěr: Přestože peritonitida při PPV má většinou komunitní původ, zaznamenali jsme v našem souboru významný výskyt kvasinek se sníženou citlivostí na azolová antimykotika. Volba antimykotického přípravku by měla vždy vycházet ze znalosti aktuální epidemiologické situace.
Klíčová slova:
citlivost na antimykotika – antimykotická léčba – perforovaný peptický vřed – kvasinky
ÚVOD
Vředová choroba gastroduodenální (VCHGD) je běžné onemocnění, jejíž prevalence v populaci se odhaduje na 1,5–3 % [1]. Přestože byl v posledních 20 letech dokumentován signifikantní pokles incidence VCHGD, klinicky závažným problémem stále zůstávají komplikace VCHGD, ke kterým dochází přibližně u 10–20 % pacientů s tímto onemocněním [1,2]. Perforace peptického vředu (PPV) je sice méně častou komplikací při srovnání s krvácivými komplikacemi, zato je však tato komplikace provázena vysokou letalitou (až 20–25 %) [1,3]. Příčinou úmrtí u PPV je abdominální sepse v důsledku difuzní peritonitidy. Principem léčby pacientů s PPV je získat kontrolu nad zdrojem peritonitidy, což většinou vyžaduje urgentní chirurgickou intervenci. Předoperační management pacienta s PPV by měl zahrnovat pouze rychlou tekutinovou resuscitaci, zavedení NGS, podání inhibitorů protonové pumpy a okamžité podání antibiotik. Na základě současných doporučení jsou v rámci iniciální antibiotické léčby indikována širokospektrá antibiotika a u rizikových pacientů také antimykotika [4,6]. Tato iniciální antibiotická léčba by měla být zahájena bezprostředně po stanovení diagnózy ještě před vlastním chirurgickým výkonem a měla by vycházet ze znalosti předpokládaného mikrobiálního původce [5,6]. Následná antibiotická terapie je pak cíleně upravena podle výsledků mikrobiologického vyšetření. S ohledem na význam iniciální antibiotické léčby jsme se rozhodli provést zhodnocení mikrobiálních nálezů z peritoneální tekutiny u pacientů operovaných pro peritonitidu v důsledku PPV.
METODY
Provedli jsme retrospektivní observační studii zaměřenou na klinicko-mikrobiologickou charakteristiku pacientů operovaných pro perforovaný peptický vřed. Do souboru byli zařazeni pacienti operovaní na I. chirurgické klinice VFN v Praze pro PPV v období 1. 1. 2015 až 31. 12. 2020. Retrospektivní identifikace pacientů v nemocničním informačním systému (NIS) byla provedena na základě diagnózy (K25.1, K26.1, K66.8) a kódu operačního výkonu (51385, 51386, 51711, 90821). V souboru jsme u pacientů zhodnotili základní demografická data, jako jsou věk a pohlaví, závažné komorbidity (malignity), typ operačního výkonu a 30denní letalitu. Ve studii jsme se pak cíleně zaměřili na analýzu mikrobiálních nálezů z peritoneální tekutiny získané v průběhu operačního výkonu. V rámci předkládané publikace jsme použili zjednodušené rozdělení mikrobiálních nálezů na bakterie aerobní (bakterie rostoucí za přítomnosti kyslíku, tedy aerobní, fakultativně anaerobní a mikroaerofilní), bakterie anaerobní (bakterie, které za přítomnosti kyslíku nerostou) a kvasinky.
Vzhledem k zaměření studie je důležité uvést metodiku odběru biologického materiálu a metodiku mikrobiologického vyšetření. Peritoneální tekutina (množství 2–5 ml) byla odebrána v průběhu operace do sterilní injekční stříkačky uzavřené kombi zátkou. Takto odebraný vzorek biologické tekutiny byl bezprostředně transportován do mikrobiologické laboratoře nebo před transportem uchován při teplotě 4 °C. Materiál byl po přijetí vyšetřen mikroskopicky barvením dle Grama a byla založena aerobní kultivace (krevní agar, Uriselect4 – Bio-Rad, Francie), anaerobní kultivace (Schaedler agar – Bio-Rad, Francie) a mykologická kultivace (Sabouraud agar – Bio-Rad, Francie). Identifikace narostlých kultur byla provedena pomocí hmotnostní spektrometrie MALDI-TOF (Bruker – Německo). Citlivost na antimikrobní přípravky byla provedena a interpretována dle EUCAST.
VÝSLEDKY
Demografická data
Do studie bylo zařazeno celkem 83 pacientů operovaných pro PPV, z čehož bylo 40 žen (48,2 %) a 43 mužů (51,8 %). Průměrný věk pacientů v souboru byl 60 let (rozmezí: 26–96 let), přičemž muži byli obecně mladší (medián 49 let) než ženy (medián 71 let). Z prognosticky závažných komorbidit bezprostředně asociovaných s letalitou byla u 7 pacientů (8,4 %) přítomna generalizovaná malignita.
Operační výkon a letalita
Operační výkon byl proveden laparoskopicky u 21 pacientů (25,3 %) a klasicky u 62 pacientů (74,7 %). Laparoskopická operace byla častěji indikována u mladších pacientů (pacienti ≤50 let 14/29, 48,3 % versus pacienti ≥51 let 7/54, 12,9 %) a u mužů (muži – 16/43, 37,2 % versus ženy – 5/40, 12,5 %). Nejčastějším typem operace byla sutura vředu a omentoplastika (76×, 91,6 %), mnohem vzácněji byla provedena resekce žaludku (7×, 8,4 %). Celkem zemřelo 13 pacientů, takže 30denní letalita byla 15,7 %. Letalita pacientů s kandidovou peritonitidou byla 32,0 % (8/25).
Mikrobiologické nálezy
Z celkového počtu 83 pacientů byla odebrána peritoneální tekutina k mikrobiologickému vyšetření u 55 pacientů (66,3 %). U těchto pacientů byl ve 23 případech (41,8 %) výsledek kultivace negativní a ve 32 případech (58,2 %) výsledek kultivace pozitivní. Celkem bylo identifikováno 66 izolátů mikrobiálních původců – 35 kmenů aerobních bakterií (53,0 %), 3 kmeny anaerobních bakterií (4,5 %) a 28 izolátů kvasinek (42,5 %). Spektrum mikrobiálních nálezů je uvedeno v tabulce (Tab. 1).
Tab. 1. Kultivační nálezy bakterií a kvasinek v peritoneální tekutině
Tab. 1: Bacterial and fungal culture results from peritoneal fluid samples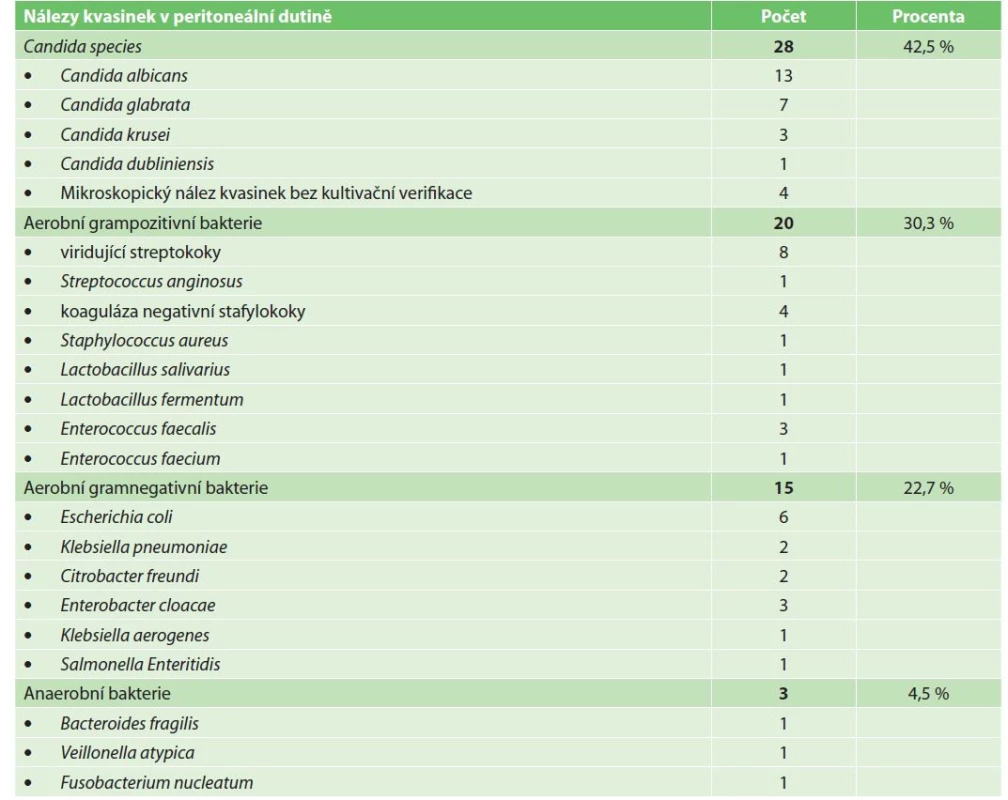
Při vyšetření citlivosti bakterií na antimikrobní přípravky nebyl v celém souboru prokázán výskyt epidemiologicky závažného multirezistentního bakteriálního patogena (bakterie produkující širokospektré betalaktamázy (ESBL), bakterie produkující karbapenemázu, vankomycin rezistentní enterokoky (VRE) apod.). Signifikantní však byl výskyt rezistence či snížené citlivosti některých kvasinek na antimykotické přípravky (Tab. 2). Všechny kmeny Candida albicans byly dobře citlivé na všechna antimykotika (azolová antimykotika i echinokandiny). Naopak všechny kmeny Candida glabrata a Candida krusei měly sníženou citlivost, respektive rezistenci k některému z azolových antimykotik (flukonazol, itrakonazol, vorikonazol). Také všechny non-albicans kmeny Candida sp. byly dobře citlivé na echinokandiny.
Tab. 2. Antimykotická citlivost/rezistence
Tab. 2: Antifungal susceptibility / resistance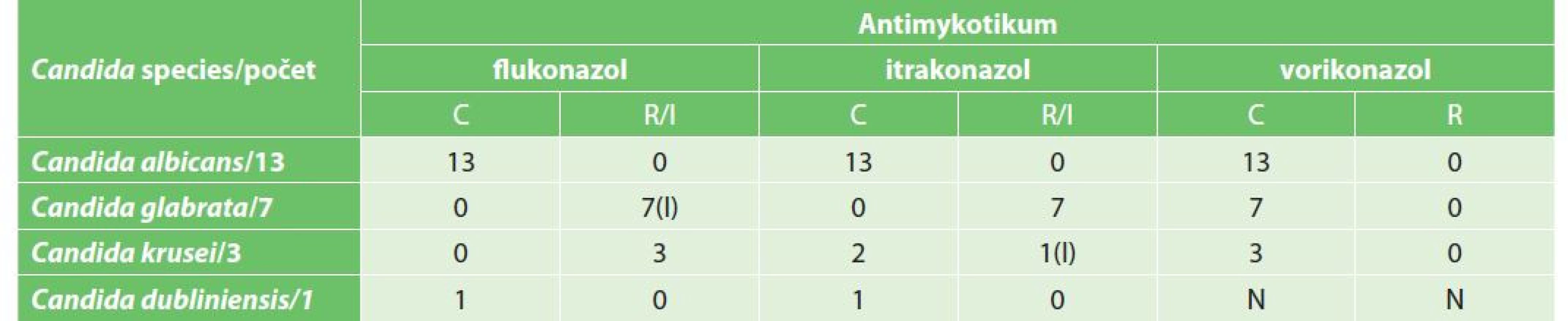
Vysvětlivky: C – citlivý; R – rezistentní; I – intermediální citlivost; N – nevyšetřeno. V průběhu sledovaného období jsme zaznamenali signifikantní změnu ve spektru izolátů kvasinek (Tab. 3). V iniciálním období 2015–2017 byla nejčastěji izolovanou kvasinkou Candida albicans (66,7 %). V následujícím období 2018–2020 byla z peritoneální tekutiny nejčastěji izolována Candida glabrata.
Tab. 3. Výskyt kvasinek ve sledovaném období 2015–2020
Tab. 3: Incidence of Candida species in the period 2015–2020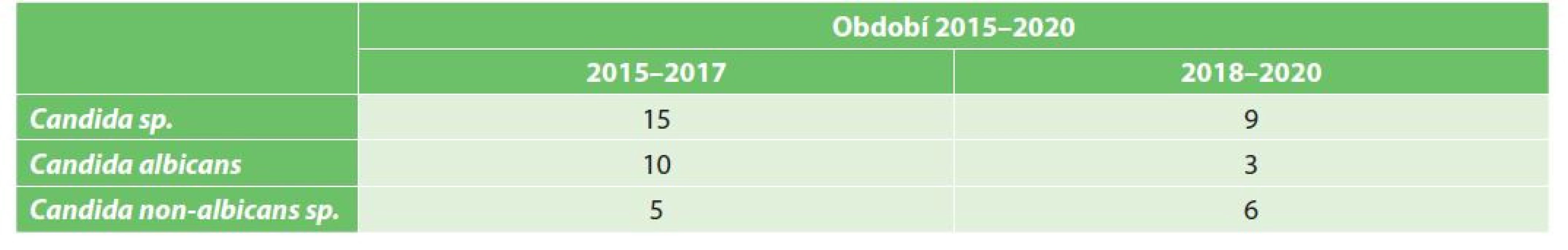
DISKUZE
Předmětem tohoto sdělení jsou mikrobiální nálezy u pacientů s peritonitidou v důsledku PPV. Tento typ sekundární peritonitidy patří mezi typické peritonitidy komunitního původu, u kterých se má za to, že jejich mikrobiální etiologie je dobře predikovatelná, s nízkým rizikem výskytu multirezistentních patogenů. Právě proto i původní guidelines pro léčbu komplikovaných nitrobřišních infekcí a peritonitid (z let 2010–2013) nedoporučovaly rutinní odběr biologického materiálu na mikrobiologické vyšetření u komunitních peritonitid [7,8]. S tímto pak koresponduje i fakt, že přibližně 1/3 pacientů v našem souboru neměla proveden odběr peritoneální tekutiny na mikrobiologické vyšetření. Současná doporučení však již zdůrazňují potřebu mikrobiologického vyšetření i u komunitních nitrobřišních infekcí, konkrétně pak u rizikových pacientů či kriticky nemocných [5,9].
Charakteristickou vlastností peritonitidy při PPV je vysoká četnost negativních kultivačních nálezů, což dokumentují i dvě recentní studie s téměř shodným výskytem negativních kultivací v 39 %, respektive 41 % [10,11]. Přitom vyšší kultivační záchyt bakterií z peritoneální tekutiny se nepodařilo dosáhnout ani v našem souboru (41,8 % negativních kultivací), a to i přesto, že jsme standardizovali a optimalizovali odběr biologického materiálu a jeho management v rámci preanalytické fáze. Vysoký podíl tzv. „sterilních“ (kultivačně negativních) nálezů při PPV je totiž důsledkem toho, že jde primárně o chemickou peritonitidu, u které dochází k mikrobiální kontaminaci až sekundárně. Výskyt kultivačně negativních nálezů je nejvyšší u pacientů operovaných do 6 hodin od začátku obtíží, s delším trváním klinické symptomatologie se zvyšuje četnost kultivačně pozitivních nálezů [11].
Dalším typickým rysem peritonitidy při PPV je její odlišný mikrobiální profil při srovnání s mikrobiálním spektrem peritonitidy v důsledku perforace v oblasti dolního GIT. Výsledky klinických studií a data z praxe ukazují, že bakterie získané z peritoneální tekutiny při PPV jsou převážné aerobního původu. Gowda, et al. ve svém souboru vyšetřili celkem 275 vzorků peritoneální tekutiny od pacientů s PPV, z čehož 51,2 % mělo pozitivní aerobní nález, pouze 6,18 % pozitivní anaerobní nález a jen 3,3 % pozitivní smíšený aerobně-anaerobní nález [10]. Nejčastěji izolovanými bakteriemi pak byly kmeny Escherichia coli (44–54 %) a Klebsiella sp. (16 – 46 %) [10,11,12]. Také naše výsledky jsou plně v korelaci s předchozím tvrzením o dominanci aerobních bakterií. U pacientů s tímto typem peritonitidy jsme kromě aerobních gramnegativních bakterií velmi často izolovali také aerobní grampozitivní bakterie. Tento fakt reflektují i recentní standardy diagnostiky a léčby PPV, které doporučují iniciální podání antibiotik s účinností na gramnegativní a grampozitivní bakterie, včetně bakterií anaerobních [4]. Výskyt anaerobních bakterií je však velmi nízký, jak ukazují i naše výsledky (4,5 %), a to i přesto, že součástí mikrobiologického vyšetření byla standardně také anaerobní kultivace. I když očekávaná, nicméně velmi potěšující je absence klinicky významných multirezistentních bakterií (ESBL+, produkující karbapenemázu, VRE – vankomycin rezistentní enterokoky) u našich pacientů s tímto typem komunitní peritonitidy.
Častý výskyt kvasinek v peritoneální tekutině u pacientů s PPV (41–70 %) je dalším charakteristickým jevem dobře dokumentovaným i v literatuře [13,14]. Současná doporučení tak podporují odběr peritoneální tekutiny k provedení mikrobiologického vyšetření zaměřeného na identifikaci nejen bakteriálního patogena, ale rutinně i na průkaz kvasinek [4]. I v našem souboru patřily kvasinky k nejčastěji izolovaným mikrobiálním patogenům vůbec. Problémem však zůstává klinický význam nálezu kvasinek v peritoneální tekutině, který není vždy jednoznačný. V současnosti bohužel nedokážeme bezpečně rozlišit mezi kontaminací či kolonizací peritoneální dutiny a opravdovou invazivní kandidovou peritonitidou. Situaci dále komplikuje i fakt, že k rozvoji invazivní kandidózy většinou dochází až za 7 až 10 dnů po expozici rizikovým faktorům [15]. Z toho pak rezultují obtíže při snaze stanovit signifikantní rizikové faktory, validně zhodnotit efekt antimykotické léčby nebo prognózu kandidové peritonitidy. V naší studii byla letalita u pacientů s pozitivním nálezem kvasinek vyšší, než byla letalita v celém souboru (32 % versus 15,7 %). Aktuálně sice existuje konsenzus na tom, že přítomnost Candida sp. v peritoneální tekutině je považována za nepříznivý rizikový faktor [16], toto tvrzení však asi neplatí obecně. Montravers, et al. např. uvádí, že izolace kvasinek se zdá být nezávislým rizikovým faktorem letality u nozokomiální peritonitidy, nikoliv však u komunitní peritonitidy [17].
Stejně jako v jiných studiích, také u našich pacientů patřily mezi nejčastěji izolované kvasinky Candida albicans a Candida glabrata. Klinicky významným jevem byla změna četnosti obou kmenů v průběhu sledovaného období, kterou jsme zaznamenali v našem souboru. V iniciálním období 2015–2017 byla nejčastěji izolovanou kvasinkou Candida albicans, zatímco v následujícím období 2018–2020 jednoznačně převládal výskyt kmenů Candida glabrata. Tento posun v mykotickém spektru kandidových peritonitid při PPV měl i svůj důležitý klinický dopad. V iniciálním období při dominantním postavení Candida albicans, která si stále zachovává vysokou citlivost na flukonazol (>98 %) a další azolová antimykotika [18], byla antimykotická léčba flukonazolem dobře účinná. Léčba flukonazolem byla neefektivní pouze u přirozeně rezistentní Candida krusei, která se však vyskytovala vzácně. V následujícím období byl zvýšený výskyt kmenů Candida glabrata provázen hrozbou selhání léčby flukonazolem. Všechny kmeny Candida glabrata totiž měly sníženou citlivost na flukonazol a byly rezistentní na itrakonazol. Podobný trend charakterizovaný vzestupem četnosti kmenů Candida glabrata se sníženou citlivostí na azolová antimykotika byl zaznamenán u invazivních abdominálních kandidóz i v recentních publikacích [19,20].
I přes velmi častý nález kvasinek v peritoneální dutině (obecně považovaný za nepříznivý rizikový faktor) je indikace podání antimykotik u pacientů s PPV stále kontroverzním tématem. Na základě aktuálně dostupných dat se totiž nepodařilo prokázat vliv antimykotik na zlepšení výsledků léčby a na prognózu pacientů s PPV, takže rutinní podání antimykotik u těchto pacientů není standardně doporučováno [21]. Dle současných mezinárodních (WSES) doporučení by antimykotická léčba u peritonitidy v důsledku PPV měla být indikována pouze u rizikových pacientů [4]. Mezi rizikové faktory pak patří imunodeficience, pokročilý věk, komorbidity, prodloužený pobyt na JIP, chirurgicky nevyřešená intraabdominální infekce. Také tuzemské doporučení diagnostiky a léčby sekundární peritonitidy preferuje selektivní podání antimykotik u komunitních nitrobřišních infekcí pouze pacientům v kritickém stavu [22]. Ukazuje se však, že do budoucna bude potřeba lépe identifikovat pacienty, kteří by mohli mít prospěch z antimykotické léčby.
ZÁVĚR
Mikrobiální nálezy z peritoneální tekutiny u pacientů s PPV mají svůj specifický profil. Vzhledem k primárně chemickému původu peritonitidy může být zpočátku kultivace negativní. Mikrobiální spektrum zahrnuje aerobní grampozitivní a gramnegativní bakterie, velmi často také kvasinky, a naopak velmi vzácně anaerobní bakterie. Mezi nejčastější původce kandidové peritonitidy patří Candida albicans a Candida glabrata. Klinicky významný je zejména výskyt Candida glabrata, která má často sníženou citlivost na azolová antimykotika. Podání antimykotik v indikovaných případech u pacientů s PPV by mělo vždy respektovat aktuální epidemiologickou situaci a výskyt rezistence na antimykotické přípravky.
Seznam zkratek:
ESBL – extended spectrum beta-lactamases (produkující širokospektré betalaktamázy)
GIT – gastrointestinální trakt
NGS – nasogastrická sonda
NIS – nemocniční informační systém
PPV – perforace peptického vředu
VCHGD – vředová choroba gastroduodenální
VRE – vankomycin rezistentní enterokoky
WSES – World Society of Emergency Surgery
Granty: Vytvořeno za podpory grantu MZ ČR – VFN64165.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
doc. MUDr. Jan Ulrych, Ph.D.
I. chirurgická klinika – hrudní, břišní a úrazové chirurgie
Všeobecná fakultní nemocnice a 1. LF Univerzity Karlovy v Praze
e-mail: Jan.Ulrych@vfn.cz
ORCID: 0000-0002-5225-9562
Zdroje
1. Chung KT, Shelat VG. Perforated peptic ulcer – an update. World J Gastrointest Surg. 2017;9(1):1–12. doi:10.4240/wjgs. v9.i1.1.
2. Xie X, Ren K, Zhou Z, et al. The global, regional and national burden of peptic ulcer disease from 1990 to 2019: a population - based study. BMC Gastroenterol. 2022;22(1):58. doi:10.1186/s12876-022 - 02130-2.
3. Weledji EP. An Overview of gastroduodenal perforation. Front Surg. 2020;7 : 573901. doi:10.3389/ fsurg.2020.573901.
4. Tarasconi A, Coccolini F, Biffl WL, et al. Perforated and bleeding peptic ulcer: WSES guidelines. World J Emerg Surg. 2020;15 : 3. doi:10.1186/s13017-019 - 0283-9.
5. Sartelli M, Chichom-Mefire A, Labricciosa FM, et al. The management of intra - abdominal infections from a global perspective: 2017 WSES guidelines for management of intra-abdominal infections. World J Emerg Surg. 2017;12 : 29. doi:10.1186/s13017-017-0141-6.
6. Sartelli M, Coccolini F, Kluger Y, et al. WSES/GAIS/SIS-E/WSIS/AAST global clinical pathways for patients with intra-abdominal infections. World J Emerg Surg. 2021;16(1):49. doi:10.1186/s13017-021 - 00387-8.
7. Solomkin JS, Mazuski JE, Bradley JS, et al. Diagnosis and management of complicated intra-abdominal infection in adults and children: guidelines by the Surgical Infection Society and the Infectious Diseases Society of America. Clin Infect Dis. 2010;50(2):133–164. doi:10.1086/649554.
8. Sartelli M, Viale P, Catena F, et al. 2013 WSES guidelines for management of intra - abdominal infections. World J Emerg Surg. 2013;8(1):3. doi:10.1186/1749 - 7922-8-3.
9. Mazuski JE, Tessier JM, May AK, et al. The Surgical Infection Society revised guidelines on the management of intra - abdominal infection. Surg Infect. (Larchmt) 2017;18(1):1–76. doi:10.1089/ sur.2016.261.
10. Gowda DB, Kadambari D, Vijayakumar C, et al. A clinico-microbiological profile in patients with perforated peptic ulcer with special reference to anaerobic organisms: a descriptive study. Int Surg J. 2017;4 : 1–6. doi:http://dx.doi.org/10.18203/2349 - 2902.isj20164301.
11. Punamiya AR, Chougule PG, Ahuja B, et al. Commonest organisms and antibiotic sensitivity in peritonitis due to duodenal ulcer perforation in Krishna Hospital, Karad. International Journal of Health Sciences and Research. 2014;4 : 93–97.
12. Ravisankar J, Venkatesan VS. A study on peritoneal fluid culture and its antibiotic sensitivity in perforative peritonitis cases. IOSR Journal of Dental and Medical Sciences.2017 : 16(03):34–37. doi:10.9790/0853-1603133437.
13. de Ruiter J, Weel J, Manusama E, et al. The epidemiology of intra-abdominal flora in critically ill patients with secondary and tertiary abdominal sepsis. Infection 2009;37(6):522–7. doi:10.1007/s15010 - 009-8249-6.
14. Jindal N, Arora S, Pathania S. Fungal culture positivity in patients with perforation peritonitis. J Clin Diagn Res. 2015;9(6):DC01–3. doi:10.7860/ JCDR/2015/13189.6050.
15. van de Veerdonk FL, Kullberg BJ, Netea MG. Pathogenesis of invasive candidiasis. Curr Opin Crit Care 2010;16 : 453e459.
16. Sartelli M, Catena F, Abu-Zidan FM, et al. Management of intra-abdominal infections: recommendations by the WSES 2016 consensus conference. World J Emerg Surg. 2017;12 : 22. doi:10.1186/ s13017-017-0132-7.
17. Montravers P, Dupont H, Gauzit R, et al. Candida as a risk factor for mortality in peritonitis. Crit Care Med. 2006;34(3):646–652. doi:10.1097/01. CCM.0000201889.39443.D2.
18. Pfaller MA, Diekema DJ, Gibbs DL, et al. Results from the ARTEMIS DISK Global Antifungal Surveillance Study, 1997 to 2007: a 10.5-year analysis of susceptibilities of candida species to fluconazole and voriconazole as determined by CLSI standardized disk diffusion. J Clin Microbiol. 2010;48(4):1366–1377.
19. Bassetti M, Vena A, Giacobbe DR, et al. Risk factors for intra-abdominal candidiasis in intensive care units: Results from EUCANDICU study. Infect Dis Ther. 2022 Feb 19. doi: 10.1007/s40121-021-00585-6.
20. Ulrych J, Adámková V, Matek J, et al. Intra - abdominal candidiasis in surgical intensive care unit – epidemiology characteristics and trends. Epidemiol Mikrobiol Imunol. 2020;69(2):57–63. English. PMID: 32819104.
21. Huston JM, Kreiner L, Ho VP, et al. Role of empiric anti-fungal therapy in the treatment of perforated peptic ulcer disease: Review of the evidence and future directions. Surg Infect (Larchmt), 2019;20(8):593–600.
22. Gürlich R, Adámková V, Ulrych J, a kol. Základní principy diagnostiky a léčby sekundární peritonitidy – doporučení odborníků s podporou SIS. Rozhl Chir. 2014;93(6):334–48,350–352.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Mikrobiologie v chirurgii
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2022 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Mikrobiologie v chirurgii
- Současná diagnostika a léčba chirurgických infekcí kůže a měkkých tkání
- Analýza mikrobiálních nálezů z peritoneální tekutiny pacientů s perforovaným peptickým vředem – retrospektivní observační studie
- Ohlédnutí za infekcemi cévních rekonstrukcí na chirurgické klinice v Plzni
- Laparoskopická sutura perforovaného peptického vředu – rutina, nebo cílený výběr pacientů?
- Benigní stenóza společného žlučovodu po Roux-Y gastrektomii
- Obří agresivní intraabdominální fibromatóza desmoidního typu kazuistika
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současná diagnostika a léčba chirurgických infekcí kůže a měkkých tkání
- Obří agresivní intraabdominální fibromatóza desmoidního typu kazuistika
- Laparoskopická sutura perforovaného peptického vředu – rutina, nebo cílený výběr pacientů?
- Benigní stenóza společného žlučovodu po Roux-Y gastrektomii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



