-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Ohlédnutí za infekcemi cévních rekonstrukcí na chirurgické klinice v Plzni
Infections associated with vascular reconstruction procedures at the Department of Surgery in Pilsen in retrospect
Introduction: Vascular graft infection is a rare but serious complication in vascular surgery, associated with high morbidity and mortality. Early diagnosis of vascular graft infection is important for proper and timely surgical and antibiotic treatment that improves the outcome. The tactic and techniques of surgical treatment of vascular graft infection have changed over the last two decades, and this trend can also be observed in our retrospective study.
Methods: We evaluated a group of patients with prosthetic vascular reconstructions performed at the Department of Surgery, University Hospital in Pilsen in the period of 2003–2021 using retrospective analysis. In the analyzed 19-year period, 23 infected vascular grafts were managed out of a total of 2090 performed peripheral bypasses, and 27 infected vascular grafts were managed out of a total set of 1940 central reconstructions.
Results: The incidence of peripheral vascular graft infections at our Department of Surgery in the period of 2003–2021 reached 1.1% with the early mortality rate of 8.7%; 1.4% central vascular graft infections occurred in the same time period with 33% early mortality.
Conclusion: The results of our retrospective study are comparable virtually in all parameters with the experience of other departments. Consistently, our department switched to in situ replacements for explanted vascular grafts and we can confirm good experience with silver impregnated grafts.
Keywords:
vascular graft infection – silver impregnated graft – arterial allograft
Autoři: B. Čertík; V. Třeška; J. Moláček; R. Šulc; K. Houdek; V. Opatrný
Působiště autorů: Chirurgická klinika Fakultní nemocnice Plzeň a Lékařská fakulta Univerzity Karlovy v Plzni
Vyšlo v časopise: Rozhl. Chir., 2022, roč. 101, č. 7, s. 318-325.
Kategorie: Původní práce
doi: https://doi.org/10.33699/PIS.2022.101.7.318–325Souhrn
Úvod: Infekce cévních rekonstrukcí je vzácná, ale závažná komplikace v cévní chirurgii, spojená s vysokou morbiditou a mortalitou. Včasná diagnostika infekce cévní rekonstrukce je důležitá pro správnou a včasnou chirurgickou a antibiotickou léčbu, která zlepšuje výsledek. Taktika a technika operačního řešení infekcí cévních rekonstrukcí se za poslední dvě dekády změnily a tento trend lze pozorovat i v naší retrospektivní studii.
Metody: Retrospektivní analýzou jsme vyhodnotili skupinu nemocných s protetickými cévními rekonstrukcemi založenými na chirurgické klinice FN v Plzni v období 2003–2021. V analyzovaném 19letém období jsme z celkového souboru 2090 založených periferních bypassů řešili 23 infikovaných cévních rekonstrukcí a z celkového souboru 1940 centrálních rekonstrukcí na břišní aortě a v pánevním řečišti řešili 27 infikovaných rekonstrukcí.
Výsledky: Incidence infekcí periferních cévních rekonstrukcí v období 2003–2021 na našem pracovišti dosáhla 1,1 % s časnou mortalitou 8,7 % a centrálních cévních rekonstrukcí za stejné časové období 1,4 % s časnou mortalitou 33 %.
Závěr: Výsledky naší retrospektivní studie jsou srovnatelné se zkušenostmi jiných pracovišť prakticky ve všech parametrech. Shodně naše pracoviště přešlo na in situ náhrady explantovaných rekonstrukcí a potvrzujeme dobrou zkušenost se stříbrem impregnovanými protézami.
Klíčová slova:
infekce cévní rekonstrukce – stříbrem impregnovaná protéza – tepenný allograft
ÚVOD
Infekce cévních rekonstrukcí je vzácná, ale závažná komplikace v cévní chirurgii, spojená s vysokou morbiditou a mortalitou. Vyskytuje se u 1 % až 6 % pacientů po periferních cévních rekonstrukcích a u 0,5 % až 4 % pacientů s rekonstrukcí aorty a pánevního řečiště. Mortalita dosahuje v závislosti na lokalizaci cévní rekonstrukce a především projevech infekce cévní protézy až 40 %.
Nejčastějšími původci jsou Staphylococcus aureus a Staphylococcus epidermidis. K bakteriální kontaminaci cévních rekonstrukcí dochází perioperačně při nedodržení zásad asepse. Rizikovou lokalitou jsou především třísla, kontaminaci zvyšuje přítomnost zánětlivého ložiska na končetině, urgentní a časově náročné výkony s prolongovanou ischemií tkání (infekce hematomů, ischemie tračníku), reoperace cévních rekonstrukcí a poranění lymfatických cest se vznikem lymfokél. Riziko infekce se zvyšuje u simultánních výkonů na trávicím traktu, zdrojem může být i primární infekce stěny aorty. Hlavním zdrojem pooperační kontaminace cévních rekonstrukcí jsou sekundární ranné infekce, nejčastěji jako infikované lymfokély v tříslech. K bakteriální kontaminaci však dochází i u dlouhodobě již vhojených cévních protéz cestou hematogenní (bakteriemie při septických onemocněních, chirurgické či diagnostické výkony spojené s vyplavením bakterií do krevního oběhu, např. extrakce zubu, cystoskopie…) nebo cestou lymfogenní (zánětlivé afekce ve spádové oblasti, např. erysipel). Náchylnější k infekci cévních rekonstrukcí jsou nemocní s nedostatečnou výživou, diabetici a imunosuprimovaní.
Podle časového intervalu od založení rekonstrukce rozlišujeme časné infekce cévních protéz, které se manifestují do čtyř měsíců, většinou jako závažné infekční komplikace (peri-protetické abscesy, infiltráty, sepse, krvácení) a pozdní infekce cévních protéz, které mohou být dlouhodobě klinicky němé (neurčité bolesti břicha, celková malátnost, chronické píštěle, pseudovýdutě, teploty, elevace zánětlivých markerů). Spektrum klinických projevů infekce je ovlivněno virulencí infekčního agens. Život nemocného je ohrožen jednak sepsí a u průchodných rekonstrukcí navíc masivním krvácením při rozvolnění cévní anastomózy [1,2,3].
Včasná diagnostika infekce cévní rekonstrukce je důležitá pro správnou a včasnou chirurgickou a antibiotickou léčbu, která zlepšuje výsledek. Naproti tomu zbytečná operace u neinfikovaných cévních rekonstrukcí může být i smrtelná. Radikálním řešením těchto stavů byla vždy snaha odstranit infikovanou cévní protézu a revaskularizaci končetin zajistit rekonstrukcí nejlépe mimo původní infikované operační pole. Taktika a technika operačního řešení infekcí cévních rekonstrukcí se za poslední dvě dekády změnily a tento trend lze pozorovat i v naší retrospektivní studii.
Cílem naší práce bylo retrospektivní analýzou stanovit výskyt infekcí periferních cévních rekonstrukcí a centrálních cévních rekonstrukcí u nemocných s protetickými cévními rekonstrukcemi založenými na chirurgické klinice FN v Plzni v období 2003–2021. Rozborem řešení infikovaných cévních rekonstrukcí, zhodnocením úspěšnosti a časné mortality se podělit o zkušenosti z našeho pracoviště.
METODY
Retrospektivní analýzou jsme vyhodnotili skupinu nemocných s protetickými cévními rekonstrukcemi založenými na chirurgické klinice FN v Plzni v období 2003–2021. Infekci cévní rekonstrukce jsme diagnostikovali na základě klinického nálezu (hnisavé píštěle, bolestivé infiltráty, přítomnost pseudovýdutí, krvácení, teploty nemocného, elevace zánětlivých parametrů…), bakteriologického vyšetření z okolí protézy včetně hemokultur a grafického nálezu především na angiografii výpočetní tomografií (CTAg) jako kolekce tekutiny a plynu v okolí cévní rekonstrukce. V nejasných případech jsme k potvrzení zánětlivé aktivity v průběhu cévní protézy využili pozitronové emisní výpočetní tomografie (PET/CT).
VÝSLEDKY
V analyzovaném 19letém období jsme z celkového souboru 2090 založených periferních bypassů s použitím pletené či polytetrafluoretylenové protézy řešili 23 infikovaných cévních rekonstrukcí u nemocných průměrného věku 64,6 roku (54–78 let). V 18 případech se jednalo o infekci femoropopliteálních (FP) bypassů, ve 3 případech femorofemorálních (FF) bypassů a ve 2 případech axilofemorálních (AxF) bypassů (Graf 1).
Graf 1. Incidence infekcí periferních cévních rekonstrukcí v období 2003–2021
Graph 1: The incidence of peripheral vascular graft infections in the period 2003–2021
Z celkového počtu prokázaných periferních cévních infekcí se v 5 případech jednalo o časné infekce do 4 měsíců od založení rekonstrukce, v ostatních 18 případech o infekce pozdní (v rozmezí 1 roku až 10 let od založení rekonstrukce).
Bakteriologické vyšetření prokázalo nejčastěji stafylokokovou infekci (9x Staphylococcus epidermidis, 6x Staphylococcus aureus), 2x Streptococcus agalactia a 2x smíšenou infekci Enterococcus faecalis a Pseudomonas aeruginosa. Ve 4 případech bylo bakteriologické vyšetření negativní.
Podobně jsme v analyzovaném 19letém období z celkového souboru 1940 centrálních rekonstrukcí na břišní aortě a pánevním řečišti řešili 27 infikovaných rekonstrukcí u nemocných průměrného věku 65,7 roku (52–80 let). Ve 21 případech se jednalo o aortobifemorální (ABF) rekonstrukci, v 5 případech o jednostranný ilikofemorální (IF) bypass a v 1 případě o aortoaortální (AA) náhradu (Graf 2).
Graf 2. Incidence infekcí centrálních cévních rekonstrukcí v období 2003–2021
Graph 2: The incidence of central vascular graft infections in the period 2003–2021
Pouze v případě AA náhrady se jednalo o časnou infekci náhrady po rupturované břišní výduti, v ostatních případech o infekce pozdní (v rozmezí 1 roku až 12 let od založení rekonstrukce). V 7 případech po ABF rekonstrukci jsme prokázali aortoduodenální píštěl s krvácením do trávicí trubice a nutností urgentního výkonu. V 15 případech byla prokázána stafylokoková infekce (8x Staphylococcus epidermidis, 7x Staphylococcus aureus). Ve 4 případech šlo o smíšenou flóru (Enterococcus faecalis, Enterobacter cloacae, Corynebacterium species, Pseudomonas aeruginosa). Ve zbylých 8 případech nebyla bakteriologie pozitivní.
Rozbor řešení infekcí periferních cévních rekonstrukcí
U infekcí FP bypassů jsme v 16 případech protézu explantovali. Následně jsme revaskularizaci končetiny řešili v 5 případech žilním bypassem, ve 4 případech silvergraftem – stříbrem impregnovaná protéza (v jednom případě pro uzávěr rekonstrukce byla nezbytná konverze na žilní bypass z druhostranné končetiny) a v 1 případě jsme využili čerstvý žilní allograft. V 6 případech jsme po explantaci infikované protézy uzavřeli společnou femorální tepnu žilním patchem se zachováním průtoku do profundální tepny. U jednoho nemocného z této skupiny byla následně nevyhnutelná vysoká amputace ve stehně a jeden nemocný zemřel na komplikace sepse – multiorgánové selhání s krvácením do trávicí trubice.
Ve 2 případech jsme úspěšně řešili infekci FP bypassu otevřenou drenáží bez explantace protézy.
Infikované FF rekonstrukce jsme ve 2 případech explantovali a revaskularizaci příslušné končetiny řešili obturatorním bypassem s použitím silvergraftu. Ve třetím případě se jednalo o 78letou ženu po opakovaných excizích malignity vulvy s infekcí ran, u které jsme explantovali FF bypass bez možnosti revaskularizace končetiny. Nemocná zemřela po vysoké amputaci ve stehně. Infikované AxF bypassy jsme explantovali a revaskularizaci příslušné končetiny řešili FF bypassem s využitím silvergraftu.
Ze souboru infekcí periferních cévních rekonstrukcí byla následně nevyhnutelná vysoká končetinová amputace ve 2 případech a zemřeli celkem dva nemocní. Z retrospektivní analýzy vyplývá, že výskyt infekcí periferních cévních rekonstrukcí v období 2003–2021 na našem pracovišti je 1,1 % s časnou mortalitou 8,7 % (2 nemocní) (Tab. 1).
Tab. 1. Řešení infekcí periferních cévních rekonstrukcí
Tab. 1: Management of peripheral vascular graft infections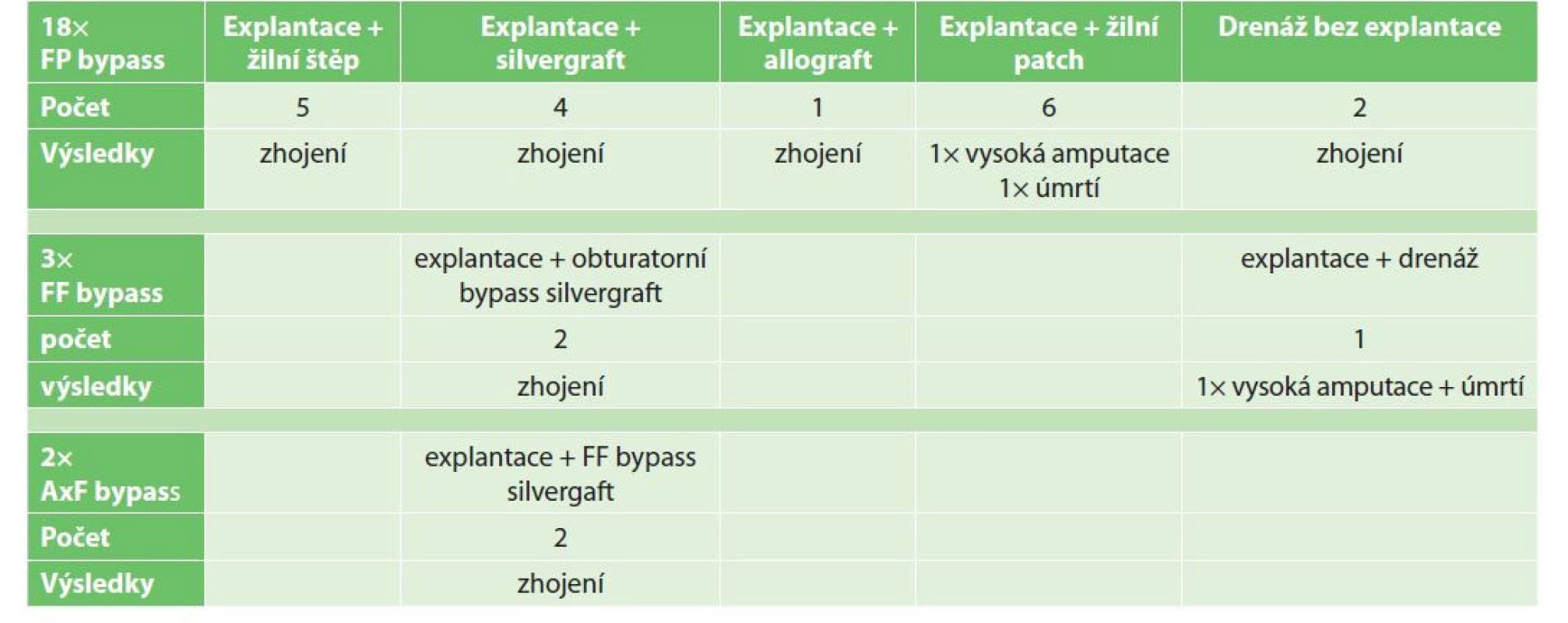
Rozbor řešení infekcí centrálních cévních rekonstrukcí
U infekcí bifurkačních rekonstrukcí jsme v 18 případech protézu kompletně explantovali. Revaskularizaci dolních končetin jsme řešili v 5 případech extraanatomicky AxBF bypassem (v jednom případě jako výkon dvoudobý – v první době založení AxBF bypassu a ve druhé době explantace ABF). Jeden nemocný po AxBF rekonstrukci zemřel po následné resekci ischemického tračníku.
V 7 případech jsme revaskularizovali dolní končetiny in situ ABF rekonstrukcí s použitím silvergraftu a v 6 případech, kdy nebyla urgence operačního výkonu, jsme využili k ABF rekonstrukci čerstvého allograftu. V jediném případě ABF rekonstrukce, kdy se jednalo o aortoduodenální píštěl s pokročilou infekcí a rozsáhlými nekrózami v retroperitoneu u resuscitovaného nemocného, jsme pouze zabránili vykrvácení nemocného explantací protézy bez revaskularizace a nemocný zemřel na septický šok.
Ve 2 případech ABF rekonstrukcí s lokalizací infekce pouze v tříslech jsme lokálně excidovali zánětlivě infiltrovanou tkáň s raménkem a interponovali silvergraftem.
U jednostranných IF bypassů jsme infikovanou protézu explantovali celou a revaskularizaci řešili ve 3 případech ABF rekonstrukcí s použitím silvergraftu a jednou s použitím tepenného allograftu. V 1 případě jsme revaskularizaci zajistili FF bypassem, který se po roce uzavřel pravděpodobně při reinfekci. Po explantaci bypassu jsme končetinu amputovali ve stehně.
V případě infekce AA náhrady u nemocného po ruptuře břišní výdutě se jednalo o časnou smíšenou infekci. Celkový stav nemocného byl vážný s multiorgánovou dysfunkcí a radikální výkon nebyl možný. Pokusili jsme se o drenážní výkon s laváží, který nebyl úspěšný, a nemocný zemřel na septické komplikace.
V analyzovaném souboru je celkem 7 případů aortoduodenálních píštělí, které byly řešeny explantací protézy a vždy suturou duodena, bez nutnosti resekčního výkonu na střevě. Ve 4 případech byla revaskularizace končetin řešena AxBF rekonstrukcí a ve 2 případech ABF rekonstrukcí s použitím silvergraftu. Ze skupiny nemocných s AxBF rekonstrukcí následně zemřeli 2 nemocní (1× multiorgánové selhání a 1× recidiva krvácení při insuficienci pahýlu aorty).
Ze skupiny nemocných s revaskularizací končetin in situ ABF rekonstrukcí s použitím silvergraftu zemřel jeden nemocný na multiorgánové selhání a u jednoho nemocného pro opakované krvácení z třísla jsme resekovali nožičku silvergraftu a nahradili ji žilním interponátem.
Ze skupiny 6 nemocných s čerstvým allograftem zemřela jedna žena v důsledku rozsáhlé střevní ischemie. Druhá žena, která byla přijata pro krvácení měsíc od implantace čerstvého allograftu, zemřela po konverzi na silvergraft na multiorgánové selhání. Podobně zemřel jeden muž na rupturu čerstvého allograftu po dvou týdnech od implantace. V tomto případě se jednalo primárně o náhradu salmonelové výdutě silvergraftem, u kterého se reinfekce projevila po 6 letech.
Z celého souboru infekcí centrálních rekonstrukcí byla nevyhnutelná jedna vysoká končetinová amputace a zemřelo celkem 9 nemocných. Z retrospektivní analýzy vyplývá, že výskyt infekcí centrálních cévních rekonstrukcí v období 2003–2021 na našem pracovišti je 1,4 % s časnou mortalitou 33 % (9 nemocných) (Tab. 2).
Tab. 2. Řešení infekcí centrálních cévních rekonstrukcí
Tab. 2: Management of central vascular graft infections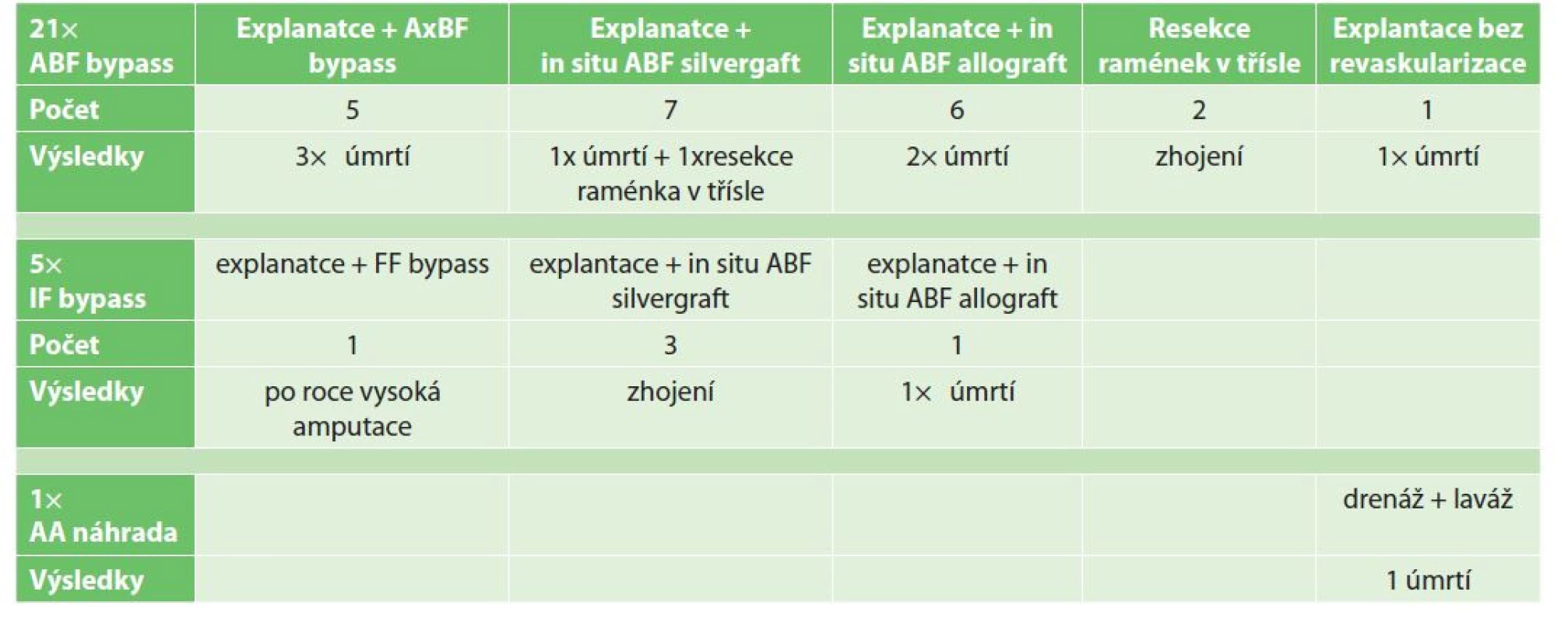
DISKUZE
Diagnostika a léčba infekcí cévních rekonstrukcí se řídí klinickým stavem pacienta, typem a rozsahem infekce. S ohledem na hloubku zánětlivé komplikace v ráně a vztahu k cévní protéze lze využít klasifikaci dle Szilagyiho nebo Samsona a s ohledem na rozsah postižení cévní protézy Buntovu klasifikaci. Je důležité rozlišení, zda se jedná o infekci protézy uložené extra či intrakavitárně (respektive periferní či centrální rekonstrukci) (Tab. 3).
Tab. 3. Klasifikace infekcí cévních rekonstrukcí s ohledem na hloubku zánětlivé komplikace v ráně a vztahu k cévní protéze (dle Szilagyiho a Samsona) a s ohledem na rozsah postižení cévní protézy (dle Bunta)
Tab. 3: Classification of vascular graft infections with respect to the depth of the inflammatory complication in the wound and relationship to the vascular graft (according to Szilagyi and Samson) and with respect to the extent of graft involvement (according to Bunt)
Zdroj/Source: European Society for Vascular Surgery (ESVS) 2020 Clinical Practice Guidelines on the Management of Vascular Graft and Endograft Infections. K překonání nedostatků jednotlivých klasifikací sestavila skupina Management of Aortic Graft Infection (MAGIC) v rámci ESVS 2020 seznam hlavních a vedlejších kritérií s ohledem na klinické, chirurgické, radiologické a laboratorní nálezy. Podle MAGIC klasifikace je diagnóza infekce cévní protézy potvrzena, pokud existuje alespoň jedno hlavní kritérium a jakékoli jiné kritérium z jiné kategorie (Tab. 4).
Tab. 4. Klasifikace MAGIC
Tab. 4: The MAGIC classification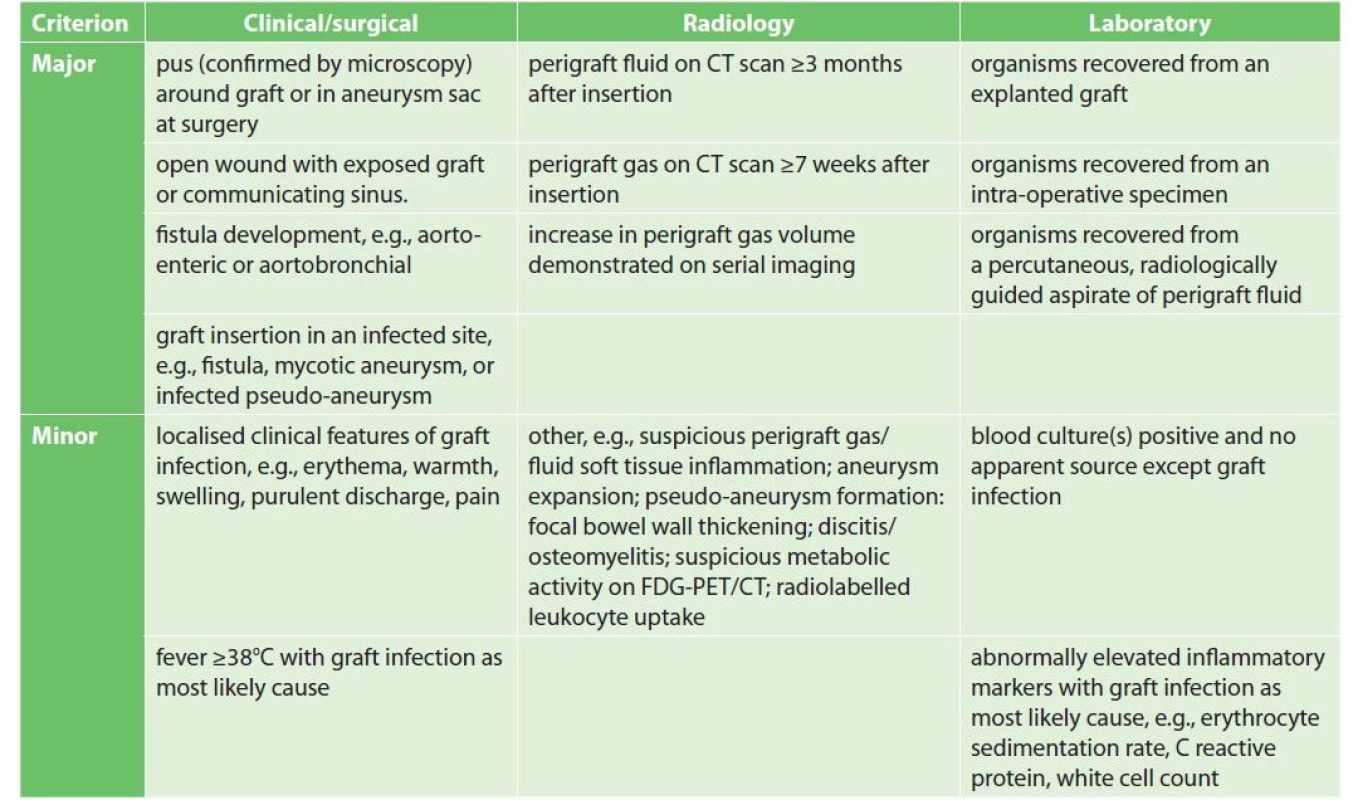
Vysvětlivky/Legend: CT – computed tomography; FDG-PET/CT – 18F-fluoro-D-deoxyglucose positron emission tomography/computed tomography. Klinický význam rozlišení mezi časnými a pozdními infekcemi je spíše otázkou hledání zdroje infekce, nikoliv způsobu jejich řešení. V horizontu 4 měsíců, kdy není protéza dostatečně vhojena, je zvýšené riziko její infekce především cestou komplikovaně se hojících ran. Při včasné lokální chirurgické a antibiotické léčbě lze v některých případech zamezit přestupu infekce na cévní protézu a dosáhnout zhojení bez nutnosti explantace cévní protézy. Naproti tomu pozdní infekce mohou být zákeřné (neurčité bolesti břicha, celková malátnost, zvýšené teploty…). U klinicky podezřelých infekcí intrakavitárních s nespecifickými příznaky bez možnosti získání materiálu k bakteriologickému vyšetření a s negativními výsledky hemokultur je poslední možností PET/CT vyšetření [3]. Při pozitivním PET/CT nálezu aktivity v okolí cévní protézy při klinicky němém průběhu lze i v těchto případech dlouhodobou antibiotickou léčbou odvrátit nutnost explantace cévní protézy. Nutné je však dlouhodobé sledování.
V ostatních případech prokázané infekce cévní rekonstrukce je nezbytné infikovanou protézu explantovat a zajistit revaskularizaci novou rekonstrukcí. U periferních cévních rekonstrukcí, kde lze využít kolateralizaci přes hlubokou stehenní tepnu, je nejjednodušším řešením žilní patch.
U centrálních rekonstrukcí, kdy je infekce lokalizovaná pouze v třísle, lze paliativně resekovat pouze tuto nevhojenou část a nahradit ji žilním štěpem nebo silvergraftem. Tento postup po zhojení považujeme za definitivní s ohledem na věk a komorbidity nemocného. V ostatních případech infekcí centrálních rekonstrukcí je nutné explantovat celou cévní protézu. Chirurgické výkony provádíme urgentně v případech krvácení z cévní anastomózy a akutně u symptomatických pseudovýdutí nebo u akutní končetinové ischemie při uzávěru infikované cévní rekonstrukce. V ostatních případech, kdy není riziko krvácení či uzávěru infikované cévní rekonstrukce, lze v první době provést drenážní výkon k detoxikaci nemocného a připravit se k časnému definitivnímu řešení. V posledních desetiletích je patrný odklon od extraanatomické revaskularice dolních končetin AxBF bypassem se slepým uzávěrem aorty. Na naší klinice byl v této indikaci naposledy založen AxBF bypass v roce 2005. Nevýhodou AxBF rekonstrukce je dlouhý operační zákrok, který lze v některých případech rozložit do dvou operačních výkonů. Následně však zůstává riziko krvácení ze slepého pahýlu aorty a koneckonců AxBF rekonstrukce nebyla vždy zakládána zcela mimo infikované pole, protože oblast třísel jako nejrizikovější z hlediska infekce nebyla novou rekonstrukcí překlenuta.
Namísto extraanatomické revaskularizace se osvědčilo zakládání in situ rekonstrukcí s použitím silvergraftu, allograftu nebo autologním materiálem. U urgentních a akutních výkonů je výběr náhrady omezen, pokud nemá pracoviště tkáňovou banku s kryoprezervovanými štěpy. Na našem pracovišti používáme silvergraft, se kterým máme dobré zkušenosti. Stříbrem impregnovanou protézu používáme nejen v indikaci řešení infekcí cévních rekonstrukcí, ale i v případech, kdy hrozí infekce primárně zakládané cévní rekonstrukce [4,5,6].
V případech, kdy lze definitivní chirurgický výkon naplánovat, lze využít tepenný allograft, který má nižší riziko reinfekce oproti impregnovaným protézám. Nicméně i allograft má svá rizika. V případě časné nekrózy allograftu je nemocný ohrožen rupturou a krvácením. V důsledku pozdních strukturálních změn ve stěně allograftu může docházet následně k uzávěrům či tvorbě výdutí v průběhu allograftu, které je nutné řešit endovaskulárně či novou rekonstrukcí. Z hlediska možných pozdních komplikací byla dávána přednost allograftům čerstvým před kryoprezervovanými [7].
Zlepšením techniky odběrů a především konzervace tepenných alloštěpů se výrazně zlepšily mechanické vlastnosti stěny štěpů a snížila se jejich imunogenicita. Experimentálně bylo prokázáno, že kryoprezervace chrání před časnými i pozdními imunitně zprostředkovanými degenerativními změnami tepenného štěpu [8,9,10,11,12].
Na našem pracovišti máme zkušenost pouze s čerstvými allografty. Také v našem souboru čerstvých allograftů došlo ve dvou případech k časné ruptuře štěpu, kdy byla stěna allograftu zcela destruovaná. V obou případech se jednalo o infekci smíšenou flórou s přítomností i střevních bakterií. K destrukci stěny allograftu došlo pravděpodobně v důsledku reinfekce než rejekce, protože nemocným podáváme imunosupresivní léčbu.
Poslední možnost in situ rekonstrukce složené z vlastních žil nemocného jsme na našem pracovišti nepoužili. Přestože jsou pracoviště, která mají dobrou zkušenost s autologní in situ náhradou, jedná se o rozsáhlý operační výkon s možnými komplikacemi (ruptury štěpů, závažná žilní insuficience dolních končetin s nutností fasciotomií) [13,14,15].
ZÁVĚR
Výsledky naší retrospektivní studie jsou srovnatelné se zkušenostmi jiných pracovišť prakticky ve všech parametrech. Výskyt infekcí cévních rekonstrukcí okolo 1 %, nejčastějším patogenem je Staphylococcus, větší procento infekcí je pozdních. Pravdou je, že ve studii nejsou započítané časné ranné komplikace (lymfokély s pozitivní bakteriologií), které se podařilo zvládnout lokální a cílenou antibiotickou léčbou bez přestupu infekce na cévní protézu. Výsledná časná mortalita u řešení periferních cévních rekonstrukcí je 8,7 % a u centrálních cévních rekonstrukcí je 33 %.
Infekcím cévních rekonstrukcí se snažíme také předcházet použitím silvergraftu v případech, kdy je zvýšené riziko infekce primárně zakládané rekonstrukce. Naše pracoviště přešlo na in situ náhrady explantovaných rekonstrukcí a potvrzujeme dobrou zkušenost se stříbrem impregnovanými protézami. Máme zkušenost také s čerstvými allografty, ale ve světle nových studií se do budoucna jeví slibnou alternativou využití allograftů kryoprezervovaných.
Všechny naše operované pacienty pravidelně sledujeme v cévní poradně. Připustíme-li, že na vzniku aortoduodenální píštěle po výkonech na aortě má hlavní podíl technická chyba při primárním výkonu, potom stojí za zmínku, že v této retrospektivní studii za období 2003–2021 jsme naposledy řešili aortoduodenální píštěl před 10 lety (Obr. 1, 2, 3).
Obr. 1. Perioperační nález aortoduodenální píštěle
Fig. 1: Perioperative finding of an aortoduodenal fistula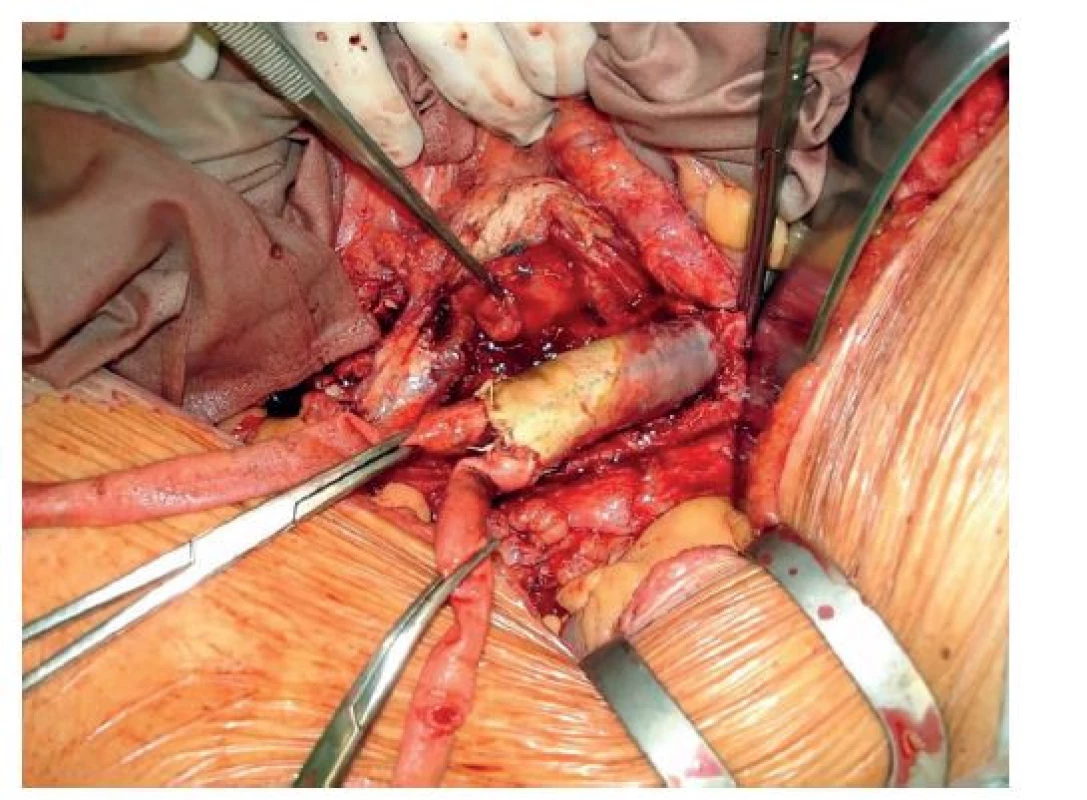
Obr. 2. Slepý uzávěr subrenální aorty a sutura duodena
Fig. 2: Blind closure of the subrenal aorta and suture of the duodenum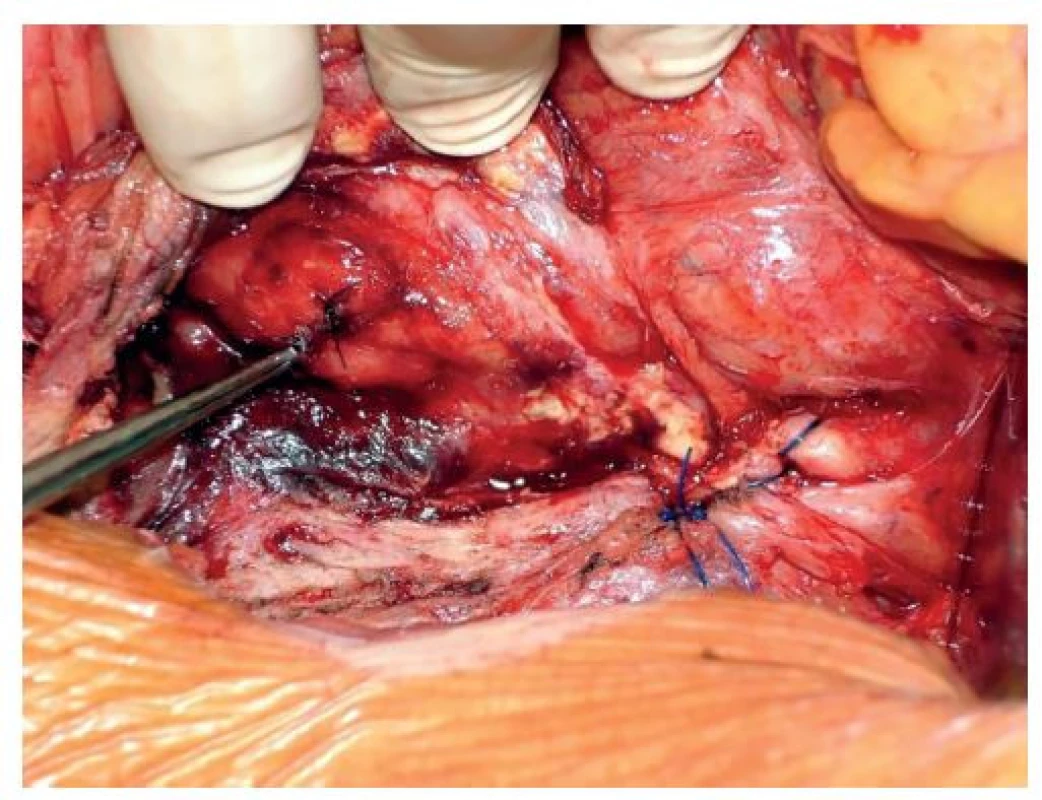
Obr. 3. Čerstvý tepenný allograft
Fig. 3: Fresh arterial allograft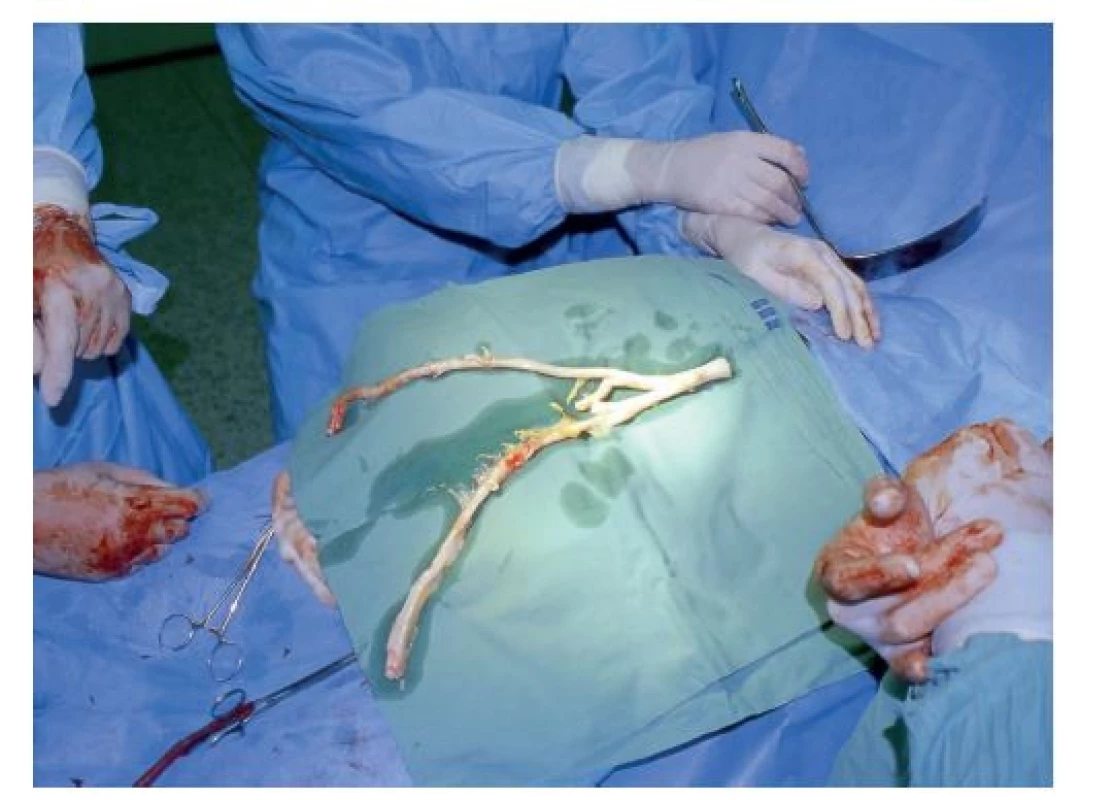
Seznam zkratek:
CTAg – angiografie výpočetní tomografií
PET/CT – pozitronová emisní výpočetní tomografie
FP – femoropoliteální rekonstrukce
FF – femorofemorální rekonstrukce
AxF – axilofemorální rekonstrukce
ABF – aortobifemorální rekonstrukce
IF – ilikofemorální rekonstrukce
AA – aortoaortální náhrada
ESVS – European Society for Vascular Surgery
Podpořeno grantem AZV NU20-02-00368.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
doc. MUDr. Bohuslav Čertík, Ph.D.
Valcha E1713 Plzeň 301 00
e-mail: certik@fnplzen.cz
Zdroje
1. Lyons OTA, Baguneid M, Barwick TD, et al. Diagnosis of aortic graft infection: A case definition by the management of aortic graft infection collaboration (MAGIC). Eur J Vasc Endovasc Surg. 2016 Dec;52(6):758−763 doi.org/10.1016/j.ejvs.2016.09.007.
2. Chakfé N, Diener H, Lejay A. European Society for Vascular Surgery (ESVS) 2020 Clinical practice guidelines on the management of vascular graft and endograft infections. Eur J Vasc Endovasc Surg. 2020 Mar;59(3):339−384. doi:10.1016/j. ejvs.2019.10.016.
3. Folmer EIR, von Meijenfeldt GCI, Scholten RS, et al. A systematic review and meta-analysis of 18 F-fluoro-d-deoxyglucose positron emission tomography interpretation methods in vascular graft and endograft infection. J Vasc Surg. 2020 Dec;72(6):2174−2185. doi:10.1016/j.jvs. 2020.05.06.
4. Bisdas T, Wilhelmi M, Haverich A, et al. Cryopreserved arterial homografts vs silver-coated Dacron grafts for abdominal aortic infections with intraoperative evidence of microorganisms. J Vasc Surg. 2011 May;53(5):1274−1281. doi:10.1016/j.jvs.2010.11.052.
5. Pupka A, Skora J, Janczak D, et al. In situ revascularisation with silver-coated polyester prostheses and arterial homografts in patients with aortic graft infection – a prospective, comparative, single-centre study. Eur J Vasc Endovasc Surg. 2011 Jan;41(1):61−67. doi:10.1016/j.ejvs.2010.10.005.
6. Molacek J, Treska V, Houdek K, et al. Use of a silver-impregnated vascular graft: Single-center experience. Antibiotics 2022 Mar;11(3):386. doi:10.3390/antibiotics11030386.
7. Šebesta P, Štádler P, Šedivý P, et al. Radikální operace infekce cévní protézy v aortofemorální pozici pomocí čerstvého tepenního alograftu: naše střednědobé zkušenosti. Rozhl Chir. 2011Jan;90(1):4−13.
8. Touma J, Cochennec F, Parisot J, et al. In situ reconstruction in native and prosthetic aortic infections using cryopreserved arterial allografts. Eur J Vasc Endovasc Surg. 2014 Sep;48(3):292−299. doi:10.1016/j. ejvs.2014.04.023.
9. Kieffer E, Gomes D, Chiche L, et al. Allograft replacement for infrarenal aortic graft infection: early and late results in 179 patients. J Vasc Surg. 2004 May;39(5):1009−1017. doi:10.1016/j.jvs. 2003.12.040.
10. Giglia JG, Ollerenshaw JD, Dawson PE, et al. Cryopreservation prevents arterial allograft dilation. Ann Vasc Surg. 2002 Nov;16(6):762−767. doi: 10.1007/s10016 - 001-0072-1.
11. Gewartowska M, Olszewski WL, Buyanowskaya O, et al. A novel method for long-lasting preservation of arterial grafts. J Surg Res. 2016 Jan;200(1):374−386. doi:10.1016/j.jss. 2015.07.046.
12. Mestres CA, Eduard Quintana E, Tomislav Kopjar T, et al. Twenty-year experience with cryopreserved arterial allografts for vascular infections. Eur J Cardiothorac Surg. 2019 Feb 1;55(2):358−365. doi:10.1093
13. Pallister ZS, Chung J. Femoral vein reconstruction for aortic infections. Vasc Specialist Int. 2021 Mar 31;37(1):4−13. doi:10.5758.
14. Modrall JG, Sadjadi J, Ali AT, et al. Deep vein harvest: predicting need for fasciotomy. J Vasc Surg. 2004 Feb;39(2):387−394. doi:10.1016/j.jvs.2003.10.021.
15. Staffa R, Kříž Z, Vlachovský R, et al. Autogenní vena femoralis superficialis jako náhrada infikované aorto-iliako-femorální cévní protézy. Rozhl Chir. 2010 Jan;89(1):39−44.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Mikrobiologie v chirurgii
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2022 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Mikrobiologie v chirurgii
- Současná diagnostika a léčba chirurgických infekcí kůže a měkkých tkání
- Analýza mikrobiálních nálezů z peritoneální tekutiny pacientů s perforovaným peptickým vředem – retrospektivní observační studie
- Ohlédnutí za infekcemi cévních rekonstrukcí na chirurgické klinice v Plzni
- Laparoskopická sutura perforovaného peptického vředu – rutina, nebo cílený výběr pacientů?
- Benigní stenóza společného žlučovodu po Roux-Y gastrektomii
- Obří agresivní intraabdominální fibromatóza desmoidního typu kazuistika
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současná diagnostika a léčba chirurgických infekcí kůže a měkkých tkání
- Obří agresivní intraabdominální fibromatóza desmoidního typu kazuistika
- Laparoskopická sutura perforovaného peptického vředu – rutina, nebo cílený výběr pacientů?
- Benigní stenóza společného žlučovodu po Roux-Y gastrektomii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



