-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Cesta k novým játrům: Decelularizace prasečích jater a jejich znovuosídlení buňkami
Repopulation of decellularized pig scaffolds: Promising approach for liver tissue engineering
Repopulation of decellularized tissue with cells is a very promising approach in tissue engineering, with liver tissue engineering not being an exception. Decellularized liver scaffolds can serve as an excellent 3D environment for recellularization as it maintain tissue-specific microarchitecture of ECM proteins with important spatial cues for cell adhesion, migration, growth and differentiation. Moreover, by using autologous cells the newly constructed graft should lack immunogenicity in the host organism and thus eliminate the need for immunosuppressive therapy in the post-transplant period. This review provides an overview of liver decellularization and repopulation experiments done so far while highlighting the advances as well as pin-pointing the challenges that remain to be solved.
Keywords:
liver – decellularization – extracellular matrix – repopulation – transplantation
Autoři: V. Liška 1,2; V. Moulisová 1; R. Pálek 1,2; J. Rosendorf 1,2; L. Červenková 1,3; L. Bolek 4; V. Třeška 2
Vyšlo v časopise: Rozhl. Chir., 2019, roč. 98, č. 10, s. 388-393.
Kategorie: Souhrnné sdělení
Souhrn
Repopulace decelularizované tkáně buňkami je velmi nadějným směrem, kterým by se mohl řešit nedostatek tkání a orgánů pro transplantace, přičemž jaterní tkáňové inženýrství není výjimkou. Decelularizovaný jaterní skelet slouží jako ideální 3D prostředí pro recelularizaci, neboť je v něm zachována tkáňově specifická mikroarchitektura proteinů extracelulární matrix (ECM) s poziční informací jak pro osídlení novými buňkami, tak pro jejich migraci, růst a diferenciaci. Při použití autologních buněk by navíc nově konstruovaný štěp měl postrádat imunogenicitu v hostitelském organismu, bylo by tedy možné se kompletně vyhnout imunosupresi, která je v současnosti nutnou součástí terapie po transplantaci. Tento přehled uvádí příklady dosud provedených decelularizačních a repopulačních experimentů v játrech, přičemž upozorňuje na pokroky a poukazuje na výzvy, které je třeba řešit.
Klíčová slova:
játra – decelularizace – extracelulární matrix – repopulace – transplantace
Úvod
Stále se zvyšující výskyt difuzních i ložiskových onemocnění jater je celosvětovým problémem [1]. Pro mnoho pacientů je jedinou léčebnou možností transplantace jater, kde se ovšem naráží na propastný rozdíl mezi počtem dostupných dárcovských orgánů a počtem lidí, kteří transplantaci potřebují [2]. V případě maligních onemocnění pak je často exkluzivním kritériem lokální rozsah tohoto postižení i přes vyloučení extrahepatálního šíření onemocnění. Intenzivně se proto hledají alternativních řešení, přičemž velké úsilí je soustředěno na vývoj strategií pro tkáňové inženýrství jater s cílem vyrobit funkční tkáň, kterou by bylo možné transplantovat.
Experimentálně byly dosud testovány různé speciální materiálové matrice, a to jak syntetické, tak přírodního původu, které by napodobovaly specifické prostředí jater a jež by bylo možné osídlit buňkami [3]. Pro maturaci a plnou funkčnost jaterní tkáně je však nezbytná kombinace mnoha různých faktorů včetně vytvoření specifické jaterní vaskulatury a žlučovodů. Tato komplexní mikroarchitektura jater přispívá k tomu, že příprava funkčního štěpu jaterní tkáně in vitro stále zůstává velkou výzvou. Tento článek si klade za cíl poukázat na unikátní možnost využití decelularizovaných jater při konstrukci nové tkáně včetně seznámení s nejnovějšími vědeckými poznatky.
Přirozené prostředí decelularizované tkáně
Decelularizovaný jaterní skelet, který má zachovanou strukturní integritu celého orgánu, je velmi dobrým výchozím bodem pro vytvoření nové funkční jaterní tkáně, a tedy i pro případné budoucí klinické aplikace [4]. Extracelulární matrix (ECM) s tkáňově specifickým proteinovým složením a mikroarchitekturou představuje ideální biologický skelet poskytující přirozené podněty důležité pro buněčnou adhezi, migraci, růst a diferenciaci. Recelularizace takového skeletu v ideálním případě buňkami příjemce pak může být elegantním řešením, jak získat vhodnou tkáň pro transplantaci, a zároveň se vyhnout nebo alespoň výrazně eliminovat imunosupresivní terapii za předpokladu časné přestavby xenogenního skeletu (Obr. 1).
Obr. 1. Vize využití decelularizovaných prasečích jater k přípravě humanizovaného graftu vhodného pro transplantaci
Fig. 1: Vision to employ decellularized pig livers for constructing humanized grafts suitable for liver transplantation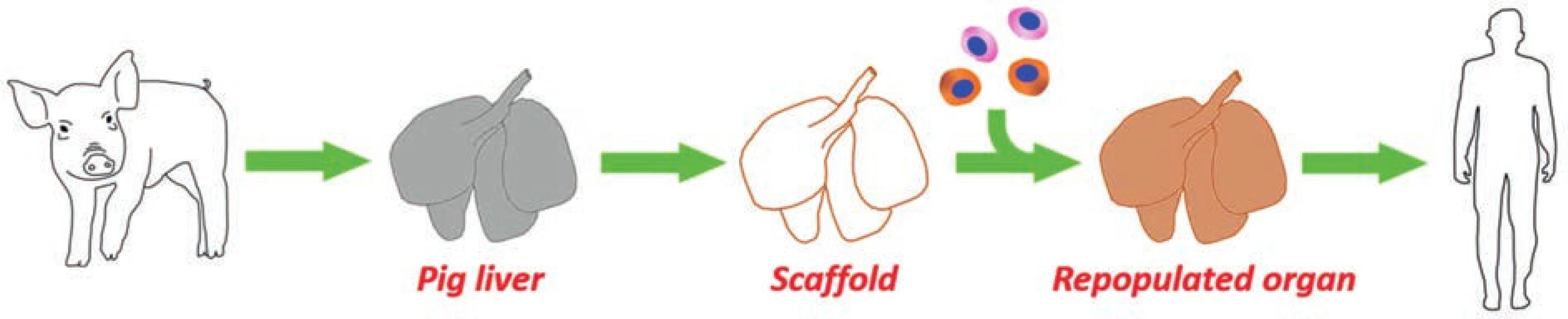
Zásadním faktorem při decelularizaci jater je tedy zachování trojrozměrné struktury ECM, která odráží morfologické znaky jednotlivých jaterních částí. Tyto zahrnují jak intralobulární sinusoidy, prostor pro centrální žílu a niky pro trámce hepatocytů, tak interlobulární vazivo včetně prostoru pro portální žílu, jaterní tepnu a žlučovod, dále pak struktury větších cév. Strukturální proteiny, jako jsou například kolageny (kolagen I, III a IV), laminin a fibronektin, mají ve své přirozené konformaci ve skeletu přístupné specifické vazebné domény jak pro samotné buňky, tak pro různé typy cytokinů a růstových faktorů, které se v extracelulárním prostoru běžně vyskytují a regulují buněčné funkce.
Pokroky v decelularizaci
Během uplynulého desetiletí byla provedena řada studií uvádějících úspěšné protokoly decelularizace pro různé tkáně [5]. V případě jater byly decelularizovány orgány jak z malých zvířat (myš, potkan nebo fretka) [6–8], tak z velkých zvířat (prase, ovce) [9–11]; příklad prasečích jater decelularizovaných na našem pracovišti před decelularizačním procesem a po něm je uveden na Obr. 2.
Obr. 2. Prasečí játra před (vlevo) a po decelularizaci (vpravo)
Fig. 2: Pig liver before (left) and after decellularization (right)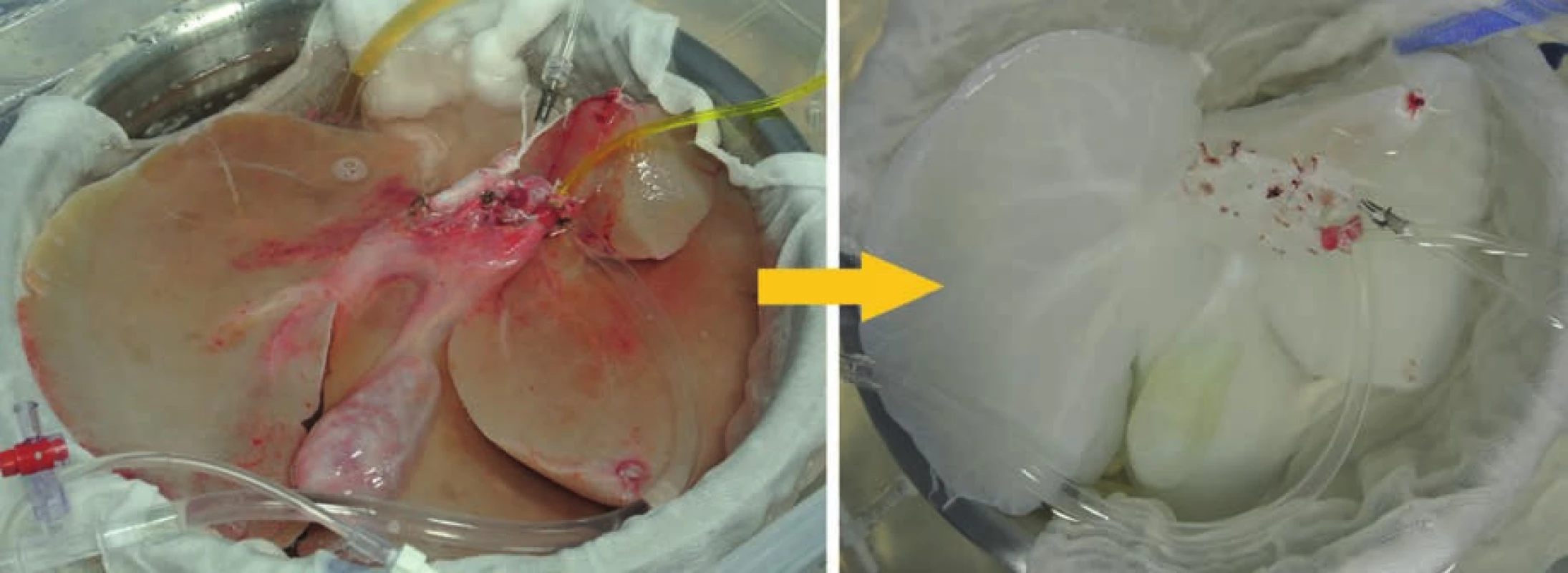
Byl rovněž připraven skelet z lidských jater [12]. Převážná většina těchto postupů byla provedena perfuzí přes portální žílu ex vivo, jsou však i práce poukazující na možnosti in vivo decelularizace [13]. Přehled vybraných decelularizačních protokolů pro játra včetně použitých typů roztoků a délky trvání celého procesu je uveden v Tab. 1.
Tab. 1. Příklady protokolů decelularizace celých jater za použití různých kombinací detergentů a dalších chemikálií; prováděno pomocí perfúze portální žílou
Tab. 1. Examples of whole liver decellularization using a range of combinations of detergents and other reagents; performed using perfusion via portal vein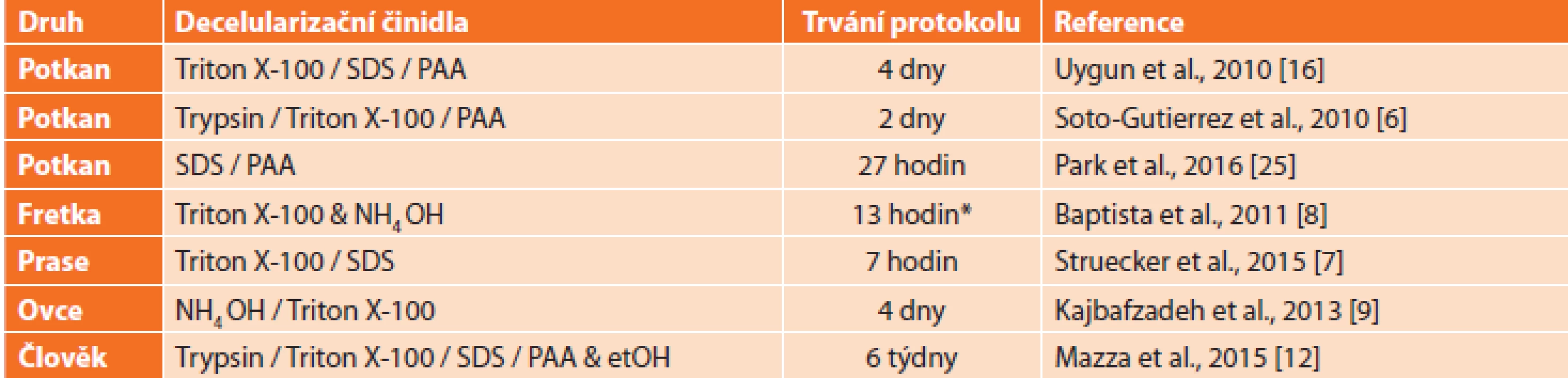
Vysvětlivky: SDS – laurylsíran sodný, PAA – kyselina peroctová; SDS – sodium dodecyl sulphate, PAA – per-acetic acid, *odhad vypočtený ze známého průtoku a objemu perfundovaného roztoku Kvalita decelularizovaného skeletu je posuzována dle několika kritérií, z nichž zásadní je ověření, že materiál neobsahuje žádné buňky ani jejich části, zejména DNA. Nejčastěji se používají histologické techniky, jako jsou například barvení hematoxylinem a eosinem (H&E) (Obr. 3a,b), barvení Massonovým trichromem a/nebo imunohistochemie (IHC) (různé kolageny, laminin, fibronektin nebo elastin), a dále hodnocení celkového množství DNA [10,14–16]. Hodnocení je někdy doplněno snímáním rastrovací elektronovou mikroskopií (SEM) (Obr. 3d), fluorescenčním barvením specifických proteinů (Obr. 3e), hodnocením obsahu glykosaminoglykanů a analýzou proteinového složení Western blotem (WB), případně proteomicky [8,14,16,17]. Dále je možné testovat mechanické vlastnosti skeletu, vizualizuje se kostra cévního systému nebo je kvantifikována retence růstových faktorů, jako jsou vaskulární endoteliální růstový faktor (VEGF) nebo základní fibroblastový růstový faktor (bFGF) [17–19].
Obr. 3. Mikroskopické zobrazení skeletu prasečích jater připraveného v naší laboratoři a) jaterní lalůček před decelularizací (H&E barvení); jaterní skelet po decelularizaci obarvený H&E; b) a zeleným nichromem; c) se zachovanou mikroarchitekturou ECM sinusoid (S), centrální žíly (CV) a interlobulárních sept (IS); d) detail sinusoidální ECM z elektronové mikroskopie (SEM) s přiblížením na jednotlivá proteinová vlákna (zelený rámeček); e) fluorescenční zobrazení kolagenu IV v sinusoidální ECM; šipky ukazují lumen sinusoid v 3D prostoru (konfokální mikroskop).
Fig. 3: Microscopic imaging of porcine liver scaff old decellularized in our lab a) liver lobulus prior to decellularization (H&E staining); decellularized liver scaff old staind with H&E; b) and Green Trichrome; c) with preserved ECM microarchitecture showing sinusoids (S), central veins (CV) and interlobular septa (IS); d) SEM images of sinusoidal ECM with a close-up of individual protein fibers (green box); e) confocal fluorescence imaging of collagen IV in sinusoidal ECM; arrows point at sinusoidal lumen in 3D (confocal microscope).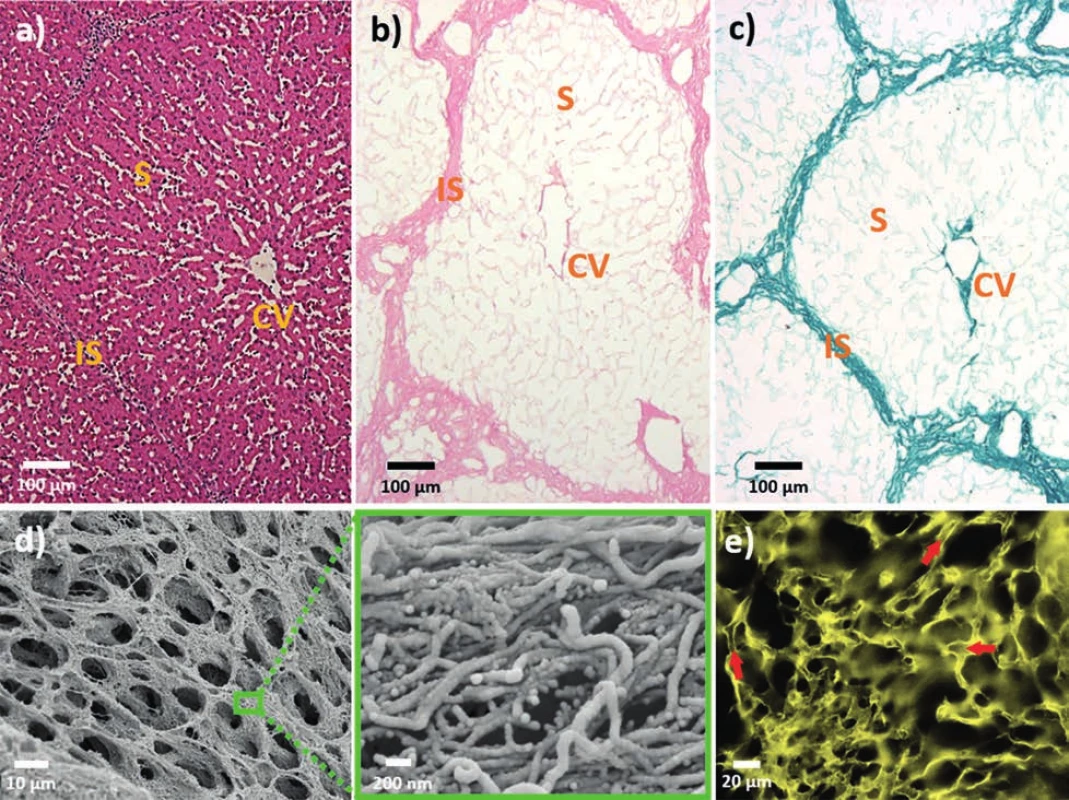
To vše představuje obsáhlý soubor testů, které z různých pohledů popisují decelularizovaný materiál. Dosud však nebyla dostatečná pozornost věnována detailní proteinové struktuře skeletu, a proto je nedostatek informací o tom, zda jsou po decelularizaci a vystavení detergentům jednotlivé proteiny stále ve skutečně přirozené konformaci ve smyslu dostupnosti specifických vazebných domén. To je zvláště důležité pro buněčnou adhezi, kterou umožňuje interakce membránových proteinů integrinů právě s vazebnými motivy ECM proteinů, případně pro zachycení různých růstových faktorů, které mohou následně stimulovat například buněčný růst či diferenciaci [20]. Zkoumání složení proteinů ve funkčně odlišných částech skeletu a specifické konformace proteinů, které přitahují různé typy buněk, by vedlo k poznání informací o poloze pro repopulační buňky. To by mohlo vrhnout světlo na mechanismy interakce protein-buňka ECM a mohlo by pomoci objasnit, zda to znamená, že sinusový lumen skeletu může být repopulován přednostně endotelovými buňkami, nebo zda hepatocyty upřednostňují vnější stranu sinusové sítě k jejímu vnitřnímu povrchu.
Ačkoli většina dosud publikovaných protokolů decelularizace umožnila získat acelulární skelet, studie obecně postrádají systematický přístup za použití různých více či méně toxických roztoků detergentů v různých koncentracích. Stejně tak se protokoly velmi liší, co se týká doby, po kterou decelularizace probíhá, a kdy je tedy skelet v přímém kontaktu s detergenty. Publikované procesy trvají v rozmezí od několika hodin po několik dnů, někdy i týdnů [12,14,15]. Prodloužený kontakt proteinů ECM s detergenty je však sporný, protože detergenty mohou modifikovat jemnou strukturu a konformaci přítomných proteinů. Zatím nejrychlejší perfuzní protokol publikovaný pro prasečí játra (velikostí orgánu odpovídající velikosti lidských jater) trval 7 hodin, kdy byl proces prováděn za podmínek oscilujícího tlaku za použití složité aparatury [10].
Naše laboratoř se nedávno začala věnovat decelularizaci prasečích jater se zaměřením na optimalizaci protokolu zejména ve smyslu zkrácení doby, kdy je jaterní skelet vystaven působení detergentů. Zároveň se zabýváme vývojem metodiky posuzování kvality decelularizovaného skeletu včetně vývoje počítačového softwaru, který by umožnil kvantitativně hodnotit, do jaké míry jsou zachovány jednotlivé morfologické struktury klíčové pro následné osídlení buňkami.
Úspěchy a úskalí repopulace
Samotný získaný skelet by postrádal klinické využití, vědci se proto různými způsoby snaží vpravit do něj nové buňky, udržet je naživu a případně přimět je se namnožit. Byly testovány různé způsoby osidlování, přičemž mezi nejjednodušší patří takzvaný „drop seeding“ (aplikace buněk na povrch materiálu), případně injekční vpravení buněk do skeletu. Obr. 4 ukazuje jaterní skelet z prasete s namnoženými buňkami potkaního endotelu a), jakož i s čerstvě přisedlými buňkami linie HepG2 b) z pilotních repopulačních experimentů v naší laboratoři. Oba způsoby osídlení mají neocenitelnou roli například při studiu buněčné adheze ke skeletu. Z pohledu vytváření tkáňové struktury ve 3D se ovšem projeví jejich nevýhody, jako je malý stupeň penetrace buněk do hlubších vrstev skeletu v případě aplikace na povrch, případně poškození jemné struktury skeletu v místě injekční aplikace. Jako nejpraktičtější způsob se tedy nabízí repopulace pomocí perfuze.
Obr. 4. Fluorescenční obrázek buněk v decelularizovaném skeletu prasečích jater a) potkaní endotelové buňky po 7 dnech inkubace; b) buňky linie HepG2 3h po aplikaci; zeleně je značen buněčný cytoskeleton, červeně kolagen IV prasečího skeletu a modře buněčná jádra. Oba typy buněk byly aplikovány metodou „drop seeding“.
Fig. 4: Fluorescence image of cells in the decellularized pig liver scaff old a) rat endothelial cells after 7 days of incubation; b) HepG2 cells 3h after seeding; the cytoskeleton is green, red is used for collagen IV from the pig scaff old, and blue depicts the nuclei. Drop seeding was used in both cases. Vysvětlivky: S – sinusoidy, CV – centrální žíla, IS – interlobulární septum; S – sinusoids, CV – central vein, IS – interlobular septum.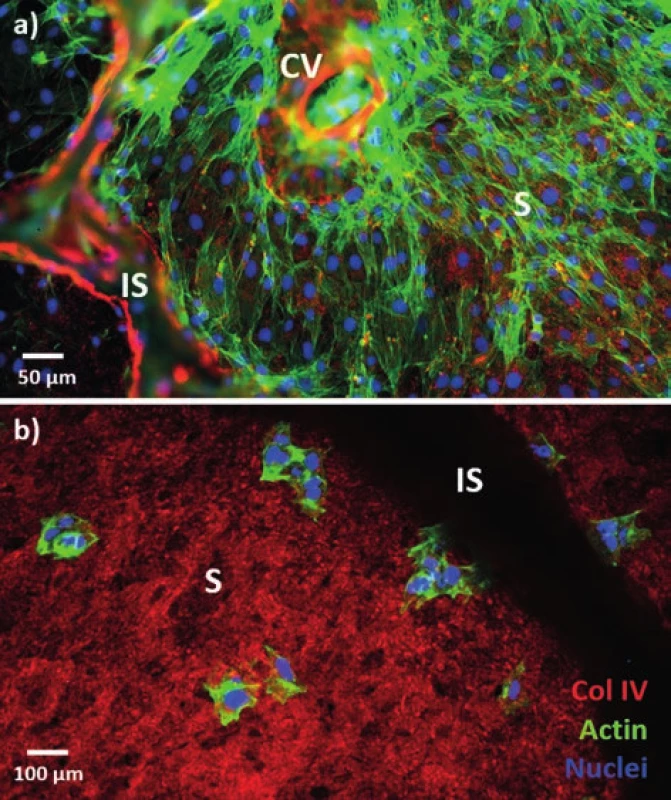
Většina pokusů o repopulaci decelularizované tkáně byla provedena na potkaních modelech. Uygun et al. v roce 2010 popisuje repopulaci potkaního skeletu hepatocyty potkana [16]; jaterní skelety potkanů byly také repopulovány myšími hepatocyty, potkaními mezenchymálními kmenovými buňkami (MSC) a lidskými endotelovými buňkami umbilikální žíly (hUVEC) [21–23]. Myší jaterní skelet byl použit jako matrice pro lidské kmenové buňky [24], zatímco potkaní skelet pro prasečí pluripotentní kmenové buňky indukované na hepatocyty (iPSC-Heps) [25]. Jaterní skelet izolovaný z fretek byl rovněž testován na repopulaci lidskýmifetálními jaterními buňkami a hUVEC [8]. Skelet prasečích jater byl použit v několika studiích buď jako celý orgán [26], nebo jako jeden lalok [27]. Většina těchto experimentů využívala jako vstupní bránu pro buněčnou infuzi systém portální žíly, byla ale také testována infuze žlučovými cestami [21,28]. Po aplikaci buněk obvykle následovalo několik dní in vitro kultivace a v několika případech byla repopulovaná tkáň implantována pokusnému zvířeti za účelem monitorování jak osudu implantované tkáně in vivo, tak i reakce hostitele. Reprezentativní přehled repopulačních experimentů je uveden v Tab. 2.
Tab. 2. Příklady repopulace jaterního skeletu buňkami včetně délky trvání in vitro, případně i in vivo experimentu; adheze buněk při infuzní repopulaci probíhala staticky a při perfuzní repopulaci za velmi pomalého průtoku buněčné suspenze
Tab. 2: Examples of liver scaff old repopulation with cells including duration of in vitro as well as in vivo experiments if available; the cells adhered under static conditions in case of infusion while very low fl ow rates were used during perfusion repopulation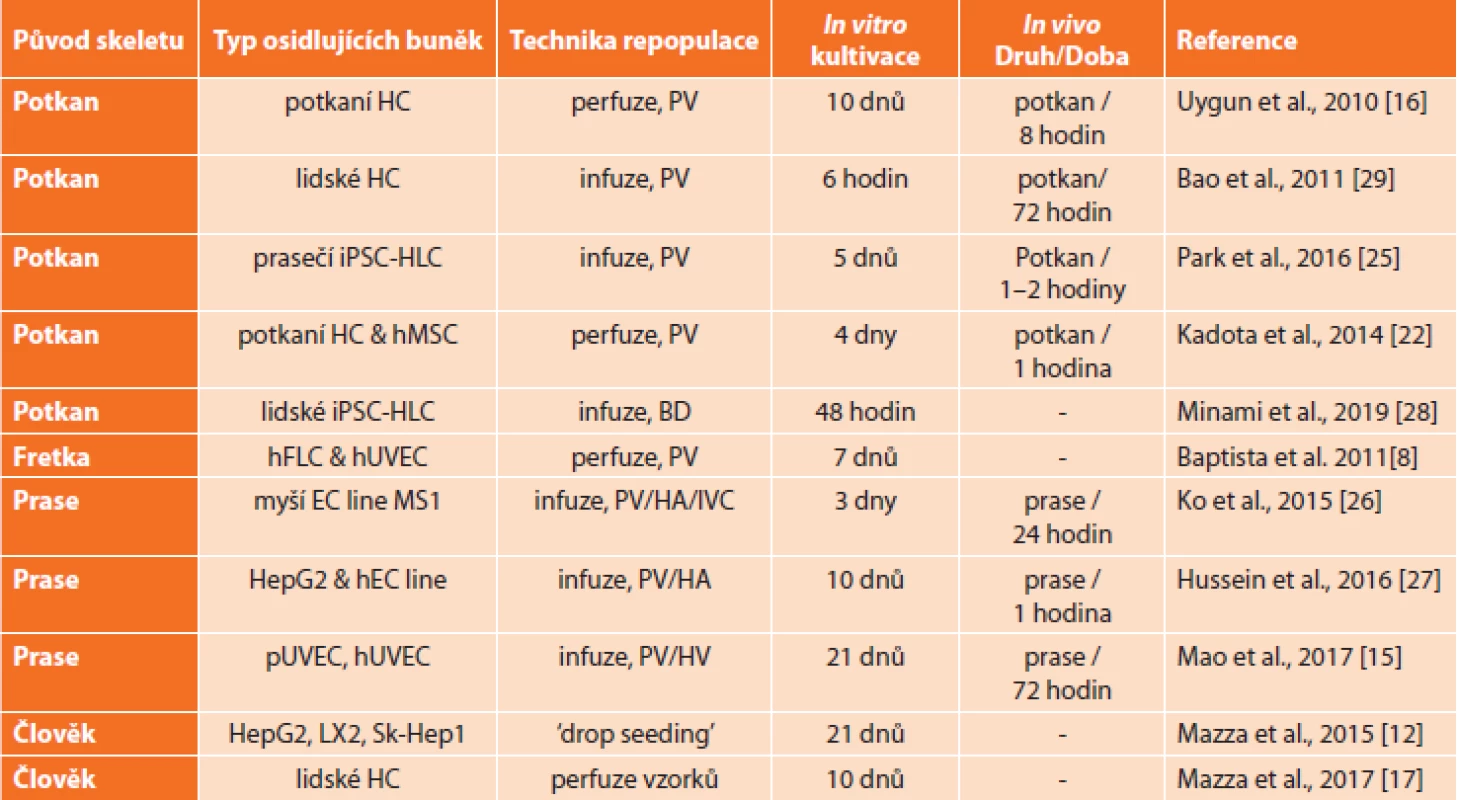
Vysvětlivky: HC – hepatocyty, iPSC-HLC – indukované pluripotentní kmenové buňky diferencované do hepatocytů, hMSC – lidské mezenchymální kmenové buňky, hFLC – lidské fetální jaterní buňky, hUVEC / pUVEC – lidské / prasečí endotelové buňky umbilikální žíly, HepG2 – linie buněk lidského hepatoblastomu, Sk-Hep1 – linie buněk lidského hepatocelulárního karcinomu, EC – endotelové buňky, LX2 – linie imortalizovaných lidských Itových buněk, PV – portální žíla, BD – žlučovod, HA – jaterní tepna, IVC – v. cava, HV – jaterní žíla. HC – hepatocytes, iPSC-HLC – induced pluripotent stem cells diferentiated into hepatocyte-like cells, hMSC – human mesenchymal stem cells, hFLC – human fetal liver cells, hUVEC / pUVEC – human / porcine umbilical vein endothelial cells, HepG2 – human hepatoblastoma cell line, Sk-Hep1 – human hepatocellular cancer cell line, EC – endothelial cells, LX2 – immortalized human hepatic stellate cell line, PV – portal vein, BD – bile duct, HA – hepatic artery, IVC- caval vein, HV – hepatic vein. Tyto experimenty jednoznačně představují velký pokrok v tkáňovém inženýrství; poukazují však i na klíčová omezení, která je ještě třeba řešit. Jedním z problémů je právě nerovnoměrná distribuce a/nebo agregace buněk ve skeletu po aplikaci; slibným přístupem k překonání tohoto problému může být vícestupňová aplikace buněk [6,27]. Dalším závažným problémem je, že skelety jsou náchylné k trombóze, když jsou následně po znovuosídlení vystaveny systémovému oběhu; toto poukázalo na důležitost reendotelizace skeletu před opětovným zavedením hepatocytů. Nedávné studie prokázaly, že vysoká trombogenicita může být částečně redukována heparinizací potkaního skeletu [27] a že stabilizované krevní perfuze lze dosáhnout u reendotelizovaného prasečího skeletu in vivo až po dobu 24 hodin [26]. Nicméně i přes veškerou snahu zůstává hlavní překážkou dlouhodobá perfuze. Jako maximální dosažená doba bezproblémové perfuze je uváděno 72 hodin [15,29], což je s ohledem na budoucí použití tkáně pro transplantaci stále příliš málo. Výzkum však pokračuje vývojem speciálních bioreaktorů, které by dlouhodobou kultivaci in vitro umožňovaly.
Závěr
Na základě literárního přehledu a našich vlastních výsledků je jasné, že je nutné detailně zkoumat strukturu samotného decelularizovaného skeletu a jeho interakce s jednotlivými buněčnými typy, aby bylo možné dosáhnout optimalizace protokolu znovuosídlení tohoto přírodního materiálu. Vícestupňové řešení definovaných problémů konstrukce recelularizovaných jater předpokládá postupný vznik parciálních orgánových perfuzních soustav, které budou schopny eliminovat trombogenicitu a dále zajistit recelularizaci v optimální buněčné hustotě. Zde předpokládáme i nutnost využití in vitro kultivace buněk – progenitorů v bioreaktorech a následné využití extrakorporální perfuze orgánu k optimalizaci lokace osidlujících buněk, jejich proliferace a diferenciace v cílové efektorové buňky. In vivo testování těchto nově osídlených štěpů ve smyslu sledování jaterních funkcí a vhojení je dalším nezbytným krokem na cestě k vytvoření jaterní tkáně, která bude finálně použitelná v klinické praxi.
Poděkování
Autoři děkují prof. Utě Dahmen z Univerzitní kliniky v Jeně za laskavé poskytnutí potkaních endotelových buněk a dr. Sandorovi Nietzschemu z Centra elektronové mikroskopie v Jeně za umožnění SEM analýzy. Práce je finančně podporována projekty MŠMT „Aplikace moderních technologií v medicíně a průmyslu“ (AMTMI, CZ.02.1.01/0.0/0.0/17_048/0007280) a Národní program udržitelnosti NPU I č. LO1503, a rovněž projektem Univerzity Karlovy UNCE/MED006 „Centrum klinické a experimentální jaterní chirurgie“.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
doc. MUDr. Václav Liška, PhD
Chirurgická klinika a Biomedicínské centrum,
LF UK v Plzni
Alej Svobody 1655/76
e-mail: liskav@fnplzen.cz
Zdroje
1 Pimpin L, Cortez-Pinto H, Negro F, et al. Burden of liver disease in Europe: Epidemiology and analysis of risk factors to identify prevention policies. Journal of Hepatology 2018;69 : 718–35. doi:10.1016/j.jhep.2018.05.011.
2 Dutkowski P, Oberkofler CE, Bechir M, et al. The model for end-stage liver disease allocation system for liver transplantation saves lives, but increases morbidity and cost: A prospective outcome analysis. Liver Transplant. 2011;17 : 674–84. doi:10.1002/lt.22228.
3 Mazza G, Al-Akkad W, Rombouts K, et al. Liver tissue engineering: from implantable tissue to whole organ engineering. Hepatol Commun. 2018;2 : 131–41. doi:10.1002/hep4.1136.
4 Faulk DM, Wildemann JD, Badylak SF. Decellularization and cell seeding of whole liver biologic scaffolds composed of extracellular matrix. Journal of Clinical and Experimental Hepatology 2015;5 : 69–80. doi:https://doi.org/10.1016/j.jceh.2014.03.043.
5 Gilpin A, Yang Y. Decellularization strategies for regenerative medicine: From processing techniques to applications. Biomed Res Int. 2017 : 13. doi:10.1155/2017/9831534.
6 Soto-Gutierrez A, Zhang L, Medberry C, et al. A whole-organ regenerative medicine approach for liver replacement. Tissue Eng Part C-Methods 2011;17 : 677–86. doi:10.1089/ten.tec.2010.0698.
7 Struecker B, Butter A, Hillebrandt K, et al. Improved rat liver decellularization by arterial perfusion under oscillating pressure conditions. J Tissue Eng Regen Med. 2017;11 : 531–41. doi:10.1002/term.1948.
8 Baptista PM, Siddiqui MM, Lozier G, et al. The use of whole organ decellularization for the generation of a vascularized liver organoid. Hepatology 2011;53 : 604–17. doi:10.1002/hep.24067.
9 Kajbafzadeh AM, Javan-Farazmand N, Monajemzadeh M, et al. Determining the optimal decellularization and sterilization protocol for preparing a tissue scaffold of a human-sized liver tissue. Tissue engineering. Part C Methods 2013;19 : 642–51. doi:10.1089/ten.TEC.2012.0334.
10 Struecker B, Hillebrandt KH, Voitl R, et al. Porcine liver decellularization under oscillating pressure conditions: A technical refinement to improve the homogeneity of the decellularization process. Tissue Eng Part C Methods 2015;21 : 303–13. doi:10.1089/ten.tec.2014.0321.
11 Wu Q, Bao J, Zhou YJ, et al. Optimizing perfusion-decellularization methods of porcine livers for clinical-scale whole-organ bioengineering. Biomed Res Int. 2015 : 9. doi:10.1155/2015/785474.
12 Mazza G, Rombouts K, Hall AR, et al. Decellularized human liver as a natural 3D-scaffold for liver bioengineering and transplantation. Scientific Reports 2015;5 : 15. doi:10.1038/srep13079.
13 Wang A, Jank I, Wei W, et al. A novel surgical technique as a foundation for in vivo partial liver engineering in rat. J Vis Exp. 2018. doi:10.3791/57991.
14 Mirmalek-Sani S-H, Sullivan DC, Zimmerman C, et al. Immunogenicity of decellularized porcine liver for bioengineered hepatic tissue. The American Journal of Pathology 2013;183 : 558–65. doi:https://doi.org/10.1016/j.ajpath.2013.05.002.
15 Mao S, Glorioso J, Elgilani F, et al. Sustained in vivo perfusion of a re-endothelialized tissue engineered porcine liver. Transplantation Research and Medicine 2017;3. doi:10.23937/2572–4045.1510031.
16 Uygun BE, Soto-Gutierrez A, Yagi H, et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nature Medicine 2010;16 : 814–20. doi:10.1038/nm.2170.
17 Mazza G, Al-Akkad W, Telese A, et al. Rapid production of human liver scaffolds for functional tissue engineering by high shear stress oscillation-decellularization. Scientific Reports 2017;7 : 5534. doi:10.1038/s41598-017-05134-1.
18 Maghsoudlou P, Georgiades F, Smith H, et al. Optimization of liver decellularization maintains extracellular matrix micro-architecture and composition predisposing to effective cell seeding. PLoS One 2016;11 : 19. doi: 10.1371/journal.pone.0155324.
19 Hussein KH, Saleh T, Ahmed E, et al. Biocompatibility and hemocompatibility of efficiently decellularized whole porcine kidney for tissue engineering. J Biomed Mater Res. Part A 2018;106 : 2034–47. doi:10.1002/jbm.a.36407.
20 Mouw JK, Ou GQ, Weaver VM. Extracellular matrix assembly: a multiscale deconstruction. Nature Reviews Molecular Cell Biology 2014;15 : 771–85. doi:10.1038/nrm3902.
21 Ogiso S, Yasuchika K, Fukumitsu K, et al. Efficient recellularisation of decellularised whole-liver grafts using biliary tree and foetal hepatocytes. Scientific Reports 2016;6. doi:10.1038/srep35887.
22 Kadota Y, Yagi H, Inomata K, et al. Mesenchymal stem cells support hepatocyte function in engineered liver grafts. Organogenesis 2014;10 : 268–77. doi:10.4161/org.27879.
23 Shirakigawa N, Takei T, Ijima H. Base structure consisting of an endothelialized vascular-tree network and hepatocytes for whole liver engineering. J Biosci Bioeng. 2013;116 : 740–5. doi:10.1016/j.jbiosc.2013.05.020.
24 Navarro-Tableros V, Herrera Sanchez MB, Figliolini F, et al. Recellularization of rat liver scaffolds by human liver stem cells. Tissue engineering. Part A 2015;21 : 1929–39. doi:10.1089/ten.TEA.2014.0573.
25 Park KM, Hussein KH, Hong SH, et al. Decellularized liver extracellular matrix as promising tools for transplantable bioengineered liver promotes hepatic lineage commitments of induced pluripotent stem cells. Tissue engineering. Part A 2016;22 : 449–60. doi:10.1089/ten.TEA.2015.0313.
26 Ko IK, Peng L, Peloso A, et al. Bioengineered transplantable porcine livers with re-endothelialized vasculature. Biomaterials 2015;40 : 72–9. doi: 10.1016/j.biomaterials.2014.11.027.
27 Hussein KH, Park KM, Kang KS, et al. Heparin-gelatin mixture improves vascular reconstruction efficiency and hepatic function in bioengineered livers. Acta Biomater. 2016;38 : 82–93. doi:10.1016/j.actbio.2016.04.042.
28 Minami T, Ishii T, Yasuchika K, et al. Novel hybrid three-dimensional artificial liver using human induced pluripotent stem cells and a rat decellularized liver scaffold. Regenerative Therapy 2019;10 : 127–33. doi:10.1016/j.reth.2019.03.002.
29 Bao J, Shi Y, Sun H, et al. Construction of a portal implantable functional tissue-engineered liver using perfusion-decellularized matrix and hepatocytes in rats. Cell Transplant. 2011;20 : 753–66. doi:10.3727/096368910x536572.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Odcházení
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2019 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Jaterní chirurgie 21. století
- Cesta k novým játrům: Decelularizace prasečích jater a jejich znovuosídlení buňkami
- Synchronní, do jater metastazující karcinom rekta a možnosti simultánní resekce
- Radiofrekvenční ablace jaterních metastáz kolorektálního karcinomu
- Léčba jaterních cyst – zkušenosti Chirurgické kliniky FN Plzeň 2009−2018
- Srovnání efektivity chirurgické intervence s terapií Cyberknife® v léčbě jaterních malignit
- Multidisciplinární tým v léčbě kolorektálního karcinomu – analýza vlastní sestavy nemocných za rok 2017
- Endovaskulárna liečba trombózy aorto-hepatického bypassu po transplantácii pečene
- Zemřel primář Otomar Rychnovský
- Odcházení
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba jaterních cyst – zkušenosti Chirurgické kliniky FN Plzeň 2009−2018
- Srovnání efektivity chirurgické intervence s terapií Cyberknife® v léčbě jaterních malignit
- Radiofrekvenční ablace jaterních metastáz kolorektálního karcinomu
- Cesta k novým játrům: Decelularizace prasečích jater a jejich znovuosídlení buňkami
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



