-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Predikce poškození střeva u pacientů s gastroschízou
Prediction of bowel damage in patients with gastroschisis
Introduction:
Gastroschisis is the most common malformation among abdominal wall defects with the incidence of 1 : 4−5000 live birth neonates. Postoperative care for these patients is very difficult due to the risk of abdominal compartment syndrome. The identification of markers that correlate with bowel damage in gastroschisis may prevent this serious postoperative complication.Methods:
Review of the literature.Conclusion:
Prenatal ultrasound prediction of bowel damage followed by an appropriate surgical strategy is a possibility of optimizing care and outcomes in gastroschisis patients. The dynamics of I-FABP is a promising biomarker for the elimination of abdominal compartment syndrome during postoperative care.Key words:
gastroschisis − preformed silo − intraabdominal dilatation − I-FABP
Autoři: B. Frýbová; A. Kokešová; R. Vlk; M. Rygl
Působiště autorů: Klinika dětské chirurgie 2. lékařské fakulty Univerzity Karlovy a FN v Motole, Praha
Vyšlo v časopise: Rozhl. Chir., 2018, roč. 97, č. 3, s. 105-108.
Kategorie: Souhrnné sdělení
Souhrn
Úvod:
Gastroschíza je nejčastějším vrozeným defektem břišní stěny s incidencí 1 : 4−5000 živě narozených dětí. Pooperační péče o tyto novorozence je velmi obtížná především kvůli riziku rozvoje břišního kompartment syndromu. Identifikací vhodných markerů, které predikují poškození střeva u gastroschízy, lze této závažné komplikaci předejít.Metody:
Přehledová práce vycházející z dostupné literatury.Závěr:
Prenatální predikce poškození střeva pomocí ultrazvuku s následnou volbou vhodné chirurgické techniky nabízí možnost, jak optimalizovat péči o pacienty s gastroschízou. V průběhu pooperačního období bude vedle standardního měření intraabdominálního tlaku možné využít dynamiku hladin i-FABP (intestinal fatty acid binding protein) pro sledování rozvoje kompartment syndromu.Klíčová slova:
gastroschíza − preformované silo − intraabdominální dilatace − i-FABPÚvod
Gastroschíza je nejčastějším vrozeným defektem břišní stěny s incidencí 1 : 4−5000 živě narozených dětí. Charakterizuje ji herniace střevních kliček, eventuálně žaludku nebo gonád přes defekt břišní stěny. Ten je 3−4 cm velký, typicky je uložen vpravo od úponu pupečníku (Obr. 1). Gastroschíza je velmi dobře diagnostikovatelná na prenatálním ultrazvuku již ve 12. až 13. týdnu gestace (Obr. 2) a rozděluje se na komplexní (tzv. complex gastroschisis, při narození je přítomna atrezie nebo perforace střeva) a jednoduchou nekomplikovanou gastroschízu (tzv. simple gastroschisis) [1]. Atrezie střeva je přítomna v 10−15 % případů. Důvod vzniku gastroschízy je nejasný. Nejčastěji se jako příčina uvádí zánik mezodermu, který formuje přední břišní stěnu, na podkladě uzávěru zásobující arterie ve 4. až 6. týdnu gestace [2]. Jako predisponující faktory pro vznik gastroschízy se uvádějí nikotinismus, abúzus drog, nízký věk matky (pod 21 let) a nízký socioekonomický status rodičky.
Obr. 1. Preformované silikonové silo Fig. 1: Preformed silicone silo 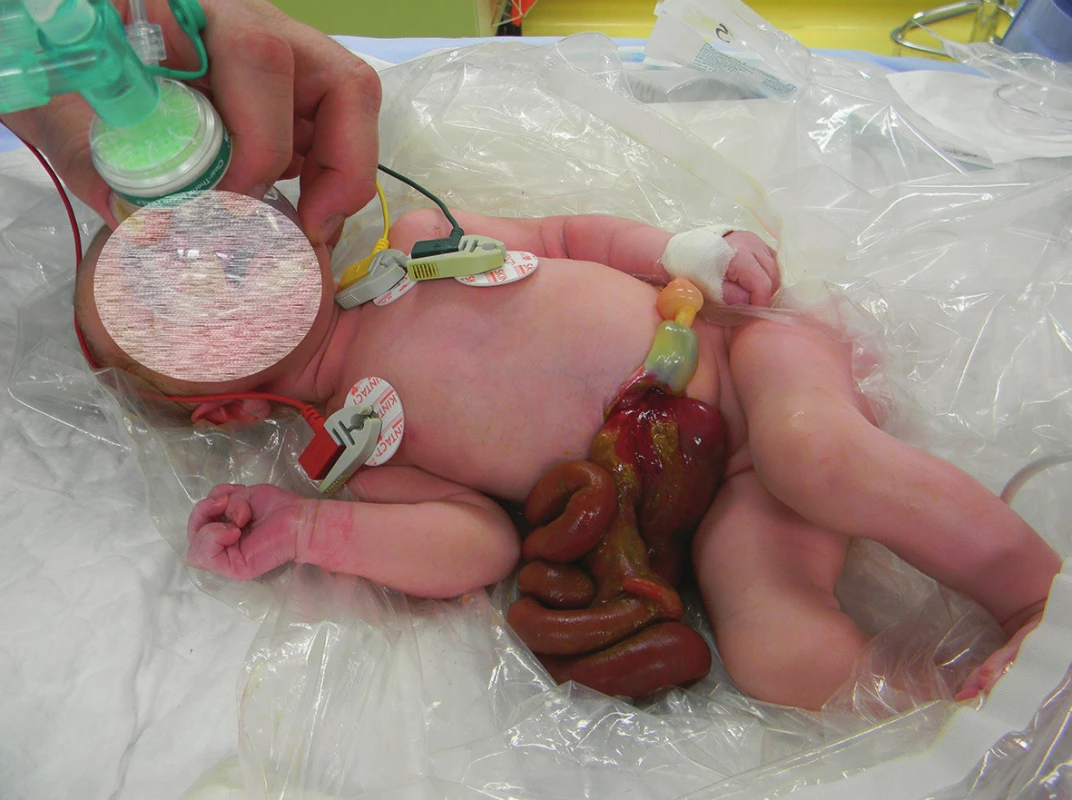
Obr. 2. Prenatální ultrazvukové vyšetření u gastroschízy Fig. 2: Prenatal ultrasound scan of gastroschisis 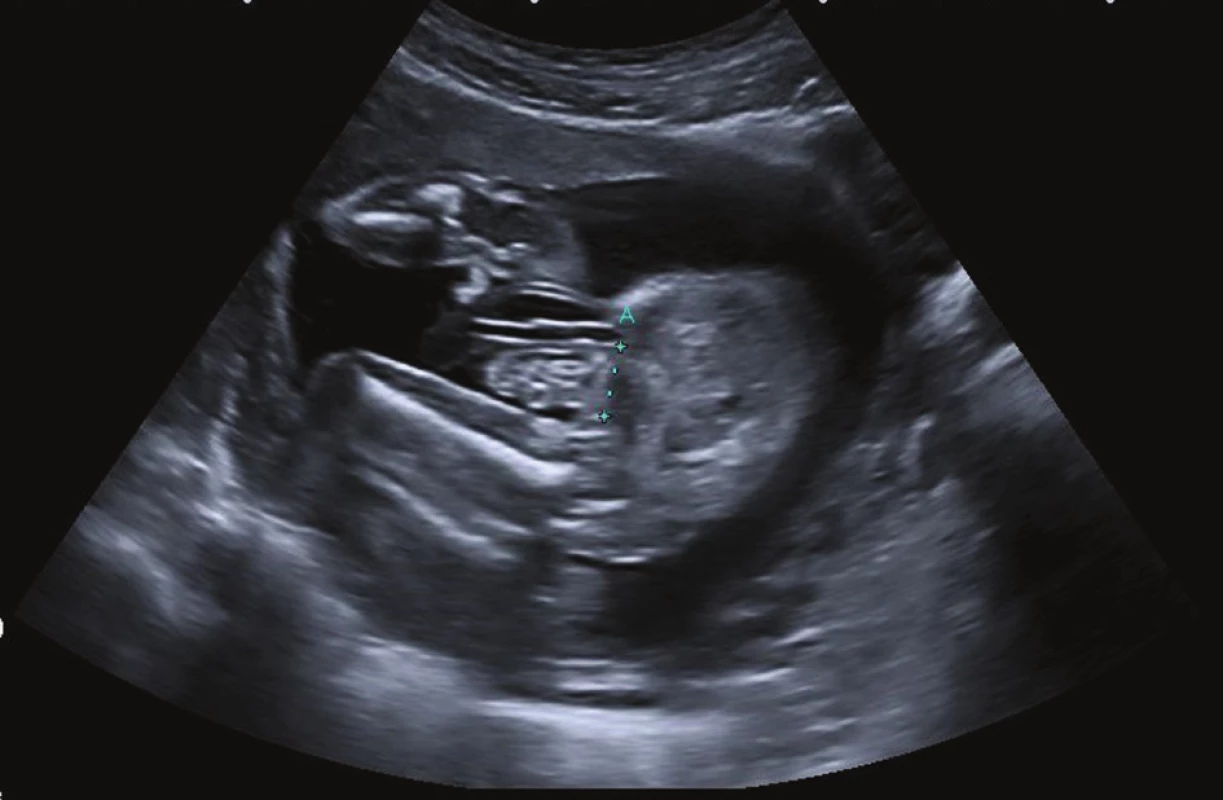
Incidence gastroschízy celosvětově vzrůstá v posledních dvou dekádách. Počet ukončených těhotenství (v ČR 70−80 % diagnostikovaných plodů s gastroschízou) však neklesá, ač je tato vada dobře chirurgicky řešitelná a prognóza pacientů je velmi dobrá. Přežití pacientů s gastroschízou je v ČR přes 90 %, což je srovnatelné s nejvyspělejšími státy světa. K tomu přispívá volba správné chirurgické techniky a kvalitní intenzivní neonatologická péče po chirurgickém výkonu. Gastroschíza je řešena buď primární plastikou, nebo – v případě nemožnosti defekt uzavřít – vícedobým uzávěrem: silikonovým preformovaným silem (Obr. 3) nebo goretexovou membránou. O morbiditě a mortalitě pacientů s touto vrozenou vývojovou vadou rozhoduje zejména poškození střeva – jak prenatální, tak i pooperační. Cílem sdělení je shrnutí současných poznatků o predikci a sledování průběhu poškození střeva u pacientů s gastroschízou.
Obr. 3. Preformované silikonové silo Fig. 3: Preformed silicone silo 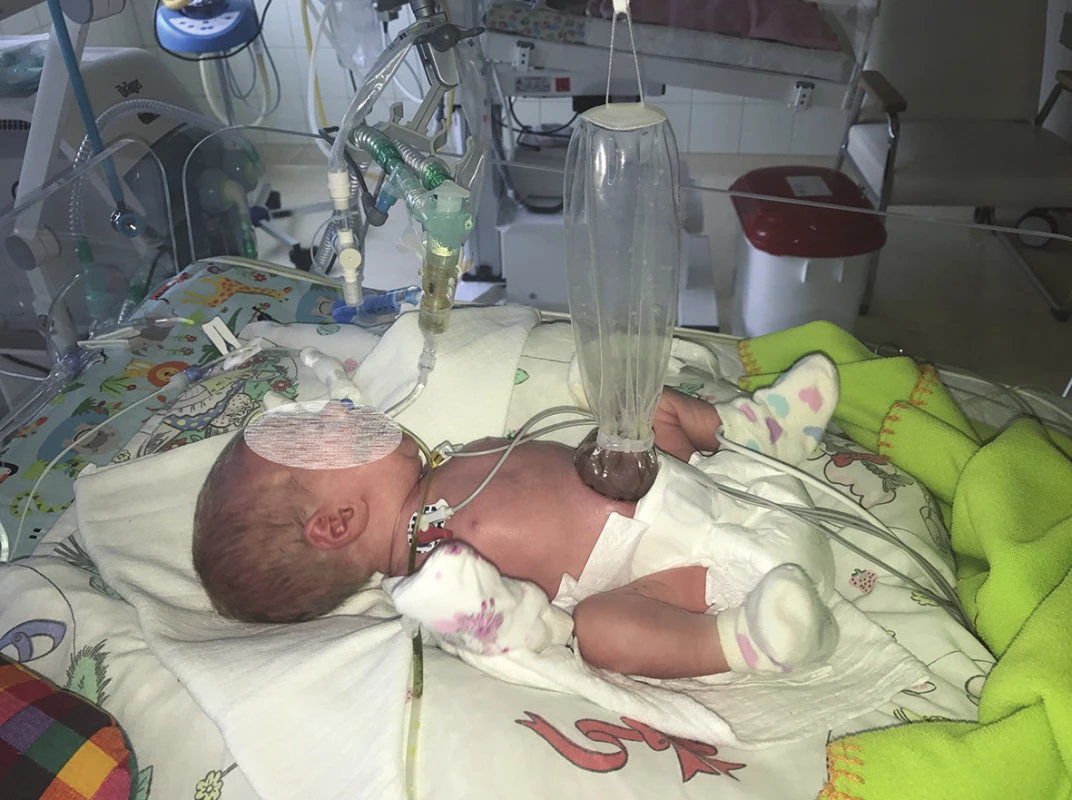
Metody
Prenatální péče a způsob vedení porodu
Přes 90 % pacientů s gastroschízou je prenatálně diagnostikováno už ve 12. až 13. týdnu gestace, ve 30. týdnu dokáže ultrazvukové vyšetření kvantifikovat poškození střeva. Ve 36. týdnu jsou rodičky s diagnostikovanou gastroschízou preventivně přijaty do prenatálního centra s návazností na dětskou chirurgickou péči. Gastroschíza není v současné době indikací k císařskému řezu, nebyl prokázán rozdíl v postnatálním vývoji mezi dětmi porozenými per vias naturales a sekcí. Při vaginálním porodu nedochází k mechanickému poškození střev novorozence.
Možnosti chirurgické léčby
Pacient s gastroschízou je ihned po narození převezen na pracoviště dětské chirurgie na jednotku intenzivní péče pro novorozence. Zavedení nasogastrické sondy, parenterální výživa a antibiotická profylaxe 48 hodin jsou nezbytnou součástí péče. Na některých světových pracovištích je preferována bed-side repozice střev do dutiny břišní za minimální sedace pacienta, kdy je defekt překryt pupečníkem (tzv. sutureless umbilical closure) [3]. Průkopníkem této metody byli Bianchi et al. [4]. V České republice je v současnosti prováděn chirurgický výkon v celkové anestezii a následuje cca 2 hodiny po stabilizaci novorozence. Primární uzávěr břišní stěny je vhodnou technikou, pokud herniované kličky lze bez většího úsilí reponovat do břišní dutiny bez zvýšených nároků na ventilaci pacienta. Pokud tato repozice není možná, je vhodné břišní stěnu uzavřít goretexovým silem nebo v dnešní době preferovanou technikou: naložit na střevní kličky preformované průhledné silikonové silo. Preformované silikonové silo se naloží na herniované kličky a samoexpandibilní silikonový kroužek na okraji sila se vloží pod okraje defektu, defekt není nutné rozšiřovat. Silo se vyvěsí tak, aby byla břišní stěna pod tahem, tím se v průběhu několika dní dosáhne její dilatace [5]. Během následujících 3 až 7 dnů se postupně střevní kličky v silu samy reponují do dutiny břišní a po jejich dokončeném sestupu lze silo sejmout a břišní stěnu bez tahu uzavřít. Právě volba sila před neuváženým primárním uzávěrem břišní dutiny pod velkým tahem je prevencí břišního kompartment syndromu, který je nejčastější příčinou úmrtí pacientů s gastroschízou.
Pooperační průběh a měření intraabdominálního tlaku
U části pacientů po primárním uzávěru břišní stěny se v časném pooperačním období rozvine různě závažný břišní kompartment syndrom. Intraabdominální tlak (IAT) u dětí by se měl pohybovat kolem 4 mmHg (1–8 mmHg) [6]. Trvalý IAT nad 20 mmHg provázený dysfunkcí orgánů (akutní selhání ledvin vedoucí k oligurii až anurii, ventilační selhání, oběhová nestabilita, porucha vnitřního prostředí ve smyslu metabolické acidózy a hyperkalemie) se hodnotí jako rozvinutý břišní kompartment syndrom a při neúspěchu konzervativní péče (analgosedace, neuromuskulární blokáda, pozice těla, NGS, rektální dekomprese, korekce pozitivní bilance tekutin – restrikce tekutin, diuretika) je indikací k chirurgickému řešení, tedy k dekompresi dutiny břišní. Měření IAT jako časného markeru rozvíjejícího se kompartment syndromu s cílem včas diagnostikovat a terapeuticky ovlivnit tuto závažnou pooperační komplikaci je nedílnou součástí pooperační péče. IAT se měří jako tlak přenesený do močového měchýře pomocí permanentního močového katétru: pacient je uložen v poloze na zádech, ve vodorovné poloze (elevace hlavy zvyšuje IAT). Pokud to není z nějakého důvodu možné, pak je důležité každé další měření provádět v identické poloze jako měření první. Nejdříve se svorkou uzavře hadička vedoucí do sběrného sáčku na moč. Injekční stříkačkou se naplní močový měchýř 1/1 FR objemem odpovídajícím 2−3 ml/kg (max. 25 ml), objem použité tekutiny by měl být stejný pro každé měření. Poté se uzavře kohout u injekční stříkačky, vyčká se 30−60 vteřin, aby došlo k vyrovnání tlaků, a zaznamená se hodnota tlaku. Pokud tlak periodicky kolísá, pak je validní hodnota na konci výdechu [6]. Záznam nitrobřišního tlaku může na monitoru vykreslovat kolísavou křivku, která odpovídá přenosu tlakových změn z břišních tepen. V případě těžkého kompartment syndromu s oligo/anurií není výjimečné použití eliminačních metod (kontinuální veno-venózní hemodialýza CVVHD). Včasný záchyt rozvoje břišního kompartment syndromu má rozhodující vliv na prevenci další morbidity a mortality po operaci. Po odeznění paralytického ileu trvajícího někdy až 3−4 týdny (vzhledem k celkové kondici střeva, které je vstupně u gastroschízy oteklé a ztluštělé), je započato s kontinuální enterální výživou cestou nasogastrické sondy. Postupné navyšování dávek mléka (mateřského nebo umělého) je závislé na toleranci – sledují se gastrická rezidua, klinický nález na břiše a pasáž stolice.
Predikce poškození střeva u gastroschízy
Střevo u gastroschízy vykazuje po narození různý stupeň poškození, ale vždy je oteklé, kožovité a může být přítomna střevní atrezie. Etiologii poškození střeva u gastroschízy lze rozdělit na prenatální v důsledku vrozené vývojové vady a postnatální jako následek operace nebo infekce (nekrotizující enterokolitidy). Stupeň prenatálního poškození střeva a jeho vliv na budoucí klinický vývoj je předmětem experimentálních studií. Např. Samala a kol. ve zvířecí experimentální studii dokázali, že moč a mekonium novorozence způsobují zánět ve střevní stěně [7]. Caglar a kol. demonstrovali na kuřecím modelu gastroschízy strukturální poškození střevní sliznice ve srovnání se zdravou kontrolní skupinou. Poškození mukózy zdůvodňuje zvýšenou apoptózou enterocytů [8]. V další animální studii Srinathan a kol. vysvětlují poškození střeva iniciální hyperplazií buněk hladké svaloviny s následným snížením jejich proliferace, které je spojeno s výskytem vyššího množství kolagenu [9]. K poškození střeva může dojít i po narození rozvojem kompartment syndromu nebo nekrotizující enterokolitidy [10].
1. Prenatální predikce poškození střeva
Klíčovým faktorem, který může kvantifikovat poškození střeva, je prenatální ultrazvukové vyšetření. Vhodnou dobou k posouzení poškození střeva intrauterinně je 30. týden gestace, kdy se rodička dostaví na ultrazvukové vyšetření. Vyšetření by měl provádět zkušený prenatální specialista v místě, kde se vady břišní stěny centralizují. Kromě jiných ultrazvukových parametrů (růst plodu, množství plodové vody atd.) se zaměřuje na měření velikosti defektu v břišní stěně, hodnotu intraabdominální dilatace střeva plodu, přítomnost jiných herniovaných orgánů kromě tenkého střeva (tlusté střevo, žaludek, vaječník, nesestouplé varle) a ztluštění stěny extraabdominálního střeva – což jsou parametry, které mají potenciál poškození střev u plodu predikovat. Dosud není spolehlivě prokázáno, že by velikost defektu ve stěně břišní a herniace dalších orgánů budoucí klinický vývoj novorozence ovlivňovaly. Ultrazvukové markery těžkého poškození střeva se zdají být především intraabdominální dilatace střeva nad 10 mm a ztluštění stěny střeva plodu nad 3 mm, což jsou v publikované literatuře nejčastěji stanovené „cut-off“ hodnoty těchto parametrů. Intraabdominální dilatace střeva dle některých autorů úzce souvisí s výskytem střevní atrezie [11−14]. Výskyt střevní atrezie zvyšuje morbiditu pacientů, což potvrzuje studie autorů Ghionzioli a kol. [15]. Intraabdominální dilataci střeva plodu jako marker těžkého poškození střeva a výskytu atrezie potvrzují Nick a kol., kdy 10 pacientů z 58 z jejich souboru mělo prenatálně zjištěnou intraabdominální dilataci a těchto deset mělo po narození diagnostikovanou střevní atrézii, zatímco zbylých 48 pacientů bez intraabdominální dilatace atrézii nemělo [16]. Naopak Cohen-Overbeek a kol. korelaci mezi výskytem intraabdominální dilatace a horším klinickým průběhem pacientů ve své studii vyloučili [17]. Ke stanovení této korelace bude nutné provést další studie. Avšak už nyní lze doporučit: pokud má plod výraznou intraabdominální dilataci střeva (a tím je střevo podezřelé z přítomnosti atrezie) a/nebo je přítomna výrazná dilatace stěny střeva plodu, je vhodné k prenatálním měřením přihlédnout a preferovat chirurgickou strategii preformovaného sila s odloženým uzávěrem defektu před primárním uzávěrem a tím eliminovat rozvoj kompartmentu.
2. Postnatální predikce poškození střeva, i-FABP (intestinal fatty acid binding protein)
Protein i-FABP je mnoha autory prokázaný marker poškození střevní sliznice, ischemie a apoptózy [10,18−22]. Nízká hladina i-FABP je běžně přítomna v plazmě jako výsledek fyziologické obnovy enterocytů. Jeho hodnota se výrazně zvyšuje při přítomnosti střevního zánětu (nekrotizující enterokolitida, enteritidy) [10,23]. I-FABP částice je velmi malá (14−15kDa) a přechází přes glomerulární membránu. Vzhledem k tomu, že i-FABP není produkován urotraktem, jeho hodnota v moči přímo souvisí s množstvím poškozených enterocytů. Vzorky moči novorozence se v přesně daných intervalech (ideálně po 4−6 hod.) odeberou a odešlou na analýzu pomocí ELISA metody. Hodnoty i-FABP (pg/ml) musejí být vždy vztaženy k aktuálním hodnotám kreatininu v moči (µmol/l), které jsou odeslány na biochemický rozbor v době odebírání vzorku moči, aby se výsledek objektivizoval i při různých hodnotách koncentrace moči. Tato výhoda měření v moči (kterou lze od novorozenců neinvazivně v pravidelných intervalech získat) nabízí možnost sledovat dynamiku i-FABP, která by v korelaci s vyššími hodnotami naměřeného nitrobřišního tlaku přesně kvantifikovala poškození střeva u pacienta s gastroschízou a pomohla tak predikovat jeho klinický vývoj a rozvoj kompartment syndromu. Limitujícím faktorem této metody je dostupnost ELISA analýzy na pracovišti.
Závěr
Prenatální predikce poškození střeva pomocí ultrazvuku s následnou volbou vhodné chirurgické techniky nabízí možnost, jak optimalizovat péči o pacienty s gastroschízou. V průběhu pooperačního období bude možné vedle standardního měření IAT využít dynamiku hladin i-FABP pro sledování rozvoje kompartment syndromu.
Seznam zkratek
I-FABP – intestinal fatty acid binding protein
FR – fyziologický roztok
IAT – intraabdominální tlak
NGS – nasogastrická sonda
CVVHD – kontinuální veno-venózní hemodialýza
ELISA – enzyme-linked immuno sorbent assay
Práce vznikla s podporou projektu GA UK 159115.
Fotodokumentace publikována se souhlasem rodičů.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Barbora Frýbová
Klinika dětské chirurgie 2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: barbora.frybova@fnmotol.cz
Zdroje
Lap CC, Brizot ML, Pistorius LR, et al. Outcome of isolated gastroschisis; an international study, systematic review and meta-analysis. Early Hum Dev 2016;103 : 209−18.
2. Holcomb GW, Murphy JD, Ostlie DJ. Ashcraft‘s Pediatric Surgery, Elsevier 2014 : 660−72.
3. Pet GE, Stark RA, Meehan JJ, et al. Outcomes of bedside sutureless umbilical closure without endotracheal intubation for gastroschisis repair in surgical infants. Am J Surg 2017;213 : 958−62.
4. Bianchi A, Dickson AP. Elective delayed reduction and no anesthesia: ‚minimal intervention management‘ for gastrochisis. J Pediatr Surg 1998;33 : 1338−40.
5. Ross AR, Eaton S, Zani A, et al. The role of preformed silos in the management of infants with gastroschisis: a systematic review and meta-analysis. Pediatr Surg Int 2015;31 : 473−83.
6. Suominen PK, Pakarinen MP, Rautiainen P, et al. Comparison of direct and intravesical measurement of intraabdominal pressure in children. Journal of Pediatric Surgery 2006;41 : 1381–5.
7. Samala DS, Parelkar SV, Sanghvi BV, et al. To observe the intensity of the inflammatory reaction caused by neonatal urine and meconium on the intestinal wall of rats in order to understand etiology of intestinal damage in gastroschisis. J Indian Assoc Pediatr Surg 2014;19 : 5−9.
8. Caglar M, Karaguzel G, Gokhan-Ocak G, et al. Multidirectional and simultaneous evaluation of gastroschisis-related intestinal damage in chick embryos. J Pediatr Surg 2014;49 : 1577−84.
9. Srinathan SK, Langer JC, Blennerhassett MG, et al. Etiology of intestinal damage in gastroschisis. III: Morphometric analysis of the smooth muscle and submucosa. J Pediatr Surg 1995;30 : 379−83.
10. Derikx JP, Evennett NJ, Degraeuwe PL, et al. Urine based detection of intestinal mucosal cell damage in neonates with suspected necrotising enterokolitis. Gut 2007;56 : 1473−5.
11. Huh NG, Hirose S, Goldstein RB. Prenatal intraabdominal bowel dilation is associated with postnatal gastrointestinal complications in fetuses with gastroschisis. Am J Obstet Gynecol 2010;202 : 391−6.
12. Janoo J, Cunningham M, Hobbs GR, et al. Can antenatal ultrasounds help predict postnatal outcomes in babies born with gastrochisis? The West Virginia experience. W V Med J 2013;109 : 22−7.
13. Kuleva M, Khen-Dunlop N, Dumez Y, et al. Is complex gastroschisis predictable by prenatal ultrasound? BJOG 2012;119 : 102−9.
14. Frybova B, Vlk R, Kokesova A, Rygl M. Isolated prenatal ultrasound findings predict the postnatal course in gastroschisis. Pediatr Surg Int 2015;31 : 381−7.
15. Ghionzoli M, James CP, David AL, et al. Gastroschisis with intestinal atresia--predictive value of antenatal diagnosis and outcome of postnatal treatment. J Pediatr Surg 2012;47 : 322−8.
16. Nick AM, Bruner JP, Moses R, et al. Second-trimester intra-abdominal bowel dilation in fetuses with gastroschisis predicts neonatal bowel atresia. Ultrasound Obstet Gynecol 2006;28 : 821−5.
17. Cohen-Overbeek TE, Hatzmann TR, Steegers EA, et al. The outcome of gastroschisis after a prenatal diagnosis or a diagnosis only at birth. Recommendations for prenatal surveillance. Eur J Obstet Gynecol Reprod Biol 2008;139 : 21−7.
18. Guthmann F, Börchers T, Wolfrum C, et al. Plasma concentration of intestinal - and liver-FABP in neonates suffering from necrotizing enterocolitis and in healthy preterm neonates. Mol Cell Biochem. 2002;239 : 227−34.
19. Thuijls G, van Wijck K, Grootjans J, et al. Early diagnosis of intestinal ischemia using urinary and plasma fatty acid binding proteins. Ann Surg 2011;253 : 303−8.
20. Lieberman J M, Sacchettini J, Marks C, et al. Human intestinal fatty acid binding protein: report of an assay with studies in normal volunteers and intestinal ischemia. Surgery 1997 March;335–342.
21. Edelson MB, Sonnino RE, Bagwell CE et al. Plasma intestinal fatty acid binding protein in neonates with necrotizing entercolitis: a pilot study. J Pediatr Surg 1999 Oct;34(10):1453–7.
22. Bingold TM, Franck K, Holzer K, et al. Intestinal Fatty Acid Binding Protein: A Sensitive Marker in Abdominal Surgery and Abdominal Infection, Surg Infect (Larchmt). 2015 Jun;16(3):247–53.
23. Coufal S, Kokesova A, Tlaskalova-Hogenova H, et al. Urinary Intestinal Fatty Acid-Binding Protein Can Distinguish Necrotizing Enterocolitis from Sepsis in Early Stage of the Disease. J Immunol Res. 2016; Available from: http://dx.doi.org/10.1155/2016/5727312.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2018 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Dětská chirurgie v 21. století
- Predikce poškození střeva u pacientů s gastroschízou
- Multidisciplinární přístup k chirurgickému onemocnění pankreatu v dětském věku
- Otevřená versus laparoskopická operace akutní apendicitidy u dětí
- Suprakondylická zlomenina humeru u dětí
- Laparoskopie na pracovišti dětské chirurgie v pětiletém období
- Hirschsprungova choroba v dospělém věku − dvě kazuistiky a přehled literatury
- Laparoskopické ošetrenie perforácie čriev po tupom brušnom poranení (BAT) u detí
- 100 let od narození profesora Zdeňka Šerého
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Suprakondylická zlomenina humeru u dětí
- Hirschsprungova choroba v dospělém věku − dvě kazuistiky a přehled literatury
- Otevřená versus laparoskopická operace akutní apendicitidy u dětí
- Laparoskopie na pracovišti dětské chirurgie v pětiletém období
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



