-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nozokomiální infekce – infekce spojené s poskytovanou zdravotní péčí
Autoři: V. Adámková
Působiště autorů: Všeobecné fakultní nemocnice a 1. lékařské fakulty UK, Praha ; Klinická mikrobiologie a ATB centrum Ústavu lékařské biochemie a laboratorní diagnostiky
Vyšlo v časopise: Rozhl. Chir., 2013, roč. 92, č. 4, s. 222-232.
Kategorie: Postgraduální vzdělávání
Nozokomiální infekce (NI) je nákaza vzniklá při pobytu v nemocnici nebo v příčinné souvislosti s tímto pobytem. Na vzniku těchto nákaz se podílí přítomnost určitých mikroorganismů v nemocničním prostředí, oslabení organismu nemocí i diagnostické a léčebné zásahy do organismu (např. cévkování, operace aj.). Vzhledem k měnícímu se charakteru poskytování zdravotní péče je třeba tuto definici rozšířit a nahradit zavádějící pojem nozokomiální infekce termínem infekce spojené se zdravotní péčí (HCAI – healh care associated infection).
Infekce spojené se zdravotní péčí jsou definovány jako infekce, které nebyly manifestní ani v inkubační době v čase přijetí do zdravotnického zařízení. Tato definice lépe odráží skutečnou problematiku než dříve používaný termín nozokomiální infekce.
Během několika hodin po přijetí do zdravotnického zařízení dochází ke změnám v kolonizaci pacienta mikroorganismy, které se vyskytují v okolním prostředí. Většina bakteriálních infekcí bývá klinicky manifestních do 48 hodin od přijetí. V případě infekcí vyvolaných jinými mikroorganismy je třeba individuálně posoudit kritérium HCAI vzhledem k délce inkubační doby.
HCAI představují závažné komplikace v systému poskytování zdravotní péče. Významně ovlivňují morbiditu i mortalitu pacientů, zhoršují kvalitu života pacientů a mají výrazný finanční dopad na zdravotní péči.
HAI se mohou projevit lokálně (ranná infekce) nebo celkově, mohou zasáhnout jakýkoliv orgánový systém, většinou jsou spojené s diagnostickým nebo léčebným zásahem [1].
Patofyziologie [2,3]
HCAI jsou nejčastěji vyvolané bakteriemi, ostatní mikroorganismy se uplatňují méně často (viry, kvasinky, paraziti) a nenesou většinou takové riziko morbidity a mortality jako bakteriální infekce. Virové nozokomiální infekce se vyskytují častěji u dětí než u dospělých, ale jsou epidemiologicky závažné. Mykotické infekce bývají diagnostikovány u pacientů s prolongovanou antibiotickou léčbou a/nebo imunosuprimovaných.
Mikroorganismy potřebují nějaký reservoár (člověk, vzduch, voda apod.), kde mohou přežívat, a cestu přenosu. Infekční agens může být přeneseno vzduchem, tělesnými tekutinami, kontaktem, fekálně orální cestou, potravou, zvířetem nebo hmyzím vektorem. Toto jsou základní předpoklady vzniku jakékoliv infekce. Z hlediska HCAI je důležitá přítomnost vnímavého jedince, pacienta.
Faktory virulence mikroorganismů určují, zda výsledkem kontaktu s infekčním agens bude pouhá kolonizace pacienta nebo dojde k rozvoji manifestní infekce. V případě kolonizace nedochází k poškození lokálních ani vzdálených tkání a nerozvíjí se imunitní odpověď.
Zdrojem HCAI může být jak endogenní, tak exogenní flóra (Tab. 1).
Tab. 1. Zdroje původců infekcí spojených se zdravotní péčí. 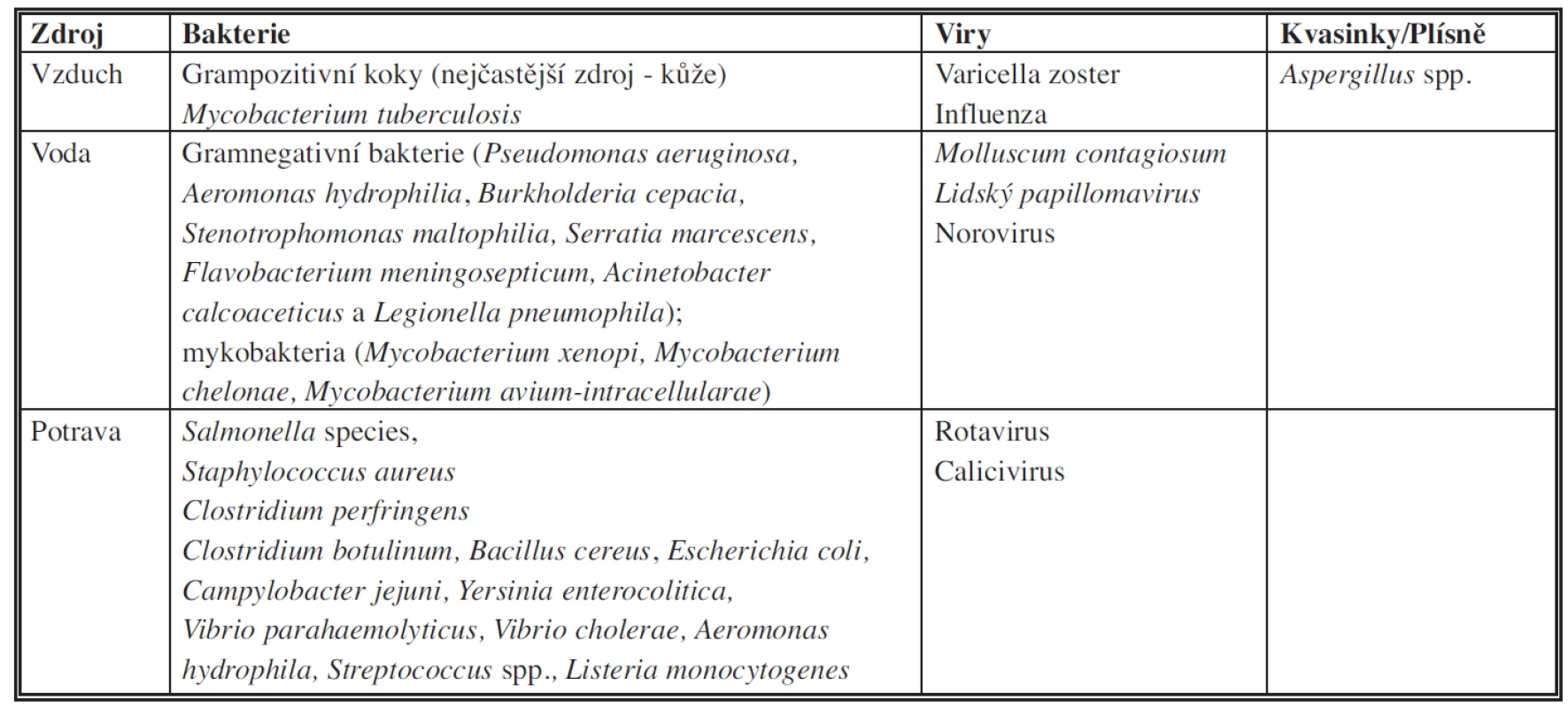
Endogenní zdroje zahrnují normální flóru lidského těla, jako např. běžná flóra orofaryngu, gastrointestinálního nebo genitouretrálního traktu.
Mezi exogenní zdroje patří například návštěvy pacientů, ošetřující personál, nástroje, prostředí.
Rizikové faktory [4,5]
Stanovit míru rizika u pacienta při příjmu do zdravotnického zařízení je nesmírně obtížné, ke každému pacientovi je třeba přistupovat individuálně. Riziko HCAI je nutné vyhodnocovat průběžně v rámci ošetřovatelské péče v kontextu primárního pacientova onemocnění a ordinovaných diagnostických postupů. Základní rizikové faktory shrnuje Tab. 2.
Tab. 2. Rizikové faktory vzniku NN 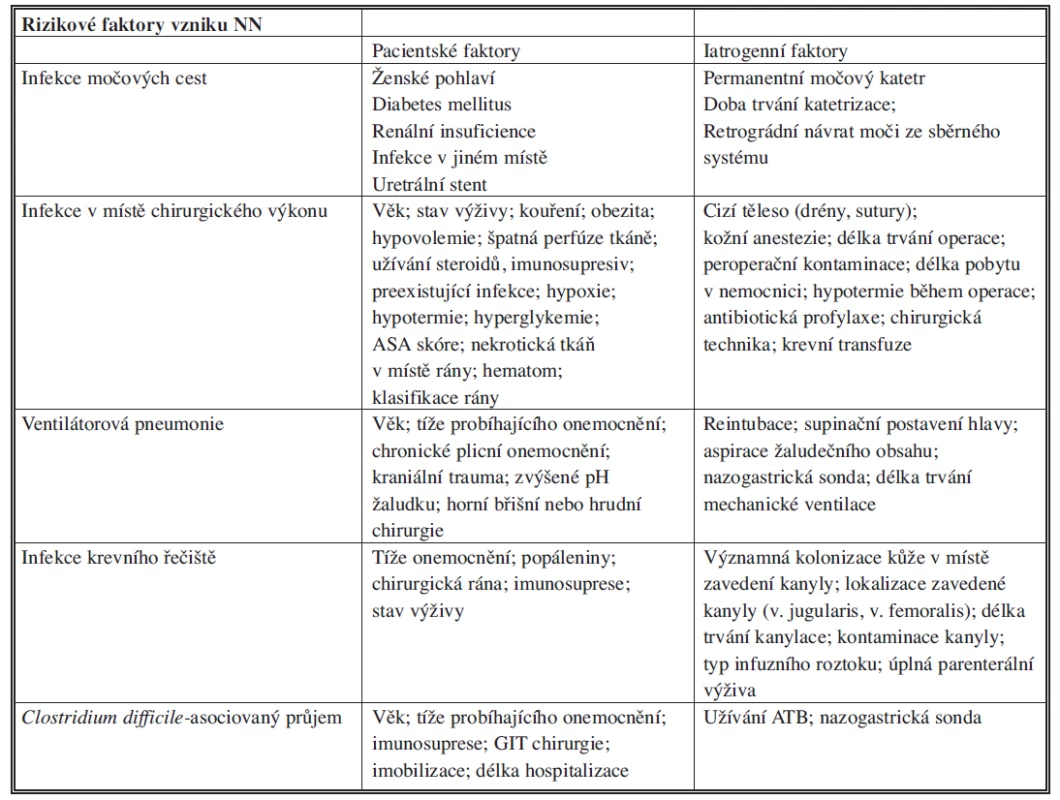
Typy HCAI [4]
Moderní zdravotní péče využívá různé typy invazivních vyšetření a zákroků ke stanovení diagnózy a následné léčby, jako jsou katetrizace, umělá plicní ventilace apod. Mezi infekce spojené s těmito postupy patří infekce krevního řečiště, katetrové močové infekce a ventilátorové pneumonie. Další skupinu tvoří infekce v místě chirurgického výkonu (SSI – surgical site infection). Antibiotická terapie může být komplikována rozvojem postantibiotické kolitidy vyvolané Clostridium difficile. Infekci C. difficile způsobí i přenos spór rukama ošetřujícího personálu. Infekce krevního řečiště, katetrové močové infekce, infekce v místě chirurgického výkonu a ventilátorové pneumonie tvoří téměř 80 % všech HCAI (Tab. 3).
Tab. 3. Nejčastější infekce spojené s poskytovanou zdravotní péčí 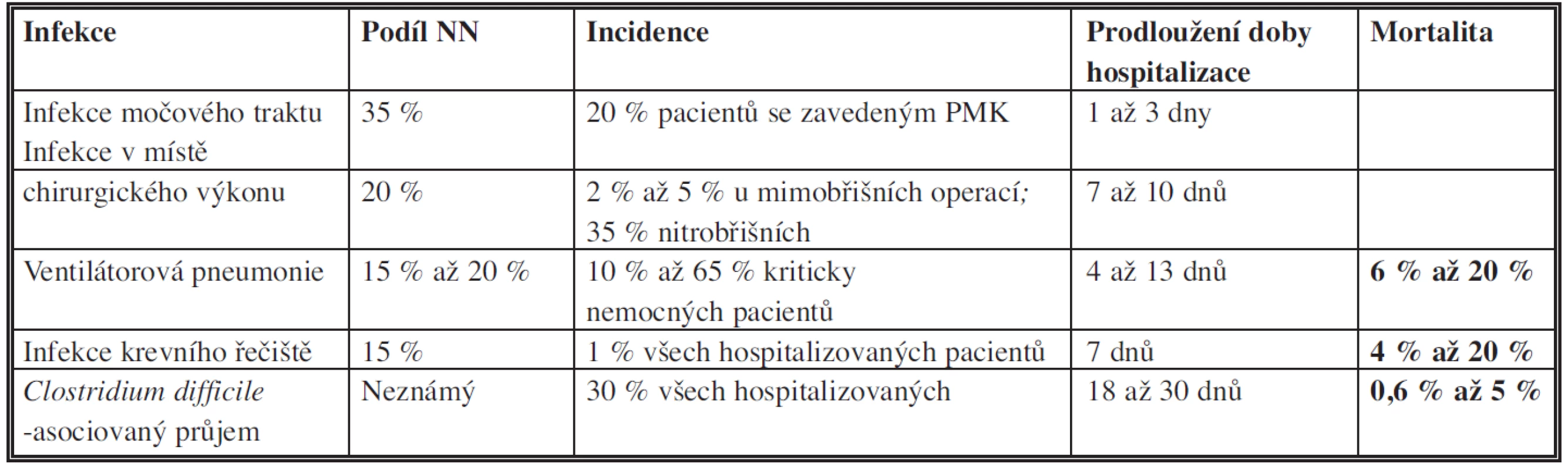
Zdravotnické prostředky
HCAI mohou být spojeny s různými typy používaných zdravotnických prostředků (přístrojů, pomůcek apod.). Na základě Spauldingovy klasifikace, přezkoumané Alvaradem, lze rozlišit tři kategorie zdravotnických prostředků [6]. Tato klasifikace vychází z rizika, které je s používáním daného prostředku spojeno v závislosti na míře invazivnosti.
- Nekritické použití (pouze styk s neporušenou kůží nebo bez styku s pacientem), např. vaničky, teploměry, manžety k měření krevního tlaku.
- Semikritické použití (styk s neporušenými sliznicemi bez pronikání do tkání), např. flexibilní endoskopy, laryngoskopy, endotracheální trubice.
- Kritické použití (chirurgické invazivní lékařské zákroky), např. katetry, implantáty, jehly, chirurgické nástroje.
Chirurgické zavádění implantátů je obecně spojeno s vysokým stupněm rizika infekce. Infekce spojené s implantací cizorodého materiálu (Tab. 4) jsou nejčastěji následkem kontaminace implantátu při zavádění. Dalším rizikovým faktorem je rozvoj biofilmu na povrchu implantátu během jeho užívání.
Tab. 4. Infekce spojené s implantací cizorodého materiálu [7] ![Infekce spojené s implantací cizorodého materiálu [7]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d0170fa7fa771c0fa9ce3ac3b047a48d.png)
Infekce v místě chirurgického výkonu [8]
Infekce v místě chirurgického výkonu tvoří až 40 % infekcí ve zdravotnických zařízeních s významným dopadem na morbiditu, mortalitu a prodlužují dobu hospitalizace. Frekvence SSI se v posledních letech relativně snížila, protože přibývá výkonů ambulantních a rozvíjí se tzv. jednodenní chirurgie. To znamená, že se zkracuje pooperační délka hospitalizace pod inkubační dobu rozvoje SSI, která je 5–7 dnů!
Frekvence výskytu infekcí po chirurgickém výkonu se různí v závislosti na klasifikaci ran a typu výkonu.
V době, kdy se neužívala antibiotická profylaxe, vyskytovaly se infekční komplikace v 1–2 % u čistých ran, v 6–9 % u čistých, kontaminovaných ran, ve 13–20 % u kontaminovaných ran a až ve 40 % u ran znečištěných. Po zavedení předoperační antibiotické profylaxe došlo k dramatickému poklesu výskytu SSI u ran čistých, čistých – kontaminovaných (3 %), kontaminovaných (6 %) a znečištěných ran (7 %). Míra výskytu infekčních komplikací u čistých ran se nezměnila.
Infekce v místě chirurgického výkonu se může rozvinout jak z endogenního, tak exogenního zdroje mikroorganismů. Tabulka 5 uvádí nejčastější původce SSI dle typu výkonu [9].
Tab. 5. Nejčastější původci infekcí v místě chirurgického výkonu 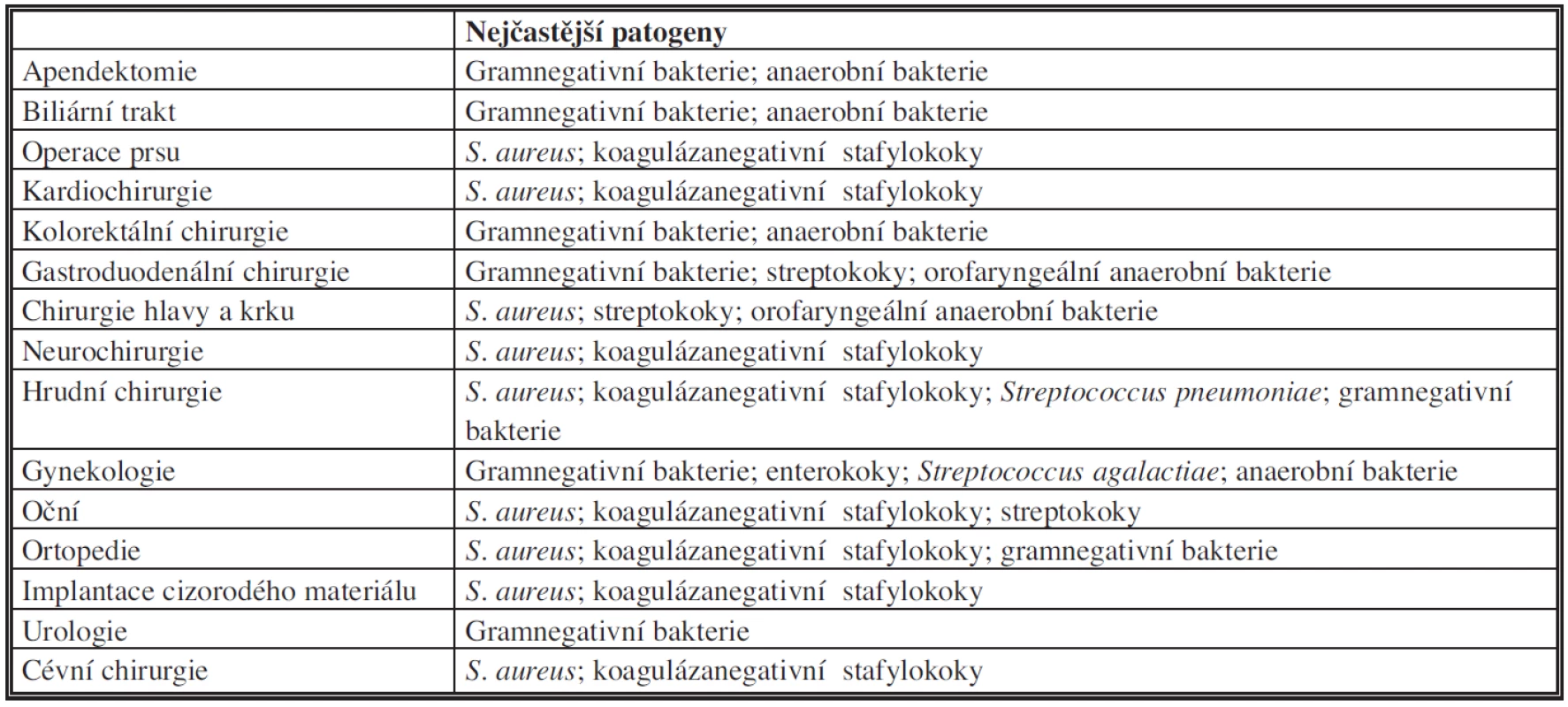
Klasifikace infekcí v místě chirurgického výkonu
- Povrchová incizní SSI
- Infekce nastupuje do 30 dnů po operaci a postihuje pouze kůži nebo podkožní část incize.
- Hluboká incizní SSI
- Infekce se objevuje do 30 dnů po operaci, jestliže nebyly v místě ponechány žádné cizorodé materiály, nebo do 1 roku, pokud byly umístěny implantáty a jeví se, že infekce souvisí s operací. Infekce postihuje hluboké měkké tkáně (např. fasciální a svalové vrstvy) v oblasti incize.
- SSI orgánu/orgánového prostoru
- Infekce se objevuje do 30 dnů po operaci, jestliže nebyly v místě ponechány žádné cizorodé materiály, nebo do 1 roku, pokud byly umístěny implantáty a jeví se, že infekce souvisí s operací. Infekce zasahuje jakoukoli anatomickou část (např. orgány nebo prostory) jinou než kůži, fascii, svaly v místě incize.
- Klasifikace infekce v místě chirurgického výkonu může být komplikovaná souběžným rozvojem povrchové a hluboké infekce.
- Teplota objevující se do 48 hodin po výkonu, stejně jako elevace CRP většinou nejsou důsledkem a známkou infekce v místě chirurgického výkonu, ale fyziologickou reakcí na operaci v rámci syndromu systémové zánětlivé odpovědi (SIRS)! Chybné pokračování v podávání profylaktických antibiotik nejenže tento stav neovlivní, ale naopak může setřít nastupující příznaky svědčící pro rozvoj následné infekce, obzvláště v případě rozsáhlých operačních výkonů v dutině břišní.
Močové infekce [10]
Infekce močových cest patří mezi nejčastější HCAI, tvoří asi 35 % těchto infekcí. Infekce močového traktu se rozvinou cca u 20 % pacientů se zavedeným permanentním močovým katetrem. Rizikové faktory rozvoje močové nozokomiální infekce shrnuje Tab. 2.
Nozokomiální infekce močového traktu jsou obvykle vyvolány gramnegativními bakteriemi, jako jsou Escherichia coli, Proteus mirabilis, Klebsiella spp.a Pseudomonas aeruginosa. Kvasinky bývají častou příčinou infekcí močového traktu na jednotkách intenzivní péče. Původce infekce je buď endogenní, nebo exogenní (zanesení personálem při zákroku, diagnostickém výkonu apod.). Většina nozokomiálních močových infekcí je vyvolána pouze jedním původcem.
Prevence nozokomiálních močových infekcí
Mezi nejdůležitější principy prevence patří:
- zavedení močového katetru pouze v nezbytně nutných případech
- aseptické techniky zavádění katetru
- správné zajištění katetru
- používat uzavřený sterilní systém
- udržovat nepřerušovaný tok moči
- moč odebírat asepticky
- odstranit katetr, jakmile je to možné
Kritéria symptomatické močové infekce:
- kritérium – alespoň jeden příznak z následujících (nevysvětlitelných jinou příčinou)
- teplota > 38 °C
- dysurie, suprapubická bolest/citlivost, naléhavost, frekventnost
- plus pozitivní kultivační nález (≥ 105 bakterií/ml moči, ne více než dva bakteriální druhy
- kritérium – alespoň jeden příznak z následujících (nevysvětlitelných jinou příčinou)
- teplota > 38 °C
- dysurie, suprapubická bolest/citlivost, naléhavost, frekventnost
Plus alespoň jeden příznak z následujících:
- pozitivní test na přítomnost leukocytesterázy a/nebo nitrátů
- pyurie (≥ 10 leukocytů/mm3)
- alespoň dva vzorky moči s opakovaným nálezem stejného uropatogenu (gramnegativní bakterie nebo S. saprophyticus) v kvantitě ≥102/ml
- bakteriurie ≤105/ml jednoho uropatogenu u pacienta přeléčeného antibiotiky s efektem na původce močových infekcí
- podezření ošetřujícího lékaře na močovou infekci
- Při přetrvávající infekci je nutné zopakovat kultivační vyšetření moči. Perzistující infekce může vést k infekci dalších orgánů genitouretrálního traktu, popř. gramnegativní sepsi u vysoce rizikových pacientů [11].
Pneumonie [12,13,14,15]
Pneumonie tvoří asi 15–20 % všech HCAI. Výskyt je vyšší u kriticky nemocných pacientů a je 6 až 20krát vyšší u pacientů vyžadujících umělou plicní ventilaci, označuje se jako ventilátorová pneumonie VAP (ventilator-associated pneumonia). VAP je definována jako pneumonie rozvíjející se během 48 hodin po intubaci. VAP se rozvine asi u 9–27 % zaintubovaných pacientů a 25 až 60 % úmrtí v příčinné souvislosti s nozokomiální nákazou může být spjato s ventilátorovou pneumonií. Dopad na morbiditu, mortalitu a náklady na léčbu jsou jedny z nejvyšších v rámci HCAI. Téměř polovina VAP se rozvine během prvních čtyř dnů od zahájení UPV.
Odlišení komunitní pneumonie a pneumonie získané ve zdravotnickém zařízení může být obtížné v případě, kdy krátce po přijetí pacienta je vyžadována invazivní podpora dýchacích funkcí. Při klasifikaci pneumonie a následném managementu léčby je důležitá anamnéza pacienta, zvláště pak předchozí pobyt v jiném zdravotnickém zařízení, popřípadě v ústavu sociální péče nebo v domově pro seniory. Pneumonie u takovýchto pacientů bývají většinou vyvolány rezistentními kmeny bakterií, a proto je třeba zahájit adekvátní léčbu s ohledem na spektrum možných původců a předpokládanou rezistenci. Riziko ventilátorové pneumonie koreluje s délkou trvání intubace. Asi polovina VAP se rozvine během prvních čtyř dnů mechanické ventilace. Ostatní rizikové faktory jsou shrnuty v Tab. 2.
Mnoho případů nozokomiální pneumonie je vyvoláno aspirací bakterií osídlujících orofarynx. Asi 50 % všech případů VAP se rozvíjí u pacientů po chirurgických výkonech, mezi nejrizikovější patří kardiochirurgické výkony a operace plic [16]. Ve studii na více než 3600 pacientech přijatých na JIP byla původcem pneumonie P. aeruginosa u 25 %, MRSA u 18 % a Acinetobacter spp. u 6 % z nich [17]. Rizikovými faktory rozvoje VAP byla předchozí ATB terapie nebo předchozí hospitalizace. Další studie prokázaly, že S. aureus je nejčastějším původcem u pacientů v kómatu, s diabetem nebo renálním selháním. P. aeruginosa je nejčastější u pacientů dlouhodobě hospitalizovaných na JIP, u pacientů po předchozí ATB nebo kortikosteroidové terapii, popř. u pacientů se strukturálními plicními změnami.
Prevence
U všech pacientů s vysokým stupněm rizika rozvoje těžké nozokomiální pneumonie je doporučená pneumokoková vakcinace. U pacientů, kteří nejsou mechanicky ventilováni, je možné snížit riziko vzniku pooperační pneumonie několika různými strategiemi, jako jsou:
- hluboké dýchání
- časté kašlání
- včasná rehabilitace na lůžku (popř. chůze)
- minimalizace užívání sedativ
U ventilovaných pacientů je vysoce rizikovým faktorem rozvoje VAP doba trvání mechanické ventilace, proto je primárním cílem prevence včasná extubace pacienta. Během UPV je nutná správná aseptická péče o celý ventilační okruh.
K opatřením vedoucím k signifikantnímu snížení rizika aspirace patří polohování pacienta, zvýšení horní poloviny těla o 30–45 %. Péče o dutinu ústní je důležitá vzhledem k souvislosti mezi zubním plakem a kolonizací S. aureus, enterobakterie a P. aeruginosa. Orální dekontaminace chlorhexidinem vede k signifikantní redukci kolonizace orofaryngu, ale tyto intervence nemají výrazný efekt na rozvoj VAP ani s ní spojenou mortalitu.
Diagnostika nozokomiální pneumonie je obtížná. Klinické příznaky mohou být vyvolány i neinfekčními podmínkami a specificita klinických kritérií je nízká. Dle CDC definice je diagnóza u dospělého pacienta založená na klinických příznacích, výsledcích laboratorních testů či zobrazovacích metod a musí splňovat jedno z následujících kritérií:
- kritérium – chrůpky nebo poklepové ztemnění
- při fyzikálním vyšetření hrudníku a alespoň jedno z následujících:
- nově se objevující purulentní sputum nebo změny v charakteru sputa
- infekční agens izolované z hemokultury
- etiologické agens izolované z BALu, tracheálního aspirátu, biopsie
- kritérium – nový nebo progredující infiltrát na rtg snímku hrudníku, konsolidace, kavitace nebo pleurální výpotek a alespoň jedno z následujících:
- nově se objevující purulentní sputum nebo změny v charakteru sputa
- infekční agens izolované z hemokultury
- etiologické agens izolované z BALu, tracheálního aspirátu, biopsie
- izolace viru nebo virového antigenu ze sekretů DCD histopatologický průkaz pneumonie
V roce 2005 byla přijata nová klinická kritéria pro diagnostiku pneumonie, která zahrnují více invazivních postupů, jsou finančně náročnější, ale léčba na nich založená je efektivnější. Tato kritéria zahrnují přítomnost nového nebo perzistujícího (více než 48 hod.) infiltrátu a alespoň jedno z následujících:
- radiologicky potvrzená přítomnost kavit nebo nekróz
- histologicky ověřená pneumonie
- kultivačně pozitivní pleurální výpotek nebo hemokultura se shodným mikroorganismem jako v sekretech z DCD
Plus dva z následujících příznaků:
- tělesná teplota vyšší než 38,3 °C
- počet leukocytů více než 10 tis./ml
- purulentní tracheální sekrece
Odběr klinického materiálu z dolních dýchacích cest na kultivaci by měl být získán při bronchoskopii a kultivační vyšetření by mělo být kvantitativní nebo alespoň semikvantitativní.
Infekce gastrointestinálního traktu
Infekce GIT u dospělých pacientů ve zdravotnických zařízeních jsou nejčastěji vyvolány Clostridium difficile. Prevalence a zejména závažnost klostridiových infekcí se v posledních letech zvýšila. U některých pacientů dochází pouze ke kolonizaci C. difficile, ale až produkce toxinů vede k rozvoji zánětu a následnému poškození střevní stěny mající za následek průjem nebo kolitidu. Onemocnění může progredovat do toxického megakolon, sepse s možnou perforací střeva a smrtí pacienta.
C. difficile se přenáší fekálně-orální cestou. Šíří se kontaktem s povrchy, nástroji nebo materiály kontaminovanými stolicí. Primárním rizikovým faktorem infekce C. difficile je antibiotická léčba; více než 90 % nozokomiálních infekcí vyvolaných C. difficile je spjato s užíváním antibiotik [18].
Katetrové infekce krevního řečiště [19,20,21,22]
Infekce krevního řečiště (IKŘ) se mohou rozvinout jako komplikace jakékoliv jiné HCAI nebo infekce na dalších místech těla, ale téměř polovina IKŘ je důsledkem intravazálních kanyl/katetrů, především centrálního žilního katetru (CŽK). Katetrové IKŘ tvoří asi 15 % všech nozokomiálních infekcí a postihnou asi 1 % všech hospitalizovaných pacientů. Náklady spojené s těmito infekcemi jsou nejvyšší v rámci HCAI s atributivní mortalitou 18 %. Riziko rozvoje katetrové IKŘ se liší dle typu použitého katetru. Mezi nejrizikovější patří netunelované CŽK, asi 90 % katetrových IKŘ je k nim vztaženo. Riziko je vyšší při zavedení katetru do v. jugularis interna. V případě periferních kanyl je rizikovější arteriální než žilní kanyla. Mezi další rizikové faktory patří klinický stav pacienta a délka zavedení kanyly. Místo zavedení kanyly není rizikovým faktorem v případě zkušeného personálu, který kanylaci provádí, přesto je doporučena v. subclavia jako preferenční místo zavedení CŽK z hlediska nejnižšího rizika vzniku infekce.
Příčiny katetrových IKŘ jsou jak endogenní, tak exogenní. Nedodržení aseptické techniky může vést ke kontaminaci kanyly kožní mikroflórou pacienta nebo rukama personálu a rozvoji IKŘ do týdne po zavedení. Kontaminace infuzních roztoků je vzácná, ale je nejčastější příčinou epidemických katetrových infekcí.
Prevence[23]
Hygiena rukou a aseptická technika zavádění kanyly jsou základem prevence IKŘ. Dále je třeba školit a trénovat personál, který kanylaci provádí, k používání 2% chlorhexidinu k dezinfekci místa inzerce, používání impregnovaných kanyl a vyhýbání se rutinní výměně CŽK, je-li riziko infekčních komplikací vysoké. Např. používání katetrů impregnovaných minocyklinem s rifampicinem na interních a chirurgických JIP vedlo k signifikantnímu snížení výskytu nozokomiálních IKŘ, katetrových infekcí a zkrátilo pobyt na JIP i celkovou délku hospitalizace, což v konečném důsledku bylo nákladově efektivnější i při vyšší ceně těchto katetrů. Přestože CDC doporučení jsou jasná, má je zahrnuto do svých rutinních postupů pouze malé procento jednotek intenzivní péče [24].
Diagnóza
Dle CDC patří mezi IKŘ laboratorně prokázaná infekce krevního řečiště a sepse definovaná klinicky.
Pro diagnózu laboratorně prokázané IKŘ musí být splněno jedno z následujících kritérií:
- kritérium – původce v jedné nebo více hemokulturách a vykultivovaný původce nemá vztah k infekci v jiném místě
- kritérium – alespoň jeden z uvedených příznaků:
- teplota > 38 °C
- zimnice
- hypotenze
- a známky, příznaky a laboratorní nálezy, které nemají vztah k jinde probíhající infekci.
Klinická diagnóza sepse u dospělého je založena na výskytu alespoň jednoho příznaku z následujících:
- teplota > 38 °C
- hypotenze
- oligurie
a hemokultura nebyla odebrána nebo nebyl prokázán žádný původce infekce v krvi a nikde neprobíhá žádná jiná zjevná infekce.
Evaluace těchto definic prokázala, že pouze 29 % primárních IKŘ je dokumentováno mikrobiologicky, což svědčí pro podhodnocení aktuální incidence těchto infekcí. Vzhledem k výše uvedenému je třeba zvolit co možná nejvýtěžnější kultivační techniky. Jako nejpřesnější se jeví kultivace párových hemokultur, se specifitou až 99 %, následována kvalitativní kultivací krve odebrané z katetru.
V případě bakteriemie/fungemie je důležité katetr odstranit nebo vyměnit, vyžaduje-li to stav pacienta. Špičku katetru je nutné zaslat k mikrobiologickému vyšetření. Jestliže příznaky infekce přetrvávají i po odstranění katetru, je nutné pátrat po jiném zdroji, např. endokarditidě, která bývá prokázána až u 25 % pacientů s katetrovou IKŘ vyvolanou S. aureus.
Principy antiinfekční terapie HCAI
Vzhledem k výše uvedenému nelze stanovit jednoznačný algoritmus či doporučený postup pro léčbu těchto infekcí. Vyvolávající původci byli zmíněni, avšak existují značné regionální rozdíly v citlivosti daných mikroorganismů, nejčastěji bakterií, k antibiotikům. Neustálá a pravidelná monitorace pacientů je proto důležitým předpokladem správné indikace antibiotické terapie, především aktivní screening na přítomnost multirezistentních (MDR – multi drug resistant) bakterií.
Pojem „multirezistentní bakterie“ zahrnuje heterogenní skupinu bakterií, které vykazují získanou necitlivost k jedné nebo více antimikrobním látkám ze tří a více různých, klinicky relevantních tříd antibiotik. Politika aktivního screeningu MDR bakterií se liší v různých zdravotnických zařízeních a je určována týmem pro kontrolu infekcí (TKI) [25]. Klasicky se mezi MDR bakterie řadí methicilin rezistentní S. aureus, vankomycin rezistentní enterokoky, enterobakterie rezistentní k třetí/čtvrté generaci cefalosporinů a nově se objevivší kmeny rezistentní ke karbapenemům, P. aeruginosa rezistentní k ceftazidimu a/nebo karbapenemům v důsledku produkce metallo-betalaktamáz a multirezistentní Acinetobacter baumanii. Schopnost ostatních multirezistentních bakterií vyvolat závažné epidemie je daleko nižší, proto jejich aktivní vyhledávání je dáno především lokální epidemiologií. Neexistuje univerzální vzorek biologického materiálu, který by ukázal kolonizaci daného pacienta, tabulka 6 ukazuje výtěžnost jednotlivých vzorků vzhledem k předmětu zájmu. Negativní výsledek screeningu nevylučuje možnost přítomnosti MDR bakterií. Výsledek screeningového vyšetření nás informuje o přítomnosti mikroorganismů ve vyšetřovaném vzorku, ale není důkazem přítomnosti infekce, jak je mnohdy mylně interpretováno. Definiční kritéria HCAI jsou zmíněna v textu a pouhá přítomnost multirezistentních bakterií (MRSA, VRE apod.) není indikací k zahájení antibiotické terapie, protože se jedná o kolonizaci pacienta [26]!
Tab. 6. Doporučené indikace klinických vzorků z hlediska výtěžnosti vyšetření [27] ![Doporučené indikace klinických vzorků z hlediska výtěžnosti vyšetření [27]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/30ea2504d2f26b6ea42e822bd9e6bad1.png)
V době narůstající rezistence bakterií k antibiotikům nelze predikovat citlivost původce, stejně tak není vhodné přejímat data o bakteriální rezistenci ze zahraničí, protože neodrážejí lokální epidemiologickou situaci. Bohužel neexistují data o citlivosti/rezistenci bakterií, které jsou původci infekcí spojených s poskytovanou zdravotní péčí, neboť vysoký výskyt bakteriální rezistence je stále managementem mnohých zdravotnických zařízení vnímán velmi negativně, a proto se tyto údaje neprezentují. Na druhé straně znalost epidemiologické situace je prvním krokem k možné nápravě.
Česká republika je sice zapojena do evropské sítě EARS-Net (European Antimicrobial Resistance Surveillance Network), kde jsou shromažďována data o citlivosti bakteriálních kmenů Escherichia coli, Enterococcus faecalis, Enterococcus faecium, Staphylococcus aureus, Streptococcus pneumoniae, Klebsiella pneumoniae a Pseudomonas aeruginosa izolovaných z hemokultur, popř. z mozkomíšního moku, avšak nelze z těchto údajů odlišit komunitní nebo nozokomiální původ izolátů. Přesto jsou uveřejněná data velmi alarmující, obzvláště v případě gramnegativních tyčinek, kde rezistence dramaticky narůstá. Obr. 1, 2, 3, 4, 5, 6. Informace jsou volně přístupné na adrese www.szu.cz/earsnet. K dispozici jsou data za rok 2011.
Obr. 1. Rezistence izolátů <i>Escherichia coli</i> k cefalosporinům 3. generace z hemokultur v roce 2011 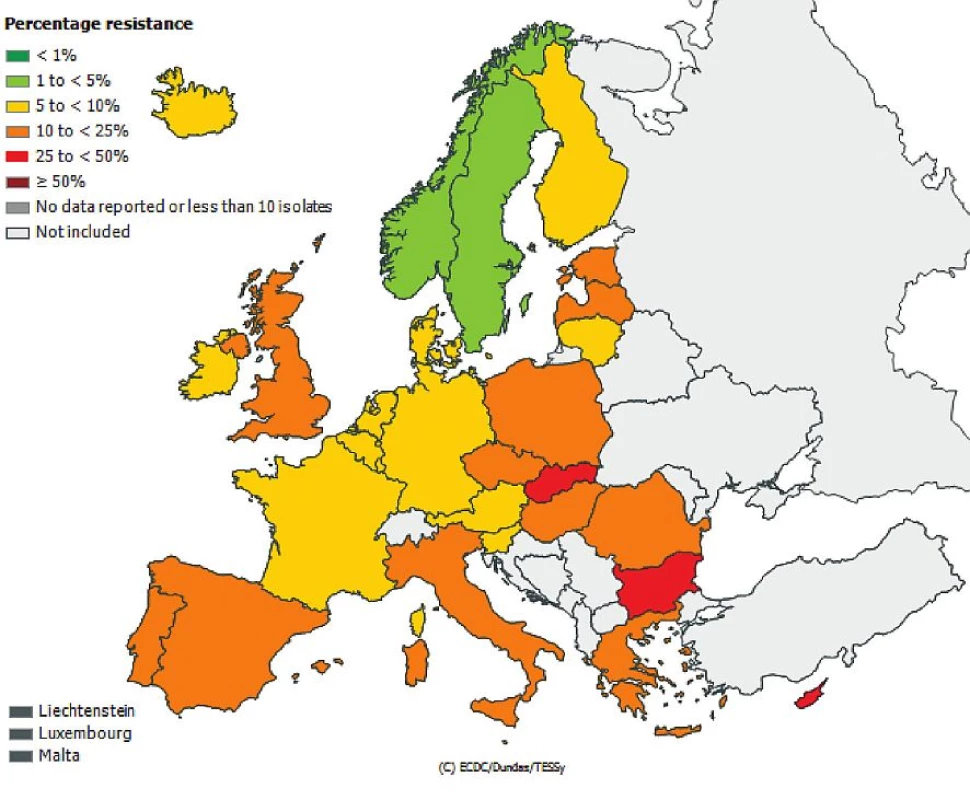
Obr. 2. Rezistence izolátů <i>Escherichia coli</i> k fluorochinolonům z hemokultur v roce 2011 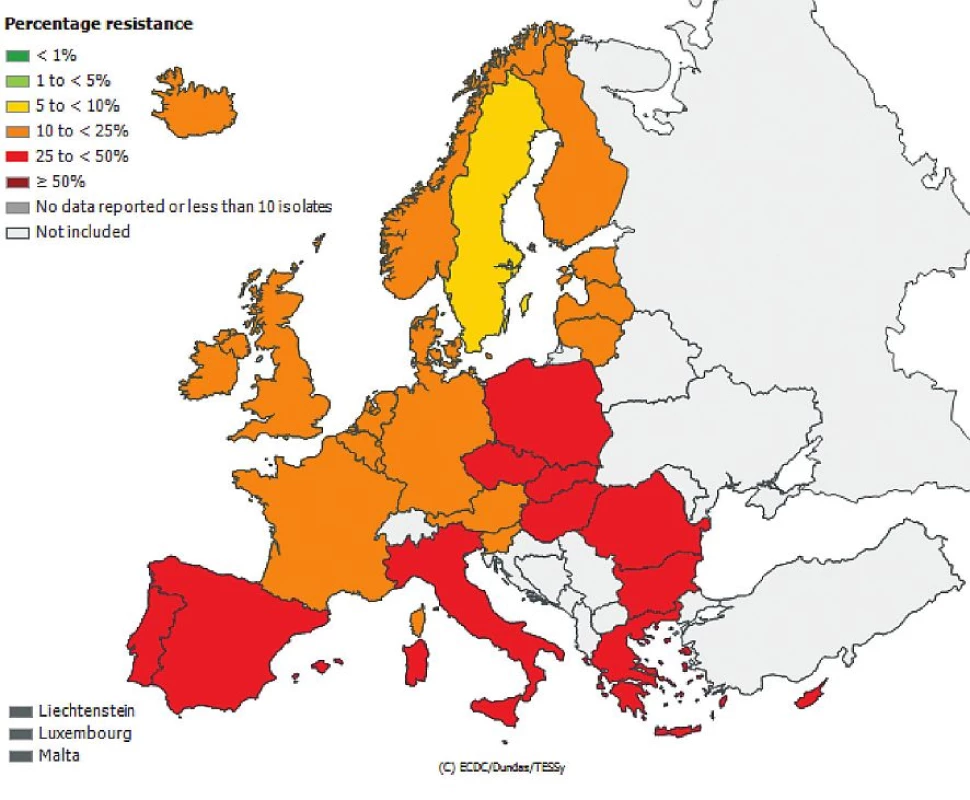
Obr. 3. Rezistence izolátů <i>Klebsiella pneumoniae</i> k cefalosporinům 3. generace z hemokultur v roce 2011 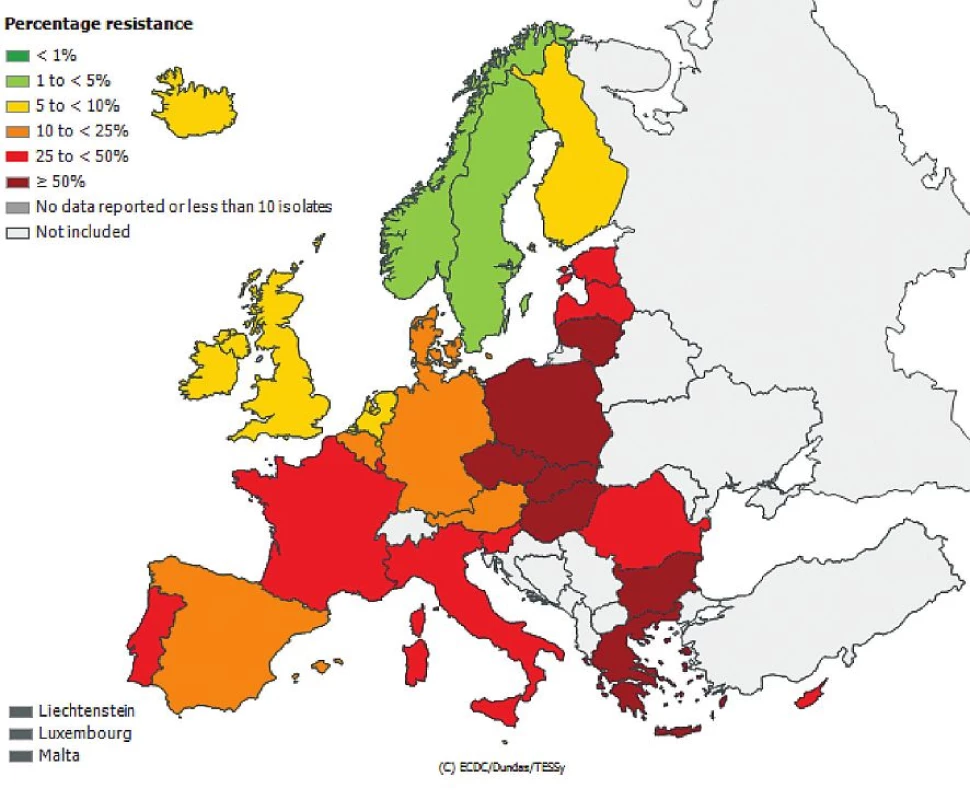
Obr. 4. Rezistence izolátů <i>Klebsiella pneumoniae</i> k fluorochinolonům z hemokultur v roce 2011 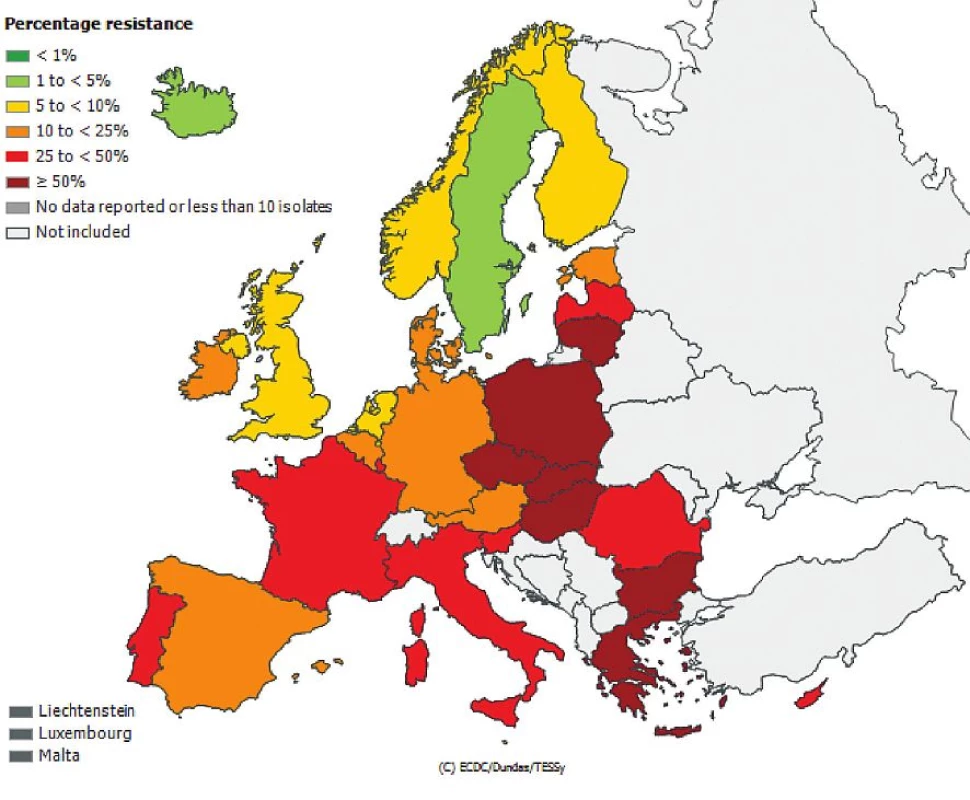
Obr. 5. Výskyt multirezistentních izolátů <i>Klebsiella pneumoniae</i> z hemokultur v roce 2011 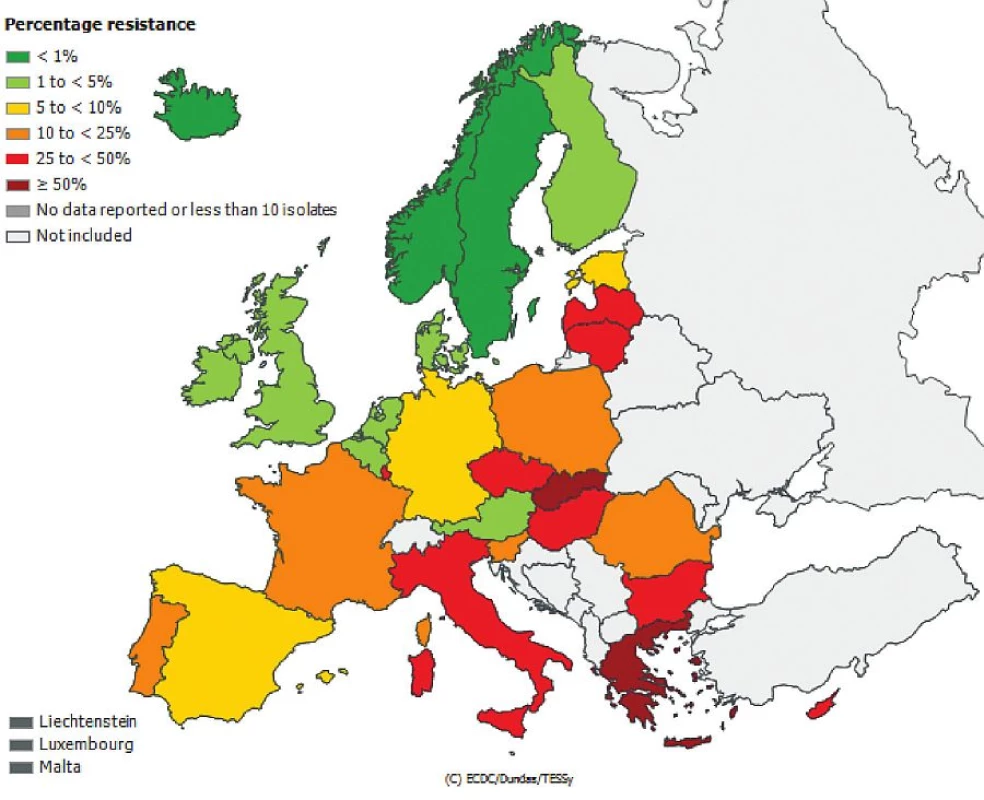
Obr. 6. Výskyt methicilin rezistentních kmenů <i>Staphylococcus aureus</i> (MRSA) v hemokulturách v roce 2011 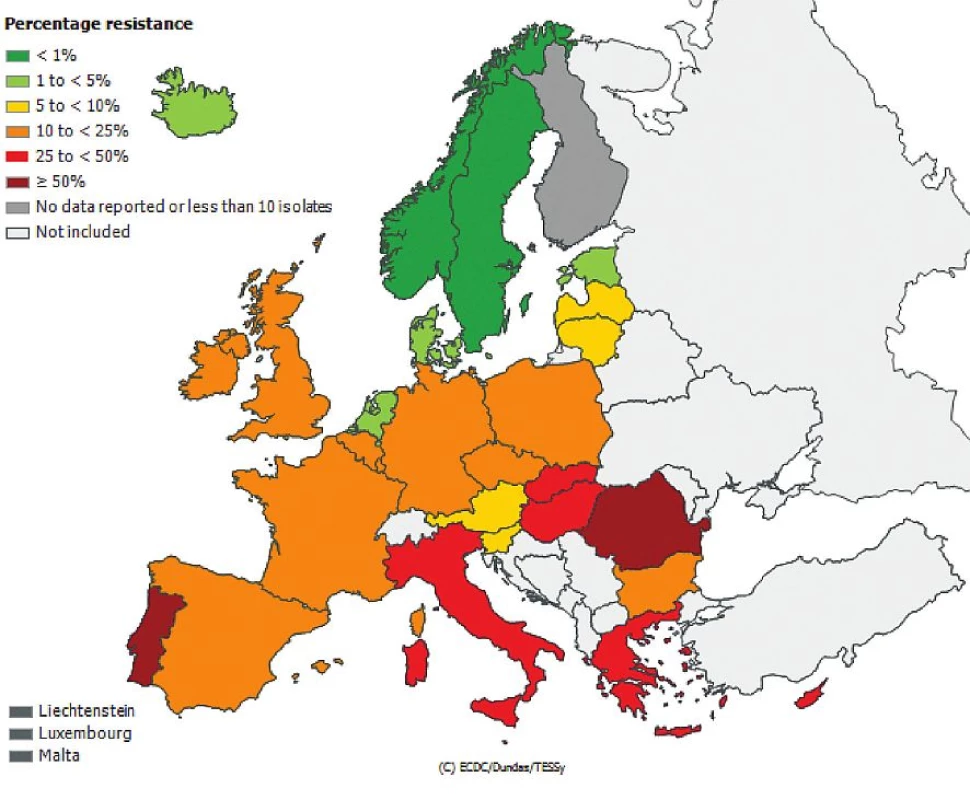
Prim. MUDr. Václava Adámková
Klinická mikrobiologie a ATB centrum ÚLBLD VFN
Ke Karlovu 2
128 00 Praha 2
e-mail: Vaclava.Adamkova@vfn.cz
Zdroje
1. Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care-associated infection and criteria for specific types of infections in the acute care setting. Am J Infect Control 2008;36,5 : 309–332.
2. World Health Organization. Prevention of Hospital-Acquired Infections. A Practical Guide, 2nd ed. Geneva, WHO Press 2002.
3. Clark AP, John LD. Nosocomial infections and bath water. Any cause for concern? Clin Nurse Spec 2006;20,3 : 119–123.
4. Farr B. Prevention and control of nosocomial infections. In: WMA Business Briefing: Global Healthcare 2002;3 : 37–41.
5. Merle V, Hallais C, Tavolacci MP, et al. Validity of medical staff assessment at admission of patient’s risk of nosocomial infection: A prospective study in a surgical intensive care unit. Intensive Care Med 2006;32,6 : 915–918.
6. Alvarado CJ. Revisiting the Spaulding classification scheme. In: Rutala WA, editor. Chemical germicides in healthcare. Washington DC, APIC 1994;203–208.
7. Vinh DC, Embil JM.: Device-related infections: a review. J Long-Term Effects Med Implants 2005;15,5 : 467–488.
8. Odom-Forren J.: Preventing surgical site infections. Nursing 2006; 36,6 : 58–63.
9. Mangram AJ, Horan TC, Pearson ML, Silver LC, Jarvis WR. The Hospital Infection Control Practices Advisory Committee. Guideline for prevention of surgical site infection. Infect Cont Hosp Epidemiol 1999;20,4 : 247–264.
10. Wong ES, Hooton TM. Guideline for prevention of catheter-associated urinary tract infections. CDC. Available at http://www.cdc. gov/ncidod/dhqp/gl_catheter_assoc.html.
11. Garner JS, Jarvis WR, Emori TG, Horan TC, Hughes JM. CDC definitions for nosocomial infections, 1988. Am J Infect Control 1988;16,3 : 128–140.
12. Kollef MH. What is ventilator-associated pneumonia and why is it important? Respir Care 2005; 50,6 : 714–721.
13. Kollef MH, Morrow LE, Niederman MS, et al. Clinical characteristics and treatment patterns among patients with ventilator-associated pneumonia. Chest 2006;129,5 : 1210–1218.
14. Depuydt P, Myny D, Blot S.: Nosocomial pneumonia: aetiology, diagnosis and treatment. Curr Opin Pulm Med 2006; 12,3 : 192–197.
15. Craven DE, Chroneou A, Zias N, Hjalmarson KI. Ventilator-associated tracheobronchitis: the impact of targeted antibiotic therapy on patient outcomes. Chest 2009; 135,2 : 521–528.
16. Burke JP. Infection Control — A Problem for Patient Safety. N Engl J Med 2003;348,7 : 651–656.
17. Flanders SA, Collard HR, Saint S. Nosocomial pneumonia: State of the science. Am J Infect Control 2006;34,2 : 84–93.
18. Sunenshine RH, McDonald LC: Clostridium difficile-associated disease: new challenges from an established pathogen. Clev Clin J Med 2006;73,2 : 187–197.
19. Hugonnet S, Sax H, Eggimann P, Chevrolet J-C, Pittet D. Nosocomial bloodstream infection and clinical sepsis. Emerg Infect Dis. 2004;10,1 : 76–81.
20. Chen HS, Wang FD, Lin M, Lin YC, Huang LJ, Liu CY. Risk factors for central venous catheter-related infections in general surgery. J Microbiol Immunol Infect. 2006;39,3 : 231–236.
21. Lessa FC, Mu Y, Ray SM, Dumyati G, Bulens S, Gorwitz RJ, et al. Impact of USA300 Methicillin-Resistant Staphylococcus aureus on Clinical Outcomes of Patients With Pneumonia or Central Line-Associated Bloodstream Infections. Clin Infect Dis 21, 2012.
22. Timsit JF, Bouadma L, Ruckly S, Schwebel C, Garrouste-Orgeas M, Bronchard R, et al. Dressing disruption is a major risk factor for catheter-related infections*. Crit Care Med 2012;40,6 : 1707–1714.
23. Guidelines for the prevention of intravascular catheter-related infections. CDC. Available at http://www.cdc.gov/mmwr/PDF/ rr/rr5110.pdf.
24. Institute for Healthcare Improvement. Getting started kit: prevent central line-associated bloodstream infection. How to guide. Available at: http://www.ihi.org/IHI/Programs/Campaign/
25. Brossette SE, Hacek DM, Gavin PJ, et al. A laboratory-based, hospital-wide, electronic marker for nosocomial infection: The future of infection control surveillance? Am J Clin Pathol 2006;125,1 : 34–39.
26. Henderson DK. Managing methicillin-resistant staphylococci: a paradigm for preventing nosocomial transmission of resistant organisms. Am J Med 2006;119(6 Suppl 1):45–52,62–70.
27. Cornaglia G, Courcol R, Herrmann JL, et al. European Manunual of Clinical Microbiology, 1st ed, Marne 2012.
28. www.szu.cz/earsnet.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Lerichův syndromČlánek Infekce chirurgického místa
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2013 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Profesor René Adam a PragueONCO 2013
- Syndrom břišního kompartmentu – přehled současných znalostí, diagnostiky a řešení
- Operace na vnitřních karotidách v lokoregionální anestezii na chirurgické klinice v Plzni za uplynulých 10 let (2002–2011)
- Lerichův syndrom
- Mediastinitida po perforaci jícnu
- Transplantace ledvin od dárců zemřelých na intoxikaci metanolem
- Kombinovaný výkon plicní resekce a radiofrekvenční ablace nádorů plic – kazuistiky
- K nedožitému 80. jubileu profesora Jaroslava Michka
- Duplikatura žlučníku – vzácný nález
- Životní jubileum profesora Jiřího Valenty
- Zpráva z jednání redakční rady Rozhledů v chirurgii dne 6. 3. 2013
- Infekce chirurgického místa
- Nozokomiální infekce – infekce spojené s poskytovanou zdravotní péčí
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Lerichův syndrom
- Nozokomiální infekce – infekce spojené s poskytovanou zdravotní péčí
- Infekce chirurgického místa
- Syndrom břišního kompartmentu – přehled současných znalostí, diagnostiky a řešení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



