-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současná mikrochirurgická a neurointervenční terapie mozkových aneuryzmat
Current microsurgical and neurointerventional therapy of cerebral aneurysms
Cerebral aneurysms occur in 5% of the adult population. Their most severe clinical manifestation is subarachnoid haemorrhage occurring in half of the patients. Morbidity and mortality of subarachnoid hemorrhage is relatively high. Stopping blood flow into the aneurysmal sac is the treatment objective. The basic techniques to achieve this are closing the aneurysmal neck with a clip – clipping – and the induction of intraaneurysmal thrombosis using platinum coils – coiling. Fusiform and giant aneurysms represent a technical challenge. The solution for indicated cases is the occlusion of the magistral artery along with a high-flow bypass. A new option is the use of special stents – flow-diverters – in unruptured aneurysms.
The authors present the current view on the treatment of both ruptured and unruptured aneurysms. At the same time the authors focus on factors that influence the application of up-to-date knowledge on everyday activities in their departments.Key words:
intracranial aneurysms – unruptured, subarachnoid haemorrhage – microsurgical therapy – endovascular treatment
Autoři: V. Přibáň 1,2; M. Choc 1; J. Mraček 1; V. Runt 1; J. Fiedler 2; P. Duras 3
Působiště autorů: Neurochirurgické oddělení, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Plzni, primář: MUDr. V. Přibáň, Ph. D. 1; Neurochirurgické oddělení, Nemocnice České Budějovice, a. s., primář: MUDr. V. Chlouba. 2; Klinika zobrazovacích metod, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Plzni, přednosta: Doc. MUDr. B. Kreuzberg CSc. 3
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 11, s. 588-596.
Kategorie: Souhrnné sdělení
Souhrn
Mozková aneuryzmata se vyskytují u dospělé populace v 5 %. Jejich nejzávažnějším klinickým projevem je subarachnoidální krvácení, které nastává u poloviny výdutí. Morbidita a mortalita subarachnoidálního krvácení je vysoká. Principem ošetření výdutě je eliminace krevního toku do vaku výdutě. Základní techniky, kterými toho lze dosáhnout, jsou zaklipování krčku výdutě svorkou – kliping a navození trombózy uvnitř vaku pomocí platinových spirálek – coiling. Fuziformní a gigantická aneuryzmata představují technickou výzvu. Řešení v indikovaných případech přináší uzavření magistrální tepny s vytvořením vysokoprůtokového bypassu. Novou alternativou je u neprasklých výdutí využití speciálních stentů – flow diverterů.
Autoři prezentují současný pohled na ošetření prasklých a neprasklých aneuryzmat. Zároveň se zaměřují na faktory, které ovlivňují aplikaci současných znalostí při každodenním provozu na vlastním pracovišti.Klíčová slova:
intrakraniální aneuryzmata – neprasklá, subarachnoidální krvácení – mikrochirurgická léčba – endovaskulární terapieÚvod
Chirurgická a intervenční terapie mozkových výdutí je jednou z nejobtížnějších oblastí v neurochirurgii. Prevalence aneuryzmat v dospělé populaci je 5 procent [1]. Na vzniku výdutě se podílí kombinace endogenních a exogenních faktorů. Klíčovým endogenním faktorem je genetický defekt tunica media cévní stěny vaku. Ze zevních faktorů se uplatňuje kouření, abusus alkoholu a zejména faktor hemodynamiky krevního proudu. Jeho vliv se projeví v případě hypoplazie nebo okluze kontralaterální tepny a může dát vznik „de novo” aneuryzmatu [2]. Oblast, kde vystupuje výduť z mateřské cévy, se nazývá krček. Krček bývá obvykle užší než vlastní fundus vaku. Poměr krček:vak je zásadním parametrem pro volbu terapeutické modality. Morfologicky se vyskytují kromě typických sakulárních aneuryzmat výdutě fuziformní. Ty bývají velmi často velké až gigantické a jsou obtížně řešitelné. Podle velikosti rozlišujeme výdutě malé do 7 mm, střední 7–12 mm, velké 13–24 mm a gigantické nad 25 mm. Tato zdánlivě nelogická terminologie vyplývá z měrných jednotek angloamerické oblasti, v tomto případě se jedná o palce.
Většina aneuryzmat je lokalizována supratentoriálně. Nejčastější zastoupení výdutí v naší populaci je v oblasti přední komunikující tepny, vnitřní karotidy a střední mozkové tepny. Výdutí v zadní jámě je přibližně 15 % z celkového počtu a jsou dominantně na zakončení bazilární tepny. Diagnostika vlastních aneuryzmat se v minulosti prováděla paušálně s využitím digitální subtrakční angiografie, která byla v současnosti převážně nahrazena méně invazivní CT angiografií (Obr. 1).
Obr. 1. Gigantická výduť v terminální oblasti bazilární tepny na CT angiografii Fig. 1: Giant aneurysm of the basilar tip on CT angiography 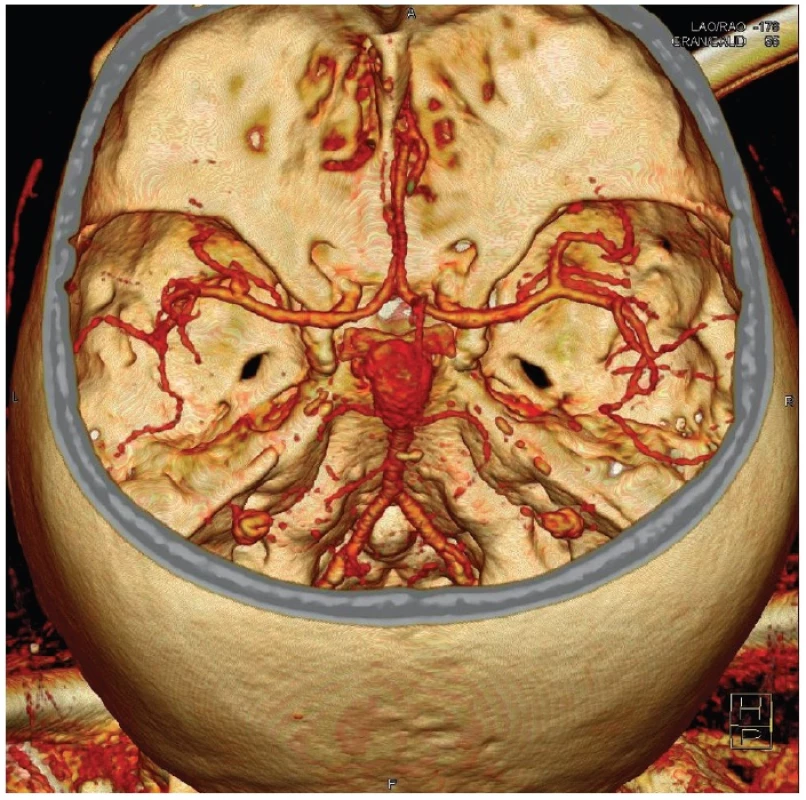
Subarachnoidální krvácení coby důsledek ruptury výdutě je v akutním stavu suverénně detekovatelné na CT. Nicméně pokud nastala mezi rupturou a vyšetřením prodleva několika dní, může být krev ze subarachnoidálních prostor již vymyta a CT je potom negativní. V takovém případě je přínosná lumbální punkce s nálezem xantochromního moku a spektrofotometrickým průkazem krve v likvoru.
Ne každé aneuryzma je symptomatické. Nejzávažnějším klinickým projevem je subarachnoidální krvácení z ruptury výdutě, které nastává přibližně u poloviny aneuryzmat [3].
Klinické projevy subarachnoidálního krvácení jsou obecně známé. Vzniká náhlá prudká bolest hlavy spolu s meningeálnímí příznaky. Iniciální stupeň poruchy vědomí je významným prognostickým faktorem pro celkový výsledek a také pro indikaci intervence. Pacienti v kómatu mají zlou prognózu. Subarachnoidální krvácení může být provázeno ve 20–40 % krvácením intracerebrálním, ve 13–28 % krvácením intraventrikulárním a ve 2–5 % krvácením subdurálním [4]. Intracerebrální hematom je typický pro rupturu výdutě střední mozkové tepny.
Dopad subarachnoidálního krvácení z mozkové výdutě na osud pacientů je velký; 15 % pacientů umírá po příhodě ještě před možným ošetřením a 30denní mortalita dosahuje 50 % [5]. Kromě iniciálního inzultu se na morbiditě/mortalitě podílí klinický vazospazmus (DIND – delayed ischaemic neurological deficit). Vazospazmus je reakcí cév na rozpadové produkty krevního barviva. Je detekovatelný transkraniálním dopplerem nepřímo podle rychlosti toku a přímo angiografií. Platí úměra, že čím je větší objem krve v subarachnoidálních prostorách, tím je riziko vazospazmu větší. Zdaleka ne vždy se morfologické změny projeví klinicky. Morfologické známky vazospasmu (detekovatelné na angiografii) jsou přítomny u 30–70 procent pacientů, zatímco klinické symptomy se projeví pouze přibližně u poloviny. Klinický vazospasmus nastává v intervalu 4.–12. den po krvácení a zodpovídá za 14% morbiditu/mortalitu [6]. Recidiva subarachnoidálního krvácení z výdutě, která nebyla akutně vyřazena z cirkulace, je 1. den 4 %, následných 14 dní 1,5 %/den. 50 % výdutí znovu praskne do 6 měsíců. Poté se riziko ruptury snižuje na 3 %/rok [7]. Tato fakta vedla k přehodnocení načasování intervencí (viz výsledky). Klinickým projevem výdutě může být méně často komprese nervových struktur. Může se jednat o varovný příznak před potenciální rupturou [8]. Nemalou skupinu tvoří incidentální neprasklá aneuryzmata. Jejich charakteristikou je absence klinických projevů. Jsou zjištěna náhodně, obvykle při CT nebo MR vyšetření.
V léčbě mozkových aneuryzmat je obecně cílem zabránit krvácení z výdutě, respektive jeho recidivě, a odstranit intracerebrální nebo intraventrikulární hematom. Autoři představují souhrn současných možností v terapii mozkových aneuryzmat, včetně jejího načasování. Dále se zaměřují na aplikaci současných terapeutických modalit v rámci vlastního pracoviště a shrnují faktory, které ovlivňují vlastní rozhodování.
Metodika
1. Kliping
Princip spočívá v uzavření krčku výdutě nasazenou svorkou. Tím nastane eliminace vtoku krve do vlastního vaku. Technika pochopitelně vyžaduje cílenou kraniotomii. Rozvoj zobrazovacích metod – CT angiografie, 3D angiografie, dává v současnosti operatérovi dobrou představu o tvaru, velikosti a směřování výdutě. Tyto technologie dokážou navíc zobrazit odstupující perforátory a sekundární váčky, jejichž přítomnost významně zvyšuje riziko peroperačního krvácení. Díky těmto informacím je operatér schopen detailně plánovat vlastní výkon. Samozřejmostí je využití principů mikrochirurgie, jak byly zavedeny Yasargilem [9]. Rizika operace spočívají zejména v neúplném uzavření vaku s možností rekurentního krvácení, v okluzi mateřské tepny a v iatrogenním uzávěru drobných tepen (tzv. perforátorů), které odstupují z magistrální tepny v blízkosti výdutě. Okluze magistrální tepny může způsobit rozsáhlou ischemii v jejím povodí s těžkým následným neurologickým deficitem. Okluze perforátorů se může projevit stejným fatálním dopadem. Tyto tepénky živí hluboké struktury mozku včetně vnitřní kapsuly. Jejich okluze může mít fatální odezvu v klinickém stavu pacienta. Další potenciálně katastrofickou situací je peroperační ruptura aneuryzmatu. V tomto okamžiku jsou obvykle nezbytné dva vysavače a dočasný uzávěr přívodných tepen k vaku výdutě. Klip na výduť je možné nasadit až poté, kdy je jasný přehled v operačním poli. Operační ruptura je negativním faktorem celkového výsledku [10]. Technika dočasného uzávěru přívodné tepny (tepen) je využívána standardně i mimo krizové situace. Aplikace aneuryzmatické svorky na magistrální tepnu sníží perfuzní tlak ve vaku. Vak „změkne” a preparace krčku se tak stává jednodušší a bezpečnější [11]. Bezpečná doba dočasného uzávěru je přibližně 10 minut, nicméně praxe autorů je taková, že by interval okluze neměl přesáhnout 5 minut. Pokud není v tomto časovém limitu výduť vyřešena, pak je rozumné dočasně obnovit distální perfuzi sejmutím dočasné svorky a po uplynutí intervalu 5 minut opět tepnu zavřít a pokračovat v preparaci krčku s finální aplikací klipu. Kompletní uzávěr vaku byl v minulosti detekován pomocí ultrazvuku, v současnosti je standardem využití ICG videoangiografie (název z anglického termínu indocyaningreen)[12]. Pomocí ICG angiografie jsme schopni dále detekovat zachovaný průtok v perforátorech. To je velmi důležité, protože jejich iatrogenní uzávěr může, jak bylo uvedeno, vyústit v těžký trvalý neurologický deficit. Funkční poruchu, kterou vyvolá okluze perforátorů, můžeme dále detekovat s využitím elektrofyziologického monitoringu somatosenzorických a motorických evokovaných potenciálů. Repozice klipu může potenciálně devastující situaci napravit [13]. Další novou technologií, která snižuje rizika otevřené operativy mozkových aneuryzmat, je peroperační flowmetrie s využitím měření tranzitního času. Tato metoda umožňuje kvantitativní měření krevního toku v magistrálních tepnách v místě výdutě. Adekvátní včasná repozice klipu při sníženém toku krve v přilehlých cévách eliminuje riziko iatrogenní teritoriální ischemie [14].
Obr. 2. Disekce Sylvijské cisterny s patrným aneuryzmatem M1/2. AN – aneuryzma, M1 – kmen a. cerebri media. M2 – temporální větev bifurkace ACM Fig. 2: Dissection of the Sylvian fissure – obvious aneurysm of MCA bifurcation. AN – aneurysm, M1 trunk of MCA, M2 temporal branch of MCA 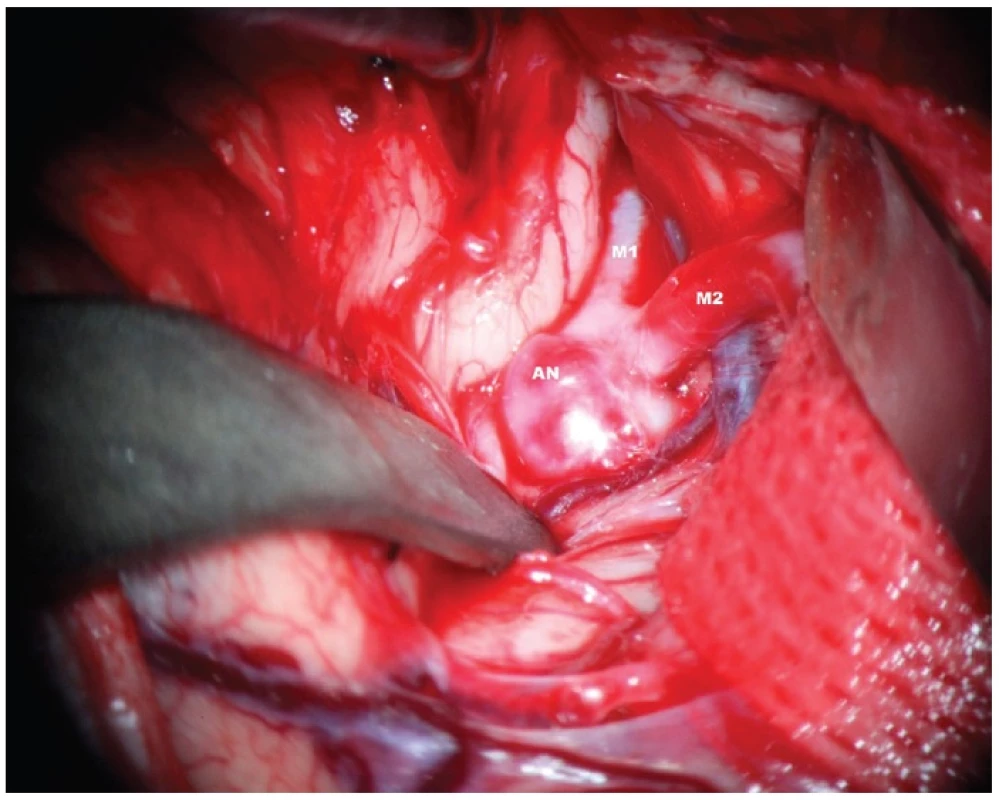
Obr. 3. 3: Stav po dočasném zaklipování kmene M1 před finální disekcí vaku –*aneuryzmatická svorka, uzavírající M1, M2t – temporální větev M2, AN vak aneuryzmatu, který je částečně sklerotický, p – perforátor, jdoucí přes fundus vaku Fig. 3: Status after temporary clipping of M1 before final dissection of the aneurysmal sac –*aneurysmal clip occluding M1, M2t – temporal branch of M2, AN – partially sclerotic aneurysmal sac, p – perforator traversing the sac of the aneurysm 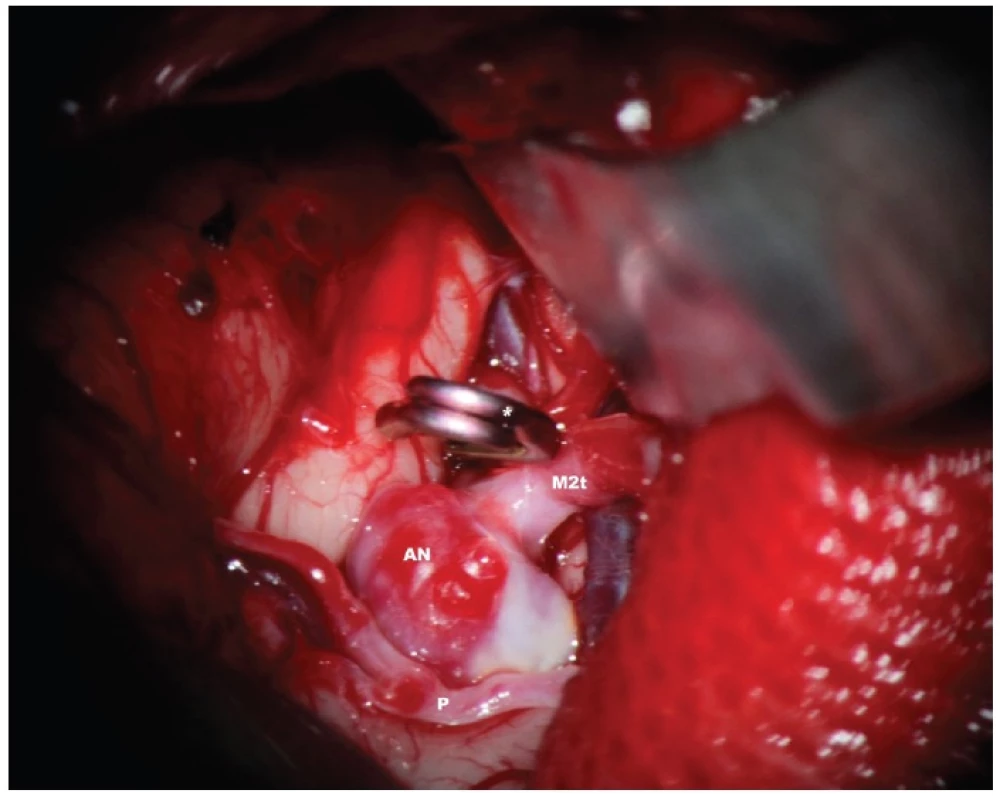
Obr. 4. tav po definitivním zaklipování vaku: AN – aneuryzma, branže svorky, M2f – frontální větev M2, M2t – temporální větev M2, p – perforátor, který je uvolněn od vaku, se zachovaným krevním průtokem Fig. 4: Status after the final clipping of the aneurysm: AN – aneurysm – blade of the clip, M2f – frontal branch of M2, M2t – temporal branch of M2, p – perforator released from the sac of the aneurysm without sacrificing blood flow 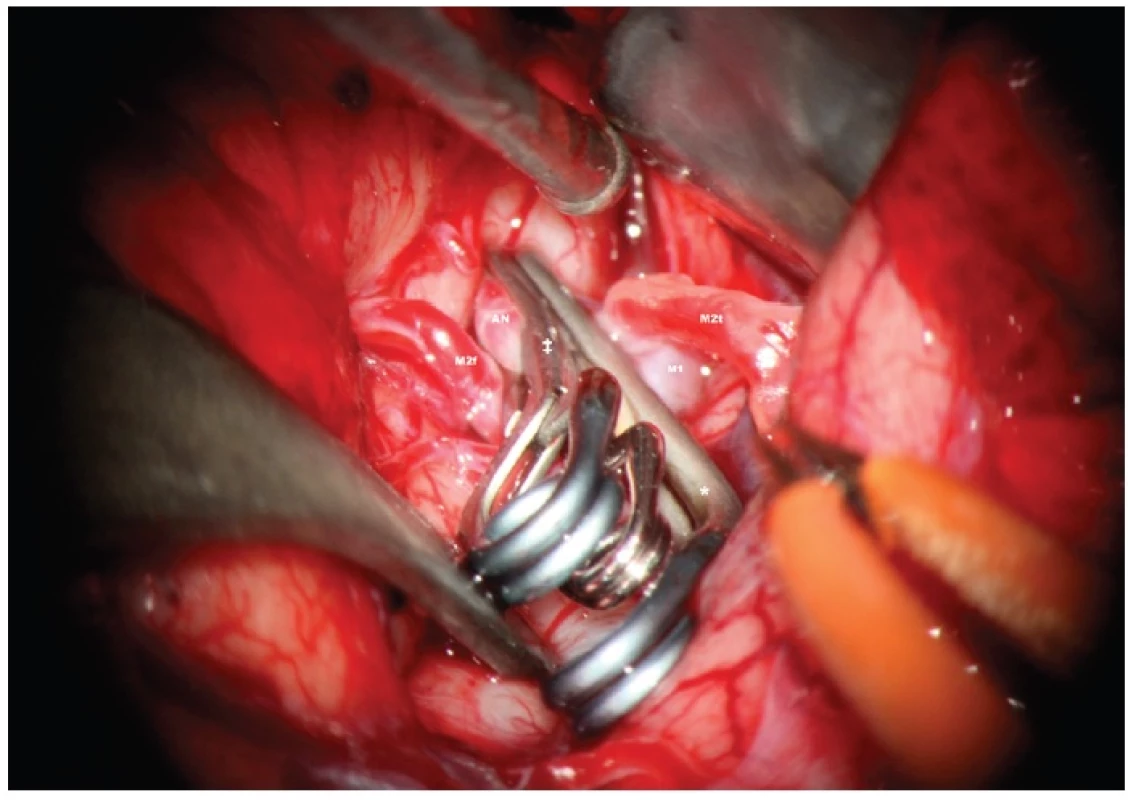
2. Koiling
Princip endovaskulární léčby spočívá ve vyplnění nitra vaku výdutě platinovými spirálkami. Katetr je zaveden retrográdně z třísla Seldingerovou metodou do nitra vaku. Jednotlivé spirálky jsou ve správném momentě elektricky odpojitelné od vlastního mikrokatetru. Kompaktní shluk koilů dá vznik trombóze uvnitř vaku.
Metoda je spolu s klipingem jednou ze dvou základních technik ošetření intrakraniálních aneuryzmat. Jistou nevýhodou je nutnost dlouhodobého angiografického sledování, protože koiling má ve srovnání s klipingem nejistou dlouhodobou „trvanlivost“ uzávěru výdutě. Recidivy opětovného plnění vaku nejsou vzácné. Tento jev vedl k uvedení bioaktivních spirálek a koilů potažených hydrogelem s cílem snížení frekvence rekanalizace výdutě [15–19]. Bioaktivní materiály představují biodegradabilní polymery, jako například polyglykolová kyselina nebo polyglykolová/mléčná kyselina. Předpokládá se efekt urychlení fibrotizace vaku s následným snížením rizika rekanalizace.
S rostoucí velikostí výdutě obecně klesá úspěšnost metody. Totéž platí pro aneuryzmata se širokým krčkem a výdutě fuziformní [20]. Pro výdutě s nepříznivým poměrem fundus: krček = ≤2 byla vyvinuta metoda kombinace inzerce stentu přes krček s doplněním spirálek do nitra vaku. Koily tak nemohou hřeznout zpět do mateřské cévy a je proto vyloučeno riziko její trombózy a okluze. Kovová slitina tvoří pouze 10 % povrchu stentů. Tím je zajištěna jejich vysoká porozita.
Obr. 5. Aneuryzma v terminální části bazilární tepny. AN – Aneuryzm, BA – bazilární tepna Fig. 5: Basilar tip aneurysma – AN – aneurysm, BA – basilar artery 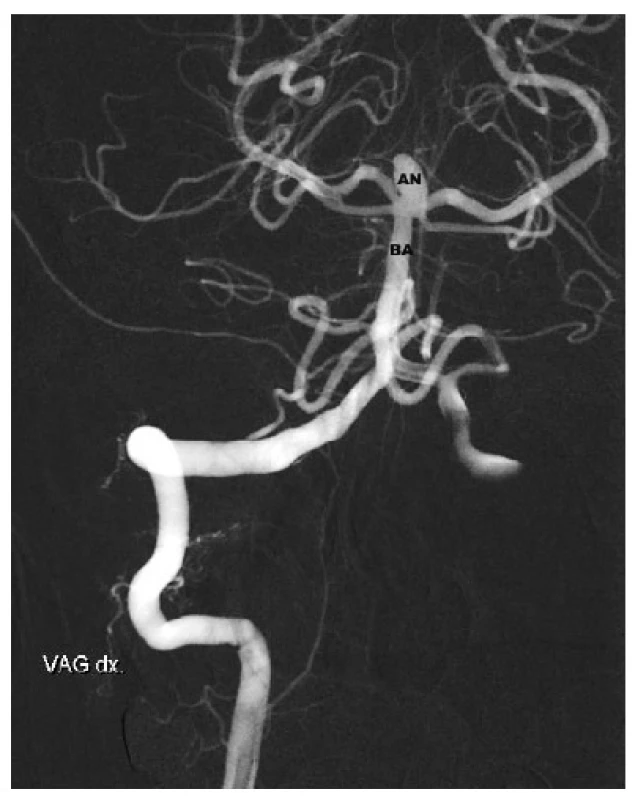
Obr. 6. Aneuryzma v terminální části bazilární tepny po ošetření koily – výduť je vyplněna spirálkami, chybí krevní náplň vaku – BA – bazilární tepna Fig. 6: Endovascular coil treatment of the basilar tip aneurysm – the sac is filled by coils – there is no blood inflow into the aneurysm – BA – basilar artery 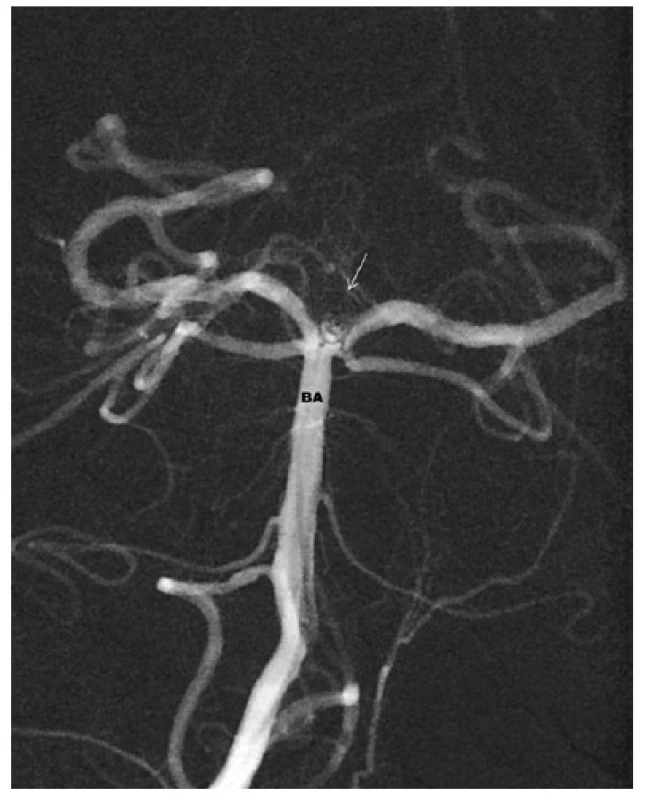
3. Flow divertery
Jedná se o relativně novou technologii. Po prvé byly flow divertery použity v roce 2006. V principu se jedná o samoexpandibilní stenty, jejichž povrch je tvořen z 30–50 % slitinou různých kovů (nikl, titan, chrom, platina…). V tom je zásadní rozdíl proti klasickým stentům, u kterých pevná část tvoří jen 10 % zevního pláště. Zatímco u klasických stentů má jejich inzerce zabránit prolapsu spirálek do magistrální tepny, u flow diverterů vede zvýšená hustota stentu (menší porozita) ke snížení vtoku krve do vaku a tím k navození trombózy uvnitř vaku. V současné době jsou na trhu dva systémy: PIPELINE (eV3, Irvine, CA, USA) a SILK (Balt Extrusion, Montmorency, France). Oba systémy mají stenty různé délky a průsvitu. Výběr optimální délky stentu je velmi důležitý. Platí pravidlo: délka stentu = trojnásobek průsvitu dané cévy + šířka krčku výdutě. Indikace k využití flow diverterů jsou neprasklá aneuryzmata nebo reziduum vaku u již léčené výdutě. Indikována jsou aneuryzmata se širokým krčkem, u kterých je vysoká pravděpodobnost selhání klasických endovaskulárních technik (koiling, koiling v kombinaci se stentem). Další indikací jsou fuziformní a disekující výdutě. Absolutní kontraindikací použití flow diverterů je akutní ruptura aneuryzmatu s projevy subarachnoidálního krvácení (riziko okluze magistrální tepny v časovém horizontu měsíců přináší nutnost dlouhodobého podávání duální antiagregace). Relativní kontraindikace pro aplikaci flow diverterů je příznivá situace pro využití metod první volby – klipingu nebo koilingu. Dále nelze tuto technologii využít v případě rezistence nebo netolerance léků duální antiagregace – klopidogrelu a anopyrinu [18–19]
4. Trapping aneuryzmatu s vysokoprůtokovým mozkovým bypassem
Jedná se o metodu „poslední volby”. Přichází v úvahu u gigantických a/nebo fuziformních výdutí, které nejsou ošetřitelné jinou technikou, zejména klipem. Gigantická aneuryzmata jsou klipovatelná přibližně v polovině případů [4]. Koiling je u nich jen dočasným řešením, protože četnost rekanalizace je vysoká. Zároveň mají gigantické výdutě výraznou tendenci k ruptuře. Proto je intervence i při vědomí zvýšeného rizika oprávněná. Principem metody je uzavření magistrální tepny, na které je výduť uložena, a našití vysokoprůtokového bypassu nad místo výdutě. Jako donor se obvykle využívá arteria carotis externa, pro vlastní bypass je vhodná a. radialis nebo v. saphena magna. Anastomóza je našita technikou end-to-side pokračující suturou nebo jednotlivými stehy. V případě trappingu aneuryzmat existují dva přístupy. Někteří autoři našijí bypass vždy, většina se však spoléhá na zátěžové testy po dočasné endovaskulární okluzi tepny - balonkový okluzní test (BOT) [21, 22]. Zátěž spočívá v indukované hypotenzi po dobu 20 minut. Bypass je proveden selektivně v případě, kdy nastane negativní odezva klinická nebo subklinická v podobě deteriorace somatosenzorických evokovaných potenciálů, snížené perfuze krve (hodnocené SPECT nebo CT) nebo významně opožděné „žilní fáze” angiografie na straně okluze [23]. Autoři textu zastávají filozofii selektivního přístupu. Bypass je proveden elektivně v odstupu po vyšetření BOT, uzávěr tepny (obvykle vnitřní karotidy) se uskuteční následně po průkazu patentnosti bypassu.
5. Trapping aneuryzmatu
Hunterská ligatura magistrální tepny - vnitřní karotidy na krku. Podvaz tepny je možné provést pouze v případě negativního okluzního testu.
6. Wrapping aneuryzmatu
Technika obalení stěny vaku svalem, vatou, fascií apod. s představou, že nastane jizvením zpevnění stěny vaku se snížením rizika ruptury. Jedná se o metodu nouzovou, jejíž smysl je sporný. Význam má pouze v případě, kdy je z anatomických důvodů ponecháno mimo dosah klipu drobné reziduum vaku. Představa, že by wrapping měl efekt jako samostatná technika, je iluzorní.
Výsledky
Prasklá aneuryzmata
1. Načasování operace
V minulosti bylo zvykem provádět operace prasklých výdutí odloženě po 3 týdnech. Panovaly obavy z akcelerace vazospazmů operačním zákrokem. Špatný přehled v operačním poli edematózního mozku s krví v bazálních cisternách zvyšoval riziko výkonu. Rozvoj mikrochirurgie přinesl tendenci k časnému operování do 72 hodin. Aktuální trend je operovat do 24 hodin. Důvod je zřejmý – zabránit recidivujícímu krvácení. Indikováni jsou zejména pacienti v dobrém klinickém stavu. Zvýšená perioperační morbidita je vyvážena prevencí recidivy krvácení. Nejvyšší operační riziko je 4.–10. den po ruptuře. V tomto období se výkon nedoporučuje. Odložené výkony jsou indikovány u pacientů v iniciálním těžkém stavu, u gigantických výdutí a aneuryzmat v zadní jámě [24].
2. Klip versus koil
První randomizovaná studie, která porovnala klinické a neuropsychologické výsledky po roce od intervence, byla uskutečněna Koivistem ve Finsku [25]. Vstupním kriteriém bylo subarachnoidální krvácení v předchozích 3 dnech u pacientů vhodných pro obě modality léčby. Endovaskulárně bylo ošetřeno 52, chirurgicky 57 pacientů. Do studie byli zařazeni také komatózní nemocní. Po roce sledování bylo 66,7 % pacientů v chirurgické skupině v dobrém stavu, v endovaskulární však 76,9 %, což znamenalo snížení absolutního rizika o 10,2 procenta u koilovaných. Výsledky klinické a neuropsychologické se po roce s ohledem na malý soubor statisticky nelišily.
ISAT. Mezinárodní multicentrická prospektivní studie. Randomizováno bylo pouhých 20 % z prezentovaných pacientů. Tento fakt je častým předmětem výhrad vůči studii. Indikační kritéria byla shodná s finskou studií. Endovaskulární léčbu podstoupilo 1073, chirurgickou pak 1070 pacientů. Po roce sledování byl špatný výsledek (těžký deficit, vegetativní stav nebo úmrtí) v endovaskulární skupině ve 24 % a v chirurgické 31 %, což představovalo 7% absolutní redukci rizika u nemocných léčených koily. Na druhé straně bylo ve skupině endovaskulární kompletně uzavřeno při kontrolní angiografii 39 % výdutí, 46 % inkompletně a 15 % pouze parciálně. Recidiva krvácení nastala po roce v 7 případech, z toho 6krát u koilovaných pacientů [26]. Pacienti byli dále sledováni z hlediska dlouhodobého rizika recidivy krvácení, úmrtí a těžkého postižení. Průměrná doba sledování činila 9 let. K recidivě krvácení z původně ošetřeného aneuryzmatu došlo v 13 případech, z toho v 10 u endovaskulární skupiny. V této skupině nastalo krvácení v 6 případech z rezidua původní výdutě a ve 4 případech na podkladě de novo aneuryzmatu. Koiling „vyžadoval”častější opakovanou intervenci. Nicméně tento nález neměl vliv na celkový výsledek pacientů po 5 letech sledování při srovnání koilingu a klipingu Počet pacientů, kteří žili nezávislým životem, se však v obou skupinách významně nelišil [27]. Barrow Ruptured Aneurysm Trial (BRAT). 233 koilovaných a 238 klipovaných pacientů. Opět byli zařazeni pacienti vhodní pro obě metody. Pacienti ve špatném iniciálním stavu nebyli vyřazeni. Výsledky byly analyzovány po 1 roce, kritérium úspěchu byla schopnost pacienta vést nezávislý život dle modifikovaného Rankinova skóre (mRS). Špatný výsledek (mRS>2) byl v chirurgické skupině v 33,7 % a v endovaskulární v 23,2 %. V BRAT studii 62,3 % pacientů indikovaných k endovaskulární léčbě tento výkon skutečně podstoupilo. Ve studii ISAT podstoupilo intervenci pouze 29,4 % randomizovaných pacientů. Tento fakt je klíčovým kritickým bodem studie. V BRAT studii byl „crossover” při volbě terapie realizován u 75 pacientů, původně indikovaných pro endovaskulární terapii. Důvodem otevřené terapie byl nejčastěji hematom, dále anatomický nález na výduti (příliš malý vak pro koil, nevhodný poměr krček/vak). Opačný přesun ve prospěch endovaskulární léčby nastal u 4 pacientů. Studie BRAT proběhla na velmi respekovaném vedoucím neurochirurgickém pracovišti s opakovaně publikovanými excelentními výsledky v oblasti cerebrovaskulární chirurgie. Závěr studie neznamená, že by výdutě měly být primárně ošetřeny endovaskulárně. Je nicméně nabíledni, že by aneuryzmata měla být ošetřována v centrech, která nabízejí obě modality léčby 24 hodin 7 dní v týdnu [28].
3. Koil versus bioaktivní koil
Vzhledem k tomu, že se jedná o nové technologie, jsou aktuální zkušenosti velmi omezené.
HELPS. Studie srovnávající koily potažené hydrogelem s klasickými koily platinovými, probíhala v 24 centrech 7 států. Ošetřena byla neprasklá aneuryzmata s výjimkou gigantických v počtu 250 (koily) a 249 (hydrogelové koily). Absolutní snížení negativního výsledku bylo v hydrogelové skupině koilů 7 %. K recidivě plnění výdutě došlo v hydrogelové skupině o 8,6 % méně často [16].
Cerecyte koily. Jsou aktuálně publikovány 2 práce týkající se těchto bioaktivních spirálek. Linfante udává primární kompletní okluzi vaku u 49 %, malé reziduum u 21 %, a nekompletní uzávěr u 30 % ve skupině cerecyte. U prostých koilů byly výsledky 41 % vs. 39 % vs. 20 %. Po 20 měsících sledování došlo k následné rekanalizaci u 11 % aneuryzmat ve skupině bioaktivních koilů a u 23 % prostých koilů. Geyik nenalezl ve své sestavě rozdíl v primárním uzávěru vaku. V dlouhodobém sledování však skupina bioaktivních koilů vykazovala nižší míru rekanalizace: okluze byla prokázána v 86 %, zatímco u prostých spirálek v 64 %.
Neprasklá aneuryzmata
Chování neprasklých „neošetřených” aneuryzmat je ovlivněno několika faktory. Klíčová je velikost výdutě. Retrospektivní studie ISUIA tvrdí, že výdutě pod 10 mm mají roční riziko ruptury 0,05 % a nad 10 mm 1 %. Riziko prasknutí gigantických aneuryzmat bylo 6 %/rok. Vyšší riziko ruptury měly výdutě zadní komunikující tepny a bazilární tepny [29]. Pooperační 30denní mortalita byla v ISUIA studii 2,3 %. Navazující prospektivní studie ISUIA-II hodnotila 4060 pacientů, z nichž 1692 bylo dále sledováno, 1917 podstoupilo otevřenou operaci a 451 absolvovalo endovaskulární výkon. Výdutě v přední cirkulaci měly 5leté kumulativní riziko ruptury 0 %, 2,6 %, 14,5 % a 40 % pro velikost<7 mm, 7–12 mm, 13–24 mm a nad 25 mm. V zadní jámě a v oblasti zadní komunikující tepny je riziko ruptury 2,5 %, 14,5 %, 18,4 % a 50 procent. Věk pacienta byl důležitým faktorem výsledku ve skupině operovaných pacientů [30]. Významnou úlohu hrála velikost a tvar výdutě ve vztahu k výsledku ve skupině operovaných i endovaskulární. Juvela sledoval 142 pacientů s 181 neprasklými výdutěmi průměrnou dobu 19,7 roku. Ve 33 případech došlo k subarachnoidálnímu krvácení, z nichž 17 bylo fatálních. Roční incidence ruptury výdutě byla v souboru 1,3 %. Rizikovým faktorem byla ve shodě s ISUIA velikost vaku a dále nikotinismus [31].
Diskuse
První zmínky o ošetření mozkové výdutě se datují do konce 19. století, kdy Victor Horsley v roce 1885 provedl ligaturu vnitřní krkavice u gigantického aneuryzmatu v oblasti chiazmatu zrakového nervu. První přímý výkon na výduti (wrapping) provedl v roce 1931 Norman Dott, který výduť, která předtím 3krát praskla, obalil svalem. Zaklipování vaku uskutečnil poprvé Walter Dandy 23. 3. 1937. 43letý pacient prodělal parézu n. oculomotorius. Operace byla indikována na podkladě klinického nálezu bez stanovení předoperační diagnózy. Peroperačně nalezl Dandy sakulární aneuryzma s malým krčkem. K jeho uzavření použil Cushingův stříbrný klip, který neumožnoval znovuotevření a eventuální repozici svorky. Pionýrem mikrochirurgie mozkových aneuryzmat byl v 70. letech 20. století MG Yasargil. Podobnou úlohu v řešení problematiky výdutí vertebrobazilární cirkulace sehrál C. Drake.
Rozvoj endovaskulárních technik zahájil Serbiněnko s odpojitelným latexovým balonkem na přelomu 60.–70. let 20. století. Spirálky uvedl do klinické praxe Ital Guglielmi v roce 1991. Spirálky byly vyrobeny z platiny, byly elektricky odpojitelné od katetru a vyznačovaly se paměťovým efektem materiálu. V roce 1995 byly koily schváleny FDA. Klíčem k rozšíření koilingu v klinické praxi byla studie ISAT z roku 2002. Ve stejném roce byl uveden do praxe nitinolový stent s paměťovým efektem. Kombinace stentu a koilů dovolila ošetřit výdutě s nepříznivým poměrem krček:vak. První informace o flow diverterech jsou z roku 2006.
Optimálním řešením komplexní problematicky terapie mozkových aneuryzmat je v současnosti týmová spolupráce neurochirurga a intervenčního radiologa. V otázce načasování intervence panuje v současnosti shoda. Je indikována akutní intervence do 72 hodin, optimálně do 24 hodin, jelikož tím zabráníme recidivě krvácení z výdutě. Odložení výkonu je na místě pouze u pacientů v hlubokém kómatu, u výdutí ve vertebrobazilárním povodí a u gigantických aneuryzmat [7]. Někteří autoři jsou aktivní i v těchto složitých situacích [11]. Studie ISAT zásadně ovlivnila výběr terapeutické modality ve prospěch koilingu u výdutí vhodných pro obě metody. Kritici studie namítají, že pouze 20 % pacientů postoupilo randomizaci. Dále bylo dosaženo kompletního uzávěru vaku jen v 39 procentech a recidiva krvácení nastala po roce u 10 koilovaných aneuryzmat a u 3 klipovaných [32, 26]. Ve studii podstoupilo 4krát více koilovaných pacientů další zákrok než ve skupině mikrochirurgie. Přes tyto zmíněné negativní faktory nebyl po 5 letech sledování shledán rozdíl ve skupinách pacientů, schopných nezávislých aktivit v běžném životě [27.]. Riziko rekanalizace vaku je nejvyšší v prvních 6 měsících po výkonu a poté klesá [33]. Riziko reruptury po 4 letech sledování ve studii CARAT bylo 3,5 % ve skupině koilů a 1,3 % u klipovaných pacientů. Riziko recidivy krvácení bylo vyšší, pokud nedošlo ke kompletnímu vyřazení výdutě z cirkulace [34]. Studie BRAT hodnotila výsledky po roce sledování. Absolutní rozdíl ve špatném výsledku byl 10 % ve prospěch endovaskulárních výkonů. Na rozdíl od ISAT bylo randomizováno 62 % pacientů, 75 pacientů bylo poté přesunuto do skupiny operovaných, naopak koilováni byli 4 pacienti původně určeni pro klip. Nejčastější důvod pro přesun ze skupiny koilů do skupiny operovaných bylo malé aneuryzma, hematom, široký krček a odstupující céva, vylučující kompletní vyplnění vaku.
Častější rekurence krvácení a rekanalizace vaku vedla k inovacím v podobě bioaktivních koilů. Cílem bylo dosažení rychlejší a trvalejší okluze výdutě. Výsledky jsou zatím nejednoznačné [15–17, 35]. V souboru Molyneuxe bylo dosaženo kompletního uzávěru vaku u 59 % ve skupině prostých koilů a v 54 % u cerecyte koilů. Opakovaný zákrok vyžadovalo 7,7 % pacientů s cerecyte koily a pouze 3,5 % pacientů s prostými koily. Klinické výsledky byly shodné v obou skupinách. Ve spektru velmi omezených informací máme výsledky svědčící ve prospěch bioaktivních koilů [15–16], v jejich neprospěch [35] a v jejich shodný efekt [17]. Zavedení flow diverterů diktovala potřeba vyřešit problematiku komplexních výdutí fuziformních, aneuryzmata se širokým krčkem, rezidua výdutí a disekující aneuryzmata. Výsledky jsou zatíženy vysokou morbiditou/mortalitou, což odráží komplexnost ošetřených lézí. Byrne a spol. ve své studii ošetřili flow diverterem SILK 70 pacientů. Téměř 40 % byly výdutě fuziformní, 20 % gigantické. Komplikace nastaly v 21 % případů, trombóza mateřské tepny v 11 %. Permanentní morbidita byla 4 % a mortalita 8 % [36]. Fischer a spol. použili PIPELINE diverter u 101 aneuryzmat. Kompletní vyřazení z cirkulace zaznamenali z 52 % výdutí, nulový efekt v 12 % případů. Závažná morbidita/mortalita činila 6 procent [19]. Lubicz měl ve svém souboru 34 výdutí se širokým krčkem nebo fuziformních ošetřených SILKem 15% morbiditu/mortalitu po 6 měsících sledování. Významná stenóza mateřské tepny nastala ve 33 %. Ke kompletnímu uzávěru výdutě došlo v 69 % [18]. Podobný výskyt nežádoucích komplikací udávají i další autoři [37–39].
Vysoká četnost komplikací v sestavách souvisí nepochybně s komplexním charakterem ošetřovaných výdutí. Zastoupení gigantických a fuziformních aneuryzmat tomu odpovídá. Na druhé straně se obecně jednalo o výdutě neprasklé. Je otázkou, zda procento komplikací ve srovnání s přirozeným průběhem onemocnění nás opravňuje aktuálně využívat tuto metodu. Z hlediska autorů textu se jedná o věc hypotetickou, protože sami s touto novou technologií zkušenost nemají. Zásadním faktorem, který ovlivňuje výsledek ošetření výdutí, je věk pacienta. Brinjik ji zpracoval retrospektivně z databáze NIS výsledky neprasklých aneuryzmat v USA v období 2001–2008. Pacienti < 50 let měli morbiditu 3,5 % v sestavě koilovaných a 8,1 % u operovaných. V mortalitě nebyl rozdíl. Ve skupině 50–64 let byla morbidita 4 vs. 13,7 % a mortalita 0,5 v.s 1 % ve skupinách koil/klip. Ve věkové kategorii 65–79 se rozdíl zvýšil na 7 vs. 27 % u morbidity a 0,8 v.s 2 % mortality. Nad 80 let byla diskrepance ještě větší 10 vs. 33,5 % morbidita a 2,4 vs. 21,4 % mortalita.
Mimořádně zajímavá situace nastává, pokud jsou obě terapeutické modality v rukách jednoho chirurga. Kaku takto ošetřil 100 pacientů s prasklými výdutěmi, 48 podstoupilo kliping s příznivým výsledkem v 77,1 % a 52 pacientů absolvovalo koiling s příznivým výsledkem v 71,2 %. V endovaskulární skupině si 9,6 % pacientů vyžádalo opakovaný zákrok, zatímco v chirurgické skupině nebyl další výkon potřebný ani jednou. Rozhodování o způsobu léčby bylo ovlivněno věkem pacienta, klinickým stavem, poměrem krček: fundus, lokalizací, směřováním fundu, přítomností sekundárního váčku, a eventuálním odstupem tepénky z vaku [41]. Stejný počet pacientů oběma technikami ošetřil Lanzino. Přestože 30 % pacientů bylo iniciálně v těžkém stavu, dosáhl dobrého výsledku v 71 % případů. Ve shodě s Kaku byla zdůrazněna komplexnost rozhodování pro určitou techniku. Faktory, které ovlivnily finální rozhodnutí způsobu léčby, byly shodné.
Autoři textu na vlastním pracovišti pečlivě analyzují proběhlé multicentrické studie a respektují jejich závěry při každodenním rozhodování při volbě léčby mozkových aneuryzmat. Zároveň jsou si vědomi dalších faktorů, které ovlivňují finální rozhodnutí. Proto nelze říct: „výdutě definované velikosti budeme vždy řešit jednou konkrétní metodou”. Jak již bylo zmíněno, mají pro rozhodnutí vliv faktory jako věk, celkový stav pacienta, interní komorbidity, pohlaví, anatomická charakteristika vaku a vystupujících tepen, eventuální familiární výskyt, výskyt aneuryzmatu v rámci genetického syndromu.
Pro otevřený výkon se obecně rozhodujeme u mladších pacientů, při výskytu expanzivního intracerebrálního hematomu, u drobných nebo naopak gigantických výdutí, u výdutí v oblasti střední mozkové tepny a u distálně uložených (zejména disekujích) výdutí. Koil využijeme u výdutí vertebrobazilárního povodí u přední komunikanty, kdy vak směřuje dozadu, při špatném klinickém stavu a při střední velikosti výdutě. Rozhodnutí o postupu je vždy týmové.
Závěr
V poslední době došlo k významnému posunu v diagnostice a terapii mozkových aneuryzmat. Došlo k pokroku v mikroneurochirurgii a zároveň k rozvoji nových terapeutických modalit intervenční radiologie. Multicentrické studie nám dávají klíč ve výběru terapeutických modalit. Komplexnost problematiky však nedovoluje zvolit jednoduché vzorce řešení. Je mnoho faktorů, které rozhodují o optimální terapii: věk pacienta, velikost, tvar a umístění výdutě na cévách Willisova okruhu, iniciální klinický stav nemocného, přítomnost intracerebrálního hematomu... Předpokladem dobrých léčebných výsledků je spolupráce neurochirurga s intervenčním radiologem. Nesmí jít o soupeření kdo s koho, ale o týmovou spolupráci. Volba léčebné modality by měla být společným rozhodnutím. V současnosti je podmínkou „lege artis” ošetřování mozkových výdutí trvalá 24hodinová dostupnost neurochirurga a intervenčního radiologa. Logickým zastřešením problematiky je vznik komplexních cerebrovaskulárních center.
MUDr. Vladimir Přibáň, Ph.D
Neurochirurgické oddělení,
Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Plzni
Alej Svobody 80304 60 Plzeň
e–mail: v.priban@centrum.cz
Zdroje
1. Wiebers DO, Whisnant JP, Sunt TM et al. The significance of unruptured intracranial saccular aneurysms. J Neurosurg 1987; 66 : 23–29.
2. Šteňo J. Cievna neurochirurgia. In: Haruštiak S et al. Princípy chirurgie II. 1. vyd. Bratislava, Slovak Academic Press, s.r.o. 2010 : 165–203.
3. Fox JL. Intracranial aneurysms. New York, Springer-Verlag 1983.
4. Greenberg MS. Handbook of neurosurgery. 6th edition, New York, Thieme 2006.
5. Hop JW, Rinkel GJ, Algra A et al. Case-fatality rates and functional outcome after subarachnoid hemorrhage. A systemic review. Stroke 1997;28 : 660–664.
6. Kassel NF, Sasaki T, Colohan AR et al. Cerebral vasospasm following aneurysmal subarachnoid hemorrhage. Stroke 1985; 16 : 567–572.
7. Kassel NF, Drake, CG. Review of the management of saccular aneurysms. Neurol Clin 1983;1 : 73–86.
8. Raps EC, Galetta SL, Solomon RA et al. The clinical spectrum of unruptured intracranial aneurysms. Arch Neurol 1993;50 : 265 –268.
9. Yasargil MG. Microneurosurgery. Vol. II. Stuttgart. New York, Georg Thieme Verlag 1984.
10. Schramm J, Cedzich, Outcome and management of intraoperative aneurysm rupture. Surg Neurol 1993;40 : 26–30.
11. Lehecka M, Laako A, Hernesniemi J. Helsinki Microneurosurgery Basics and Tricks. Helsinki, Druckerei Hohl, 2011.
12. Dashti R, Laakso A, Niemelä M, Porras M, Hernesniemi J. Microscope-integrated near-infrared indocyanine green videoangiography during surgery of intracranial aneurysms: the Helsinki experience. Surg Neurol 2009;71 : 543–550.
13. Szelényi A, Langer D, Kothbauer K et al. Monitoring of muscle motor evoked potentials during cerebral aneurysm surgery: intraoperative changes and postoperative outcome. J Neurosurg 2006;105 : 675–681.
14. Amin-Hanjani S, Alaraj A, Charbel FT. Flow replacement bypass for aneurysms: decision-making using intraoperative blood flow measurement. Acta Neurochir 2010;152 : 1021–1032.
15. Geyik S, Ertugrul O, Yavuz K et al. Comparison of bioactive coils and bare platinum coils for treatment of intracranial aneurysms: a matched-pair analysis. J Neurosurg 2010;112 : 709–713.
16. White PM, Lewis SG, Gholkar A et al. Hydrogel-coated coils versus bare platinum coils for the endovascular treatment of intracranial aneurysms (HELPS): a randomized controlled trial. Lancet 2011;377 : 1655–1662.
17. Linfante I, DeLeo MJ, Gounis MJ et al. Cerecyte versus platinum coils in the treatment of intracranial aneurysms: packing attenuation and clinical and angiographical midterm results. Am J Neuroradiol 2009;30 : 1496–1501.
18. Lubicz B, Collington L, Raphaeli G et al. Flow-diverter stent for the endovascular treatment of intracranial aneurysms: A prospective study in 29 patients with 34 aneurysms. Stroke 2010; 41 : 2247–2253.
19. Fischer S, Vajda Z, Perez MA et al. Pipeline embolization device (PED) for neurovascular reconstruction: initial experience in the treatment of 101 intracranial aneurysms and dissections. Neuroradiology 2012;54 : 369–382.
20. Koebbe CJ, Veznedaroglu E, Jabbour P et al. Endovascular management of intracranial aneurysms: current experience and future advances. Neurosurgery 2006;59(5) suppl: 93–100.
21. Drake CG, Peerless SJ, Ferguson GG. Hunterian proximal arterial occlusion and giant aneurysms of the carotid circulation. J Neurosurg 1994;81 : 651–665.
22. Lawton MT, Hamilton MV, Morcos JJ et al. Revascularization and aneurysm surgery: current techniques, indications, and outcomes. Neurosurgery 1996;38 : 83–94.
23. Standard SC, Ahuja A, Guterman LR et al. Balloon test occlusion of the internal carotid artery with hypotensive challenge. Am J Neuroradiol 1995;16(7):1453–1458.
24. Kassel NF, Torner JC, Jane JA et al. The international cooperative study on the timing of aneurysm surgery. Part 2: Surgical results. J Neurosurg 1990;73 : 37–47.
25. Koivisto T, Vanninen R, Hurskainen H et al. Outcomes of early endovascular versus surgical treatment of ruptured cerebral aneurysms. A prospective randomized study. Stroke 2000;31 : 2369–2377.
26. Molyneux A, Kerr R, Stratton I et al. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomized trial. Lancet 2002;360 : 1267–1274.
27. Molyneux A, Kerr RSC, Birks J et al. Risk of subarachnoid haemorrhage, death, or dependence and standardised mortality ratios after clipping or coiling of an intracranial aneurysm in the international Subarachnoid Aneurysm Trial (ISAT): long-term follow-up. Lancet Neurol 2009;8 : 427–433.
28. McDougall CG, Spetzler RF, Zabramski JM et al. The Barrow Ruptured Aneurysm Trial. J Neurosurg 2012;116 : 135–144.
29. The International Study Group of Unruptured Intracranial Aneurysms Investigators (ISUIA): Unruptured aneurysms - risk of rupture and risk of surgical intervention. N Engl J Med 1998; 339 : 1725–1733.
30. Wiebers DO, Whisnant JP, Huston J et al. Unruptured intracranial aneurysms: natural history, clinical outcome, and risk of surgical and endovascular treatment. Lancet 2003;362 : 103–110.
31. Juvela S, Porras M, Poussa K. Natural history of unruptured intracranial aneurysms: probability of and risk factors for aneurysm rupture. J Neurosurg 2008;108 : 1052–1060.
32. Thornton J, Debrun GM, Aletich VA et al. Follow-up angiography of intracranial aneurysms treated with endovascular placement of Guglielmi detachable coils. Neurosurgery 2002;50 : 249–250.
33. Schaafsma JD, Sprengers ME, VanRooij WJ et al. Long-term recurrent subarachnoid hemorrhage after adequate coiling versus clipping of ruptured intracranial aneurysms. Stroke 2009; 40 : 1758–1763.
34. Johnston SC, Dowd CF, Higashida RT et al. Predictors of rehemorrhage after treatment of ruptured intracranial aneurysms: the Cerebral Aneurysm Rerupture After Treatment (CARAT) study. Stroke 2008;39 : 120–125.
35. Molyneux AJ, Clarke A, Sneade M et al. Cerecyte coil trial: Angiographic outcomes of a prospective randomized trial comparing endovascular coiling of cerebral aneurysms with either cerecyte or bare platinum coils. Stroke 2012. www.controled-trials.com. ISRCT TN 82461286.
36. Byrne JV, Beltechi R, Yarnold JA et al. Early experience in the treatment of intra-cranial aneurysms by endovascular flow diversion: A multicentre prospective study. Plos ONE 2010;5(9): e12492.
37. Briganti F, Napoli M, Tortora F et al. Italian multicenter experience with flow-diverter devices for intracranial unruptured aneurysms treatment with periprocedural complications -retrospective data analysis. Neuroradiology 2012; DOI: 10/s0234-012-1047–3.
38. Berge J, Biondi A, Machi P et al. Flow-diverter silk stent for the treatment of intracranial aneurysms: 1-year follow-up in a multicenter study. Am J Neuroradiol 2012;33 : 1150–1155.
39. Maimon S, Gonen L, Nossek E et al. Treatment of intra-cranial aneurysms with the SILK flow diverter: 2 years experience with 28 patients at single center. Acta Neurochir (Wien) 2012;154 : 979–987.
40. Brinjikji W, Rabinstein AA, Lanzino G et al. Effect of age on outcome of treatment of unruptured cerebral aneurysms. A study of National Inpatient Sample 2001–2008. Stroke 2011;42 : 1320–1324.
41. Kaku Y, Yamashita K, Kokuzawa J et al. Treatment of ruptured cerebral aneurysms-clip and coil, not clip versus coil. Acta Neurochir suppl. 2010;107 : 9–13.
42. Lanzino G, Fraser K, Kanaan Y, Wangenbach A. Treatment of ruptured intracranial aneurysms since the International Subarachnoid Aneurysm Trial: practice utilizing clip ligation and coil embolization as individual or complementary therapies J Neurosurg 2006;104 : 344–349.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2012 Číslo 11- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- O úspěšnosti operací
- Současná mikrochirurgická a neurointervenční terapie mozkových aneuryzmat
- Významné životní jubileum doc. Čestmíra Neorala
- Infekce cévních rekonstrukcí v aortofemorální oblasti
- Opakované operace pro karcinom příštítného tělíska
- Význam endosonografie v předoperačním managementu nemocných s karcinomem hlavy pankreatu
- Výtěžnost peroperační ultrasonografi v chirurgii příštítných tělísek
- Ošetření pankreatické pooperační píštěle gastrofistuloanastomózou – soubor kazuistik
- NanoKnife a dva úspěšné případy intrakavitální ireverzibilní elektroporatizace nádorů hlavního bronchu
- Postup při poranění břicha
- Poranění pankreatu
- Současný postup u poranění sleziny
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současný postup u poranění sleziny
- Postup při poranění břicha
- Opakované operace pro karcinom příštítného tělíska
- Současná mikrochirurgická a neurointervenční terapie mozkových aneuryzmat
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



