-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Infekce cévních rekonstrukcí v aortofemorální oblasti
Vascular reconstructions infections in the aortofemoral region
Introduction:
The incidence of prosthetic vascular graft infections in the aortofemoral region is reported at 0.6–3%. These complications are burdened with a high mortality of up to 50% and an amputation rate of up to 20%. The aim of our study was to give a complex view on the diagnostic and treatment possibilities of these serious complications of reconstructive vascular surgery.Material and methods:
Prosthetic bypass grafts were performed in 1088 patients in the aortofemoral region between 2001–2011 at the Department of Surgery, Teaching Hospital and the Faculty of Medicine, Charles University, in Pilsen. 24 (2.2%) patients suffered from graft infection at various time intervals after primary vascular reconstruction. Clinical examination, computed tomography and positron emission tomography were the main diagnostic methods of vascular graft infection. “In situ” reconstructions dominated over extra-anatomic reconstructions. When the infection involved only the peripheral part of the prosthetic graft, a more conservative approach – local debridement and drainage – was used.Results:
The mortality of the patients was 20.8%, high amputation rate 12.5%, and morbidity rate 58.3%, respectively. The average time of hospitalization in surviving patients was 46.5 days. Primary 30-day patency rate in “in situ” and extra-anatomic reconstructions was 100 and 60%, respectively.Conclusion:
Prosthetic vascular graft infections in the aortofemoral region require tailored multidisciplinary treatment approach in vascular centres. “In situ” reconstructions are the method of first choice. A more conservative approach in infections involving only the peripheral part of the vascular reconstruction has a positive treatment effect.Key words:
vascular reconstructions – aortofemoral region – infections – diagnosis – treatment
Autoři: V. Třeška; B. Čertík; J. Moláček; K. Houdek; M. Čechura; R. Šulc; J. Fichtl; J. Doležal; M. Polák
Působiště autorů: Chirurgická klinika FN a LFUK v Plzni, přednosta: Prof. MUDr. V. Třeška, DrSc.
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 11, s. 597-600.
Kategorie: Původní práce
Souhrn
Úvod:
Incidence infekcí aortofemorálních rekonstrukcí se pohybuje v rozmezí 0,6–3 %. Jsou zatíženy až 50% mortalitou a až u 20 % nemocných je nutno provést vysokou amputaci končetin. Cílem práce bylo podat komplexní pohled na současné diagnostické a léčebné možnosti těchto závažných komplikací rekonstrukční cévní chirurgie.Materiál a metodika:
V letech 2001–2011 jsme na Chirurgické klinice FN a LFUK v Plzni založili celkem 1088 rekonstrukcí v aortofemorální oblasti. U 24 nemocných (2,2 %) se v různém časovém období od primární rekonstrukce vyskytla infekce cévní protézy. K základním diagnostickým prostředkům patřila vedle klinického vyšetření computerová tomografie (CT) a pozitronová emisní tomografie s využitím fluorodeoxyglukózy (FDG PET CT). V operačních výkonech převažovaly „in situ“ nad extraanatomickými rekonstrukcemi. Pokud byla postižena jen periferní část protézy v oblasti třísla, využili jsme k léčbě konzervativní způsob – drenážní výkony.Výsledky:
Mortalita nemocných byla 20,8 %, vysoká amputace byla nutná u 12,5 % nemocných. Morbidita nemocných po sekundárním výkonu byla 58,3 %. Doba hospitalizace přeživších nemocných byla v průměru 46,5 dne. 30 dní po operaci zůstaly průchodné všechny „in situ“ rekonstrukce, extraanatomické rekonstrukce měly 60% primární průchodnost.Závěr:
Infekce cévních rekonstrukcí v aortofemorální oblasti vyžadují personalizovanou léčbu multidisciplinárním týmem cévního centra. Dobré výsledky byly dosaženy pomocí sekundárních „in situ“ rekonstrukcí, které dnes patří k metodě léčebné volby. Pozitivní léčebný efekt měly i místní drenážní výkony u infekcí, které postihovaly jen periferní část cévní rekonstrukce.Klíčová slova:
cévní rekonstrukce – aortofemorální oblast – infekce – diagnostika – léčbaÚVOD
Infekce cévních rekonstrukcí v aortofemorální oblasti (ICRAF) patří k nejzávažnějším komplikacím cévních rekonstrukcí. Jejich výskyt je udáván mezi 0,6–3 % [1, 2]. Tyto komplikace jsou zatíženy vysokou mortalitou (až 50 %), vysokými amputacemi končetin (až 20 %) a rovněž vysokou incidencí reinfekcí nové cévní rekonstrukce (25 %) [3, 4, 5]. ICRAF způsobují dlouhodobou hospitalizaci a vysoké ekonomické náklady pracovišť cévní chirurgie. Cílem naší práce bylo zhodnotit soubor nemocných léčených na Chirurgické klinice FN a LFUK v Plzni s tímto typem infekce cévních protéz a na základě vlastních zkušeností a literárních údajů navrhnout diagnostický a léčebný postup těchto závažných komplikací cévní chirurgie.
MATERIÁL A METODIKA
Hodnotili jsme retrospektivně soubor nemocných s pánevní rekonstrukcí provedenou v letech 2001–2011. Celkem jsme založili pánevní rekonstrukci u 1088 nemocných a infekce se vyskytla u 24 (2,2 %) nemocných v intervalu 2 měsíce – 10 let po založení rekonstrukce. Jednalo se o 19 mužů a 5 žen průměrného věku 63,8 roku (48–88 let). Primárním výkonem byl 14krát aortobifemorální bypass (5krát po resekci aneuryzmatu břišní aorty), 10krát pak jednostranná pánevní rekonstrukce (Tab. 1). Příčinami ICRAF byla protézoduodenální, jejunální, kolická píštěl (4krát), ischemická kolitida (3krát), lymfatické píštěle v třísle (3krát), systémová infekce (2krát), opakované cévní a radiointervenční výkony (2krát). V 10 případech byla příčina ICRAF neznámá. Infekční agens bylo známo u 87,3 % nemocných. Nejčastějším kultivačním nálezem byl Staphylococcus aureus, Staphylococcus epidermidis, Pseudomonas aeruginosa, Proteus, Escherichia colli, Streptococcus species, Klebsiella species a Enterococcus faecalis – Tab. 2. Diagnostiku ICRAF jsme provedli na základě klinického obrazu, leukocytózy, sérových hladin C – reaktivního proteinu (CRP), prokalcitoninu (PCT), computerové tomografie (CT) – Obr. 1 a v nejasných případech jsme využili fluorodeoxyglukózové pozitronové emisní tomografie (FDG PET CT) – Obr. 2. U 9 nemocných jsme po důsledném debridement okolních infikovaných tkání extirpovali kompletně protézu a nahradili ji in situ rekonstrukcí (6krát Silver graft – BBraun, Melsungen AG, 2krát čerstvý allograft, 1krát žilní bypass – vena saphena magna). U 5 nemocných jsme po extirpaci infikované protézy založili axillofemorální, bifemorální bypass. U 3 nemocných jsme provedli pouze kompletní extirpaci cévní protézy (nebo jednoho raménka bifurkační náhrady) a debridement infikovaných tkání bez dalšího založení cévní rekonstrukce především z důvodů celkového těžkého stavu nemocného. 5krát jsme provedli pouze drenáž abscesu v třísle, 2krát pak debridement tkání s proplachovou drenáží při ponechání cévní protézy in situ z důvodu těžkého stavu nemocného (Graf 1).
Graf 1. Typy sekundárních výkonů pro ICRAF Graph 1: Types of secondary vascular procedures for ICRAF 
Obr. 1. Snímek infekce aortobifemorální protézy (šipky ukazují tekutiny kolem levého raménka protézy) Fig. 1: Aortobifemoral graft infection (peri-graft fluid collection marked by arrows) 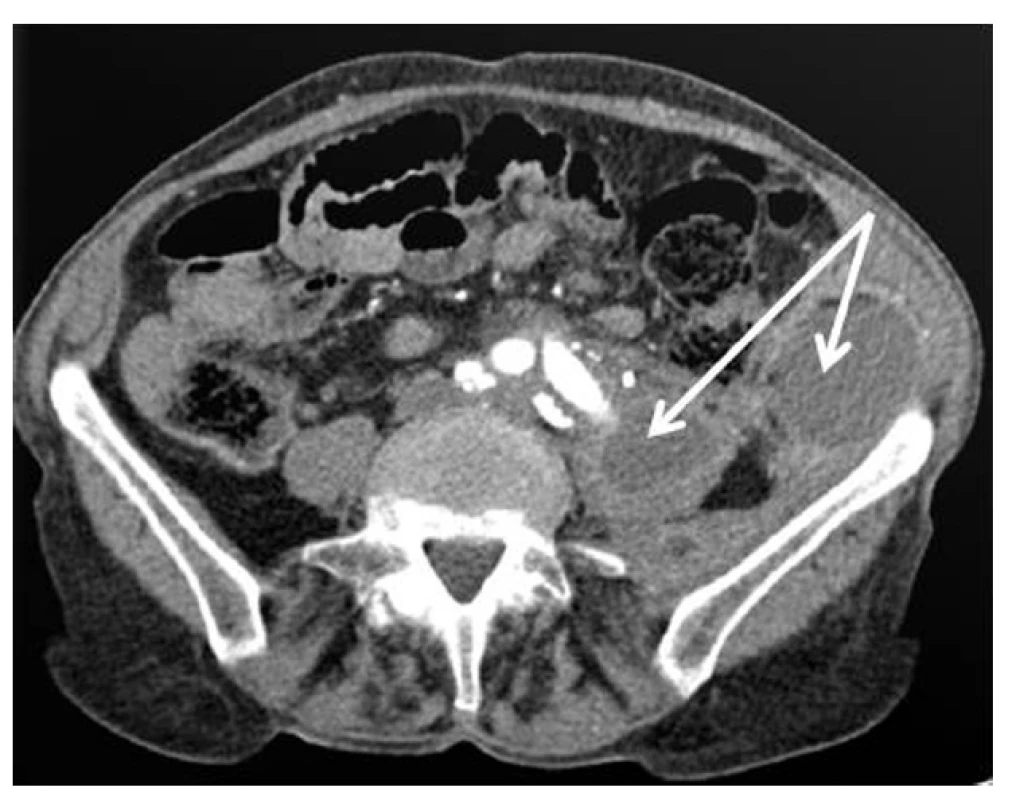
Obr. 2. FDG PET CT infekce aortobifemorální rekonstrukce Fig. 2: FDG PET CT of aortobifemoral graft infection 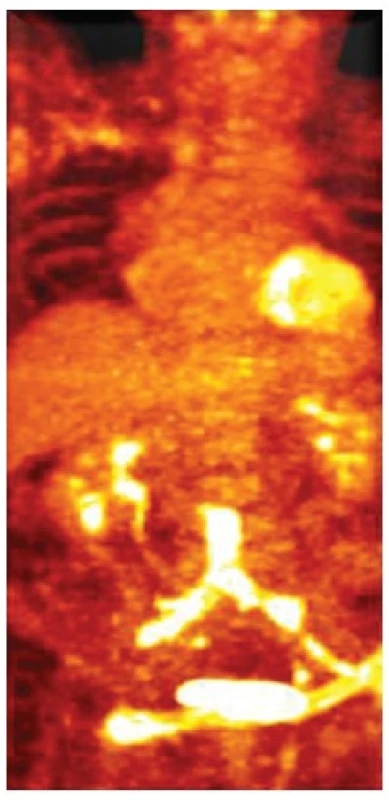
Tab. 1. Soubor nemocných (2001–2011) Tab. 1: Group of patients (2001–2011) 
Vysvětlivky. AAA – aneuryzma abdominální aorty Tab. 2. Příčiny infekcí cévních rekonstrukcí v aortofemorální oblasti Tab. 2: The causes of graft infections in the aortofemoral area 
VÝSLEDKY
Zemřelo 5 nemocných (20,8 %) v důsledku sepse nebo masivního krvácení při sepsi. Zemřeli oba nemocní, u kterých byla vzhledem k celkově těžkému stavu provedena jen drenáž infikované protézy, dále 2 nemocní po extirpaci protézy bez následné rekonstrukce a jeden nemocný po extirpaci bifurkační protézy a založení extraanatomické rekonstrukce. U 3 nemocných (12,5 %) byla nutná vysoká amputace končetiny pro její ischemii. 58,3 % nemocných mělo závažné komplikace po sekundárním výkonu pro ICRAF. Průměrná doba hospitalizace u 19 přeživších nemocných byla 46,5 dne. 30 dní po sekundární rekonstrukci zůstaly průchodné všechny in situ rekonstrukce a z extra anatomických rekonstrukcí byly průchodné 3 rekonstrukce (60 %). Všechny místní drenážní výkony v třísle skončily eradikací infekce a zhojením původní cévní protézy – Tab. 3.
Tab. 3. Výsledky léčby ICRAF Tab. 3: Results 
DISKUZE
ICRAF patří k nejtěžším komplikacím v cévní chirurgii a jsou noční můrou každého cévního chirurga. Jsou zatíženy obecně vysokou morbiditou a mortalitou. Jejich léčba vyžaduje vysoce erudovaný multidisciplinární tým, je dlouhodobá a způsobuje cévním pracovištím vysoké ekonomické náklady.
Příčinami ICAR je nedodržení asepse během operačních nebo radiointervenčrních výkonů, nesprávná technika operace, opakované cévní výkony, bakteriemie z důvodu infekčních fokusů na jiném místě organismu, obezita, diabetes, dlouhodobá medikace kortikoidy a imunosupresivy. Příčinami jsou také dlouhé a komplikované primární cévně rekonstrukční výkony, reoperace, urgentní výkony a uvádějí se také současné výkony na gastrointestinálním traktu [6, 7]. Mezi nezanedbatelné příčiny patří příprava nemocného před cévní rekonstrukcí, kdy končetinové ochlupení by mělo být odstraněno těsně před operací a nikoliv v předvečer operace či dříve. Kariézní chrup či jiné infekční fokusy jsou značným nebezpečím pro infekci cévní rekonstrukce, a proto je nutné veškeré tyto zdroje infekce před cévní rekonstrukcí sanovat.
ICRAF se může manifestovat kdykoli po založení cévní rekonstrukce. Obecně dělíme ICRAF na časné, vzniklé do 3 měsíců a pozdní nad 3 měsíce po primární cévní rekonstrukci. Klinické vyšetření při podezření na ICRAF je základní vyšetřovací metodou. Únava nemocného, subfebrilie, febrilie, zarudnutí, otok rány v třísle, bolesti břicha, zad nebo projevy krvácení do gastrointestinálního traktu, vysoké sérové hladiny CRP a PCT, leukocytóza, trombóza cévní rekonstrukce či tvorba nepravé výdutě musejí být varujícími klinickými známkami ICRAF.
Z radiodiagnostických metod pak má zásadní význam CT vyšetření s nálezem kolekce tekutiny a bublin plynu kolem cévní protézy. V diferenciálně diagnostických případech pak je velmi výhodné využít FDG PET CT s akumulací F-18 fluorodeoxyglukózy v ložisku infekce [8, 9].
Léčba ICRAF vyžaduje personalizovaný přístup ke každému nemocnému. Extraanatomické rekonstrukce donedávna považované za zlatý standard řešení ICRAF po extirpaci infikované protézy lze použít u vysoce virulentních cévních infekcí (gram-negativní, anaerobní, methicillin rezistentní stafylokoky – MRSA, mykotické infekce – časté u píštělí do gastrointestinálního traktu) s těžkým místním nálezem v oblasti centrální, aortální anastomózy. Jejich značnou nevýhodou je jejich špatná dlouhodobá průchodnost, vysoký počet amputací, nebezpečí krvácení z aortálního pahýlu (5–23 % nemocných) a nezanedbatelný je i počet reinfekcí [10, 11]. Proto „in situ“ rekonstrukce především u méně virulentních infekcí jsou metodou léčebné volby po extirpaci cévní rekonstrukce a důsledném debridement okolních infikovaných tkání. Volba materiálu cévní protézy závisí na jeho dostupnosti a zvyklosti operujícího chirurga. Vhodnými materiály jsou např. femorální žíla, protézy kryté stříbrem nebo sycené antibiotikem (Rifampicin), čerstvý nebo prezervovaný allograft. Nelze jednoznačně upřednostňovat ten či onen typ rekonstrukce, nicméně pokud je k dispozici čerstvý allograft nebo vhodná žíla, budou výsledky těchto rekonstrukcí pravděpodobně lepší ve srovnání s ostatními materiály. Incidence reinfekce je u těchto materiálů nejnižší [12]. Výjimečně lze u nízce virulentních infekcí použít i PTFE protézu. Důležité je vést „in situ“ rekonstrukci novým kanálem v retroperitoneu a krýt ji omentem, pokud je to technicky možné [13]. Otázka antibiotik je rovněž diskutována v řadě publikací. Pokud není primárně k dispozici materiál na bakteriologické vyšetření, podávají se baktericidní širokospektrá antibiotika a po operačním výkonu pak dle kultivace již cílená antibiotika po domluvě s antibiotickým střediskem. Délka podávání antibiotik se rovněž různí, někteří doporučují podávat antibiotika trvale, jiní dodržují limit 6 měsíců a jiní ukončují jejich podávání po normalizaci bílého krevního obrazu, CRP, PCT. K této poslední skupině se řadíme i my. Pokud není postižena celá cévní protéza infekcí a její centrální část je dostatečně vhojena do okolní tkáně, snažíme se o maximálně konzervativní postup – místní výkony v třísle, drenáže (včetně vakuové drenáže s krytím místa cévní anastomózy), s kterým máme v souhlase i s jinými autory [14, 15] velmi dobré zkušenosti. U těžce polymorbidních nemocných, kde rozsáhlý operační výkon není možný, můžeme volit drenážní výkony s instalací proplachové drenáže podél infikované protézy. Nicméně tento postup je zatížen vysokou mortalitou, tak jako tomu bylo i v našem souboru nemocných.
ZÁVĚR
ICRAF mají stále vysokou morbiditu a mortalitu nemocných. Jejich léčba vyžaduje individualizovaný přístup. Jednoznačně má být směrována do cévních center s multidisciplinárním týmem schopným řešit na patřičné úrovni tyto závažné komplikace rekonstrukční cévní chirurgie.
Práce podpořena Výzkumným projektem P 36 Univerzity Karlovy.
Prof. MUDr. Vladislav Třeška, DrSc.
U Českého dvora 11
326 00 Plzeň
e–mail: treska@fnplzen.cz
Zdroje
1. Herman J, Utíkal P, Sekanina Z, Bachleda P. Infekce náhrad abdominální aorty. Rozhl Chir 2009;88(7):349–352.
2. OęConnor S, Andrew P, Batt M, Becquemin JP. A systematic review and meta-analysis of treatments for aortic graft infection. J Vasc Surg 2006;44 : 38–45.
3. Healy AH, Reid BB, Allred BD, Doty JR. Antibiotic-Impregnated beads for the treatment of aortic graft infection. Ann Thorac Surg 2012;93 : 984–985.
4. Calligaro KD, Veith FJ, Yuan JG, Gargiulo NJ, Dougherty MJ. Intra-abdominal aortic graft infection: Complete or partial graft preservation in patients at very high risk. J Vasc Surg 2003;38 : 1199–1205.
5. Larena-Avellaneda A, Russman S, Fein M, Debus ES. Prophylactic use of silver-acetate-coated graft in arterial occlusive disease: A retrospective, comparative study. J Vasc Surg 2009;50 : 790–798.
6. Hart JP, Eginton MT, Broiwn KR, Seabrook GR, Lewis BD, Edmiston ChE, Towne JB, Cambria RA. Operative strategies in aortic graft infections: Is complete graft excision always necessary? Ann Vasc Surg 2005;19 : 154–160.
7. Ali AT, Modrall G, Hocking J, Valentine J, Spencer H, Eidt JF, Clagett P. Long-term results of the treatment of aortic graft infection by in situ replacement with femoral popliteal vein grafts. J Vasc Surg 2009;50 : 30–39.
8. Gardet E, Addas R, Monteil J, Le Guyader A. Comparison of detection of F-18 fluorodeoxyglucose positron emission tomography and 99m Tc-hexamethylpropylene amine oxide labelled leukocyte scintigraphy for an aortic graft infection. Interact CardioVasc Thorac Surg 2010;10 : 142–143.
9. Aavik A, Lieberg J, Kals J, Pulges A, Kals M, Lepner U. Ten years experience of treating aorto-femoral bypass graft infection with venous allografts. Eur J Vasc Endovasc Surg 2008;36 : 432–437.
10. Garg N, Kalra M. Novel extra-anatomic intra-abdominal reconstruction for treatment of paravisceral aortic infection. J Vasc Surg 2012;55 : 599–602.
11. Oderich GS, Bower TC, Cherry KJ, Panneton JM, Sullivan TM, Noel AA, Carmo M, Cha S, Kalra M, Gloviczki P. Evolution from axillofemoral to in situ prosthetic reconstruction for the treatment of aortic graft infections at a single center. J Vasc Surg 2006;43 : 1166–1174.
12. Staffa R, Kříž Z, Vlachovský R, Dvořák M, Novotný T, Buček J, Sárník S, Vojtíšek B. Autogenní povrchní stehenní žíla jako náhrada infikované aorto-iliko-femorální cévní rekonstrukce. Rozhl Chir 2010;89 : 39–44.
13. Kieffer E, Gomes D, Chiche L, Fléron LCh, Koskas F, Bahnini A. Allograft replacement for infrarenal aortic graft infection: Early and late results in 179 patients. J Vasc Surg 2004; 39 : 1009–1017.
14. Batt M, Jean-Baptiste E, OęConnor S, Bouillanne PJ, Haudebourg P, Hassen-Khojda R, Declemy S, Farhad R. In-situ revascularisation for patients with aortic graft infection: A single centre experience with silver coated polyester grafts. Eur J Vasc Endovasc Surg 2008;36 : 182–188.
15. Brown KE, Heyer K, Rodriquez H, Eskandari M, Pearce WH, Morasch MD. Arterial reconstruction with cryopreserved human allografts in the setting of infection: A single-center experience with midterm follow-up. J Vasc Surg 2009;49 : 660–666.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2012 Číslo 11- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- O úspěšnosti operací
- Současná mikrochirurgická a neurointervenční terapie mozkových aneuryzmat
- Významné životní jubileum doc. Čestmíra Neorala
- Infekce cévních rekonstrukcí v aortofemorální oblasti
- Opakované operace pro karcinom příštítného tělíska
- Význam endosonografie v předoperačním managementu nemocných s karcinomem hlavy pankreatu
- Výtěžnost peroperační ultrasonografi v chirurgii příštítných tělísek
- Ošetření pankreatické pooperační píštěle gastrofistuloanastomózou – soubor kazuistik
- NanoKnife a dva úspěšné případy intrakavitální ireverzibilní elektroporatizace nádorů hlavního bronchu
- Postup při poranění břicha
- Poranění pankreatu
- Současný postup u poranění sleziny
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současný postup u poranění sleziny
- Postup při poranění břicha
- Opakované operace pro karcinom příštítného tělíska
- Současná mikrochirurgická a neurointervenční terapie mozkových aneuryzmat
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



