-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné postupy při řešení karcinomu jícnu
Autoři: R. Aujeský; Č. Neoral
Působiště autorů: I. chirurgická klinika LF a UP Olomouc, přednosta Doc. MUDr. Č. Neoral, CSc.
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 10, s. 568-573.
Kategorie: Postgraduální vzdělávání
Karcinom jícnu patří mezi diagnózy, jejichž počet stále narůstá. Nejčastějšími typy jsou spinocelulární karcinom a adenokarcinom. Jestliže v minulosti byl ve dvou třetinách případů diagnostikován spinocelulární karcinom, v průběhu 20 let se prevalence obou typů výrazně změnila a stále je demograficky zásadně odlišná. Zatímco v Japonsku nadále představuje spinocelulární karcinom 90 % všech karcinomů jícnu, v západních zemích v posledních 3 dekádách rapidně narůstá počet adenokarcinomů [1]. Orringer v sestavě karcinomů jícnu od r. 1976 do roku 1998 uvádí 73 % a 69 % adenokarcinomů aborální třetiny jícnu a ezofagogastrické junkce [16]. Nárůst incidence adenokarcinomu, stejně jako pokles výskytu spinocelulárního karcinomu v západních zemích, souvisí především se změnou životního stylu. Ke vzniku spinocelulárního karcinomu přispívají alimentární zlozvyky, především konzumace bílých destilátů, jejichž spotřeba v posledních letech klesá ve prospěch kvalitnějších alkoholů, především vína. Naopak adenokarcinom jícnu vzniká většinou malignizací Barrettovy sliznice (pokud nepřerůstá z kardie), tedy v souvislosti s refluxní chorobou jícnu, jejíž výskyt snad i díky kvalitnější diagnostice stále narůstá [17]. Nicméně diagnostika i terapie obou typů karcinomu jícnu je samozřejmě identická. Významný rozdíl spočívá pouze ve stagingu obou onemocnění v období stanovení diagnózy. U spinocelulárního karcinomu je ve více než 90 % prvním symptomem dysfagie, což je příznak pozdní, vzniku adenokarcinomu často předchází dlouhá anamnéza projevů refluxní choroby, takže zde je větší pravděpodobnost stanovení diagnózy v časnějším stadiu choroby [3]. Nicméně průměrná délka anamnézy nemocných s karcinomem jícnu jsou pouhé dva měsíce.
Předoperační období
Při diagnostice karcinomu jícnu využíváme na prvním místě ezofagogastroskopii s odběrem materiálu na histologické vyšetření. Podává nám informaci o lokalizaci tumoru, rozsahu postižení jícnu i míře stenotizace jeho lumen. Informace o lokalizaci tumoru je důležitá pro volbu budoucího operačního přístupu při resekci jícnu, průchodnost tumoru při endoskopii pro posouzení indikace k založení nutritivní jejunostomie před neoadjuvantní terapií. V pořadí druhým vyšetřením, nutným ke stanovení dalšího postupu, je PET CT. To nám v posledních letech zcela nahradilo klasické CT, které v případě diagnostiky tumorů jícnu už nevyužíváme. Rozdíl v těchto vyšetřeních spočívá jednak v přesnější detekci metastáz, především v lokalizacích, kde v období klasického CT nebyly identifikovány (gluteální krajina…), a jednak v podstatně přesnější monitoraci efektu neoadjuvantní radiochemoterapie. V případě klasického CT může být obraz před a po neoadjuvanci stejný, přitom nelze odlišit, jak velký objem tumoru byl po onkologické léčbě nahrazen fibrózou. Na PET CT je tento rozdíl zobrazen naprosto dokonale. Na základě výsledku PET CT a celkového stavu nemocného včetně nutričních parametrů a přidružených chorob, zejména kardiovaskulárních, se rozhoduje o dalším postupu [10]. Endosonografii využíváme pouze u stadia T1, kde je metodou volby lokální terapie. Poskytuje nám informace jednak o vztahu tumoru k submukóze, jednak o periezofageálních uzlinách. Nemocní s generalizací tumoru jsou indikováni k zajištění výživy samoexpanzivním stentem, v případě lokalizace tumoru v oblasti krčního jícnu, kde je největší riziko fisurace jícnu horním okrajem stentu s možností tracheoezofageální píštěle či dokonce perforace karotidy, je metodou volby spíše výživná gastrostomie. Po zajištění nutrice následuje paliativní onkologická terapie. Nemocní bez diagnostikované generalizace tumoru jsou indikováni k radikální terapii. Většina z nich před operací podstupuje neoadjuvantní radiochemoterapii. Řada pracovišť indikuje pro stadia T1-T2N0M0 výkon bez neadjuvantní terapie, tu rezervuje pro stadia T3N0-1M0 anebo T1-3N1M0 [23]. My indikujeme k onkologickému předléčení i stadia T2N0M0, protože ani PET CT nemůže eventuální uzlinový proces zcela vyloučit. K radiochemoterapii, předcházející resekčnímu výkonu na jícnu, jsou indikováni nemocní přímo, pokud tolerují alespoň kašovitou stravu, a jícen s nádorovou infiltrací je pro endoskop prostupný. V opačném případě onkologické terapii předchází založení nutritivní jejunostomie. Většina pracovišť v rámci neadjuvantní terapie provádí chemoterapii kombinací 5-Fluorouracil a Cisplatina, radioterapii v dávce 40–64 Gy [6]. Pro stadium T1N0M0 jsou v současné době metodou volby endoskopická mukozektomie anebo endoskopická subslizniční resekce. Podmínkou výkonu je pečlivé endosonografické vyšetření, při kterém je vyloučeno prorůstání tumoru do submukózy a absence zvětšených periezofageální uzlin. Aspirační mukozektomie je z obou metod bezpečnější, ale „en block“ jí lze resekovat léze maximálně do 20 mm, endoskopickou subslizniční resekcí je možné řešit i léze větší než 20 mm, ale je zde vyšší riziko komplikací, především krvácení a perforace [22].
Operace
K operačnímu výkonu jsou nemocní indikování nejdříve 2 měsíce po ukončení onkologické terapie. Podmínkou je kontrolní vyšetření PET CT, vylučující generalizaci tumoru. U většiny případů je při srovnávání s vyšetřením před neoadjuvancí nalezena regrese tumoru, nejčastěji parciální. Nicméně studie zabývající se efektivitou předoperační radiochemoterapie popisují kompletní odezvu s úplným vymizením tumoru u 15–40 % nemocných [6]. V těchto případech pak při indikaci k operaci rozhoduje celkový stav nemocného a s tím spojené riziko operačního výkonu i postoj nemocného k operaci. Neoperovaní nemocní musejí být následně pečlivě dispenzarizováni s pravidelným PET CT a endoskopickým vyšetřením.
Operační přístupy
O operačním přístupu rozhoduje lokalizace tumoru, stav nemocného i zkušenosti a zvyklosti pracoviště. Paralelně se využívají jak přístupy klasické, tak miniinvazivní.
Klasické přístupy
Tumory dolní třetiny jícnu
Transhiatální přístup dle Orringera, levostranná torakotomie, torakofrenolaparotomie. Z těchto přístupů se nejčastěji využívá transhiatální, který je pro nemocného nejšetrnější. Nedochází při něm k otevření hrudníku, byť artificiální poranění mediastinální pleury není vzácné. Jeho nevýhodou je preparace v mediastinu „naslepo“, bez kontroly zraku s omezenou radikalitou a možnými hemoragickými komplikacemi. Práce porovnávající transhiatální a transtorakální přístup s extenzivní lymfadenektomií většinou konstatují, že transhiatální přístup je zatížen nižší operační morbiditou a snazším pooperačním průběhem, ale v horizontu pětiletého přežívání je úspěšnější torakotomický přístup [7]. Nicméně podle jiných studií není rozdíl v dlouhodobém přežívání u mininvazivního a otevřeného přístupu, včetně jeho podskupin – transhiatální, torakotomické i kombinované miniinvazivní [23]. Rovněž hospitalizační mortalita je ve všech skupinách téměř stejná [5].
Torakofrenolaparotomii dnes považujeme za obsoletní. Poskytuje sice velmi dobrý přehled o regiu dolní třetiny jícnu, ale hojení operační rány je obtížnější než u jiných přístupů. Další nevýhody, respektive pooperační komplikace výkonu souvisejí s nutností otevření pleurální dutiny.
Levostranná torakotomie byla rezervována pro tumory dolní třetiny hrudního jícnu a dodnes se ještě na některých pracovištích používá. Preferovanějším je ale v těchto případech transhiatální přístup. Na našem pracovišti se levostranná torakotomie užívá při exstirpacích jícnu jen velmi sporadicky. Logickou indikací by byly velké tumory aborálního hrudního jícnu, adherující k aortě, špatně přístupné klasickou transhiatální cestou. Ty ale lze v současné době řešit efektivněji transhiatálně videolaparoskopicky. Podstatně více je levostranná torakotomie v současné době využívána při řešení tumorů kardie, přerůstajících na žaludek a částečně na jícen, kdy po totální gastrektomii s resekcí aborálního jícnu není konstrukce ezofagojejunoanastomózy v mediastinu transhiatální cestou bezpečná anebo dokonce proveditelná.
Tumory střední a horní třetiny jícnu
Pravostranná torakotomie – jediný klasický a stále nejpoužívanější přístup pro řešení tumorů orálních dvou třetin jícnu. Výše torakotomie koresponduje s lokalizací tumoru, nejčastěji se využívá 6 mezižebří.
Miniinvazivní přístupy (MIE)
Jde buď o zcela miniinvazivní techniky, kdy břišní i hrudní fáze jsou prováděny pouze mininvazivně, anebo manuálně asistovaně s využitím hand portu anebo minilaparotomie. Patří sem laparoskopická chirurgie (LS), manuálně asistovaná laparoskopická chirurgie (HALS), torakoskopická chirurgie (TS) a videoasistovaná torakoskopická chirurgie (VATS). V případě transhiatálního přístupu se rozlišuje transhiatální laparoskopický (LTH) a manuálně asistovaný transhiatální laparoskopický (HALT). Jako hybridní miniinvazivní ezofagektomie (HMIE) se označují výkony, kdy jedna fáze (hrudní anebo břišní) je provedena miniinvazivně a druhá klasicky [11].
Naše pracoviště využívá videoasistovaný transhiatální anebo videoasistovaný torakoskopický přístup [13]. V případě transhiatálního přístupu používáme stejné rozmístění portů jako při operacích v oblasti jícnového hiatu bránice (Obr. 1). Samotný výkon začínáme přerušením malého omenta v jeho avaskulární partii, následně pokračujeme izolací obou crus jícnového hiatu bránice a poté izolací jícnu v mediastinu orálním směrem. Zde v závislosti na velikosti tumoru i míře fibrózní infiltrace po radioterapii může dojít k arteficiálnímu otevření pleurálních dutin parciální disekcí mediastinální pleury. Touto cestou lze izolovat aborální polovinu jícnu. V některých případech se může podařit uvolnění jícnu až pod v. azygos. U torakoskopického přístupu je nemocný v poloze na levém boku, téměř na břiše, porty umísťujeme v zadní axiální čáře ve 3., 5. a 7. mezižebří, čtvrtý port pak ve skapulární čáře většinou v sedmém mezižebří. Výkon se provádí při selektivní intubaci s desuflací pravé plíce. Představuje podélné protětí mediastinální pleury nad jícnem, izolaci jícnu od aorty se selektivním přerušením cévního zásobení z aorty. V závislosti na uložení tumoru, většinou v oblasti bifurkace trachey, se nevyhneme přerušení v. azygos endovaskulárním staplerem. Při této lokalizaci tumoru je největším rizikem poranění hlavních bronchů. Hlavní výhodou oproti klasické torakotomii by měla být především nižší incidence respiračních komplikací. Ty jsou u klasického přístupu z velké části způsobeny omezením plicní ventilace v časném pooperačním období, peroperačně pak poměrně dlouho trvající desuflací jedné plíce při selektivní intubaci. Tu sice využíváme i u torakoskopického přístupu, ale ventilaci nemocného v bezprostředním pooperačním období neomezuje velká rána s většinou přerušeným žebrem. Přitom bronchopneumonie a respirační selhání po ezofagektomii jsou spojeny s více než 20% rizikem úmrtí v časném pooperačním období [2]. Názory na vliv mininvazivní techniky na snížení respiračních komplikací se však rozcházejí. Podle některých studií se respirační komplikace v časném pooperačním období po resekci jícnu vyskytují ve stejné míře u miniinvazivního přístupu jako u klasické torakotomie [14]. Jiné práce naopak uvádějí nižší frekvenci respiračních komplikací u mininvazivního přístupu [11]. My jsme zaznamenali snížení respiračních komplikací u mininvazivních resekcí oproti resekcím z torakotomie o 22 %. V případě klasické torakotomie může snížit riziko pooperačních respiračních komplikací epidurální analgesie [19]. Lymfadenektomie je nedílnou součástí ezofagektomie. Na její extenzivitu se však názory liší. Řada pracovišť, a my se k nim řadíme, považuje za dostatečnou lymfadenektomii ze dvou polí, která představuje odstranění mediastinálních, perigastrických a celiakálních uzlin. Především japonští autoři ji v rámci lymfadenektomie ze 3 polí rozšiřují o disekci supraklavikulárních a krčních paratracheálních uzlin [8, 21]. Počet odebraných lymfatických uzlin je zhruba stejný u torakotomického a miniinvazivního přístupu, u transhiatálního je znatelně menší. Nicméně dle některých studií nemá extenzivní lymfadenektomie na dlouhodobé přežívání nemocných po resekci jícnu velký vliv [20]. Omloo a kol. nenalezl významný rozdíl v 5letém přežívání nemocných ve stadiu II po resekci jícnu z pravostranné torakotomie a transhiatálního přístupu, bylo to 34 % a 36 % pro torakotomovanou skupinu. Ale v případě menšího počtu pozitivních uzlin shledal významně lepší přežívání u torakotomického přístupu. Při nálezu více než 8 pozitivních uzlin pak bylo přežívání v obou skupinách nemocných stejně špatné. Stejně tak se nelišilo v raritní kategorii nemocných, kteří měli všechny uzliny negativní [14]. Zde byla prognóza těchto nemocných velmi dobrá. My rutinně provádíme lymfadenektomii ze dvou polí, tedy bez disekce krčních uzlin, ale víceméně pokládáme nález pozitivních uzlin pouze za prognostický faktor délky přežívání, na které extenzivní lymfadenektomie nemá velký vliv. Stále není zcela jasné, zda existuje zásadní rozdíl ve vlivu neoadjuvantní terapie na pooperační průběh nemocných operovaných miniinvazivně a klasicky. Většinou se uvádí, že zatímco u nemocných, kteří nepodstoupili předoperační radiochemoterapii, je operační morbidita v případě mininvazivního i klasického přístupu téměř stejná, po neoadjuvanci se významně zvyšuje u miniinvazivní skupiny [24]. My máme zkušenosti opačné. U nemocných po radiochemoterapii se pravidelně setkáváme s nálezem fibrózního infiltrátu v mediastinu, zaujímajícího jícen, mediastinální pleuru, perikard a hrudní aortu. Jakákoliv izolace jícnu v tomto terénu je obtížná. Tady je transhitální přístup „naslepo“ zatížen vysokým rizikem krvácení. Torakotomický přístup nemocné s předchozí radioterapií zase více zatěžuje rizikem respiračních komplikací. Proto je v těchto případech mininvazivní přístup torakoskopický či laparoskopický velmi výhodný. Dle některých studií je krevní ztráta u MIE nižší než u klasické torakotomie, ale doba operace znatelně delší [11, 20]. S nižší krevní ztrátou u miniinvazivního přístupu souhlasíme, ale délka operace je dle našich zkušeností prakticky stejná jako u klasického přístupu. Dokonce může být i kratší v případě výše uložených nádorů, klasicky operabilních pouze za cenu torakotomie, které lze miniinvazivně vyřešit transhiatální cestou.
Obr. 1. Umístění portů při laparoskopické exstirpaci jícnu 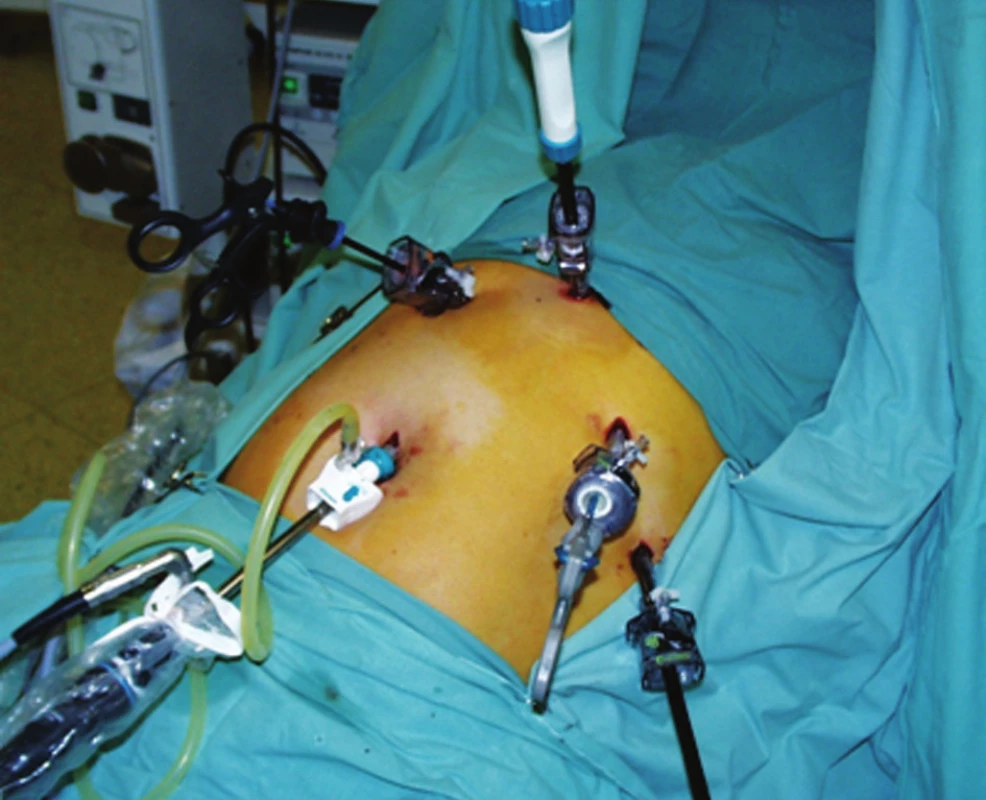
Rekonstrukce jícnu
K rekonstrukci zažívacího traktu po exstirpaci jícnu se využívají žaludek, tlusté i tenké střevo.
Náhrada žaludkem patří mezi nejčastější typ substituce jícnu po jeho resekci. Výhodou oproti náhradě tračníkem je kratší čas výkonu a pouze jedna anastomóza. Nižší morbidita i letalita jsou způsobeny i menším počtem anastomotických komplikací, především díky lepšímu prokrvení žaludečního transponátu. Určitou nevýhodou použití žaludku oproti tlustému střevu je horší odolnost žaludeční sliznice vůči biliárnímu refluxu a ztráta žaludečního rezervoáru. Ta se u nemocného projevuje zmenšením velikosti jednotlivé porce stravy, většinou o třetinu až polovinu oproti předchorobí. Tenké střevo není rovnocennou náhradou za žaludeční tubus nebo kolon pro svou limitovanou délku, většinou neumožňující vitální anastomózu v kupule mediastina, natož na krku.
Rekonstrukce celým žaludkem
Vychází z původní práce I. Lewise z r. 1946 [9]. Při této technice je žaludek mobilizován tak, aby byl ponechán intaktní systém pravého gastroepiploického i gastrického cévního svazku. Resekce jícnu je provedena z pravostranné torakotomie a ezofagogastrická anastomóza je konstruovaná v hrudníku.
Rekonstrukce žaludečním tubusem (Akiyama 1978) [1]
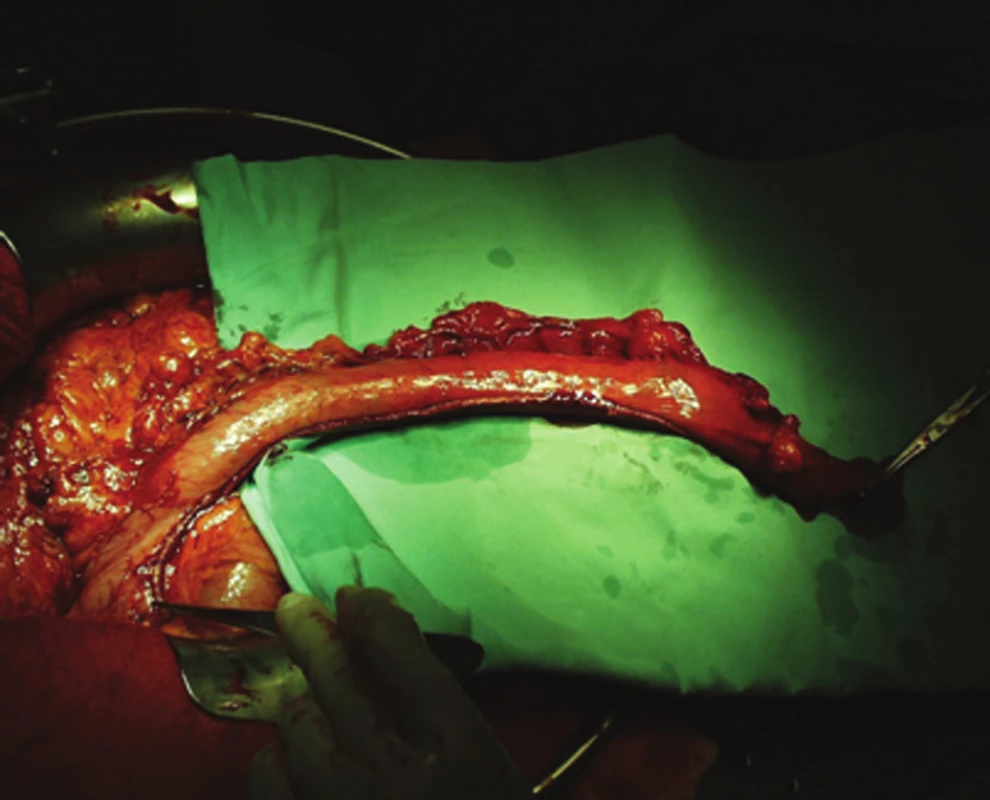
Operace vznikla z potřeby vytvořit tak dlouhou náhradu jícnu, aby bylo možné její uložení v retrosternálním prostoru s anastomózou na pahýl krčního jícnu. V současné době se žaludeční tubus, až na výjimky, umísťuje v zadním mediastinu v místě uložení původního jícnu. Po otevření omentální burzy je žaludek skeletizován tak, aby byly zachovány všechny větve pravé gastroepiploické tepny a vény. Vasa gastrica brevia, včetně zadní gastrické tepny jako jejich první větve, se kompletně přerušují, takže orální polovina tubusu je zásobována a venózně drénována pouze intramurální cévní sítí. Velká kurvatura žaludku musí být uvolněna až k abdominálnímu jícnu. Pravá gastrická tepna může být zachována, ale pro zásobení tubusu nemá velký význam, oproti tomu její přerušení napomůže mobilizaci neojícnu. Samotnou konstrukci žaludečního tubusu provádíme s pomocí katrů, oblast naložení jednotlivých staplerů přešíváme jednotlivými stehy, celou resekční linii pokračujícím stehem (Obr. 2, 3). Za nedílnou součást výkonu je u většiny pracovišť považována pyloroplastika. Někteří autoři ji neprovádějí z obavy možného biliárního refluxu, který nastává až u poloviny nemocných [18]. My se ale kloníme k většinou uznávanému názoru, že podstatně důležitější je zajištění hladké evakuace neojícnu. V opačném případě hrozí insuficience anastomózy se všemi možnými důsledky.
Obr. 2. Konstrukce žaludečního tubusu 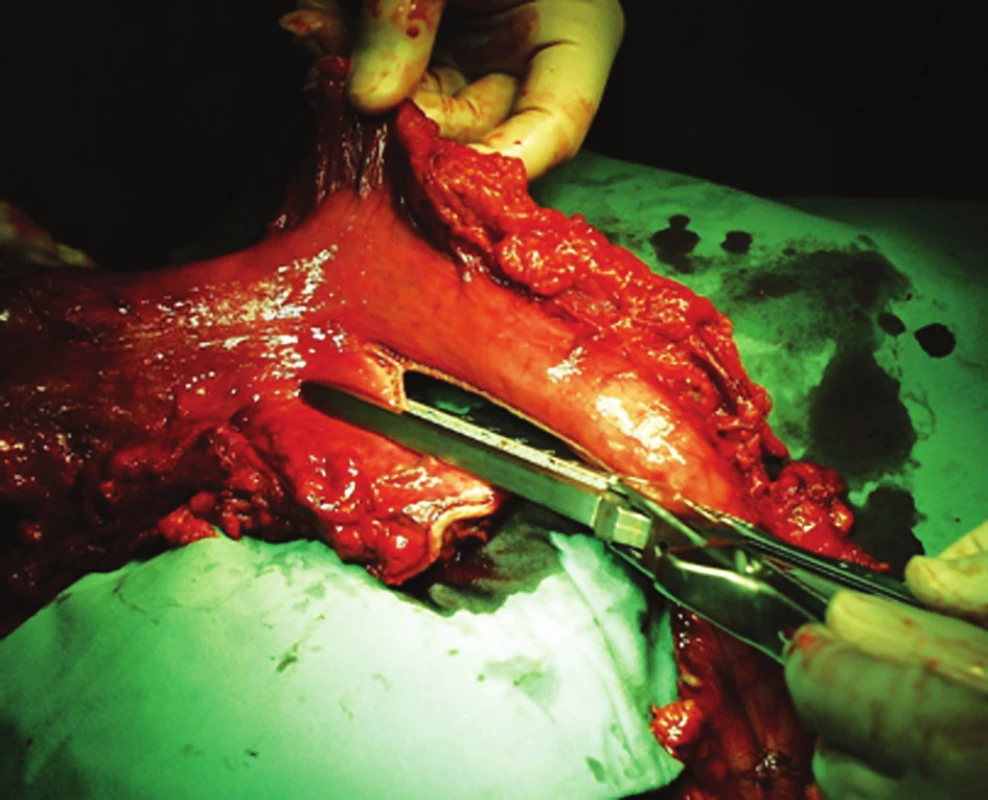
Rekonstrukce tenkým střevem
Dnes se využívá pouze při parciální resekci jícnu jako součásti totální gastrektomie při přerůstání tumoru žaludku na distální partii jícnu. K náhradě se využívá unilaterální exkludovaná klička jejuna buď s J pouchem, anebo bez rezervoáru. Pro náhradu větší části jícnu tato rekonstrukce vhodná není.
Rekonstrukce tlustým střevem
Tento typ náhrady se využívá především k rekonstrukci pasáže po exstirpaci jícnu u benigních onemocnění, jako jsou achalázie IV. stupně, korozivní ezofagitida anebo vrozené vady jícnu u dětí. V případě malignit jícnu se dnes využívá prakticky pouze tehdy, kdy k substituci odstraněného jícnu nelze použít žaludek. Je to především po předchozích resekčních výkonech na žaludku anebo tehdy, kdy rozsah nádoru vyžaduje nejen exstirpaci jícnu, ale i totální gastrektomii. Velkou výhodou této rekonstrukce je lepší kvalita života nemocných oproti všem ostatním typům náhrady. Vzhledem ke kapacitě tlustého střeva, použitého k náhradě, tolerují nemocní často stejně velké porce stravy jako v předchorobí. Pasáž neojícnem zde, stejně jako u jiných náhrad jícnu, probíhá pasivně pouze po gravitačním spádu i několik hodin, ale to nemocný nepociťuje. Značnou nevýhodou tohoto typu rekonstrukce oproti žaludečnímu tubusu je větší operační morbidita i mortalita díky problematičtější vaskularizaci tračníku. K rekonstrukci se dnes využívá především příčný tračník s částí sestupného tračníku, jako výživnou cévní stopku dnes preferujeme před střední levou kolickou tepnu [12]. Pro dobrou funkci kolotransponátu je podstatné zvolení jeho správné délky. Musí být taková, aby dolní část neojícnu nebyla prověšená a zároveň anastomóza s krčním jícnem nebyla pod tahem. Aborální konec transponátu anastomozujeme s žaludkem, respektive jeho pahýlem, pokud je po resekci. Další možností je anastomóza s bulbem duodena anebo Rouxovou kličkou. Velkou výhodou rekonstrukce s využitím Rouxovy kličky je absence biliárního refluxu do transponátu.
Anastomóza
Lokalizace anastomózy
Stejně jako její vlastní provedení zůstává i lokalizace anastomózy dodnes věcí názoru a ani četné prospektivní randomizované studie nepřispěly k jejímu ujednocení. Anastomóza jak na krku, tak v hrudníku má své výhody i nevýhody. Výhodou hrudní anastomózy je zkrácení doby operace v případě, kdy byla exstirpace jícnu prováděna z torakotomie. Další nezanedbatelnou výhodou je podstatně menší nárok na délku jícnové náhrady, a tedy logicky nižší nebezpečí špatné vitality neojícnu. S tím souvisí i skutečnost, že anastomóza v hrudníku je ve srovnání s anastomózou na krku zatížena menším rizikem její dehiscence [25]. Hlavním argumentem proti lokalizaci anastomózy v hrudníku je menší onkologická radikalita výkonu a především velké riziko mediastinitidy v případě její dehiscence. Naše klinika ve většině případů volí následující postup. U resekcí jícnu bez otevření hrudníku (včetně torakoskopických výkonů) indikujeme anastomózu transponátu s pahýlem krčního jícnu. Pokud jsme nuceni provést deliberaci jícnu z torakotomie a lze dodržet vzdálenost resekční linie od hranice tumoru nejméně 6 cm, pak provádíme anastomózu v mediastinu.
Konstrukce anastomózy
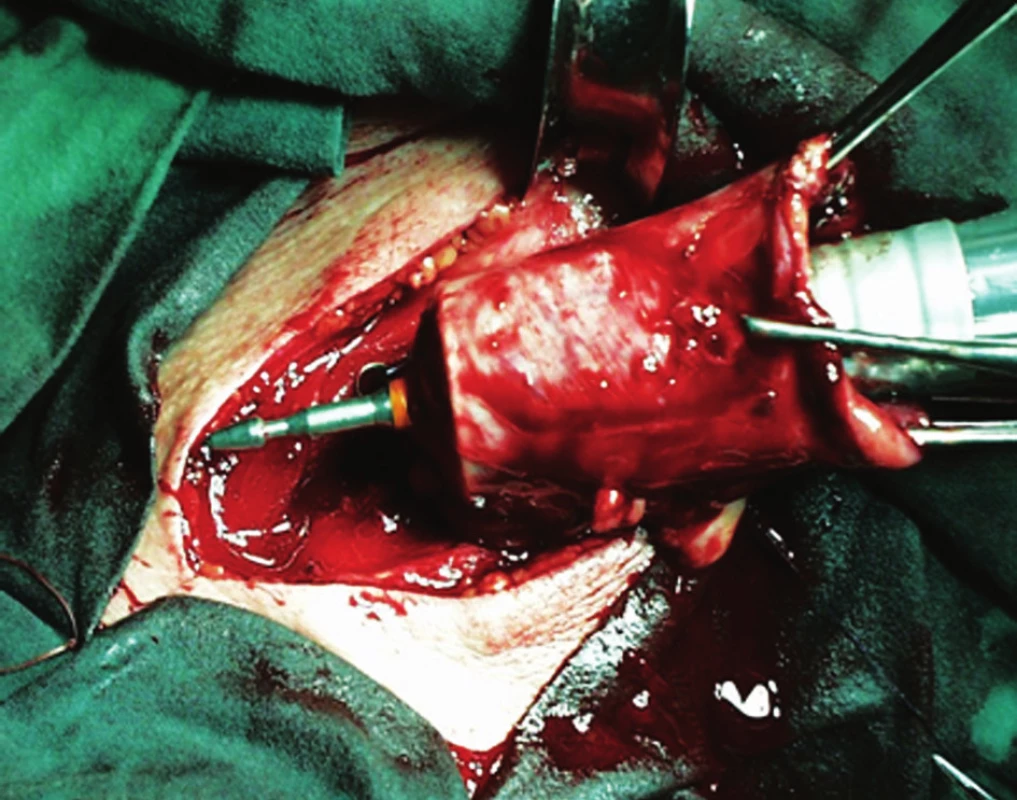
V současné době se využívají jak manuálně, tak staplerem konstruované anastomózy. Staplerové anastomózy jsou zatíženy nižším rizikem dehiscence, ale mají vyšší četnost striktur, především v pozdějším pooperačním období [4]. Při jejich konstrukci existuje řada modifikací, např. side to side anastomózy, konstruované GIA katrem anebo častěji anastomózy tvořené kruhovým staplerem [15]. Ty jsme prováděli na naší klinice v době před 10 lety (Obr. 4). Manuálně konstruované anastomózy „z ruky“ se liší počtem vrstev, výběrem šicího materiálu a v neposlední řadě i šicí technikou. Naše pracoviště preferuje jednovrstevné end-to-end anastomózy, konstruované pokračujícím vstřebatelným stehem.
Pooperační péče
Bezprostředně po operaci je nemocný umístěn na specializovaném pooperačním oddělení, u nás nejčastěji na oddělení intenzivní péče chirurgických oborů anebo klinice anestezie a resuscitace. Jen výjimečně je probuzen a extubován bezprostředně po operaci, většinou zůstává několik dalších hodin na řízené ventilaci. K extubaci pak dochází za 6 až 18 hodin. Nutrice nemocného je realizována kombinací enterálního a parenterálního režimu. Enterální výživa je podávána prostřednictvím nutritivní části dvoucestné sondy, jejíž konec je zaveden do první jejunální kličky, derivační část sondy je lokalizována v neojícnu. Pokud je bezprostřední pooperační průběh bez komplikací, šestý až sedmý den po operaci je provedeno RTG vyšetření polykacího aktu. V případě vyloučení netěsnosti anastomózy je odstraněna dvoucestná sonda a zahájena pozvolná realimentace.
Doc. MUDr. René Aujeský, CSc.
I. chirurgická klinika LF a UP
I. P. Pavlova 6
775 20 Olomouc
Zdroje
1. Akiyama H, Miyazomo H. Use of the stomach as an esophageal substitute. Ann Surg 188 : 606–610,1978.
2. Atkins BZ, Shah AS, Hutcheson KA, Mangum JH, Pappas TN, Harpole DH Jr et al, Reducing hospital morbidity and mortality following esophagectomy. Ann Thorac Surg 2004;78 : 1170–6.
3. Aujeský R, Neoral Č, Král V, Klein J. Časný karcinom jícnu. Rozhl Chir 2000;79(11):524–7.
4. Beitler AL, Urschel JD. Comparison of stapled and hand-sewn esophagogastric anastomoses. Am J Surg 1998;175 : 337–40.
5. Braghetto I, Csendes A, Cardemil G, Burdiles P, Korn O, Valladares H. Open transthoracic or transhiatal esophagectomy versus minimally invasive esophagectomy in terms of morbidity, mortality and survival. Surg Endosc 2006;20(11):1681–6. Epub 2006 Sep 6.
6. Hingorani M, Crosby T, Maraveyas A, Dixit S, Bateman A, Roy R Neoadjuvant chemoradiotherapy for resectable oesophageal and gastro-oesophageal junction cancer—do we need another randomised trial? Clin Oncol (R Coll Radiol) 2011;23(10):696–705. Epub 2011 Jun 17.
7. Hulscher JB, van Sandick JW, de Boer AG, Wijnhoven BP, Tijssen JG, Fockens P, Stalmeier PF, ten Kate FJ, van Dekken H, Obertop H, Tilanus HW, van Lanschot JJ. Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the esophagus. N Engl J Med 2002;21;347(21): 1662–9.
8. Igaki H, Tachimori Y, Kato H. Improved survival for patients with upper and/or middle mediastinal lymph node metastasis of squamous cell carcinoma of the lower thoracic esophagus treated with 3-field dissection. Ann Surg 2004;239(4):483–90.
9. Lewis I. The surgical treatment of carcinoma of the oesophagus with special reference to a new operation for growths in the middle third. Br J Surg 1946;34 : 18–31.
10. Myslivecek M, Neoral C, Vrba R, Vomackova K, Cincibuch J, Formanek R, Koranda P, Zapletalova J. The value of (18)F-FDG PET/CT in assessment of metabolic response in esophageal cancer for prediction of histopathological response and survival after preoperative chemoradiotherapy. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2011 Nov 1. doi: 10.5507/bp. 2011.048.
11. Nagpal K, Ahmed K, Vats A, Yakoub D, James D, Ashrafian H, Darzi A, Moorthy K, Athanasiou T. Is minimally invasive surgery beneficial in the management of esophageal cancer? A meta-analysis. Surg Endosc 2010;24(7):1621–9. Epub 2010 Jan 28.
12. Neoral C, Aujeský R, Král V. Esophageal replacement using large intestine – experience with 109 cases. Rozhl Chir 2010;89(12):740–5.
13. Neoral Č, Aujeský R, Král V, Bohanes T, Vrba R. Naše zkušenosti s transhiatální laparoskopickou ezofagektomií. Slovenský chirurg 2004;3 : 9–11.
14. Omloo JM, Lagarde SM, Hulscher JB, Reitsma JB, Fockens P, van Dekken H, Ten Kate FJ, Obertop H, Tilanus HW, van Lanschot JJ. Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the mid/distal esophagus: five-year survival of a randomized clinical trial. Ann Surg 2007;246(6):992–1000; discussion 1000–1.
15. Orringer MB, Marshall B, Iannettoni MD. Eliminating the cervical esophagogastric anastomotic leak with a side-to-side stapled anastomosis. J Thorac Cardiovasc Surg 2000 Feb;119(2): 277–88.
16. Orringer MB, Marshall B, Iannettoni MD. Transhiatal esophagectomy: clinical experience and refinements. Ann Surg 1999;230 : 392–403.
17. Pera M, Cameron AJ, Trastek VF et al. Increasing incidence of adenocarcinoma of the esophagus and esophagogastric junction. Gastroenterology 1993;104 : 510–513.
18. Poghosyan T, Gaujoux S, Chirica M, Munoz-Bongrand N, Sarfati E, Cattan P. Functional disorders and quality of life after esophagectomy and gastric tube reconstruction for cancer. J Visc Surg 2011;148(5):e327–35. Epub 2011 Oct 22.
19. Rigg JRA, Jamrozik K, Myles PS et al. Epidural anaesthesia and analgesia and outcome of major surgery: a randomised trial. Lancet 2002;359 : 1276–82.
20. Smithers BM, Gotley DC, Martin I, Thomas JM. Comparison of the outcomes between open and minimally invasive esophagectomy. Ann Surg 2007 : 245 : 232–40.
21. Udagawa H, Ueno M, Shinohara H, Haruta S, Kaida S, Nakagawa M, Tsurumaru M. The importance of grouping of lymph node stations and rationale of three-field lymphoadenectomy for thoracic esophageal cancer. J Surg Oncol 2012 Apr 13.
22. Urabe Y, Hiyama T, Tanaka S, Yoshihara M, Arihiro K, Chayama K. Advantages of endoscopic submucosal dissection versus endoscopic oblique aspiration mucosectomy for superficial esophageal tumors. J Gastroenterol Hepatol 2011;(2):275–80. doi: 10.1111/j.1440-1746.2010.
23. Zingg U, McQuinn A, DiValentino D, Esterman AJ, Bessel JR. Minimally invasive vs open esophagectomy. Ann Thorac Surg 2009;87 : 911–9.
24. Urschel JD, Vasan H. A meta-analysis of randomized con trolled trials that compared neoadjuvant chemoradiation and surgery to surgery alone for resectable esophageal cancer. Am J Surg 2003;185 : 538–43.
25. Urschel JD. Esophagogastrostomy anastomotic leaks complicating esophagectomy: a review. Am J Surg 1995;169 : 634–40.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Práce je hodně, lidí máloČlánek Hrudní chirurgie
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2012 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Práce je hodně, lidí málo
- History of thoracic surgery: From the beginnings to the end of the 19th century
- Blahopřání k životnímu jubileu primáři Františku Čížkovi
- Traumatická ruptura hrudní aorty
- Idiopatické střevní záněty – vývoj chirurgické léčby
- Protein S-100b v diferenciální diagnostice komoce mozkové a povrchního poranění hlavy u pacientů v ebrietě
- Anaplastický karcinom štítné žlázy
- Katameniální pneumotorax – kazuistiky z vlastního pracoviště v období 10 let
- Raritní vnitřní kýla v ligmentum falciforme hepatis jako vzácná příčina náhlé příhody břišní
- Hrudní chirurgie
- Chirurgická léčba plicních metastáz
- Současné postupy při řešení karcinomu jícnu
- Karcinom plic z pohledu chirurga
- Empyém hrudníku – současný diagnosticko-léčebný algoritmus
- Významná monografie z oboru ortopedie
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Empyém hrudníku – současný diagnosticko-léčebný algoritmus
- Traumatická ruptura hrudní aorty
- Anaplastický karcinom štítné žlázy
- Karcinom plic z pohledu chirurga
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání