-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaProblematika embolizace větve portální žíly u nemocných s primárně neoperabilními nádory jater
Portal Vein Branch Embolization in Patients with Primary Inoperable Liver Tumors
Introduction:
Portal vein embolization (PVE) is indicated in patiens with insufficient liver remnants following liver resections for tumor disorders. Therefore, due to PVE, the number of primary operable patiens is higher. Insufficient growth of the liver parenchyma or malignant progression remain the PVE cons.Aim of the study:
To date outcomes of PVE are assessed based on the authors’ own experience and literature data. In particular, the authors focus on difficulties with PVE, i.e. its failures.Methods:
40 patients (35 with colorectal carcinoma metastases, 2 with breast carcinoma metastates and one with ovarian carcinoma metastases, 2 with hepatocellular carcinoma) were indicated for PVE due to insufficient liver reserve following planned liver resection.Results:
Liver resections were completed in 22 subjects, 42.6 days (mean value) after PVE. In14 (35%) subjects, the liver resection could not be performed (11x tumor progression, 3x insufficient liver tissue growth). In four subjects, only radiofrequency ablation was performed. At year one, two and three after the procedure, the survival rate is 83.7, 69.7 and 52.3% (resp.)of the subjects, while the survival rate following exploration and in unoperated subjects was 22.2% (25 subjects) (p< 0.001). A one-year, resp. two-year relapse – free survival rate was 30.3, resp. 7%.Conclusion:
PVE has become an established procedure in stage liver procedures, due to its potential to facilitate operability of primary and secondary liver tumors. In order to improve the outcomes, attention must be paid to the post - PVE growth of the liver parenchyma and further assessment of oncological treatment approaches during the pre - and post - PVE period, with the aim to reduce liver and extra-liver malignant progression rates prior to the liver resection procedure.Key words:
liver tumors – portal vein branch embolization – outcomes
Autoři: V. Třeška; T. Skalický; A. Sutnar; V. Liška; J. Ferda *
; H. Mírka *; F. Šlauf *; P. Duras *; B. Kreuzberg *
Působiště autorů: Chirurgická klinika FN a LF UK v Plzni, přednosta: prof. MUDr. Vladislav Třeška, DrSc. ; Radiodiagnostická klinika FN a LF UK v Plzni, přednosta: doc. MUDr. Boris Kreuzberg, CSc. *
Vyšlo v časopise: Rozhl. Chir., 2010, roč. 89, č. 9, s. 556-560.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Embolizace větve portální žíly (PVE) je indikována u nemocných s nedostatečným zbytkem jaterní tkáně po resekci jater pro nádorové onemocnění. PVE tak zvyšuje počet primárně operabilních nemocných. Problémem PVE je nedostatečný nárůst jaterního parenchymu nebo progrese malignity.Cíl studie:
Na základě vlastních a literárních zkušeností autoři hodnotí dosavadní výsledky PVE a zaměřují se především na úskalí PVE ve smyslu jejího neúspěchu.Metoda:
40 nemocných (35 s metastázami kolorektálního karcinomu, 2 s metastázou karcinomu prsní žlázy a jedna s metastázou karcinomu ovaria, 2 s hepatocelulárním karcinomem) bylo indikováno k PVE z důvodu nedostatečné jaterní rezervy po plánované resekci jater.Výsledky:
Jaterní resekce byla provedena u 22 nemocných v průměru za 42.6 dní po PVE. U 14 (35%) nemocných nebylo možné provést jaterní resekci (11x progrese nádoru, 3x nedostatečný nárůst jaterní tkáně). Ve čtyřech případech byla provedena jen radiofrekvenční ablace. Jeden, dva a tři roky po jaterní resekci přežívá 83,7, 69,7 a 52,3 % nemocných, po exploraci a u neoperovaných nemocných jeden rok přežilo jen 25, resp. 22,2 % nemocných (p < 0,001). Jeden a dva roky po resekci bylo bez recidivy nádoru 30,3, resp. 7 % nemocných.Závěr:
PVE má dnes pevné místo v etapových výkonech na játrech pro zvýšení operability primárních a sekundárních nádorů jater. Pro zlepšení výsledků bude nutné zaměřit pozornost na růst objemu jater po PVE a zhodnocení taktiky onkologické léčby v období kolem PVE s cílem snížení výskytu progrese malignity v játrech a organismu před vlastní jaterní resekcí.Klíčová slova:
nádory jater – embolizace větve portální žíly – výsledkyÚVOD
Embolizace větve portální žíly (PVE) před resekcí jater pro primární nebo sekundární nádory je dnes běžně zavedenou metodou z oblasti tzv. etapových výkonů indikovaných pro zvýšení resekability jaterních nádorů. Její primární indikací je nedostatečný funkční zbytek jaterní tkáně po odstranění nádoru s cílem stimulovat zbylý jaterní parenchym k jeho hypertrofii před vlastní resekcí jater a tím zajistit dostatečné metabolické funkce jater po chirurgickém výkonu. Vedle této nesporně pozitivní stránky PVE zvyšující resekabilitu jaterních nádorů, existuje řada otázek, které bude nutné v blízké budoucnosti řešit. K takovým patří např. možnost stimulačního vlivu PVE na primární nebo metastatický jaterní proces, nebo fakt, že u některých nemocných nedojde ani po úspěšné PVE ke stimulaci růstu jaterního parenchymu a tím k nemožnosti provést chirurgický výkon na játrech jako jediný, doposud známý radikální výkon významnou měrou prodlužující život nemocných s primárními nebo sekundárními jaterními nádory.
MATERIÁL A METODA
Na chirurgické klinice jsme za posledních 10 let operovali celkem 529 nemocných s jaterním nádorem. Z toho bylo 347 nemocných s metastázami kolorektálního karcinomu,78 s metastázami nekolorektálního původu, 62 s primárním nádorem jater a 42 s karcinomem žlučníku a žlučových cest. U 40 nemocných (35 nemocných s metastázami kolorektálního karcinomu, 2 s metastázou karcinomu prsní žlázy a 1 s metastázou karcinomu ovaria, 2 nemocní s hepatocelulárním karcinomem) byl předpokládaný budoucí zbytek jaterního parenchymu po resekci (FLRV = future liver remnant volume) nedostatečný (podle měření objemu jaterní tkáně pomocí computerově tomografické volumometrie – CT volumometrie) a museli jsme provést PVE na straně nádoru (Obr. 1). Průměrný věk nemocných byl 60,8 let (33,3–70,6 let). Embolizaci jsme prováděli transparietálním přístupem pomocí kovových spirálek, lipiodolu, tkáňového lepidla nebo fibrinové pěny. U každého nemocného jsme před vlastním výkonem provedli funkční test pomocí jaterní clearance indocyaninové zeleně. Pokud byl výsledek testu vyšší 14 %, byl test po úspěšné PVE opakován před resekcí jater k posouzení rozsahu operačního výkonu, který jsme volili pomocí volumometrických a funkčních kritérií uvedených v tabulce 1. Změnu FRLV po PVE jsme sledovali v týdenních intervalech pomocí CT volumometrie a jakmile dosáhla požadovaného objemu, nemocný byl indikován k resekci jater. Pokud nemocný byl léčen chemoterapií, či biologickou léčbou (často v kombinaci), tuto léčbu jsme před PVE ukončili a pokračovali jsme až přibližně 3 týdny po jaterní resekci, nebo v případech, kdy došlo k progresi nádoru po PVE, nebo jsme nemohli operovat z důvodu nedostatečného nárůstu jaterního objemu. Resekci jater jsme provedli v průměru za 42,6 dní (27–87 dní) po PVE. Výsledky jsme zhodnotili pomocí statistického softwaru Statistica 9.0 s využitím Kaplanovy-Maierové křivky ke stanovení dlouhodobého přežívání nemocných a bezpříznakového období (DFI = disease free interval).
Obr. 1. Embolizace pravé větve portální žíly u metastáz kolorektálního karcinomu do jater s volumometrií levého laloku 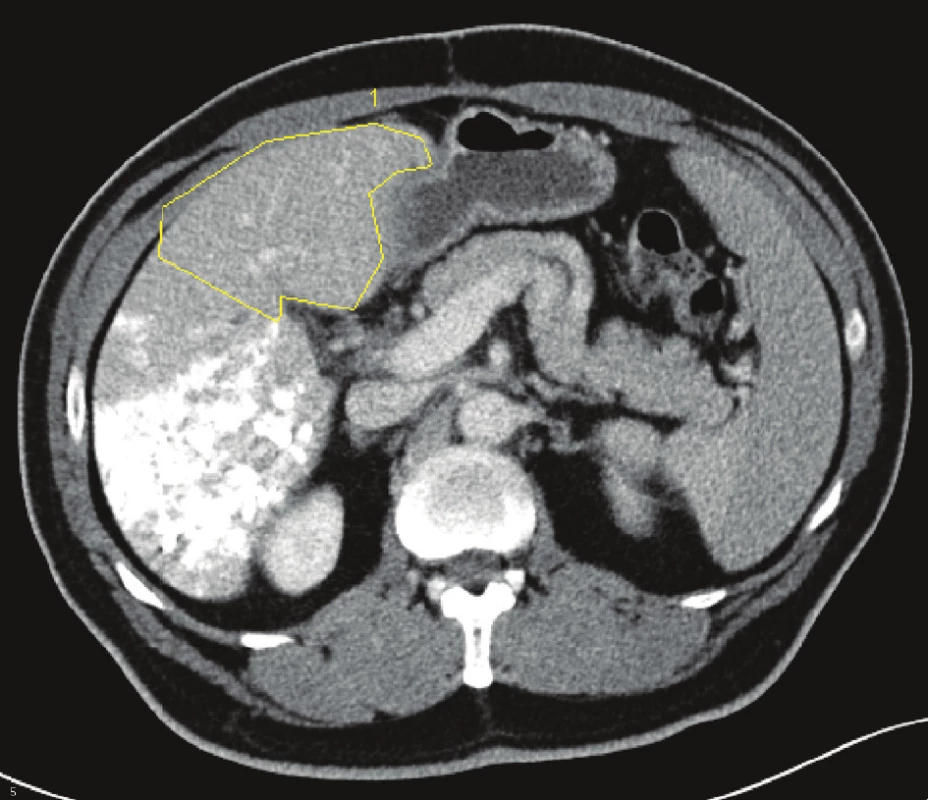
Tab. 1. Funkční a volumometrická kritéria jaterních resekcí 
VÝSLEDKY
Na základě volumetrických a funkčních hodnot jsme u nemocných po PVE provedli 22 velkých (nad 3 segmenty) resekcí, u 4 nemocných jsme nemohli z různých příčin (celkový stav nemocných, nedostatečný nárůst objemu neembolizovaného laloku, vznik nádoru v neembolizovaném laloku) provést resekci jater a stav jsme řešili radiofrekvenční ablaci (RFA) nádorů. U 14 nemocných jsme nemohli provést jaterní resekci. Důvodem byla progrese nádoru v játrech s rozvojem mimojaterních metastáz (N = 11) a nedostatečný nárůst FLRV (N = 3). Tři nemocní, u kterých nedošlo k dostatečnému nárůstu objemu jaterní tkáně byli diabetici. V celé skupině (N = 40) se vyskytl diabetes mellitus u 6 nemocných. Po radikální jaterní resekci pro primární nádor jater přežívá 1, 2 a 3 roky 83,7; 69,7 a 52,3 % nemocných, po exploraci jeden rok přežilo jen 25 % nemocných a tam, kde jsme neoperovali v důsledku progrese nádoru nebo nedostatečného nárůstu kontralaterálního laloku přežilo 1 rok jen 22,2 % nemocných (p < 0,001) – Graf 1. Vzhledem k malému počtu nemocných po RFA (N = 4) jsme tuto skupinu nehodnotili pro nebezpečí zkreslení výsledků. Výsledky resekcí po PVE jsou v porovnání s našimi předchozími výsledky srovnatelné s výsledky primárních resekcí bez PVE. DFI je u radikálních resekcí po 1. a 2. roce 30,3, resp. 7 %. (Graf 2). Ani zde jsme nehodnotili výsledky DFI po RFA vzhledem k malým číslům. Zde jsou však naše výsledky podstatně horší, než pokud jde o dříve publikované výsledky DFI po primárních jaterních resekcích [1].
Graf 1. Přežívání nemocných s PVE po resekci jater 
Graf 2. Bezpříznakové období nemocných s PVE po resekci jater 
DISKUSE
V roce 1984 Makuuchi [2] úspěšně provedl embolizaci pravé větve portální žíly u hilové formy cholangiokarcinomu s následnou pravostrannou hepatektomií. Od té doby byla publikována řada sdělení týkajících se indikací, kontraindikací PVE společně s diskusí na téma nedostatečné hypertrofie neembolizovaného laloku jater, nebo růstu vlastního nádoru v játrech po PVE.
Resekce jater je dnes i přes pokroky v onkologické léčbě zlatým standardem nabízejícím nemocným s primárními nebo sekundárními nádory jater kvalitní dlouhodobé výsledky. Primárně resekabilních jaterních malignit je však jen kolem 30 %. Zbývající pak nejsou resekabilní z důvodů šíření nádoru intra-, či extrahepatálně. Dalším důvodem je i limitující zbytek jater po odstranění nádoru (FLRV). Obecně platí pravidlo, že pro bezpečnou resekci nádoru jater musí být zachováno minimálně 30 % zdravého jaterního parenchymu a u cirhotiků minimálně 60–70 % jaterní tkáně. Jestliže po primárních velkých resekcích jater (více jak 3 segmenty jater) je mortalita nemocných u jinak nepoškozených jater 3,2–7 %, pak u cirhotických, nebo jinak poškozených jater (např. po chemoterapii, při cholestáze) může dosáhnout až 32 % [3, 4]. Právě u těchto nemocných s nedostatečným FLRV a rovněž s nedostatečnou funkcí jater je PVE indikována jako první krok před velkou resekcí jater. Obyčejně jaterní parenchym hypertrofuje po PVE v intervalu 2–8 týdnů o 20–46 % a nemocní mohou podstoupit resekci jater v intervalu 4–6 týdnů po PVE. Dobrým ukazatelem hypertorfie jaterního parenchymu jsou první 3 týdny po PVE. Pokud v této době nedojde k nárůstu jaterního parenchymu kontralaterálního laloku, je málo pravděpodobné, že PVE bude úspěšná. Dlouhodobé výsledky jaterních resekcí po PVE jsou prakticky srovnatelné s primárními operacemi a dosahují 3 - a 5letého přežívání nemocných 60 a 44 % [5, 6]. Tak tomu bylo i u naší skupiny nemocných. Pokud jde o bezpříznakové přežívání (DFI), pak literární data popisují horší DFI po jaterních resekcích po PVE v porovnání s primárními resekcemi bez PVE (3 a 5 let – 19 a 5 %, resp. 29 a 21 %) [7]. Rovněž naše zkušenosti jsou shodné a nemocní s jaterními resekcemi po PVE budou nepochybně vyžadovat častější pooperační kontroly event. jiný terapeutický režim ve smyslu chemoterapie nebo biologické léčby. PVE lze dobře využít u nemocných s bilobárním jaterním postižením nádorem, kdy v první fázi provedeme metastazektomii, RFA nebo malou resekci v jednom laloku, ve druhé fázi, která následuje bezprostředně pak PVE větve portální žíly druhého laloku a ve třetí fázi pak hepatektomii na straně PVE, nebo menší výkon podle lokalizace a velikosti nádoru v postiženém jaterním laloku. Výsledky tohoto postupu jsou rovněž dobré a některá pracoviště dosahují 1 - a 3letého přežití nemocných v 70 a 54 % [8].
Za fyziologických okolností přivádí portální žíla až 80 % krve do jater, zbytek 20 % je dodáván arteriálním oběhem. Po PVE se výraznou měrou zvyšuje průtok krve portální žilou neembolizovaného laloku, kompenzatorně se zvyšuje i průtok arteriální krve v embolizovaném laloku, známý jako „hepatic arterial buffer response“ [9]. Zde pak může nastat hlavní problém vedoucí k progresi mikrometastáz v játrech po PVE, které jsou živeny arteriální krví a které nejsou viditelné běžnými radiodiagnostickými metodami (USG, CT, MRI, PET CT) před PVE. Problémem samozřejmě může být i růst nádoru (především mikrometastáz) na jiném místě v organismu, protože po PVE se uvolňuje z jater do oběhu celá řada faktorů s přímým vlivem na progresi nádorového bujení (cytokiny, růstové faktory a další).
Určitou cestou jak ovlivnit růst nádorů jater je kombinace PVE s transarteriální chemoembolizací (TACE) nebo systémovou chemoterapií (zde i ovlivnění možného růstu systémových mikrometastáz). Výhodou TACE provedené v intervalu 7–10 dní před PVE je vedle zabránění proliferace nádoru v embolizovaném laloku jater i zvýšení cirkulace v kontralaterálním laloku, a tak teoreticky podpoření regenerace tohoto laloku jater. Některé práce [9, 10] hovoří až o 80% nekróze nádoru po TACE v porovnání s 5% nekrózou po jen PVE. Prakticky do současnosti byla systémová chemoterapie u nemocných indikovaných k PVE přerušena několik týdnů před PVE a opět se začala podávat za 3–4 týdny po jaterní resekci. Důvodem bylo možné poškození jaterních funkcí po aplikaci oxaliplatiny (sinusoidální kongesce), irinotekanu (steatóza) spojených s nedostatečnou regenerací jaterního parenchymu po PVE. Z tohoto postupu pak jednoznačně plynulo nebezpečí progrese jaterního nádoru v období bez chemoterapie po PVE. To byla pravděpodobně i příčina progrese jaterních metastáz u našich nemocných, u nichž jsme přerušovali systémovou chemoterapii v období před a po PVE. Současné znalosti ukazují, že systémová chemoterapie na bázi fluorouracilu s nebo bez oxaliplatiny, irinotekanu, bevacizumabu probíhající současně s PVE není ve většině případů na překážku hypertrofii neembolizovaného laloku a je do jisté míry pojistkou před proliferací jaterního nádoru nebo systémových mikrometastáz v intervalu nutném k nárůstu neembolizovaného laloku po PVE [11, 12, 13]. S výhodou lze rovněž použít tam, kde se nám jedná o chemoterapeutický „downstaging“ jaterního nádoru. Navíc antiangiogenní účinek bevacizumabu může hrát významnou roli u „hepatic arterial buffer response“ v oblasti embolizovaného jaterního laloku. Opatrnosti v systémové chemoterapii v období PVE je zapotřebí u strukturálně poškozených jater (fibróza, cirhóza) [14, 15]. Otázkou samozřejmě zůstává jaterní resekce při probíhající chemoterapii, kdy ze zkušenosti víme, že jaterní parenchym je podstatně křehčí a krvácivější než při vysazení chemoterapie několik týdnů před operací.
U nemocných s chronickým onemocněním jater, diabetiků, nebo tam, kde došlo po PVE k rekanalizaci embolizované portální větve, či přítomnosti portální hypertenze s tvorbou portosystémových spojek musíme počítat s nižší úspěšností hypertrofie jater po PVE. I u naší skupiny třech nemocných, kde nedošlo k nárůstu jaterního objemu po PVE se diabetes vyskytl ve 100 %, nicméně jedná se o malá čísla nemocných, ze kterých nelze dělat zatím žádné závěry. U některých nemocných je však příčina nedostatečné jaterní regenerace po PVE neznámá. Určitým směrem v podpoře regenerace jater po PVE u těchto skupin nemocných může být aplikace kmenových buněk do neembolizované větve portální žíly s cílem navození účinné hypertrofie kontralaterálního jaterního laloku. Tímto výzkumem se kromě našeho pracoviště zabývají i jiná centra hepatobiliární chirurgie [16], ale na definitivní výsledky budeme muset ještě čekat.
ZÁVĚR
PVE je dnes rutinní metodou u nemocných s resekabilním primárním nebo sekundárním nádorem jater, u nichž je nedostatečný FLRV. U řady nemocných však zůstává z různých příčin neúspěšná. Je na budoucím klinickém a experimentálním výzkumu hledat další cesty jak účinně zvýšit efektivitu PVE a nabídnout tak primárně neoperabilním nemocným jaterní resekci, která jim dává největší naděje na dlouhodobé přežívání.
Práce vznikla s podporou grantu IGAMZNS 9727-4 a 10240-3.
Prof. MUDr. Vladislav Třeška, DrSc.
U Českého dvora 11
326 00 Plzeň
e-mail: treska@fnplzen.cz
Zdroje
1. Třeška, V., Skalický, T., Sutnar, A., Liška V. Chirurgická léčba jaterních metastáz kolorektálního karcinomu. Rozhl. Chir., 2009; 88 : 69–75.
2. Makuuchi, M., Thai, B. L., Takayasu, K. Preoperative portal vein embolization to increase safety of major hepatectomy for hilar bile duct carcinoma: a preliminary report. Surgery, 1990; 107 : 521–527.
3. Aussilhou, B., Lesurtel, M., Sauvanet, A. Right portal vein ligation is a efficient as portal vein embolization to induce hypertrophy of the left liver remont. J. Gastrointest. Surg., 2008; 12 : 297–303.
4. Yokoyama, Y., Nagino, M., Nimura, Y. Mechanisms of hepatic regeneration following portal vein embolization and partial hepatectomy: a review. World J. Surg., 2007; 31 : 367–374.
5. Jaeck, D., Oussoultzoglou, E., Rosso, E. A two-stage hepatectomy procedure combined with portal vein embolization to achieve curative resection for initially unresectable multiple and bilobar colorectal liver metastases. Ann. Surg., 2004; 240 : 1037–1049.
6. Covey, A. M., Tuorto, S., Brody, L. A. Safety and efficacy of preoperative portal vein embolization with polivynyl alkohol in 58 patients with liver metastases. AJR Am. J. Roentgenol., 2005; 185 : 1620–1626.
7. Wicherts, D. A., de Haas, R. J., Andreani, P., Sotirov, D., Salloum, C., Castaing, D., Adam, R., Azoulay, D. Impact of portal vein embolization on long-term survival of patients with primarily unresectable colorectal liver metastases. Br. J. Surg., 2010; 97 : 240–250.
8. Jaeck, D., Bachellier, P., Nakano, H. One or two-stage hepatectomy combined with portal vein embolization for initially nonresectable colorectal liver metastases. Am. J. Surg., 2003; 185 : 221–229.
9. Gulik, T., Esschert, J. W., Graaf, W., Lienden, K. P., Busch, O. R. C., Heger, M., Delden, O. M., Laméris, J., Gouma, D. J. Controversies in the use of portal vein embolization. Dig. Surg., 2008; 25 : 436–444.
10. Goere, D., Farges, O., Leporrier, J. Chemotherapy does not impal hypertrophy of the left liver after right portal vein obstruction. J. Gastrointest. Surg., 2006; 10 : 365–370.
11. Belghiti, J., Benhaim, L. Portal vein occlusion prior to extensit resection in colorectal liver metastasis: A necessity rather than an option. Ann. Surg. Oncol., 2009; 16 : 1098–1099.
12. Tanaka, K., Kumamoto, T., Matsuyama, R., Takeda, K., Nagano, Y., Endo, I. Influence of chemotherapy on liver regeneration induced by portal vein embolization or first hepatectomy of a staged procedure for colorectal liver metastases. J. Gastrointest. Surg., 2010; 14 : 359–368.
13. Furst, G., Schulte, E. J., Hosch, S. B. Portal vein embolization and autologous CD 133+ bone marrow stem cells for liver regeneration: initial experience. Radiology, 2007; 234 : 171–179.
14. Neumann, U. P., Seehofer, D., Neuhaus, P. The surgical treatment of hepatic metastases in colorectal carcinoma. Dtsch. Arztebl. Int., 2010; 107 : 335–342.
15. Chaudhury, P., Hassanain, M., Bouganim, N., Salman, A., Kavan, P., Metrakos, P. Perioperative chemotherapy with bevacizumab and liver resection for colorectal liver metastasis. HPB (Oxford), 2010; 12 : 37–42.
16. Furst, G., Schulte, E. J., Hosch, S. B. Portal vein embolization and autologous CD 133+ bone marrow stem cells for liver regeneration: initial experience. Radiology, 2007; 234 : 171–179.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2010 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- 4. setkání hrudních chirurgů 3. 6. 2010 Plzeň
- Augmentace dekompresivní kraniektomie obvazovou textilií COM 30 v terapii refrakterní nitrolební hypertenze – kazuistika
- Paréza radiálního nervu způsobená pakloubem diafýzy humeru – kazuistika
- Lymfadenektomie u papilárního karcinomu štítné žlázy
- Hernia pľúc po limitovanej torakotómií
- Reimplantace AMI a akcesorní pravé AR u infrarenálního AAA a současný pohled na indikační kritéria k reimplantaci AMI
- Problematika embolizace větve portální žíly u nemocných s primárně neoperabilními nádory jater
- Neobvyklý přístup k resekci metastázy jater
- Poúrazová pseudocysta sleziny
- Prudká infekce kosti a měkkých tkání horní končetiny – kazuistika
- Fraktura proximálního humeru komplikovaná lézí arteria axillaris – kazuistika
- Laudatum k 60. narozeninám prim. MUDr. Jiřího Gaťka, Ph.D.
- Zápis z jednání schůze výboru ČCHS dne 21. 6. 2010
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prudká infekce kosti a měkkých tkání horní končetiny – kazuistika
- Lymfadenektomie u papilárního karcinomu štítné žlázy
- Poúrazová pseudocysta sleziny
- Paréza radiálního nervu způsobená pakloubem diafýzy humeru – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




