-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Fast track ve střevní chirurgii, aktuální přehled
Fast Track in Intestinal Surgery; Current Review
Introduction:
Results of the elective surgical procedures are affected not only by quality of the procedure, but also by perioperative care. Accelerated postoperative rehabilitation (fast track) reduces the frequency of postoperative complications, shortens the length of hospital stay and increases the patients’ comfort. These modern procedures are subject to number of trials and they are even part of current European guidelines.Aim:
The aim of this review is to evaluate scientific significance of the individual procedures in terms of fast track perioperative care and their comparison with traditional perioperative care.Conclusion:
There is number of evidence that complex program of fast track postoperative rehabilitation improves postoperative healing. Its introduction into general practice could contribute to quality of perioperative care which differs greatly and often depends more on experiences than on scientific evidences.Key words:
fast track – intestinal surgery
Autoři: Z. Šerclová
Působiště autorů: Chirurgická klinika FN Na Bulovce, Praha, přednosta: prof. MUDr. F. Antoš, CSc.
Vyšlo v časopise: Rozhl. Chir., 2009, roč. 88, č. 9, s. 527-535.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Výsledky elektivních střevních operací jsou ovlivněny nejen kvalitou operačního výkonu, ale též kolem-operační péčí. Akcelerovaná pooperační rehabilitace (fast track) snižuje frekvenci pooperačních komplikací, zkracuje hospitalizaci a zvyšuje komfort nemocných. Tyto moderní postupy jsou předmětem řady studií a jsou i součástí evropských doporučení.Cíl:
Cílem sdělení je zhodnotit význam a vědecký podklad jednotlivých postupů v rámci fast track perioperační péče a jejich porovnání s tradičním způsobem péče.Závěr:
Existuje řada důkazů, že komplexní program fast track pooperační rehabilitace zlepšuje pooperační hojení. Zavedení do široké praxe by mohlo přispět ke zkvalitnění perioperační péče, která je velmi rozdílná a často závislá spíše na zkušenostech, než na vědeckých důkazech.Klíčová slova:
fast track – střevní chirurgieÚVOD
Před více než dvaceti lety popsal H. Kehlet [1] metodu tzv. akcelerované rehabilitace v perioperační péči, která původně dokazovala, že pooperační rehabilitace může být stejně rychlá po otevřených chirurgických výkonech jako po laparoskopické chirurgii. Tyto moderní postupy, nazývané – akcelerovaná pooperační rehabilitace, fast track či ERAS (enhanced recovery after surgery), jsou prozatím užívány pouze v elektivní chirurgii s cílem snížit frekvenci pooperačních komplikací, délku hospitalizace a zlepšit komfort nemocných, tedy dosáhnout atraktivního cíle tzv. „stress and pain free“ chirurgie. Stávají se součástí edukace chirurgů a jejich zájmu o patofyziologii operačního traumatu. I když existuje řada medicínských důkazů [2–4], že moderní postupy jsou užitečné a výhodné, přesto je na většině chirurgických pracovišť [5, 6] užívána mnohem více traumatizující pooperační péče tradiční. Stejně je tomu i v České republice, i když i v naší literatuře byla metoda několikrát zmíněna [7, 8]. Důvodem našeho sdělení je podpořit širší zavedení těchto postupů do běžné praxe připomenutím současného stavu důkazů.
PRINCIPY PERIOPERAČNÍ PÉČE TYPU FAST TRACK (FT)
Jedná se o řadu kroků na všech úrovních péče o chirurgického nemocného. Důležité je však jejich použití v optimální kombinaci tak, aby působily synergicky. Právě kombinace účinků pravděpodobně vede k nejefektivnější pooperační rehabilitaci a nejvíce redukuje operační stres. Jednotlivé hlavní postupy jsou rozebrány v dalším textu.
1. Důkladná předoperační příprava a informace nemocného o pooperační péči
Příprava zahrnuje pohovor s nemocným a písemnou edukaci. V jejím rámci se provádí nácvik rehabilitace, s nemocným jsou probrány jeho dietetické preference, je seznámen s hodnocením pooperační bolesti (obvykle podle vizuální analogové škály), případně s principem pumpy k pacientem kontrolované analgezii (PCA). Podrobně je probrána příprava k operaci a obvyklý pooperační průběh s důrazem na předoperační i pooperační perorální příjem a rehabilitaci. Takto vedená příprava snižuje strach nemocných z vlastní operace a zvyšuje jejich compliance s akcelerovanou rehabilitací. Bez ní tento postup není možný. Potlačení anxiozity je jedním z mechanismů snižujících operační stres [9].
2. Redukce předoperačního hladovění
Důvodem k předoperačnímu hladovění je obava z aspirace během celkové anestezie (CA). Frekvence aspirace (0,7–4,7 na 10 000 anestezií) a jejích fatálních následků (1 úmrtí na 35 000–72 000 anestezií) je relativně nízká. Aspirace je však jednou z nejzávažnější komplikací CA [10]. Na mnoha studiích bylo prokázáno [11, 12], že perorální příjem tekutin do 2 hodin před operací nezvyšuje ani nesnižuje obsah a pH v žaludku při úvodu do CA, tedy ani riziko aspirace. Proto od roku 1999 řada anesteziologických společností (americká, britská, norská, kanadská ...) povolila ve svých doporučených postupech příjem tekutin až 2 hodiny před operací u elektivních výkonů, příjem tuhé diety se obvykle 6 hodin předoperačně nedoporučuje [13]. Interval je však prodloužen u nemocných s vyšším rizikem aspirace, mezi které patří: těhotné ženy, nemocní s cukrovkou, s gastroezofageálním refluxem či hiátovou hernií, akutně operovaní nemocní, nemocní se střevní obstrukcí a nemocní, u kterých se předpokládá obtížná endotracheální intubace.
Proč však byl tento boj o omezení perioperačního hladovění vůbec rozpoután? Důsledkem operačního stresuje katabolický stav se ztrátou proteinů a s periferní inzulinovou rezistencí, která i po středně těžké operaci přetrvává relativně dlouhou dobu. Předoperační podání sacharidů snižuje tuto rezistenci a chrání tělesné proteiny, jak bylo prokázáno Stockholmskou skupinou [14, 15]. Další práce ověřily, že předoperační podání sacharidů (glukóza intravenózně, maltodextriny event. dipeptidy perorálně) vedlo k nižšímu poklesu svalové síly, redukci délky hospitalizace a pooperačních komplikací [16]. Perorální popíjení tekutin (12,5% sacharidový roztok, Nutricia preOp, Nutricia Ltd.) je obvykle preferováno před intravenózní přípravou z důvodů rizik intravenózní kanylace. Nezanedbatelným efektem je i zlepšení komfortu nemocných, snížení pocitu hladu, žízně a již výše zmíněné anxiozity v předoperačním období [9, 17]. Tyto principy jsou součástí doporučení Evropské společnosti pro parenterální a enterální výživu (ESPEN) [18].
3. Předoperační střevní příprava mechanickou ortográdní laváží není u většiny nemocných třeba
Cílem odstranění střevního obsahu před operací je omezení možné peroperační kontaminace a tím redukce pooperačních komplikací zejména infekčních. Běžně užívané typy střevní přípravy jsou však založeny na principu osmoticky aktivních látek. Takto navozená dehydratace nemocného si pak vynutí velmi extenzivní peroperační rehydrataci ve snaze udržet oběhovou stabilitu. Důsledky dehydratace jsou více zřejmé v případě užití výhodné kombinované anestezie s epidurální analgezií. Dalším negativním následkem střevní přípravy je výrazný dyskomfort v době předoperačního stresu, dysmikrobie z mechanické přípravy, přičemž možnost kontaminace operačního místa střevními bakteriemi zůstává téměř nezměněná. U pacientů se semiobstrukcí či obstrukcí se riziko kontaminace naředěním střevního obsahu ortográdní laváží nad překážkou dokonce zvyšuje. Na základě zkušeností s akutními střevními operacemi, kde nelze přípravu střeva použít, začala být mechanická příprava střevní zkoumána i u elektivních operací, přičemž žádná její výhoda ověřena nebyla [19–21]. Vzhledem k možným nevýhodám tedy není podle medicíny založené na důkazech doporučena [22]. Jedinou výjimkou je operace na rektu, při které nebylo provedeno dostatek prospektivních studií [23], proto se mechanická příprava dosud používá většinou i v rámci FT protokolů.
4. Racionální perioperační intravenózní příjem tekutin
V průběhu vlastní operace je kriticky důležitá spolupráce s anesteziologem, jeho porozumění a snaha dodržet cíl postupu. Pro urychlenou rehabilitaci je podstatné, aby anestezie probíhala bez excesivního peroperačního příjmu tekutin. Není výjimkou, že nemocný absolvující 1,5–2 hodinovou operaci, musel zpracovat během operace 3–8 litrů tekutin a to obvykle krystaloidů [24]. Podání intravenózního objemu tekutin, zajišťující systémovou perfuzi tkání a distribuci kyslíku, je součástí perioperační péče. Během anestezie však dochází k snazší retenci tekutin v intersticiu. Na zvířecím pokusu bylo prokázáno, že intravenózní objem krystaloidů 25 ml/kg vyvolá změnu v poměru intersticiální tekutiny k močovému výdeji 1 : 2. Pokud však byl subjekt v CA, poměr se změnil 6 : 1 ve prospěch intersticiální tekutiny, v případě podání některých anestetik dokonce ještě výrazněji [25]. Oběhová stabilita dosažená pouze intravenózní aplikací krystaloidů během operace vede tedy k retenci tekutin a natria a k edémům tkání, trvajícím po mnoho dnů i týdnů. Následkem je pak paradoxně nedostatečná oxygenace tkání a orgánová dysfunkce, která se klinicky může projevit poruchou střevní motility a dalších střevních funkcí, respirační insuficiencí a vyšší frekvencí pneumonií, zhoršeným hojením ran a anastomóz, celkem tedy prodlouženou hospitalizací. Pokud během anestezie chceme dosáhnout zvyklého výdeje moči, musíme překonat významnou a nežádoucí retenci tekutin v intersticiu s výše uvedenými nežádoucími účinky [24–27]. Řada studií prokázala, že snížený příjem tekutin během operace vede ke snížení pooperačních komplikací zvláště v kolorektální chirurgii [28]. Pro restriktivní režimy jsou výhodné ostatní postupy používané v rámci akcelerované pooperační rehabilitace. Pacienti nejsou předoperačně významně dehydratováni, protože nemají předoperačně omezený příjem tekutin perorálně a většina neprochází mechanickou střevní přípravou. V množství nejvýhodnějšího objemu intravenózního příjmu tekutin však není v literatuře jasno. Většinou se za restriktivní režim považuje i.v. příjem pod 15 ml/kg/hod. během operace, ovšem za předpokladu standardního průběhu operačního výkonu. Dalším problémem je, že během operace není obvykle možné potřebu tekutin a míru intersticiálního edému měřit. Invazivní monitorace (např. Swanův-Ganzův katétr) není u běžných operací žádoucí, její komplikace převáží její výhody. Na druhé straně, méně invazivní monitorace, včetně měření centrálního žilního tlaku, je nepřesná pro přirozené kompenzační mechanismy. V posledních letech se většinou doporučuje monitorace pomocí jícnové Dopplerovy sondy a tzv. cílená tekutinová terapie během operace. Tato metoda však zatím nepatří ke standardním postupům. Ve střevní chirurgii byla užita ve čtyřech prospektivních randomizovaných studiích, které v meta-analýze upřednostňují cílenou metodu před běžným postupem [29, 30], nicméně frekvence pooperačních komplikací byla ve všech těchto studiích vyšší než ve studiích s tzv. restriktivním režimem, obě možnosti nebyly dosud porovnány a budou jistě předmětem dalších diskusí.
5. Optimální celková anestezie
Předoperačně bývá v rámci anesteziologické péče zdůrazňována řádná příprava, zejména s ohledem na preexistující orgánové dysfunkce. V premedikaci nejsou doporučovány dlouhodobě působící benzodiazepiny. Většinou bývají doporučovány beta-blokátory a alfa-2-agonisté pro možný analgetika a anestetika šetřící efekt a možné zlepšení hemodynamické stability [31]. Beta-blokátory však nejsou přijímány jednoznačně, zvláště u nemocných, kteří je předoperační neužívali [32]. Během CA se za vhodná považují krátkodobá anestetika, méně solubilní volatilní anestetika (sevofluran, desfiuran...), protože lépe umožňují časnou rehabilitaci a nebývají příčinou pooperační nauzey. Vynechání oxidu dusného může redukovat pooperační poruchu střevní pasáže a může vést i k nižší frekvenci pooperačních komplikací [33, 34]. Preferovány jsou obecně přípravky, vyvolávající méně vedlejších účinků, či preventivní medikamentózní ovlivnění těchto účinků, zejména pooperační nauzey a zvracení [31]. Perioperačně bývá doporučováno zvýšení procenta inspirované frakce kyslíku (80 %) kvůli možnému antiemetickému efektu a významu pro hojení ran a anastomóz [35, 36]. Závěry studií nejsou jednoznačné, ale metoda se považuje za jednoduchou, bezpečnou a levnou, proto bývá do programů zařazována. Perioperační zajištění normotermie by mělo být součástí každé operace.
Celkovou potřebu opiátů lze redukovat kontinuální aplikací lokálních anestetik do operační rány. Z meta-analýzy pěti publikovaných prospektivních randomizovaných studiích (542 pacientů) vyplývá, že tato metoda vedla k signifikantní redukci bolesti 3. pooperační den v klidu a 1.–3. den při pohybu, což snížilo celkový příjem opiátů [37]. Nicméně vliv na rychlejší obnovu střevních funkcí a zkrácení délky hospitalizace nebyl zaznamenán, proto není metoda zatím jednoznačně doporučena.
6. Chirurgické možnosti ovlivnění operačního stresu
A. Minimální invaze v přístupu i chirurgickém postupu
Mezi chirurgické techniky redukující operační stres a následnou humorální a zánětlivou odpověď patří minilaparotomie a šetrné operační techniky s omezením manipulace s orgány. Za šetrnější bývají považovány příčné laparotomie, jejich význam v kombinaci s epidurální analgezií však nebyl dostatečně prokázán [38]. Laparoskopické metody v břišní chirurgii jsou jistě z hlediska miniinvazivity racionální. Nicméně existuje jen málo randomizovaných studií, které by srovnávaly laparoskopickou a otevřenou střevní chirurgii v kombinaci s akcelerovanou rehabilitací a jejich závěry jsou konfliktní [39, 40]. Takže prozatím nejsou důkazy o rychlejší rekonvalescenci nemocných operovaných laparoskopickou metodou oproti nemocným s otevřenou střevní resekcí za použití principů fast tracku [41]. FT principy mají pravděpodobně větší vliv na rekonvalescenci než použitý chirurgický přístup.
B. Omezení používání invazivních vstupů: drény, nazogastrické sondy, močové katétry
Účelem omezení rutinních drenáží tělních dutin je snaha snížit rizika pooperačních infekčních komplikací, zlepšit pooperační komfort nemocného a usnadnit časnou pooperační rehabilitaci, která je pro nemocného významně omezena, pokud má v pooperačním období nazogastrickou sondu (NGS), permanentní močový katétr (PMK) a profylaktické břišní drény, vše se sběrnými sáčky. Proto byla opět zkoumána evidence pro jejich použití. Standardní použití nazogastrické sondy po střevní resekci vychází z tradiční představy, že je možné tímto způsobem účinně dekomprimovat gastrointestinální trakt a takto zlepšit hojení anastomóz, zabránit nauzee a zvracení a aspiraci žaludečního obsahu s infekčními pulmonálními konsekvencemi a též snížit počet dehiscencí operačních ran. Pokud je však rutinně zaváděna NGS, dochází k poruše polykacích reflexů, což je pravděpodobně příčinou častějších pulmonálních komplikací. Dyskomfort nemocného je zřejmý, ani dekomprese střevního obsahu nebývá dostatečně účinná, protože podstatou prolongovaného paralytického ileu bývá dlouhodobá porucha motility tlustého střeva, která není gastrickou cestou řešena. Podle posouzení publikovaných studií, zahrnujících více než 4 000 nemocných, rutinní zavedení a ponechání NGS nevedlo ke splnění žádného z tradičních předpokladů [42]. Pacienti bez NGS měli signifikantně rychleji obnoveny gastrointestinální funkce a marginálně nižší frekvenci pulmonálních komplikací, nesignifikantně vyšší počet ranných komplikací, přičemž nebyl rozdíl v hojení anastomóz. Rutinní ponechání NGS se ukazuje neracionálním i u operací v oblasti horní části gastrointestinálního traktu či hepatobiliární chirurgii [43, 44]. Pokud peroperačně dojde k dilataci žaludku je jistě vhodné peroperačně žaludek dekomprimovat, ponechání sondy by však mělo být rezervováno pouze pro nemocné v kritickém stavu či nemocné s poruchou evakuace žaludku. Ostatní nemocní by měli být této stresující intervence ušetřeni.
Intraabdominální drény se obvykle užívají ke kontrole časného pooperačního krvácení a k časnému rozpoznání dehiscence anastomózy. Drén však obvykle vyvolá reakci se zvýšenou produkcí fibrinu, čímž přestává fungovat jako spojená nádoba s intraabdominálním obsahem a neumožní jej sledovat. Sám o sobě může vést ke stimulaci sekrece z peritoneální dutiny a zároveň mechanicky poranit vlastní anastomózu, přičemž může být zdrojem exogenní bakteriální kontaminace břišní dutiny. Proto bývá doporučováno pouze selektivní a účelné užívání drénů a pokud jsou peroperačně zavedeny, jejich časné odstranění [45]. Když nastane pooperační infekční komplikace ve smyslu abscesu (5.–7. pooperační den), pak je jejím řešením aktuální drenáž pod CT kontrolou. Rutinní umístění drénů je zatím standardním postupem při výkonech v malé pánvi, při kterých hrozí riziko vzniku hematomu. Nejnovější meta-analýza [46], která zpracovává 1 400 nemocných, potvrzuje tyto závěry: pacienti po elektivní kolorektální resekci bez drenáže trpěli méně infekcí v ráně a dehiscencí anastomózy (statisticky nesignifikantně), nebyl rozdíl v plicních komplikacích. Detekce závažné komplikace ve smyslu dehiscence anastomózy pomocí drénu měla jen 5% senzitivitu (1 pacient ze 20).
Podobná situace je s rutinním zavedením či pooperačním ponecháním močového katétru, i když zde existuje mnohem méně evidentních důkazů. Mimo operace v malé pánvi s preparací v okolí močového měchýře či jeho discizí, není rutinní ponechání PMK nutné. I když jeho dočasné zavedení si někdy vynutí delší doba operace pro vlastní peroperační náplň měchýře. Většina střevních výkonů, během kterých nedošlo k peroperační komplikaci, zejména krvácení, rutinní zavedení močového katétru nevyžaduje. Samozřejmě to znamená, že se pooperačně nemůžeme orientovat podle hodinové diurézy a musíme se více soustředit na jiné příznaky nestability nemocného. Hodinová diuréza pooperačně je však více zvyklým než objektivním faktorem monitorace nemocného. Vzhledem k vlivu operačního stresu a anestezie bývá významně nižší a dosažení diurézy například 100 ml/hod. v časném pooperačním období u jinak stabilizovaného pacienta bývá považováno za porušení protokolu z důvodů významného zvýšení příjmu tekutin [24, 27]. Tato pravidla však neplatí pro nemocné v sepsi či šoku či kriticky nemocné obecně, tedy i pro nemocné, kteří absolvovali operaci s komplikovaným průběhem.
7. Optimální analgezie
Podmínkou bezproblémového pooperačního hojení je dostatečná analgezie, která umožní časnou a intenzivní rehabilitaci. Principem analgezie ve FT je optimální multimodální (či vícestupňová) opiáty šetřící analgezie. Systémově užívané opioidní analgetika mají řadu nevýhodných účinků: nauzea a zvracení, střevní paralýza, snížení kognitivních funkcí nemocného, hypotenze a imunosuprese [38]. Proto je pooperační analgetická péče zaměřena na jejich redukci a preferovány jsou opiáty s krátkodobým účinkem. Pro břišní, stejně jako pro hrudní, chirurgii existují robustní dobré důkazy, vyplývající z meta-analýz [47], které ukazují, že pooperační analgezie cestou hrudní epidurální je účinnější než intravenózní či jiný typ analgezie. Epidurální analgezie (zejména hrudní) je metoda opiáty šetřící, zároveň i pravděpodobně sympatickou blokádou působí prokineticky a tím zkracuje pooperační paralytický ileus [48]. Byl prokázán její efekt na snížení frekvence pooperační myokardiální ischemie a snížení pooperačních komplikací plicních [49, 50]. Délka hospitalizace není významně zkrácena, i když nemocní splňují kritéria k propuštění dříve než nemocní s pooperační intravenózní analgezií s opiáty [51]. Epidurální analgezie je kontraindikována u nemocných s krvácivým stavem a koagulopatií a u septických stavů. Nejčastější komplikací epidurální analgezie je hypotenze. U nemocných procházejících akcelerovanou rehabilitací je riziko hypotenze méně významné, protože nejsou dehydratováni předoperačním omezením příjmu tekutin či mechanickou střevní přípravou. Zánětlivé komplikace epidurální analgezie se redukují, pokud je katétr odstraněn do 72 hodin po operaci, což je obvyklé. Epidurální či intravenózní analgezie se s výhodou kombinuje s intravenózním podáním jiných typů analgetik jako je metamizol či paracetamol či diclofenac. Časné podání perorálních analgetik, opět neopioidového typu, umožňuje propuštění nemocných [52, 53]. V akcelerované rehabilitaci se většinou upřednostňuje pacientem kontrolovaná analgezie (PCA) epidurální či intravenózní před prostým kontinuálním podáním analgetika.
8. Pooperační perorální příjem
Racionálním důvodem časného pooperačního podání enterální či perorální výživy je co nejvíce zkrátit interval intraluminálního střevního klidu, který rnůže být příčinou atrofie střevní sliznice a bakteriální translokace. Pozitivní efekt (snížení mortality, tendence ke snížení infekčních komplikací a délky hospitalizace) časné enterální či perorální výživu je po střevních operacích je prokázán v řadě studiích a meta-analýzách [54, 55]. Za časnou pooperační enterální výživu je obvykle považováno podání do 24 hodin po operaci. Obecně je efektivita enterální výživy vyšší u velmi časného podání a její výhody jsou těžko prokazatelné, pokud se podává později. Prokineticky efekt intraluminální výživy se pravděpodobně může uplatnit zejména před pooperačním nástupem paralytického ileu, tedy do několika hodin po operaci. Podmínkou podání enterální výživy je fungující gastrointestinální trakt, v časném pooperačním období je nutná dobrá perfuze splanchnickým řečištěm, tedy oběhová stabilita nemocného, jíž je obvykle možné dosáhnout do 2 hodin po běžné abdominální operaci.
V době, kdy se časně po operaci připouští enterální výživa, je pozornost zaměřena i na časný perorální příjem. Perorální cesta výživy je nejfyziologičtější a pro nemocného nejméně stresující. V elektivní kolorektální chirurgii existuje dostatek důkazů, že je bezpečná a nezvyšuje frekvenci pooperačních komplikací [56]. Problémem je dosažení kalorického cíle, tedy její tolerance v časném pooperačním období. Časný perorální příjem je snášen u 70–100 % nemocných, mnohem lépe však u těch, u kterých je používán jako součást akcelerované rehabilitace, zejména v kombinaci s opiáty šetřící analgezií a časnou mobilizací [57]. Z praktického hlediska se obvykle doporučuje neomezený příjem tekutin a lehká večeře podle tolerance nemocného v den operace, v dalších dnech dobře stravitelná kašovitá až tuhá dieta podle preference nemocného a samozřejmě neomezený příjem tekutin. Výhodným doplňkem je sipping kaloricky hodnotných koktejlů. Tímto způsobem většina nemocných toleruje řádnou racionální dietu během 2–4 pooperačních dní. Časný perorální příjem začíná být aktuální i u nemocných s operacemi na horní části gastrointestinálního traktu [58].
9. Redukce pooperační nauzey a vomitu (PONV) a pooperačního ileu (POI)
Pooperační střevní dysmotilita nastává po všech abdominálních i některých mimobřišních operacích. Její etiologie je multifaktoriální a podílejí se na ní vlivy neurogenní, inflamatorní i hormonální. PONV a POI významně prodlužují hospitalizaci, zvyšují náklady na léčbu a snižují komfort v pooperačním období. Prodloužený pooperační ileus se klinicky manifestuje střevní distenzí, nauzeou a zvracením, trvajícími déle než 5 dní. Související omezení enteránílho příjmu vede k nutnosti parenterální výživy, nemožnost rehabilitace pak k vyšší frekvenci pooperačních infekčních komplikací a tromboembolických příhod [59]. Protrahovaná střevní distenze vede k pooperačním kýlám. Největším rizikovým faktorem pro vznik POI jsou opioidová analgetika a jejich absolutní podané množství, dále pak výše krevní ztráty a délka operace [60]. Rozsah operačního traumatu významně ovlivňuje délku POI. Manipulace se střevem způsobuje uvolnění oxidu dusnatého, proinflamatorních cytokinů a prostaglandinů a aktivuje endogenní opioidy s následnou supresí funkce střevní svaloviny.
„Fast-trackové“ postupy používají různé metody, zkracující POI a pravděpodobně opět právě jejich kombinace vede k tomu, že POI bývá signifikantně zkrácen. Mezi tyto metody patří: anestezie bez oxidu dusného, perioperační restrikce intravenózních tekutin, či cílená intravenózní terapie, šetrné chirurgické techniky (laparoskopie, malé operační rány, omezení manipulace s nitrobřišními orgány), opiody šetřící analgezie, epidurální analgezie ve výši Th 6-10, časná enterální (perorální) výživa, časná rehabilitace, časná perorální analgezie apod. [61]. Několik meta-analýz [62–64] ukazuje, že použití žvýkačky v pooperačním období 3x denně, významně snižuje POI. Ve zpracovaných prospektivních randomizovaných studiích je sice zahrnuto pouze 158 a 222 nemocných, nicméně data jsou přesvědčivá a jedná se o levnou metodu, která zasluhuje pozornost.
Farmakologické možnosti ovlivnění POI jsou nyní předmětem řady experimentů a studií [65]. Jsou zkoumáni noví agonisté motilinu, jejichž starším zástupcem byl erythromycin. Agonisté ghrelinu, střevního hormonu produkovaného endokrinními buňkami žaludeční mukózy, jsou zatím zkoušeny na zvířeti. Nejslibnějšími se jeví periferní selektivní antagonisté μ-opioidních receptorů – methylnaltrexone, alvimopan [66]. Obě léčiva selektivně blokují účinek opiátů ve střevě a neprocházejí hematoencefalickou bariérou, takže neovlivňují analgetický účinek. Mají tedy zejména význam při typech pooperační analgezie s opioidními analgetiky. Klinické studie v pooperační péči již proběhly, jejich účinek na zkrácení POI byl prokázán, ale nejsou ještě dostatečně známy negativní důsledky jejich použití, alvimopan měl sice stejnou frekvenci nežádoucích účinků jako placebo, ale proporce závažných nežádoucích účinků (infarkt myokardu, nádorové onemocnění) byla v alvimopanových skupinách vyšší [67].
10. Perioperační rehabilitace
Zlepšení tělesné kondice předoperačně tzv. pre-rehabilitací nebylo původně zahrnuto ve FT postupech. Existují však předpoklady [68, 69], že program předoperačního zlepšení tělesné kondice vede k nižší potřebě analgetik, zlepšení pooperační kvality života, snížení morbidity a mortality [38]. Součástí všech typů akcelerované rehabilitace naopak je pooperační rehabilitace s pobytem mimo lůžko několikrát denně již od dne operace a pobytem mimo lůžko až 6 hodin v době propuštění. Smyslem omezení klidu na lůžku je prevence pulmonálních [70] a tromboembolických komplikací, prevence inzulinové rezistence a navození anabolického stavu [2]. Optimální analgezie a dobrá organizace jsou nezbytné.
11. Kritéria k propuštění
Součástí postupu akcelerované rehabilitace je časné propuštění z nemocnice na základě definovaných kritérií. Podmínkou propuštění bývá dobrá kontrola pooperační bolesti perorálními analgetiky, perorální příjem nevyžadující suplementaci tekutin intravenózně, pacient je dostatečně mobilizován, nejeví známky komplikace, gastrointestinální funkce jsou obnoveny a pacient s propuštěním souhlasí [2, 71]. Tito nemocní však musí mít snadný kontakt s chirurgickým pracovištěm pro případ vzniku komplikací. Na některých pracovištích, zejména severoamerických, jsou nemocní propouštěni 2–3 dny po operaci [71], obvykle však časnější propuštění vede k častější nutnosti rehospitalizace (20 %) [70]. Naopak v jiných zemích socioekonomické podmínky včetně politiky zdravotního pojištění [72] vedou i přes splnění podmínek k hospitalizaci delší.
ZÁVĚR
Principy akcelerované rehabilitace, shrnuté v tabulce 1, jistě nejsou rigidní a jistě se postupem času budou měnit. Zavedení do praxe znamená skutečnou spolupráci zdravotnických pracovníků, podílejících se na péči o chirurgické nemocné, kde velkou úlohu hraje střední zdravotnický personál. Vytvoření protokolu a kontrola jeho dodržování je nezbytná, jednotlivé protokoly se však mohou lišit. Uplatnění fast tracku, ale neznamená, že nemocní, kteří jsou indikováni k extenzivnější péči či přípravě, tuto nedostanou, například malnutriční nemocní či nemocní s rizikem malnutrice musí být podle platných doporučení zajištěni artificiální intervencí. Akcelerovaná rehabilitace jednoznačně vede k lepšímu komfortu nemocných a jejich rychlejší rekonvalescenci, je však dosud rezervovaná pro elektivní středně těžké operace. U nemocných, kteří jsou díky rozsahu operace či komplikaci v kritickém stavu, je třeba uplatňovat zásady intenzivní péče, i když její metody většinou nejsou v rozporu s fast trackem (časné využití gastrointestinálního traktu, metody omezující sedaci nemocných, časná rehabilitace).
Tab. 1. Principy fast track rehabilitace po střevních operacích Tab. 1. Principles of Fast Track Rehabilitation in Intestinal Surgery 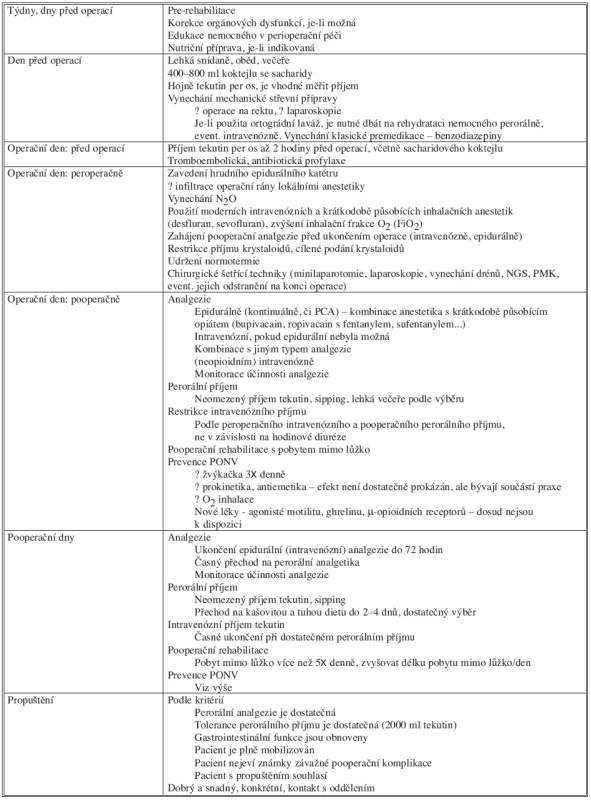
Zkratky: NGS – nazogastrická sonda, PMK – permanentní močový katétr, PCA – pacientem kontrolovaná analgezie, PONV – pooperační nausea a vomitus Seznam zkratek
FT – Fast track
PCA – Pacientem kontrolovaná analgezie
CA – Celková anestezie
NGS – Nazogastrická sonda
PMK – Permanentní močový katétr
PONV – Pooperační nausea a zvracení (vomitus)
POI – Pooperační ileus
MUDr. Z. Šerclová
Chirurgická klinika FN Na Bulovce
Budínova 2
180 81 Praha 8
e-mail: sercl@seznam.cz
Zdroje
1. Kehlet, H. Organizing postoperative accelerated recovery programs. Reg. Anesth., 1996, Nov-Dec; 21(6 Suppl): 149–151. Review.
2. Fearon, K. C., Ljungqvist, O., von Meyenfeldt, M., Revhaug, A., Dejong, C. H., Lassen, K., Nygren, J., Hausel, J., Soop, M., Andersen, J., Kehlet, H. Enhanced recovery after surgery: a consensus review of clinical care for patients undergoing colonic resection. Clin. Nutr., 2005, Jun; 24(3): 466–477.
3. Kehlet, H., Büchler, M. W., Beart, R. W. Jr., Billingham, R. P., Williamson, R. Care after colonic operation-is it evidence-based? Results from a multinational survey in Europe and the United States. J. Am. Coll. Surg., 2006, Jan; 202(l): 45–54.
4. Wind, J., Polle, S. W., Fung Kon Jin, P. H., Dejong, C. H., von Meyenfeldt, M. F., Ubbink, D. T., Gouma, D. J., Bemelman, W. A. Laparoscopy and/or Fast Track Multimodal Management Versus Standard Care (LAFA) Study Group; Enhanced Recovery after Surgery (ERAS) Group. Systematic review of enhanced recovery programmes in colonic surgery. Br. J. Surg., 2006, Jul; 93(7): 800–809. Review
5. Hasenberg, T., Keese, M., Langle, F., Reibenwein, B., Schindler, K., Herold, A., Beck, G., Post, S., Jauch, K. W., Spies, C., Schwenk, W., Shang, E. ‘Fast-track’ colonic surgery in Austria and Germany-results from the survey on patterns in current perioperative practice. Colorectal Dis., 2009, Feb; 11(2): 162–167.
6. Lassen, K., Hannemann, P., Ljungqvist, O., Fearon, K., Dejong, C. H., von Meyenfeldt, M. F., Hausel, J., Nygren, J., Andersen, J., Revhaug, A., Enhanced Recovery After Surgery Group. Patterns in current perioperative practice: survey of colorectal surgeons in five northern European countries. BMJ, 2005, Jun 18; 330(7505): 1420–1421.
7. Plodr, M., Ferko, A. Fast track in surgery. Rozhl. Chir., 2005, Nov; 84(11): 557–560.
8. Šerclová, Z., Dytrych, P., Marvan, J., Nová, K., Hankeová, Z., Ryska, O., Šlágrová, Z., Burešová, L., Trávníková, L., Antoš, F. Tolerance akcelerované pooperační rehabilitace po střevních resekčních výkonech. Rozhl. Chir., 2009., 88 (4): 178–840.
9. Hausel, J., Nygren, J., Lagerkranser, M., Hellstrom, P. M., Hammarqvist, F., Almström, C., Lindh, A., Thorell, A., Ljungqvist, O. A carbohydrate-rich drink reduces preoperative discomfort in elective surgery patients. Anesth. Analg., 2001, Nov; 93(5): 1344–1350.
10. Kluger, M. T., Visvanathan, T., Myburgh, J. A., Westhorpe, R. N. Crisis management during anaesthesia: regurgitation, vomiting, and aspiration. Qual. Saf. Healthcare, 2005, Jun; 14(3): e4.
11. Maltby, J. R., Pytka, S., Watson, N. C., Cowan, R. A., Fick, G. H. Drinking 300 mL of clear fluid two hours before surgery has no effect on gastric fluid volume and pH in fasting and non-fasting obese patients. Can. J. Anaesth., 2004, Feb; 51(2): 111–115.
12. Yagci, G., Can, M. F., Ozturk, E., Dag, B., Ozgurtas, T., Cosar, A., Tufan, T. Effects of preoperative carbohydrate loading on glucose metabolism and gastric contents in patients undergoing moderate surgery: a randomized, controlled trial. Nutrition, 2008, Mar; 24(3): 212–216.
13. Stuart, P. C. The evidence base behind modem fasting guidelines. Best Pract. Res. Clin. Anaesthesiol., 2006, Sep; 20(3): 457–469. Review
14. Svanfeldt, M., Thorell, A., Hausel, J., Soop, M., Nygren, J., Ljungqvist, O. Effect of „preoperative“ oral carbohydrate treatment on insulin action. A randomised cross-over unblinded study in healthy subjects. Clin. Nutr., 2005, Oct; 24(5): 815–821.
15. Ljungqvist, O., Nygren, J., Soop, M., Thorell, A. Metabolic perioperative management: novel concepts. Curr. Opin. Crit. Care, 2005, Aug; 11(4): 295–299. Review.
16. Yuill, K. A., Richardson, R. A., Davidson, H. I., Garden, O. J., Parks, R. W. The administration of an oral carbohydrate-containing fluid prior to major elective upper-gastrointestinal surgery preserves skeletal muscle mass postoperatively – a randomised clinical trial. Clin. Nutr., 2005, Feb; 24(1): 32–37.
17. Kaska, M., Grosmanová, T., Havel, E., Hyspler, R. Preparation of patients for operation with per-oral intake on the day of the planned surgery. Rozhl. Chir., 2006, Nov; 85(11): 554–559.
18. Weimann, A., Braga, M., Harsanyi, L., Laviano, A., Ljungqvist, O., Soeters, P. DGEM, Jauch, K. W., Kemen, M., Hiesmayr, J. M., Horbach, T., Kuse, E. R., Vestweber, K. H. ESPEN Guidelines on Enteral Nutrition: Surgery including organ transplantation. Clin. Nutr., 2006, Apr; 25(2): 180–186.
19. Slim, K., Vicaut, E., Launay-Savary, M. V., Contant, C., Chipponi, J. Updated systematic review and meta-analysis of randomized clinical trials on the role of mechanical bowel preparation before colorectal surgery. Ann. Surg., 2009, Feb; 249(2): 203–209.
20. Gravante, G., Caruso, R., Andreani, S. M., Giordano, P. Mechanical bowel preparation for colorectal surgery: a meta-analysis on abdominal and systemic complications on almost 5,000 patients. Int. J. Colorectal Dis., 2008, Dec; 23(12): 1145–1150.
21. Jung, B., Pahlman, L., Nyström, P. O., Nilsson, E., Mechanical Bowel Preparation Study Group. Multicentre randomized clinical trial of mechanical bowel preparation in elective colonic resection. Br. J. Surg., 2007, Jun; 94(6): 689–695.
22. Guenaga, K. K., Matos, D., Wille-Jorgensen, P. Mechanical bowel preparation for elective colorectal surgery. Cochrane Database Syst. Rev., 2009, Jan 21; (l): CD001544. Review
23. Bretagnol, F., Alves, A., Ricci, A., Valleur, P., Panis, Y. Rectal cancer surgery without mechanical bowel preparation. Br. J. Surg., 2007, Oct; 94(10): 1266–1271.
24. Brandstrup, B. Fluid therapy for the surgical patient. Best Pract. Res. Clin. Anaesthesiol., 2006, Jun; 20(2): 265–283. Review.
25. Johnston, W. E. PRO: Fluid restriction in cardiac patients for noncardiac surgery is beneficial. Anesth. Analg., 2006, Feb; 102(2): 340–343.
26. Spahn, D. R., Chassot, P. G. CON: Fluid restriction for cardiac patients during major noncardiac surgery should be replaced by goal-directed intravascular fluid administration. Anesth. Analg., 2006, Feb; 102(2): 344–346.
27. Walsh, S. R., Tang, T. Y., Farooq, N., Coveney, E. C., Gaunt, M. E. Perioperative fluid restriction reduces complications after major gastrointestinal surgery. Surgery, 2008, Apr; 143(4): 466–468.
28. Brandstrup, B., Tonnesen, H., Beier-Holgersen, R. Danish Study Group on Perioperative Fluid Therapy. Effects of intravenous fluid restriction on postoperative complications: comparison of two perioperative fluid regimens: a randomized assessor-blinded multicenter trial. Ann. Surg., 2003, Nov; 238(5): 641–648.
29. Abbas, S. M., Hill, A. G. Systematic review of the literature for the use of oesophageal Doppler monitor for fluid replacement in major abdominal surgery. Anaesthesia, 2008, Jan; 63(1): 44–51.
30. Walsh, S. R., Tang, T., Bass, S., Gaunt, M. E. Doppler-guided intra-operative fluid management during major abdominal surgery: systematic review and meta-analysis. Int. J. Clin. Pract., 2008, Mar; 62(3): 466–470.
31. White, P. F., Kehlet, H., Neal, J. M., Schricker, T., Carr, D. B., Carli, F., Fast-Track Surgery Study Group. The role of the anesthesiologist in fast-track surgery: from multimodal analgesia to perioperative medical care. Anesth. Analg., 2007, Jun; 104(6): 1380–1396.
32. Chopra, V., Plaisance, B., Cavusoglu, E., Flanders, S. A., Eagle, K. A. Perioperative beta-blockers for major noncardiac surgery: Primum Non Nocere. Am. J. Med., 2009, Mar; 122(3): 222–229.
33. Leslie, K., Myles, P. S., Chan, M. T., Paech, M. J., Peyton, P., Forbes, A., McKenzie, D., ENIGMA Trial Group. Risk factors for severe postoperative nausea and vomiting in a randomized trial of nitrous oxide-based vs nitrous oxide-free anaesthesia. Br. J. Anaesth., 2008, Oct; 101(4): 498–505.
34. Myles, P. S., Leslie, K., Chan, M. T., Forbes, A., Paech, M. J., Peyton, P., Silbert, B. S., Pascoe, E., ENIGMA Trial Group. Avoidance of nitrous oxide for patients undergoing major surgery: a randomized controlled trial. Anestesiology, 2007, Aug; 107(2): 221–231.
35. Orhan-Sungur, M., Kranke, P., Sessler, D., Apfel, C. C. Does suppjemental oxygen redukce postoperative nausea and vomiting? A meta-analysis of randomized controlled trials. Anesth. Analg., 2008, Jun; 106(6): 1733–1738. Review.
36. Greif, R., Akca, O., Horn, E. P., Kurz, A., Sessler, D. I. Supplemental perioperative oxygen to reduce the incidence of surgical-wound infection. Outcomes Research Group. N. Engl. J. Med., 2000, Jan 20; 342(3): 161–167.
37. Karthikesalingam, A., Walsh, S. R., Markar, S. R., Sadat, U., Tang, T. Y., Malata, C. M. Continuous wound infusion of local anaesthetic agents following colorectal surgery: systematic review and meta-analysis. World J. Gastroenterol., 2008, Sep 14; 14(34): 5301–5305. Review.
38. Zargar-Shoshtari, K., Hill, A. G. Optimization of perioperative care for colonic surgery: a review of the evidence. ANZ J. Surg., 2008, Jan-Feb; 78(1–2): 13–23. Review.
39. Basse, L., Jakobsen, D. H., Bardram, L., Billesbolle, P., Lund, C., Mogensen, T., Rosenberg, J., Kehlet, H. Functional recovery after open versus laparoscopic colonic resection: a randomized, blinded study. Ann. Surg., 2005, Mar; 241(3): 416–423.
40. King, P. M., Blazeby, J. M., Ewings, P., Franks, P. J., Longman, R. J., Kendrick, A. H., Kipling, R. M., Kennedy, R. H. Randomized clinical trial comparing laparoscopic and open surgery for colorectal cancer within an enhanced recovery programme. Br. J. Surg., 2006, Mar; 93(3): 300–308.
41. Vlug, M. S., Wind, J., van der Zaag, E., Ubbink, D. T., Cense, H. A., Bemelman, W. A. Systematic review of laparoscopic vs open colonic surgery within an enhanced recovery programme. Colorectal Dis., 2009, May; 11(4): 335–343.
42. Nelson, R., Edwards, S., Tse, B. Prophylactic nasogastric decompression after abdominal surgery. Cochrane Database Syst. Rev., 2007, Jul 18;(3): CD004929.
43. Pessaux, P., Regimbeau, J. M., Dondéro, F., Plasse, M., Mantz, J., Belghiti, J. Randomized clinical trial evaluating the need for routine nasogastric decompression after elective hepatic resection. Br. J. Surg., 2007, Mar; 94(3): 297–303.
44. Yang, Z., Zheng, Q., Wang, Z. Meta-analysis of the need for nasogastric or nasojejunal decompression after gastrectomy for gastric cancer. Br. J. Surg., 2008, Jul; 95(7): 809–816.
45. Satinský, I., Mitták, M., Foltys, A., Dostalík, J. Subhepatic drainage in laparoscopic cholecystectomy – a necessity or an overused tradition?. Rozhl. Chir., 2003, Aug; 82(8): 427–431.
46. Petrowsky, H., Demartines, N., Rousson, V., Clavien, P. A. Evidence-based value of prophylactic drainage in gastrointestinal surgery: a systematic review and meta-analyses. Ann. Surg., 2004, Dec; 240(6): 1074–1084
47. Wu, C. L., Cohen, S. R., Richman, J. M., et al. Efficacy of postoperative patient-controlled and continuous infusion epidural analgesia versus intravenous patient-controlled analgesia with opioids: a meta-analysis.a meta-analysis. Anaesthesiology, 2005; 103 : 1079–1088.
48. Gendall, K. A., Kennedy, R. R., Watson, A. J., Frizelle, F. A. The effect of epidural analgesia on postoperative outcome after colorectal surgery. Colorectal Dis., 2007, Sep; 9(7): 584–598.
49. Liu, S. S., Wu, C. L. Effect of postoperative analgesia on major postoperative complications: a systematic update of the evidence. Anesth. Analg., 2007, Mar; 104(3): 689–702.
50. Marret, E., Remy, C., Bonnet, F., Postoperative Pain Forum Group. Meta-analysis of epidural analgesia versus parenteral opioid analgesia after colorectal surgery. Br. J. Surg., 2007, Jun; 94(6): 665–673.
51. Pöpping, D. M., Elia, N., Marret, E., Remy, C., Tramer, M. R. Protective effects of epidural analgesia on pulmonary complications after abdominal and thoracic surgery: a meta-analysis. Arch. Surg., 2008, Oct; 143(10): 990–999; discussion 1000.
52. Hannemann, P., Lassen, K., Hausel, J., Nimmo, S., Ljungqvist, O., Nygren, J., Soop, M., Fearon, K., Andersen, J., Revhaug, A., von Meyenfeldt, M. F., Dejong, C. H., Spies, C. Patterns in current anaesthesiological peri-operative practice for colonic resections: a survey in five northern-European countries. Acta Anaesthesiol. Scand., 2006 Oct; 50(9): 1152–1160.
53. Neugebauer, E. A., Wilkinson, R. C., Kehlet, H., Schug, S. A., PROSPECT Working Group. PROSPECT: a practical method for formulating evidence-based expert recommendations for the management of postoperative pain. Surg. Endosc., 2007, Jul; 21(7): 1047–1053.
54. Lewis, S. J., Andersen, H. K., Thomas, S. Early enteral nutrition within 24 h of intestinal surgery versus later commencement of feeding: a systematic review and meta-analysis. J. Gastrointest. Surg., 2009, Mar; 13(3): 569–575.
54. Andersen, H. K., Lewis, S. J., Thomas, S. Early enteral nutrition within 24 h of colorectal surgery versus later commencement of feeding for postoperative complications. Cochrane Database Syst. Rev., 2006, Oct 18(4): CD004080.
55. Ng, W. Q., Neill, J. Evidence for early oral feeding of patients after elective open colorectal surgery: a literature review. J. Clin. Nurs., 2006, Jun 15(6): 696–709. Review.
56. Henriksen, M. G., Hansen, H. V., Hessov, I. Early oral nutrition after elective colorectal surgery: influence of balanced analgesia and enforced mobilization. Nutrition. 2002 Mar; 18(3): 263–267.
57. Lassen, K., Kjaeve, J., Fetveit, T., Trano, G., Sigurdsson, H. K., Horn, A., Revhaug, A. Allowing normal food at will after major upper gastrointestinal surgery does not increase morbidity: a randomized multicenter trial. Ann. Surg., 2008 May; 247(5): 721–729.
58. Senagore, A. J. Pathogenesis and clinical and economic consequences of postoperative ileus. Am. J. Health Syst. Pharm., 2007, Oct 15; 64(20 Suppl 13): S3–7.
59. Artinyan, A., Nunoo-Mensah, J. W., Balasubramaniam, S., Gauderman, J., Essani, R., Gonzalez-Ruiz, C., Kaiser, A. M., Beart, R. W. Jr. Prolonged postoperative ileus-definition, risk factors, and predictors after surgery. World J. Surg., 2008, Jul; 32(7): 1495–1500.
60. Kehlet, H. Postoperative ileus – an update on preventive techniques. Nat. Clin. Pract. Gastroenterol. Hepatol., 2008 Oct; 5(10): 552–558.
61. Vásquez, W., Hernández, A. V., Garcia-Sabrido, J. L. Is gum chewing useful for ileus after elective colorectal surgery? A systematic review and meta-analysis of randomized clinical trials. J. Gastrointest. Surg., 2009 Apr; 13(4): 649–656.
62. Chan, M. K., Law, W. L. Use of chewing gum in reducing postoperative ileus after elective colorectal resection: a systematic review. Dis. Colon Rectum, 2007, Dec; 50(12): 2149–2157. Review.
63. Noble, E. J., Harris, R., Hosie, K. B., Thomas, S., Lewis, S. J. Gum chewing reduces postoperative ileus? A systematic review and meta-analysis. Int. J. Surg., 2009, Apr; 7(2): 100–105.
64. Greenwood-Van Meerveld, B. Emerging drugs for postoperative ileus. Expert Opin. Emerg. Druha, 2007, Nov; 12(4): 619–626.
65. McNicol, E., Boyce, D. B., Schumann, R., Carr, D. Efficacy and safety of mu-opioid antagonists in the treatment of opioid-induced bowel dysfunction: systematic review and meta-analysis of randomized controlled trials. Pain Med., 2008, Sep; 9(6): 634–659.
66. Marderstein, E. L., Delaney, C. P. Management of postoperative ileus: focus on alvimopan. Ther. Clin. Risk. Manag., 2008, Oct 4(5): 965–973.
67. Kim do, J., Mayo, N. E., Carli, F., Montgomery, D. L., Zavorsky, G. S. Responsive measures to prehabilitation in patients undergoing bowel resection surgery. Tohoku J. Exp. Med., 2009, Feb 217(2): 109–115.
68. Carli, F., Zavorsky, G. S. Optimizing functional exercise capacity in the elderly surgical population. Curr. Opin. Clin. Nutr. Metab. Care, 2005, Jan 8(1): 23–32. Review
69. Lawrence, V. A., Cornell, J. E., Smetana, G. W., American College of Physicians. Strategies to reduce postoperative pulmonary complications after noncardiothoracic surgery: systematic review. Ann. Intern. Med., 2006, Apr 18; 144(8): 596–608.
70. Lindsetmo, R. O., Champagne, B., Delaney, C. P. Laparoscopic rectal resections and fast-track surgery: what can be expected? Am. J. Surg., 2009, Mar 197(3): 408–412.
71. Andersen, J., Hjort-Jakobsen, D., Christiansen, P. S., Kehlet, H. Readmission rates after a planned hospital stay of 2 versus 3 days in fast-track colonic surgery. Br. J. Surg., 2007, Jul 94(7): 890–893.
72. Schwenk, W., Gunther, N., Wendling, P., Schmid, M., Probst, W., Kipfmuller, K., Rumstadt, B., Walz, M. K., Engemann, R., Junghans, T. „Fast-track“ Colon II Quality Assurance Group. „Fast-track“ rehabilitation for elective colonic surgery in Germany-prospective observational data from a multi-centre quality assurance programme. Int. J. Colorectal. Dis., 2008, Jan 23(1): 93–99.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2009 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Rozhledy v chirurgii – 88 roků od jejich založení a 40 let práce prof. MUDr. Miloše Hájka, DrSc.
- Transmyokardiální laserová revaskularizace
- Náhrada aortální chlopně a vzestupné aorty u pacienta s Takayasuovou arteritidou
- Kompresivní syndromy n. suprascapularis – zkušenosti s chirurgickou léčbou
- Antimikrobní léčba nozokomiálních nitrobřišních infekcí – nové léčebné možnosti tygecyklinem
- Laparoskopické resekce jater. Úspěchy a nezdary spojené se zavedením techniky – soubor kazuistik
- Laparoskopická adrenalektomie
- Cizí tělesa – méně obvyklá příčina poranění zažívacího traktu
- Fast track koncept v kolorektální chirurgii v podmínkách nemocnice okresního typu
- Fast track ve střevní chirurgii, aktuální přehled
- Operace varixů dolních končetin radiofrekvenční ablací metodou VNUS-Closure®
- Sto let od narození prof. MUDr. Jana Hromady, DrSc., anatoma světového jména, významného vědce, pedagoga, lékaře
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Kompresivní syndromy n. suprascapularis – zkušenosti s chirurgickou léčbou
- Fast track ve střevní chirurgii, aktuální přehled
- Cizí tělesa – méně obvyklá příčina poranění zažívacího traktu
- Laparoskopická adrenalektomie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



