-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Antimikrobní léčba nozokomiálních nitrobřišních infekcí – nové léčebné možnosti tygecyklinem
Antimicrobial Treatment of Nosocomial Intra-Abdominal Infections – New Treatment Options with Tygecycline
Introduction:
Nosocomial, intra-abdominal infections are extremely serious conditions, considering possibilities for their early diagnosis, as well as for their effective therapy. Multiresistant bacteria(Enterobacteriacae producing extended-spectrum beta-lactamases – ESBL Escherichia coli, Klebsiella species, vancomycin-resistant enterococci [VRE], and methicillin-resistant Staphylococcus aureus [MRSA]) are frequently isolated as pathogens of these infections. Tygecycline is among the novel wide - spectrum antibiotics affecting multiresistant bacteria, which are being introduced in clinical practice.Aim:
The aim of this study is to assess actual sensitivity of tygecycline to the commonest pathogens of intra-abdominal infections, generated in hospitalized surgical patients. Based on the sensitivity tests, tygecycline was indicated for targeted antibiotic therapy in intra-abdominal infections.Methods:
Sensitivity to tygecycline, aminopenicillins, fluorochinoloni and gentamycine was established for the following bacteria: Escherichia coli, Klebsiella pneumonie, Enterobacter cloacea, Proteus mirabilis. Sensitivity to oxacillin, clincamycine and tygecycline was tested in Staphylococcus aureus, and to fluorochinolini,gentamycine and tygecycline in Enterococcus faecalis, and to fluorochinoloni, gentamycine, ceftazidime and gentamycine in Pseudomonas aeruginosa.
Based on the sensitivity results, tygecycline was administered in two patients with postsurgical intra-abdominal infections caused by ESBL Escherichia coli and Klebsiella pneumonie. The initital dose of tygecycline was 100 mg i.v., followed by tygecycline 50 mg i.v. every 12 hours for 7 days.Results:
The isolated bacteria showed 98–100% sensitivity to tygecycline, except Psudomonas aeruginosa, where 100% resistance was demonstrated. Targeted antimicrobial medication with tygecycline proved effective in postoperative nosocomial intra-abdominal infections, the both concerned patients recovered.Conclusion:
The choice of antimicrobial medication in nosocomial intra-abdominal infections requires through evaluation considering various factors including prior antibiotic therapy, co-morbidities and the current status of sensitivity with respect to potential multiresistant pathogens. Tygecycline shows significant in vitro efficacy against resistant gram-positive and key gram-negative facultative bacteria, which are a common cause of intra-abdominal infections in surgery patients. Clinical experience has shown that tygecycline is safe and effective in the treatment of complicated intra-abdominal infections.Key words:
intra-abdominal infections – tygecycline – in vitro sensitivity – indications for therapy
Autoři: F. Vyhnánek; Adámková V.+; V. Ducháč; Teplan V. Jr; Jirásek T.++
Působiště autorů: 3. LF UK a FNKV Praha ; +Ústav lékařské mikrobiologie, přednosta: doc. MUDr. Marek Bednář, CSc. ; ++Ústav patologie, přednosta: prof. MUDr. Václav Mandy, CSc. ; Chirurgická klinika, přednosta: prof. MUDr. Robert Gürlich, CSc.
Vyšlo v časopise: Rozhl. Chir., 2009, roč. 88, č. 9, s. 503-507.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Nozokomiální nitrobřišní infekce patří mezi velmi závažné infekce z pohledu jak časné diagnózy tak i účinné terapie. U těchto infekcí jsou častěji izolovány jako pathogeny multirezistentní bakterie (Enterobacteriacae produkující rozšířené spektrum beta-laktamáz – ESBL Escherichia coli, Klebsiella species, vankomycin rezistentní enterokoky [VRE], a methicilin rezistentní Staphylococcus aureus [MRSA]). Mezi nová antibiotika se širokým spektrem účinku postihující multirezistentní bakterie je do klinické praxe uváděn tygecyklin.
Cílem sdělení je vyhodnocení současné citlivosti tygecyklinu k nejčastějším patogenům nitrobřišních infekcí generovaných u nemocných hospitalizovaných na chirurgické klinice. Na základě citlivosti byl tygecyklin indikován k cílené antibiotické léčbě u nitrobřišních infekcí.Metoda:
Byla stanovena aktuální citlivost na tygecyklin u Escherichia coli, Klebsiella pneumonie, Enterobacter cloacea, Proteus mirabilis u aminopenicilinů, fluorochinolonů, tygecyklinu a gentamicinu. Citlivost na oxacilin, klindamycin a tygecyklin byla testována u Staphylococcus aureus, na flourochinolony, gentamicin a tygecyklin u Enterococcus faecalis, a na flourochinolony, gentamicin, ceftazidim a gentamicin u Pseudomonas aeruginosa.
Na základě výsledku citlivosti byl tygecyklin podán u dvou nemocných s pooperační nitrobřišní infekcí vyvolaných ESBL Escherichia coli a Klebsiella pneumonie. Tygecyklin byl podán v úvodní dávce 100 mg i.v. a dále 50 mg i.v. po l2 hodinách po dobu 7 dní.Výsledky:
Izolované bakterie byly citlivé k tygecyklinu a to 98–100 % mimo Psudomonas aeruginosa, kde byla prokázána 100% rezistence. Cílená antimikrobní léčba tygecyklinem u pooperační nozokomiální nitrobřišní infekce byla účinná, oba nemocní se zhojily.Závěr:
Výběr antimikrobní léčby u nozokomiálních nitrobřišních infekcí vyžaduje pečlivou úvahu s pohledu řady faktorů jako je předchozí antibiotická léčba, přidružená onemocnění a aktuální stav citlivosti proti multirezistentním potenciálním patogenům. Tygecyklin má významnou účinnost in vitro proti rezistentním Gram-pozitivním i klíčovým Gram-negativním fakultativním bakteriím, které jsou často příčinou nitrobřišní infekce u chirurgického nemocného. Dosavadní klinické zkušenosti ukazují, že tygecyklin je bezpečný a účinný v léčbě komplikovaných nitrobřišních infekcí.Klíčová slova:
nitrobřišní infekce – tygecyklin – citlivost in vitro – indikace k léčběÚVOD
Nozokomiální infekce vzniká u nemocných hospitalizovaných více než 48 hodin a obvykle je vyvolána nemocniční získanou infekcí, která zahrnuje bakterie se získanou antimikrobní rezistencí [1]. Rozvoj této nitrobřišní infekce závisí na stupni kontaminace peritonea bakteriemi a střevním obsahem a na stavu obranyschopnosti nemocného. Nozokomiální nitrobřišní infekce patří mezi velmi závažné infekce z pohledu jak časné diagnózy tak i účinné terapie [1, 2, 3]. Úspěšný výsledek léčby závisí na časné diagnóze, rychlé a přiměřené chirurgické intervenci a výběru účinného antibiotického režimu. Opoždění v chirurgické revizi je spojeno se signifikatním zvýšením úmrtnosti [2]. Iniciální výběr antimikrobní léčby u komplikovaných nozokomiálních nitrobřišních infekcí je extrémně důležitý protože při spojení nepřiměřené empirické antimikrobní léčby a opožděného klinického řešení se prodlužuje doba hospitalizace a zvyšuje se riziko úmrtnosti [1, 4, 5]. U těchto infekcí jsou častěji izolovány jako patogeny multirezistentní bakterie (Enterobacteriacae produkující rozšířené spektrum beta-laktamáz – ESBL Escherichia coli, Klebsiella species, vankomycin-rezistentní enterokoky [VRE] a methicillin rezistentní Staphylococcus aureus [MRSA]). Mezi nová antibiotika se širokým spektrem účinku postihující i multirezistentní bakterie vyvolávající nozokomiální nitrobřišní infekce je do klinické praxe uváděn tigecyklin [5, 6, 7, 8, 9]. Tygecyklin patří mezi glycylcykliny, semisyntetické deriváty tetracyklinů se širokým spektrem účinku proti bakteriím, se kterými se často setkáváme u nitrobřišních infekcí zahrnující aerobní a fakultativní Gram-pozitivní a Gram-negativní bakterie a anaerobní bakterie. Tygecyklin je in vitro účinný proti rezistentním bakteriím jako je MRSA, VRE a ESBL-produkující Enterobacteriaceae.
MATERIÁL, METODA, VÝSLEDKY
Cílem sdělení je vyhodnocení současné citlivosti tygecyklinu k nejčastějším patogenům nitrobřišních infekcí generovaných u nemocných hospitalizovaných na chirurgické klinice a na základě přehledu doporučení pro empirickou antimikrobní léčbu u nitrobřišních infekcí a i vlastní zkušenosti uvést současné možnosti zařazení tygecyklinu mezi léky volby u vysoce rizikových nemocných s nozokomiální nitrobřišní infekcí. Byla stanovena aktuální rezistence u Enterobacteriacae/Escherichia coli (131 bakterií), Klebsiella pneumonie (49), Enterobacter cloacae (8), Proteus mirabilis (36) u aminopenicilinů, fluorochinolonů, tygecyklinu a gentamicinu (Graf 1–4). Citlivost na oxacilin, klindamycin a tygecyklin byla testována u 70 izolovaných Staphylococcus aureus (Graf 5) a na flourochinolony, gentamicin a tygecyklin u 46 izolovaných Enterococcus faecalis (Graf 6). Dalším nozokomiálním patogenem, který byl vyšetřen byla Pseudomonas aeruginosa (Graf 7), kdy u 38 bakterií byla testována citlivost na tygecyklin, flourochinolony, ceftazidim a gentamicin. Všechny izolované bakterie byly získány z mikrobiologických vyšetření od nemocných hospitalizovaných na chirurgické klinice. Citlivost k tygecyklinu byla 98–100 % u všech testovaných bakterií mimo Pseudomonas aeruginosa, kde byla prokázána 100% rezistence. Na základě těchto výsledků in vitro a výsledků recentních studií byl tygecyklin podán k cílené léčbě pooperační nitrobřišní infekce.
Graf 1. In vitro citlivost Escherichia coli Graph 1. In vitro sensitivity of Escherichia coli Počet bakterií 131. Zkratky: AMC – aminopeniciliny, FQ – fluorochinolony, TYG – tygecyklin, GEN – gentamicin, CITL – % citlivosti , REZ – % rezistence 
Graf 2. In vitro citlivost Klebsiella pneumonie Graph 2. In vitro sensitivity of Klebsiella pneumonie Počet bakterií 49. Zkratky: AMC – aminopeniliny, FQ – fluorochinolony, TYG – tygecyklin, GEN – gentamicin, CITL – % citlivosti, REZ – % rezistence 
Graf 3. In vitro citlivost Enterobacter cloacae Graph 3. In vitro sensitivity of Enterobacter cloacae Počet bakterií 8. Zkratky: AMC – aminopeniciliny, FQ – fluorochinolony, TYG – tygecyklin, GEN – gentamicin, CTIL – % citlivosti, REZ – % rezistence 
Graf 4. In vitro citlivost Proteus mirabilis Graph 4. In vitro sensitivity of Proteus mirabilis Počet bakterií 36. Zkratky: AMC – aminopeniciliny, FQ – flouorochinolony, TYG – tygecyklin, GEN – gentamicin, CITL – % citlivosti, REZ – % rezistence 
Graf 5. In vitro citlivost Staphylococcus aureus Graph 5. In vitro sensitivity of Staphylococcus aureus Počet bakterií 70. Zkratky: OXA – oxacilin, CLI – klindamycin, TYG – tygecyklin, CITL – % citlivosti, REZ – % rezistence 
Graf 6. In vitro citlivost Enterococcus faecalis Graph 6. In vitro sensitivity of Enterococcus faecalis Počet bakterií 46. Zkratky: FQ – fluorochinolony, GEN – gentamicin, TYG – tygecyklin, CITL – % citlivosti, REZ – % rezistence 
Graf 7. In vitro citlivost Pseudomonas aeruginosa Graph 7. In vitro sensitivity of Pseudomonas aeruginosa Počet bakterií 38. Zkratky: TYG – tygecyklin, FQ – fluorochinolony, CTZ – ceftazidim, GEN – gentamicin, CITL – % citlivosti, REZ – % rezistence 
KAZUISTIKA 1
Nemocný, 63 let, přijat na chirurgickou kliniku pro recidivu bolestí v pravém podžebří, před 3 týdny propuštěn po konzervativní léčbě cholecystitidy s prokázanou cholelitiázou. Nemocný febrilní 38 °C. Laboratorní vyšetření: leukocyty 11,2, CRP 130. Ultrazvuk žlučníku: empyém žlučníku, výrazné zánětlivé změny ve stěně s drobnými abscesy, drobný konkrement (6 mm). Zahájena antimikrobní léčba ceforepazonem / sulbaktamem. Kontrolní vyšetření za 2 dny leukocyty 18,9, CRP 227, CT břicha (Obr. 1) se závěrem: známky abscesu v lůžku žlučníku. Indikována operace. Operační diagnóza: cholecystitis gangrenosa acuta, cholelithiasis, abscesu retrovesicalis. Operace: cholecystektomie, drenáž podjaterní krajiny. Histologický nález: těžká ulceroflegmonózní cholecystitis, ve stěně flegmonózní zánětlivý infiltrát, místy až s formací abscesů. V pooperačním průběhu šestý den přetrvává vysoká hodnota CRP 209, subfebrilie a hnisavá sekrece z rány. Podle klinického vyšetření a kontrolního CT břicha (Obr. 2) jde o hlubokou infekci chirurgického místa, která drénována. Vzhledem k výsledku mikrobiologického vyšetření ESBL-Escherichia coli rezistentní na betalaktamázová antibiotika podán podle citlivosti tygecyklin v dávce 100 mg i.v. a dále 50 mg po 12 hod po dobu jednoho týdne. Po 48 hodinách od zahájení léčby afebrilní kontrolní CRP 35, mírná sekrece z rány přetrvává ještě osmý den, kdy nemocný je propuštěn do domácího ošetření. Při ambulantní kontrole jedenáctý den hojící se rána per secundam, již bez sekrece.
Obr. 1. CT vyšetření břicha s nálezem rozšíření stěny žlučníku a tekutinou v lůžku žlučníku Fig. 1. Abdominal CT examination showing a thickened gall bladder wall and fluid within the gall bladder bed 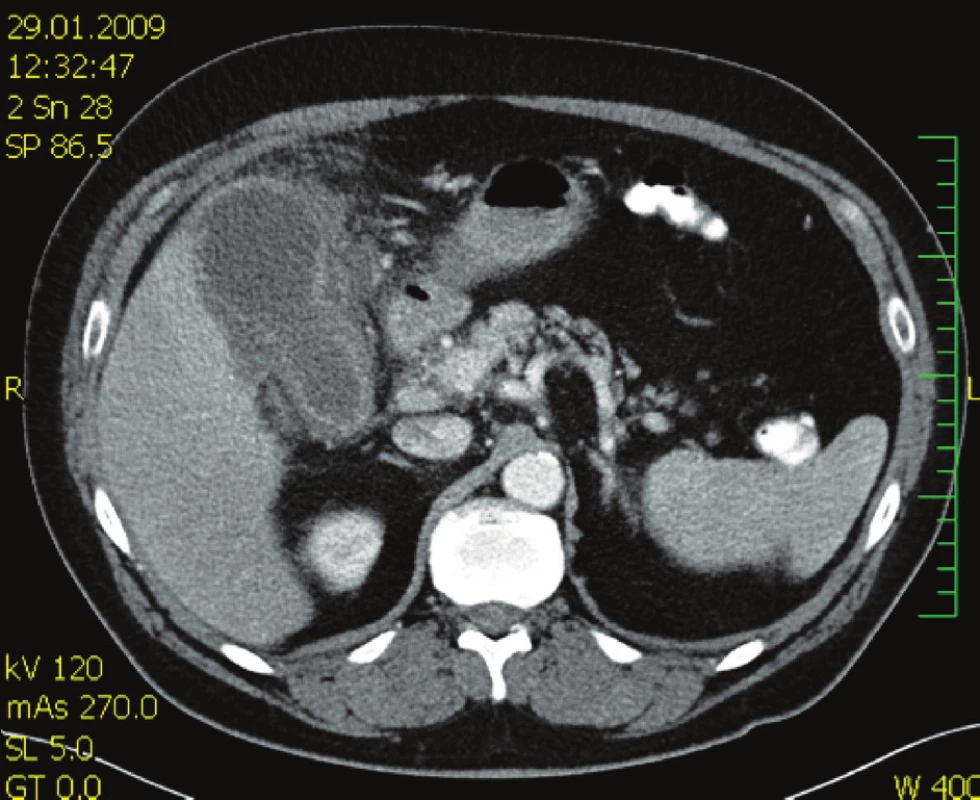
Obr. 2. CT vyšetření břicha s nálezem defektu v břišní stěně se vzduchem Fig. 2. Abdominal CT examination showing an abdominal wall defect with air 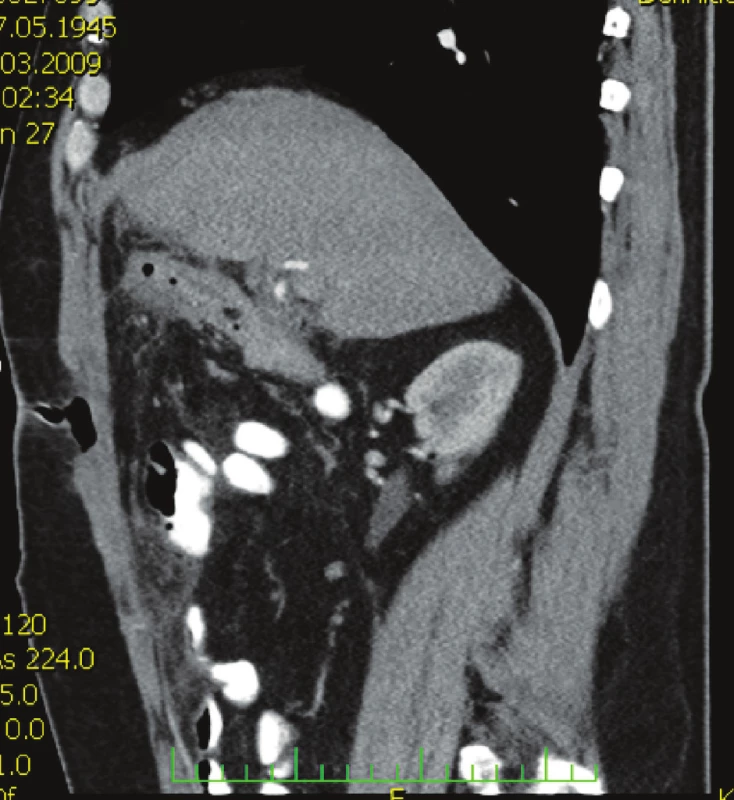
KAZUISTIKA 2
Nemocný, 56 let, přijat na chirurgickou kliniku s bolestí v pravém mezogastriu, zvracením, febrilní (37,8 °C) a nálezem na břiše s palpační bolestí v pravém mezo - a hypogastriu se známkami peritoneálního dráždění. Laboratorní vyšetření: leukocyty 18,2, CRP 190,7. Závěr klinického vyšetření: akutní appendicitis. Nemocný indikován k operaci. Operační diagnóza: appendicitis gangrenosa perforativa retrocoecalis, abscesu periappendicularis. Operace: appendektomia, drenáž peritoneální dutiny. Histologický nález: appendix rozsáhle prostoupen fibrinózně hnisavým zánětlivým infiltrátem, obraz ulceroflegmonózní apendicitidy, na mnoha místech přecházející do obrazu apendicitidy gangrenózní. Na povrchu rozsáhle fibrinózně hnisavá periappendicitis s přechodem zánětlivého infiltrátu až i do tukové vazivové tkáně mezoapendixu. Antimikrobní léčba ampicilin / sulbatam, metronidazol. Sedmý pooperační den febrilie 38,3 °C. CRP 188, bolesti v pravém hypogastriu, pro podezření na recidivu nitrobřišní infekce provedeno CT břicha (Obr. 3) s nálezem nitrobřišního abscesu indikována operační revize. Operační diagnóza: abscesuss intraperitonealis hypogastrii dx. Operace: evakuace abscesu, drén. Za tři dny po reoperaci střevní sekrece z drénů, indikována další revize. Operační diagnóza: pistula coecocutanea z dehiscence uzávěru pahýlu appendixu. Operace: sutura céka, laváž, drenáž peritoneální dutiny. Vzhledem k výsledku mikrobiologického vyšetření s nálezem ESBL-Escherichia coli a Klebsiella pneumonie rezistentní na betalaktamázová antibiotika podán tygecyklin v dávce 100 mg i.v. a dále 50 mg po 12 hodinách 7 dní. V dalším průběhu nemocný afebrilní a postupně se snižující sekrece z rány, propuštěn jedenáctý den po druhé reoperaci. Při ambulantní kontrole za 3 dny rána zhojena per secundam.
Obr. 3. CT vyšetření břicha s nálezem ohraničené kolekce tekutiny v ileocékální krajině Fig. 3. Abdominal CT examination showing defined fluid collection within the ileocaecal region 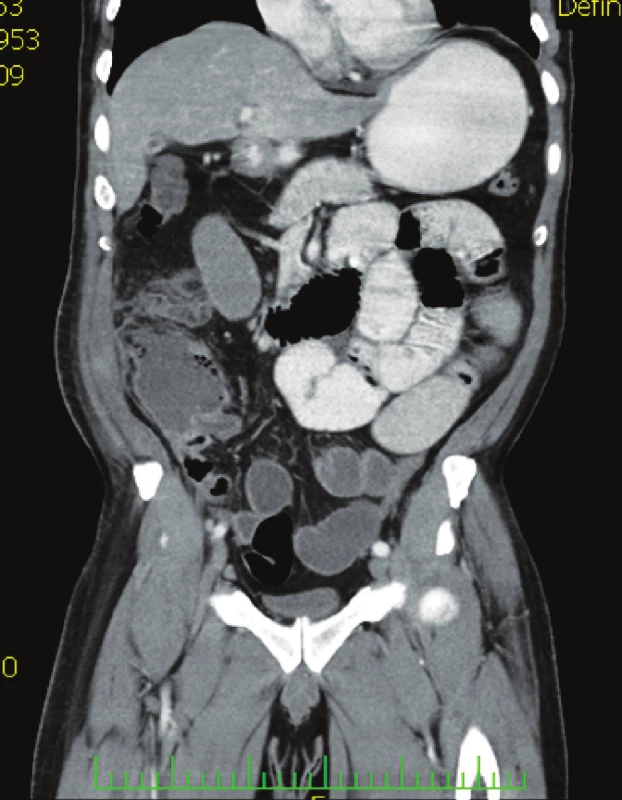
DISKUSE
Výsledek léčby nozokomiální nitrobřišních infekcí především pooperačních závisí na jejich časné diagnóze, rychlé a přiměřené chirurgické nebo radiologické intervenci a výběru účinného antibiotického režimu s cílem volby širokospektrých farmak účinných proti jak častým tak i neobvyklým patogenům [1, 2, 3]. Všechny iniciální antibiotické režimy u nitrobřišní infekcí jsou empirické, protože jde o velký počet potencionálních patogénů a dále fakt, že výsledky kultivace a citlivosti lze získat většinou až po 48 hodinách [1]. Promptní podání antibiotik je nezbytné a studie prokázaly, že podání antibiotik až 8 hodin po přijetí nemocného zvyšuje morbiditu a letalitu a to u obou tj. závažných komunitních – získaných a i u závažných nozokomiálních infekcí [1, 2]. K empirické rozvaze je proto nezbytné zajistit surveillance program, kde je sledována epidemiologická situace u patogenů na daném chirurgickém oddělení. Zvláště pak monitorace rezistentních patogenů jako je ESBL-produkující Enterobacteriaceae, vankomycin rezistentní enterokoky nebo methicilin rezistentní stafylokoky. K ním patří i karbapenem rezistentní Acinetobacter baumani nebo Pseudomonas aeruginosa [1]. Z hlediska výběru léčby jsou doporučovány režimy s monoterapií a kombinovanou léčbou. Především monoterapie je doporučována v léčení vysoce rizikových nemocných s nozokomiální nitrobřišní infekcí a to karbapenemy (meropenem, imipenem/ cilastatatin) nebo širokospektré peniciliny s inhibitorem betalaktamázy (piperacilin - tazobaktam) [1]. Nicméně i jejich účinnost je dnes limitována narůstající rezistencí uvedených multirezistentních bakterií. Mezi novější léčebné možnosti v terapii nozokomiálních infekcí se řadí tygecyklin [5, 6, 7, 8, 9], který má širokospektrou aktivitu a to především proti multirezistentním patogenům. Jediným rezistentním patogenem je Pseudomonas aeruginosa, což bylo prokázáno i v naší studii. Klinické studie srovnávaly účinek tygecyklinu s imimpenem / cilastatinem u nitrobřišních infekcí Výsledky byly srovnatelné (vyléčeno 89 % vs. 88 % nemocných) a i pokud jde o eradikaci jednotlivých patogenů (Escherichia coli 86,2 % vs. 87,1 %, Klebsiella pneumonie 88,5 % vs. 90 %, MRSA 92,9 % vs. 91,7 %). V taktice podání tygecyklinu u nitrobřišní infekcí je v současné době indikován jako: 1. iniciální empirická antimikrobní léčba komplikovaných infekcí (sekundární peritonitidy) s příznaky SIRS, 2. cílená antimikrobní léčba u nozokomiálních infekcí (pooperační peritonitida, absces, infekce chirurgického místa), 3. cílená antimikrobní léčba u reziduální infekce při selhání iniciální empirické antibiotické léčby [5, 6]. Limitující faktor tj. rezistence u Pseudomonas aeruginosa je u empirické antimikrobní léčby minimální, protože tento patogen je příčinou nozokominálních infekcí v pooperačním průběhu.
Zkušenosti s cílenou léčbou u nozokominální infekce vyvolané multirezistentními patogeny znamenají zařazení tygecyklinu jako antibiotika první volby.
ZÁVĚR
Výběr antimikrobní léčby u nozokomiálních nitrobřišní infekcí vyžaduje pečlivou úvahu s pohledu řady faktorů jako je předchozí antibiotická léčba a přidružená onemocnění a aktuální stav citlivosti především multirezistentních potenciálních nozokomiálních patogenů. Současné doporučení je u těchto infekcí pro volbu antibiotika účinného proti aerobním i anaerobním bakteriím. Tygecyklin je první z glycylcyklinů, který má významnou účinnost proti rezistentním Gram-pozitivním mikroorganismům a i kličovým Gram-negativním fakultativním bakteriím, které jsou často spojené s nitrobřišní infekcí. Dosavadní klinické zkušenosti ukazují, že tygecyklin je bezpečný a účinný v léčbě komplikovaných nitrobřišní infekcí. Tygecyklin reprezentuje slibné doplnění spektra v antimikrobní léčbě těchto závažných infekcí.
Doc. MUDr. František Vyhnánek, CSc.
Chirurgická klinika FNKV
Šrobárova 50
100 34 Praha 10
e-mail: vyhnanek@fnkv.cz
Zdroje
1. Dupont, H. The empiric treatment of nosocomial intra-abdominal infections. Int. J. Infect Dis., 2007 ,11: Suppl. 1: S1–S6.
2. Cheadle, W. G., Spain, D. A. The continuing challenge of intra-abdominal infection. Am. J. Surg., 2003, 186 : 5: 15–22.
3. Vogel, T. R., Dombrovskiy, V. Y., Lowry, S. F. Trends in postoperative sepsis: Are we improving outcomes? Surg. Infect., 2009, 10 : 1: 71–78.
4. Mazuski, J. E. Vancomycin-resistant enterococcus: risk factors, surveillance, infections, and treatment. Surg. Infect., 2008, 9 : 6: 567–571.
5. Fomin, P., Beran, M., Gradauskas, A., et al. Tygecycline is efficacious in the treatment of complicated intra-abdominal infections. Int. J. Surg., 2005, 3 : 1: 35–47.
6. Homer-Vanniasinkam, S. Treatment of intra-abdominal and skin and soft tissue infections: The role of the glycylcyclines. Int. J. Surg., 2005, 4 : 1: 45–52.
7. Marešová, V., Urbánková, P. Tigecyklin. Remedia, 2008, 18 : 3: 194–200.
8. Wilcox, M. H. Efficacy of tigecycline in complicated structure infections and complicated Intra-abdominal infections. J. Chemother., 2005, 17: Suppl. 1: S23–S29.
9. Babinchak, T., Ellis-Grosse, E., Dartois, N., et al. The efficacy and safety of tigecycline for the treatment of complicated intra-abdominal infections: analysis of pooled clinical trial data. Clin. Infect. Dis., 2005, 41: Suppl. 5: S354–S367.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2009 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Rozhledy v chirurgii – 88 roků od jejich založení a 40 let práce prof. MUDr. Miloše Hájka, DrSc.
- Transmyokardiální laserová revaskularizace
- Náhrada aortální chlopně a vzestupné aorty u pacienta s Takayasuovou arteritidou
- Kompresivní syndromy n. suprascapularis – zkušenosti s chirurgickou léčbou
- Antimikrobní léčba nozokomiálních nitrobřišních infekcí – nové léčebné možnosti tygecyklinem
- Laparoskopické resekce jater. Úspěchy a nezdary spojené se zavedením techniky – soubor kazuistik
- Laparoskopická adrenalektomie
- Cizí tělesa – méně obvyklá příčina poranění zažívacího traktu
- Fast track koncept v kolorektální chirurgii v podmínkách nemocnice okresního typu
- Fast track ve střevní chirurgii, aktuální přehled
- Operace varixů dolních končetin radiofrekvenční ablací metodou VNUS-Closure®
- Sto let od narození prof. MUDr. Jana Hromady, DrSc., anatoma světového jména, významného vědce, pedagoga, lékaře
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Kompresivní syndromy n. suprascapularis – zkušenosti s chirurgickou léčbou
- Fast track ve střevní chirurgii, aktuální přehled
- Cizí tělesa – méně obvyklá příčina poranění zažívacího traktu
- Laparoskopická adrenalektomie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



