-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Variace léčby primárního spontánního pneumotoraxu
Variations of Primary Spontaneous Pneumothorax Management
Objective:
The aim of our study was to determine the current practice and variation among pulmonologists, general and thoracic surgeons treating primary spontaneous pneumothorax (PSP) in the Czech Republic.Methods:
A pneumothorax questionnaire was mailed to 153 chiefs of departments of general surgery, pneumology and to thoracic surgeons (55 pulmonologists, 75 general surgeons, 23 thoracic surgeons). Mail contained the survey questionnaire and cover letter requesting the recipients’ participation and explaining the purpose of the research. National survey questionnaire included questions on PSP management, chest tube attachment preferences and its removal managementResults:
Ninety seven respondents (63%) answered the survey. This included 28 pulmonologists (28/55, 52%), 48 general surgeons (49/75, 64%) and 20 thoracic surgeons (20/23, 87%). Sixty nine percent of respondents treat first PSP with chest tube, 6% by aspiration. Seventy four percent of respondents insert chest tube in the second intercostal space midclavicular line and 22% in the fourth intercostal space midaxillary line. Nearly 71% of pulmonologists use < 18F chest tube, 85% of thoracic surgeons insert a 20–24F chest tube. Active suction use 56% of respondents. Seventy four percent of physicians clamp chest tube prior its removal. Thirty nine percent of respondents pull out a chest tube at the end of inspirium, and 33% at the end of expirium.Conclusions:
Marked practice variations exist among physicians treating spontaneous pneumothorax. Variations exist not only between pulmonologists and surgeons, but also in the group of surgeons itself.Key words:
primary spontaneuos pneumotorax – chest tube – thoracoscopy
Autoři: A. J. Stolz; J. Šimonek; P. Pafko
Působiště autorů: III. chirurgická klinika 1. LF UK a FN Motol, Praha, přednosta: prof. MUDr. P. Pafko, DrSc.
Vyšlo v časopise: Rozhl. Chir., 2008, roč. 87, č. 1, s. 5-9.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Cílem naší studie bylo zjistit rozdílnosti v terapii primárního spontánního pneumotoraxu (PSP) mezi pneumology, všeobecnými a hrudními chirurgy v České republice.Metody:
Dotazník týkající strategie léčby PSP byl rozeslán 153 primářům oddělení pneumologie a všeobecné chirurgie a také hrudním chirurgům (55 pneumologům, 75 všeobecným chirurgům a 23 hrudním chirurgům). Obsahem byl úvodní dopis s vysvětlením cílů studie a žádostí, aby se této studie zúčastnili. Dotazník obsahoval otázky ohledně strategie terapie PSP, volby a managementu hrudních drénů.Výsledky:
Studie se zúčastnilo 97 (63 %) lékařů. Celkem odpovědělo 28 pneumologů (28/55, 52 %), 48 všeobecných chirurgů (49/75, 64 %) a 20 hrudních chirurgů (20/23, 87 %). První ataku PSP modelového případu by 69 % lékařů léčilo zavedením hrudního drénu, 6 % lékařů by provedlo aspiraci. Hrudní drén by zavedlo v 2. mezižebří medioklavikulární čáry 74 % lékařů a 22 % by volilo 4. mezižebří střední axilární čáry. Skoro 71 % pneumologů by použilo hrudní drén velikosti < 18 F, 85 % hrudních chirurgů by zvolilo hrudní drén velikosti 20–24F. Zavedený hrudní drén by 56 % lékařů dalo hned na aktivní sání. Uzavření hrudního drénu před jeho odstraněním by provedlo 74 % lékařů. Celkem 39 % lékařů by hrudní drén odstranilo na konci inspíria a 33 % na konci expíria.Závěr:
Mezi lékaři, kteří se podílejí na terapii PSP, existují rozdílné přístupy v léčbě. Tyto rozdíly existují jak mezi pneumology a chirurgy, tak mezi hrudními a všeobecnými chirurgy.Klíčová slova:
primární spontánní pneumotorax – hrudní drén – videotorakoskopieÚVOD
Léčba primárního spontánního pneumotoraxu (PSP) je charakteristická v rozdílném přístupu mezi lékaři. Strategie léčby pak hodně závisí na specializaci ošetřujícího lékaře (pneumolog, všeobecný nebo hrudní chirurg) a terapeutických možností daného pracoviště. Tyto rozdíly vedly k vypracování národních standardů a doporučení [1, 2]. Primární spontánní pneumotorax se vyskytuje u pacientů bez zřejmého onemocnění plicního parenchymu. Sekundární spontánní pneumotorax je komplikací onemocnění plicního parenchymu, nejčastěji na základě chronické obstrukční plicní nemoci (CHOPN). Cílem naší studie bylo zjistit rozdílnosti v terapii primárního spontánního pneumotoraxu mezi lékaři, kteří se na jeho terapii podílejí.
METODY
Dotazník ohledně strategie léčby PSP byl rozeslán 153 primářům oddělení pneumologie a všeobecné chirurgie a také hrudním chirurgům (55 pneumologům, 75 všeobecným chirurgům a 23 hrudním chirurgům). Dotazník byl adresován právě primářům, kteří by měli reprezentovat určitou strategii léčby PSP na pracovištích, která vedou. Obsahem byl úvodní dopis s vysvětlením cílů studie a požádáním, aby se studie zúčastnili. Dotazníky obsahovaly otázky ohledně strategie terapie PSP, volby a managementu hrudních drénů. Byl vybrán modelový příklad pacienta s PSP na hranici velkého a malého PSP podle kritérií Baumanna, kdy velikost pneumotoraxu od vrcholu pleurální dutiny byla 30 mm a 20 mm od laterální hrudní stěny na předozadním skiagramu hrudníku – odhadovaná velikost PSP podle Rhea 30 %. Odpovědi byly akceptované do října 2006.
VÝSLEDKY
Studie se zúčastnilo 97 (63 %) lékařů. Celkem odpovědělo 28 pneumologů (28/55, 52 %), 48 všeobecných chirurgů (49/75, 64 %) a 20 hrudních chirurgů (20/23, 87 %).
Tabulka 1 demonstruje odpovědi lékařů na modelový případ první ataky PSP: 251etý mladý, eupnoický pacient s první atakou PSP. Tento modelový případ by lékaři nejčastěji řešili zavedením hrudního drénu (69 %). Aspiraci PSP by jako metodu první volby volilo jen 6 % respondentů. Skoro polovina respondentů by hrudní drén zavedla na jednotce intenzivní péče, kdežto 41 % hrudních chirurgů by drén zavedlo na operačním sále s cílem minimalizace rizika infekce. Nejčastějším místem zavedení hradního drénu bylo 2. mezižebří medioklavikulární čáry (74 %). Lékaři by nejčastěji zavedli hrudní drén velikosti 20–24 F (61 %), ale existovaly zde rozdíly mezi specializacemi. Pneumologové by více použili tenčí drény (14–18 F, 71 %), většina hrudních chirurgů by použila drény většího rozměru (20–24 F, 85 %). Další okruh otázek se týkal napojení hrudního drénu. Po zavedení hrudního drénu by jej na aktivní sání napojilo 56 % lékařů. Heimlichovu chlopeň by použilo 1 % lékařů. Pneumologové by spádovou drenáž použili častěji než hrudní chirurgové (48 % vs. 30 %).
Tab. 1. První ataka primárního spontánního pneumotoraxu Tab. 1. The first episode of primary spontaneous pneumothorax 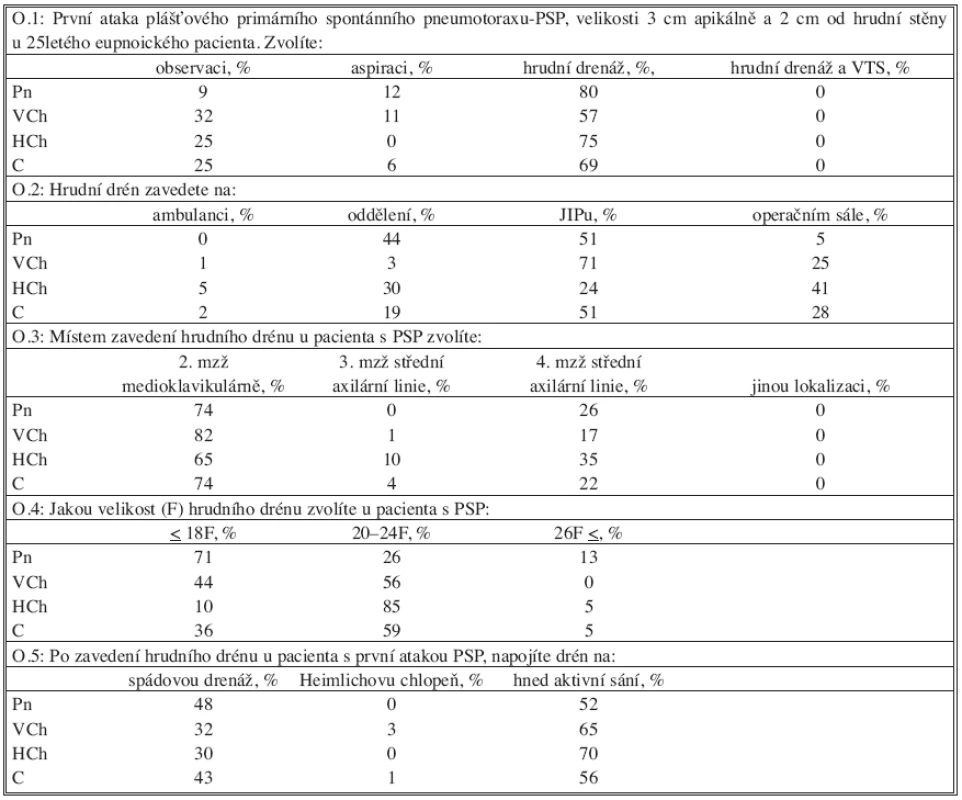
O – otázka, PSP – primární spontánní pneumotorax, Pn – pneumolog, VCh – všeobecný chirurg, HCh – hrudní chirurg, C – celá skupina lékařů Tabulka 2 se věnuje starostlivosti o hrudní drény. Většina lékařů (64 %) odstraní drén 24–48 hodin po ukončení úniku vzduchu. Před jejím odstraněním se většina lékařů přesvědčí uzavřením drénu o tom, že nedochází ke kolapsu plíce. Pneumologové uzavírají hrudní drén častěji než hrudní chirurgové (89 % vs. 60 %). Rozdíly existují také v načasování odstranění hrudního drénu v závislosti od respiračního cyklu. Skoro 39 % lékařů odstraní drén na konci inspíria, 23 % na konci expíria a 28 % v průběhu expíria.
Tab. 2. Management hrudních drénů Tab. 2. Chest tube management 
O – otázka, PSP – primární spontánní pneumotorax, Pn – pneumolog, VCh – všeobecný chirurg, HCh – hrudní chirurg, C – celá skupina lékařů Tabulka 3 znázorňuje odpovědi na otázku strategie terapie druhé ataky PSP u modelového případu. Bez zavedeného hrudního drénu by pacienta přeložilo na oddělení hrudní chirurgie 41 % pneumologů a 37 % všeobecných chirurgů. Před operací by zavedlo 10 % hrudních chirurgů hrudní drén. Ostatní by indikovali pacienta k operaci bez zavedeného hradního drénu. V provedení operačního výkonu pro recidivu PSP jsou mezi chirurgy rozdíly. V případě, že nejsou viditelné blebs, staplerovou resekci apexu I. segmentu by provedlo 51 % chirurgů, resekci jiné části plicního parenchymu by provedlo 20 % a 29 % chirurgů by neprovedlo výkon na plicním parenchymu.
Tab. 3. Recidiva primárního spontánního pneumotoraxu Tab. 3. Recurrence of primary spontaneous pneumothorax 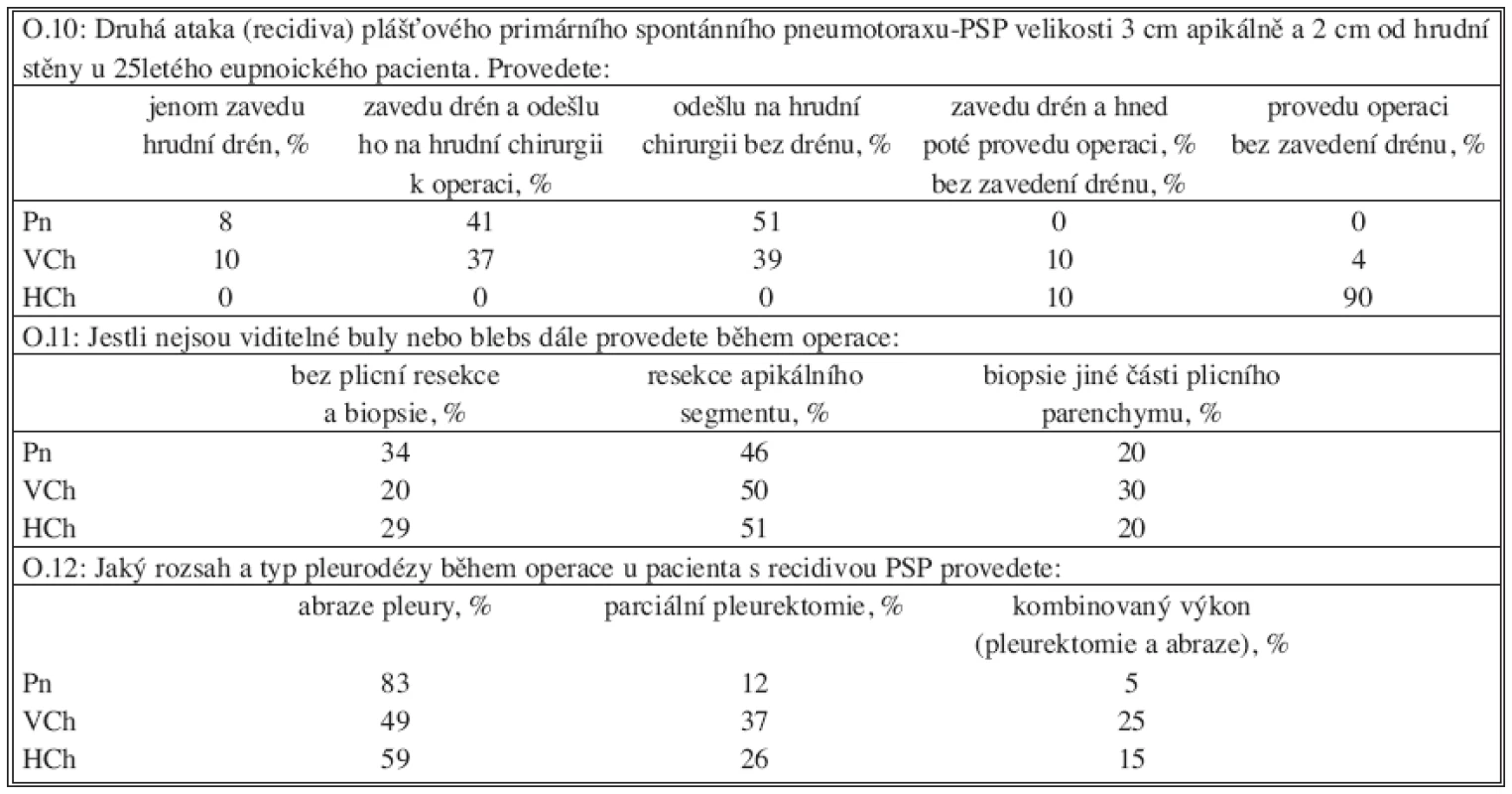
O – otázka, PSP – primární spontánní pneumotorax Pn – pneumolog, VCh – všeobecný chirurg, HCh – hrudní chirurg DISKUSE
Primární spontánní pneumotorax se vyskytuje u přibližně 10/100 000 obyvatel a v jeho terapii a léčbě jsou různé přístupy. Tyto rozdílnosti v přístupu k terapii mohou vycházet z různých specializací lékařů, kteří se na jeho léčbě podílejí (pneumologové, všeobecní a hrudní chirurgové) a malého množství randomizovaných a prospektivních studií. Cílem naší studie bylo zjistit rozdílné přístupy kliniků podílejících se na léčbě PSP.
V terapii PSP v závislosti od jeho velikosti je možné postupovat od sledování pacienta, aspiraci až po zavedení hrudního drénu. Doporučení British Thoracic Society (BTS) doporučuje u PSP většího než 20 mm provést jako první krok jeho aspiraci [2]. Úspěšnost aspirace závisí na věku pacienta (< 50 let – 70–81 %, > 50 let – 19–31 %) a velikosti PSP (velikost podle objemu aspirace: < 3 l aspirováno – 89% úspěšnost, > 3 l aspirováno – bez úspěchu) [2, 4]. V randomizované studii Noppen zjistil, že aspirace má podobné výsledky a úspěšnost jako terapie hrudních drenáží (59 % vs. 63 %) [5]. V případě, že aspirace by nevedla k úspěšné terapii a rozvinutí plíce. Henry doporučuje opakovat aspiraci hlavně tam, kde neúspěch aspirace byl na podkladě zalomeného nebo nesprávně zavedeného aspiračního katétru [2]. V případě, že PSP je větší než 30 mm, Baumann doporučuje zavedení hrudního drénu [6]. Z naší studie vyplynulo, že v 69 % bylo nejčastějším léčebným postupem u PSP o velikosti 30 mm zavedení hrudního drénu.
Mezi možné komplikace zavádění hrudních drénů patří poškození plíce, srdce, jater nebo sleziny [7]. Bald publikoval pozorování, kdy při terapii PSP byla 3 % hrudních drénů zavedena extrapleurálně a 6 % drénů poškodilo plicní parenchym [8]. V případě podezření na tuto komplikaci je vhodné zvážit CT vyšetření k verifikaci lokalizace hrudního drénu. Infekce je další možnou komplikací v souvislosti s hrudní drenáží. Incidence empyému v souvislosti s hrudní drenáží je kolem 0,5–1 % [9]. Tomu lze předejít dodržováním aseptických kautel při zavádění hrudního drénu. I to je jeden z důvodů, proč dáváme na naší klinice přednost zavedení hrudního drénu na operačním sále. Olgac neprokázal přínos profylaktického používání antibiotik při hrudní drenáži [10].
Jsou rozdílné názory, jestli po zavedení hrudního drénu zvolit spádovou drenáž nebo aktivní sání [2, 7, 11–14]. Henry doporučuje ponechat hrudní drén po zavedení jen pod hladinou tekutiny a v případě, že nedojde k rozvinutí plíce po 24–48 hodinách, zvolit aktivní sání [2]. Aktivní sání, aplikované hned po zavedení drénu, může v závislosti od velikosti kolapsu plíce vést k reexpanzivnímu plicnímu edému [15, 16]. To je pravděpodobně způsobeno zvýšenou permeabilitou kapilár poškozených bez kolapsu plíce. Incidence reexpanzivního edému je častější u větších pneumotoraxů a u mladších pacientů [16].
Mezi lékaři jsou rozdíly v managementu o hrudní drény. To se týká také uzavřením hrudního drénu před jeho odstraněním. V případě úniku vzduchu, uzavřením hrudního drénu může dojít k rozvoji života ohrožujícího tenzního pneumotoraxu. Podle studie Baumanna skoro 55 % lékařů nikdy neuzavírá hrudní drén před jeho odstraněním ke zjištění přítomnosti úniku vzduchu [1]. Uzavírání drénu není všeobecně doporučováno hlavně z bezpečnostních důvodů. Je to akceptovatelné v situacích, kdy pacienti zůstávají pod lékařskou kontrolou a v případě potíží pacienta drenáž znovu zprůchodní [2].
Skoro 62 % lékařů provádí rentgenový snímek plic 5–12 hodin po skončení úniku vzduchu a před odstraněním drénu k verifikaci rozvinutí plíce [1]. V naší studii by celkem 96 % lékařů provedlo rentgenový snímek hrudníku před odstraněním drénu a 86 % po jeho odstranění. Palesty nepovažuje skiagram hrudníku po odstranění za nutný, ale měl by být proveden až na základě klinického vyšetření pacienta. To sníží jak ekonomické náklady, tak ušetří pacienta radiační expozice [17].
Mnoho autorů se liší i v tom, jakým způsobem odstraňovat hrudní drén [1, 7, 14, 18]. Odstranění hrudního drénu doporučuje Miller na konci expíria a při použití Valsalvova manévru [7]. Deslautiers provádí odstranění hrudního drénu na konci inspíria [14]. Jejich předpoklad je založen na skutečnosti, že odstranění drénu je spojeno s náhlou bolestivostí a pacienti mají tendenci se nadechnout a tím se náhle zvýší podtlak v pleurální dutině. Tím se zvýší i riziko, že dojde k aspiraci vzduchu do pleurální dutiny. Na naší klinice odstraňujeme drén na konci expíria a za použití Valsalvova manévru. Bell ve studii 102 pacientů nepozoroval rozdíl v recidivě pneumotoraxu při odstranění drénu na konci expíria (recidiva v 6 %) nebo na konci inspíria (recidiva v 8 %) [18].
Relativní vysoká recidiva PSP (16–52 %) vedla rozvoj různých terapeutických procedur k jeho snížení. Tyto postupy kombinují různý rozsah pleurodézy jak chemické, tak mechanické s resekcí části plicního parenchymu [1, 2, 11, 19–22]. Většina pacientů s první atakou PSP nemá recidivu, proto tyto postupy v případě první ataky PSP nejsou indikované. V otázce prevence dalších recidiv PSP jsou diskutované dva torakoskopické léčebné postupy: terapie patologických změn podobných plicnímu emfyzému (emphysema-like changes ELC), provedení pleurodézy, nebo kombinace obou postupů. Jedním zmožných příčin PSP je ruptura jedné nebo více ELC (blebs, bula), které jsou velice často lokalizované ve vrcholu plicního parenchymu. Incidence ELC je kolem 75–90 %, ale zůstává otázkou, jestli právě tyto změny ELC jsou místem úniku vzduchu [11]. Relativní vysoká recidiva PSP (15–20 %) po odstranění blebs nebo bul samotných klade otázku, zda místo úniku vzduchu může být mimo odstraněné ELC [12,23]. V současné době se za metodu volby v případě nenalezeného zdroje úniku vzduchu nebo ELC v plicním parenchymu pokládá staplerová resekce apexu plíce s apikální pleurektomií, kdy po kombinaci těchto výkonů se udává recidiva PSP 0–6 % [24, 25]. Pleurodéza bez resekčního výkonu na plicním parenchymu má recidivu v případě apikální pleurektomie v 6–9 %, v případě mechanické abraze kolem 10 % [11, 19].
Naše práce poukazuje na variace v terapii primárního spontánního pneumotoraxu, a to jak mezi chirurgy a pneumology, tak mezi všeobecnými a hrudními chirurgy. Limitací naší studie je počet lékařů oslovených a taky počet odpovědí na náš dotazník. Primáře oddělení pneumologie a všeobecné chirurgie jsme považovali za reprezentující osobu strategie jak terapie, tak managementu drénů na pracovištích, které vedou. Naše práce odpovídá na otázky, jaké metody jsou k terapii PSP používané, jaký je management starostlivosti o drény. Důležité jsou jistě také výsledky zvolených léčebných postupů, délka hospitalizace pacienta, incidence rekurence PSP po chirurgickém výkonu pro PSP a další. Pro odpověď na tyto otázku by bylo vhodné provést prospektivní interinstitucionální studii.
MUDr. A. J. Stolz, Ph.D., MBA
III. chirurgická klinika FN Motol
V Úvalu 84
150 00 Praha 5
Zdroje
1. Baumann, M. H., Stran, C., Heffner, J. E., Light, R., Kirby, T. J., Klein, J., Luketich, J. D., Panacek, E. A., Sahn, S. A. Management of spontaneous pneumothorax: an American College of Chest Physicians Delphi consensus statement. Chest, 2001, 119, s. 590–602.
2. Henry, M., Arnold, T., Harvey, J. BTS guidelines for the management of spontaneous pneumothorax. Thorax, 2003, 58, s. 39–52.
3. Rhea, J. T, DeLuca, S. A., Greene, R. E. Determining the size of pneumothorax in the upright patient. Radiology, 1982, 144, s. 733–736.
4. Ng, A. W. K., Chan, K. W., Lee, S. K. Simple aspiration of pneumothorax. Singapore Med. J., 1994, 35, s. 50–52.
5. Noppen, M., Alexander, P., Driesen, P., Slabbynck, H., Verstraeten, A. Manual aspiration versus chest tube drainage in first episodes of primary spontaneous pneumothorax: a multicenter, prospective, randomized pilot study. Am. J. Respir. Crit. Care Med., 2002, 165, s. 1240–1244.
6. Baumann, M. H. What size chest tube? What drainage systém is ideal? And other chest tube management questions. Curr. Opin. Pulm. Med., 2003, 9, s. 276–281.
7. Miller, K. S., Sahn, S. A. Chest tubes. Indications, technique, management and complications. Chest, 1987, 91, s. 258–264.
8. Baldt, M. M., Bankier, A. A., Germann, P. S., Poschl, G. P., Skrbensky, G. T., Herold, C. J. Complications after emergency tube thoracostomy: assessment with CT. Radiology, 1995, 195, s. 539–543.
9. Chan, L., Reilly, K. M., Henderson, C., Kahn, F., Salluzzo, R. F. Complication rates of tube thoracostomy. Am. J. Emerg. Med., 1997, 15, s. 368–370.
10. Olgac, G., Aydogmus, U., Mulazimoglu, L., Kutlu, C. A. Antibiotics are not needed during tube thoracostomy for spontaneous pneurnothorax: an observational case study. J. Cardiothorac. Surg., 2006, 13, s. 43–47.
11. Tschopp, J. M., Rami-Porta, R., Noppen, M., Astoul, P. Management of spontaneous pneumothorax: state of the art. Eur. Respir. J., 2006, 28, s. 637–650.
12. Noppen, M., Baumann, M. H. Pathogenesis and treatment of primary spontaneous pneumothorax: an overview. Respiration, 2003, 70, s. 431–438.
13. Baumann, M. H., Strange, C. The clinician‘s perspective on pneumothorax management. Chest, 1997, 112, s. 822–828.
14. Gregoire, J., Deslautiers, J. Closed drainage and suction systems. In: Pearson, F. G., Deslautiers, J., Hiebert, C. A., Ginsberg, R. T., McKineally, M. F., Urschel, H. C. Thoracic surgery. Philadelphia: Churchill Livingstone, 1995, s. 1121–1135.
15. Sherman, S. C. Reexpansion pulmonary edema: a case report and review of the current literature. J. Emerg. Med., 2003, 24, s. 23–27.
16. Matsuura, Y., Nomimura, T., Murakami, H., Matsushima, T., Kakehashi, M., Kajihara, H. Clinical analysis of reexpansion pulmonary edema. Chest, 1991, 100, s. 1562–1566.
17. Bell, R. L., Ovadia, P., Abdullah, F., Spector, S., Abinovici, R. Chest tube removal: end-inspiration or end-expiration? J. Trauma, 2001, 50, s. 674–677.
18. Palesty, J. A., McKelvey, A., Dudrick, S. J. The efficacy of X-rays after chest tube removal. Am. J. Surg., 2000, 179, s. 13–16.
19. Gossot, D., Galetta, D., Stern, J. B., Debrosse, D., Caliandro, R., Girard, P., Grunenwald, D. Results of thoracoscopic pleural abrasion for primary spontaneous pneumothorax. Surg. Endosc., 2004, 18, s. 466–471.
20. Lang-Lazdunski, L., Chapuis, O., Bonnet, P. M., Pons, F., Jancovici, R. Videothoracoscopic bleb excision and pleural abrasion for the treatment of primary spontaneous pneumothorax: long-term results. Ann. Thorac. Surg., 2003, 75, s. 960–965.
21. Ben-Nun, A., Soudack, M., Best, L. A. Video-assisted thoracoscopic surgery for recurrent spontaneous pneumothorax: the long-term benefit. World J. Surg., 2006, 30, s. 285–290.
22. Vodička, J., Špidlen, V. Spontánní pneumotorax. Čas. Lek. Čes., 2006, 145, s. 611–615.
23. Korner, H., Andersen, K. S., Stangeland, L., Ellingsen, I., Engedal, H. Surgical treatment of spontaneous pneumothorax by wedge resection without pleurodesis or pleurectomy. Eur. J. Cardiothorac. Surg., 1996, 10, s. 656–659.
24. Czerny, M., Salat, A., Fleck, T., Hofmann, W., Zimpfer, D., Eckerberger, F., Klepetko, W., Wolker, W., Mueller, M. R. Lung wedge resection improves outcome in stage I primary spontaneous pneumotorax. Ann. Thorac. Surg., 2004, 77, s. 1802–1805.
25. Zisic, C., Stratakos, G. Do we know the ideal surgical treatment for primary spontaneous pneumotorax? Eur. J. Cardiothorac. Surg., 2006, 29, s. 1067–1068.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Duální transplantace ledvinČlánek Recenze
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2008 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Kolorektální karcinom jako příčina náhlých příhod břišních
- Diagnostika střevní ischemie. Vliv operačního výkonu na plazmatické hladiny I-FABP jako specifického ukazatele poškození enterocytů
- Pooperační nutriční podpora v chirurgii jater. Účinek specializované parenterální výživy obohacené o rozvětvené aminokyseliny po resekci jater pro metastázy kolorektálního karcinomu
- Implementace skórovacího systému POSSUM pro objektivizaci morbidity laparoskopických operací kolorekta
- Umíme ocenit zkušenosti svých učitelů?
- K-ras mutace u kolorektálního karcinomu jako prognostický faktor vývoje onemocnění
- Periampulární gangliocytický paragangliom
- Nové možnosti v léčbě poúrazových defektů kloubní chrupavky
- Polytrauma u zraněných starších 65 let
- Variace léčby primárního spontánního pneumotoraxu
- Duální transplantace ledvin
- Recenze
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nové možnosti v léčbě poúrazových defektů kloubní chrupavky
- Diagnostika střevní ischemie. Vliv operačního výkonu na plazmatické hladiny I-FABP jako specifického ukazatele poškození enterocytů
- K-ras mutace u kolorektálního karcinomu jako prognostický faktor vývoje onemocnění
- Variace léčby primárního spontánního pneumotoraxu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



