-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Role intersticiální brachyterapie v multimodalitní léčbě solidních tumorů
The Role of Interstitial Brachytherapy in Multimodality Management of Solid Tumors
Although being used for several decades, interstitial brachytherapy remains a modern radiotherapeutic method. Over the time, it has been highly improved, including the latest technologies. Its broad use has been facilitaed by the use of high dose rate (HDR) afterloadings. The method is fast and fairly inexpensive. Its prons include, in particular, a possibility to apply a dose, in addition to external radiotherapy, directly into the tumor region or its focus, which may improve treatment success rates in patients with localized tumors.
The commonest diagnoses, where interstitial brachytherapy is employed, include the following: breast carcinomas, soft tissue sarcomas, head and neck tumors, gynaecological tumors, penile and anal tumors and prostate tumors.
In the article, the authors aimed to highlight potential and benefits of intersitital brachytherapy in individaual diagnoses. Only multidisciplinary management of these patients may improve their prognosis or quality of life.Key words:
interstitial brachytherapy – HDR brachytherapy
Autoři: R. Soumarová 1; L. Homola 1; H. Perková 1; S. Czudek 2; M. Škrovina 2; L. Adamčík 2
Působiště autorů: Onkologické centrum J. G. Mendela, Nový Jičín, primář: MUDr. R. Soumarová, Ph. D. 1; Chirurgické oddělení, Nemocnice Nový Jičín, primář: MUDr. S. Czudek, CSc. 2
Vyšlo v časopise: Rozhl. Chir., 2007, roč. 86, č. 10, s. 533-539.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Intersticiální brachyterapie patří mezi moderní radioterapeutické metody i přesto, že se používá již několik desetiletí. Za tu dobu se prudce rozvinula a využívá nejmodernějších technologií. Její širší uplatnění se uskutečnilo zejména díky využívání afterloadingů s vysokým dávkovým příkonem (HDR). Jedná se o metoda rychlou a relativně levnou. Její přínos spočívá zejména v možnosti doplnit dávku se zevní radioterapie do oblasti nádoru nebo jeho ložiska a zvýšit tak pravděpodobnost vyléčení pacienta s lokalizovaným nádorovým onemocněním.
Mezi nejčastější diagnózy, u kterých se intersticiální brachyterapie využívá patří nádory prsu, sarkomy měkkých tkání, nádory hlavy a krku, gynekologické tumory, nádory penisu, anu a nádory prostaty.
V přehledném článku se snažíme poukázat na možnosti a přínos intersticiální brachyterapie u jednotlivých diagnóz. Pouze v případě multidisciplinárního přístupu k těmto nemocným lze zlepšit jejich prognózu nebo kvalitu života.Klíčová slova:
intersticiální brachyterapie – HDR brachyterapieÚVOD
Moderní radioterapie tvoří nedílnou součást léčby zhoubných nádorů. Indikuje se v léčbě kurativní, kde je účinná až u dvou třetin nemocných s lokálním či lokoregionálním postižením zhoubným nádorem v době diagnózy, dále v léčbě adjuvantní, kdy doplňuje chirurgický výkon a též v léčbě paliativní, při níž přispívá zejména ke zlepšení kvality života nevyléčitelně nemocných pacientů.
Radioterapie je rozdělována podle řady kritérií. Základní dvě formy radioterapie se rozlišují v závislosti na vzdálenosti zdroje záření od pacienta: teleterapie neboli transkutánní radioterapie či zevní radioterapie, a na brachyterapii neboli vnitřní radioterapii.
Intratumorální aplikace se prováděly již v roce 1904, při nichž se malé skleněné tuby v tenkostěnných stříbrných nebo zlatých pouzdrech po incizi zaváděly do nádoru [1, 2]. Pro léčbu se převážně využívalo radium, a proto se vžil název radiumterapie. Kromě radonu a radia se pro účely intersticiální brachyterapie postupně začaly využívat kobaltové jehly [3], tantalové drátky [4, 5] a posléze i drátky iridiové [6].
V padesátých letech minulého století byly zpřísněny požadavky na radiační bezpečnost, což následně vedlo k zúžení indikací brachyterapie. K renesanci však opět došlo v letech sedmdesátých, kdy byly uměle vyrobené radioizotopy (Cs, Co, I, Au) z radiohygienického hlediska bezpečnější, a začala se používat technika afterloadingu, tedy dodatečného zavádění zdrojů do aplikátoru. Nejprve se začal uplatňovat manuální afterloading, tedy přemístění zdroje z kontejneru nebo trezoru ručně, v letech osmdesátých se již rozšířil automatický afterloading, kdy se přesun zdroje do aplikátoru prováděl mechanicky. Automatický afterloading umožnil další snížení radiační zátěže personálu a zlepšení dávkové distribuce v cílovém objemu.
V současné době se intersticiální brachyterapie uplatňuje zejména v kombinaci s orgán zachovávajícími resekčními výkony. Její hlavní předností je možnost zvýšit dávku uvnitř cílového objemu a maximální šetření okolní zdravé tkáně.
Intersticiální brachyterapie může být indikována jako:
- – Primární radikální léčba. Je vhodná pro malé, dobře lokalizované nádory s minimálním rizikem šíření do regionálních lymfatických uzlin.
- – Boost k zevní radioterapii. Aplikace může být provedena buďto v průběhu primárního operačního výkonu do oblasti lůžka nádoru (např. po parciální mastektomii), nebo bez odstranění nádoru přímo do tumoru (např. karcinom prostaty apod.). Výkon je většinou prováděn v celkové, případně spinální anestezii.
- – Opakované ozáření. Po předchozí radikální radioterapii, při kontraindikaci operačního výkonu, je v některých případech jedinou možností léčby provedení reiradiace. Možnosti zevní radioterapie mohou být již vyčerpány rizikem překročení tolerance okolních zdravých tkání, například míchy. Rychlý pokles dávky do okolí umožňuje použít intersticiální brachyterapii i při metastázách v krčních uzlinách.
Intersticiální brachyterapie je indikována většinou jako doplnění (boost) k zevní radioterapii.
Indikace intersticiální brachyterapie jsou uvedeny v tabulce (Tab. 1).
INTERSTICIÁLNÍ BRACHYTERAPIE KARCINOMU PRSU
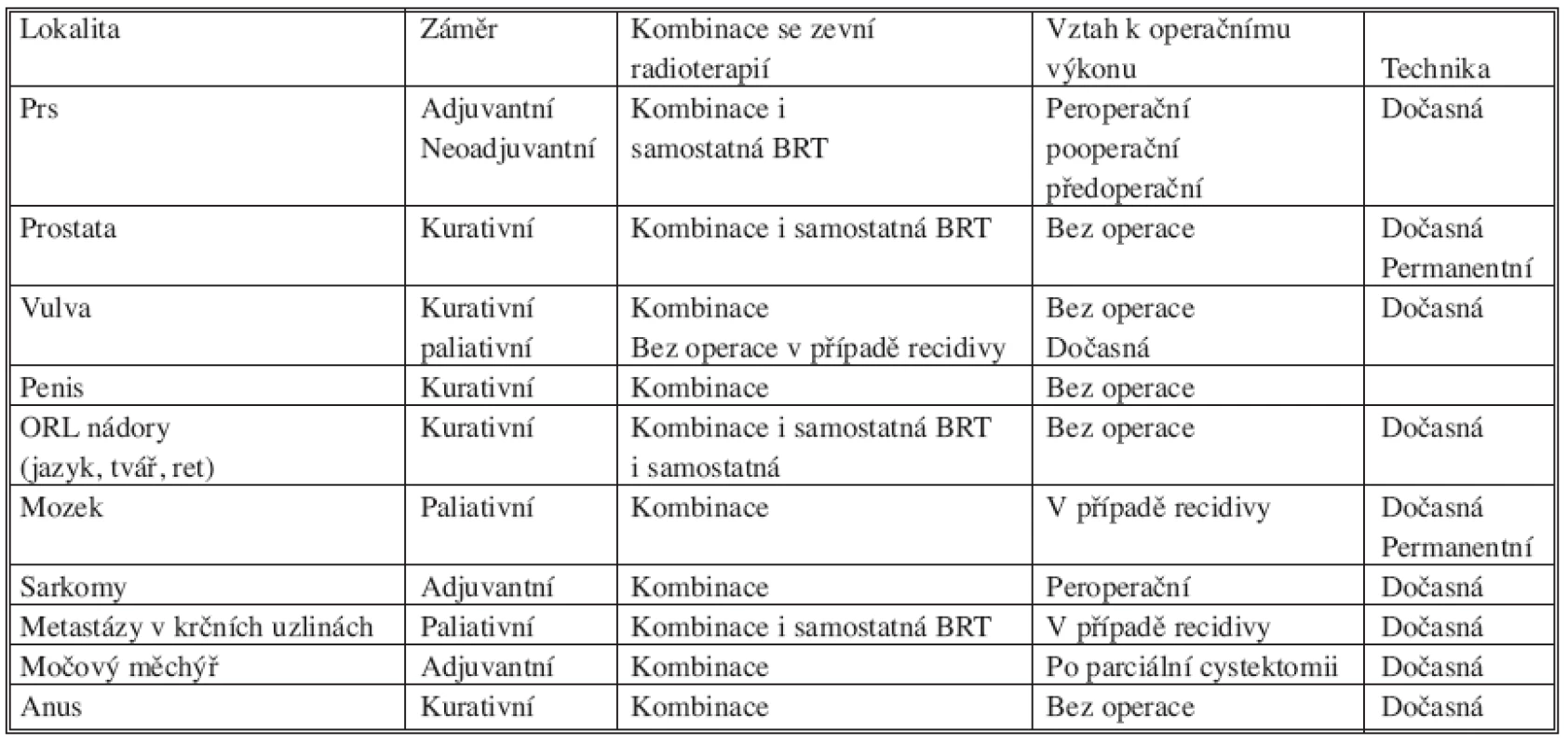
Operační řešení nádorů prsu je nejstarším léčebným postupem a v minulosti bylo často jedinou terapeutickou možností. Management chirurgické léčby nádorů prsu se vyvíjel od původně velmi mutilujících Haldstetových operací přes modifikované radikální mastektomie až po částečné (parciální), prs zachovávající výkony s případným vyšetřením sentinelových lymfatických uzlin. Nedílnou součástí konzervativního přístupu se tedy stala pooperační – adjuvantní radioterapie, která má za úkol sterilizovat subklinické onemocnění zůstávající v prsu, eventuálně v lymfatických uzlinách, po chirurgickém výkonu. V současné době se za standardní adjuvantní radioterapii považuje ozáření celého prsu (se svodnou nebo bez svodné lymfatické oblasti), a to technikou dvou tangenciálních polí v dávce 50 Gy v 25 frakcích (2 Gy/frakce/den). Samozřejmostí by mělo být použití moderních ozařovačů (lineárních urychlovačů) a trojrozměrného plánování. Zlepšení lokální kontroly onemocnění je dosahováno doozářením lůžka nádoru (boostem na lůžko nádoru), k čemuž můžeme použít metodu intersticiální brachyterapie (Obr. 1). Intersticiální boost se provádí pomocí můstku – templatu, s jasně definovaným geometrickým rozložením jehel.
Obr. 1. Provedení intersticiální brachyterapie lůžka tumoru po parciální mastektomii pomocí jehel a můstku Fig. 1. Interstitial brachytherapy procedure of a tumor focus after partial mastectomy, using needles and a bridge 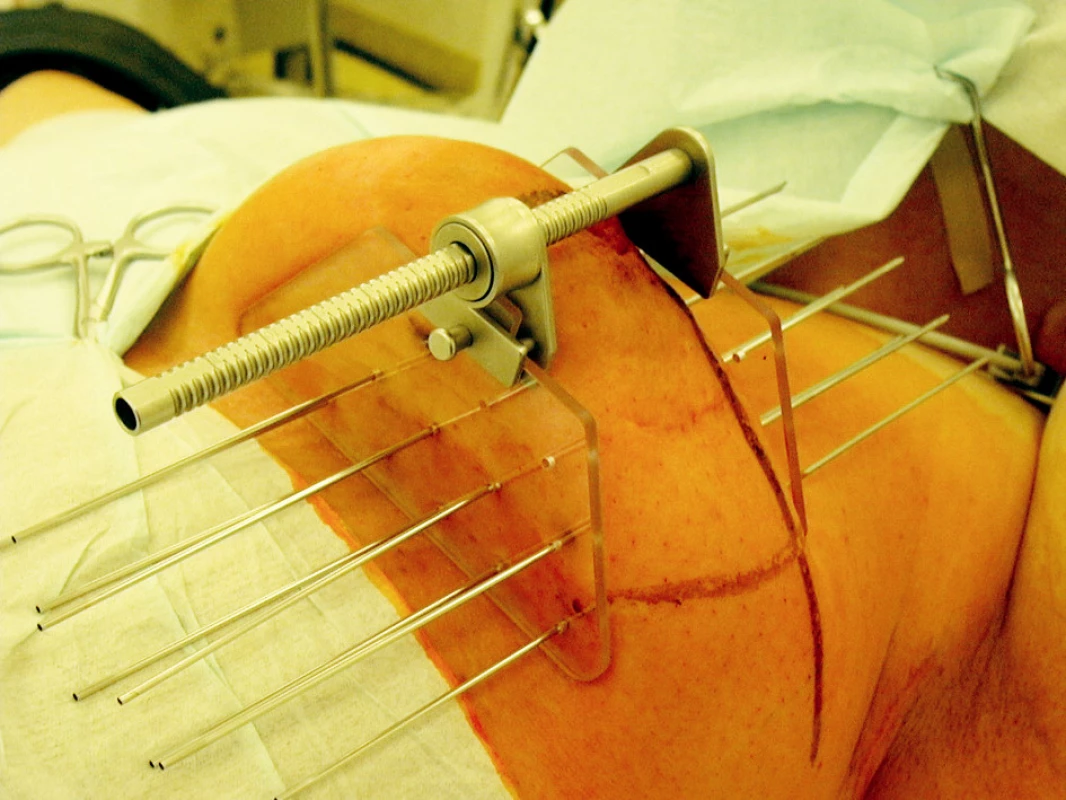
Koncept zrychleného částečného ozáření prsu – accelerated partial breast irradiation (APBI), vychází ze současných dat o nálezu lokálních recidiv v operovaném prsu. Řada prací potvrzuje, že lokální recidiva se objevuje ve většině případů (60–80 %) v původním lůžku nádoru [7, 8]. Pouze nemnohé však uvádí, že recidiva mimo původní lůžko nádoru se vyskytuje v 1,5–3,5 % případů. Tato četnost je podobná u skupiny žen s parciálním chirurgickým výkonem, jak s následnou radioterapií, tak i bez radioterapie [9, 10]. Tento fakt podporuje nezbytnost ozáření pouze lůžka nádoru u vybrané skupiny pacientek. Můžeme použít opět zavedení jehel po operaci nebo umístění plastikových vodičů během operačního výkonu (Obr. 2).
Obr. 2. Provedení peroperační intersticiální brachyterapie lůžka tumoru pomocí plastikových vodičů Fig. 2. Peroperative interstitial brachytherapy of a tumor focus using plastic leaders 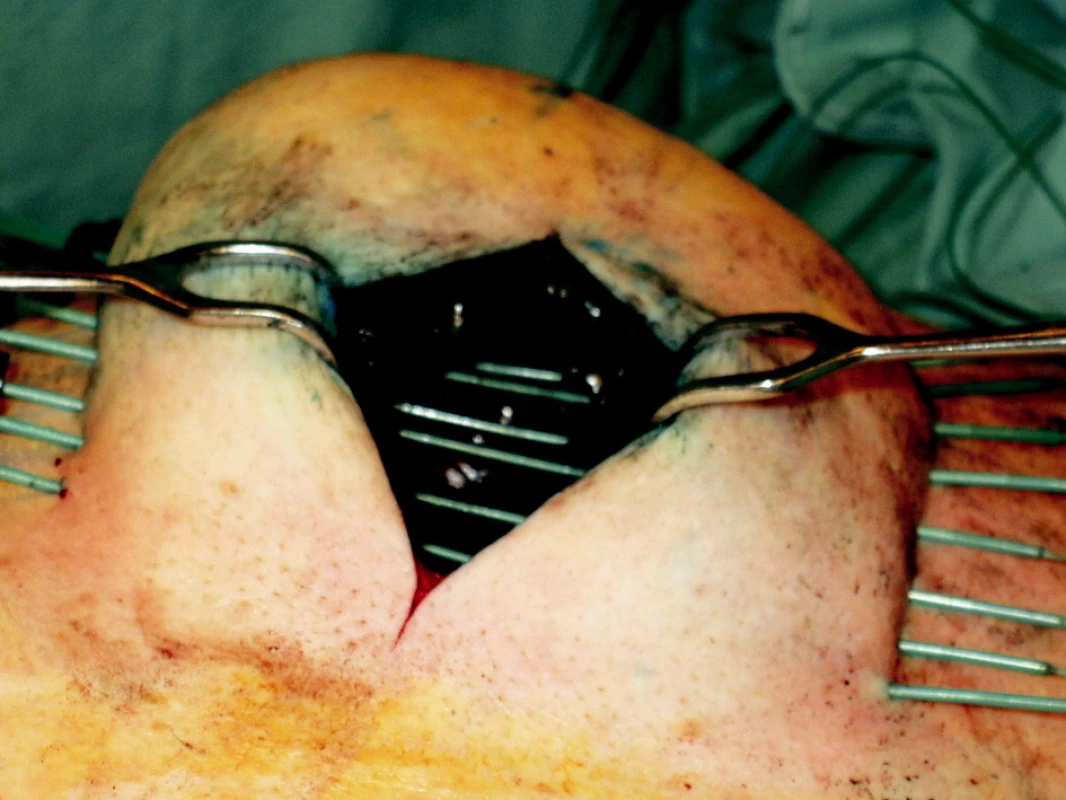
INTERSTICIÁLNÍ BRACHYTERAPIE NÁDORŮ HLAVY A KRKU
Léčba nádorů hlavy a krku je komplexní, přičemž součástí je nejen chirurgie hlavy a krku, ale i plastická a rekonstrukční chirurgie, radiační a klinická onkologie, nutriční podpora, rehabilitace, patologie, radiodiagnostika, léčba bolesti a podpůrná terapie.
Multimodální přístup se uplatňuje v různém sledu radioterapie, chemoterapie a radikálního chirurgického výkonu. Ten je často velmi mutilující a může být v některých případech nahrazen kurativní radioterapií. V rozhodovacím algoritmu hraje důležitou roli lokalizace a rozsah nádoru, celkový stav pacienta, preference pacienta, zkušenost operatéra, dostupnost radioterapie a kvalita života.
Brachyterapie se v léčbě nádorů hlavy a krku používala od začátku dvacátého století. Odborná literatura zahrnuje desítky prací, které se zabývají brachyterapií nádorů hlavy a krku, při níž se využívají rozličné techniky, různé zdroje záření, různorodé aktivity a nestejné dávkové příkony. Celá řada publikovaných prací prokázala výborné výsledky samostatné brachyterapie nebo v kombinaci se zevní radioterapií v lokální kontrole nádorů předních dvou třetin jazyka [11–19]. Nádory větší než 40 mm jsou spíše vhodnější pro chirurgické řešení s následnou radioterapií, ačkoliv u starších osob nebo u pacientů s interkurencemi, eventuálně při preferenci konzervativního výkonu je možná i kombinace zevní radioterapie a brachyterapie.
Nádory spodiny dutiny ústní jsou vhodné pro provedení samostatné brachyterapie, jestliže nejsou větší než 30 mm a pokud se nešíří v těsné blízkosti mandibuly [20].
Brachyterapie je vynikající metodou u více než 90 % nádorů rtu. Její jednoznačnou výhodou je dobrý až excelentní kosmetický efekt v 80–95 % případů [21]. Pouze u velmi malých superficiálních nádorů (do 5 mm) se provádí klínovitá excize. Oproti tomu u velkých nádorů nad 50 mm je indikována zevní radioterapie v kombinaci s brachyterapií nebo rekonstrukční chirurgický výkon, který je preferován i u nádorů invadujících do kosti.
Standardní léčbou recidivujících nádorů je chirurgická léčba, která je často spojena s vysokou morbiditou. Brachyterapie může být výhodnou alternativou zejména u pacientů po předchozím ozáření (Obr. 3, 4).
Obr. 3. Intersticiální brachyterapie u pacienta s nádorem horního rtu Fig. 3. Interstitial brachytherapy in a patient with an upper lip tumor 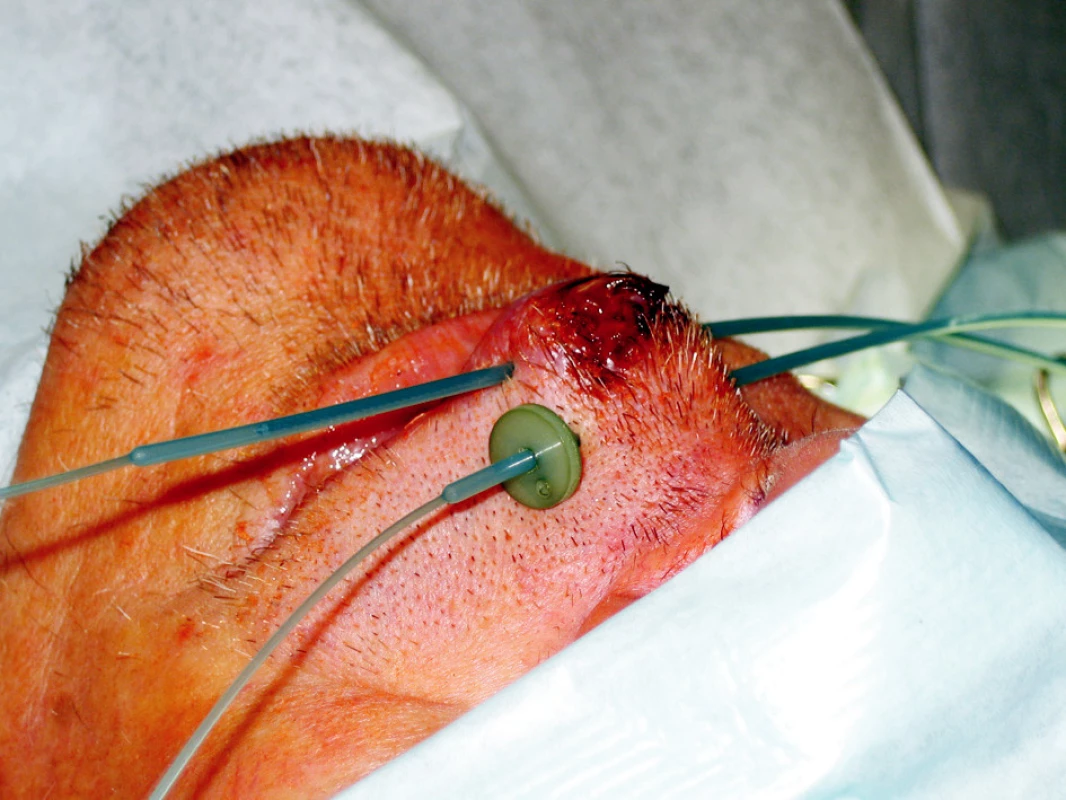
Obr. 4. Efekt léčby po 5 měsících sledování Fig. 4. Treatment outcomes after a 5-month follow up period 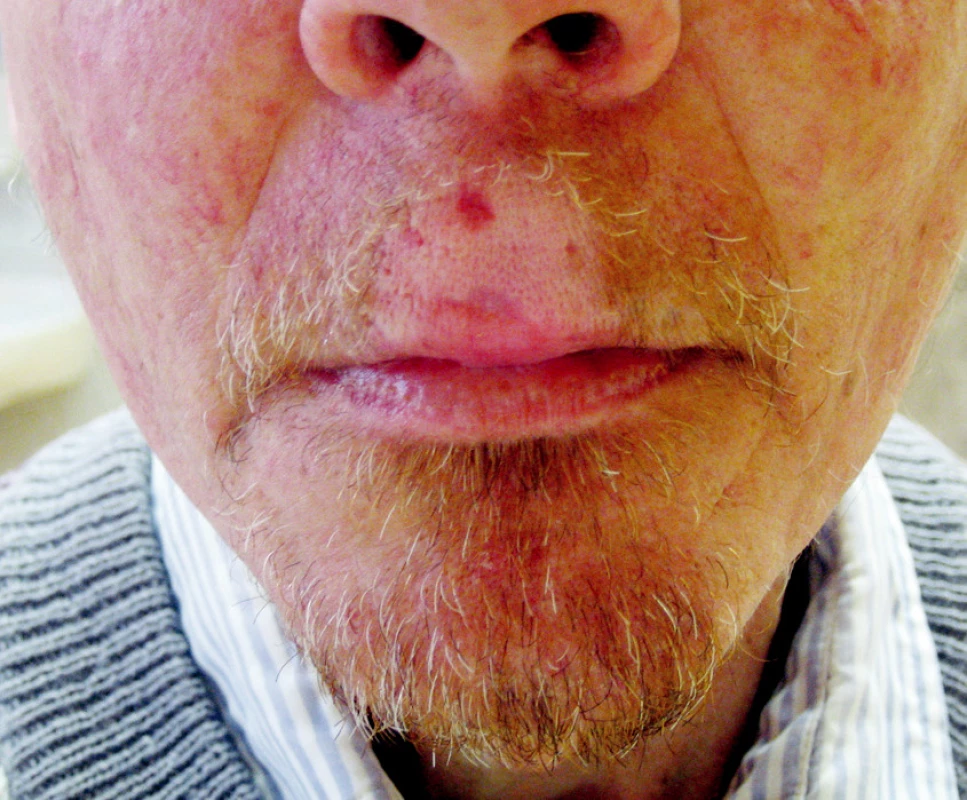
INTERSTICIÁLNÍ BRACHYTERAPIE SARKOMŮ MĚKKÝCH TKÁNÍ KONČETIN
Amputace byla dlouhou dobu standardní léčbou sarkomů měkkých tkání končetin, sice s dobrou lokální kontrolou onemocnění, avšak se špatnou kvalitou života. Od šedesátých let minulého století byla provedena řada odborných prací týkajících se předoperační nebo pooperační radioterapie a konzervativního chirurgického výkonu [22–28]. Na jejich základě je v současné době u sarkomů měkkých tkání jednoznačně prokázáno, že kompletní resekce a adjuvantní radioterapie zlepšují lokální kontrolu onemocnění bez vlivu na celkové přežití.
Využívá se kombinace zevní radioterapie a brachyterapie. Důvodem pro spojení zevní radioterapie s brachyterapií je velikost ozařovaného objemu. Brachyterapie nezaručuje v tomto případě dávkovou homogenitu a zevní radioterapie kompenzuje toto nerovnoměrné rozložení dávky. Léčba intersticiální brachyterapií může být zahájena v relativně krátkém časovém odstupu od operace na rozdíl od zevní radioterapie, která může začít teprve až po zahojení resekční rány, tzn. za 2–3 týdny. Používá se technika plastových trubiček zavedených peroperačně do lůžka nádoru (Obr. 5).
Obr. 5. Peroperační intersticiální brachyterapie sarkomu měkkých tkání Fig. 5. Peroperative interstitial brachytherapy of a soft tissue sarcoma 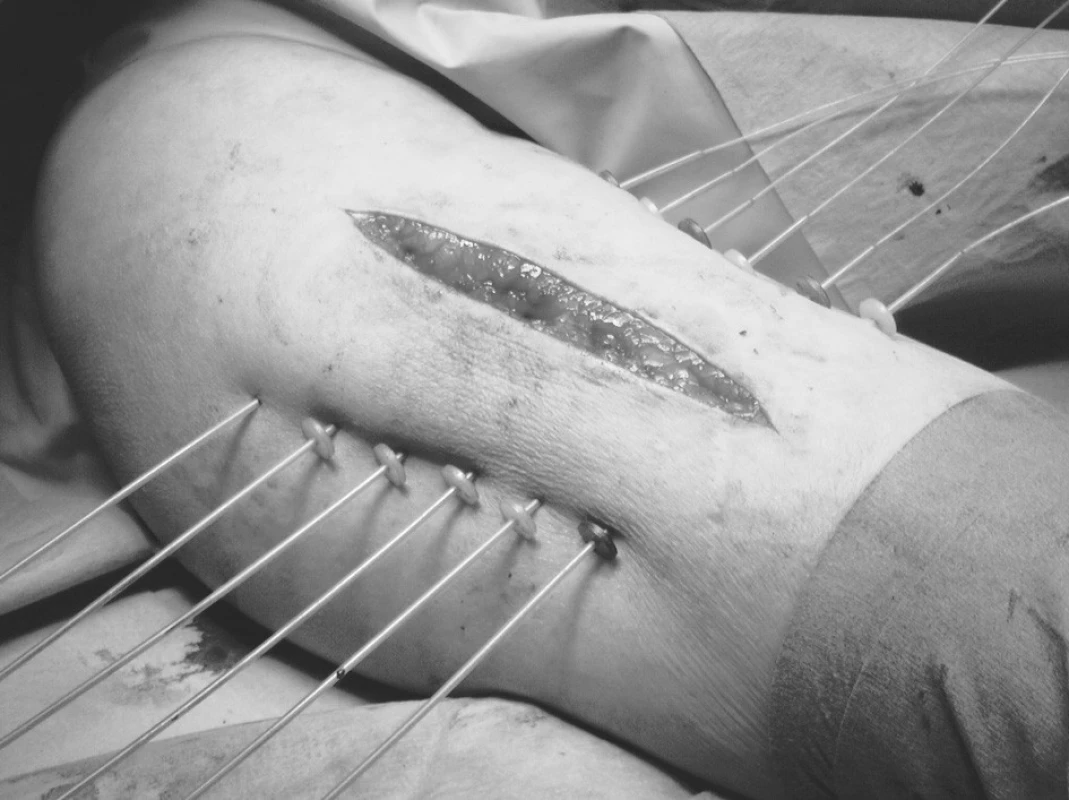
U recidivujících onemocnění je indikována maximálně možná resekce s následnou brachyterapií se zevní nebo bez zevní radioterapie. Reiradiace zevním svazkem není doporučována z důvodu očekávané velké morbidity. Brachyterapie může být použita i pokud je nezbytné provést plastiku kůže.
INTERSTICIÁLNÍ BRACHYTERAPIE KARCINOMU PENISU
Nádory penisu tvoří přibližně 1 % maligních onemocnění u mužů. Chirurgické výkony představují efektivní možnost léčby karcinomu penisu, avšak znamenají provedení parciální nebo totální penektomie včetně všech funkčních a psychosociálních důsledků.
Názory na indikace různých léčebných modalit: brachyterapie formou muláže, intersticiální brachyterapie nebo zevní radioterapie [29, 30], zevní radioterapie v kombinaci s bleomycinem [31], parciální nebo radikální penektomie [32, 33], se často liší. Je to způsobeno nejen relativně nízkou incidencí onemocnění (1 % všech nádorů u mužů) a malými soubory pacientů, ale též různými časovými obdobími a i odlišnými názory na strategii léčby v jednom zdravotnickém zařízení. Žádná randomizovaná studie srovnávající jednotlivé metody však prozatím neexistuje.
Indikací pro samostatnou brachyterapii jsou tumory do velikosti 40 mm lokalizované na glans penis, které nepřesahují sulcus coronarius [34, 35]. Před zahájením léčby by měl pacient podstoupit cirkumcizi, která nejenže umožňuje optimální stanovení rozsahu nádoru a cílového objemu, ale zároveň též snižuje poradiační komplikace.
Při intersticiální brachyterapii jsou v celkové anestezii přímo do tumoru zaváděny paralelně v geometrickém vztahu jehly (Obr. 6).
Obr. 6. Intersticiální brachyterapie karcinomu penisu Fig. 6. Interstitial brachytherapy of a penis carcinoma 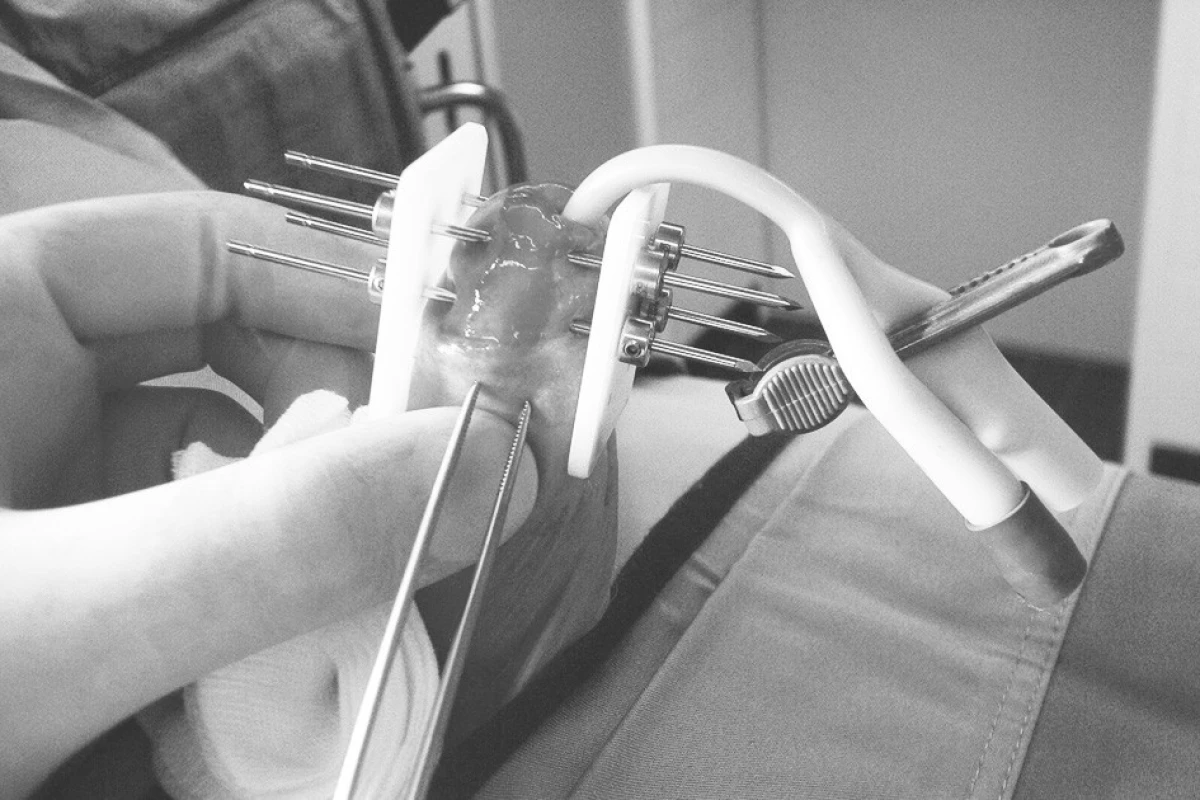
Téměř vešekerá publikovaná literatura o brachyterapii karcinomu penisu se týká léčby s nízkým dávkovým příkonem. Do studií zabývajících se low dose rate brachyterapií karcinomu penisu bylo zahrnuto více než 500 pacientů, z nichž 80 % mělo stadium T1 nebo T2. Lokální kontroly bylo dosaženo v 80–85 % případů, s pětiletým bezpříznakovým přežitím v rozmezí 70–75 %. Postradiační komplikace byly pozorovány asi u 20–30 % pacientů [36–41].
INTERSTICIÁLNÍ BRACHYTERAPIE KARCINOMU ANU
V minulosti bylo jediným kurativním řešením provedení abdominoperineální resekce s trvalou kolostomií, a to se všemi psychosociálními důsledky. V současné době se amputace rekta doporučuje pouze pro recidivující nebo perzistující onemocnění.
Jako léčba volby je dnes používána konkomitantní radiochemoterapie a to buď zevní radioterapie nebo v kombinaci s brachyterapií.
Lokální kontroly onemocnění s použitím intersticiálního boostu je dosaženo v 80–90 %, procento vážných komplikací vyžadujících provedení kolostomie nepřesahuje 5 % [42].
K nejvýznamnějším prediktivním faktorům úspěšnosti léčby patří dosažení dávky radioterapie ve stanovené frakcionaci a celková doba terapie. Interval mezi zevní radioterapií a brachyterapií kratší než 6 týdnů a celková doba léčby kratší než 12 týdnů jsou spojeny s lepší lokální kontrolou onemocnění [43]. Výhodou brachyterapie však může být pokrytí cílového objemu požadovanou dávkou, a to nejen za kratší dobu, ale bez ozáření okolních zdravých tkání.
INTERSTICIÁLNÍ BRACHYTERAPIE KARCINOMU VULVY
Radikální chirurgický výkon byl dlouho považován za standardní léčbu nádorů vulvy I., II. a III. klinického stadia [44, 45]. Teprve až v posledních dvaceti letech se radikalita chirurgického výkonu začala snižovat, především se záměrem zmírnit nejen psychosociální důsledky tohoto zákroku, ale i s tím spojenou pooperační morbiditou [46, 47].
I přes to, že radiosenzitivitu spinocelulárních karcinomů vulvy je možné přirovnat k radiosenzitivitě kožních nádorů, konkrétní uplatnění radioterapie zde bylo dlouho opomíjeno, a to především z důvodů vysokého procenta lokálních relapsů a zejména i značně vysoké akutní a pozdní toxicity [48, 49]. Mezi faktory k tomu přispívajícími patřil věk a celkový stav pacientek, dále radiosenzitivita okolních struktur zejména perineální a tříselné oblasti, i nízká energie záření a též suboptimální frakcionace. Výsledky radioterapie nádorů vulvy se zlepšily teprve se zavedením megavoltážní terapie a s používáním intersticiální brachyterapie [50, 51].
Hlavní přínos brachyterapie spočívá v možnosti eskalace dávky, jejímž výsledkem je dobrá lokální kontrola, ačkoliv přežití je limitováno regionální a vzdálenou diseminací [52].
Intersticiální brachyterapie se využívá i u recidivujících karcinomů v oblasti vulvy [53, 54], avšak na prvním místě se u recidivujícího onemocnění doporučuje chirurgický výkon.
K hlavním indikacím v současné době patří lokálně pokročilé onemocnění k doozáření (boost) reziduálního tumoru po konkomitantní chemoradioterapii nebo po samostatné radioterapii a inoperabilní recidiva onemocnění po primární radioterapii nebo chemoradioterapii.
Uplatňuje se technika „free hand“ technika pomocí plastikových trubiček.
ZÁVĚR
Prudký rozvoj intersticiální brachyterapie v posledních letech ovlivnily zejména čtyři technologické změny: počítačově prováděná kalkulace dávkové distribuce, její optimalizace pomocí úpravy polohy a času zdroje, využívání trojrozměrného zobrazení i navigované zavádění aplikátorů.
Počty pacientů léčených touto metodu prudce rostou, což je způsobeno zejména rostoucím zájmem o intersticiální brachyterapii karcinomu prostaty, ale i v řadě jiných diagnóz se intersticiální brachyterapie uplatňuje ve větší míře. Důvodem je možnost zvýšení dávky v nádorovém ložisku a tím zvýšení pravděpodobnosti vyléčení nemocného, kvalitnější technické vybavení (automatické afterloadingy) i interdisciplinární spolupráce mezi řadou oborů podílejících se na péči o onkologicky nemocné.
MUDr. R. Soumarová, Ph.D.
Onkologické centrum J. G. Mendela
Purkyňova 2138/16
741 01 Nový Jičín
e-mail: renata.soumarova@radioterapie.cz
Zdroje
1. Abbe, R. Notes on the physiologic and therapeutic action of radium. Wash. Med. Ann., 2 : 363–377, 1904.
2. Dominici, H., Barcat, J. L‘action thérapeutique du radium sur les néoplasies. Arch. Elect. Méd., 16 : 655–663, 1908.
3. Sahatchiev, A., Krov, S., Tcheretchanski, P., Moushmov, M. Résultats de la curiethérapie interstitielle du cancer de la vessie. Ann. Radiol., 14 : 643–648; 1971.
4. Wallace, D. M., Stapleton, J. E., Turner, R. C. Radioactive tantalum wire implantation as a method of treatment for early carcinoma of the bladder. Br. J. Radiol., 25 : 421–424; 1952.
5. Williams, G. B., Trott, P. A., Bloom, H. Carcinoma of the bladder treated by interstitial irradiation. Br. J. Urol. 53 : 221–224, 1981.
6. Pizzi, G. B., Calzavara, F., Cauzzo, C., Zorat, P. L. Endocuriethérapie du cancer de la vessie. Proposition d’une nouvelle technique par fils de 192 Iridium en tubes de Cyponil. J. Radiol., 60 : 715–718, 1979.
7. Fisher, E. R., Digram, J., Tan-Chiu, E., et al. Pathologic findings from the National Surgical Adjuvant Breast Project (NSABP) eight-year update of protocol B-17. Cancer, 86 : 429–438, 1999.
8. Holli, K., Saaristo, R., Idoly, J., et al. Lumpectomy with or without postoperative for breast cancer with favourable prognostic features: results of a randomized study. Br. J. Cancer, 84 : 164–169, 2001.
9. Douglas, W. A., Vicini, F. A., Kuske, R. R., et al. Accelerated partial breast irradiation: an update report from the American Brachytherapy Society. Brachytherapy, 2 : 124–130, 2003.
10. Kuske, R. R. Interstitial brachytherapy for breast cancer: technical issues and avoiding pitfalls. Radiother. Oncol., 71 (suppl. 2, abstr. 61): 31, 2004.
11. Akine, Y., et al. Stage I–II carcinoma of the anterior two-thirds of the tongue treated with different modalities: a retrospective analysis of 244 patients. Radiother. Oncol., 21 : 24–28, 1991.
12. Benk, V., Mazeron, J. J., Grimard, J., et al. Comparison of curietherapy versus external irradiation combined with curie-therapy in stage II squamous cell carcinomas of the mobile tongue. Radiother. Oncol., 18 : 229–247, 1990.
13. Bolla, M., Elbaze, D., Barthelme,, et al. Exclusive irradiation of carcinomas of the oral tongue and floor of mouth. Results about 457 cases. J. Eur. Radiother., 4 : 64–73, 1983.
14. Fujita, M., Hirokawa, Y., Kashiwado, K., et al. Interstitial brachytherapy for stage I and II squamous cell carcinoma of the oral tongue: factors influencing local control and soft tissue complications. Int. J. Radiat. Oncol. Biol. Phys., 44 : 767–775, 1999.
15. Gerbaulet, A., Haie-Meder, C., Marsiglia, H., et al. Role of brachytherapy in the treatment of Head & Neck cancer. Selectron Brachy. J., 3 : 15–20, 1992.
16. Lefebvre, J. L., Coche-Dequeant, B., Buisset, E., et al. Management of early oral cavity cancer. Experience of Centre Oscar Lambret. Eur. J. Cancer, 30B: 216–220, 1994.
17. Pernot, M., Malissard, L., Hoffstetter, S. The study of tumoral, radiobiological and general health factors that influence results and complications in a series of 448 oral tongue carcinomas treated exclusively by irradiation. Int. J. Radiat. Oncol. Biol. Phys., 29 : 673–679, 1994.
18. Yamazaki, H., Inoue, T., Yoshida, K., et al. Brachytherapy for early oral tongue cancer: low dose rate to high dose rate. J. Radiat. Res. (Tokyo), 44 (1): 37–40, 2003.
19. Inoue, T., Inoue, T., Yoshida, K., et al. Phase III trial of high - vs. low-dose-rate interstitial radiotherapy for early mobile tongue cancer. Int. J. Radiat. Oncol. Biol. Phys., 51 (1): 171–175, 2001.
20. Gerbaulet, A., Mazeron, J. J., Ash, D. Floor of Mouth Cancer. In: Gerbaulet, A., Potter, R., Mazeron, J. J., et al. The GEC ESTRO handbook of brachytherapy. ACCO, Leuven, Belgium, 253–264, 2002.
21. Gerbaulet, A., van Limbergen, E. Lip Cancer. In: Gerbaulet, A., Potter, R., Mazeron, J. J., et al. The GEC ESTRO handbook of brachytherapy. ACCO, Leuven, Belgium, 227–236, 2002.
22. Coucke, P. A., Guillemin, C. L., Mirimanoff, R. O. The role of radiotherapy in the treatment of soft tissue sarcoma. Bull. Cancer Radiother., 80 : 13–26, 1993.
23. Marcus, S. J., Merino, M. J., Glatstein, E., et al. Long term outcome in 87 patients with low grade soft tissue sarcoma. Arch. Surg., 128 : 1336–1343, 1993.
24. Rosenblatt, E., Meushar, N., Eidelman, M., et al. Low dose-rate interstitial brachytherapy in soft tissue sarcomas. Sarcoma, 3 : 101–105, 1999.
25. Schray, M., Gunderson, L., Sim, F., et al. Soft tissue sarcoma – integration of brachytherapy, resection and external irradiation. Cancer, 66 : 451–456, 1990.
26. Shiu, M., Hilaris, B., Harrison, L., et al. Brachytherapy and function saving resection of soft tissue sarcoma arising in the limb. Int. J. Radiat. Oncol. Biol. Phys., 21 : 1485–1492, 1991.
27. Suit, H., Mankin, H., Wood, W., et al. Preoperative, intraoperative and postoperative radiation in the treatment of primary soft tissue sarcoma. Cancer, 55 : 2659–2667, 1985.
28. Yang, J. C., Chang, A. E., Baker, A. R., et al. Randomized prospective study of the benefit of adjuvant radiation therapy in the treatment of soft tissue sarcomas of the extremity. J. Clin. Oncol., 16 (1): 197–203, 1998.
29. El-Denthy, M., Olivek, R., Hope-Stone, H., Blandy, J. Reappraisal of the role of radiotherapy and surgery in the management of carcinoma of the penis. Br. J. Urol., 56 : 724–728, 1984.
30. Neave, F., Neal, A., Hoskin, P., Hope-Stone, H. Carcinoma of the penis: a retrospective review of treatment with iridium mould and external beam irradiation. Clin. Oncol., 5 : 207–210, 1993.
31. Haile, K., Delclos, L. The place of radiation therapy in the treatment of carcinoma of the distal end of the penis. Cancer, 45 : 1980–1984, 1980.
32. Fraley, E., Zhang, G., Saxama, R., Lange, P. Cancer of the penis. Prognosis and treatment plans. Cancer, 55 : 1618–1624, 1985.
33. Narayana, A., Olney, L., Loening, S., et al. Carcinoma of the penis. Analysis of 219 cases. Cancer, 49 : 2185–2191, 1982.
34. Gerbaulet, A., Lambin, P. Radiation therapy of cancer of the penis: indications, advantages and pitfalls. In: Crawford, D. E., Das, S. (eds) Penile, urethral, and scrotal cancer. The Urologic Clinics of North America. Philadelphia: W.B. Saunders, 325–332, 1992.
35. Mazeron, J. J., Langlois, D., Lobo, P. A., et al. Interstitial radiation therapy for carcinoma of the penis using iridium 192 wires: the Henri Mondor experience (1970–1979). Int. J. Radiat. Oncol. Biol. Phys., 10 : 1891–1895, 1984.
36. Akimoto, T., Mitsuhashi, Takahashi, I., et al. Brachytherapy for penile cancer using silicon mould. Oncology, 54 : 23–27, 1997.
37. Chaudhary, A. J., Ghosh, S., Bhalavat, R. L., et al. Interstitial brachytherapy in carcinoma of the penis. Strahlenther Oncol., 175 : 17–20, 1999.
38. Delannes, M., Malavaud, V., Douchez, J., et al. Iridium-192 interstitial radiation therapy for squamous cell carcinoma of the penis. Int. J. Radiat. Oncol. Biol. Phys., 10 : 1891–1895, 1984.
39. Guedea, F., Craven-Bartle, J., Caeles, J., et al. Interstitial radiotherapy using iridium 192 wires for carcinoma of the penis. Bull. Cancer Radiother., 78 : 141–147, 1991.
40. Kanfir, K., Haie-Meder, C., Albano, M., et al. Outcome of patients treated with exclusive brachytherapy for carcinoma of the penis: the IGR experience. Radiother. Oncol., 55 (suppl 1, abstr. 36): 25, 2000.
41. Kiltie, A. E., Elwell, C., Close, H. J., Ash, D. V. Iridium-192 implantation for node-negative carcinoma of the penis: the Cookridge Hospital experience. Clin. Oncol., 12 : 25–31, 2000.
42. Mazeron, J. J., Limbergen E. Anorectal cancer. In: The GEC ESTRO Handbook of Brachytherapy, A Gerbaulet, R Potter, JJ Mazeron, H Meertens, E Limbergen eds., ACCO, Leuven, Belgium, 2002, 505–514.
43. Berger, C., Felix-Faure, C., Chauvet, B., at al. Conservative treatment of anal canal carcinoma with external radiotherapy and interstitial brachytherapy, with or without chemotherapy: long term results. Cancer Radiother., 3 (6): 461–467, 1999.
44. Jacobson, G. Evolving concepts in the management of carcinoma of the vulva. In: Tobias, J., Thomas, P. Current Radiation Oncology, Arnold, 1998, 219–239.
45. Hacker, N. F., Eifel, P., McGuire, W. P., Wilkinson, E. J. Vulva. In: Hoskins, W. J., Perez, C. A., Young, R. C., edit. Principles and practice of gynecologic oncology. Philadelphia: Lippincott; 1992, 537–566.
46. Kelley, J. L., Burke, T. W., Tornos, C., Morris, M., Gershenson, D. M., Silva, E. G., Wharton, J. T. Minimally invasive vulvar carcinoma: an indication for conservative surgical therapy. Gynecol. Oncol., 44 : 240–244, 1992.
47. Stehman, F. B., Bundy, B. N., Dvoretsky, P. M., Creasman, W. T. Early Stage I carcinoma of the vulva treated with ipsilateral superficial inguinal lymphadenectomy and modified radical hemivulvectomy: a prospective study of the Gynecologic Oncology Group. Obstet Gynecol., 79 : 490–497, 1992.
48. Backstrom, A., Edsmyr, F., Wicklund, H. Radiotherapy of carcinoma of the vulva. Acta Obstet Gynecol. Scand., 51 : 109–115, 1972.
49. Berven, E. G. E. Carcinoma of the vulva. Br. J. Radiol., 22 : 498, 1949.
50. Daly, J. W., Million, R. R. Radical vulvectomy combined with elective node irradiation for TxN0 squamous carcinoma of the vulva. Cancer, 34 : 161–165, 1974.
51. Frischbier, H. J., Thomsen, K. Treatment of cancer of the vulva with high-energy electrons. Am. J. Obstet. Gynecol., 111 : 431–435, 1971.
52. Seeger, A. R., Windschall, A., Lotter, M., et al. The role of interstitial brachytherapy in the treatment of vaginal and vulvar malignancies. Strahlenther Onkol., 182 (3): 142–148, 2006.
53. Prempree, T., Amornmarn, R. Radiation treatment of recurrent carcinoma of the vulva. Cancer, 54 : 1943–1949, 1984.
54. Hoffman, M., Greenberg, S., Greenberg, H., et al. Interstitial radiotherapy for the treatment of advanced or recurrent vulvar and distal vaginal malignancy. Am. J. Obstet. Gynecol., 162 : 1278–1282, 1990.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2007 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Endovaskulární léčba stenóz karotických tepen s použitím cerebrální protekce: pětileté zkušenosti
- Léčba infekce cévní protézy a aorto-enterické píštěle jako pozdní komplikace rekonstrukčního výkonu na abdominální aortě – kazuistika
- Biliárny ileus – zriedkavá komplikácia cholecystolitiázy
- Role intersticiální brachyterapie v multimodalitní léčbě solidních tumorů
- Chirurgická léčba karcinomu prsu v MOÚ
- Nádorová kmenová buňka – nový pohled v onkologii?
- Nový přístup k léčbě jaterních metastáz: manuálně asistovaná laparoskopická radiofrekvenční resekce jater
- Autofluorescenčná videotorakoskopia – prvé vlastné skúsenosti
- Interdisciplinární přístup k řešení mnohočetných tepenných aneuryzmat u pacienta s osmou recidivou incizionální kýly – kazuistika
- Zemřel prof. MUDr. Jiří Bartoš, DrSc.
- Otevřený dopis vedoucímu redaktorovi Rozhledu v chirurgii, prof. MUDr. Miloši Hájkovi, DrSc.
- Otevřený dopis
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Biliárny ileus – zriedkavá komplikácia cholecystolitiázy
- Chirurgická léčba karcinomu prsu v MOÚ
- Zemřel prof. MUDr. Jiří Bartoš, DrSc.
- Endovaskulární léčba stenóz karotických tepen s použitím cerebrální protekce: pětileté zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání