-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nádorová kmenová buňka – nový pohled v onkologii?
Tumorous Stem Cells – A Novel View in Oncology?
Authors present contemporary knowledges, arguments and hypothesis about cancer STEM cells and their relations to current concepts of oncology and surgical oncology. The aim is to introduce new view of carcinogenesis and origin of metastatical process as a diseas of STEM cells to general surgical public that deal with surgical oncology and is confronted with new trends in modern oncological pharmacology. The presented theory of tumour origin by cancer STEM cells is confronted critically with all current theories.
Key words:
cancer STEM cell – embryonal STEM cell – adult STEM cell – cancerogenesis – metastatical process – surgical oncology
Autoři: V. Liška 1; V. Třeška 1; M. Korabečná 2
Působiště autorů: Chirurgická klinika, FN Plzeň-Lochotín, LF UK v Plzni, přednosta: prof. MUDr. V. Třeška, DrSc. 1; Biologický ústav, LF UK Plzeň, přednosta: doc. RNDr. J. Reischig, CSc. 2
Vyšlo v časopise: Rozhl. Chir., 2007, roč. 86, č. 10, s. 548-552.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Autoři prezentují současné znalosti, důkazy a hypotézy o nádorové kmenové buňce a jejím vztahu k současné koncepci onkologie a tedy i onkochirurgie. Cílem předkládané publikace je seznámit širokou chirurgickou veřejnost, která se denně zabývá onkologickou léčbou a střetává se i s novými trendy v moderní onkologické farmakologii s novým pohledem na karcinogenezi a vznik metastatického procesu jako na chorobu kmenových buněk. Prezentovaná teorie vzniku tumoru v součinosti s tumorózními kmenovými buňkami je kriticky konfrontována se stávajícími teoriemi.
Klíčová slova:
nádorová kmenová buňka – embryonální kmenová buňka – adultní kmenová buňka – kancerogeneze – metastatický proces – onkochirurgieÚVOD
Kmenové buňky jsou charakterizovány svou schopností sebeobnovy a současně vysokým diferenciačním potenciálem, který jim dává možnost obnovovat alespoň v omezené míře veškeré tkáně lidského těla. Kmenové buňky lze pro naši potřebu rozdělit na embryonální a adultní. Embryonální kmenové buňky jsou odvozeny z blastocysty a lze říci, že jejich úkolem je vytvořit jednotlivé tkáně a orgány, čímž zodpovídají za konečnou podobu lidského embrya. Mají tedy velmi vysokou schopnost tvořit de novo. Opačným případem jsou adultní kmenové buňky, které mají svou diferenciací doplňovat jednotlivé tkáně. Nepředpokládá se u nich, a lze říci, že je nežádoucí, schopnost tvořit nové ještě neexistující tkáně. Byla prokázána existence kmenových buněk hematopoietických, neurálních, gastrointestinálních, jaterních a mezenchymálních. Nalézají se v jednotlivých tkáních a jsou zodpovědné za reparaci poškozené tkáně. Tyto buňky jsou mechanismy kontaktní inhibice udržovány v klidovém stavu, za normálních okolností proliferují vzácně. Tato proliferace adultních kmenových buněk slouží k jejich udržení v příslušné tkáni a vzniku progenitorových buněk, které dále diferencují v typy potřebné pro reparaci dané tkáně [1, 2, 3]. V novém modelu procesu karcinogeneze, který se začíná prosazovat a bude popsán v následujícím textu, hrají adultní kmenové buňky a jejich transformace na kmenové buňky nádoru hlavní roli.
NÁDOROVÁ KMENOVÁ BUŇKA
Současné znalosti tumorigeneze, na nichž je založena současná koncepce onkologické léčby, předpokládají postupnou transformaci normálních buněk v nádorové buňky. V tomto mnohostupňovém procesu dochází k postupné akumulaci mutací a epigenetických změn, které vyústí ve změnu fenotypu a genotypu nádorové buňky. Tato ztrácí také schopnost přijímat regulační podněty ze svého okolí a naopak je charakterizována tvorbou autostimulačních faktorů, které urychlují její proliferační aktivitu. Kde se však bere tato u normální diferencované tkáňové buňky ztracená schopnost proliferace? Jak vysvětlit, že částečně změněná prekancerózní tkáň nezaniká a má již schopnost sebeobnovy? Například tak velmi častá prekanceróza jako adenomatóza tračníku. Klasická slizniční buňka má velmi omezenou životnost a než by stihla nashromáždit všechny potřebné a vyjmenované změny dávno zaniká a odpadá do lumen střeva. Jak je tedy možné, že právě zde vzniká u nás nejčastější adenokarcinom gastrointestinálního traktu? Je až neuvěřitelné, co vše není schopná současná čtyřicet let všeobecně přijímaná koncepce kancerogeneze vysvětlit.
V důsledku těchto otázek si několik vědců položilo otázku, zda neexistuje nádorová kmenová buňka, která právě tuto proliferační aktivitu zajišťuje? Vyšli z velmi jednoduchého předpokladu, že nádorová masa je vlastně také „de facto“ tkáň se svými jistými pravidly a vztahy. Dokonce se chová jako „nový“ orgán. Má své vlastní cévní zásobení, mezi nádorovými buňkami nalézáme množství pojiva a dokonce se svým okolím, tedy zdravými tkáněmi, komunikuje. A jako každá adultní tkáň má svou kmenovou buňku ke svému doplňování, tak i nádorová tkáň potřebuje svou kmenovou buňku. Tuto hypotézu podporuje i vysoká schopnost nádorové tkáně k překotné expanzi. Dokonce se dá přímo i dokázat, že ne každá buňka tumoru se dále dělí. To znamená, že by zde měly být buňky kmenové určené jak k sebeobnově tak k diferenciaci v tumorozní buňky, které se již dále nedělí a tvoří vlastní masu tumoru. Dokonce lze předpokládat, že v tumoru neexistuje jen jeden klon nádorových kmenových buněk, ale několik subpopulací, které mají i různou heterogenitu s ohledem na různou proliferační schopnost a následnou diferenciaci [4]. V následujícím sdělení se pokusíme shrnout současné znalosti, důkazy a hypotézy o nádorové kmenové buňce a její vztah k současné koncepci onkologie a tedy i onkochirurgie.
NÁDOROVÁ TRANSFORMACE
V roce 2001 byla v časopise Nature publikována zásadní práce [1] ohlašující změnu pohledu na proces karcinogeneze a připisující hlavní roli v tomto procesu transformaci adultních kmenových buněk. Na tomto základě stojí i práce Haury a kolektivu [5], která předkládá koncepci nádorové transformace ve spojení s poznatky současné onkologie o etiologii a patogenezi nádoru. Doplňuje je o nové poznatky z výzkumu kmenových buněk vzniklé v posledních deseti letech. Vše dokladuje na vzniku plicního karcinomu a jeho diseminace [5]. Předpokládá, že opakované toxické či zánětlivé inzulty plicního epitelu vyvolávají chronickou zánětlivou odpověď v daném místě. Trvalé „nedohojení“ postiženého místa, které není schopna realizovat regenerační kapacita dané tkáně, stimuluje buďto kmenové buňky dané tkáně či kmenové buňky původem z kostní dřeně tedy hematopoietické či mezenchymové. Ty do tohoto místa vcestují a zde mají za úkol obnovit původní kontinuitu postiženého epitelu. Jejich proliferační potenciál jim umožňuje podstatně vyšší kapacitu k dokončení regenerace tkáně a to ať již mechanismem stimulace lokálních kmenových buněk (progenitorů) či vlastní diferenciací ve tkáň, která defekt vyplní. Bohužel chronicky inzultovaný epitel zřejmě obsahuje již epitelové buňky či progenitory transformované, s vysokým množstvím fenotypových a genotypových změn, které mají narušenou regulaci a mezibuněčnou komunikaci právě v důsledku vystupňované chronické stimulace. Tyto transformované prekancerotické buňky splývají s příchozími kmenovými buňkami [6]. Tato fúze má vytvořit buňku čistě nádorovou, která má pozměněnou zpětnovazebnou regulaci a mezibuněčnou komunikaci a není tedy přístupná růstovým inhibičním podnětům, které zajišťují integritu orgánu a celého organismu. Současně tato buňka vykazuje i vlastnosti kmenových buněk a to vysokou mitotickou aktivitu a schopnost vycestovat z jedné tkáně a naopak se infiltrovat do tkáně druhé, tedy vlastnosti vysoce pokročilé malignity s metastatickým procesem. Teorii fúze podporuje i analýza vlastností hepatocelulárního karcinomu, která zaznamenává vysoký výskyt mnohojaderných buněk s imunohistochemickými znaky kmenových buněk z kostní dřeně [7]. Rizvi prokázal fúzi transplantovaných kmenových buněk kostní dřeně s normálními ale i transformovanými kmenovými buňkami tenkého střeva. Tyto zjevně neoplastické fúzované buňky však v daném experimentu nevyvolaly vznik tumoru [8]. Proliferace buňky vzniklé fúzí poskytuje široké možnosti pro vznik aneuploidních karyotypů. Duesberg et al. přináší důkazy, že nikoliv genové mutace, ale aneuploidie karyotypu předznamenávají proces karcinogeneze [9]. Liu kmenové buňky z kostní dřeně nejen transformoval in vitro, ale dokázal vyvolat vznik teratomů po jejich transplantaci in vivo [10].
Lze též předpokládat účast kmenových buněk z kostní dřeně při angiogenezi či spíše neovaskulogenezi v nádorové tkáni [6]. A to buďto přímo vlastní diferenciací v tkáně novotvořených cévních struktur či tvorbou růstových faktorů stimulujících angiogenezi například Vascular Endothelial Growth Factor (VEGF) [11]. Význam kmenových buněk kostní dřeně je též spojován se vznikem nádorového stromatu či lymfangiogeneze [12].
Jinou teorií je možnost přímé transformace zdravé kmenové buňky za blíže nespecifikovaných podmínek v nádorovou kmenovou buňku. Rubio docílil při dlouhodobé in vitro kultivaci mezenchymových kmenových buněk jejich maligní transformaci [13].
Obrázek 1 porovnává teorii karcinogeneze založenou na akumulaci mutací a epigenetických změn v diferencované buňce s nově nastupujícím paradigmatem nádorové biologie, které již zohledňuje existenci kmenových buněk a jejich význam pro vznik tumorů. Toto nové paradigma odvozuje vznik maligních tumorů od adultních kmenových buněk, které se vymkly tkáňové kontrole, množí se, nediferencují nebo jen omezeně a mají uchovánu schopnost migrace. Benigní tumory pak vznikají z již více diferencovaných potomků těchto progenitorových buněk [2, 3]. Nová teorie nevylučuje úlohu mutací, pouze mění pohled na typ buněk, které jsou jimi zasaženy. Transformačním agens přetvářejícím adultní kmenovou buňku v kmenovou buňku nádoru by mohly být jak mutace, tak epigenetické změny postihující signální dráhy, či výše zmiňovaná fúze buněk.
Obr. 1. Porovnání dvou modelů karcinogeneze Původní teorie předpokládá nahromadění kritických mutací v jediné diferencované buňce. Důsledkem těchto mutací a epigenetických dějů je nádorová transformace a dediferenciace dané buňky, která dává vzniknout tumoru. Karcinogeneze vycházející z adultních kmenových buněk přítomných v každé tkáni naopak předpokládá že mutace či deregulační epigenetická změna transformuje kmenovou buňku na kmenovou buňku nádoru tak, že se tato stává základem buněčné populace tvořící tumor (volně podle Takana, 2007 a Woodwardové 2005). Fig. 1. Comparison of two carcinogenesis models The former theory hypothesised concentration of critical mutations within a single differentiated cell. These mutations and epigenetic actions are then expected to result in tumorous transformation and dedifferentiation of the cell, from which a tumor would originate. Contrary to that, carcinogenesis based on adult stem cells present in any tissue, supposes that a mutation or a deregulation epigenetic change would transform a stem cell into a tumorous stem cell , which then would give rise to a cell population, forming a tumor. (according to Takan, 2007 and Woodward, 2005). 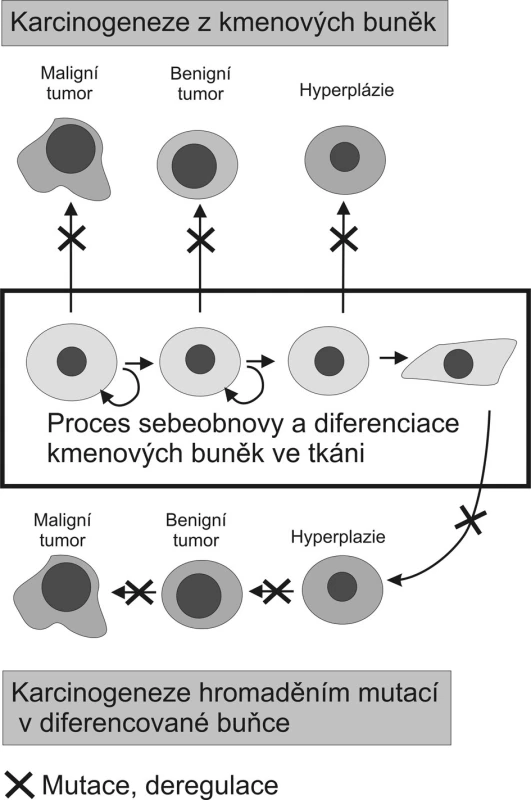
Zde dochází k těsnému sblížení nádorové a vývojové biologie. Pro rozpoznání klíčových změn vedoucích k nádorové transformaci bude potřeba plně pochopit děje určující chování kmenových buněk. Precizní pochopení diferenciačních mechanismů v jednotlivých tkáních se zdá být v této souvislosti nutnou podmínkou pro pochopení specifik jejich karcinogeneze. Ukazuje se, že nádorové kmenové buňky mají deregulovány některé signální dráhy, které fungují u normálních adultních kmenových buněk [14]. Z této oblasti lze očekávat metodiky nutné k determinaci kmenových buněk v nádoru, což, jak bude dále ukázáno, může mít zásadní význam pro nádorovou terapii.
VZNIK METASTÁZ
Ještě zajímavější je přístup k vysvětlení vzniku metastatického procesu. Metastazovat může jen nádorová kmenová buňka, která má nejen schopnost se uvolnit z původní nádorové tkáně a infiltrovat jinou tkáň, ale má i dostatek proliferačního potenciálu. Proto také nelze definitivně spojovat detekci cirkulujících tumorózních buněk s výskytem metastáz či mikrometastatického procesu. Jen malý zlomek těchto buněk jsou transformované buňky kmenové, které mohou metastázu vytvořit. Výskyt cirkulujících nádorových buněk lze spojit jen s pokročilým stagingem tumoru – tedy s infiltrací cévních struktur, a tak lze zvýšenou pravděpodobnost výskytu metastatického procesu předpokládat pouze nepřímo. Vzhledem ke známým vlastnostem kmenových buněk (schopnost migrace a totipotence) je logické, že nádorové kmenové buňky mohou stát přímo za vznikem metastatického procesu. Kterou tkáň si však tato nádorová kmenová buňka vybere k infiltraci a iniciování vzniku metastázy? Je všeobecně známo, že jisté tumory mají i vysoce tkáňově specifické lokalizace svých metastáz.
Kaplanová toto vysvětluje teorií premetastatické niche. Niche je mikroprostředí, ve kterém je kmenová buňka obklopena ostatními podpůrnými buňkami (pojivo, kapiláry), které ji pomáhají regulovat vlastní proliferaci a diferenciaci [15, 16]. Dlouhodobé udržení adultních kmenových buněk v klidovém stavu je založeno právě na mechanismech buněčné adheze a interakcích s mezibuněčnou hmotou [3]. Kaplanová vysvětluje svou teorii atraktivitou niche dané tkáně pro cirkulující nádorové kmenové buňky, každá jednotlivá pro daný orgán specifická niche má svou originální molekulární strukturu. Dokonce dokazuje, že hematopoietické kmenové buňky z kostní dřeně, které mají vysokou hustotu receptorů právě pro zmiňovaný VEGF, mohou iniciovat vznik těchto niche v jednotlivých cílových orgánech [17, 18].
KLINICKÉ KORELACE
Theise s kolektivem detekoval buňky s imunohistochemickými znaky kmenových buněk ve čtyřech případech vysoce dediferencovaných hepatocelulárních karcinomů vzniklých v terénu chronické hepatitidy. Předpokládá, že se jedná o nádorové kmenové buňky [19]. Wu rozlišuje hepatální kmenovou buňku od buňky hepatocelulárního karcinomu [20]. Bhatia a Baker nezávisle analyzovali dlouhodobě sledované pacienty, kteří podstoupili transplantaci kostní dřeně pro malignitu. Sleduje výskyt solidních nádorů v tomto souboru. Prezentovaná data potvrzují zvýšené riziko výskytu solidních tumorů v této populaci. Vysvětlení může být dáno jednak deregulací nových kmenových buněk po transplantaci, ale také případně vlivem chemoterapie nebo radioterapie a dlouhodobé imunosuprese, která byla spojena s léčbou základního onemocnění [21, 22].
Pro teorii tumorové kmenové buňky svědčí i experimenty s tumorózními buňkami, kdy jen menší část použitých buněk izolovaných z tkání tumoru, byla schopna tvořit kolonie in vitro [1].
NÁDOROVÉ KMENOVÉ BUŇKY A LÉČBA
Současná konzervativní i radikální onkologická léčba solidních či hematologických malignit se potýká s vysokým výskytem recidiv základního onemocnění i přes důsledné dodržování stávajících pravidel léčby, a to i přes kombinovanou léčbu a zajištění pacienta neoadjuvantní onkologickou léčbou po radikálním odstranění nádoru. Předpokládá se, že vlastní nádorová kmenová buňka je vysoce rezistentní na jakoukoliv farmakologickou léčbu vzhledem k vysoké expresi ABC membránových transportérů zodpovědných za rezistenci těchto buněk k chemoterapii [1]. Ty jsou schopné buňku dlouhodobě očišťovat od dnes používaných chemoterapeutik. Naproti tomu chemoterapeutika nové generace jako například specifické protilátky na tyto kmenové buňky nemusí účinkovat, jelikož mají velmi eliminovanou regulaci extracelulárními podněty a proliferační stimuly jsou si schopny samy z větší části zajistit. Proto lze předpokládat, že současná onkologická léčba zpravidla uspokojivě eliminuje tumorózní masu, která je citlivá k podané léčbě, ale není schopna zcela eliminovat uvažované nádorové kmenové buňky [23]. Časný i pozdní výskyt recidivy je tak dán reaktivací nádorových kmenových buněk v celém organismu případně v referovaných premetastatických niche. Tyto mikrometastázy jsou pak zodpovědné za recidivu onemocnění.
Ačkoliv idea terapie namířené přímo proti nádorovým kmenovým buňkám je vrcholně atraktivní (Obr. 2), její uskutečnění je závislé na vývoji postupů, které dovolí tyto buňky spolehlivě rozeznat především in vivo. Řešení problému je komplikováno faktem, že nádorové kmenové buňky, i přes svoji transformaci, zůstávají v porovnání s buňkami tvořícími masu nádoru buňkami klidovými a nelze je tedy eliminovat metodami osvědčujícími se na rychle rostoucí buněčné populace.
Obr. 2. Porovnání stávající terapeutické strategie a strategie namířené proti nádorovým buňkám tumoru Strategie selektivně eliminující nádorové kmenové buňky (NKB) by sice v okamžitém efektu nevedla k omezení masy nádorových buněk, poskytla by však definitivní řešení v podobě odstranění prvotní příčiny nádorového růstu. Nádor bez svých kmenových buněk by neměl být schopen dlouhodobé existence (volně podle Woodwardové 2005). Fig. 2. Comparison of the current therapeutic strategy and the anti-tumorous cell strategy Selective elimination of the tumorous stem cell (NKB) would not immediately result in reduction of the tumorous mass, however, it would provide a definitive solution, removing the original causative factor of the tumorous growth. Any tumor with its stem cells removed, is not expected to survive in a long run. (according to Woodward, 2005). 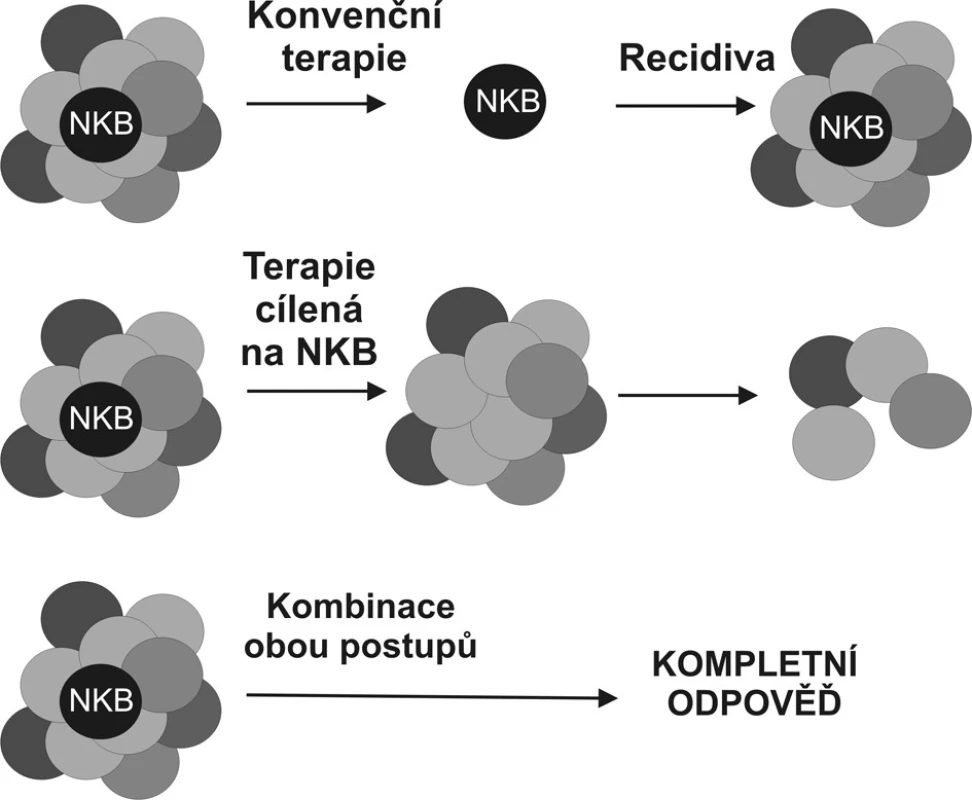
ZÁVĚR
Cílem předkládaného článku bylo seznámit širokou chirurgickou veřejnost, která se denně zabývá onkologickou léčbou a střetává se i s novými trendy v moderní onkologické farmakologii s novým pohledem na karcinogenezi a vznik metastatického procesu jako na chorobu kmenových buněk. Vše by mělo směřovat k prověření současných onkologických postupů a to jak diagnostických, tak i léčebných. V daném tématu je samozřejmě ještě více otázek než odpovědí. Je nutná další experimentální i klinická práce k objasnění dané problematiky. Prezentované téma svým charakterem přímo vybízí k diskuzi v široké vědecké i klinické obci zabývající se onkologickou problematikou.
Použité zkratky:
VEGF – Vascular Endothelial Growth Factor
NKB – nádorová kmenová buňka
Práce byla podpořena granty IGA MZ CR 8860/1-3 a IGA MZ CR 8301-3 a Výzkumným záměrem MSM 0021620819
MUDr. V. Liška
Chirurgická klinika LF UK a FN Plzeň
Alej svobody 80
304 00 Plzeň
e-mail: LiskaV@FNPlzen.cz
Zdroje
1. Reya, Morrison, S. J., Clarke, M. F., Weissman, I. L. Stem cells, cancer, and cancer stem cells. Nature, 2001, 414 : 105–111.
2. Takano, T. Fetal cell carcinogenesis of the thyroid: theory and practice. ., 2007, 17 : 233–240.
3. Woodward, W, A., Chen, M. S., Behbod, F., Rosen, J. M. J. On mammary stem cells. Cell Sci., 2005, 118 : 3585–3594.
4. Soltysova, A., Altanerova, V., Altaner, C. Cancer stem cells. Neoplasma, 2005, 52 : 435–440.
5. Haura, E. B. Is repetitive wounding and bone marrow-derived stem cell mediated-repair an etiology of lung cancer development and dissemination? Med. Hypothese, 2006, 67 : 951–956.
6. Jain, R. K., Duda, D. G. Role of bone marrow-derived cells in tumor angiogenesis and treatment. Cancer Cell, 2003, 3 : 515–516.
7. Wu, X. Z., Yu, X. H. Bone marrow cells: The source of hepatocellular carcinoma? Med. Hypothese, 2007, 69 : 36–42.
8. Rizvi, A.Z., Swain, J. R., Davies, P. S., Bailey, A. S., Decker, A. D., Willenbring, H., Grompe, M., Fleming, W. H., Wong, M. H. Bone marrow-derived cells fuse with normal and transformed intestinal stem cells. Proc. Natl. Acad. Sci. U S A, 2006, 103 : 6321–6325.
9. Duesberg, P., Li, R., Fabarius, A., Hehlmann, R. The chromosomal basis of cancer. Cellular Oncology, 2005, 27 : 293–318.
10. Liu, C., Chen, Z., Zhang, T., Lu, Y. Multiple tumor types may originate from bone marrow-derived cells. Neoplasia, 2006, 8 : 716–724.
11. Hattori, K., Heissig, B., Wu, Y., Dias, S., Tejada, R., Ferris, B., Hicklin, D.J., Zhu, Z., Bohlen, P., Witte, L., Hendrikx, J., Hackett, N.R., Crystal, R.G., Moore, M.A., Werb, Z., Lyden, D., Rafii, S. Placental growth factor reconstitutes hematopoiesis by recruiting VEGFR1(+) stem cells from bone-marrow microenvironment. Nat. Med., 2002, 8 : 8 41–849.
12. Wu, X. Z., Chen, D., Xie, G. R. Bone marrow-derived cells: roles in solid tumor. Neoplasma, 2007,54 : 1–6.
13. Rubio, D., Garcia-Castro, J., Martin, M. C., de la Fuente, R., Cigudosa, J. C., Lloyd, A. C., Bernad, A. Spontaneous human adult stem cell transformation.Cancer Res, 2005, 65 : 3035–3039.
14. Sagar, J., Chaib, B., Sales, K., Winslet, M., Seifalian, A. Role of stem cells in cancer therapy and cancer stem cells: a review. Cancer Cell Int, 2007, 7 : 9.
15. Kaplan, R. N., Psaila, B., Lyden, D. Bone marrow cells in the ‘pre-metastatic niche’: within bone and beyond. Cancer Metastasis Rev., 2006, 25 : 521–529.
16. Kaplan, R. N., Psaila, B., Lyden, D. Niche-to-niche migration of bone-marrow-derived cells. Trends Mol Med, 2007, 13 : 72–81.
17. Kaplan, R. N., Riba, R. D., Zacharoulis, S., Bramley, A. H., Vincent, L., Costa, C., MacDonald, D. D., Jin, D. K., Shido, K., Kerns, S. A., Zhu, Z., Hicklin, D., Wu, Y., Port, J. L., Altorki, N., Port, E. R., Ruggero, D., Shmelkov, S. V., Jensen, K. K., Rafii, S., Lyden, D. VEGFR1-positive haematopoietic bone marrow progenitors initiate the pre-metastatic niche. Nature, 2005, 438 : 820-827.
18. Oppenheimer, S. B. Cellular basis of cancer metastasis: A review of fundamentals and new advances. Acta Histochem., 2006,108 : 327–334.
19. Theise, N. D., Yao, J. L., Harada, K., Hytiroglou, P., Portmann, B., Thung, S. N., Tsui, W., Ohta, H., Nakanuma, Y. Hepatic ‘stem cell’ malignancies in adults: four cases. Histopathology, 2003, 43 : 263–271.
20. Ma, S., Chan, K. W., Hu, L., Lee, T. K., Wo, J. Y., Ng, I. O., Zheng, B. J., Guan, X. Y. Identification and characterization of tumorigenic liver cancer stem/progenitor cells. Gastroenterology, 2007, 132 : 2542–2556.
21. Baker, K. S., DeFor, T. E., Burns, L. J., Ramsay, N. K., Neglia, J. P., Robison, L. L. New malignancies after blood or marrow stem-cell transplantation in children and adults: incidence and risk factors. J. Clin. Oncol., 2003, 21 : 1352–1358.
22. Bhatia, S., Louie, A. D., Bhatia, R., O‘Donnell, M. R., Fung, H., Kashyap, A., Krishnan, A., Molina, A., Nademanee, A., Niland, J. C., Parker, P. A., Snyder, D. S., Spielberger, R., Stein, A., Forman, S. J. Solid cancers after bone marrow transplantation. J. Clin. Oncol., 2001, 19 : 464–471.
23. Pardal, R., Clarke, M. F., Morrison, S. J. Applying the principles of stem-cell biology to cancer. Nat. Rev. Cancer, 2003, 3 : 895–902.
24. Duelli, D., Lazebnik, Y. Cell fusion: a hidden enemy? Cancer Cell, 2003, 3 : 445–448.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2007 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Endovaskulární léčba stenóz karotických tepen s použitím cerebrální protekce: pětileté zkušenosti
- Léčba infekce cévní protézy a aorto-enterické píštěle jako pozdní komplikace rekonstrukčního výkonu na abdominální aortě – kazuistika
- Biliárny ileus – zriedkavá komplikácia cholecystolitiázy
- Role intersticiální brachyterapie v multimodalitní léčbě solidních tumorů
- Chirurgická léčba karcinomu prsu v MOÚ
- Nádorová kmenová buňka – nový pohled v onkologii?
- Nový přístup k léčbě jaterních metastáz: manuálně asistovaná laparoskopická radiofrekvenční resekce jater
- Autofluorescenčná videotorakoskopia – prvé vlastné skúsenosti
- Interdisciplinární přístup k řešení mnohočetných tepenných aneuryzmat u pacienta s osmou recidivou incizionální kýly – kazuistika
- Zemřel prof. MUDr. Jiří Bartoš, DrSc.
- Otevřený dopis vedoucímu redaktorovi Rozhledu v chirurgii, prof. MUDr. Miloši Hájkovi, DrSc.
- Otevřený dopis
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Biliárny ileus – zriedkavá komplikácia cholecystolitiázy
- Chirurgická léčba karcinomu prsu v MOÚ
- Zemřel prof. MUDr. Jiří Bartoš, DrSc.
- Endovaskulární léčba stenóz karotických tepen s použitím cerebrální protekce: pětileté zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



