-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Změny hladiny metalothioneinu u pacientů se zhoubným nádorem prostaty – pilotní studie
Changes in metallothionein levels in patients with malignant prostate cancer – a pilot study
Aim: To analyse concentrations of metallothionein (MT) in urine samples of patients diagnosed with prostate cancer (CaP).
Methods: Samples were electrochemically analysed by difference pulse voltametry (DPV) method in Brdička’s buffer. Acquired data were then evaluated as an area under the curve (AUC). Concentrations of MT were determinedby calibration curve method.
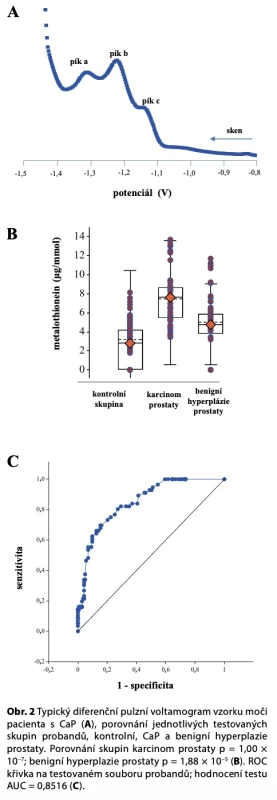
Results: Metallothioneins are proteins with molecular weight about 10 kDa. Theirbiological significance lies in maintaining homeostasis of metal ions. Their analytical determination is complicated. One of the most effective determination methods is by electrochemistry. Previously mentioned methods were used tostudy the changes of MT concentrations of patients with CaP, and with benign prostate hyperplazia (BHP). Our pilotexperiment determined concentrations of MT in a) healthy controls (n = 13) was 2.9 ± 1.2 µg/mmol of creatinine, b) BHP was 4.7 ± 1.7 μg/mmol of creatinine, c) CaP group (n = 9) was 6.7 ± 1.5 µg/mmolof creatinine. Difference between healthy controls and CaP group was statistically significant (p = 0.0099). Differencebetween BHP and CaP group was also determined (p = 0.0928). Difference between BHP and healthy controls is notvery statistically significant (p = 0.7869).
Conclusion: We were able to demonstrate differences between healthycontrols, BHP patients and CaP patients.Concentrations of MT in CaP patients were elevated, but they need to be studied in more detail.Keywords:
oxidative stress – thiol compounds – metallomics – electrochemical methods
Autoři: L. Melich 1; J. Raja 1; L. Vysloužilová 2; O. Štěpánková 2; J. Čepová 1; M. Fořtová 1; K. Kotaška 1; E. Klapková 1; J. Werle 1; R. Průša 1; R. Kizek 1
Působiště autorů: 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Motole, Praha Ústav lékařské chemie a klinické biochemie, Přednosta: prof. MUDr. Richard Průša, CSc. 1; České vysoké učení technické v Praze, Český institut informatiky, robotiky a kybernetiky Oddělení biomedicínského inženýrství a asistivní technologie, Vedoucí oddělení: prof. RNDr. Olga Štěpánková, CSc. 2
Vyšlo v časopise: Prakt. Lék. 2023; 103(6): 299-303
Kategorie: Z různých oborů
Souhrn
Cíl studie: V pilotním experimentu analyzovat metalothioneinu (MT) ve vzorcích moči pacientů se zhoubným nádorem prostaty (CaP).
Metody: Vzorky byly analyzovány elektrochemicky metodou diferenční pulzní voltametrie (DPV) vBrdičkově základním elektrolytu. Získaná data byla vyhodnocena jako plochy pod křivkou (AUC). Koncentrace MT bylyvyhodnoceny metodou kalibrační křivky.
Výsledky: Metallothioneiny jsou proteiny o molekulové hmotnosti kolem 10kDa. Jejich biologická role je především v udržování homeostázy iontů kovů v organismech. Analytické stanovení je komplikované. Mezi nejvhodnější metody patří elektrochemie. Uvedené metodické přístupy jsme aplikovali nasledování změn obsahu MT u pacientů s CaP a zbytnělou prostatou. V pilotním experimentu jsme zjistili, že průměrnáhladina MTu: a) kontrolní skupiny (n = 13) byla 2,9 ± 1,2 µg/mmol kreatininu; b) benigní hyperplazie prostaty 4,7 ± 1,7 μg/mmol kreatininu; c) CaP skupina (n = 9) 6,7 ± 1,5 µg/mmol kreatininu. Rozdíl mezi kontrolní skupinou a skupinouCaP byl statisticky průkazný (p = 0,0099). Mezi benigní hyperplazií prostaty a CaP byl také prokázán rozdíl (p =0,0928). Signály u pacientů s benigní hyperplazií prostaty (BHP) nevykazují statisticky významný rozdíl proti kontrolnískupině (p = 0,7869).
Závěr: Získané prvotní výsledky naznačují, že hladiny MT lze v moči stanovit elektrochemicky. Mezi testovanými skupinami se podařilo prokázat rozdíly. Hladiny MT u pacientů s CaP byly zvýšené, ale musejí být dále detailněji studovány.Klíčová slova:
oxidační stres – thiolové sloučeniny – metalomika – elektrochemické metody
ÚVOD
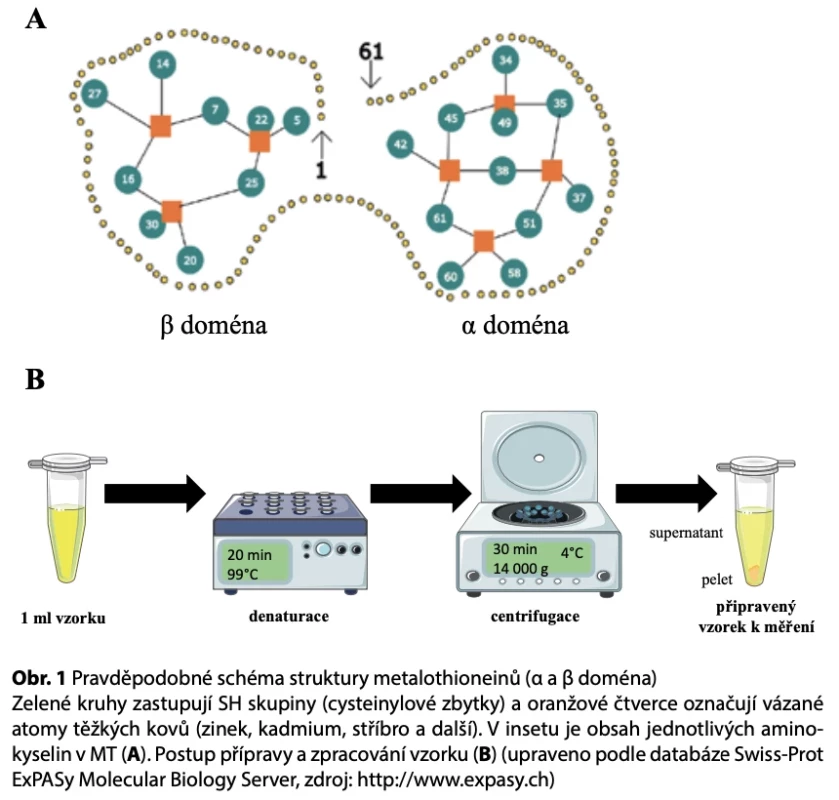
Metalothionein (MT) náleží do rodiny metaloproteinů, které jsou široce rozšířeny v živočišné říši, nicméně podobné typy proteinů byly popsány i u bakterií rostlin a hub. Jedná se o nízkomolekulární (6–10 kDa) na cysteiny bohaté proteiny, které neobsahují žádné aromatické aminokyseliny (1). Asi 30 % hmotnosti tvoří aminokyselina cystein, která vytváří charakteristické rysy MT (obr. 1). Právě díky sulfhydrylovým skupinám cysteinu dokáže MT vázat ionty kovů, sedm dvojmocných iontů nebo 12 jednomocných (2). Fyziologických funkcí MT bylo doposud rozpoznáno několik. Předně je to významný přenašeč iontů kovů. Největší afinitu má k Cu2+, ale nejčastěji váže Zn2+, čímž se velmi intenzivně zapojuje do homeostázy těchto iontů v organismu. Následná detoxikace poté proběhne pravděpodobně v ledvinách. MT má také významnou antioxidativní roli (3). Spolu s glutathionem (GSH) vytváří oxidačně redukční dvojici, která reguluje výskytvolných kyslíkových radikálů. Spolu tak vytvářejí redukční prostředí, které pomáhá chránit nukleové kyseliny, fosfolipidové membrány a proteinové aparáty buňky před ionizujícími účinky vysoko energetického záření achemooxidačním působením toxických činidel. V poslední době se také stále více poukazuje na schopnost MT regulovat expresi na kovech závislých genů. MT se schopností vázat atomy zinku dokáže přenášet esenciální kovy na transkripční faktory, a tak je aktivovat (4).
Klinický význam MT
Existuje řada studií vyhodnocující hladinu metalothioneinu u pacientů (5). Klinicky jsou změněné hladiny MT významné u řady onemocnění jako nefrotický syndrom (6), expozici zvýšeným hladinám těžkých kovů, jako je kadmium, zinek (7–9), cisplatina (10), spina bifida, nádory (11), a případně poškození dalších orgánů (12). Výzkumyukázaly zvýšenou hladinu MT (asi 5krát) v krevním séru i u dětských pacientů s nádory (13). Koncentrace proteinuMT je dávána do souvislosti s lokalizací tumoru, stadiem onemocnění, prognostickými vyhlídkami, ale i věkem pacienta, stravovacími návyky a podobně. V této oblasti je potřeba dále provádět intenzivní výzkum, aby se lépe pochopilo fungování nádorové buňky. Zvýšená hladina MT pravděpodobně indikuje změny v proliferaci buněk (14, 15).
Nádorová onemocnění a metalothioneiny
Vztah MT k nádorovému onemocnění nebyl doposud uspokojivě vysvětlen, nicméně protein hraje roli v kancerogenezi (4, 5, 16, 17). Pokusy na geneticky modifikovaných myších bez genu pro MT ukázaly, že jsou citlivější ke vzniku nádorového onemocnění způsobeným těžkým kovem. Také se ukázalo, že proliferující buňky obsahují více MT, čímž se přímo nabízí spojitost s nádorovým bujením. Antioxidační aktivita metallothioneinu je využita při zhášení kyslíkových radikálů vzniklých při zvýšené aktivitě mitochondrií dělících se buněk.
Elektrochemická detekce a metalothioneiny
Pro analytické stanovení MT lze využít celou řadu analytických metod (2, 18). Metallothioneiny jsou proteiny bohaté na – SH skupiny. Z těchto důvodů lze pro detekci MT použít elektrochemických metod založených na katalytických reakcích (19, 20). Těchto metod bylo využito pro stanovení MT v kulturách buněk, v tkáních měkkýšů (21) nebo i v krevním séru(13, 22). Optimalizací postupu a celkových podmínek přípravy vzorku se podařilo dosáhnout velmi nízkých limitů detekce u různých analytických metod (tab. 1).
Cílem práce bylo navrhnout metodu pro elektrochemickou analýzu MT ze vzorků moči a aplikovat ji na pilotním vzorku pacientů s nádorem prostaty.
MATERIÁL A METODY
Použité chemikálie
MT byl zakoupen od společnosti Sigma-Aldrich (USA) a ostatní chemikálie použité pro analýzu byly zakoupeny odspolečnosti Merck (Darmstadt, Německo) v čistotě
p.a. Pro chemicko-biochemickou analýzu byly využity pracovní roztoky od společnosti Siemens (USA).
Biologické vzorky
Kontrolní skupina byla moč zdravých dobrovolníků (n = 13, věk 16–48 let). Skupinu tvořili pacienti s primárními záchytyCaP (n = 14, věk 50–60 let). Další skupinou byli pacienti s benigní hyperplazií prostaty (n = 9, věk 50–60 let). Individuálnívzorky (n = 5) byly smíchány do sterilní nádoby (objem minimálně 500 ml). Vzorky moči byly denaturovány 99 °C natermomixeru po dobu 15 min při teplotě 4 oC. Denaturované vzorky byly centrifugovány při 4 oC, 15 000 g po dobu 30 min.
Elektrochemická analýza
Elektrochemická analýza byla provedena na AUTOLAB Analyser (Metrohm, Herisau, Switzerland) ve spojení s VA-Stand 663 (Metrohm, Herisau, Switzerland). Vzorky byly měřeny diferenční pulzní voltametrií (DPV). DPV parametry byly následující: počáteční potenciál –0,6 V akonečný potenciál byl –1,95 V, modulační čas 0,057 s, interval 0,2 s, step potenciál byl 1 mV/s, modulační amplituda250 mV a akumulační čas 240 s. Základní elektrolyt (Brdičkův roztok) 1 mmol/l Co(NH3)6Cl3, 1 mol/l NH3(aq) a 1mol/l NH4Cl, pH 9,6. Další podrobnosti k metodě jsou popsány v dalších pracích (22–24).
Statistické a matematické vyhodnocení
Veškerá analyzovaná data byla převedena do laboratorní databáze QINSLAB a statisticky vyhodnocena. Všechny elektrochemické analýzy byly provedeny minimálně v pěti opakováních. Analytické parametry LOD a LOQ byly vypočítány podle práce Hubauxe a Vose (25).
VÝSLEDKY A DISKUZE
Dlouhodobě je pro kvantitativní stanovení MT je využíváno Brdičkovy reakce (19, 26, 27). Skotákem modifikovaný bioanalytický postup využíval pro analýzu MT v moči (23, 28). Elektrochemická analýza MT byla námi popsána v různých experimentálních pracích (20, 29). Studované vzorky močí byly nejdříve tepelně denaturovány po dobu 30 min a následně 30 min centrifugovány pro odstranění vzniklého precipitátu. Připravený vzorek byl následně analyzován za využití Brdičkovy reakce (obr. 2). Pro vyhodnocení získaných voltametrických křivek bylo využito určení ploch pod křivkou AUC. U získaných voltamogramů byla vyhodnocena AUC pod grafem ve čtyřech zónách (první zóna od –0,6 V do –1,0 V, druhá od –1,01 V do –1,3 V, třetí od –1,31 V do –1,6 V a čtvrtá zóna od –1,61 Vdo –1,95 V). Získané AUC pro jednotlivé zóny ukázaly nejlepší závislost na koncentraci MT pro zónu dvě a tři.Zaznamenané AUC odezvy jednotlivých zón narůstaly v závislosti na množství aplikovaného vzorku. Dalšímetodické podrobnosti k analýze MT jsou publikované v naší nejnovější práci (24). V dostupných studiích byly stanoveny hladiny MT v běžné populaci, v mírně industriálně zatížené se pohybují kolem 20 až 40 µg/mmol kreatininu (30). Většinou mezi pohlavím a věkem nejsou pozorovány význačné rozdíly, ale lze očekávat, že navelkém souboru dat budou tyto závislosti prokázány (12, 30).
Tab. 1. Vybrané analytické metody pro stanovení metalothioneinů 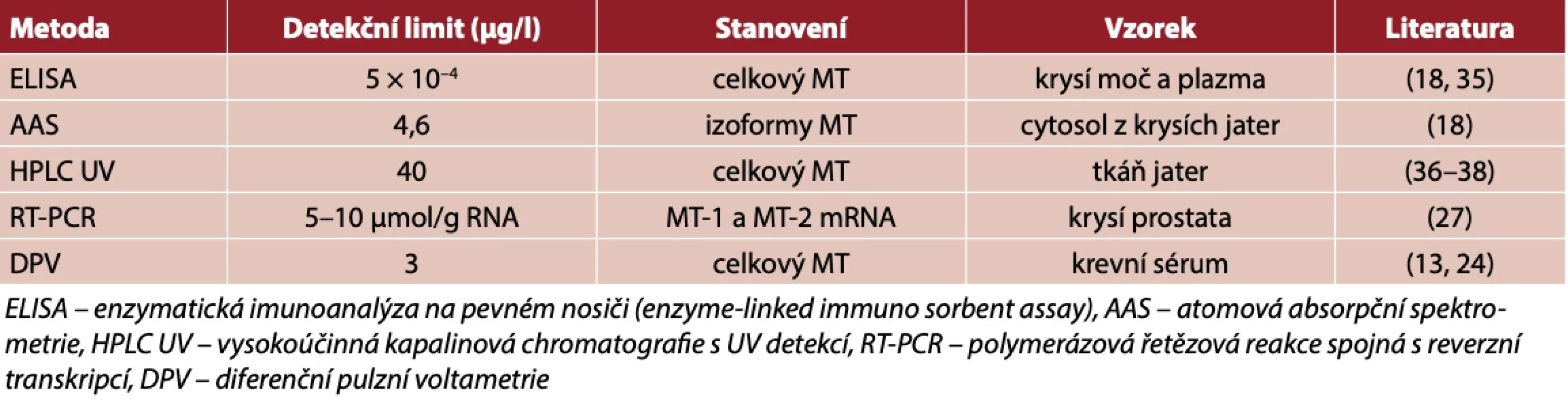
Zjistili jsme, že průměrná hladina MT u kontrolní skupiny (n = 13) byla 2,9 ± 1,2 µg/mmol kreatininu, u benigníhyperplazie prostaty 4,7 ± 1,7 μg/mmol kreatininu a ve skupině s CaP (n = 9) 6,7 ± 1,5 µg/mmol kreatininu. Rozdíl mezi kontrolní skupinou a skupinou CaP byl statisticky průkazný (p = 0,0099). Mezi benigní hyperplazií prostaty a CaP nebyl prokázán významný rozdíl (p = 0,0928). Signály u pacientů s benigní hyperplazií prostaty nevykazují statisticky významný rozdíl proti kontrolní skupině (p = 0,7869). S ohledem na pilotní studii byl analyzován malý vzorek pacientů, v získaných datech jsme nepozorovali žádné závislosti koncentrace MT na věku.
Výzkum, který se zabýval MT v moči dětí se spina bifida, ukázal rovněž jeho zvýšenou hladinu u skupiny pacientů, zhruba 2krát (31). Nejvíce byla hladina MT zkoumána u populací žijících v prostředí se zvýšenou koncentrací těžkýchkovů. MT v moči je úzce spojen s množstvím těžkých kovů přítomných v moči. U skupiny mužů vystavených pracovníexpozici kadmiem byly hladiny MT kolem 150 µg/mmol kreatininu. U žen žijících v Japonsku v oblasti zamořené kadmiem trpících tzv. nemocí „itai-itai“ byla v moči naměřena hladina MT kolem 750 µg/mmol kreatininu (32). Při podobné studii provedené na populaci obývající zamořenou oblast ve Španělsku bylo u žen naměřeno kolem 4 µg MT/mmol kreatininu a u mužů 3 µg MT/mmol kreatininu (30). Při trvalé expozici kadmiu se hladiny MT v moči postupně zvyšovaly s délkou expozice. O uvolnění MT do krve amoči nejsou dostupné informace, protože MT je cytoplazmatický protein. Pravděpodobně dochází k poškození epitelu tubulů v důsledku apoptózy a/nebo nekrózy (12). U neexponovaných jedinců však mechanismus není zřejmý a může souviset se změnami v endocytóze v nefronu: uvolnění z buněk tubulů v důsledku vyšší permeability způsobené reaktivními formami kyslíku (ROS), uvolnění z buněk tubulů, které prošly řízenou apopózou, změnami na membráně, v průběhu sekrece proteinů exozomy, membránovými bublinami (12). MT má množství biologických funkcí, mezi nejvýznamnější patří homeostáza iontů kovů (27, 33). Tato oblast stále není podrobně probádána a je nutné ji v budoucnu věnovat pozornost. Hladina MT může být ovlivněna mnoha různými fyzikálními a biologickými faktory (34).
ZÁVĚRY PRO KLINICKOU PRAXI
Metallothioneiny jsou stanovovány v řadě různých matricí, především ve vzorcích orgánů. V poslední době jsme věnovali pozornost detekci MT v krvi a séru. Další matricí, ve které je MT možné analyzovat, je moč. Byla provedena pilotní studie elektrochemické analýzy MT v moči. Uvedené metodické přístupy jsme aplikovali na sledování změn obsahu MT u pacientů s CaP a zbytnělou prostatou. Mezi testovanými skupinami se podařilo prokázat rozdíly, hodnoty u pacientů s CaP byly zvýšené, ale musí být dále detailněji studovány.
Poděkování
Práce na tomto projektu byla financována Ligou proti rakovině Praha 2019. Děkujeme společnosti Metrohm CZ za dlouhodobou podporu, a především Vítu Skotákovi za realizaci experimentů. Naše velké poděkování patří panu RNDr. Josefu Růžičkovi za vytváření laboratorní databáze a algoritmů pro vyhodnocování experimentálních dat.
Seznam zkratek
AUC plocha pod křivkou
BHP benigní hyperplazie prostaty CaP karcinom prostaty
DPV diferenční pulzní voltametrie GSH glutathion
MT metalothionein
Konflikt zájmů: žádný.
Zdroje
- Binz PA, Kagi JHR. Metallothionein: Molecular evolution and classification. In: Klaassen CD. (eds). Metallothionein IV. Advances in Life Sciences. Basel: Birkhäuser 1999.
- Kizek R, Trnkova L and Palecek E. Determination of metallothionein at the femtomole level by constant current stripping chronopotentiometry. Anal Chem 2001; 73(20): 4801–4807.
- Ruttkay-Nedecky B, Nejdl L, Gumulec J, et al. The role of metallothionein in oxidative stress. Int J Mol Sci 2013; 14(3): 6044–6066.
- Krizkova S, Fabrik I, Adam V, et al. Metallothionein – a promising tool for cancer diagnostics. Brat Med J 2009; 110(2): 93–97.
- Kruseova J, Hynek D, Adam V, et al. Serum metallothioneins in childhood tumours – a potential prognostic marker. Int J Mol Sci 2013; 14(6): 12170–12185.
- Martinez VA, Serrat N, Paternain JL, et al. Zinc and metallothionein metabolism in nephrotic syndrome. Trace Elem Electrolyt 1996; 13(1): 14–17.
- Chen L, Jin TY, Huang B, et al. Critical exposure level of cadmium for elevated urinary metallothionein – An occupational population study in China.Toxicol Appl Pharmacol 2006; 215(1): 93–99.
- Kido T, Shaikh Z A, Kito H, et al. Dose–response relationship between urinary cadmium and metallothionein in a japanese population environmentally exposed to cadmium. Toxicology 1991; 65(3): 325–332.
- Nakajima M, Kobayashi E, Suwazono Y, et al. Excretion of urinary cadmium, copper, and zinc in cadmium–exposed and nonexposed subjects, with special reference to urinary excretion of beta(2)-microglobulin and metallothionein. Biol Trac Elem Res 2005; 108(1–3): 17–31.
- Kotoh S, Naito S, Sakamoto N, et al. Metallothionein expression is correlated with cisplatin resistance in transitional-cell carcinoma of the urinary-tract. J Urol 1994; 152(4): 1267–1270.
- Zimmerman AW, Horak E, Banta JV, et al. Urinary-excretion of zinc and metallothionein in children with spina-bifida. Annal Neurol 1983; 14(3): 385–385.
- Sabolic I, Breljak D, Skarica M, et al. Role of metallothionein in cadmium traffic and toxicity in kidneys and other mammalian organs. Biometals 2010; 23(5): 897–926.
- Krizkova S, Masarik M, Kukacka J. Serum metallothionein in newly diagnosed patients with childhood solid tumours. Acta Biochim Pol 2010; (57): 561–566.
- Petrlová J, Blaštík O, Průša R, a kol. Analýza obsahu metalothioneinu u pacientů se zhoubným nádorem prsu, tlustého střeva nebo maligním melanomem. Klin Onkol 2006; 19(2): 138–142.
- Fabrik I, Adam V, Křížková S, a kol. Určení hladiny termostabilních thiolů u pacientů se zhoubným nádorem. Klin Onkol 2007; 20(6): 384–389.
- Fabrik I, Kukačka J, Adam V, a kol. Metalothionein a jeho vztah k protinádorové léčbě na bázi platinových komplexů. Prakt. Lék. 2008; 88(2): 90–93.
- Raudenská M, Šmerková K, Tanhäuserová V, a kol. Metalothionein a jeho role v detoxikaci těžkých kovů a predispozici k chorobám. Prakt. Lék. 2012; 92(6): 322–326.
- Lobinski R, Chassaigne H, Szpunar J. Analysis for metallothioneins using coupled techniques. Talanta 1998; 46(2): 271–289.
- Brdicka R. Application of the polarographic effect of proteins in cancer diagnosis. Nature 1937; 139 : 330.
- Olafson RW, Olsson PE. Electrochemical detection of metallothionein. Methods Enzymol 1991; 205 : 205–213.
- Raspor J, Pavicic B. Electrochemical methods for quantification and characterization of metallothioneins induced in Mytilus galloprovincialis. Fresenius J Anal Chem 1996; 354 : 529–534.
- Petrlová J, Potěšil D, Mikelová R, et al. Attomole voltammetric determination of metallothionein. Electrochim Acta 2006; 51(24): 5112–5119.
- Skoták V, Sehnal K, Banáš D, a kol. Využití Brdičkovy reakce pro detekci metalothioneinu v moči. Czech Chem Soc Symp Ser 2020; 18 : 4P–08 : 131.
- Melich L, Fořtová M, Hosnedlová B, a kol. Studium hladiny metalothionienu v séru pacientů se zhoubným nádorem. Chem Listy 2023; 117(10): 573–580.
- Hubaux A, Vos G. Decision and detection limits for linerar calibration curves. Anal Chem 1970; 42(8): 849–851.
- Brdicka R. Polarographic investigation in serological cancer diagnosis. Nature 1937; 139 : 1020–1021.
- Dabrio M, Rodríguez AR, Bordin G, et al. Recent developments in quantification methods for metallothionein. J Inorg Biochem 2002; 88(2): 123–134.
- Skoták V. Elektrochemická detekce metalothioneinu v moči a jeho vztah k zhoubnému nádoru prostaty. Gymnázium Boskovice:Středoškolská odborná činnost 2021; 1–31.
- Olafson RW. Electrochemical characterization of metallothionein metal mercaptide complexes – Application of cyclic voltammetry to investigation of metalloproteins. Bioelectrochem Bioenerg 1988; 19(1): 111–125.
- Folch J, Ortega A, Cabre A, et al. Urinary levels of metallothioneins and metals in subjects from a semiindustrialized area in Tarragona Province of Spain. Biol Trace Elem Res 1998; 63(2): 113–121.
- Zimmerman AW, Garvey JS, Banta JV, et al. Urinary zinc and metallothionein in children with spina bifida. Ped Neurol 1985; 1(1): 23–27.
- Tohyama C, Shaikh ZA, Nogawa K, et al. Urinary metallothionein as a new index of renal dysfunction in „ltai-ltai“ disease patients and otherJapanese women environmentally exposed to cadmium. Arch Toxicol 1982; (50): 159–166.
- Dziegiel P, Pula B, Kobierzycki C, et al. Metallothioneins in normal and cancer cells. Adv Anat Embryol Cell Biol 2016; 218 : 1–117.
- Coyle P, Philcox JC, Carey LC, et al. Metallothionein: The multipurpose protein. Cell Mol Life Sci 2002; 59(4): 627–647.
- Nordberg GF, Garvey JS, Chang CC. Metallothionein in plasma and urine of cadmium workers. Environment Res 1982; 28(1): 179–182.
- Bordin G, Raposo FC, Rodriguez A. Mammalian metallothionein sub-isoform separation by RP-HPLC with online UV and electrochemical detection. In: Klaassen CD. (eds) Metallothionein IV. Advances in Life Sciences. Basel: Birkhäuser 1999.
- Bordin G, Cordeiro-Raposo F, Rodriguez AR. Study of mammalian metallothionein polymorphism by reverse phase HPLC with on-linediode array and electrochemical detection. J Liq Chrom Rel Technol 2000; 23(7): 999–1018.
- Miyairi S, Shibata S and Naganuma A. Determination of metallothionein by high-performance liquid chromatography with fluorescence detection using an isocratic solvent system. Anal Biochem 1998; 258(2): 168–175.
adresa pro korespondenci:
prof. Ing. René Kizek, Ph.D., DrSc., MBA
Ústav lékařské chemie aklinické biochemie
2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
e-mail: kizekrene@gmail.comŠtítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2023 Číslo 6- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Projevy puchýřnatých chorob v dutině ústní
- Analýza vztahu rizikových faktorů demence a aterosklerózy
- Topická aplikace léčivého preparátu s β-glukanem
- Změny hladiny metalothioneinu u pacientů se zhoubným nádorem prostaty – pilotní studie
- Perorální xenogenní imunomodulační peptid – transfer faktor
- Intoxikace bobkovišní lékařskou
- Intoxikace ožankou kalamandrou (Teucrium chamaedrys) po požití čaje doporučeného bylinkářkou – rizika fytoterapie
- Co zvyšuje riziko vzniku psychotického onemocnění po zneužívání kanabis
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Projevy puchýřnatých chorob v dutině ústní
- Intoxikace bobkovišní lékařskou
- Analýza vztahu rizikových faktorů demence a aterosklerózy
- Intoxikace ožankou kalamandrou (Teucrium chamaedrys) po požití čaje doporučeného bylinkářkou – rizika fytoterapie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání