-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Metastatický karcinom ledviny: minulost a současnost
Metastatic renal cell carcinoma: past and present
The breakthroug novel treatments including immunoherapy (nivolumab, pembrolizumab, ipilimumab, avelumab, atezolizumab) and low molecular weight targeted therapy (such as axitinib, cabozantinib) have been introduced into the treatment of renal cancer in recent years. The result of these advances is the fact that a large proportion of patients are long-term survivivors. Current randomized clinical trials with these drugs are broadly discussed in this article.
Keywords:
renal carcinoma – immunotherapy – targeted therapy – PD-1 inhibitor – PD-L1 inhibitor
Autoři: J. Novotný
Působiště autorů: Institut klinické a experimentální medicíny, Praha
Vyšlo v časopise: Prakt. Lék. 2022; 102(3): 145-150
Kategorie: Z různých oborů
Souhrn
Adenokarcinom ledviny patří mezi nádorové diagnózy, u nichž v posledních letech došlo k takovému průlomu v léčbě, že i v případě rozvoje metastatického onemocnění jsme schopni novými léky zajistit u velkého podílu pacientů dlouhodobé přežití. Mezi tyto pokrokové léky patří imunoterapeutika (nivolumab, pembrolizumab, ipilimumab, avelumab, atezolizumab), která podáváme samostatně nebo v kombinaci s cílenými léky (s bevacizumabem, axitinibem). Silné i slabé stránky těchto studií jsou v článku podrobně diskutovány.
Klíčová slova:
cílená léčba – imunoterapie – karcinom ledviny – PD-1 inhibitor – PD-L1 inhibitor
ÚVOD
Spontánní regrese nádorů je velmi řídkým jevem. Poprvé byla popsána u sarkomu již v roce 1893. U metastatického karcinomu ledvin je první literární zmínka datována do roku 1928. Většina publikovaných kazuistik popisovala regresi plicních metastáz po odstranění primárního nádoru ledviny, i když byla také opakovaně zaznamenána spontánní regrese mozkových, jaterních, adrenálních a kostních metastáz. Výskyt tohoto jevu se předpokládá kolem 1 %, dle ojedinělých nejoptimističtějších studií až v 7 % (1).
V roce 1966 se objevila první vědecká práce, ve které byla poprvé teoreticky popsána spontánní regrese nádorů ledvin jako důsledek zvláště silné aktivace imunitního systému. Od té doby se také datují pokusy řízeně aktivovat imunitní systém a dosáhnout měřitelných protinádorových efektů.
Imunoterapie interferonem alfa (I) nebo interleukinem 2 (IL2) byla používána od devadesátých let 20. století, neboť v mnoha četných studiích druhé fáze byly pozorovány léčebné odpovědi. Protože se jednalo o studie počtem zařazených pacientů nevelké, byla provedena jejich metaanalýza, která zjistila, že interferon alfa v monoterapii, ve srovnání s libovolným neimunologickým přípravkem, vede k delšímu mediánu přežívání pacientů – a to o 4,5 měsíce (2).
Interleukin 2 byl schválen k použití v roce 1992 (3). V první studii provedené na 283 pacientech byl podáván IL-2 v dávce 700 000 IU/kg každých 8 hodin, 15 dávek na cyklus. U 20 % pacientů byla zaznamenána léčebná odpověď, u 7 % úplná. Medián trvání kompletní léčebné odpovědi činil 76 měsíců, medián trvání parciální odpovědi pak 69 měsíců. S léčbou byla spojena úmrtnost 1,1 %. Po této pozitivní studii následovaly dvě další s podobným designem i výsledky. Zvláště hodnotným zjištěním byl medián trvání odpovědí, který ani do dnešních dní není moderní imunoterapií překonán. Vzhledem k riziku vážných komplikací byly studovány i režimy s nižšími dávkami IL-2, což sice vedlo k lepší toleranci, ovšem bohužel i ke snížení účinnost léčby, a to z pohledu četnosti léčebných odpovědí přibližně o polovinu.
Z tohoto důvodu se další vývoj na přelomu tisíciletí ubíral dvěma směry. Tím prvním byl návrat vysokodávkované léčby IL-2 s adekvátní podpůrnou péčí, druhým pak zachování nízkých dávek a kombinacemi s cytostatiky, zvláště pak s 5-fluorouracilem, vinka alkaloidy a cisplatinou.
Studie s chemoterapeutiky nedosahovaly žádných ohromujících výsledků, naproti tomu vysokodávkovaný IL-2 si i dnes zasluhuje pozornost a u pacientů v dobrém výkonnostním stavu je stále živou léčebnou možností, s níž se ztotožňuje též konsorcium prestižních amerických onkologických institucí NCCN. Medián přežívání u respondérů na IL-2 je stále nedostižný pro jakékoliv jiné farmakologické postupy testované u metastatického karcinomu ledviny. Bohužel pro mnoho pacientů s horším výkonnostním stavem a komorbiditami je třeba hledat nové postupy, což se pak v dalších letech i stalo.
CÍLENÁ LÉČBA VS. STARŠÍ IMUNOTERAPIE
Počátkem 21. století dosáhlo poznání kancerogeneze renálního karcinomu mírného pokroku. Ten pak umožnil syntézu a klinické zkoušky nových přípravků, které atakovaly transdukční signální kaskády, jejichž činnost byla kancerogenezí narušena. Šlo především o nízkomolekulární inhibitory VEGF(R), PDGFR, CSF-1R, FLT-3, mTOR, MET, KIT. Tyto léky byly nejprve testovány proti do té doby používaným standardním postupům – zejména proti interferonu alfa, nebo ve vyšších liniích proti placebu, a později proti sobě. Byly také testovány dublety různých přípravků (studie TORAVA, RECORD-02, INTORACT), ale jejich toxicita byla značná, a proto se až na výjimky uplatňoval po celou poslední dekádu koncept sekvenční monoterapie. A než budete číst následující řádky, vysvětlím, jak se stratifikují nemocní podle rizika progrese nemoci. Na velkých souborech pacientů bylo zjištěno, že někteří pacienti přežívají velmi dlouho, jiní velmi krátce. Byly proto vytvořeny multivariační modely, které dnes onkologové rutinně používají: 1. při diskuzi o prognóze s pacientem a 2. pro volbu léčebných postupů. Nejužívanějšími jsou modely MSKCC a IMDC, které jsou dostupné online (https:// www.mdcalc.com). Pacienti dobré, střední a špatné prognózy mají dle IMDC predikován medián přežití 43,2; 22,5 a 7,8 měsíce. Při výpočtu přežití pacienta se zohledňuje čas od primární operace do vzniku metastáz, výkonnostní stav, vybrané parametry krevního obrazu, koncentrace sérového kalcia nebo LDH.
Tedy zpět k léčbě. Obecně lze říci, že za cenu velkých finančních nákladů bylo dosaženo poměrně málo nad úroveň nespecifické imunoterapie interferonem alfa. Posuďte sami:
• Sunitinib (Su) byl hodnocen v randomizované studii NCT00098657 proti interferonu alfa, a to u podskupin pacientů s dobrou nebo střední prognózou. Celkové přežívání nebylo mezi skupinami pacientů rozdílné. Efekt byl statisticky signifikantní pouze z hlediska času do progrese (11 vs. 5 měsíců, S vs. I, p < 0,001) – a na základě tohoto rozdílu byl lék v roce 2007 schválen k použití (4).
• Ve studii COMPARZ (5) byla popsána ekvivalence sunitinibu a pazopanibu (P) u nemocných dobré a střední prognózy. Léky byly ekvivalentní jak dosaženou četností léčebných odpovědí (31% pazopanib, 25% sunitinib, p = 0,03), tak i dosaženým mediánem celkového přežívání (28,4 vs. 29,3 měsíce, P vs. Su). Pazopanib byl většinou pacientů preferován vzhledem k celkově lepší toleranci.
• Sorafenib (So) byl testován u osob dobré a střední prognózy proti interferonu alfa a nebylo dosaženo zlepšení, ani pokud jde o čas do progrese, ani o celkové přežívání, ani počet léčebných odpovědí (6). Pozitivní hodnotou získanou z této studie bylo nalezení signifikantně vyššího počtu pacientů léčených So, u nichž bylo dosaženo kontroly nemoci, tedy součtu pacientů s léčebnou odpovědí nebo stabilizací – DCR 79,4 % vs. 64,1 %). A také kvalita života byla popisována jako lepší v rameni se So.
• Interferon alfa doplněný o bevacizumab prokázal ve dvou studiích (7, 8) signifikantní prodloužení času do progrese (8,4 vs. 49; resp. 10,4 vs. 5,5 měsíce) a počtu léčebných odpovědí (25,5 % vs. 13,1 %; resp. 31 % vs. 12 %) proti interferonu alfa samotnému, aniž bychom za cenu vysokých nákladů a toxicity dosáhly jakéhokoliv zlepšení přežívání našich pacientů.
• Temsirolimus (T) je jediným lékem, který byl testován v populaci prognosticky vysoce rizikové a který opravdu dosáhl primárního cíle, což bylo prodloužení přežití pacientů. Navíc dosáhl i sekundárního cíle, prodloužit čas do progrese. Medián času do progrese a medián celkového přežití činily při srovnání s interferonem 3,8 vs. 1,9, ss.; resp. 10,9 vs. 7,3, ss.; T vs. I) (9).
• Kabozantinib ve studii CABOSUN prokázal u pacientů intermediární a špatné prognózy v první linii stejné celkové přežívání při signifikantně vyšším počtu léčebných odpovědí (20 % vs. 9 %) a delším času do progrese (8,6 vs. 5,3 měsíce) než sunitinib (10).
Matematicky jsme tedy v druhé dekádě dosáhli výsledků uvedených v tabulce 1.
Tab. 1. Závěry klíčových studií ve schematickém znázornění 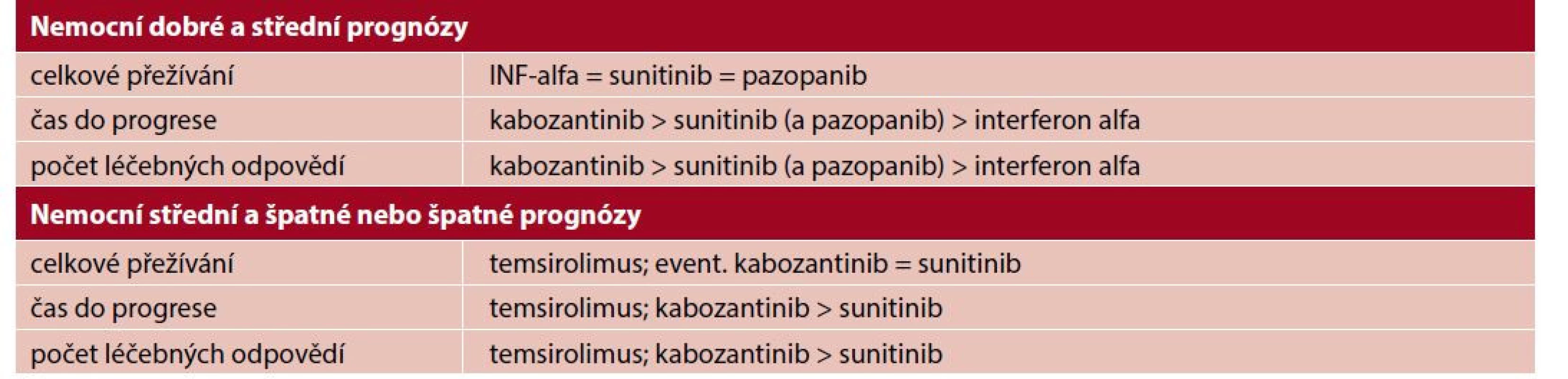
Pozn.: Chybí přímé srovnání temsirolimu a kabozantinibu (sunitinibu). Souhrnně vzato, neoddiskutovatelně jsme zvýšili počet léčebných odpovědí, což může být dílčí pomoc pro nemocné ve specifických situacích (např. u těch, kteří mají plicní insuficienci z důvodu metastáz). Prodloužili jsme čas do progrese, což je parametr, na který se žádný pacient ještě nikdy nezeptal. Pacienti se ptají na celkové přežívání. A to jsme prokazatelně prodloužili o několik měsíců u pacientů se špatnou prognózou.
Dobré je, že aktuálně máme více léků k dispozici, a když tedy selže první, máme druhý a třetí a čtvrtý, což jsme dříve neměli.
MODERNÍ IMUNOTERAPIE VS. CÍLENÁ LÉČBA
Vzhledem ke skutečnosti, že prakticky u všech nemocných s metastatickým karcinomem ledviny je po určité době podávání výše diskutované cílené terapie zaznamenána progrese, bylo logické a racionální studovat již od první linie léčby podání nových imunomodulačních léků, o nichž je známo (i z jiných diagnóz, např. z léčby melanomu), že dokážou u části pacientů navodit dlouhotrvající odpovědi – a možná i vyléčení.
S výjimkou durvalumabu byly ve studiích fáze III prověřeny PD-1 inhibitory nivolumab (11) a pembrolizumab (12) i PD-L1 inhibitory atezolizumab (13) a avelumab (14).
Prvním společným znakem studií těchto přípravků je v experimentálním rameni testování základního léku v kombinaci – s jiným imunomodulátorem (ipilimumabem), s nízkomolekulární cílenou léčbou (axitinibem) nebo s bevacizumabem.
Druhou společnou charakteristikou je srovnávací léčba sunitinibem, a to napříč všemi studiemi a rizikovými skupinami. Nemám nic proti sunitinibu u pacientů dobré a střední prognózy. Co je mi ale nejasné zcela, je fakt, proč byl sunitinib podán i u nemocných špatné prognostické skupiny, když v níž systematicky studován nebyl. Má výrazná výtka tedy směřuje k volbě komparátoru – neexistuje pro tyto nemocné účinnější lék – temsirolimus – s kterým bychom měli provést srovnání? A odpovídám si: Ano, temsirolimus by byl vhodnější. A aby situace byla ještě nepřehlednější, existuje navíc i druhý lék, který má účinnost vyšší než sunitinib – a tím je kabozantinib. Ten ve studii CABOSUN prokázal u pacientů intermediární a špatné prognózy v první linii stejné celkové přežívání při signifikantně vyšším počtu léčebných odpovědí (20 % vs. 9 %) a delším času do progrese (8,6 vs. 5,3 měsíce) než sunitinib. Vzhledem k takovému designu bychom zřetelněji prokázali, jakou roli má vlastně přidání pembrolizumabu nebo avelumabu k axitinibu. Tedy – se „silnějším“ komparátorem by asi byly efekty nové léčby mírnější.
Třetí podobnost najdeme u podílu pacientů s předchozí nefrektomií – ten se konstantně pohybuje napříč studiemi mezi 73–83 %.
Čtvrtá podobnost ukazuje na fakt, že téměř tři čtvrtiny zařazených pacientů byly ve všech studiích muži.
Od této chvíle však podobnosti končí. Jednotlivé studie se významně liší v klinických a patologických charakteristikách zařazených nemocných (tab. 2), proto jejich vzájemné srovnání je téměř nemožné nebo přinejmenším hrubě zkreslující. V některých studiích byli zařazeni nemocní jen dle základní diagnózy, v jiných až po naplnění určitých prediktivních markerů. V některých byli zařazeni i pacienti s mozkovými metastázami, z jiných byli vyloučeni. Některé studie mají dostatečný follow-up, publikace jiných byla uspěchána a hovořit můžeme pouze o předběžných závěrech.
Tab. 2. Základní charakteristika klinických studií s novými režimy v první linii léčby metastatického karcinomu ledvin 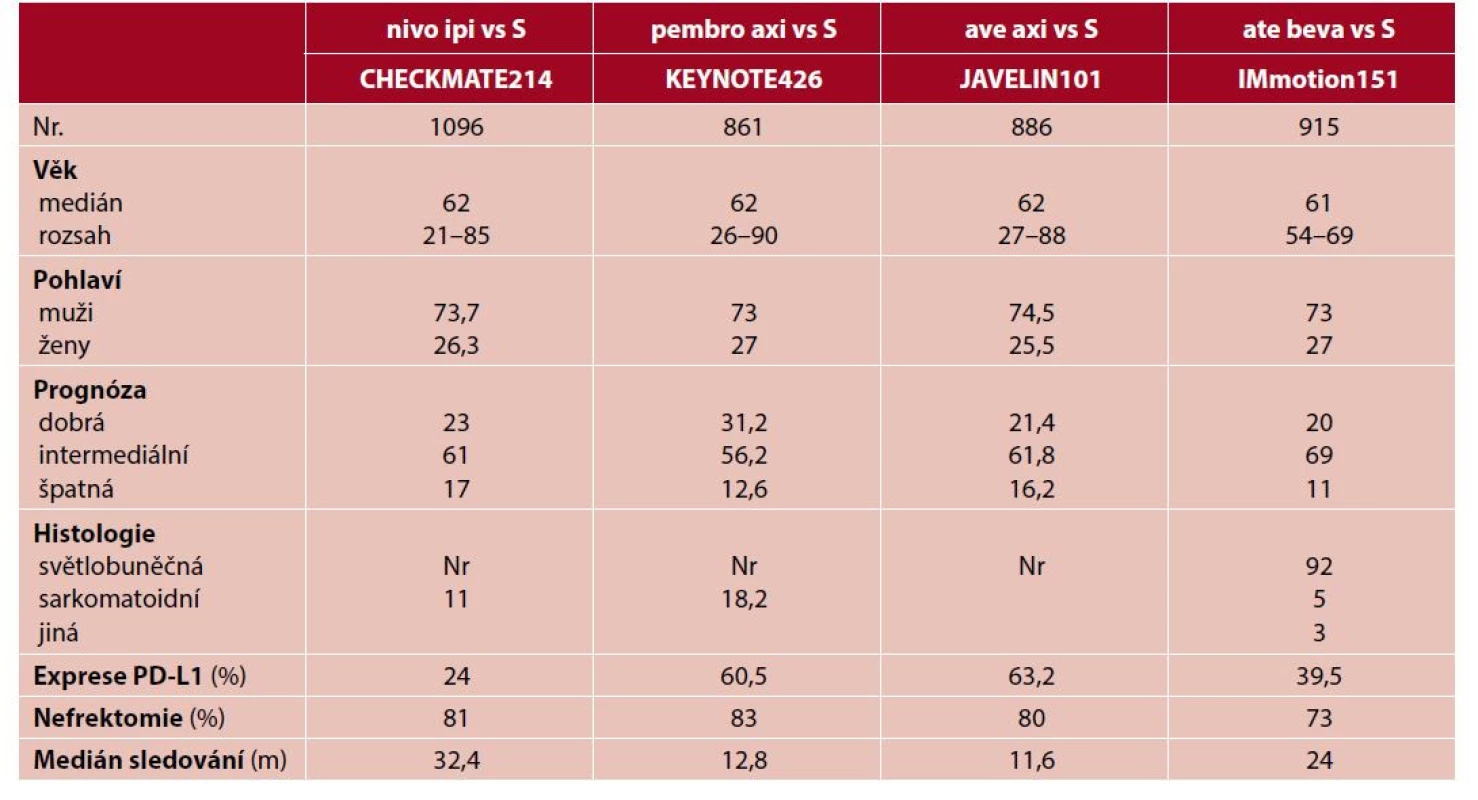
Jak tedy interpretovat výše uvedené výsledky (tab. 3)? Studie umožňují několik nepřímých srovnání.
Tab. 3. Výsledky léčby v novějších studiích s imunoterapií v první linii léčby metastatického karcinomu ledviny 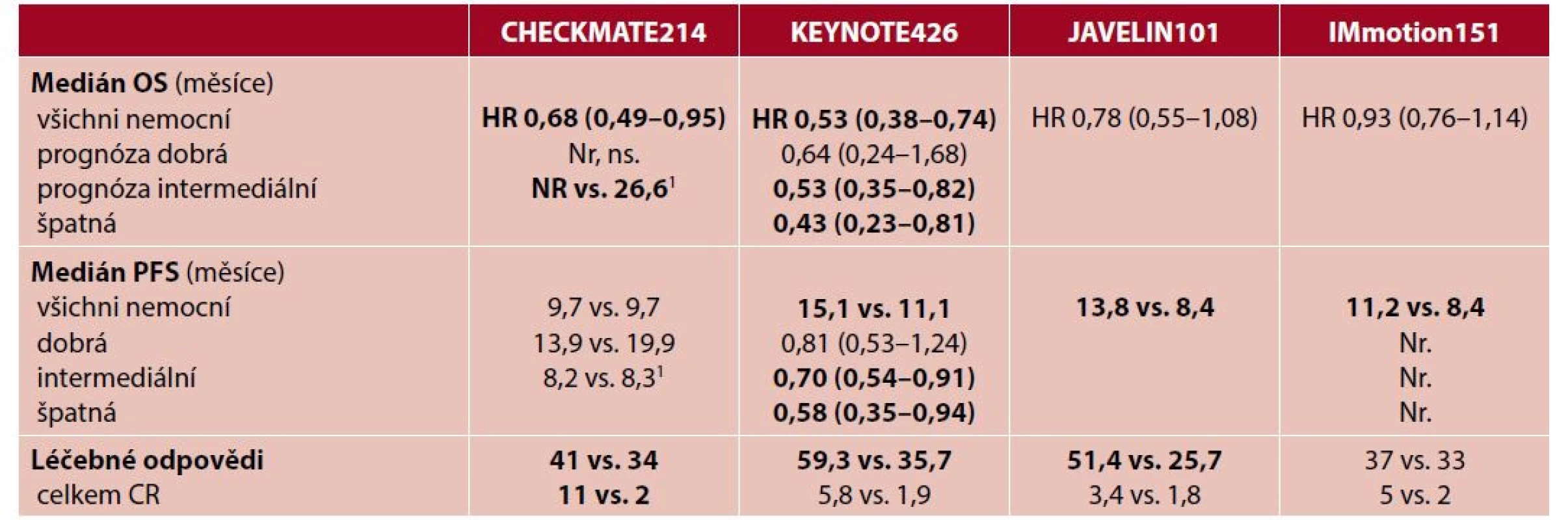
Tučně jsou vyznačeny statisticky signifikantní rozdíly.
1společně hodnocena skupina intermediate + poor risk, Nr. – not reported, NR – nedosaženoNejdelší follow-up mají studie CHECKMATE214 a IMmotion151. Za téměř shodně dlouhou dobu sledování (2–3 roky) nebylo prokázáno podáním atezolizumabu s bevacizumabem prodloužení přežívání ve srovnání se sunitinibem samotným (medián OS 33,6 vs. 34,9 měsíce). Naproti tomu nivolumab s ipilimumabem vykazuje přežívání signifikantně delší na úrovni HR 0,68. Medián ve skupině s imunoterapií ještě nebyl dosažen, ve skupině léčené Su dosáhl 37,9 měsíce; 18měsíční přežívání činí u imunoterapie 75 % a u Su 60 %. A nadto lze kombinovanou imunoterapií dosáhnout i vyššího počtu kompletních léčebných odpovědí (11 % vs. 2 %, NI vs. Su).
Druhé srovnání lze provést mezi studiemi KEYNOTE426 a JAVELIN101. Obě mají medián sledování podobný – kolem 1 roku. Populace jsou podobné, i když přeci jen ty ve studii s avelumabem byly o několik procent rizikovější. Ale jen pembrolizumab s axitinibem dosahuje signifikantně delšího přežívání pacientů. Dvanáct a 18 měsíců přežilo 89,9 %; resp. 82,3 % pacientů léčených pembrolizumabem a axitinibem a pouze 78,3 %, resp. 72,1 % léčených sunitinibem, p < 0,0001).
Je zajímavé, že oba režimy s PD-L1 inhibitory vykazují horší výsledky léčby než režimy s PD-1 inhibitory. Proto režimy s avelumabem a atezolizumabem považuji za nevhodné k rutinnímu použití.
Zbývá tedy posoudit dva režimy, které vyšly z předchozího semifinále vítězně. CHECKMATE214 nebo KEYNOTE426. V případě CHECKMATE214 se nedoporučuje (NCCN, ESMO) podání imunoterapie nivolumab a ipilimumab pacientům dobré prognostické skupiny, neboť u nich je léčebný výsledek totožný se sunitinibem. Imunoterapii tak můžeme s výhodou rezervovat pro druhou linii, v níž vykazuje zásadně delší přežití (CHECKMATE025) než everolimus.
Je zřejmé, že i když cena nových režimů je značná, protinádorové efekty jsou spíše mírné. Otázkou tedy je, zda by nešlo exponovat novým režimům pouze pacienty, u nichž by byla již před zahájením léčby predikována dobrá léčebná odpověď. Bohužel, v současné době nemáme žádný prediktivní faktor, který by byl klinicky využitelný. Porovnáme-li výsledky léčby v kohortě všech pacientů s výsledky u pacientů s vyšší expresí PD-L1, nezjistíme podstatné rozdíly. A druhý potenciální prediktivní marker, počet mutací v nádoru, nebyl v žádné studii systematicky testován.
Jak vést léčbu první linie v kontextu současných dat?
Nemocní s příznivou prognózou by měli být léčeni pazopanibem nebo sunitinibem.
U nemocných středního rizika v dobrém klinickém stavu, bez kontraindikace imunoterapie, je možné volit mezi nivolumabem a ipilimumabem nebo pembrolizumabem a axitinibem. U ostatních by bylo optimální nasadit kabozantinib.
U nemocných špatné prognostické skupiny je situace komplikovaná, temsirolimus je dobrou volbou, a výše uvedené režimy pro střední riziko pravděpodobně též.
SPECIFIKA U MINORITNÍCH HISTOPATOLOGICKÝCH TYPŮ
Hlouběji je možné se vyjádřit k účinnosti nových režimů pouze u podskupiny pacientů se sarkomatoidní variantou karcinomu ledvin (sRCC), protože ti byli v dostatečné míře do studií zahrnuti.
Loni publikovaná metaanalýza léčebných výsledků dosažených v subpopulaci 512 sRCC pacientů vs. u všech 3814 nemocných zařazených do studií imunoterapie vs. sunitinib ukazuje, že:
• Efektivita imunoterapie vs. sunitinib ve smyslu celkového přežití je u populace sRCC ještě vyšší než u populace neselektované. HR ve prospěch imunoterapie činí pro populaci sRCC 0,56 (0,40–0,78), v populaci obecné je rozdíl menší – pouze 0,7 (0,51–0,96).
• Efektivita imunoterapie vs. sunitinib ve smyslu času do progrese je u podskupiny sRCC také vyšší než u neselektované skupiny pacientů (HR sRCC 0,57 (0,45–0,74), obecná populace HR 0,79 (0,70–0,89).
• Nejvyšší počet kompletních léčebných odpovědí dosažených imunoterapií byl zaznamenán v populaci pacientů s diagnózou sRCC léčených režimem nivolumab/ ipilimumab – 18,3 %. Pro režim pembrolizumab axitinib činí počet kompletních odpovědí 11,8 %, pro atezolizumab a bevacizumab 10 % a avelumab a axitinib 4,3 %.
• Celková kumulativní četnost kompletních léčebných odpovědí ve všech studiích s imunoterapií dosáhla 10,2 % pro sRCC a 5,4 % pro všechny typy souhrnně.
ZÁVĚR
Léčba metastatického karcinomu ledviny prodělává v posledních měsících bouřlivý vývoj. U pacientů s nízce rizikovým metastatickým karcinomem ledviny je stále vhodné podávat sunitinib nebo ekvivalentní pazopanib. U pacientů se středním rizikem je vhodné uvažovat o kombinaci nivolumab/ipilimumab, neboť u této kombinace je popsáno dosud nejdelší prodloužení celkového přežívání ve srovnání s adekvátním komparátorem (sunitinib). Podání jednoho imunomodulátoru s axitinibem může být výhodné u pacientů nevhodných ke kombinované imunoterapii. Co pozitivního vyplývá z nových studií pro léčbu pacientů vysokého rizika je nejasné. Dle názoru autora je vhodné postupovat v monoterapii temsirolimem, neboť u něj je ve srovnání s interferonem alfa popsáno jasně delší celkové přežití. Sunitinib data pro populaci „poor risk“ nemá, proto jeho zařazení do nových studií coby srovnávacího léku této podskupiny je překvapením. Nové léky proti suboptimálnímu sunitinibu mírnou přednost vykazují, otázkou však je, jak by dopadly při srovnání s logicky indikovaným temsirolimem.
I když celkově může být vyznění pokroků trošičku rozpačité, rád bych zdůraznil jedno důležité optimistické pozorování. Při nasazení imunoterapie lze vypozorovat, že křivka přežití v recentních studiích nabývá charakteru plateau. Tedy lze předpokládat, že určitý podíl metastatických pacientů může být vyléčen, nebo minimálně je navozen stabilizovaný mnohaletý stav, kdy objem nádorové tkáně v těle není nulový, léčba je nutná, ale k progresi nemoci nedochází. Tedy, u části pacientů dochází ke změně průběhu nemoci z dříve fulminantního na chronický. Takových pacientů je v závislosti na studiích přibližně 25–30 %.
Konflikt zájmů: žádný.
adresa pro korespondenci:
doc. MUDr. Jan Novotný, PhD.
IKEM
Vídeňská 1958/9, 140 21 Praha 4
e-mail: jan.novotny@ikem.cz
Zdroje
1. Maruschke M, Aristotelis G, Anastasiadis, et al. Hakenberg Spontaneous regression of renal cell carcinoma: Reality or myth? World J Clin Urol 2014; 24 : 201–208.
2. Coppin C, Porzsolt F, Kumpf J, et al. Immunotherapy for advance renall cell cancer. Cochrane Database System Rev 2005; 1: CD001425.
3. Amin A, White RL. Interleukin-2 in Renal Cell Carcinoma: A hasbeen or a still-viable option? J Kidney Cancer VHL 2014; 1(7): 74–83.
4. Motzer RJ, Hutson TE, Tomczak P, et al. Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renall cell carcinoma. J Clin Oncol 2009; 27 : 3584–3590.
5. Motzer RJ, Hutson TE, Cella D, et al. Pazopanib versus sunitinib in metastatic renal-cell carcinoma. N Engl J Med 2013; 369 : 722–731.
6. Escudier B, Szczylik C, Hutson ET. Randomized phase II trial of first-line treatment with sorafenib versus interferon alfa-2a in patients with metastatic renal cell carcinoma. J Clin Oncol 2009; 27(8): 1280–1289.
7. Rini BI, Halabi S, Rosenberg JE, et al. Phase III trial of bevacizumab plus interferon alfa versus interferon alfa monotherapy in patients with metastatic renal cell carcinoma: final results of CALGB 90206. J Clin Oncol 2010; 28 : 2137–2143.
8. Escudier B, Bellmunt J, Negrier S, et al. Phase III trial of bevacizumab plus interferon alfa-2a in patients with metastatic renal cell carcinoma (AVOREN): final analysis of overall survival. J Clin Oncol 2010; 28 : 2144–2150.
9. Hudes G, Garducci M, Tomczak P, et al. Temsirolimus, interferon Alfa, or both for advanced renal-cell carcinoma. N Engl J Med 2007; 356 : 2271–2281.
10. George DJ, Hessel C, Halabi S, et al. Cabozantinib versus sunitinib for untreated patients with advanced renal cell carcinoma of intermediate or poor risk: subgroup analysis of the Alliance A031203 CABOSUN trial. Oncologist 2019; 24(11): 1497–1501.
11. Motzer RJ, Rini BI, McDermott DF, et al. Nivolumab plus ipilimumab versus sunitinib in first-line treatment for advanced renal cell carcinoma: extended follow-up of efficacy and safety results from a randomised, controlled, phase 3 trial. Lancet Oncol 2019; 20(10): 1370–1385.
12. Rini BI, Plimack ER, Stus V, et al. Pembrolizumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2019; 380 : 1116–1127.
13. Rini BI, Powles T, Atkins MB, et al. Atezolizumab plus bevacizumab versus sunitinib in patients with previously untreated metastatic renal cell carcinoma (IMmotion151): a multicentre, open-label, phase 3, randomised controlled trial. Lancet 2019; 393 : 2404–2415.
14. Motzer RJ, Penkov K, Haanen J, et al. Avelumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2019; 380 : 1103–1111.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2022 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Pacienti s medicínsky nevysvětlenými příznaky v ordinaci praktického lékaře
- Lamblióza, jedno z nejvýznamnějších parazitárních onemocnění na světě
- Vliv implementace doporučení ERAS na výsledky u pacientů v kolorektální chirurgii: retrospektivní a srovnávací studie
- Problematika podávání rizikových léčivých přípravků všeobecnou sestrou
- Metastatický karcinom ledviny: minulost a současnost
- Bronchogenní karcinom a screening karcinomu plic pohledem praktika – kazuistiky
- 11. červenec – Světový den populace
- Prof. MUDr. Julius Špičák, CSc. – životní jubileum
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Lamblióza, jedno z nejvýznamnějších parazitárních onemocnění na světě
- Bronchogenní karcinom a screening karcinomu plic pohledem praktika – kazuistiky
- Pacienti s medicínsky nevysvětlenými příznaky v ordinaci praktického lékaře
- Problematika podávání rizikových léčivých přípravků všeobecnou sestrou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



