-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Horečka dengue
Dengue fever
Dengue fever is considered to be the most widely spread arthropod-borne viral disease, which is present in many tropical and subtropical regions. Infection is produced by any of four closely related serotypes of dengue RNA virus, which belongs to the family Flaviviridae. The principal vectors of dengue are Aedes aegypti mosquitoes. Dengue represents one of the most frequently imported febrile tropical infections to developed countries from South and Southeast Asia and Latin America. The infestation with Aedes albopictus mosquitoes is considered as significant risk for the disease spread to new non-endemic regions. These mosquitoes are present even in southern Europe, where cases of autochthonous transmission have recently been described. Infection may be asymptomatic or presents as classical dengue fever or may lead to dengue haemorrhagic fever and shock syndrome. Severe infections are seen more frequently in young children and are usually associated with secondary infection with a different dengue serotype. Dengue has an incubation period of around 4 to 7 days. Typical symptoms are fever, arthralgia, myalgia, headache and maculopapular rash. Laboratory findings include leukocytopenia, thrombocytopenia and elevation of aminotransferases. Diagnosis can be confirmed by ELISA detection of IgM and IgG antibodies, however, recently methods of direct detection have been introduced such as detection of viral RNA or NS1 antigen, which are usually positive in the early febrile phase of dengue. There is no specific treatment available, future vaccines are intended for use especially for children living in the endemic areas.
Keywords:
dengue – tropical medicine – imported infections – fever
Autoři: M. Trojánek 1; V. Marešová 1; F. Stejskal 1,2,3
Působiště autorů: I. infekční klinika, 2. LF UK v Praze a Nemocnice Na Bulovce, Praha Přednosta: doc. MUDr. Dušan Pícha, CSc. 1; Infekční oddělení, Krajská nemocnice Liberec Primář: MUDr. Adam Vitouš 2; Ústav imunologie a mikrobiologie, 1. LF UK v Praze a VFN, Praha Přednostka: prof. RNDr. Libuše Kolářová, CSc. 3
Vyšlo v časopise: Prakt. Lék. 2013; 93(4): 163-168
Kategorie: Postgraduální vzdělávání
Souhrn
Horečka dengue je celosvětově nejrozšířenější arbovirovou nákazou, která se vyskytuje ve většině zemí tropů a subtropů. Onemocnění vyvolávají čtyři blízce příbuzné sérotypy RNA viru dengue, který náleží do čeledi Flaviviridae. Rezervoárem nákazy je člověk ve viremickém stadiu onemocnění, vektorem infekce jsou antropofilní komáři Aedes aegypti a další komáři z rodu Aedes. Nákaza virem dengue představuje jedno z nejčastěji importovaných horečnatých onemocnění do vyspělých zemí z oblasti jihovýchodní a jižní Asie a Latinské Ameriky. Za významné riziko pro šíření infekce do nových oblastí je považován výskyt příbuzných komárů Aedes albopictus, jež se vyskytují i v řadě oblastí jižní Evropy, kde byly v posledních letech popsány případy autochtonního přenosu horečky dengue. Nákaza může proběhnout asymptomaticky, případně jako nekomplikované horečnaté onemocnění nebo pod obrazem hemoragické horečky, která může vést k rozvoji šokového stavu. Nejtěžší formy onemocnění se vyskytují zejména v dětském věku a v souvislosti s opakovanou infekcí jiným sérotypem viru dengue. Inkubační doba onemocnění je obvykle 4–7 dní. Mezi typické příznaky patří horečka, bolesti kloubů, svalů, hlavy a výsev makulopapulózního exantému. Onemocnění je doprovázeno leukocytopenií, trombocytopenií a elevací jaterních aminotransferáz. Pro diagnostiku infekce se rutinně využívá detekce IgM a IgG protilátek metodou ELISA, avšak v poslední době nabývají na významu metody přímé detekce viru (průkaz virové RNA a NS1 antigenu). Jejich výhodou je pozitivita již v časných stadiích onemocnění. Specifická terapie není dostupná, vyvíjené vakcíny budou určeny k prevenci onemocnění malých dětí v endemických oblastech.
Klíčová slova:
dengue – tropická medicína – importované infekce – horečnatá onemocněníÚVOD
Horečka dengue je celosvětově nejrozšířenější arbovirovou nákazou. Výskyt tohoto onemocnění byl zaznamenán již v 101 zemích (1) a udává se, že v oblastech s endemickým výskytem žije více než 2,5 miliardy lidí (2).
První zmínky o onemocnění, které svým popisem připomínalo horečku dengue, pochází z Číny z období dynastie Jin (přibližně 265–420 n. l.). Zajímavé je, že nalezený rukopis zmiňuje asociaci horečnaté nákazy s „otrávenou vodou“, která vedla k pomnožení létajícího hmyzu. Epidemie nemoci velmi podobné horečce dengue byly popsány v letech 1635 a 1699 v Karibiku a v letech 1779 a 1780 v Asii, Africe a Severní Americe. První věrohodný popis onemocnění však podal až Benjamin Rush v roce 1789, který nákazu pojmenoval „nemoc lámající kosti“ („breakbone fever“) (3).
Zvýšený výskyt těžkých forem dengue je zaznamenáván od druhé poloviny 20. století. První rozsáhlé epidemie hemoragické formy byly popsány v padesátých letech v jihovýchodní Asii a v osmdesátých letech v Latinské Americe. Odhaduje se, že každý rok se nakazí více než 50 milionů osob, z nichž se přibližně u 500 000 rozvine hemoragická horečka nebo šokový stav a 22 000 nemoci podlehne. Mezi nejohroženější skupinu patří děti a infekce vyvolané virem dengue představují jednu z nejvýznamnějších příčin nemocnosti a úmrtnosti u dětí, zejména v jihovýchodní Asii (4).
Import horečky dengue do Evropy je častý a počet diagnostikovaných případů neustále narůstá (5, 6), což platí i pro Českou republiku. V roce 2012 bylo do systému EPIDAT (SZÚ) hlášeno 29 případů horečky dengue, tedy více než případů malárie, kterých bylo 27. Skutečné počty jsou zřejmě vyšší, neboť ne všechny případy jsou diagnostikovány a hlášeny. V Nemocnici Na Bulovce bylo od ledna 2004 do prosince 2012 diagnostikováno celkem 91 případů onemocnění, z toho 71 pacientů bylo vyšetřeno v akutní horečnaté fázi. Zřetelný nárůst jsme zaznamenali zejména v poslední době, v letech 2011 a 2012 bylo z výše uvedeného počtu diagnostikováno 41 případů.
PŮVODCE NÁKAZY
Původcem horečky dengue jsou čtyři blízce příbuzné typy viru dengue, který náleží do rodu Flavivirus z čeledi Flaviviridae. Do této čeledi patří další významní původci jako např. virus žluté zimnice, západonilské horečky, japonské encefalitidy nebo klíšťové encefalitidy. Viriony mají sférickou ikosahedrickou nukleokapsidou o průměru 45 nm obalenou lipidovou dvojvrstvou. Genom viru je tvořen jednořetězcovou nesegmentovanou RNA pozitivní polarity o velikosti přibližně 11 000 nukleotidů, která kóduje 10 virových proteinů. Mezi čtyřmi antigenně odlišnými, ale geneticky blízce příbuznými typy viru dengue 1–4, je udávána asi 65–70% sekvenční homologie (7).
Virion tvoří tři strukturální proteiny: malý bazický kapsidický (C), obalový (E) a membránový (M) protein. Virový obal je tvořen fosfolipidovou dvojvrstvou, která pochází z endoplazmatického retikula hostitelské buňky, a k ní jsou připojeny E a M proteiny. Glykosylovaný E protein je zodpovědný za adhezi viru k hostitelské buňce, následnou fúzi a je také hlavním cílem neutralizačních protilátek. Tento protein patří mezi vysoce konzervativní strukturální flavivirové proteiny a případné mutace mají vliv na virulenci kmene (8). Přítomnost zkříženě reaktivních protilátek proti doméně E proteinu, které nemají neutralizační schopnost, je spojena s významně vyšším rizikem rozvoje hemoragické formy při sekundární nákaze jiným sérotypem viru (9).
Virus je dále tvořen sedmi nestrukturálními proteiny. Protein NS 1 se uplatňuje zejména v časných stadiích replikace a zřejmě se podílí i na skládání a maturaci virových partikulí. Exprimuje se časně ve velkém množství a jeho přítomnost v séru se využívá k rychlé diagnostice nákazy (10).
EPIDEMIOLOGIE A VEKTOR NÁKAZY
Vektorem infekce jsou samice komárů rodu Aedes, především Aedes aegypti, který je velmi dobře adaptovaný na lidské prostředí. Komáři se množí v nevelkých vodních zdrojích, např. různých vodních zásobnících, tancích, cisternách, ve vázách, odpadcích, jako jsou lahve, plastové kontejnery, pneumatiky apod. Vajíčka mohou odolávat vysychání po celé týdny až měsíce. Larvální stadium trvá 7–9 dní, stadium kukly pak 2–3 dny (7). Komáři jsou aktivní zejména ve dne, k poštípání dochází nejčastěji v brzkých ranních hodinách nebo pozdě odpoledne (11).
Dalším komárem, který se může uplatnit jako vektor nákazy, je Aedes albopictus, který se adaptoval na lidské prostředí a rozšířil se po celé Asii, do USA, na většinu území Střední a Jižní Ameriky a do některých oblastí Afriky a jižní Evropy (12).
Existuje i sylvatický cyklus viru dengue. Na přenosu se podílí komáři A. niveus, A. africanus, A. furcifer a hostiteli jsou opice rodu Macaca, Presbytis, Cercopithicus a Papio (13). Epizoocie nákazy se vyskytují v jihovýchodní Asii i západní Africe. Během těchto epizoocií byl zaznamenán i přenos na člověka, i když v cirkulaci viru zřejmě nehraje významnější roli (14).
Horečka dengue se vyskytuje ve více než 100 zemích světa. Onemocnění je rozšířeno v oblastech tropů a subtropů všech kontinentů s výjimkou Evropy a některých oblastí Afriky. Mezi nejrizikovější regiony patří jižní a jihovýchodní Asie, západní Pacifik, Střední a Jižní Amerika a Karibik (15).
V Asii došlo k významnému rozšíření horečky dengue zejména po druhé světové válce, kdy byla zahájena rozsáhlá urbanizace a došlo k nárůstu populace. V Americe se onemocnění vyskytuje typicky sezonně, v posledních 30 letech byl zaznamenán téměř pětinásobný nárůst počtu případů. V letech 2002 a 2008 proběhly rozsáhlé epidemie v hustě osídlené oblasti kolem Rio de Janeiro, v roce 2009 v Bolívii a nejnověji také v severních oblastech Argentiny, kde se onemocnění vyskytuje i v okolí Buenos Aires. V Africe je v posledním desetiletí popsán zvýšený výskyt horečky dengue zejména na západě kontinentu (16).
V Evropě poslední epidemie horečky dengue proběhla v Řecku v letech 1927–1928. Nákaza se v současné době v Evropě endemicky nevyskytuje, avšak v řadě oblastí jižní Evropy jsou přítomni komáři A. albopictus, takže i zde existuje riziko přenosu a šíření nákazy. V srpnu 2010 byla popsána nákaza virem dengue u německého občana, který trávil dovolenou v Chorvatsku a v září 2010 u dvou pacientů, kteří pobývali v okolí Nice na jihu Francie (6).
RIZIKO NÁKAZY PRO TURISTY
Řada endemických oblastí dengue patří mezi oblíbené turistické destinace. Riziko nákazy stoupá zejména v období dešťů, kdy se zvyšuje i populace komárů. Nákaza virem dengue tvoří přibližně 6 % ze všech případů importovaných horečnatých onemocnění. Do Evropy je onemocnění nejčastěji importováno z oblasti jihovýchodní Asie, indického subkontinentu, Latinské Ameriky, Karibiku a Afriky (17).
Pro turisty představuje zvýšené riziko komplikovaného průběhu sekundární nákaza virem dengue, fatální případy byly zaznamenány v Německu, Norsku i Finsku (18–20).
Případy horečky dengue diagnostikované v Nemocnici Na Bulovce byly nejčastěji importovány z Thajska (29), Indonésie (15), Indie (14), Malediv (10), Vietnamu (6), dalších zemí jižní a jihovýchodní Asie (5) a Latinské Ameriky (11). V jednom případě byla nákaza prokázána u cestovatele ze západní Afriky, z Rovníkové Guiney.
PATOFYZIOLOGIE ZÁVAŽNÝCH FOREM
U klasické i hemoragické formy nákazy dochází během inkubační doby onemocnění k primárnímu pomnožení viru v dendritických a Langerhansových buňkách v blízkosti místa vstupu viru do organismu, dále se virus množí v buňkách monocyto-makrofágového systému a lymfocytech (21). V případě hemoragické horečky dengue a šokového stavu dochází ke zvýšení vaskulární permeability bez morfologických známek poškození kapilárního endotelu. Přestože je onemocnění nazýváno hemoragickou horečkou, je toto označení zavádějící, neboť v patofyziologii se uplatňuje zejména únik tekutin z kapilár a následná hemokoncentrace, hypoproteinémie, tvorba výpotků v serózních dutinách, hypotenze a rozvoj hypovolemického šoku. Předpokládá se, že zvýšená permeabilita kapilár je způsobena nadprodukcí vazoaktivních prozánětlivých cytokinů a jejich hladina koreluje s tíží příznaků (22). Dále dochází k rozvoji trombocytopenie, leukocytopenie, změnám v hemostatických mechanismech a jaternímu poškození (2).
Patogenetické mechanismy, které vedou k rozvoji těžkých forem horečky dengue, nebyly dosud přesně objasněny. Jelikož k rozvoji těžkých a komplikovaných forem nedochází během akutní horečnaté fáze, ale až během poklesu teploty, byla vyslovena teorie, že na patogenezi má výrazný vliv imunitní odpověď hostitele (23).
Mezi nejčastěji uváděné teorie vzniku hemoragické a šokové formy horečky dengue patří usnadnění replikace viru přítomností zkříženě reaktivních protilátek, které však nemají neutralizační schopnost, při sekundární infekci jiným sérotypem viru (tzv. ADE –„antibody-dependent enhancement“). Po již prodělané nákaze se totiž zkříženě reagující protilátky vážou na E protein viru a usnadňují vstup viru do buněk, které exprimují Fc-receptor, čímž dochází ke zvýšení počtu infikovaných monocytů a makrofágů. Zároveň je usnadněna replikace viru uvnitř infikovaných buněk, hodnoty virémie jsou 10–100krát vyšší u hemoragické formy ve srovnání s klasickou horečkou dengue. Stejný mechanismus se uplatňuje i u kojenců ve věku 4–12 měsíců, kteří se narodí matkám po prodělané horečce dengue (24).
Zastoupení hemoragických forem nákazy se liší mezi jednotlivými sérotypy. V případě primární infekce sérotypem 1 nebo 3 přibližně 2krát častěji dojde k rozvoji těžké hemoragické formy. V případě sekundární nákazy je riziko rozvoje hemoragické formy nejvyšší při infekci sérotypem 2. Nejmenší riziko rozvoje komplikovaných forem bylo pozorováno u sérotypu 4 (25).
PŘÍZNAKY ONEMOCNĚNÍ
Infekce virem dengue může být zcela asymptomatická, proběhnout jako lehké, nespecifické horečnaté onemocnění nebo pod obrazem klasické horečky dengue či závažné hemoragické horečky s rozvojem šokového stavu. U dětí je nákaza virem často asymptomatická, zatímco u starších dětí a dospělých probíhá spíše pod obrazem klasické horečky dengue (22).
Inkubační doba nákazy je 4–7 dní, výjimečně může být i více než 10 dní. Poté dochází náhle k rozvoji horečnatého stavu doprovázeného značnou únavou až celkovou slabostí, bolestmi svalů, kloubů a frontální nebo retroorbitální bolestí hlavy a fotofobií. Horečka trvá 2–7 dní, může dosahovat i hyperpyretických hodnot, často bývá bifazická a doprovázena relativní bradykardií (3). Nakažení mívají nechutenství, dysgeusii, nauzeu, případně zvrací, mohou udávat i četnější řídké až vodnaté stolice (26). Onemocnění je doprovázeno překrvením spojivek, zarudnutím a bolestí v krku, cervikální lymfadenopatií, eventuálně mírnou hepatomegalií. Mnohem častěji se však vyskytují kožní příznaky, které jsou popisovány až u poloviny postižených. Těsně před nebo spolu s nástupem horečky dochází k rozvoji výrazného faciálního erytému nebo erytematózního mramorování, které mizí za 1–2 dny. Obvykle po poklesu teploty dochází k výsevu skarlatiniformního až morbiliformního makulopapulózního exantému, který obvykle začíná na trupu, šíří se na tváře a končetiny, vynechává však dlaně a chodidla a přetrvává obvykle 2–3 dny (27). U dospělých jsme často pozorovali přítomnost intenzivně svědícího erytému na dlaních a ploskách chodidel, který byl doprovázen slupováním kůže v postižených oblastech. U některých pacientů je na kůži přítomné typické penízkovatění, což je označení pro výskyt drobných bílých ostrůvků velikosti menší mince v rozsáhlých erytematózních oblastech (28) (obr. 1). U dětí bývají přítomny častěji než u dospělých nespecifické příznaky jako kašel, bolesti břicha a zvracení (23). Součástí klinického obrazu nekomplikované horečky dengue mohou být i mírné krvácivé projevy jako např. epistaxe, krvácení z dásní, případně ke konci horečnaté fáze nebo krátce v období rekonvalescence může dojít k výsevu drobných petechií až splývavých sufuzí (29). Klasická horečka dengue bývá benigní a samoúzdravné onemocnění, avšak rekonvalescence může trvat i několik týdnů a může ji komplikovat sklon k depresím (3, 22). Frekvence příznaků, které jsme pozorovali v našem souboru pacientů, je uvedena v tabulce 1.
Obr. 1. Kožní nález tzv. penízkovatění („white islands in a sea of red“) u pacienta s akutní horečkou dengue 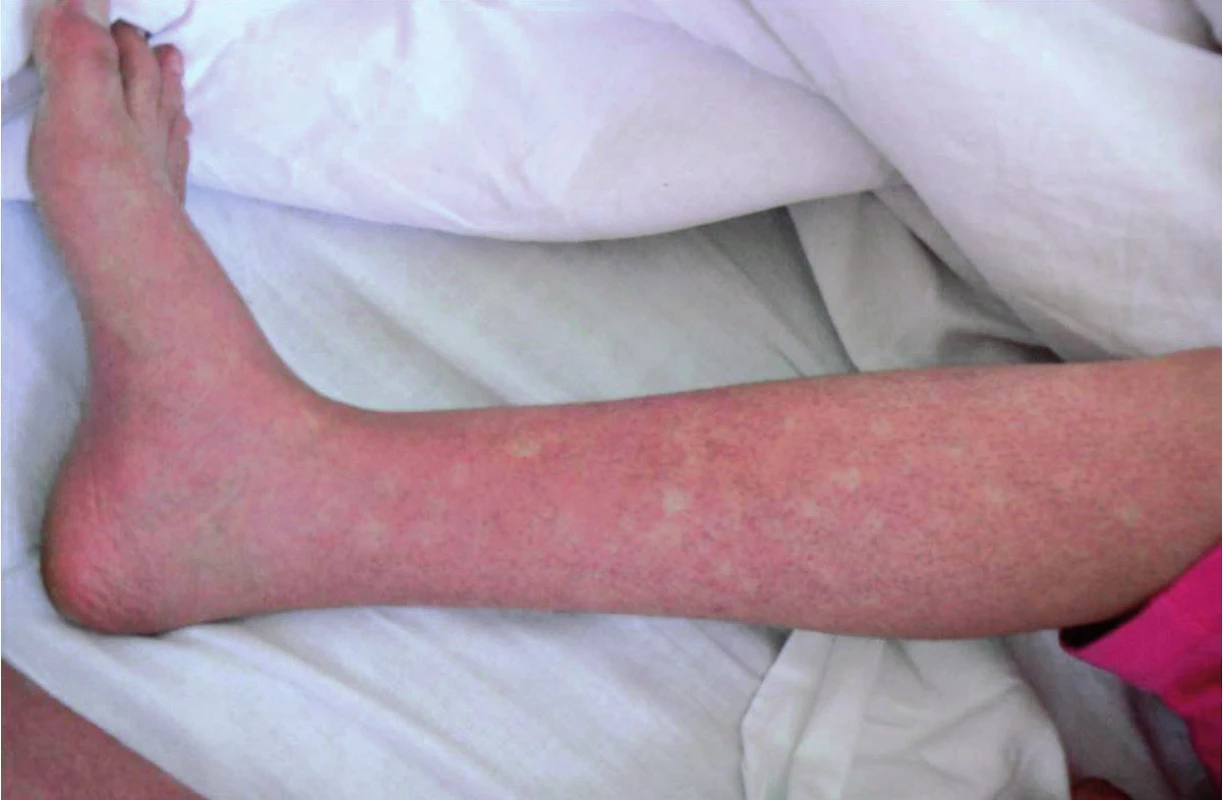
Tab. 1. Příznaky horečky dengue u 91 pacientů ošetřených v Nemocnici Na Bulovce 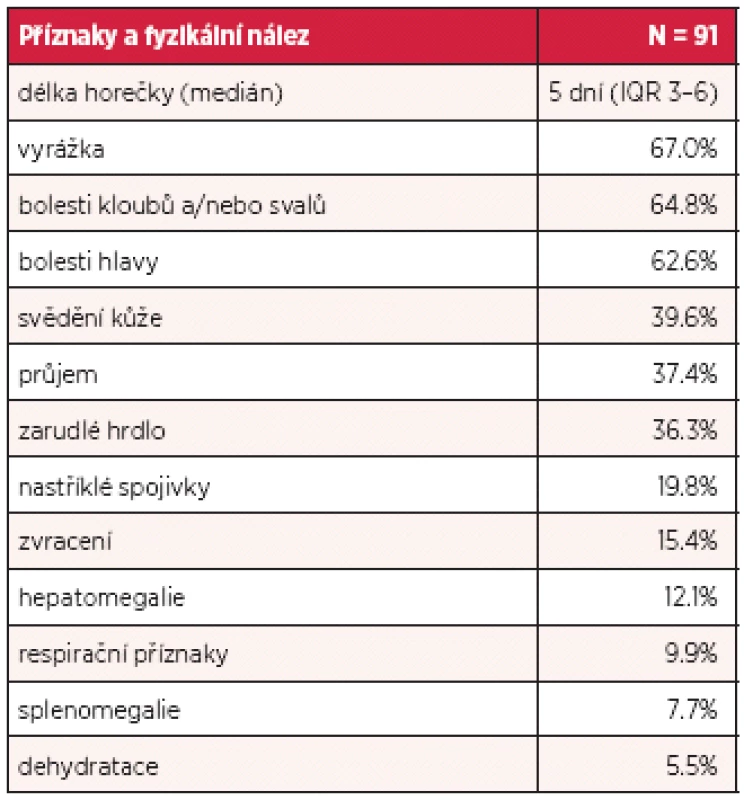
Hemoragická forma onemocnění se na rozdíl od klasické horečky dengue vyskytuje typicky u dětí mladších 15 let, které pobývají dlouhodobě v endemických a hyperendemických oblastech, tj. oblastech, ve kterých dochází k současné cirkulaci dvou či více různých sérotypů viru. K rozvoji onemocnění však může dojít i u dospělých. U cestovatelů tvoří hemoragická horečka až 3 % případů (29).
Podle definice WHO je tato forma nákazy charakterizována vysokou horečkou, krvácivými projevy, hemokoncentrací a oběhovým selháním. Počáteční příznaky hemoragické horečky jsou obdobné jako u klasické formy nákazy. K rozvoji hemoragické symptomatologie, případně oběhového selhání, dochází typicky mezi 2.–9. dnem od počátku příznaků, přibližně ve stejné době, kdy dochází k poklesu teploty. Velmi často je začátek komplikované formy doprovázen významným poklesem počtu trombocytů (< 100 000/µl) a vzestupem hematokritu. Někdy může být ještě před rozvojem komplikací přítomna cirkumorální cyanóza, studená mramorovaná kůže, mělký pulz s tachykardií. Hemoragická diatéza se manifestuje nejčastěji jako petechie až sufuze, ekchymózy, méně často pak jako epistaxe, krvácení z dásní nebo hemateméza či meléna. Prognóza mírné formy hemoragické horečky dengue je příznivá, k úpravě stavu může dojít i spontánně, případně po parenterálním dodání tekutin. Naopak u těžších případů dochází k rychlému multiorgánovému selhání a úmrtí i do několika hodin od začátku příznaků. Smrtnost při rozvoji šokového stavu dosahuje až 40 % (30).
Původní klasifikace nákazy zahrnovala klasickou horečku dengue, hemoragickou horečku a šokový stav vyvolaný virem dengue. Dle poslední revize klasifikace by onemocnění mělo být děleno na dengue s přítomností nebo bez varovných znaků a těžkou horečku dengue definovanou závažným kapilárním únikem, těžkým krvácením a orgánovým postižením (tab. 2) (31).
Tab. 2. Současná klasifikace horečky dengue dle WHO (2009) 
LABORATORNÍ NÁLEZY
U případů horečky dengue bývá obvykle v krevním obraze leukocytopenie, která je způsobená výraznou neutropenií doprovázenou relativní lymfocytózou, často s přítomností atypických lymfocytů. K poklesu v bílé řadě krevního obrazu dochází obvykle během febrilního stádia, nejčastěji však 1–2 dny před poklesem horeček. Pro nákazu je typická i výrazná trombocytopenie, ke které dochází v době defervescence. Z biochemických parametrů bývá u nakažených popisována mírná hyponatrémie a elevace aminotransferáz, která je obvykle mírného stupně, ale u některých pacientů může dosáhnout i relativně vysokých hodnot (8–16 µkat/l) (3). Bylo prokázáno, že vyšších hodnot dosahuje aktivita AST v porovnání s ALT, což je vysvětlováno současným poškozením monocytů a myocytů. Bilirubin nebo GMT a ALP bývají zvýšeny jen zřídka. Nejvyšší hodnoty aminotransferáz bývají zachyceny až po poklesu teplot, obvykle kolem 9. dne od začátku onemocnění, k normalizaci u zdravých jedinců dochází většinou do 3 týdnů (32).
DIAGNOSTIKA
Mezi základní metody, které jsou využívány v diagnostice nákazy virem dengue, patří detekce virově specifických protilátek třídy IgM a IgG, virových genomových sekvencí založená na amplifikaci virové RNA pomocí reverzní transkripce (RT-PCR), přímý průkaz nestrukturálního antigenu NS1, případně izolace viru na tkáňových kulturách či průkaz viru v séru nebo moči pomocí elektronové mikroskopie (TEM).
Během několika dní, obvykle od 5. dne od začátku horečky, začíná produkce protilátek třídy IgM, která vrcholí kolem 14. dne od začátku příznaků. Protilátky IgM bývají nedetekovatelné za 2–3 měsíce (33). S odstupem začíná i syntéza protilátek IgG, které jsou sérotypově specifické.
Sérologické metody jsou poměrně spolehlivé pro retrospektivní průkaz infekce virem dengue při vyšetření párových vzorků. Pokud je vyšetření prováděno pouze z jednoho vzorku, je zatíženo určitou mírou falešně pozitivních výsledků způsobených nespecifickou IgM odpovědí a zkříženou reaktivitou s jinými flaviviry ve třídě IgG (34). Průkaz onemocnění pomocí sérologických metod se nejčastěji provádí metodou ELISA, dále je možné využít hemaglutinačně-inhibičního testu, virus-neutralizačního testu nebo komplement-fixační reakce (33).
Molekulárně-biologické metody (RT-PCR) patří mezi základní a nepostradatelné metody v diagnostice akutní nákazy virem dengue. Mezi nesporné výhody RT-PCR patří vysoká senzitivita a specificita této metody. Dále umožňuje odlišit jednotlivé sérotypy viru a molekulárně-epidemiologická analýza izolovaných kmenů zároveň poskytuje důležité informace pro sledování šíření nákazy v endemických oblastech. Jejich nevýhodou je poměrně vysoká cena (27).
Nově zavedenou a velmi slibnou metodou v diagnostice onemocnění je detekce NS1 antigenu viru metodou ELISA. Bylo prokázáno, že metoda má vysokou senzitivitu, která je srovnatelná s molekulárně-biologickými metodami (35).
LÉČBA
V současné době není k dispozici specifická kauzální antivirová terapie, proto je léčba onemocnění pouze symptomatická. Klasická horečka dengue je léčena zejména antipyretiky, dostatečným přísunem tekutin a klidem na lůžku. Z antipyretik se doporučuje paracetamol, neměly by se podávat salicyláty, případně jiná nesteroidní antiflogistika (ibuprofen, metamizol a další).
V případě hemoragické a šokové formy nákazy bylo jednoznačně prokázáno, že včasné hrazení ztrát tekutin krystaloidními, koloidními roztoky nebo plazmou významně snižuje smrtnost onemocnění. Rychlá náhrada tekutin je zároveň prevencí rozvoje diseminované intravaskulární koagulopatie (36).
Diskutovanou otázkou je užití kortikosteroidů v léčbě těžkých forem horečky dengue, avšak bylo prokázáno, že jejich užití nevede ke snížení smrtnosti onemocnění.
PREVENCE
Prevence a kontrola nákazy virem dengue je odvislá zejména od kontroly rozšíření vektoru nákazy, především komárů Aedes aegypti. Bohužel programy na snížení infestace území komáry nejsou příliš úspěšné. Účinnou metodou představuje eliminace vhodného prostředí k vývoji larev v okolí domovů a měst, ať už odstraněním vodních rezervoárů, jejich čištěním nebo aplikací insekticidů (22).
Pro snížení rizika nákazy je cestovatelům doporučována ochrana před poštípáním komáry. Vhodné je užívání účinných repelentů (přípravky s 50% DEET nebo s 20% icaridinem), impregnace oblečení insekticidy a užívání impregnovaných moskytiér (29, 35).
V současné době není dostupná vakcína pro aktivní imunizaci proti infekci virem dengue, ale bylo vyvinuto několik slibných kandidátních vakcín, které jsou v různých fázích klinického testování. Ve vývoji jsou živé atenuované tetravalentní a monovalentní vakcíny, tetravalentní chimérické, inaktivované, rekombinantní podjednotkové a DNA vakcíny. Mezi základní požadavky na potenciální očkovací látku patří: ochrana před všemi čtyřmi sérotypy viru (tetravalentní formulace), bezpečnost, použitelnost u kojenců (9–12 měsíců věku) a dlouhotrvající ochrana po očkování (37).
ZÁVĚR
Přestože řada onemocnění probíhá mírně, neměla by tato infekce být opomenuta v diferenciální diagnostice, neboť opakovaná nákaza virem dengue, může vést i k rozvoji život ohrožujícího šokového stavu. Za důležité je považováno zlepšení diagnostického přístupu, zejména u akutních případů, kdy by měly být upřednostňovány metody přímého průkazu. Význam sledování importovaných případů a molekulárně-biologická genotypizace vyvolávajících kmenů viru přispívají k pochopení epidemiologie nákazy a cirkulaci jednotlivých endemických oblastech. Výzkum v této oblasti je prioritou ECDC, protože opakovaně prokázaný autochtonní přenos nákazy v oblastech jižní Evropy představuje riziko i pro ostatní populaci.
Poděkování
Autoři článku by chtěli poděkovat zejména MUDr. Zdeně Manďákové a MUDr. Doře Tomíčkové za pomoc při získávání klinických dat u pacientů ošetřených v Nemocnici Na Bulovce a poskytnutí obrazové dokumentace a Mgr. Naděždě Sojkové a Janu Maixnerovi z Oddělení virologie v Praze Zdravotního ústavu se sídlem v Ústí nad Labem za nadstandardní spolupráci při sledování případů horečky dengue a poskytnutí virologických dat.
ADRESA PRO KORESPONDENCI:
MUDr. Milan Trojánek
I. infekční klinika 2. LF UK a Nemocnice Na Bulovce
Budínova 2, 180 81 Praha 8
e-mail: milan.trojanek@bulovka.cz
Zdroje
1. Rigau-Perez JG, Clark GG, Gubler DJ, et al. Dengue and dengue haemorrhagic fever. Lancet 1998; 352(9132): 971–977.
2. Oishi K, Saito M, Mapua CA, et al. Dengue illness: clinical features and pathogenesis. J Infect Chemother 2007; 13(3): 125–133.
3. Ooi EE, Dubler GD. Dengue and dengue hemorrhagic fever. In Guerrant RL, et al. Tropical Infectious Diseases. 3rd Ed. Edinburgh: Elsevier 2011; 504–510.
4. McBride WJ, Bielefeldt-Ohmann H. Dengue viral infections; pathogenesis and epidemiology. Microbes Infect 2000; 2(9): 1041–1050.
5. Ryan ET, Wilson ME, Kain KC. Illness after international travel. N Engl J Med 2002; 347(7): 505–516.
6. Gould EA, Gallian P, De Lamallerie X, et al. First cases of autochthonous dengue fever and chikungunya fever in France: from bad dream to reality! Clin Microbiol Infect 2010; 16(12): 1702–1704.
7. Halstead SB. Dengue. London: Imperial College Press 2008 : 29–83. Ser. Tropical Medicine: Science and Practice. Vol. V. ISBN 10 - 1-84816-228-6.
8. Chen Y, Maguire T, Marks RM. Demonstration of binding of dengue virus envelope protein to target cells. J Virol 1996; 70(12): 8765–8772.
9. Lai CY, Tsai WY, Lin SR, et al. Antibodies to envelope glycoprotein of dengue virus during the natural course of infection are predominantly cross-reactive and recognize epitopes containing highly conserved residues at the fusion loop of domain II. J Virol 2008; 82(13): 6631–6643.
10. Basu A, Chaturvedi UC. Vascular endothelium: the battlefield of dengue viruses. FEMS Immunol Med Microbiol, 2008; 53(3): 287–299.
11. Wang E, Ni H, Xu R, et al. Evolutionary relationships of endemic/epidemic and sylvatic dengue viruses. J Virol 2000; 74(7): 3227–3234.
12. Gubler DJ, Rosen L. Variation among geographic strains of Aedes albopictus in susceptibility to infection with dengue viruses. Am J Trop Med Hyg 1976; 25(2): 318–325.
13. Rudnick A. Ecology of dengue viruses. Asian J Infect Dis 1978; 2 : 156–160.
14. Diallo M, Ba Y, Sall AA, et al. Amplification of the sylvatic cycle of dengue virus type 2, Senegal, 1999-2000: entomologic findings and epidemiologic considerations. Emerg Infect Dis 2003; 9(3): 362–367.
15. Kuno G. Research on dengue and dengue-like illness in East Asia and the Western Pacific during the first half of the 20th century. Rev Med Virol 2007; 17(5): 327–341.
16. Guzman A, Isturiz RE. Update on the global spread of dengue. Int J Antimicrob Agents 2010; 36(Suppl 1): S40–42.
17. Bulugahapitiya U, Siyambalapitiya S, Seneviratne SL, et al. Dengue fever in travellers: a challenge for European physicians. Eur J Intern Med 2007; 18(3): 185–192.
18. Huhtamo E, Vuorinen S, Uzcategui NY, et al. Fatal dengue virus infection in a Finnish traveler. J Clin Virol 2006; 37(4): 323–326.
19. Schmidt-Chanasit J, Tenner-Racz K, Poppert D, et al. Fatal dengue hemorrhagic fever imported into Germany. Infection 2012; 40(4): 441–443.
20. Vainio K, Noraas S, Holmberg M, et al. Fatal and mild primary dengue virus infections imported to Norway from Africa and south-east Asia, 2008-2010. Euro Surveill 2010; 15(38): 1–4.
21. Wu SJ. Human skin Langerhans cells are targets of dengue virus infection. Nat Med 2000; 6(7): 816–820.
22. Murgue B. Severe dengue: questioning the paradigm. Microbes Infect 2010; 12(2): 113–118.
23. Whitehorn J, Simmons CP. The pathogenesis of dengue. Vaccine 2011; 29(42): 7221–7228.
24. Hammon WM, Rudnick A, Sather GE. Viruses associated with epidemic hemorrhagic fevers of the Philippines and Thailand. Science 1960; 131(3407): 1102–1103.
25. Murrell S, Wu SC, Butler M. Review of dengue virus and the development of a vaccine. Biotechnol Adv. 2011; 29(2): 239–247.
26. Wichmann O, Mühlberger N, Jelinek T. Dengue-the underestimated risk in travellers. Dengue Bull 2003; 27 : 126–137.
27. Kurane I, Takasaki T. Dengue fever and dengue haemorrhagic fever: challenges of controlling an enemy still at large. Rev Med Virol 2001; 11(5): 301–311.
28. Hayes EB, Gubler DJ. Dengue and dengue hemorrhagic fever. Pediatr Infect Dis J 1992; 11(4): 311–317.
29. Wichmann O, Jelinek T. Dengue in travelers: a review. J Travel Med 2004; 11(3): 161–170.
30. Gibbons, R. V., Vaughn, D. W. Dengue: an escalating problem. BMJ, 2002, 324(7353): 1563–1566.
31. Deen JL, Harris E, Wills B, et al. The WHO dengue classification and case definitions: time for a reassessment. Lancet 2006; 368(9530): 170–173.
32. Gulati S, Maheshwari A. Atypical manifestations of dengue. Trop Med Int Health 2007; 12(9): 1087–1095.
33. Teles FR, Prazeres DM, Lima-Filho JL. Trends in dengue diagnosis. Rev Med Virol 2005; 15(5): 287–302.
34. Wichmann O, Stark K, Shu PY, et al. Clinical features and pitfalls in the laboratory diagnosis of dengue in travellers. BMC Infect Dis 2006; 6 : 120.
35. Halstead SB. Dengue. Lancet 2007; 370(9599): 1644–1652.
36. Dung NM, Day NP, Tam DT, et al. Fluid replacement in dengue shock syndrome: a randomized, double-blind comparison of four intravenous-fluid regimens. Clin Infect Dis 1999; 29(4): 787–794.
37. Schmitz J, Roehrig J, Barrett A, et al. Next generation dengue vaccines: a review of candidates in preclinical development. Vaccine 2011; 29(42): 7276–7284
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2013 Číslo 4- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Lokální antiseptická terapie faryngitidy – účinnost oktenidinu a zachování integrity střevní mikrobioty
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Ženský a mužský mozek
- XXI. BRNĚNSKÉ DNY PRAKTICKÉHO LÉKAŘSTVÍ
- Využití nepřímé radionuklidové uroflowmetrie
- Nutriční imunologie: modulace imunity složkami nutrice
- Horečka dengue
- Plánované akce složek ČLS JEP
-
Personalizovaná medicína chronické obstrukční plicní nemoci
Souhrn nového doporučeného postupu České pneumologické a ftizeologické společnosti - Vybrané údaje o dlouhodobé péči a sociálních službách
- Chlorochinová retinopatie: kazuistika a doporučení pro screening
- MUDr. Vladislav Vančura – spisovatel padlý v boji za svobodu
- Evžen Ponča
- Víte o vzniku Centra zdravotní ekonomie a managementu?
- 55. Purkyňův den v Libochovicích
- Jubilanti
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chlorochinová retinopatie: kazuistika a doporučení pro screening
- Ženský a mužský mozek
- Horečka dengue
- Jubilanti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



