-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Idiopatická trombocytopenická purpura
Idiopathic thrombocytopenic purpura
Idiopathic thrombocytopenic purpura (ITP) is a disease commonly seen by the haematologist. The incidence of ITP is 6 patients per 100 000 people a year. Children, usually suffering from the acute form of ITP, represent approximately half of these patients. On the other hand, the majority of adult patients require repeated therapeutic intervention because of recurrent chronic ITP associated with severe thrombocytopenia. It normally affects adults between 50 and 60 years of age. Many elderly patients have a significant comorbidity and their health status can be made worse with haematological treatment. Patients with active ITP accompanied with significant thrombocytopenia may often have to be referred back to various specialists to modify some diagnostic and therapeutic approaches.
Key words:
idiopathic thrombocytopenic purpura, corticosteroids, immunoglobulins, anti-D globulin, splenectomy, rituximab.
Autoři: L. Raida; A. Hluší; J. Procházková; J. Juráňová
Působiště autorů: Přednosta: Prof. MUDr. Karel Indrák, DrSc. ; Fakultní nemocnice Olomouc ; Hemato-onkologická klinika ; Lékařská fakulta Univerzity Palackého, Olomouc
Vyšlo v časopise: Prakt. Lék. 2008; 88(12): 690-694
Kategorie: Přehledy
Souhrn
Idiopatická trombocytopenická purpura (ITP) je onemocněním, se kterým se klinický hematolog denně setkává ve své praxi. Incidence ITP je 6 nemocných na 100 000 obyvatel, přičemž téměř polovinu pacientů představují děti s dominující akutní formou onemocnění. ITP dospělých je zastoupena převážně formou chronickou, často vyžadující opakované léčebné intervence pro recidivy těžké trombocytopenie. Věkový medián dospělých pacientů se pohybuje mezi 50–60 lety a u řady seniorů je klinická situace komplikována dalšími onemocněními, jejichž průběh může být zhoršen hematologickou léčbou. Aktivní ITP s významnou trombocytopenií tak nejednou nutí lékaře různých specializací modifikovat u těchto pacientů některé diagnostické nebo léčebné postupy.
Klíčová slova:
idiopatická trombocytopenická purpura, kortikosteroidy, imunoglobuliny, anti-D globulin, splenektomie, rituximab.Idiopatická trombocytopenická purpura (ITP) je autoimunitním onemocněním, charakterizovaným sníženým počtem krevních destiček, jež se může klinicky manifestovat krvácivými projevy, zejména na sliznicích a kůži. Incidence jakékoliv autoimunitně podmíněné trombocytopenie se pohybuje okolo 10 případů na 100 000 obyvatel. Většina těchto nemocných je diagnostikována ve věku mezi 18 až 40 lety, přičemž ženy jsou postiženy až třikrát častěji než muži. Je však třeba rozlišovat mezi primární (v pravém smyslu idiopatickou) a sekundární formou autoimunitní trombocytopenie, která je indukována jiným základním onemocněním. Studie hodnotící výskyt ITP u dětí došly k závěrům, že onemocnění se nejčastěji manifestuje do 5 let věku, s častějším postižením chlapců (55 %) než děvčat (45 %) (17). Incidence ITP v dospělosti byla rovněž analyzována v různých studiích a bylo potvrzeno, že narůstá u seniorů. Ve věkové kategorii < 60 let je výskyt cca 1,5–2 a ve skupině > 60 let 4,5–5 případů na 100 000 obyvatel, přičemž věkový medián dospělých pacientů je 56 let (11). Obecný výskyt ITP, bez ohledu na věkovou kategorii, je 6 nemocných na 100 000 obyvatel.
ITP lze dělit na akutní a chronickou formu. Akutní forma postihuje především děti (více než 70 % dětí s ITP), chronická je naopak „výsadou“ dospělých.
Za chronickou však lze ITP považovat až poté, co trombocytopenie trvá 6 měsíců a bez léčby nedochází k zlepšení nebo normalizaci počtu destiček. Právě chronická forma onemocnění, rekurentní či refrakterní na standardní léčbu, může představovat závažný problém, se kterým se v klinické praxi potýkají nejen hematologové, ale i lékaři ostatních specializací.
Patogeneze ITP
Již více než 50 let je známo, že příčinou trombocytopenie u nemocných s ITP je zvýšená destrukce krevních destiček způsobená imunologickými mechanismy. Produkce autoprotilátek proti trombocytům svědčí o selhání imunologické tolerance jedince vůči vlastním antigenům, přičemž etiologický spouštěcí mechanismus je nejasný.
Z patogenetického hlediska dochází k interakci mezi destičkami, antigen-prezentujícími buňkami (APC), T - a B-lymfocyty. Proteiny destiček jsou cestou hlavního histokompatibilního komplexu (MHC) II. třídy na povrchu APC prezentovány přes T-buněčný receptor (TCR) pomocným (Th)T-lymfocytům, u kterých dochází ke zvýšení exprese CD40 ligandu (CD40L) s následnou interakcí s CD40 na povrchu APC. Tato kostimulace vede k zvýšené produkci cytokinů, zejména interleukinu-2 (IL-2) a interferonu-γ (IFN-γ), jež dále ovlivňují diferenciaci B-lymfocytů a produkci autoprotilátek, ale také cytotoxické (Tc) T-lymfocyty, které jsou primárně rovněž aktivovány APC, avšak přes MHC I. třídy.
Protilátky proti krevním destičkám
Autoprotilátky třídy IgG hrají klíčovou roli v patogenezi ITP. Cílovými antigeny jsou zejména povrchové glykoproteiny GPIIb/IIIa a GPIb/IX, ale u řady nemocných s ITP byly nalezeny protilátky proti více destičkovým antigenům (19).
Fagocytóza krevních destiček
Fagocytóza autoprotilátkami opsonizovaných trombocytů patří k hlavním patofyziologickým mechanismům jejich destrukce. Makrofágy exprimují na svém povrchu Fcγ receptory (FcγR), na které se vážou IgG protilátky pokrývající destičky. Tato vazba vede ke spuštění intracelulárních signálů s následnou fagocytózou trombocytů makrofágy (8).
Destrukce krevních destiček způsobená protilátkami
V některých případech ITP, a to zejména u nemocných s přítomností anti-GPIb protilátek, se uplatňuje více přímá cytotoxicita nebo vazba komplementu než přes Fcγreceptory zprostředkovaná fagocytóza.
Destrukce krevních destiček způsobená cytotoxickými T-lymfocyty
Tc-lymfocyty zprostředkovaná lýza krevních destiček představuje alternativní patogenetický mechanismus u ITP, který se však může zásadním způsobem podílet na rozvoji téměř 40 % chronických forem onemocnění (20).
Trombopoéza
Původní představa vystupňované dřeňové trombopoézy jako homeostatického kompenzačního mechanismu při této konsumpci byla v posledních letech korigována. Naopak, produkce destiček může být u ITP dokonce snížena. V experimentu „in vitro“ bylo potvrzeno, že růst megakaryocytů lze potlačit přidáním plazmy s přítomností antitrombocytárních protilátek (18). Hladiny trombopoetinu (TPO) jsou u pacientů s ITP normální nebo pouze mírně zvýšené, narozdíl od stavů s útlumem megakaryopoézy, u kterých jsou zvýšeny významně. Toto zjištění představuje důležitý výstup pro klinickou praxi, protože růstové faktory stimulující megakaryopoézu, respektive trombopoézu, by mohly být využity právě v léčbě ITP.
Klinický obraz
Ke spontánním, většinou kožním a slizničním krvácivým projevům dochází u většiny pacientů při hodnotách trombocytů < 20 x 109/l. Sklon ke krvácení bývá ovlivněn řadou faktorů, zejména fragilitou cévní stěny, přidruženými chorobami a eventuálně i léky, které nemocní užívají. Projevy krvácivé diatézy se objevují nejvíce v lokalizacích přirozeně vystavených největšímu tlaku (obr. 1).
Obr. 1. Projevy petechiálního kožního krvácení na dolních končetinách u nemocného s ITP 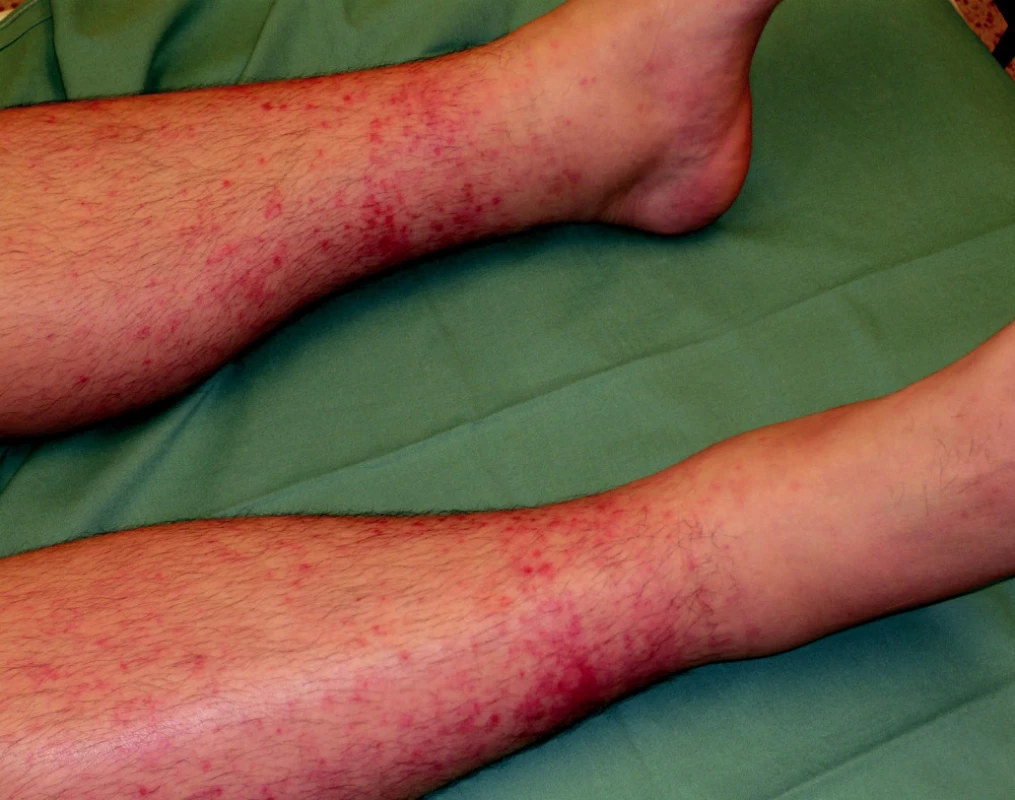
Trombocyty < 10 x 109/l představují již významné riziko krvácení z gastrointestinálního či urogenitálního traktu. Nejobávanějším je přirozeně krvácení do centrálního nervového systému (CNS), které je obecně u ITP relativně nízké (do 1 %), ale ve věkové skupině nemocných > 60 let významně narůstá (6). Počet destiček může u chronické formy ITP klesat pozvolna a trombocytopenie je zjištěna náhodně při vyšetření krevního obrazu z jiné indikace nebo si pacient stěžuje na zvýšený sklon k tvorbě hematomů či krvácení i po malém traumatu.
Tyto potíže se mohou objevit u nemocných až při poklesu a setrvávání hodnot krevních destiček < 50 x 109/l. Při stabilních počtech trombocytů > 50 x 109/l je riziko krvácení za jinak normálních podmínek minimální. Kromě projevů krvácivé diatézy nelze uvést jiný specifický abnormální nález při fyzikálním vyšetření. Nebývá zjevná organomegalie, i když u cca 10 % dětí lze při fyzikálním vyšetření palpovat mírně zvetšenou slezinu (17). V anamnéze může být údaj o infektu, který pacient prodělal několik dnů až týdnů před rozvojem krvácivé diatézy.
Diagnostická vyšetření
Stanovení diagnózy ITP se opírá o komplexní vyhodnocení klinického obrazu, anamnestických údajů a výsledků laboratorních, eventuálně paraklinických vyšetření. Vzhledem k relativně vysokému počtu patologických stavů, které mohou být provázeny trombocytopenií a absenci jednoznačně specifického testu, je ITP diagnostikována víceméně per exclusionem.
Krevní obraz
Nejnápadnější změnou je trombocytopenie různého stupně. Hodnoty hemoglobinu a leukocytů bývají u ITP normální. Anémie může být způsobena sekundárně krevními ztrátami při těžké trombocytopenii. Pokud se jedná o ztráty chronické provázené sideropenií, pak klesá střední objem erytrocytů (MCV) a obsah hemoglobinu (MCH), anémie je mikrocytární, hypochromní.
Počítačovým analyzátorem detekovaná izolovaná výrazná trombocytopenie u pacienta s absencí jakýchkoliv krvácivých projevů může provázet fenomén tzv. pseudotrombocytopenie. Ve zkumavce s K3 EDTA dojde k shlukování krevních destiček a jejich počet je následně analyzátorem vyhodnocen chybně jako nižší. Vyšetření nátěru periferní krve v mikroskopu odhalí shluky trombocytů (obr. 2).
Obr. 2. Pseudotrombocytopenie – velké shluky trombocytů v nátěru periferní krve odebrané do K3 EDTA (počet trombocytů odečtených analyzátorem – 4 x 109/l). 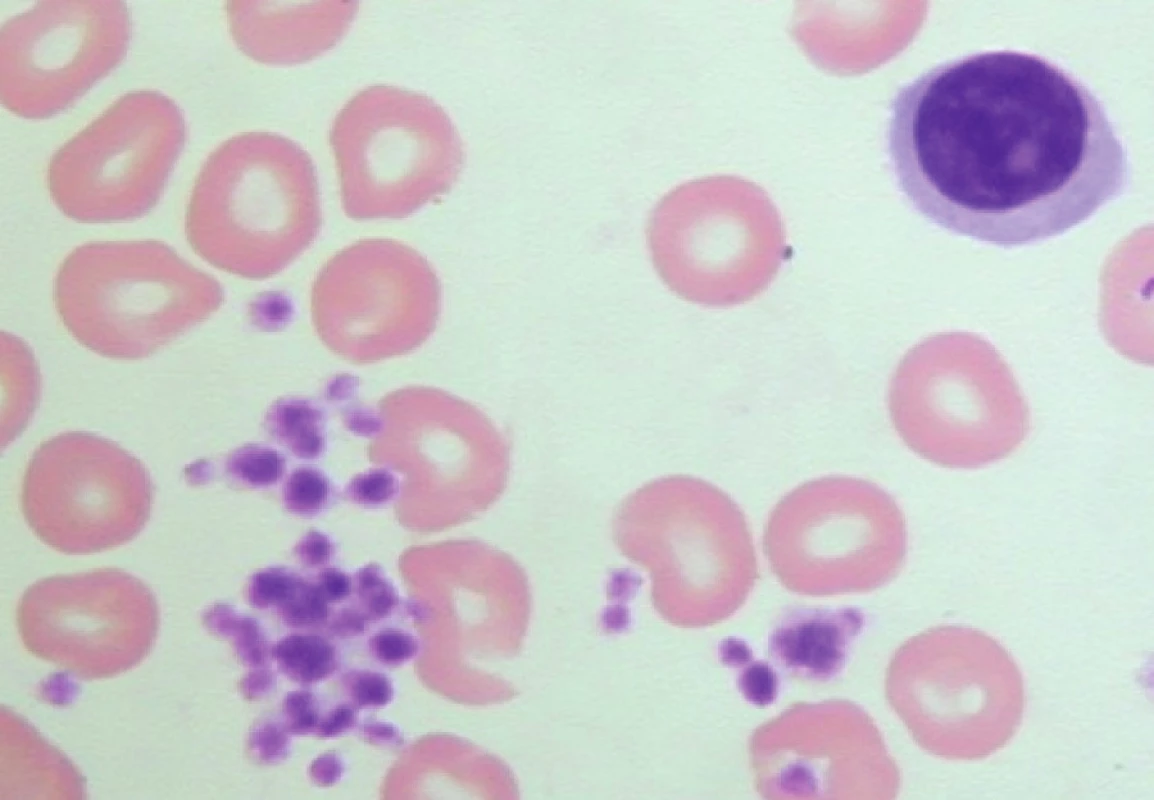
Pokud je zkumavka s odebraným vzorkem krve před vyšetřením krevního obrazu temperována ve vodní lázni s teplotou 37°C nebo je krev paralelně odebrána do zkumavky s oxalátem, je tvorba shluků destiček snížena (obr. 3) nebo úplně eliminována (obr. 4) a analyzátor odečte jejich reálnou hodnotu. Vyloučení shluků trombocytů je v rámci diagnostického postupu vždy naprosto nezbytné.
Obr. 3. Pseudotrombocytopenie – snížení tendence trombocytů k agregaci (menší shluky) v nátěru periferní krve odebrané do K3 EDTA a po inkubaci ve vodní lázni o teplotě 37°C (počet trombocytů odečtených analyzátorem – 38 x 109/l). 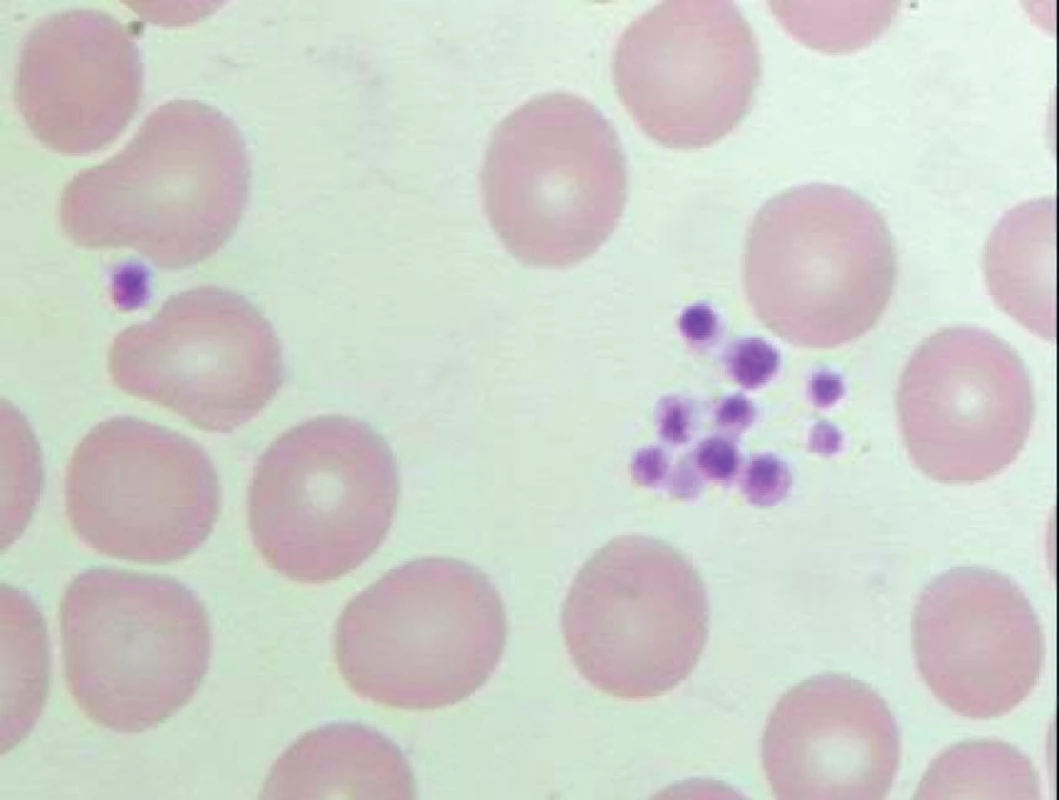
Obr. 4. Pseudotrombocytopenie – bez známek agregace trombocytů v nátěru periferní krve odebrané do oxalátu (počet trombocytů odečtených analyzátorem – 206 x 109/l). 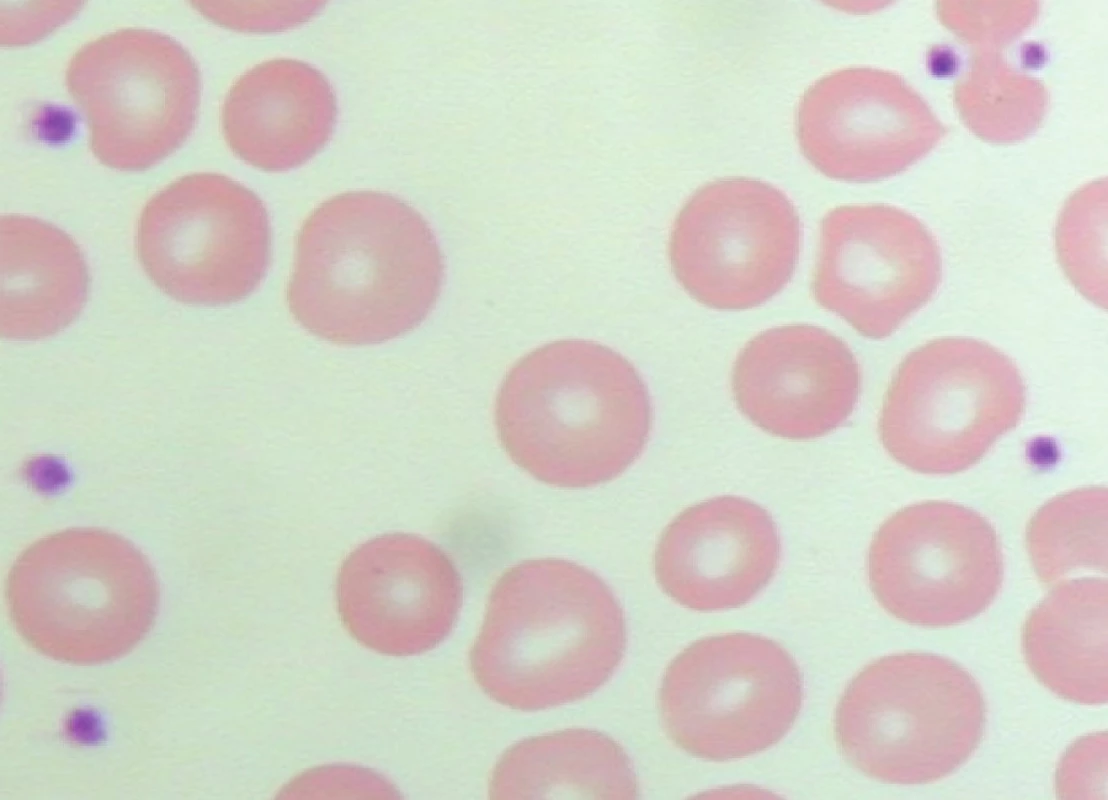
Koagulační vyšetření
Základní koagulační skrínink, který se opírá o vyšetření protrombinového času (PT, Quickův test), aktivovaného parciálního tromboplastinového času (aPTT), trombinového času (TT), hladiny fibrinogenu a antitrombinu III (AT III), musí být proveden u všech nemocných s trombocytopenií. Vyšetření může pomoci odhalit patologické stavy rovněž provázené poklesem počtu destiček, jako např. diseminovanou intravaskulární koagulaci (DIC) s abnormitami prakticky všech uvedených koagulačních parametrů nebo antifosfolipidový syndrom s prodlouženým aPTT.
Cytologické vyšetření aspirátu kostní dřeně
Buněčnost aspirátu kostní dřeně bývá normální. Počet megakaryoblastů a megakaryocytů je normální nebo lehce zvýšen. Ostatní krevní řady bývají v nátěru normálně zastoupeny. V granulocytární i lymfocytární řadě mohou být naznačeny reaktivní změny ve smyslu toxických granulací cytoplazmy neutrofilních myelocytů, metamyelocytů, tyčí a segmentů, bývají početnější mladší a granulované lymfocyty, lymfoplazmocytoidní formy, někdy i plazmocyty. V souladu s reaktivními změnami bývají zastiženy i četnější eozinofilní elementy. Vyšetření kostní dřeně by mělo být provedeno u všech pacientů starších 60 let, a to hlavně kvůli vyloučení myelodysplastického syndromu (MDS). U mladších nemocných je doporučováno při rezistenci trombocytopenie na standardní léčbu a před splenektomií (12). Imunocytologické, cytogenetické či molekulárně biologické vyšetření aspirátu kostní dřeně je indikováno zejména v případech, kdy je nutno vyloučit nádorové onemocnění jako možnou příčinu trombocytopenie.
Vyšetření protilátek proti destičkovým antigenům
Protilátky proti trombocytárním glykoproteinům (“platelet-associated IgG“, PAIg) se mohou stanovovat pomocí různých metod, např. „immunobeads assay” nebo „monoclonal antibody immobilization of platelet antigens” (MAIPA). Předpokládaná senzitivita a specificita se pohybuje od 49 do 66 %, respektive od 78 do 92 % (15). Pozitivita testů v souladu s ostatními laboratorními a klinickými nálezy diagnózu ITP podporuje, negativita ji však nevylučuje (3).
Vyšetření přežívání krevních destiček
Jde o radionuklidové vyšetření, při kterém jsou nemocnému podány dárcovské trombocyty značené izotopem 51Cr. V pravidelných intervalech je pak v krvi měřena aktivita s výpočtem úbytku trombocytů. Normální životnost krevních destiček vyplavených do periferní krve je 7–9 dní, avšak při jejich zvýšené konsumpci, jako u ITP, může být významně zkrácena. Při tomto vyšetření lze detekovat i orgány s největším záchytem a destrukci trombocytů (slezina, játra).Vyšetření není specifické pro diagnózu ITP, ale může usnadnit indikaci splenektomie, pokud je slezina vyšetřením potvrzena jako orgán s nejvýraznější konsumpcí trombocytů (9).
Ultrazvuková vyšetření
Ultrazvukové vyšetření břicha, zejména jater a sleziny, je plně indikované vzhledem k faktu, že diagnóza ITP je nezřídka stanovena právě vylučovacím způsobem. Vyšetření může odhalit splenomegalii, abnormity struktury orgánů, např. jater, lymfadenomegalii, aj. Dopplerovské vyšetření portálního žilního systému prokáže eventuální portální hypertenzi, jež vede k hypersplenismu s konsumpcí trombocytů.
Diferenciální diagnostika
Z hlediska léčebného přístupu je třeba odlišit jiné příčiny trombocytopenie než ITP. Nádorová onemocnění mohou způsobit pokles krevních destiček různými mechanismy:
- infiltrací kostní dřeně s útlakem normální krvetvorby,
- hypersplenismem při splenomegalii způsobené nádorem,
- sekundární tvorbou autoprotilátek proti trombocytům,
- konsumpcí destiček při generalizované paraneoplastické tvorbě mikrotrombů v cévním řečišti (mikroangiopatie) s následnou hemolytickou anémií (MAHA),
- dysfunkční megakaryopoesou (u MDS), a
- možnou kombinací těchto příčin.
Uvedené patogenetické mechanismy vedoucí k trombocytopenii však nemusí být vyvolány pouze nádory. Hypersplenismus s konsumpční trombocytopenií provází choroby s portální hypertenzí (jaterní cirhóza jakékoliv etiologie) nebo výraznou aktivací retikuloendotelového systému (RES) sleziny (systémové zánětlivé reakce různé etiologie). Imunologické antitrombocytární mechanismy s následným poklesem krevních destiček se objevují i u jiných onemocnění vzniklých na autoimunitním podkladě. K takovým lze řadit i antifosfolipidový syndrom, často provázený pozitivitou lupus antikoagulans, u kterého však v klinickém obraze dominují trombotické komplikace.
Zvýšená spotřeba trombocytů s tvorbou mikrotrombů a následnou hemolýzou nemusí být pouze paraneoplastickým syndromem, ale i projevem tzv. trombotické trombocytopenické purpury (TTP). Neefektivní megakaryopoesa s trombocytopenií bývá pozorována u deficitních stavů, např. perniciózní anémie. Opomenuty by neměly být ani trombocytopenie polékové nebo spojené s ethylismem. Vrozené trombocytopenie, eventuálně trombocytopatie jsou většinou diagnostikovány krátce po narození nebo v dětském věku.
Problematická bývá diferenciální diagnostika trombocytopenie vzniklé v graviditě. Mírný pokles destiček je v těhotenství poměrně častý. Od skutečné ITP, jejíž incidence je cca 5 případů na 10 000 gravidit, je třeba odlišit zejména gestační trombocytopenii manifestující se obvykle v třetím trimestru gravidity. Trombocytopenie bývá pouze lehká (vzácně trombocyty < 80 x 109/l), bez krvácivých projevů a k úpravě dochází po porodu.
Na rozdíl od ITP není gestační trombocytopenie spojena s rizikem neonatální trombocytopenie, která je způsobena průnikem protilátek třídy IgG přes placentu do fetálního oběhu. Asi u 10 % novorozenců matek s ITP je po porodu potvrzen počet trombocytů < 50 x 109/l, avšak do dvou týdnů obvykle dochází ke spontánní úpravě jejich hodnot. Významným poklesem krevních destiček mohou být provázeny závažné těhotenské komplikace, jako preeklampsie, diseminovaná intravaskulární koagulace (DIC) nebo HELLP („hemolysis + elevated liver enzymes + low platelets”) syndrom, které se často klinicky překrývají.
Řada onemocnění sekundárně vedoucích k trombocytopenii mívá, kromě možných krvácivých projevů, specifickou klinickou symptomatologii a často i laboratorní nálezy, včetně krevního obrazu.
Léčba
Volba léčebného přístupu u ITP vyplývá z aktuálního počtu krevních destiček, klinického stavu a rizika krvácení (v praxi by mělo být zohledněno např. i zaměstnání pacienta). Nemocné se vstupními hodnotami trombocytů > 30 x 109/l a absencí jakéhokoliv krvácení je možno pouze sledovat a léčbu zahájit až při eventuálním zhoršení trombocytopenie nebo rozvoji projevů krvácivé diatézy (12).
Počet trombocytů < 10 x 109/l provázený většinou slizničními, kožními či jinými krvácivými projevy, je závažným stavem a vyžaduje okamžitou terapeutickou intervenci. V těchto případech je standardní léčbou intravenózní aplikace pulzu methylprednisolonu (1,0 g/den 1–3 dny po sobě), která je kombinována s vysokými dávkami imunoglobulinů (IVIg, 1,0 g/kg/den 2–3 dny po sobě) (4, 5, 12).
U Rh-pozitivních pacientů může být alternativou IVIg podání anti-D imunoglobulinu (75 mg/kg) (22). Imunosupresivní účinek kortikoidů lze podpořit vinkristinem (1–2 mg) (5). Při akutním nebo dokonce život ohrožujícím krvácením je na místě transfúze krevních destiček, ve výjimečných případech doplněna aplikací rekombinantního aktivovaného faktoru VII (23). Na tuto bezprostřední urgentní léčbu by měla vždy navazovat perorální léčba kortikoidy.
Hodnoty destiček v rozmezí 10–30 x 109/l jsou alarmující, ale ne u všech nemocných s těmito počty dochází k spontánním krvácivým projevům. Kortikoidy jsou léčbou první volby i u těchto pacientů. Obvykle je perorálně podáván prednison v iniciální dávce 1 mg/kg/den (5, 12). Alternativou je dexamethason, jehož dávkování je 40 mg/den, čtyři dny v měsíci, perorálně. Podáním IVIg nebo anti-D globulinu lze léčbu kortikoidy doplnit v závislosti na klinickém obrazu, projevech krvácivé diatézy a dalších chorobách, které mohou buď zvýšit riziko závažného krvácení při trombopenii, nebo se může zhoršit jejich průběh při dlouhodobé nemožnosti redukovat dávku kortikoidů.
Dosažení setrvalých hodnot trombocytů > 30 x 109/l se snížením rizika spontánního krvácení umožní nemocného dále pouze sledovat. Pokud dojde primární léčbou ke stabilizaci počtu krevních destiček na hodnotách 20–30 x 109/l, jsou kortikoidy obvykle postupně redukovány (k dávkám prednisonu ≤ 10 mg/den), ale ponechány v medikaci po dobu minimálně tří měsíců. Vzhledem k nežádoucím účinkům kortikoidů při jejich dlouhodobém užívání, které mohou významně zhoršit stav některých chronických onemocnění (diabetes mellitus, hypertenze, ischemická choroba srdeční, aj.), a to zejména u pacientů seniorské věkové skupiny, může být léčba doplněna dalšími léky. Ty mohou stabilizovat počty trombocytů i při rychlejší redukci a eventuálním vysazení kortikoidů.
Rh-pozitivním nemocným lze opět zkusit podání anti-D imunoglobulinu (jednotlivé dávky 50–75 mg/kg). Z dalších léků je to zejména Danazol (10–15 mg/kg/den p.o.) (1). Jiná imunosupresiva, ať již se jedná o cyklofosfamid, azathioprin, cyklosporin A (CSP-A) nebo mykofenolát mofetil (MMF) nejsou většinou součástí standardní primární terapie, i když je jejich použítí referováno na limitovaných počtech pacientů (13). Podobně je tomu s aplikací anti-CD20 protilátky (Rituximab, MabThera®) (7).
Pokud tato léčba vede v průběhu 6 měsíců k stabilním počtům destiček > 30 x 109/l a absenci spontánních krvácivých projevů, lze nemocného dále sledovat bez léčby. Při přetrvávající trombocytopenii < 20 x 109/l je indikována splenektomie jako léčba druhé volby (5, 12). U nemocných s hraničními hodnotami destiček 20–30 x 109/l a bez známek krvácení je možno se splenektomií vyčkat, zvláště pokud jsou tyto počty stabilní i po vysazení imunosuprese (kortikosteroidů).
Ke splenektomii lze přistoupit i dříve než 6 měsíců od stanovení diagnózy ITP, a to v případech naprosto refrakterních na uvedené léčebné postupy. Snahou je však, pokud to vývoj ITP u nemocného dovolí, tento zákrok co nejvíce oddálit. Splenektomie vede k vzestupu a normalizaci počtu krevních destiček u více než 60 % nemocných, většinou v průběhu několika následujících dní (16). Vzhledem k významnému zvýšení rizika infekcí, zejména tzv. opouzdřenými bakteriemi (Streptococcus pneumonie, Neisseria meningitidis, Haemophillus influenzae), které mohou mít těžký a život ohrožující průběh, je u nemocných před plánovanou splenektomií doporučována vakcinace.
Asi 30–40 % pacientů podstoupivších splenektomii pro ITP buď nedosáhne normálních počtů destiček, nebo po přechodné normalizaci počtů dojde k jejich opětovnému poklesu. Pravděpodobnost jejich vyléčení je malá, a proto jsou další léčebná opatření zaměřená hlavně na stabilizaci trombocytů na takových hodnotách, které minimalizují riziko krvácení. Za tuto hranici je považován počet 20–30 x 109/l. Nižší hodnoty destiček, eventuálně s klinickými projevy krvácivé diatézy, představují indikaci k další léčbě po splenektomii. Avšak před zahájením další systémové imunosupresivní léčby je vhodné vyloučit přítomnost akcesorní sleziny, která se může opět podílet na konsumpci trombocytů (21).
Jako léčba první linie je doporučováno podání anti-CD20 protilátky. Rituximab je aplikován v dávce 375 mg/m2 týdně, a to v průběhu 4 týdnů. Odpovědi je dosaženo přibližně u 50 % a setrvalé kompletní remise u cca 33 % nemocných (2). Alternativou léčby Rituximabem je medikace danazolu v kombinaci s imunosupresivy azathioprinem nebo mykofenolát mofetilem (MMF). Tato terapie může být při těžké trombocytopenii doplněna kortikoidy, eventuálně i IVIg nebo anti-D imunoglobulinem. Při refrakteritě na tuto léčbu lze ve druhé linii podat, podobně jako u jiných autoimunitních a revmatických chorob, intravenózně nebo perorálně cyklofosfamid nebo cyklosporin A (CSP-A).
Nadále přetrvávající těžká trombocytopenie provázená krvácivými projevy ospravedlňuje v terapii i volbu kombinované chemoterapie či dokonce zvážení transplantace krvetvorných kmenových buněk (10).
V průběhu gravidity je hlavním cílem udržet počty destiček > 30 x 109/l, v době porodu kolem 50 x 109/l. Těhotné pacientky s ITP by měly být kontrolovány minimálně jednou měsíčně v průběhu prvních dvou trimestrů, co druhý týden ve třetím trimestru a jednou týdně v době termínu porodu. Pokud stav těhotné ženy s diagnózou ITP vyžaduje léčbu, jsou obvykle voleny kortikoidy v kombinaci s IVIg. Z imunosupresiv lze při nedostatečné léčebné odpovědi doplnit azathioprin nebo CSP-A, i když zkušenosti s podáváním těchto léků v graviditě jsou omezené, a je proto pochopitelná snaha jejich aplikaci co nejvíce oddálit.
Splenektomii lze zvážit u pacientek refrakterních na uvedenou léčbu. Relativně nejméně rizikové je její provedení ve druhém trimestru (14).
Závěr
Nemocný s ITP by měl být dispenzarizován a léčen hematologem. Je třeba si uvědomit, že většina dospělých pacientů trpí chronickou formou onemocnění s limitovanou kurabilitou a častými recidivami. Proto je nezbytné vždy zvážit riziko krvácení vyplývající z aktuálních hodnot krevních destiček a riziko možných komplikací vyplývajících z imunosupresivní léčby, eventuálně splenektomie.
V neposlední řadě je nutno mít na paměti, že většina trombocytopenií není projevem ITP, která je diagnózou obvykle stanovenou vylučovacím způsobem. Otevírá se tak prostor pro diferenciální diagnostiku, která již nemusí být výsadou pouze hematologa, ale záležitostí mezioborovou.
MUDr. Luděk Raida, Ph.D.
Hemato-onkologická klinika
Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc
I.P. Pavlova 6
775 20 Olomouc
E-mail: raida@fnol.cz
Zdroje
1. Ahn, Y.S., Rocha, R., Mylvaganam, R. et al. Long-term danazol therapy in autoimmune thrombocytopenia : unamaintaned remission and age-dependent response in women. Ann. Int. Med. 1989, 111, p. 723-729.
2. Braendstrup, P., Bjerrum, O.W., Nielsen, O.J., et al. Rituximab chimeric anti-CD20 monoclonal antibody treatment for adult refractory idiopathic thrombocytopenic purpura. Am. J. Hematol. 2005, 78, p. 275-280.
3. Brighton, T.A., Evans, S., Castaldi, P.A. et al. Prospective evaluation of the clinical usefulness of an antigen-specific assay (MAIPA) in idiopathic thrombocytopenic puprpura and other immune thrombocytopenias. Blood 1996, 88, p. 194-201.
4. Bussel, J. Intravenous immunoglobulin therapy for the treatment of idiopathic thrombocytopenic purpura. Prog. Hemost. Thromb. 1986, 8, p. 103-125.
5. Cines, D.B., Bussel, J.B. How I treat idiopathic thrombocytopenic purpura (ITP). Blood 2004, 106, p. 2244-2251.
6. Cohen, Y.C., Djulbegovic, B., Shamai-Lubovitz, O. et al. The bleeding risk and natural history of idiopathic thrombocytopenic purpura in patients with persistently low platelets counts. Arch. Intern. Med. 2000, 160, p. 1630-1638.
7. Cooper, N., Stasi, R., Cunningham-Rundles, S. et al. The efficacy and safety of B-cell depletion with anti-CD20 monoclonal antibody in adults with chronic immune thrombocytopenic purpura. Br. J. Haematol. 2004, 125, p. 232-239.
8. Crow, A. R., Lazarus, A. H. Role of Fcg receptors in the pathogenesis and treatment of idiopathic thrombocytopenic purpura. J. Pediatr. Hematol. Oncol. 2003, 25, p. 14-18.
9. Černá, M., Pospíšilová, D. Trombocytopenie. In Indrák, K. a kol. Hematologie. Praha/Kroměříž: Triton, 2006, s. 101-106.
10. Figueroa, M., Gehlsen, J., Hammond, D. et al. Combination chemotherapy in refractory immune thrombocytopenic purpura. N. Engl. J. Med. 1993, 328, p. 1226-1229.
11. Frederiksen, H., Schmidt, K. The incidence of idiopathic thrombocytopenic purpura in adults increases with age. Blood 1999, 94, p. 909-913.
12. George, J.N., Woolf, S.H., Raskob, E. et al. Idiopathic thrombocytopenic purpura: a practice guideline developer by explicit methods for the American Society of Hematology. Blood 1996, 88, p. 3-40.
13. George, J.N., Kojouri, K., Perdue, J.J. et al. Management of patients with chronic, refractory idiopathic thrombocytopenic purpura. Semin. Hematol. 2000, 37, p. 290-298.
14. Gill, K.K., Kelton, J.G. Management of idiopathic thrombocytopenic purpura in pregnancy. Semin. Hematol. 2000, 37, p. 275-289.
15. Kiefel, V., Santoso, S., Weisheit, M. et al. Monoclonal antibody-specific immobilization of platelet antigens (MAIPA): a new tool for the identification of platelet-reactive antibodies. Blood 1987, 70, p. 1722-1726.
16. Kojouri, K., Vesely, S.K., Terrell, D.R. et al. Splenectomy for adult patients with idiopathic thrombocytopenic purpura: a systematic review to assess long-term platelet count responses, rediction of response, and surgical complications. Blood 2004, 104, p. 2623-2634.
17. Kuhne, T., Imbach, P., Bolton-Maggs, P.H.B. et al. Newly diagnosed idiopathic thrombocytopenic purpura in childhood: an observational study. Lancet 2001, 358, p. 2122-2125.
18. McMillan, R., Wang, L., Tomer, A. et al. Suppression of in vitro megakaryocyte production by antiplatelet autoantibodies from adult patients with chronic ITP. Blood 2003, 103, p. 1364-1369.
19. McMillan, R., Wang, L., Tani, P. et al. Prospective evaluation of the immunobead assay for the diagnosis of adult chronic immune thrombocytopenic purpura (ITP). J. Thromb. Haemost. 2003, 1, p. 485-491.
20. Olsson, B., Andersson, P-O., Jernas, M. et al. T-cell-mediated cytotoxicity toward platelets in chronic idiopathic thrombocytopenic purpura. Nature Med. 2003, 9, p. 1123-1124.
21. Rudowski, W.J. Accessory spleens: clinical significance with particular reference to the recurence of idiopathic thrombocytopenic purpura. World J. Surg. 1985, 9, p. 422-430.
22. Scaradavou, A., Woo, B., Woloski, B.M.R. et al. Intravenous anti-D treatment of immune thrombocytopenic puprura: experience in 272 patients. Blood 1997, 89, p. 2689-2700.
23. Vidarsson, B., Önundarson, P.T. Recombinant factor VIIa for bleeding in refractory thrombocytopenia. Thromb. Haemost. 2000, 83, p. 634-635.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek OBSAHOVÝ REJSTŘÍKČlánek VĚCNÝ REJSTŘÍK - pokračováníČlánek AUTORSKÝ REJSTŘÍKČlánek Ukázky básnické tvorby českých lékařů na rozhraní 20. a 21. století Několik sond do jejich tvorbyČlánek JUBILEAČlánek VĚCNÝ REJSTŘÍK
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2008 Číslo 12- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- OBSAHOVÝ REJSTŘÍK
- VĚCNÝ REJSTŘÍK - pokračování
- Kardiorehabilitace – účinná, ale opomíjená léčba
- Plánované úterní semináře v Lékařském domě na rok 2009
- Idiopatická trombocytopenická purpura
- Kandidové biofilmy – súčasný problém klinickej praxe
- AUTORSKÝ REJSTŘÍK
- Současné způsoby osteosyntézy dětských zlomenin
- Nádorové markery u karcinomu prostaty, blýská se na lepší časy?
- Nový inkubátor pro mosteckou nemocnici
- Perkutánní endoskopická gastrostomie – zkušenosti Centra pro PEG v letech 2002–2008
- Stručný přehled radioterapie karcinomu rekta
- Poskytování spirituální péče v českých nemocnicích
- Biologická léčba revmatoidní artritidy
- Problémy působené alkoholem – interakce rizikových a ochranných činitelů
- Volvulus sigmoidea – netypické onemocnění v dětském věku
- Ukázky básnické tvorby českých lékařů na rozhraní 20. a 21. století Několik sond do jejich tvorby
- Ze života společností ČLS JEP
- Pražané jsou ochotni si u praktického lékaře více připlatit
- O společnosti lekari-online.cz
- JUBILEA
- VĚCNÝ REJSTŘÍK
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Idiopatická trombocytopenická purpura
- Perkutánní endoskopická gastrostomie – zkušenosti Centra pro PEG v letech 2002–2008
- Současné způsoby osteosyntézy dětských zlomenin
- Volvulus sigmoidea – netypické onemocnění v dětském věku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



