-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Předčasné ovariální selhání
Premature ovarian failure – POF
Premature ovarian failure is an ovarian disorder occuring in 1 % of women. It is characterized by premature failure of ovarian functions before the age of forty. Incidence of POF is generally increasing. Autoimmune damage of ovaries, genetic causes and iatrogenic harm belong among the most common causes of premature ovarian failure. In last few years knowledge of etiology of POF is getting improved, especially in the means of genetic, cell (macrophages) and biochemic (cytokines) levels. POF is characterized by hypergonadotrophic hypogonadism, hypoestrinism and infertility. The management of POF is aimed to the treatment of infertility using the assisted reproduction techniques with donor oocytes and to hormonal replacement therapy.
Key words:
premature ovarian failure – hypergonadotropic amenorrhoea – infertility – follicular atresia – donor oocytes
Autoři: MUDr. Ivana Prokopová; doc. MUDr. Igor Crha, CSc.
Působiště autorů: Gynekologicko-porodnická klinika FN MU Brno
Vyšlo v časopise: Prakt Gyn 2007; 11(4): 170-173
Souhrn
Předčasné ovariální selhání (POF - premature ovarian failure) je onemocnění postihující asi 1 % žen před 40. rokem věku. Mezi nejčastější známé příčiny POF patří genetické příčiny, iatrogenní poškození a autoimunitní poškození folikulárního aparátu. Poznatky posledních let postupně objasňují patogenezi předčasného ovariálního selhání, zejména na úrovni molekulárně genetické, buněčné (makrofágy) a na úrovni působení mediátorů (cytokinů). Hlavním příznakem POF je hypergonadotropní amenorea, výpadové příznaky z nedostatku estrogenů a neplodnost. Základem léčby POF je léčba neplodnosti pomocí metod asistované reprodukce s využitím darovaných oocytů a hormonální substituční léčba.
Klíčová slova:
předčasné ovariální selhání – hypergonadotropní amenorea – poruchy plodnosti – folikulární atrézie – darované oocytyÚvod
Předčasné ovariální selhání je charakterizováno předčasným vyhasínáním ovariální funkce před 40. rokem života ženy. Incidence předčasného ovariálního selhání neustále vzrůstá. V současné době postihuje asi 1 % žen před 40. rokem věku a 0,1 % žen před 30. rokem věku. POF je onemocnění charakterizované amenoreou, elevací gonadotropinů v séru a hypoestrinizmem. Podrobný výzkum posledních let přispěl k pochopení příčin a mechanizmů, které se na poškození vaječníků podílejí. Cílem práce je přinést přehled nových poznatků o etiologii, patogeneze, diagnostice a terapii předčasného ovariálního selhání.
Etiologie POF
POF je z hlediska etiologie heterogenní onemocnění. Současné poznatky o etiologii POF poukazují na několik skupin příčin. Nejčastěji se jedná o poškození folikulárního aparátu manifestující se poruchou funkce folikulů v ovariích (dysfunkce ovarií). K nejznámějším genetickým příčinám patří patologie chromozomu X, detekce abnormit na molekulární úrovni je obtížnější. Přibývá také žen s poškozením ovarií po gonadotoxické léčbě v souvislosti s onkologickým onemocněním. Na podkladě akcelerace folikulární atrézie dochází k depleci folikulů v ovariích [1].
Dysfunkce folikulů v ovariích
Existuje celá řada případů, kdy folikuly přítomné v ovariích jsou rezistentní ke stimulaci gonadotropiny. Tento stav bývá také označován jako syndrom rezistentního ovaria. Vyznačuje se vysokými hladinami gonadotropinů v séru, četnými primordiálními folikuly
v biopsii ovaria (obr. 1) a rezistencí ke stimulaci exogenními gonadotropiny; 40 % těchto stavů se projevuje jako primární amenorea, 60 % jako sekundární amenorea, nejčastěji ve 3. dekádě života [2]. Příčiny folikulární dysfunkce vedoucí k syndromu rezistentního ovaria mohou být autoimunitní, receptorové a postreceptorové defekty pro gonadotropiny a defekty enzymů.
Obr. 1. Mikroskopická stavba primordiálního folikulu. (foto MUDr. P. Rotterová) 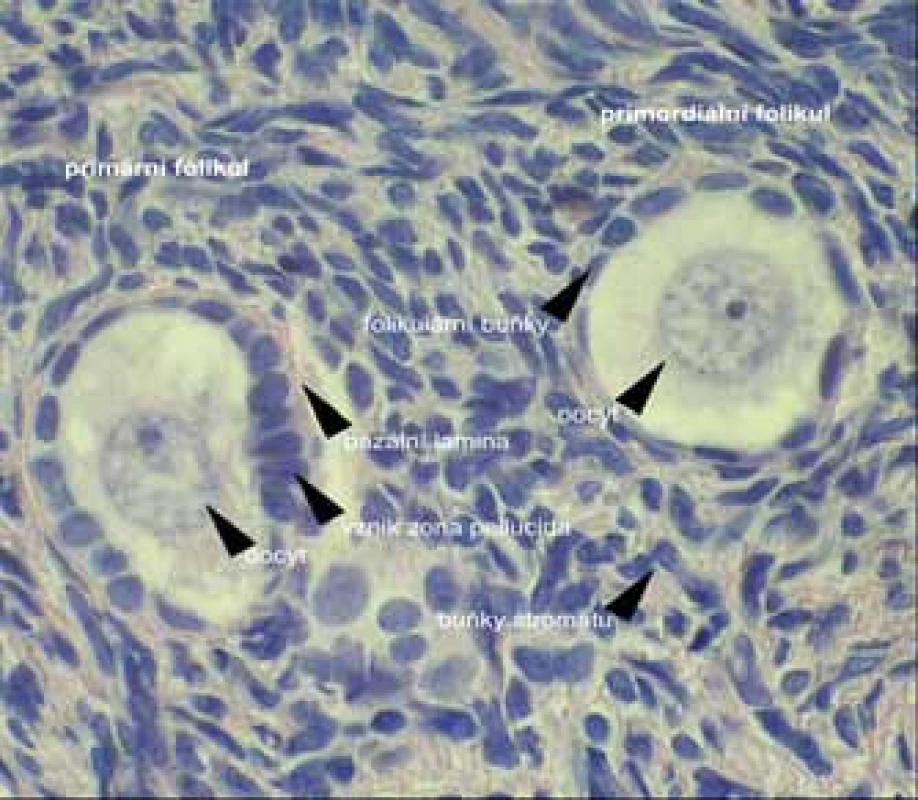
Hlavním podkladem autoimunitního poškození je abnormální celulární nebo humorální imunitní reakce. Současné poznatky odhalily hlavní roli makrofágů v procesu vývoje folikulů, a tedy i v patogenezi předčasného ovariálního selhání [3]. Makrofágy jsou multifunkční buňky, přítomné ve tkáních reprodukčního systému. Účastní se procesu folikulogeneze, ovulace, formování žlutého tělíska i jeho regrese (obr. 2). Makrofágy také vytváří růstové faktory, chemokiny, cytokiny a jsou schopny fagocytózy. Cytokiny se jako tkáňové mediátory účastní řízení ovariálního cyklu. Hlavní roli hrají zejména IL-1β, IL-6 a TNFα. Podle nejnovějších studií jsou sérové hladiny TNFα signifikantně nižší u pacientek s POF, což do budoucna poukazuje na nové možnosti diagnostiky POF [4]. U pacientek s POF také zjišťujeme přítomnost autoprotilátek, jejichž spektrum je velmi široké – od antityreoidálních protilátek, antiadrenálních protilátek přes vlastní antiovariální protilátky, antinukleární protilátky až po revmatoidní faktor. POF je často spojeno se systémovými autoimunitními onemocněními jako je Addisonova choroba, polyglandulární syndrom typ I, II, myasthenia gratis, Crohnova choroba, systémový lupus erythematodes či revmatoidní artritida [5].
Obr. 2. Přehled funkcí makrofágů v ovariu. 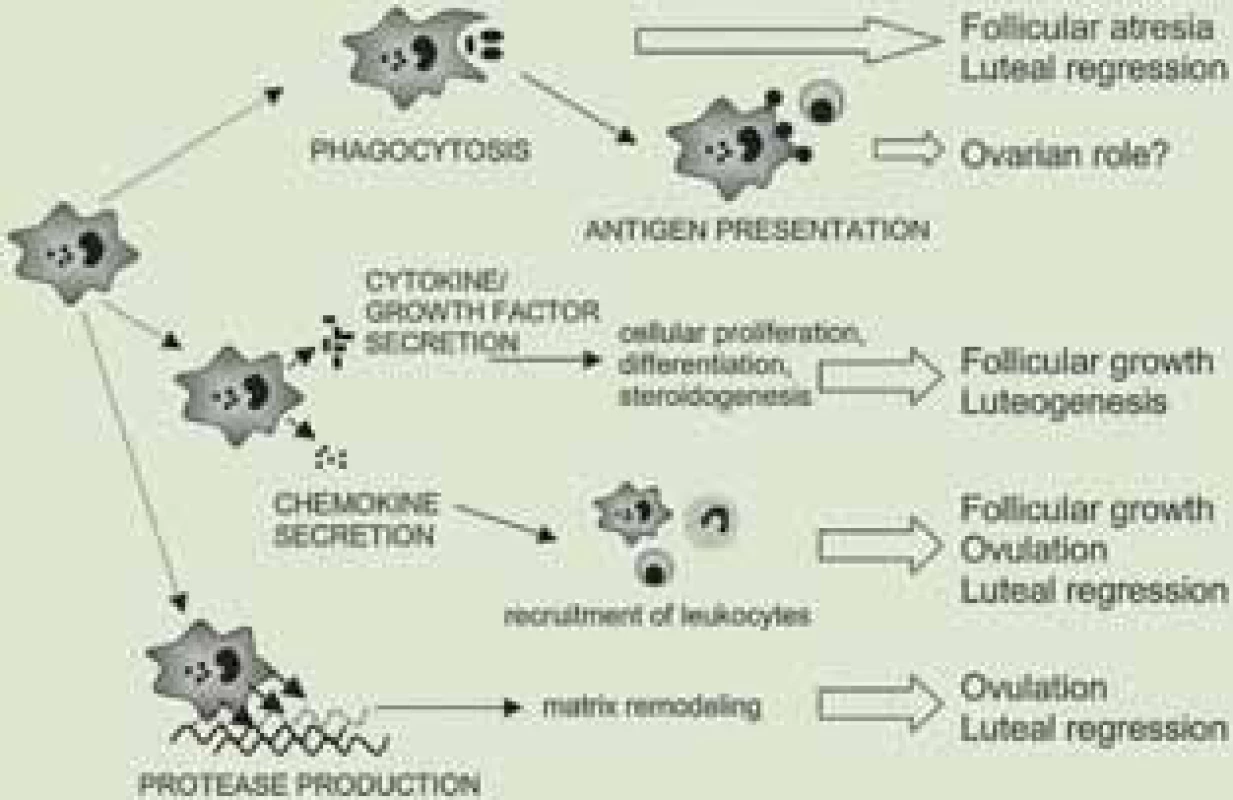
Abnormality gonadotropinových receptorů (polymorfizmus) jsou důsledkem mutací genu pro gonadotropinové receptory, což jsou případy, v nichž i podální exogenních gonadotropinů je bez efektu. Většinou se jedná o autozomálně recesivní dědičnost, přičemž heterozygoti mají normální funkci ovarií. V podrobnějším zkoumání polymorfizmu genů se skrývá velká šance pochopit patogenezi POF. Abnormality molekuly gonadotropinů, a tím i snížená biologická aktivita endogenních gonadotropinů jsou další z příčin snížené funkce ovariálního aparátu. Při této poruše je působení exogenních gonadotropinů v normě [6].
Deplece folikulů v ovariích
Během 6. gestačního týdne vývoje plodu dochází k vytváření zárodečných buněk z entodermu žloutkového váčku a k jejich migraci do genitální lišty. Následně dochází k rychlému mitotickému dělení oogonií a k meióze s konverzí oogonií na primární oocyty.
V období kolem 28. týdne těhotenství již oogonií nepřibývá. Ty, které nedosáhly profáze prvního zracího dělení, podléhají atrézii. Nejvyššího počtu dosahují zárodečné buňky kolem 20. týdne (asi 7 milionů), v době porodu je jejich počet již redukován na 1–2 miliony. V období puberty zůstává v ovariích přibližně 300 tisíc zárodečných buněk. Hlavním procesem, který reguluje počet zárodečných buněk, je především folikulární atrézie [7]. U většiny pacientek s POF dochází ke geneticky podmíněné zrychlené atrézii folikulů, v menším procentu případů se jedná o primárně redukovaný počet zárodečných buněk již při narození způsobený například defektem migrace zárodečných buněk.
Nedostatek folikulů může být způsoben zejména chromozomálními poruchami nebo iatrogenním poškozením. Nejčastější genetickou příčinou POF jsou patologie X chromozomu, které vedou k akceleraci folikulární atrézie, a to zejména monozomie X - Turnerův syndrom (obr. 3), mozaika X, syndrom fragilního X a některé další chromozomální aberace, které jsou v současné době předmětem podrobného zkoumání. Vedle abnormalit chromozomu X byly u žen s POF identifikovány i některé mutace autozomů, např. mutace genu pro gonadotropinové receptory nebo mutace genů pro jednotlivé gonadotropiny [8].
Obr. 3. Lištovité ovarium u ženy s Turnerovým syndromem. 
Iatrogenní poškození funkce ovarií s deplecí folikulů je způsobeno především při chemoterapii (obr. 4,5) a radioterapii maligních onemocnění u žen ve fertilním věku nebo při chirurgických operacích v malé pánvi a na ovariích (obr. 6).
Obr. 5. Ovarium po chemoterapii. 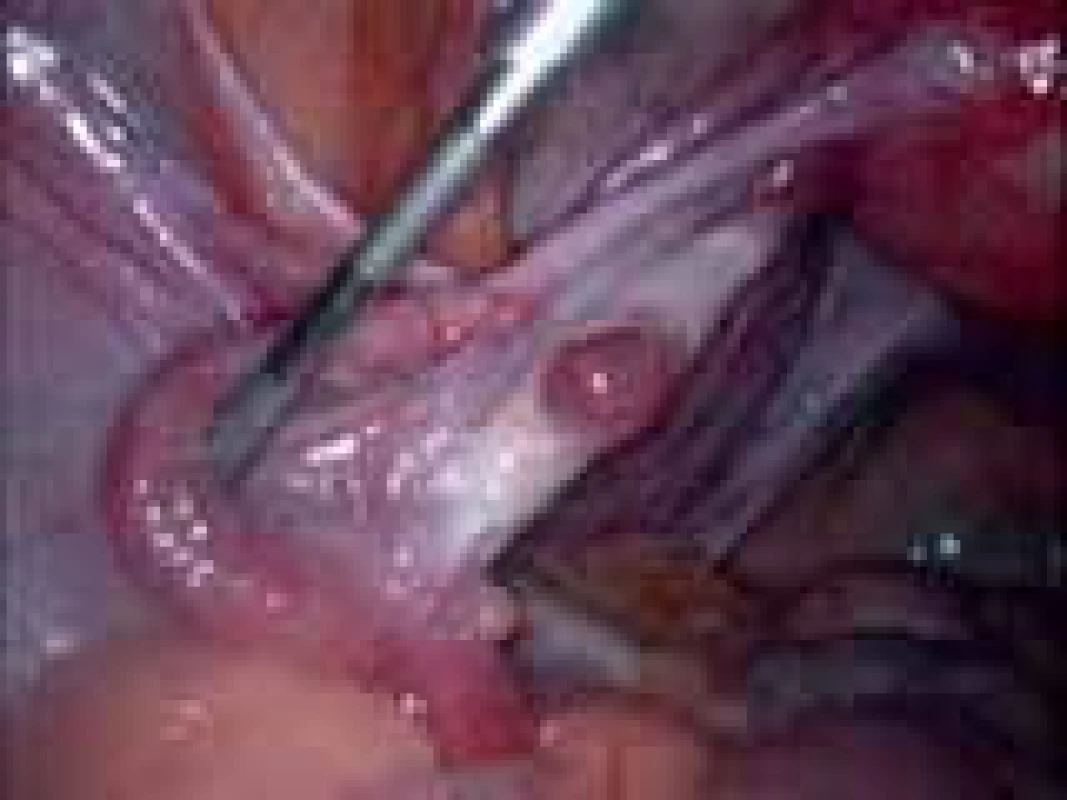
Obr. 6. Ovarium po resekci cysty. 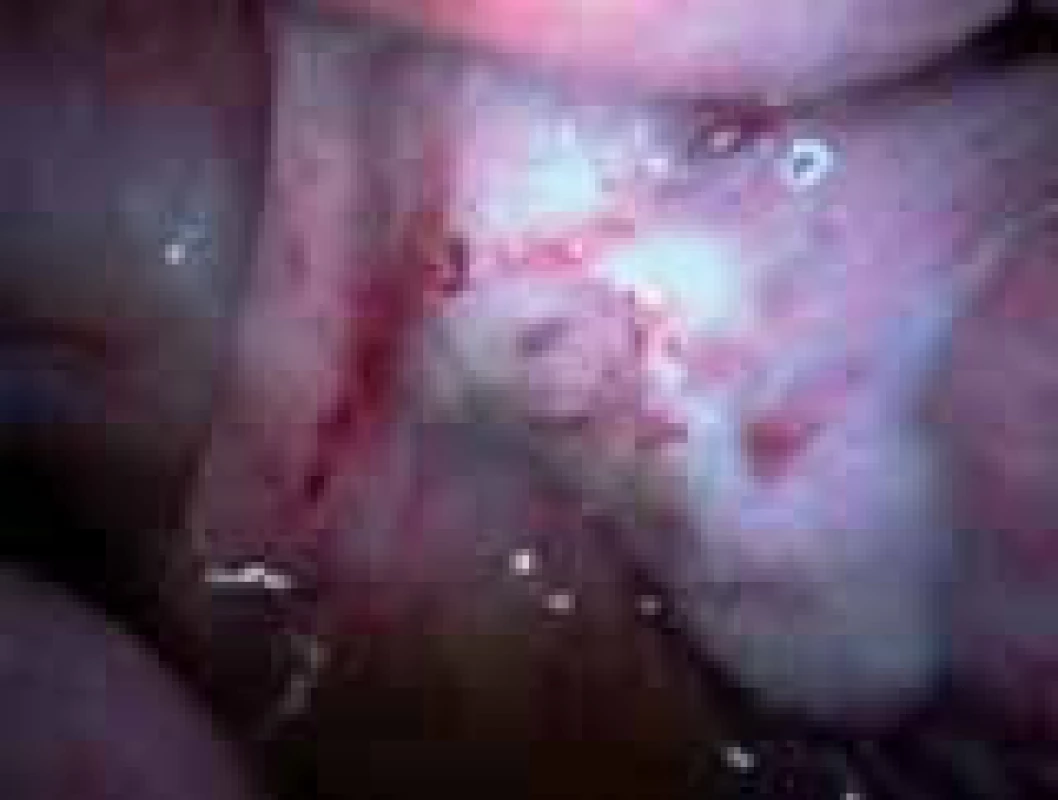
Příznaky POF
Hlavním nálezem u žen s POF je hypergonadotropní hypogonadizmus (nedostatek ovariálních steroidů), který se laboratorně projevuje jako vysoké hladiny folikulostimulačního hormonu (FSH > 40 IU/l), vysoké hladiny luteinizačního hormonu (LH > 25 IU/l) a nízké hladiny 17beta-estradiolu (E2 < 0,1 nmol/l).
Některé případy POF se projevují jako primární amenorea, jiné jako sekundární amenorea po předchozích pravidelných fertilních cyklech, jako post-pill amenorea nebo post partum amenorea. Součástí projevů je rovněž anovulace a sterilita. Některé případy se prezentují typickými perimenopauzálními projevy s oligomenoreou, návaly horka, depresemi, nočním pocením, palpitacemi, poruchami spánku, suchostí sliznic, osteoporózou a zvýšeným rizikem kardiovaskulárních chorob při vyšších hladinách cholesterolu [9].
Samostatnou kapitolou je okultní ovariální selhání, které je charakterizováno anovulací a zvýšenými hladinami FSH při pravidelném menstruačním cyklu. Jedná se o časné stadium předčasného ovariální selhání s nedostatečnou reakcí na stimulaci exogenními gonadotropiny. Predikce ovariálního selhání či diagnostika jeho časných stadií má zásadní význam pro fertilitu ženy, neboť umožní koncepci ještě před kompletním selháním folikulárního aparátu. Při plně rozvinutém onemocnění je šance na spontánní otěhotnění malá a možnosti stimulace ovarií omezené [10].
Diagnostika POF
Indikací k vyšetření gonadotropinů a ovariálních steroidů je amenorea při dosud pravidelném cyklu, vegetativní příznaky hypoestrinizmu, post-pill či post partum amenorea a amenorea primární. Do diagnostického algoritmu POF patří podrobná anamnéza, klinické vyšetření, hormonální screening, vyšetření karyotypu, vyšetření přítomnosti autoimunitních onemocnění a funkce ostatních žláz s vnitřní sekrecí, ultrazvukové vyšetření malé pánve a v indikovaných případech také biopsie ovarií.
Anamnéza
Anamnestické údaje by se měly zaměřit na průběh menstruačního cyklu, klinické projevy vyhasínání ovariální funkce, jako jsou návaly horka, noční pocení, poruchy spánku, palpitace, depresivní nálady, suchost sliznic. Důležité jsou informace o prodělaných autoimunitních onemocněních, předchozích chirurgických operacích v oblasti malé pánve nebo o absolvované chemoterapii či radioterapii.
Klinické vyšetření
Klinické vyšetření u žen s POF většinou prokazuje normální gynekologický nález, mohou být přítomny známky hypoestrinizmu.
Hormonální screening
Laboratorní nález ukazuje zvýšení hladin gonadotropinů (FSH > 40 IU/l, LH > 25 IU/l) a snížení hladiny estradiolu (E2 < 0,1 nmol/l).
Genetické vyšetření
Stanovení karyotypu je doporučeno zejména u žen mladších 30 let z důvodu vyšší incidence gonadálních tumorů u karyotypu 46, XY, kdy je indikována gonadektomie. Genetické vyšetření indikujeme také u žen s rodinnou anamnézou POF a u žen s poruchou plodnosti.
Vyšetření autoimunitních onemocnění
Prevalence s POF asociovaných autoimunitních onemocnění se obtížně odhaduje. V různých publikovaných studiích se široce liší. Imunologické vyšetření je indikováno u hypotyreoidizmu, Addisonovy choroby, diabetes mellitus, revmatoidní artritidy, systémového lupus erythematodes. Screening antiovariálních protilátek má omezený klinický a prognostický význam.
Ultrazvukové vyšetření a biopsie ovarií
Ultrazvukové vyšetření a biopsie ovarií má pro stanovení diagnózy POF relativním význam. Až u 60 % žen s POF lze při vaginální ultrasonografii prokázat folikulární aktivitu. Tento nález však u pacientek s laboratorně prokázaným POF nezvyšuje pravděpodobnost spontánního otěhotnění ani úspěšnost ovariální stimulace. Až u 20 % žen s POF lze i při biopsii ovarií histologicky prokázat přítomnost folikulů, tento nález však rovněž nemá vztah k prognóze onemocnění [11,12].
Diferenciální diagnostika
Diferenciálně diagnosticky je nutno od hypergonadotropního hypogonadizmu při POF odlišit hyperprolaktinemickou anovulaci, hypogonadotropní anovulaci a normogonadotropní anovulaci při syndromu polycystických ovarií.
Iatrogenní (chemoterapií indukované) předčasné ovariální selhání
Chemoterapie je jednou ze základních léčebných modalit u pacientek s maligním onemocněním. Až 10 % žen, které onemocní rakovinou, je ve fertilním věku. U 70-100 % těchto žen patří předčasné ovariální selhání mezi dlouhodobé následky chemoterapie.
Současné poznatky moderní medicíny s použitím metod asistované reprodukce mohou nabídnout vyléčeným onkologickým pacientkám šanci na vlastní děti. Existují 2 základní možnosti prevence sterility onkologických pacientek. Na našem pracovišti u onkologických pacientek ve fertilním věku rutinně provádíme farmakologickou ochranu ovariálních funkcí pomocí aplikace GnRH-analog. GnRH-analoga vedou k inhibici folikulogeneze převedením ovarií do prepubertálního stavu down-regulací receptorů pro gonadotropiny, a tím ke zvýšení rezistence ovaria k chemoterapii. Ověření protektivního účinku GnRH-analog je předmětem prospektivní kohortové studie probíhající v současné době na našem pracovišti. Další skupinou modalit, které mohou vést k záchraně fertility, je kryokonzervace embryí získaných při IVF cyklu před zahájením chemoterapie, eventuálně kryokonzervace oocytů a nebo ovariální tkáně. Zejména metoda kryokonzervace ovariální tkáně a možnosti jejího následného využití včetně vývoje metod in vitro maturace oocytů jsou předmětem jednoho z grantových úkolů naší kliniky [13,14].
Léčebné možnosti POF
Hlavní úsilí při zvládání POF míří k terapii neplodnosti a k substituci chybějících hormonů v organizmu.
Metody asistované reprodukce s využitím darovaného oocytu
Nejspolehlivější a nejúspěšnější metodou dosažení těhotenství u žen s POF je in vitro fertilizace s využitím darovaného oocytu spolu s estrogen-gestagenní přípravou endometria [15]. Stimulace ovulace gonadotropiny je u žen s POF neúčinná. V centrech asistované reprodukce se pregnancy rate v tomto programu u žen s POF pohybuje okolo 40-50 % na cyklus. I přesto, že dítě není geneticky příbuzné matce, je příbuzné pouze otci, je tato varianta léčby neplodnosti u žen s POF všeobecně přijatelná zejména také proto, že žena má šanci těhotenství sama donosit a může dítě kojit [1,16]. Pro ženy, které neakceptují darované oocyty, zůstává asi 5 % šance, že při diagnóze POF mohou spontánně otěhotnět. Tato šance závisí zejména na etiologii POF [1].
Hormonální substituční terapie
Vzhledem k hypoestrinizmu a jeho negativním projevům je u žen s POF nutná hormonální substituce, která se podává jednak ve formě hormonální antikoncepce (HAK) a jednak ve formě hormonální substituční terapie (HST). Exogenně dodávané estrogeny mají příznivý vliv na vazomotorické příznaky nedostatku estrogenů, zabraňují vzniku urogenitální atrofie, příznivě ovlivňují lipidové spektrum, kostní metabolizmus, centrální nervový systém a sexualitu. Mezi nežádoucí účinky patří zvýšení rizika karcinomu prsu a tromboembolické nemoci. U žen s POF se zachovanou dělohou je indikována gestageny oponovaná hormonální substituční terapie nebo kombinovaná hormonální antikoncepce v prevenci vzniku karcinomu endometria. Jednotlivé kategorie žen pro použití HAK nebo HST nejsou jednoznačně stanoveny, mladší ženy většinou užívají HAK, starší ženy pak HST [17-20].
Závěr
Incidence předčasného ovariálního selhání se zvyšuje. Výzkum přinesl nové poznatky o etiologii a patogeneze tohoto onemocnění. Základem léčby neplodnosti při předčasném ovariálním selhání je program darovaných oocytů, hypoestrinizmus je korigován hormonální substitucí.
Doručeno do redakce: 2. 7. 2007
Přijato po recenzi: 11. 8. 2007
MUDr. Ivana Prokopová
doc. MUDr. Igor Crha, CSc.
Gynekologicko-porodnická klinika LF MU a FN Brno
Zdroje
1. Altchek A, Deligdisch L, Kase NG et al. Diagnosis and management of ovarian disorders. London: 2003 : 169-179.
2. Cibula D, Živný J. Syndrom předčasného ovariálního selhání. Čes Gynek 2000; 65(2): 98-102.
3. Wu R, Van der Hoek KH, Ryan NK et al. Macrophage contributions to ovarian function. Hum Reprod Update 2004; 10(2): 119-133.
4. Vital Reyes VS, Tellez Velasco S, Hinojosa Cruz JC et al. Serum levels of IL-1beta, IL-6 and TNF-alpha in infertile patients with ovarian dysfunction. Gynecol Obstet Mex 2005; 73(11): 604-610.
5. Yan G, Schoenfeld D, Penney C et al. Identification of premature ovarian failure patients with underlying autoimmunity. J Womans Health Gend Based Med 2000; 9(3): 275-287.
6. Goswami D, Conway GS. Premature ovarian failure. Hum Reprod Update 2005; 11(4): 391-410.
7. Vital Reyes VS, Tellez Velasco S, Hinojosa Cruz JC et al. Ovarian apoptosis. Gynecol Obstet Mex 2001; 69 : 101-107.
8. Santoro N. Mechanisms of premature ovarian failure. Ann endocrinol (Paris) 2003; 64(2): 87-92.
9. Meskhi A, Seif MW. Premature ovarian failure. Curr Opin Obstet Gynecol 2006; 18(4): 418-426.
10. Cameron IT, O’Shea FC, Rolland JM et al. Occult ovarian failure: a syndrome of infertility, regular menses, and elevated follicle-stimulating hormone concentrations. J Clin Endocrinol Metab 1988; 67(6): 1190-1194 .
11. Vital-Reyes V, Chhieng D, Rodriguez-Burford C et al. Ovarian biopsy in infertile patiens with ovarian dysfunction. Int J Gynecol Pathol 2006; 25(1): 90-94.
12. Massin N, Gougeon A, Meduri G et al. Significance of ovarian histology in the management of patients presenting a premature ovarian failure. Hum Reprod 2004; 19(11): 2555-2560.
13. Huser M, Juránková E, Crha I et al. Fertility preservation strategie in women undergoing chemotherapy for haematological malignancy. Eur Clinics Obstet Gynaecol 2006; 2 : 77-81.
14. Huser M, Juránková E, Crha I et al. Kryokonzervace ovariální tkáně – šance na záchranu fertility žen s nádorovým onemocněním. Čes Gynek 2007; 72(1): 68-73.
15. Hudeček R, Ventruba P, Juránková E. Terapeutické možnosti asistované reprodukce u perimenopauzálních žen. Prakt Gyn 2004; 8(6): 6-9.
16. Žáková J, Vetruba P, Crha I et al. Možnost využití darovaných gamet nebo embryí při léčbě neplodnosti. Prakt Gyn 2006; 10(3): 105-107.
17. Cibula D, Henzl R M, Živný J et al. Základy gynekologické endokrinologie. 1. vyd. Praha: Grada 2002 : 239-274.
18. Fajt T, Vrablík M. Vývoj názorů na vliv hormonální substituční terapie na riziko ischemické choroby srdeční. Prakt gyn 2002; 6(6): 19-21.
19. Fajt T. Má perorální kombinovaná kontracepce vliv na riziko osteoporózy? Prakt gyn 2002; 6(6): 11 - 2.
20. Fajt T. Novinky v klimakterické medicíně. Prakt gyn 2002; 6(4): 18-21.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopisePraktická gynekologie
Nejčtenější tento týden
2007 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Pater semper incertus, sed nonnumquam etiam mater incerta est
-
Autorská soutěž praktické gynekologie
O nejlepší článek v roce 2007 - Edukační kazuistiky
- Štítna žľaza z pohľadu gynekológa
- Diferenciální diagnostika a terapie opakovaných těhotenských ztrát – 1. část
- Předčasné ovariální selhání
- Legální anonymní odložení novorozence – současné možnosti v ČR
- Digitální obrazový archiv
- In vitro maturácia oocytov: naše skúsenosti s prevenciou OHSS u rizikových pacientok
- Odborné akce
- Praktická gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Předčasné ovariální selhání
- Legální anonymní odložení novorozence – současné možnosti v ČR
- Diferenciální diagnostika a terapie opakovaných těhotenských ztrát – 1. část
- In vitro maturácia oocytov: naše skúsenosti s prevenciou OHSS u rizikových pacientok
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání