-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vakcíny proti lidským papilomavirům
Vaccination against human papillomaviruses
Persistent high – risk human papillomavirus (HPV) infection causes virtually almost all the cases of cervical cancer. Ability of HPV – L1 capsid protein to form non-infectious virus-like particles was the basis for developing of prophylactic vaccines. They have safety profile, they are highly immunogenic and they have complete type – specific protection against persistent HPV infection and associated lesions in fully vaccinated women.
Key words:
carcinoma of the uterine cervix - human papillomavirus – HPV - vaccine
Autoři: MUDr. Jiří Sláma; doc. MUDr. Pavel Freitag, CSc.
Působiště autorů: Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha
Vyšlo v časopise: Prakt Gyn 2007; 11(1): 30-32
Souhrn
Většina karcinomů děložního hrdla vzniká v souvislosti s perzistentní infekcí vysoce rizikových kmenů lidských papilomavirů (HR HPV). Schopnosti papilomavirového L1-kapsidového proteinu tvořit neinfekční virus-like částice bylo využito k vývoji profylaktických vakcín, které jsou bezpečné, vysoce imunogenní a vykazují u plně vakcinovaných žen kompletní typově specifickou ochranu proti perzistentní infekci HR HPV a s ní asociovaných lézí.
Klíčová slova:
karcinom děložního hrdla - lidský papilomavirus – HPV - vakcínaÚvod
Karcinom děložního hrdla je po karcinomu prsu druhou nejčastější příčinou úmrtí na zhoubný nádor u žen. Ročně je na světě diagnostikováno přibližně 500 000 nových případů a více než polovina postižených v důsledku onemocnění zemře. Asi 80 % všech nádorů děložního hrdla je diagnostikováno v méně ekonomicky rozvinutých zemích a v zemích s neexistujícím screeningovým programem. Do této skupiny spadá i Česká republika s dlouhodobou incidencí 19-20/100 000 žen.
Rozhodujícím faktorem v etiopatogenezi je infekce lidskými papilomaviry (HPV) [1,2,3]. HPV jsou relativně malé viry s ikosahedrální neobalenou kapsidou a genomem tvořeným jednou 2vláknovou molekulou cirkulární DNA s přibližně 8 000 páry bází. Jejich genom je rozdělen na 3 částí - dlouhou kontrolní oblast (long control region - LCR), oblast časných genů (early region - E) sestávající z genů E 1-8, které kódují nestrukturální časné proteiny zodpovědné za transkripci, replikaci a transformaci, a oblast pozdních genů (late region - L složenou z genů L1 a L2 kódujících strukturální pozdní proteiny formující virovou kapsidu. [1,2,3,4,5]
HPV jsou řazeny do samostatné čeledi papilomaviridae. Jejich klasifikace je založena na odlišnostech ve struktuře DNA kódující oblasti pro časné proteiny E6 a E7 a pozdní protein L1 (tab. 1). V současnosti je známo více než 130 genotypů. Z klinického pohledu jsou HPV členěny na základě onkogenního potenciálu na nízce (low risk – LR: 6, 11, 40, 42, 43, 44, 54, 61, 72 a 81) a vysoce rizikové (high risk – HR: 16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73 a 82). U 99,7 % spinocelulárních karcinomů a 56-94 % adenokarcinomů děložního hrdla je možné prokázat přítomnost DNA HR-HPV [3]. Nejčastěji detegované jsou HPV 16, 18, 31 a 45. WHO uznala typy 16 a 18 za lidské karcinogeny. Přítomnost HPV 16 je možno prokázat u 50-60 % cervikálních karcinomů, přítomnost HPV-18 u dalších 10-20 %. [2] V případě benigních kondylomat jsou v 90-95 % detegovány LR-HPV 6 a 11.
HPV je nejčastějším virovým sexuálně přenosným agens. Díky druhové a tkáňové specifičnosti infikuje pouze lidské proliferující buňky bazálních vrstev epitelu kůže a sliznic. Vstupní branou jsou mikrotraumata kůže a sliznic. Inkubační doba infekce je obvykle 3 měsíce (1,5-8 měsíců). Virové partikule vstupují do zárodečných buněk bazálních vrstev epitelu, v jejichž jádrech replikují. Ke kompletizaci virionů dochází až v diferencovaných buňkách superficiální vrstvy epitelu. [4,5] U benigních a premaligních lézí je virová DNA lokalizována extrachromozomálně - epizomálně, maligní transformace je spojena s inkorporací virového genetického materiálu do genomu.
Populační prevalence infekce je 14-40 % s vrcholem v časné dospělosti (18-25 let). Převážná většina infekce má tranzitorní charakter v důsledku spontánní clearence HPV vyvolané přirozenými imunitními mechanizmy hostitele. Průměrná délka spontánní clearence tzv. clearingový čas je 7-24 měsíců. Pro maligní transformaci je nezbytná perzistence infekce HR-HPV, která je obvykle definována jako infekce detegovaná více než 1krát v období 6 a více měsíců. Interval mezi akvizicí infekce a rozvojem maligního nádoru je minimálně 10 let, obvykle však delší (tab. 2) [1].
Tab. 2. Vztah průběhu mezi HPV infekcí a rozvojem invazivního karcinomu. 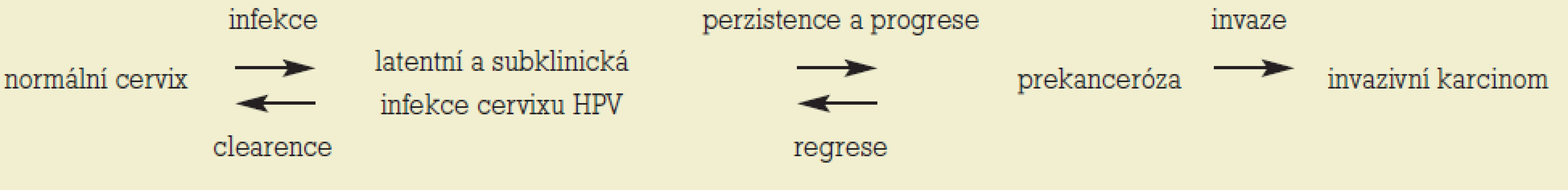
Profylaktické vakcíny
Znalost struktury geonomu HPV i prokázaná souvislost mezi HPV-infekcí a rozvojem karcinomu děložního hrdla vedou k cílení léčebně-preventivních postupů ve snaze eliminovat perzistentní infekci HR-HPV. Základ poznatků vedoucích k vývoji profylaktických vakcín je datován do roku 1991, kdy Zhou et al zjistili, že jsou-li hlavní kapsidové proteiny L1 HPV 16 exprimovány v rekombinantním systému eukaryotickými vektory, vedou k formování prázdných kapsid, tzv. virus-like partikulí (VLP). [6] VLP jsou neinfekční, neobsahují virovou DNA, ale jejich morfologická podoba s viriony a přítomnost imunodominantních epitopů podmiňuje vysokou produkci specifických neutralizačních protilátek. Pro prevenci rozvoje HPV-infekce je stěžejní humorální imunita. Již přítomná HPV-infekce je navíc kontrolována i mechanizmy buněčné imunity.
Velmi příznivé poznatky z klinických experimentů s VLP byly podnětem pro vývoj profylaktických vakcín. Experimentálně byla ověřena schopnost VLP indukovat tvorbu vysokých hladin neutralizačních protilátek, schopnost pasivní imunizace přenosem specifických IgG i průkaz protekce proti homologní HPV-infekci u pokusných zvířat po parenterální vakcinaci VLP. [2] Vývoj vakcín probíhá pod záštitou dvou farmaceutických společností (Merk, resp. MSD a GlaxoSmithKline GSK). Základem obou vakcín je VLP tvořená proteinem L1. Vakcína firmy MSD (Gardasil, Silgard) je produkována kvasinkami, vakcína firmy GSK (Cervarix) je produkována buňkami hmyzu cestou rekombinantního bakuloviru. MSD používá jako adjuvans hydroxyfosfosulfát hlinitý, GSK používá AS04-adjuvans tvořené hydroxidem hlinitým a monofosforylem A (detoxikovaným lipopolysacharidem). Obě vakcíny jsou složeny z purifikovaných částic, které jsou aplikovány v podobě 3 intramuskulárních injekcí během 6 měsíců ve schématu 0., 1. a 6. měsíc, respektive 0., 2. a 6. měsíc. [1,2,7,8]
I přes fylogenetickou příbuznost jednotlivých onkogenních typů HPV jsou imunodominantní epitopy jejich VLP vedoucí k produkci neutralizačních protilátek typově specifické. Proto bylo nutné první generaci vakcín zacílit proti nejčastěji diagnostikovaným typům. To vedlo obě společnosti k výběru HPV 16 a 18, prokazovaných asi u 70 % nádorů děložního hrdla. Vakcína firmy Merck navíc obsahuje i HPV 6 a 11, dominantní původce benigních kondylomat.
Za cílové kritérium hodnocení účinnosti vakcíny byla při sledování spolehlivosti vakcín stanovena redukce incidence typově specifické perzistentní HPV-infekce a s ní sdružených high-grade cervikálních intraepiteliálních neoplazií (CIN 2+) obsažených ve vakcíně. Primární hodnocení redukce incidence zhoubných nádorů cervixu by vedla k etickému rozporu, neboť je možná již ošetřením na úrovni těžkých prekanceróz; v zemích s efektivním screeningovým programem je tato cesta velmi úspěšná.
Publikované výsledky follow-up plně vakcinovaných žen, které byly HPV 16, 18, případně i 6 a 11 negativní před zahájením i po celou dobu očkování, ukázaly – na rozdíl od výsledků kontrolní kontrolní skupině – 100% spolehlivost ochrany proti rozvoji CIN 2+ asociovaných s HPV 16 a 18 a proti kondylomatům asociovaným s HPV 6 a 11. Již 1 měsíc po podání první imunizační dávky lze prokázat asi 90% protektivitu. [7,8,9,10] Průběh imunitní odpovědi přináší po parenterální imunizaci a iniciálním vzestupu hladiny sérových protilátek perzistenci jejich stabilní hladiny. Titry protilátek zjišťované po aktivní imunizaci jsou ve srovnání s imunitní odpovědí při infekci 50–80krát vyšší (tab. 3) [2].
Tab. 3. Přehled studií s profylaktickými vakcínami. 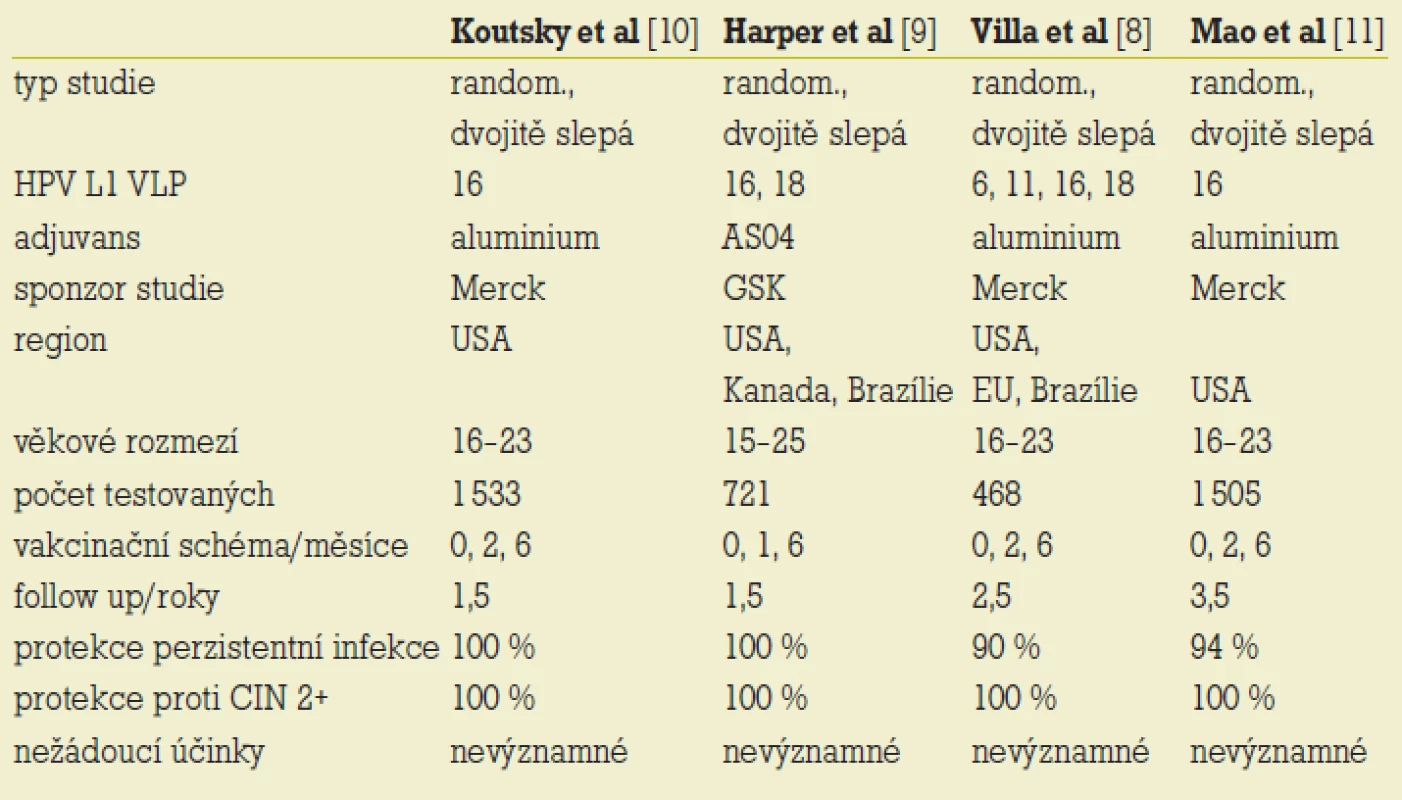
Studie s monovalentní vakcínou proti HPV 16 firmy Merck nepřinesly informace o incidenci infekce ostatními onkogenními typy HPV. Sledované soubory však nevykazovaly rozdíly v počtech zjištěných nonHPV 16 asociovaných dysplazií u očkovaných a v kontrolní skupině. Studie firmy GSK po vakcinaci bivalentním preparátem s HPV 16 a HPV 18 přinesla navíc zisk určitého stupně zkřížené protektivity proti HPV 31 a 45, která však nedosahovala takové komplexnosti jako v případě typově specifické ochrany. [7] Přesto jde o významný faktor, který může potencovat efektivitu vakcíny.
Ačkoliv profil obou vakcín vykazuje vysokou bezpečnost a spolehlivost, přetrvává potřeba zodpovědět řadu dalších otázek. Pokračující follow-up očkovaných žen má přinést odpověď, jak dlouho bude udržována velmi vysoká hladina specifických protilátek a zda, případně kdy, bude třeba provést revakcinaci. Faktorem s dopadem na podání boostovací dávky bude též délka přetrvávání zkřížené protektivity. Její slábnutí je totiž obecně významně rychlejší než u ochrany specifické.
Nejen medicínskou, ale i eticko-společenskou otázkou zůstává složení cílové skupiny vhodné k vakcinaci. Nedostatečná data o účinku vakcinace u mužů vedla k primární vakcinaci žen. Hlavní profit z preventivního účinku vakcíny nastane při HPV-negativitě před i po celou dobu vakcinace, z čehož vyplývá, že prioritní cílovou skupinou jsou ženy a dívky, které ještě nezahájily pohlavní život. I ženy již sexuálně aktivní mohou mít prospěch z účinku preventivní vakcíny, ale lze předjímat, že bude nepřímo úměrný k délce trvání a intenzitě předchozího sexuálního života. První pozitivní dopad vakcinace lze očekávat v podobě poklesu incidence high-grade prekanceróz CIN 2+ spojených s perzistencí infekce příslušných kmenů HPV. Dopad na snížení incidence invazivních nádorů bude možné s ohledem na dlouhou dobu rozvoje maligního procesu hodnotit až v horizontu desetiletí.
8. června 2006 byl americkou FDA (Food and Drug Adminstration) schválen Gardasil firmy Merck jako první vakcína určená pro prevenci karcinomu děložního hrdla a prekanceróz dolního genitálního traktu. Indikace k jeho podání shrnuje tab. 4. Vakcinace je určena pro ženy a dívky ve věkovém rozpětí 9–26 let. Podle ACIP (Advisory Committee on Immunisation Practices) a CDC (Center for Disease Control) je rutinní vakcinace doporučena pro dívky mezi 11–12 lety, může být však zahájena již u dívek 9letých. Ženy mezi 13–26 lety lze též očkovat. V této věkové kategorii bude vakcinace zvláště přínosná pro ty, které ještě nezahájily pohlavní život. Pro Evropskou unii schválila 20. září 2006 EMEA (European Agency for the Evaluation of Medical Products) použití vakcíny společnosti Merck (resp. MSD) za stejných podmínek jako v USA. Do České republiky bude vakcína distribuována pod označením Silgard.
Tab. 4. Změny, k jejichž prevenci je učena kvadrivalentní vakcína. 
Terapeutické vakcíny
Zatímco očekávaný benefit profylaktických vakcín se dostaví v řádech desetiletí, terapeutické vakcíny by mohly toto období překlenout působením na již vzniklé HPV-infekce a na onemocnění dolního genitálního traktu, která jsou HPV podmíněna. Vývoj terapeutických vakcín však představuje mnohem obtížnější problém než v případě vakcín profylaktických. Je totiž nutné, aby obsahovaly antigenní determinanty odvozené od časných proteinů – zejména E6 a E7 – které jsou odpovědné za indukci a udržování maligního fenotypu. Většina publikovaných studií pracuje s chimérickými vakcínami zaměřenými proti proteinu E7. Ten má totiž hojnější expresi a jasnější a stabilnější imunologickou charakteristiku. [2]
Sledován byl také terapeutický potenciál profylaktických vakcín. Jejich léčebným mechanizmem však pravděpodobně není přímý účinek na již vzniklé léze, nýbrž omezení schopnosti přenosu časné infekce z místa na místo v důsledku působení specifických protilátek. [2]
Závěr
Lidské papilomaviry jsou kauzálně spojeny s procesem kancerogeneze. Hlavní příčinou je perzistentní infekce onkogenními high-risk typy, nejčastěji HPV 16, 18, 31 a 45. Poznatky o této unikátní vazbě vedly k vývoji profylaktických vakcín obsahujících neinfekční imunogenní virus-like částice, které jsou schopny navodit tvorbu specifických protilátek proti konkrétním typům HPV. Ve studiích vykazují vysokou spolehlivost a účinnost. Specifická obrana s podílem zkřížené obrany přesahuje u žen, které byly před zahájením vakcinace HPV negativní, 90 %. Vývoj terapeutických vakcín představuje obtížnější problematiku vzhledem k odlišným imunitním mechanizmům, které se uplatňují u již vzniklých premaligních a maligních onemocnění souvisejících s přítomností papilomavirů.
MUDr. Jiří Sláma
doc. MUDr. Pavel Freitag, CSc.
Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha
Zdroje
1. Lowy DR, Schiller JT. Prophylactic human papillomavirus vaccines. J Clin Invest 2006; 116 : 1167-1173.
2. Mohdavi A, Monk BJ. Vaccines agains human papillomavirus and cervical cancer: Promises and challenges. Onkologist 2005; 10 : 528-538.
3. Prendiville W, Davies P. The health professional’s HPV handbook. Abingdon: Taylor and Francis 2004.
4. Freitag P. Papillomavirové infekce v gynekologii. Praha: Triton 1998.
4. Sláma J. Kondylomata accuminata ženského genitálu. Mod Gynek Porod 2005; 14 : 231-237.
5. Zhou J, Sun XY, Stenzel DJ et al. Expression of vaccinia recombinant HPV 16 L1 and L2 ORF proteins in epithelial cells is sufficient for assembly of HPV virion-like particles. Virology 1991; 185 : 251-257.
7. Harper DM, Franco EL, Wheeler CM et al. Sustained efficacy up to 4.5 years of a bivalent L1 virus-like particle vaccine against human papillomavirus types 16 and 18: follow-up from randomised control trial. Lancet 2006; 367 : 1247-1255.
8. Villa LL, Costa RL, Petta CA et al. Prophyllactic quadrivalent human papillomavirus (types 6, 11, 16 and 18) L1 virus-like particle vaccine in young women: a randomised double blind placebo-controlled multicentre phase II efficacy trial. Lancet Oncol 2005; 6 : 271-278.
9. Harper DM, Franco EL, Wheeler C et al. Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with human papillomavirus types 16 and 18 in young women: a randomised controlled trial. Lancet 2004; 364 : 1757-1765.
10. Koutsky LA, Ault KA, Wheeler CM et al. A controlled trial of a human papillomavirus type 16 vaccine. N Engl J Med 2002; 347 : 1645-1651.
11. Mao C, Koutsky LA, Ault KA et al. Efficacy of human papillomavirus-16 vaccine to prevent cervical intraepithelial neoplasia: a randomised controlled trial. Obstet Gynecol 2006; 107, 18–27.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopisePraktická gynekologie
Nejčtenější tento týden
2007 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Optimalizovaný postup při provádění spinální anestezie pro císařský řez
- Astma bronchiale v těhotenství
- Amniocentéza - bezpečná metoda invazivní prenatální diagnostiky
- Rooming in
- Per aspera ad astra…
- Vakcíny proti lidským papilomavirům
- Korelácia natívnej mamografie a histológie karcinómu prsníka do 10 mm
- PRAKTICKÁ UROGYNEKOLOGIE XV. – Mělník 2006
-
Autorská soutěž praktické gynekologie
O nejlepší článek v roce 2007 - Odborné akce
-
Celostátní konference
Sdružení soukromých gynekologů ČR a České gynekologické a porodnické společnosti ČLS JEP 25.–27. května 2007, TOP hotel, Praha
Seminář porodních asistentek
26. května 2007, TOP hotel, Praha - Zvyšuje IVF incidenci zhoubného nádoru ovaria?
- Edukační kazuistiky
- Praktická gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Astma bronchiale v těhotenství
- Optimalizovaný postup při provádění spinální anestezie pro císařský řez
- Rooming in
- Amniocentéza - bezpečná metoda invazivní prenatální diagnostiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




