-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Úspěšnost identifikace axilárních sentinelových uzlin
Effectiveness of axillar sentinel lymph node detection
Introduction:
Sentinel Lymph Node Biopsy (SLNB) is a standard method in the early stage of breast cancer in axillar surgery. It presumes a team cooperation.Goal:
To assess the effectiveness of location and detection of Sentinel Lymph Node (SLN) after their labeling with a radiopharmaceutical in further context.Methods:
We retrospectively evaluated a group of 172 patients with the early stage of breast cancer (average age 63 (32–87) y) in whom the SLNB concept was used during surgery from 1/2010 to 12/2015. Two-day protocol for labeling and detection was used at the department of nuclear medicine.Results:
Labeling of SLN succeeded in 99.4 %, only in one case SLN was not labeled neither with radiopharmaceutical nor with color. 1 to 3 SLN were detected in 92 %, 4 and more in 8 %. Suspected Non-Sentinel Lymph Nodes (NSLN) except of SLN were removed in 25 % during surgery. Primary axillar disection or sampling was done in 10 %. SLN were negative in 72 %, with macrometastases in 17 %, with micrometastases in 8 % and with isolated malignant cells in 3 %. False negative SLN were in 3/172 pts. Axillar disection was indicated in 17/29 pts with macrometastases, in 12/29 such pts radiotherapy and systemic treatment were prefered. Remote metastases were detected in 4/172 pts, upper extremity lymphedema was present in 8/172 pts.Conclusion:
Our data support effectivity of labeling and detection of SLN as well as necessity of team cooperation.Key Words:
early breast cancer, sentinel lymph node, metastases
Autoři: Ivana Bradáčková 1; Věra Benešová 2; Lubomír Slavíček 2; Zdeněk Eibel 3; František Molva 3; Vladimír Šuťak 3; Michal Kheck 4
Působiště autorů: Oddělení zobrazovacích metod 1; Onkologické oddělení 2; Chirurgické oddělení 3; Patologicko-anatomické oddělení, Nemocnice Jihlava p. o., ČR 4
Vyšlo v časopise: NuklMed 2016;5:27-32
Kategorie: Původní práce
Souhrn
Úvod:
V axilární chirurgii je dnes u časného karcinomu prsu standardem tzv. biopsie sentinelové uzliny (Sentinel Lymph Node Biopsy – SLNB), která předpokládá týmovou spolupráci.Cíl:
Posoudit úspěšnost identifikace a detekce sentinelových uzlin (Sentinel Lymph Node – SLN) po jejich značení radiofarmakem v kontextu dalších souvislostí.Metoda:
Retrospektivně hodnocen soubor 172 pacientek s časným karcinomem prsu (průměrný věk 63 let, věkové rozmezí 32–87 let), kdy byla v období 1/2010 – 12/2015 při chirurgické léčbě využita koncepce SLNB. Při předoperačním značení a detekci na pracovišti nukleární medicíny byl využíván dvoudenní protokol.Výsledky:
V 99,4 % souboru bylo značení SLN úspěšné, v jediném případě se SLN nezobrazily ani po označení radiofarmakem, ani barvivem. V 92 % detekovány 1–3 SLN, v 8 % 4 a více. Peroperačně exstirpovány mimo SLN ve 25 % i podezřelé NSLN (Non-Sentinel Lymph Node), disekce axily v první době popř. sampling v 10 %. V 72 % byly SLN negativní, v 17 % s makrometastázami, v 8 % s mikrometastázami a ve 3 % s izolovanými nádorovými buňkami. U 3/172 pacientek byly SLN falešně negativní. Disekce axily byla indikována u 17/29 pacientek s prokázanou makrometastázou v SLN, u 12/29 upřednostněna radioterapie a systémová léčba. U 4/172 pacientek byly zjištěny vzdálené metastázy, u 8/172 lymfedém horní končetiny.Závěr:
Uvedená data dokumentují úspěšnost značení a detekce SLN stejně jako nutnost těsné týmové spolupráce.Klíčová slova:
časný karcinom prsu, sentinelové uzliny, metastázyÚVOD
V axilární chirurgii je dnes u časného karcinomu prsu standardem tzv. biopsie sentinelové uzliny (Sentinel Lymph Node Biopsy – SLNB). Umožňuje přesné zjištění stavu postižení lymfatického systému, i když nejsou spolu s primárním tumorem odstraněny všechny spádové axilární uzliny jako v případě disekce axilárních lymfatických uzlin (Axillary Lymph Node Disection – ALND). Současně se takto snižuje operační zátěž nemocných a redukuje výskyt závažné pooperační komplikace – lymfedému. Koncepce vychází z předpokladu, že vyšetření sentinelových uzlin (Sentinel Lymph Node – SLN) může predikovat pravděpodobnost postižení dalších uzlin ve vyšších etážích. 1 První SLN je obecně definována jako první uzlina či uzliny v lymfatickém povodí nádoru, do kterého je nádor drénován, a které případné migrující nádorové buňky nemohou minout. Zde také mohou být metastázy nejpravděpodobněji přítomny. Jejich průkaz či nepřítomnost v SLN má pak zásadní prognostický význam a nejen u karcinomu prsu se staly nejdůležitějším kritériem v rozhodování o adjuvantní systémové léčbě. Jak je všeobecně známo, SLNB je postup, který v klinické praxi vyžaduje týmovou spolupráci specialistů několika oborů.
CÍL
Cílem sdělení je zhodnotit jednak úspěšnost identifikace SLN na pracovišti nukleární medicíny (NM), jednak na základě výsledků ověřit spolehlivost týmové spolupráce v kontextu stávající metodiky SLNB.
MATERIÁL A METODA
V období 1/2010 – 12/2015 jsme na pracovišti NM značili SLN u 201 nemocných s časným karcinomem prsu (T1N0M0). Do hodnoceného souboru jsme pak zařadili 172 žen s touto diagnózou (z toho 1x šlo o oboustranný souběžný časný karcinom prsu), u kterých byla při chirurgické léčbě v jihlavské nemocnici využita koncepce SLNB a dosud jsou pravidelně ambulantně sledovány onkologem KOC Jihlava. Průměrný věk sledovaných žen byl 63 let (věkové rozmezí 32–87 let), průměrná doba sledování pacientek 2,6 roku (rozmezí 0,5 až 5,5 roku). Do souboru jsme nezařadili 27 žen, u kterých jsme sice axilární SLN značili, avšak ostatní podmínky splněny nebyly, a dále dva mužské pacienty. Indikace k vyšetření SLN, značení a jejich následná detekce, vlastní operační výkon a postup při bioptickém zpracování SLN patologem probíhal v souladu s platným standardem „Postup při vyšetření sentinelové uzliny při operaci karcinomu prsu“ v rámci řízených dokumentů Nemocnice Jihlava p. o., jak dále uvádíme.
Indikace k vyšetření SLN: karcinom prsu maximální velikosti do 20 mm bez palpačního nálezu v axile, tedy klinická klasifikace T1N0M0. Vyloučeny byly jednak případy se sonografickým podezřením na metastatické postižení axilárních uzlin, jednak zvýšeným rizikem postižení uzlin na základě diagnostické biopsie primárního nádoru, zejména grade 3 a 4 s eventuální nepřítomností obou steroidních receptorů (pokud bylo imunohistochemické vyšetření provedeno již z biopsie). Indikace k detekci SLN probíhala v onkochirurgické komisi Komplexního onkologického centra (KOC) Jihlava (onkolog, onkochirurg, rentgenolog, patolog, lékař se specializací nukleární medicína). Pacientky byly současně informovány o možném rozsahu chirurgického výkonu (mastektomie totální/parciální včetně exstirpace SLN), o možnosti jak dvoudobé operace v axile, tak i provedení kompletní disekce axily v jedné době.
Předoperační značení a detekce SLN na pracovišti NM: den před operačním výkonem po poučení v rámci informovaného souhlasu a stranové kontrole jsme nejdříve aplikovali periareolárně lokální anestetikum (Lidocain 10% sprej).
S několikaminutovým odstupem pak 99mTc-Senti-Scint (Seroalbuminum humanum colloidalis, MEDI-RADIOPHARMA Ltd., HU) s velikostí částic více než z 80 % v rozmezí 100–600 nm, a to periareolárně subdermálně 6 injekcí o objemu 0,2 ml, s celkovou aktivitou 120 MBq. Následovala lokální masáž, kterou prováděla sama pacientka po dobu 5 min. K detekci jsme využívali jednak hybridní kameru pro SPECT/CT Philips Precedence 6P, jednak dvouhlavou kameru pro SPECT Toshiba GCA-7200A/UI, vždy s kolimátory LEHR. Samotná detekce se realizovala při elevované ipsilaterální horní končetině v následujících krocích:
- dynamická scintigrafie hrudníku v příslušné přední šikmé projekci vleže po dobu 20 min (zobrazení dynamických skenů po jedné minutě, tj. 20 skenů) s následným statickým skenem (5 min),
- ihned poté časná planární scintigrafie hrudníku v přední projekci vleže (5 min),
- s odstupem 2 h po aplikaci radiofarmaka (RF) pozdní planární scintigrafie hrudníku v přední projekci vleže (5 min),
- příslušná přední šikmá projekce vleže, ev. vstoje,
- značení projekce SLN nesmytelným markerem na kůži v příslušné přední šikmé projekci. Následoval popis s interpretací nálezu.
Vlastní operační výkon: probíhal vždy další den, po kontrolním vyšetření pacientky chirurgem a podrobným seznámením s rozsahem operace, možnými variantami i riziky. Při výkonu na prsní žláze bylo standardem kompletní odstranění nádoru s negativními okraji, a to formou mastektomie anebo konzervativního výkonu, s exstirpací SLN s následnou biopsií. Peroperační orientace v axile se zaměřením na SLN byla zajištěna označením projekce SLN na kůži, navigace a detekce scintilační sondou Europrobe (Canberra Packard). Nastavení sondy a její používání ve sterilním terénu se řídilo Standardem centrálních operačních sálů. Za SLN byly považovány uzliny s přesvědčivou detekcí sondou Europrobe jak in vivo, tak posléze i in vitro. Po exstirpaci byly SLN v patřičně označených transportních nádobách odeslány k definitivnímu histologickému zpracování na patologii. Při exstirpaci SLN se operatér řídil obecnými pravidly platnými pro preparaci v axile. Pokud při jejich vyhledávání zjistil neočekávanou patologii v oblasti uzlin, byl oprávněn v jedné době provést kompletní disekci axily. V případě neúspěšné identifikace SLN značením RF bylo doporučeno použít k jejich identifikaci patentní modř V (postup: 10 min před operací 4x peritumorózní aplikace vždy 0,5 ml preparátu).
Při bioptickém zpracování SLN patologem se dodržovaly tyto postupy:
- když operatér požadoval peroperační zhodnocení SLN, přepůlila se tato uzlina/y podél nejdelší osy, zhotovil se peroperační kryořez. O výsledku patolog informoval operatéra. Peroperačně negativní SLN byla později zpracovávána v protokolu SLN, pozitivní jako nesentinelová.
- pooperační zpracování SLN záviselo na jejich velikosti. Do maximálního průměru 4 mm se SLN pouze přepůlila a zpracovaly se obě poloviny. Větší byla kompletně nakrájena na cca 1,5 mm plátky a po řadě zablokována. Ze všech bloků materiálu zalitého do parafínu se nakrájely na jedno sklo 4–5 mm řezy obarvené hematoxylin-eozinem (H&E). Pokud byla v tomto preparátu metastáza, dále se v prokrájení nepokračovalo a uzavřela se diagnóza. V opačném případě a po současném ověření, že primární ložisko bylo invazivní malignita nebo high-grade duktální karcinom in situ (DCIS), se v dalším kole provedla prořezávka a imunohistochemie (IHC) ze všech dalších bloků. Tento postup se dále po 500 mm opakoval až do vyřezání veškerého materiálu v parafínovém bloku. Preparáty se obarvily H&E, následná IHC pak s protilátkou AE1/AE3 (koktejl cytokeratinů). Spolehlivé hodnocení a výslednou diagnózu umožňoval vedle zkušeností patologa i software pro digitální analýzu obrazu a digitální kamera. Takto byla prokazována přítomnost makrometastáz (MTS), kdy je nádorová infiltrace ≥ 2 mm, mikrometastáz s nádorovým ložiskem velikosti od 0,2 do 2 mm a izolovaných nádorových buněk (isolated tumor cells, ITC) s jednotlivými nádorovými buňkami anebo jejich shluky o průměru ≤ 0,2 mm v nejdelším rozměru.
Definitivní pooperační zhodnocení nálezů a stanovení dalšího postupu bylo plně v kompetenci onkologa. Odvíjelo se od histopatologického nálezu v SLN v kontextu nálezů ostatních. Po komplexním zhodnocení pak onkolog indikoval jak ev. disekci axily v druhé operační době, tak následnou adjuvantní terapii (tj. radioterapii a systémovou terapii).
VÝSLEDKY
U 172 pacientek proběhlo značení a detekce SLN celkem 173x, v 99,4 % (172/173) s úspěchem. V jediném případě se SLN nezobrazily nejen po značení RF, ale ani další den peroperačně po předchozí peritumorózní aplikaci patentní modři V. V 92 % souboru (159/173) jsme poté detekovali v axile 1–3 SLN, v 8 % (14/173) se zobrazily 4 a více SLN, z toho jedenkrát více než 10. Počet exstirpovaných SLN byl v 83 % (143/173) 1–3, v 17 % (30/173) více než 4. Při výkonu v axile v první operační době byly mimo SLN odebrány v některých případech i NSLN. (Graf 1) Zásadní informace přineslo následné histopatologické vyšetření SLN (Graf 2) doplněné o obdobné vyšetření i odebraných NSLN. Zde jsme pak 3x konstatovali tzv. falešnou negativitu SLN, když ve 3/173 případů byly SLN po zhodnocení patologem sice negativní, ale následně vždy v jedné z odebraných podezřelých NSLN byla prokázána makrometastáza. Ne u všech 17 % žen souboru s přítomnou makrometastázou v SLN byla provedena disekce axily. (Graf 3) Klinické sledování souboru pacientek přineslo informace o vývoji onemocnění. (Tab. 1)
Graf 1. Výsledky – operační výkon v axile (první operační doba), odebrané sentinelové (SLN) a nesentinelové uzliny (NSLN). 
Graf 2. Výsledky – histopatologické vyšetření sentinelových uzlin (SLN - sentnelová uzlina, ITC - izolovaná nádorovách buňka). 
Graf 3. Výsledky – disekce axily u 29 pacientek s makrometastázou v sentinelové uzlině. 
Tab. 1. Výsledky – klinické sledování (průměrná doba 2,6 roku) – vývoj onemocnění, komplikace, úmrtí. 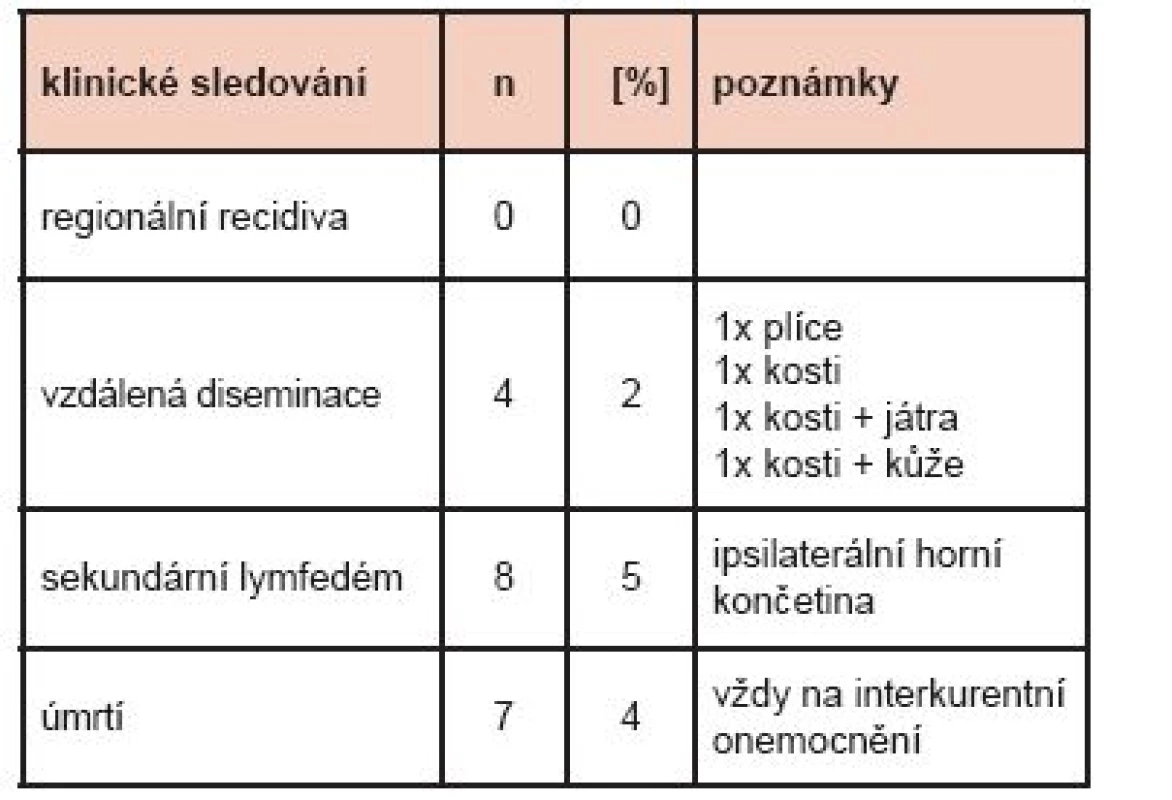
DISKUZE
SLNB u časného karcinomu prsu se stala v současnosti metodou první volby. V našem souboru sledujeme pacientky s klinickou klasifikací T1N0M0, i když nyní indikuje onkochirurgická komise k SLNB i pacientky s klasifikací T2N0M0. S identifikací SLN včetně více než 4letého období „learning curve“ v letech 2005–2009, kdy jsme postupně hodnotili dva soubory celkem 62 pacientek, máme téměř 11leté zkušenosti. Metodika SLNB byla vypracována v onkochirurgickém týmu KOC Jihlava a je zakomponována do systému Standardních operačních postupů (SOP) řízených dokumentů zdejší nemocnice. Je průběžně aktualizována v návaznosti jak na nové poznatky této problematiky, tak na zkušenosti specialistů. V současnosti diskutujeme možnost zobrazení SLN metodou SPECT/CT, avšak existují výhrady – zvýšení radiační zátěže a názor, že metoda nepřináší významné zlepšení detekce. Ročně se v KOC Nemocnice Jihlava p. o. léčí s karcinomem prsu všech stádií průměrně 120 pacientek. Zdejší onkochirurgové operovali v uplynulém roce 67 pacientek s touto diagnózou, průměrný každoroční počet výkonů v protokolu SLNB byl ve sledovaném období 28; to vše dokumentuje jejich dostatečnou erudici. Na základě zkušeností v období „ learning curve“ tým zvolil dvoudenní protokol značení SLN s periareolární subdermální aplikací RF. K velikosti nosiče RF poznamenáváme, že i když je dle literatury 1,2 preferovanou velikostí koloidních částic 80–100 nm, preparát, který používáme a velikost jehož částic je z 80 % v rozmezí 100–600 nm, se v klinické praxi osvědčil. (Obr. 1 A, B, C) V současné době se při značení SLN v rámci klinické studie v Masarykově onkologickém ústavu zkouší a porovnává využití nanočástic, které je možno detekovat pomocí magnetického pole 3, tedy bez využití radioaktivity. Při rozhodování o volbě místa aplikace RF jsme v letech 2005–2009 vycházeli z literárních údajů, kdy nejúspěšnější detekci axilárních SLN uváděly protokoly po periareolární subdermální aplikaci RF. 4 Dle lymfatického mapování 5 u většiny žen tvoří prs jedno lymfatické povodí, parenchym mléčné žlázy i její kožní kryt mají shodný lymfatický cévní systém, pravděpodobně při společném embryonálním základu v ektodermu. Lymfatická síť je nejhustší při okraji areoly ve smyslu tzv. Sappeyho plexu, kde se mísí lymfa z celého prsu. Dále pak odtéká dvěma velkými superficiálními lymfatickými cévami do axily, která je takto primární spádovou oblastí lymfy prsu. Zde ústí kolektory do lymfatické uzliny/uzlin v distální části axily a tyto lze tak považovat za uzlinu/uzliny sentinelové. Takto je drénováno dle současných názorů 75–90 % lymfy. 1 Tomu odpovídají i naše zkušenosti. Sekundárního charakteru se jeví drenáž do parasternálních uzlin. Pokud by byly v SLN v této lokalizaci přítomny metastázy, jsou většinou současně přítomny i v SLN v příslušné axile. Izolovaný výskyt metastáz jen v parasternálních SLN byl pozorován pouze ve 4–7 %. 1 V současné době je postoj k detekci a případné exstirpaci parasternálních SLN kontroverzní a stále dosud předmětem diskuzí. 1,2,6 Z chirurgického hlediska se jeví sporné, zda případná náročná exstirpace této SLN přináší operované ženě prospěch, když benefit v celkovém přežití prokázán nebyl, a to ani po radioterapii. 7 V našem souboru jsme parasternální lokalizaci SLN neprokázali, ojediněle pak v lokalizaci supraklavikulární a infraklavikulární. Počet axilárních SLN je variabilní 8, v našem souboru se scintigraficky zobrazily v 92 % 1–3 SLN, avšak 1x jsme detekovali i více než 10 SLN. Máme zkušenost i se stranovou variabilitou jejich počtu, a to u pacientky našeho souboru s oboustranným karcinomem prsu. Asymetrie počtu SLN, zjištěná při jejich detekci, byla potvrzena další den peroperačně. Obdobnou zkušenost jsme učinili ještě jedenkrát, ale tato pacientka byla operována na jiném pracovišti a neměli jsme tak možnost nález verifikovat. Úspěšnost detekce SLN byla v našem souboru 99,4 %, v jediném případě byl neúspěšný i protokol kombinovaný s patentní modří V. Peroperačně proto u této 36leté pacientky chirurg rozhodl o disekci axily v první operační době, později patolog popsal u 12/13 odebraných uzlin nádorovou infiltraci. Zda příčinou selhání obou metod byla tato skutečnost anebo přetrvávající hematom o rozměru 3 x 3 cm v zevním horním kvadrantu prsu po core-cut biopsii, ev. šlo o kombinaci obou, nebylo možno jednoznačně rozhodnout. Počet peroperačně odebraných SLN byl v našem případě nejčastěji 1–3, a to zcela v souladu s literaturou 9, méně často i vyšší. Exstirpovali jsme vždy všechny uzliny, které splňovaly obecně známá kritéria chirurgické definice SLN (medián našeho souboru 2, jak se udává i u velkých souborů 8). Za SLN jsme považovali každou uzlinu, která vykazovala přítomnost radioaktivity. Chceme zdůraznit nutnost důkladného klinické posouzení i nesentinelových uzlin (NSLN) v axilárním prostoru, kdy při klinickém podezření jsme exstirpovali separátně i tyto uzliny k histologickému vyšetření. Zde je nutno brát vždy v úvahu možnost zablokování skutečné SLN metastázou a odklonění toku lymfy do NSLN. V našem souboru tak byly v první operační době celkem ve 35 % z axily mimo SLN odebrány i NSLN. Definitivní počet odebraných SLN, popřípadě i NSLN, upřesnil až patolog po jejich preparaci z tukového tělesa axily před bioptickým zpracováním. Peroperační (freeze) biopsii SLN, která má svá technická úskalí, indikovali operatéři jen 3x, z toho u jedné z pacientek byla u 1/3 SLN potvrzena makrometastáza. Odebrané SLN byly v případě negativního nálezu dále zpracovány dle protokolu. Senzitivitu záchytu MTS peroperační biopsií uvádějí autoři až v 75 %. 10 Převaha axilárních SLN našeho souboru byla bez přítomnosti metastáz či minimálního metastatického postižení (tzv. negativní SLN) zcela ve shodě s literaturou 6, přítomnost makrometastáz byla v 17 %. Literatura udává přímý vztah mezi velikostí primárního nádoru a metastazováním do lymfatických uzlin, kdy s narůstající velikostí nádoru se zvyšuje i počet postižených uzlin 1, a to u T1 v 10–32 %, popř. 5–28 %, u tumorů menších než 1 cm pak v 10–20 %. Vztah mezi velikostí primárního nádoru a přítomností metastáz jsme však ve sledovaném souboru blíže nehodnotili. Mikrometastázy samotné jsme zjistili v 8 % a ITC ve 3 %. (Obr. 2, 3, 4) Jejich přítomnost v SLN sice patrně statisticky zhoršuje prognózu onemocnění proti nemocným bez jejich výskytu, avšak adjuvantní léčba horší prognózu zcela mění. Na celkové přežití a přežití bez projevů onemocnění má signifikantní vliv systémová léčba a nikoliv disekce axily. 11 Avšak u jedné ze čtyř pacientek našeho souboru s progresí onemocnění ve smyslu metastáz skeletu (verifikováno SPECT/CT) jsme konstatovali při střední proliferační aktivitě nádorových buněk právě mikrometastázu v 1/2 SLN. 12 U žen s metastatickým postižením SLN (jedna nebo dvě makrometastázy) se v současné době připouští i možnost vynechat axilární disekci, a to pokud byla provedena lumpektomie a radioterapie, jedná se o příznivější charakter nádoru u pacientek po menopauze, s odpovídající systémovou terapií. 11 Názor je v souladu s doporučeními National Comperhensive Cancer Network (NCCN). V našem souboru při pozitivitě 29/173 SLN (rozumí se přítomnost makrometastázy v SLN) volil onkolog v rozvaze o další léčbě po důkladném komplexním zhodnocení všech nálezů vždy individuální přístup. Neindikoval tak disekci v druhé operační době u pacientek polymorbidních, vyššího kalendářního věku se současným příznivějším histologickým profilem nádoru (pozitivita hormonálních receptorů, nízký grading….). U těchto bylo i riziko komplikací po případné disekci axily vysoké a byly tak indikovány k další adjuvantní onkologické léčbě. U 17/29 nemocných disekce axily proběhla, z toho u tří již v první operační době, ve shodě se zkušenostmi dalších autorů. 10 Rozsah a techniku axilární disekce jsme nehodnotili. Pokud jsme konstatovali u 3/172 pacientek tzv. falešnou negativitu SLN (1,7 %), vždy šlo o průkaz metastázy pouze v jediné z odebraných NSLN. Kdyby se neprovádělo důkladné klinické peroperační hodnocení axily, tyto pacientky by byly tzv. poddiagnostikovány. Nicméně tento přístup logicky vede ke statistickému zvýšení počtu falešně negativních SLN v souboru. Ve 2 % jsme zjistili progresi onemocnění, vždy ve smyslu metastatického rozsevu. U 2/4 těchto pacientek byly axilární SLN negativní, ale u jedné z nich šlo o nádorovou triplicitu, druhá měla nádor s vysokou růstovou aktivitou. U další pacientky byly 2/2 SLN vyplněny makrometastázou, ve druhé době proběhla disekce axily. Přes následnou příslušnou komplexní onkologickou léčbu byly s odstupem dvou let zjištěny metastázy v kosterním systému a kůži. U této, dnes 44leté ženy, se jedná o nádorové onemocnění s vysokou proliferační aktivitou (proliferační faktor KI 67 pozitivní asi v 70 % nádorových buněk). Poslední ze čtyř pacientek byla již zmiňována výše. Lokální, regionální či lokoregionální progresi jsme v našem souboru nenalezli. V literatuře je opakovaně doloženo 13,14,15 signifikantně vyšší riziko lymfedému příslušné horní končetiny po ALND proti operaci v protokolu SLNB. V naší sestavě byl lymfedém přítomen ve sledovaném časovém úseku v 5 % případů. Z tohoto počtu byly provedeny 2 ALND a 6 exstirpací SLN. Lymfedém byl pozorován do 1 roku od výkonu u 3/8 pacientek, do 2 let u 3/8 žen a do 3 let od výkonu u 2/8 pacientek. Ve srovnání s údaji o frekvenci této komplikace před érou současných šetrnějších chirurgických výkonů – ve velkých souborech se uvádí až ve 30 % – jde jednoznačně o její významnou redukci. 1
Obr. 1. Zobrazení sentinelových uzlin v pravé axile po periareolární subdermální aplikaci, peroperačně exstirpovány 2 sentinelové uzliny A – časné dynamické skeny, projekce RAO B – pozdní statický sken, projekce ANT C – pozdní statický sken, projekce RAO 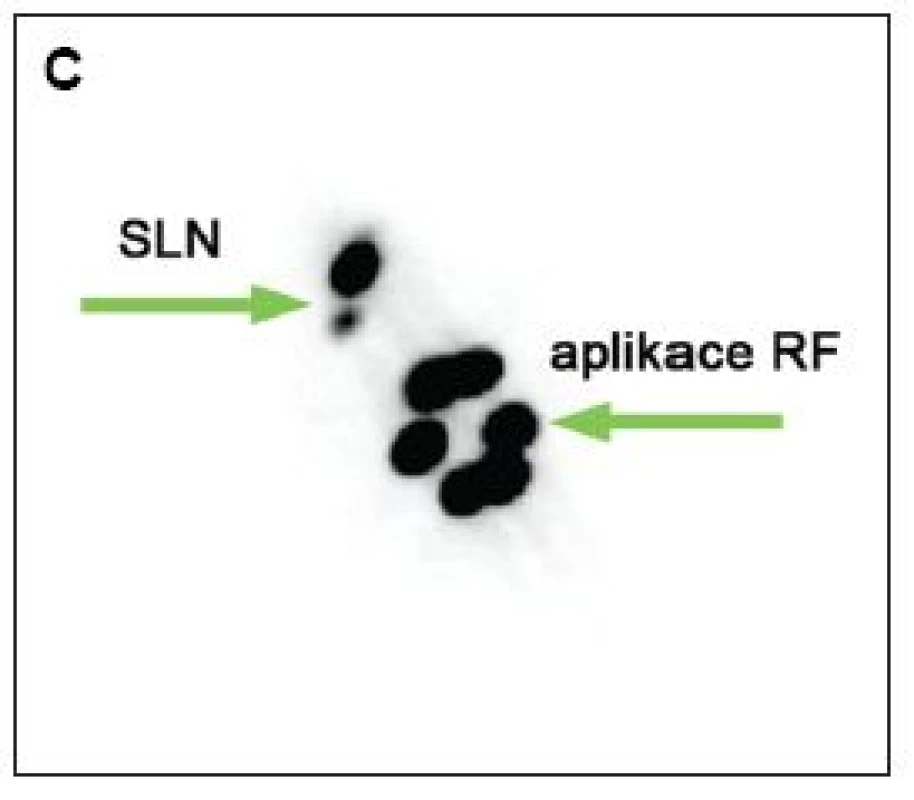
Obr. 2. Sentinelová uzlina, makrometastáza invazivního duktálního karcinomu, barveno H&E, zvětšení – objektiv 20x. 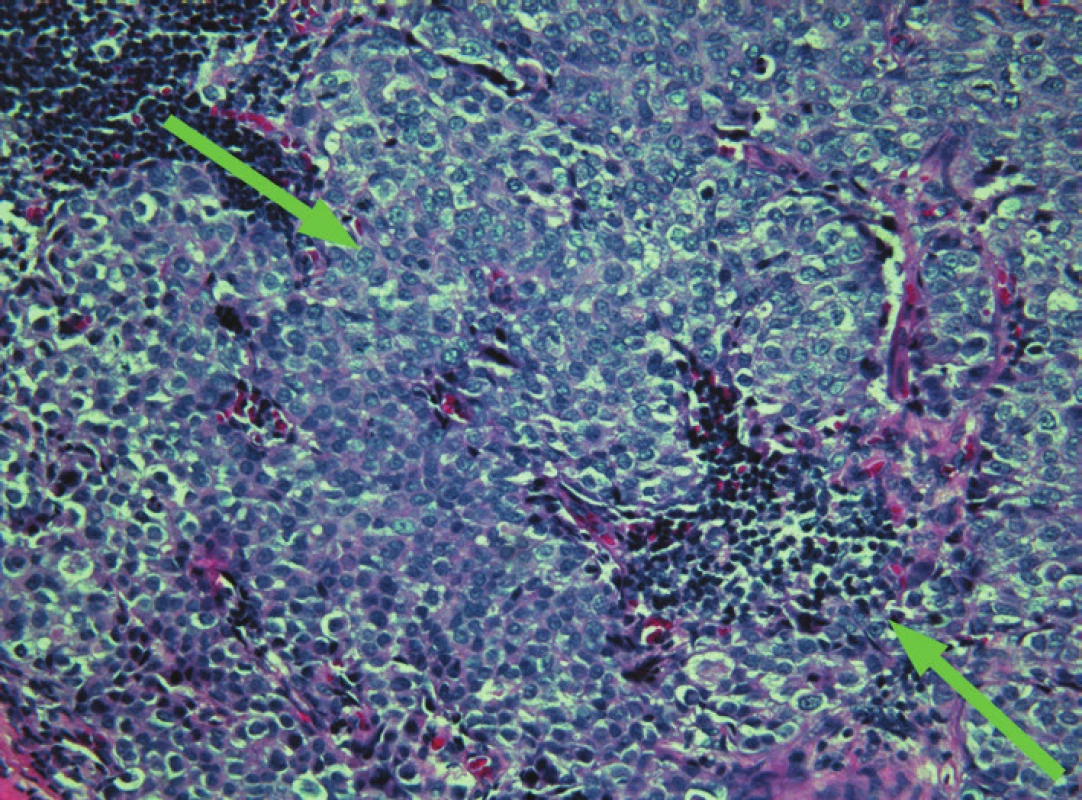
Obr. 3. Sentinelová uzlina, mikrometastáza invazivního duktálního karcinomu, barveno H&E, zvětšení – objektiv 20x. 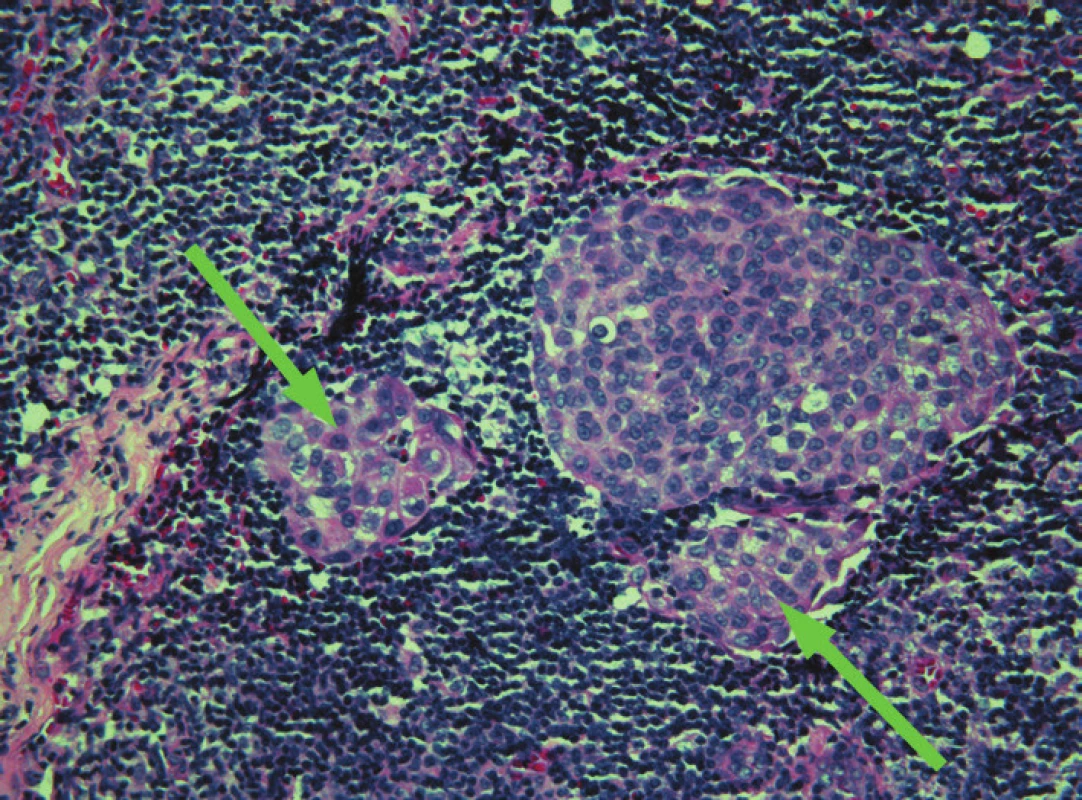
Obr. 4. Sentinelová uzlina, shluk nádorových buněk invazivního duktálního karcinomu, barveno H&E, zvětšení – objektiv 20x. 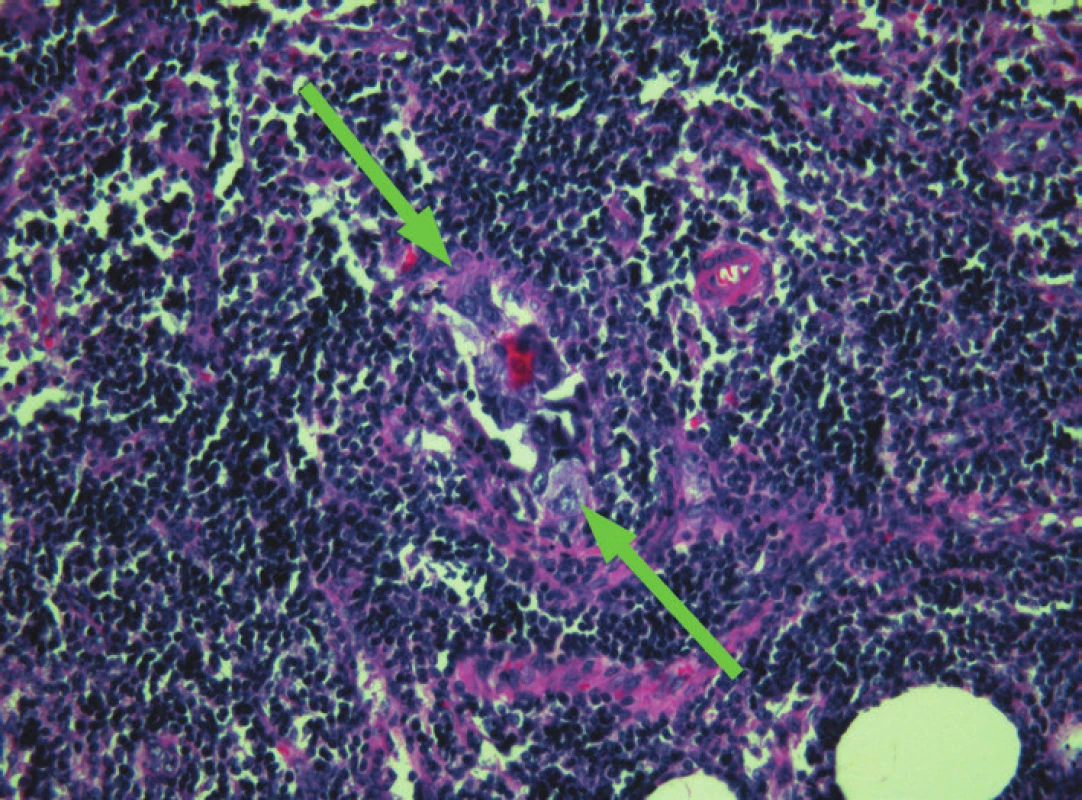
ZÁVĚR
SLNB je metoda, která má dalekosáhlé klinické důsledky pro léčbu pacientek s karcinomem prsu. Ověřili jsme si, že se jedná o postup, který vyžaduje úzkou týmovou spolupráci s velmi pečlivým dodržováním jednotlivých kroků. SLNB může být za přesnou metodu predikce stavu axilárních uzlin považována tehdy, dosahuje-li četnost detekce více než 90 % a falešná negativita je méně než 5 %. 1,10 V našem souboru tato podmínka byla splněna.
Fotografie (Obr. 2, 3, 4) – MUDr. Michal Kheck, patologicko-anatomické oddělení Nemocnice Jihlava.
ivana.bradackova@nemji.cz
Zdroje
1. Neoral Č, Bohanes T et al. Biopsie sentinelové uzliny. Praha, Galén, 2012, 141 p
2. Giammarile F, Alazraki N, Aarsvold JN et al. The EANM and SNMMI practice guideline for lymphoscintigraphy and sentinel node localization in breast cancer [online]. 2013. [cit. 2016-01-26]. Dostupné na: http://snmmi.files.cms-plus.com/docs/Final%20Breast%20Sentinel%20Node%20Guideline.pdf
3. Detekce sentinelových uzlin [online]. 2015. [cit. 2016-01-21]. Dostupné na: http://www.mou.cz/tz_detekce_sentinelovych_uzlin.pdf
4. Chakera AH, Friis E, Hesse U et al. Factors of importance for scintigraphic non - visualisation of sentinel nodes in breast cancer. Eur J Nucl Med Mol Imaging 2005;32 : 286-293
5. Pavlišta D, Eliška O. Mapa povrchových lymfatik prsu a jejich vztah k sentinelové uzlině. Čes Gynek 2005;70 : 192-197
6. Strnad P. Radionavigované chirurgické výkony u karcinomu prsu [online]. 2011. [cit. 2016-01-18].Dostupné na: http://zdravi.e15.cz/clanek/postgradualni_medicina/radionavigovane_chirurgicke_vykony_u_karcinomu_prsu_462099
7. Šimánek M, Abrahám V, Kořínek J. Dlouhodobá kontrola efektivity biopsie sentinelové uzliny sledováním výsledků komplexní terapie. NuklMed 2013;2 : 13-17
8. Coufal O, Vrtělová P, Krsička P. Operace mízních uzlin u karcinomů prsu – současný pohled [online]. 2012. [cit. 2015-05-22]. Dostupné na: http://zdravi.e15.cz/clanek/postgradualni_medicina/operace_miznich_uzlin_u_karcinomu_prsu_soucasny_pohled_464239
9. Zapletal O, Coufal O, Selingerová I et al. Počet odebíraných axilárních sentinelových uzlin a jeho vliv na diagnostickou přesnost sentinelové biopsie u karcinomu prsu. Rozhl Chir 2013;92 : 21-26
10. Pecha V, Kolařík D, Menzlová E et al. Biopsie sentinelové uzliny u žen s časným karcinomem prsu. Onkologie 2011;5 : 16-22
11. AGO DGS SGS ÖGS Panelists Executive Board Members German, Austrian and Swiss consensus konference on the diagnosis and local treatment of the axilla in breast cancer. Eur J Cancer 2013;49 : 2277-2283
12. Šimánek M, Abrahám V, Hruška J. Indikace axilární disekce uzlin při nálezu mikrometastatického postižení sentinelové uzliny u karcinomu prsu. NuklMed 2015;4 : 4-7
13. McLaughlin SA, Wright MJ, Morris KT et al. Prevalence of Lymphedema in Women With Breast Cancer 5 Years After Sentinel Lymph Node Biopsy or Axillary Dissection: Objective Measurements. J Clin Oncol 2008;26 : 5213-5219
14. Sener SF, Winchester DJ, Martz CH et al. Lymphedema after Sentinel Lymphadenectomy for Breast Carcinoma. Cancer 2001;92 : 748-752
15. Schrenk P, Rieger R, Shamiyeh A et al. Morbidity following Sentinel Lymph Node Biopsy versus Axillary Lymph Node Dissection for Patients with Breast Carcinoma. Cancer 2000;88 : 608-614
Štítky
Nukleární medicína Radiodiagnostika Radioterapie
Článek vyšel v časopiseNukleární medicína
Nejčtenější tento týden
2016 Číslo 2- Biochemoterapie agresivního karcinomu rekta – kazuistika z českého prostředí
- Intersticiální plicní procesy a jejich fibrotická progrese
- MDT Board: unikátní projekt pro lékaře pečující o pacienty s onemocněním plic a dalšími patologiemi v oblasti hrudníku
- Časná regrese nádoru jako marker celkového přežití v 1. linii léčby mCRC
- Kolorektální karcinom a jeho léčba v pokročilém stadiu dle aktuální Modré knihy ČOS
Nejčtenější v tomto čísle- Úskalí 18F-FDG PET/CT v diagnostice zánětlivých stavů nejasné etiologie
- Úspěšnost identifikace axilárních sentinelových uzlin
- Shodný defekt plicní perfuze i ventilace u embolie do plicnice
- Kontrola kvality eluátu 223Ra
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





