-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nové trendy v neoadjuvantní léčbě lokálně pokročilého karcinomu rekta z pohledu chirurga – komentář
New trends in neoadjuvant therapy of locally advanced rectal cancer from a surgeon’s perspective – a commentary
Background: Rectal cancer treatment advanced rapidly during last decades. The most important factors of this progress are new neoadjuvant therapy options, improvement in imaging (allowing for quality staging and restaging) and routine implementation of the total mesorectal excision technique. For the best outcomes, it is crucial to combine the treatment methods in the best way possible with ideal timing. It is necessary to keep in mind both advantages and complications of the individual kinds of approach. Therefore, interdisciplinary agreement is essential in the treatment of rectal cancer. Considering these new therapeutic possibilities, the debate about timing, indication and radicality of the surgical procedures is reopened. Surgical approaches are currently focused on mini-invasive methods and robotic surgery. New trend with promising potential seems to be clinical complete response achievement with watch and wait follow-up strategy. This approach, in the spirit of the organ sparing philosophy, however asks new questions about indication, timing and conception of this method. Proper answers are essential for sparing, yet radical oncotherapy of this disease.
Keywords:
rectal cancer – Surgical oncology – neoadjuvant therapy – organ sparing treatment – time management
Autoři: prof. MUDr. Kala Zdeněk, CSc. 1; MUDr. Zatloukal Martin 1; MUDr. Čan Vladimír 1; MUDr. Hemmelová Beáta 1; MUDr. Ostřížková Lenka 2; Bohatá Šárka 3; prof. RNDr. Slabý Ondřej, Ph.D. 4,5; prof. MUDr. Svoboda Marek, Ph.D. 6; prof. MUDr. Šlampa Pavel, CSc. 7
Působiště autorů: Chirurgická klinika LF MU a FN Brno 1; Interní a hematoonkologická klinika LF MU a FN Brno 2; Klinika radiologie a nukleární medicíny LF MU a FN Brno 3; Ústav patologie LF MU a FN Brno 4; Klinika komplexní onkologické péče MOÚ Brno 5; Klinika radiační onkologie MOÚ Brno 6
Vyšlo v časopise: Klin Onkol 2020; 33(5): 362-371
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2020362Souhrn
Východiska: Léčba karcinomu rekta prodělala v posledních desetiletích rapidní rozvoj. Mezi zásadní nosné změny patří zejména rozšíření neoadjuvantní terapie, pokrok v zobrazovacích metodách umožňující kvalitní staging i restaging a v rámci operativy provádění totální mezorektální excize. Pro optimální výsledek, zejména v případě pokročilého karcinomu rekta, je nutné co nejlépe kombinovat dostupné metody léčby v ideální časové posloupnosti. Je nutné brát v úvahu nejen základní schéma terapie, ale i komplikace a možná rizika, která mohou další léčbu či její jednotlivé části zpomalit, odložit nebo úplně znemožnit. Mezioborový konsensus, realizovaný multioborovou komisí, je tedy stěžejní. Na poli chirurgie probíhá diskuse o základních parametrech chirurgického výkonu – jeho indikaci, načasování a radikalitě – ve vztahu k celkovým změnám, novým možnostem a trendům v terapii nádorů konečníku. Chirurgie reaguje na modernizaci v onkologické terapii rozvojem a rutinním prováděním operací miniinvazivní cestou. Moderním trendem se slibným potenciálem se jeví dosažení klinické kompletní odpovědi – tedy vymizení nádoru bez operační léčby – s doprovodnou „watch and wait“ strategií. Tento přístup, ve smyslu „organ sparing“ filozofie, však klade nové otázky stran postupu, indikace, rozsahu a metody léčby, jejichž uspokojivé odpovědi jsou v přímém vztahu k citlivému, avšak onkologicky radikálnímu přístupu k tomuto onkologickému onemocnění.
Klíčová slova:
karcinom rekta – onkologická chirurgie – neoadjuvantní léčba – léčba šetřící orgány – organizace času
Úvod do problematiky z pohledu chirurga
Historie léčby karcinomu rekta odráží snahu vyrovnat se s hlavními úskalími léčby – s vysokým rizikem lokální recidivy a rizikem metastazování.
Riziko lokální recidivy snížila zvláště radioterapie a zlepšení techniky chirurgické resekce, především zavedení totální mezorektální excize (total mesorectal excision – TME). V éře před moderní neoadjuvantní léčbou a resekcí s TME se lokální recidivy karcinomu rekta vyskytovaly u 20–40 % pacientů. Technika TME spolu s radiochemoterapií toto číslo snížily na 5–8 % [1].
Primárním cílem léčby je zabránit lokální recidivě. K tomu slouží:
- exaktní lokální staging pomocí magnetické rezonance (MR);
- neoadjuvantní léčba;
- chirurgická technika s provedením kompletní lymfadenektomie dosažená kompletním odstraněním mezorekta (TME), zajištěním negativního distálního resekčního okraje (distal resection margin – DRM) a negativního radiálního (cirkumferenčního) resekčního okraje (circumferential resection margin – CRM).
Riziko výskytu vzdálených metastáz zůstává stále velkým problémem.
V historii diagnostiky a léčby karcinomu rekta představují velký pokrok zejména následující (nechronologicky uvedené) kroky:
Radiochemoterapie
Radioterapie, původně paliativní metoda léčby karcinomu rekta, se stala významnou modalitou, jejíž použití v perioperačním období významně snížilo počet lokálních recidiv chirurgických resekcí.
Rozvoj neoadjuvantní konkomitantní terapie
Významným mezníkem bylo zjištění superiority neoadjuvantní radioterapie nad pooperačním ozařováním [2]. Lepší efekt je dán zejména působením radiace na dobře oxygenované tkáně nenarušené předchozí operací. Z pohledu chirurga zařazení neoadjuvantní konkomitantní radiochemoterapie před operaci snížilo díky svému efektu downsizingu nádoru u respondentních pacientů počet R2 a R1 resekcí a snížilo počet lokálních recidiv. V některých případech zmenšení nádoru vlivem neoadjuvantní léčby umožní provedení sfinkter záchovné operace s příslibem R0 resekce [3,4], i když jiné studie tento efekt zpochybňují [5,6]. Dalšími argumenty pro využití neoadjuvantní radioterapie jsou zamezení pooperačního ozařování anastomotického spojení a také kliček tenkého střeva, které se, především po amputaci rekta, dostanou do ozařované oblasti [7].
Ještě v 90. letech 20. století byla standardem neoadjuvantní léčby izolovaná předoperační radioterapie. Postupně se zavedla do klinické praxe senzibilizace nádoru současně podávanou chemoterapií nitrožilně podávaným 5-fluorouracilem (5-FU) či perorálně podávaným kapecitabinem [8].
S příznivým efektem neoadjuvantní terapie jdou nicméně ruku v ruce jeho nežádoucí účinky a komplikace. Kombinace neoadjuvantní radioterapie a chirurgického výkonu s TME zvyšuje riziko pozdějších funkčních výsledků v rámci gastrointestinálního traktu (GIT) a sexuálních funkcí [9]. Proto byly hledány možnosti neoadjuvantní léčby v podobě samotné chemoterapie bez radiační složky, která by však též umožnila lokální kontrolu tumoru rekta. Nejlepší výsledky byly dosaženy s režimy FOLFOX bez biologické léčby. Byla prokázána i účinnost a bezpečnost protokolu s režimem FOLFIRINOX [10,11]. Tyto postupy se zdají být slibnými i z pohledu kontroly vzdálených metastáz, zvláště při relativně málo uspokojivých výsledcích adjuvantní léčby.
V současnosti probíhají studie se zařazením cílených léků (biologická léčba) do neoadjuvantních režimů.
Radiační neoadjuvantní terapie – konvenční „long-course” RT vs. „short-course” 5 × 5 Gy
V současnosti existují v Evropě dva paralelní neoadjuvantní režimy využívající radiační léčbu. U „long-course“ RT jsou doporučené dávky typicky 45–50 Gy ve 25–28 frakcích. U předoperační „short-course“ RT (SCRT) je nádor ozářen dávkou 25 Gy v pěti frakcích v průběhu jednoho pracovního týdne [12]. Zlatým standardem současné neoadjuvantní léčby je radiochemoterapie v podobě „long-course“. Zkrácený režim radioterapie je zvažován především u pacientů s vícečetnými komorbiditami, u pacientů s krvácejícím tumorem nebo u pacientů se synchronními metastázami, kde je podmínkou včasné zahájení systémové léčby. Protože po samotné radioterapii nedochází k významnějšímu downsizingu, není tento režim doporučován u hraničně resekabilních nádorů [13,14].
Chirurgická resekční technika – totální mezorektální excize
Koncepce totálního odstranění mezorekta u nádorů konečníku, kterou již v roce 1979 navrhl R. J. Heald [15], vedla k významnému zvýšení lokální kontroly nádoru a snížení počtu lokálních recidiv. To se ovšem děje za cenu zvýšení pooperační morbidity, zejména na vrub četnějších komplikací spojených s hojením anastomózy [16].
Resekci rekta s odstraněním mezorekta lze provést jednak otevřeným způsobem, ale také minimálně invazivním – laparoskopicky, roboticky asistovaně a nejnověji i transanálně (transanal TME – TaTME). Všechny uvedené přístupy jsou z hlediska dlouhodobého onkologického hodnocení rovnocenné, pokud operaci provádí zkušený chirurg, jenž je nezávislým prognostickým faktorem léčby karcinomu rekta [17].
Kontrolu kvality a kompletnosti provedené TME umožnil postup a protokol zpracování resekátu, který koncem 90. let 20. století navrhl leedský patolog Quirke [18].
Pokrok v zobrazovacích metodách
Významné zpřesnění lokálního stagingu karcinomu rekta bylo umožněno pokrokem v zobrazovacích metod – především MR rekta, která nahradila CT. Na MR posuzujeme zejména vztah nádoru k tzv. fascia recti, která ohraničuje mezorektum, vztah ke svěračům a k pánevnímu dnu. MR je v současnosti jediná reprodukovatelná zobrazovací metoda s vysokou iniciální specificitou (92 %) pro předpověď negativního cirkumferenčního resekčního okraje (CRM) a pro určení hloubky invaze přes stěnu rekta [19]. U vyšších stadií může MR zobrazit extramurální vaskulární invazi (extramural vascular invasion – EMVI) tumoru. Přesný lokální staging negeneralizovaného lokálně pokročilého karcinomu rekta umožnil přesnější indikaci případné neoadjuvantní léčby. Tím dokázal ochránit před nežádoucími následky ozáření pánve ty pacienty, kteří by z neoadjuvantní léčby neměli prospěch. Dále MR selektovala ty pacienty, kteří by bez efektu downsizingu a downstagingu neoadjuvantní léčby neměli šanci na provedení R0 resekce nádoru, jež je základním předpokladem potenciálně kurativního zákroku.
Lokální staging na základě hodnocení MR rekta je založen na posouzení čtyř parametrů:
1. T (tumor)
Současným standardem popisu MR u tumorů rekta je nejen rozlišení jednotlivých stadií T1–T4, ale v případě nádorů T3 i odlišení jeho podskupin T3a–T3d na základě šíření nádoru v mezorektálním tuku (extramural depth – EMD) a taktéž odlišení T4a, resp. T4b. Z hlediska rizik lokální recidivy, onkologické prognózy a indikace neoadjuvantní radiochemoterapie rozlišujeme tyto podtypy nádorů:
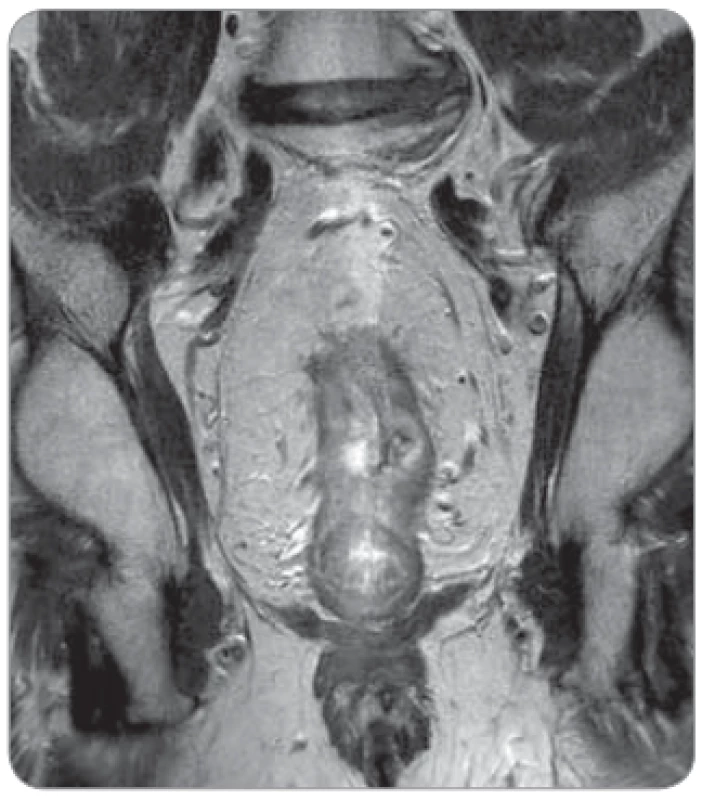
- s příznivější prognózou („good“ T3) – T3a (EMD < 1 mm), T3b (EMD 1–5 mm) (obr. 1);
- s nepříznivou prognózou („bad“ T3) – T3c (EMD 5–15 mm), T3d (EMD > 14 mm) (obr. 2);
- velmi nepříznivé nádory („ugly“) – k nim patří nádory T3, které mají infiltrovanou mezorektální fascii, která je potenciálním pozitivním CRM u resekcí s TME. Dále do této skupiny patří nádory T4a (prorůstají celou stěnou rekta) a T4b (infiltrují okolní tkáně nebo orgány) (obr. 3).
Obr. 2. „Bad“ tumor u mužského pacienta, nádor v 5 cm infi ltrující mezorektální tuk s těsným vztahem k fascia recti a semenným váčkům. 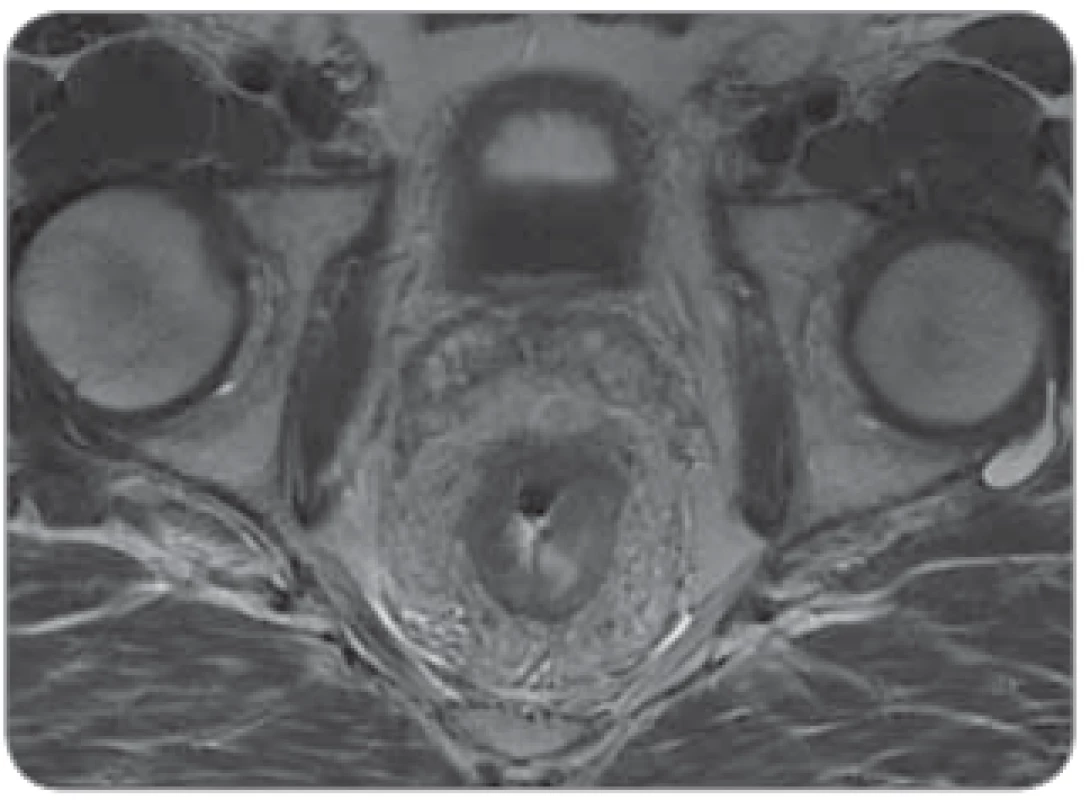
Obr. 3. „Ugly“ tumor u pacientky s tumorózní infi ltrací stěny rekta s přerůstáním do dělohy ventrálně, cT4b N2 M0. 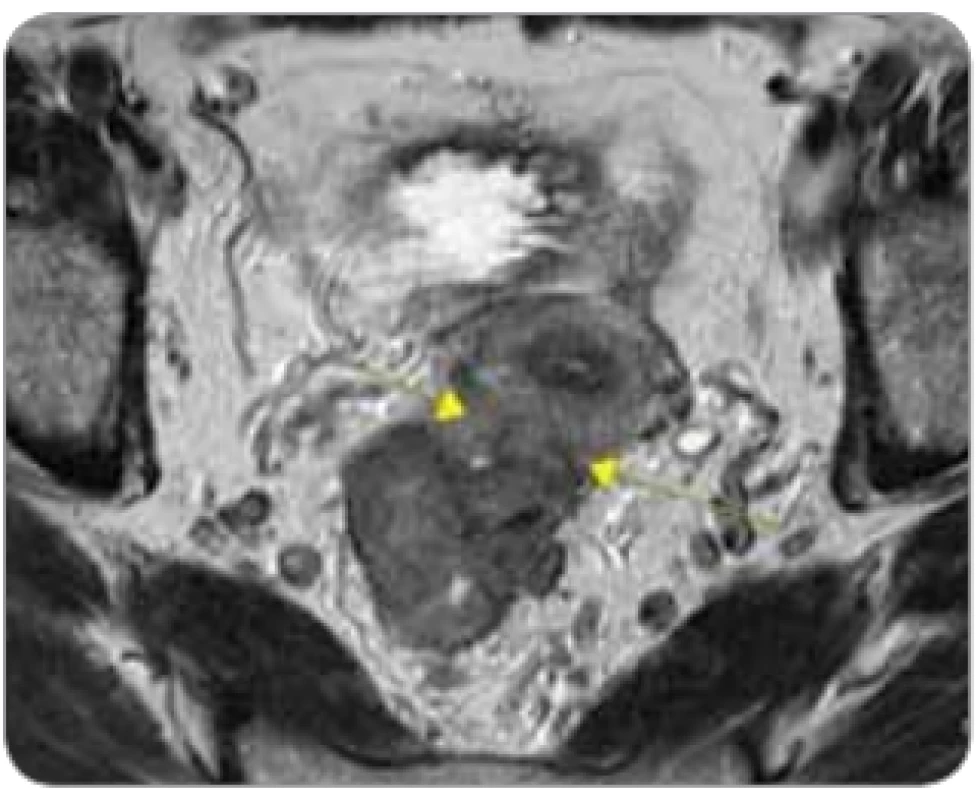
Nově jsou nádory distálního rekta infiltrující vnitřní svěrač hodnoceny jako T3 (dříve T4).
Z uvedeného vyplývá, že z pohledu prognózy a indikace event. neoadjuvantní léčby je důležitější než odlišení stadia T2 a T3 detailní zjištění nepříznivého stadia T3c–d s EMD > 5 mm. Přežití bez nemoci (disease free survival – DFS) u T3a a T3b je 85 %, u nádorů T3c a T3d jen 54 %.
2. N (lymfatické uzliny)
Nález uzlinového postižení N1 a N2 na MR je indikací k provedení neoadjuvantní radiochemoterapie [14].
3. CRM
Pozitivní CRM znamená nejen vyšší riziko lokální recidivy, ale i vyšší riziko vzdálených metastáz. Jako pozitivní CRM je hodnocen takový nález na MR, kdy je vzdálenost tumoru od fascia recti ≤ 1 mm. Takto malá vzdálenost predikuje nemožnost chirurgicky odstranit tumor s dostatečným cirkumferenčním bezpečnostním okrajem tak, aby se předešlo vzniku lokálních recidiv a vzdálených metastáz.
4. EMVI
Vyšetření MR taktéž umožňuje posoudit event. přítomnost nádorových buněk ve vaskulárních strukturách v okolí tumoru rekta (EMVI) (obr. 5). EMVI se také nazývá zobrazovací biomarker, protože na MR sledujeme její přítomnost, vymizení či zmírnění po neoadjuvantní léčbě, podobně jako příznivá odpověď nádoru (regrese velikosti a okolní fibróza) či nepříznivá odpověď na neoadjuvantní léčbu. „Good responders“ ve faktoru EMVI dosáhnou 3letého DSF v 87,5 %, na rozdíl od „poor responders“ s 3letým DSF v jen 45,8 % [20].
Obr. 4. Vlevo: Vstupní MR vyšetření, tumorózní infi ltrace stěny rekta s prorůstáním do okolního tuku, cT3b N2 M0. Vpravo: Kontrolní MR vyšetření po proběhlé neoadjuvantní radiochemoterapii, trvají patologické intenzity v přilehlém tuku, hodnoceno jako ycTx N1 M0. Dle patologa po resekci ypT3 N0, stupeň regrese Dworak 1. 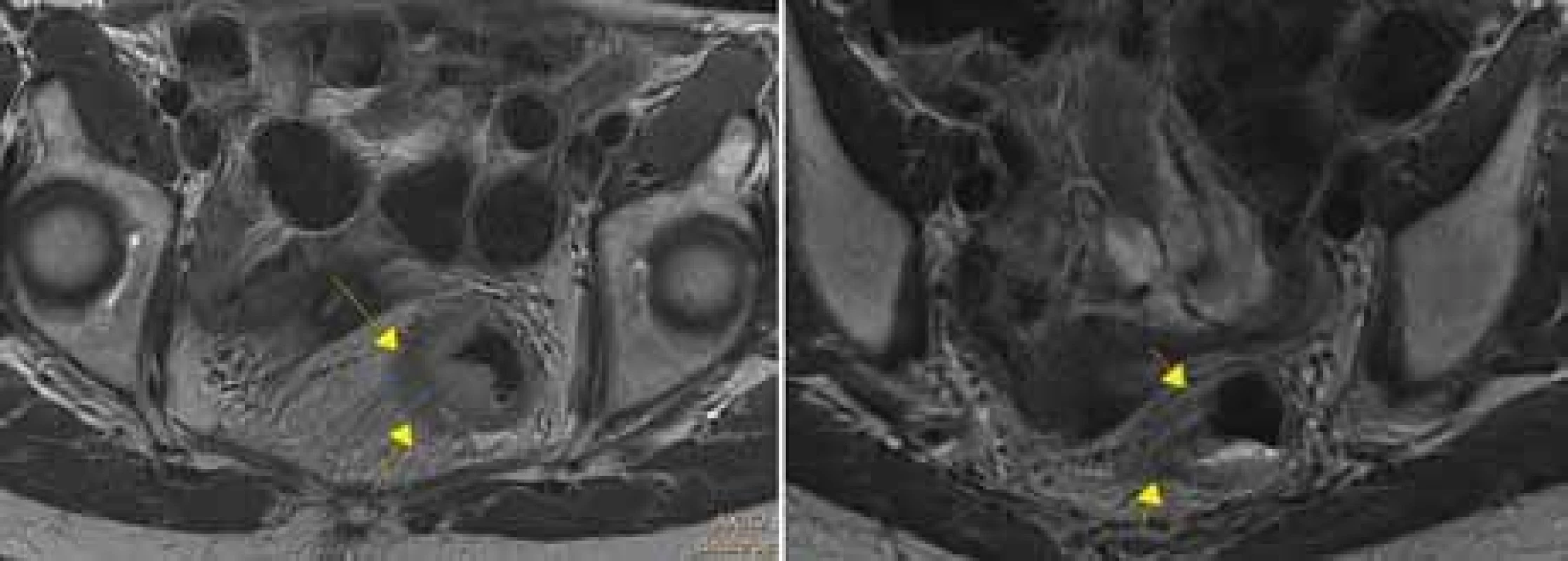
MR – magnetická rezonance Obr. 5. Tumor s extramurální vaskulární invazí+, vlevo transverzální rovina, vpravo koronární rovina. 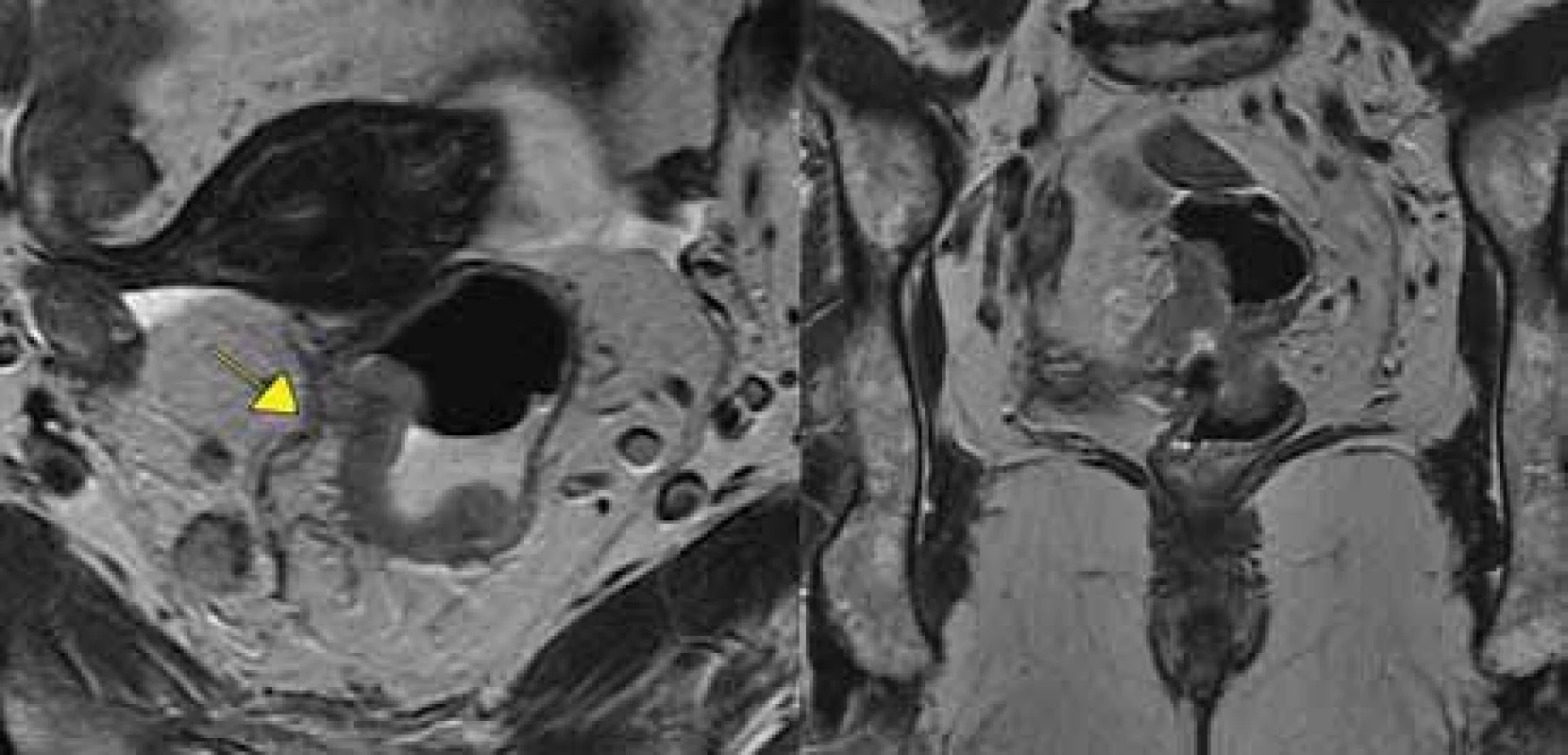
Vyšetření MR rekta se úspěšně používá i pro hodnocení efektu neoadjuvantní léčby po skončení radiochemoterapie. V rámci restagingu dokáže MR odlišit pacienty s dobrou odpovědí na neoadjuvantní léčbu (respondéry) od tzv. non-respondérů, u kterých nejsou známky zmenšení nádoru. Významný pokrok představuje zjištění, že stupeň event. regrese nádoru rekta po neoadjuvantní léčbě (tumor regression grading – TRG) (tab. 1) stanovený na resekátu odpovídá regresi na restagingovém vyšetření MR (obr. 4) [21].
Tab. 1. Klasifikace regrese nádoru (tumor regression grading) dle Dworaka. 
Přesnější detekci vzdálených metastáz a diagnostiku IV. stadia onemocnění přinesly metody pozitronové emisní tomografie (PET-CT, PET-MR) [22,23].
Doporučený postup u pokročilého karcinomu rekta
Na základě klinického vyšetření (per rectum, endoskopie s biopsií) a výše uvedených zobrazovacích metod (MR rekta, CT hrudníku, CT břicha, event. PET), příp. dalších vyšetření (histologie, biologie nádoru – grading, molekulární charakteristiky nádoru) a celkového stavu pacienta se rozhoduje o primární modalitě léčby v prostředí multidisciplinární oborové komise.
Zlatým standardem současné léčby je u pokročilého karcinomu rekta neoadjuvantní léčba v podobě radiochemoterapie a poté s odstupem chirurgická resekce s TME následovaná adjuvantní léčbou [23]. Neoadjuvantní léčbu by měli podstoupit zvláště pacienti s tumory se špatnou prognózou („bad“, „ugly“), mezi které se řadí i mucinózní nádory.
V první fázi u karcinomů rekta v I., II. a III. stadiu onemocnění komise rozhoduje, zda se léčba zahájí primárně chirurgickým resekčním výkonem na rektu a mezorektu, či předoperační systémovou léčbou.
V časných stadiích karcinomu rekta a v případech příznivého nálezu na MR dle současných doporučení neoadjuvantní léčbu neindikujeme (tab. 2). Stejně tak u tumorů orálního rekta, tj. lokalizovaných nad peritoneální řasou, je indikována neoadjuvantní léčba až ve stadiu T4 [14].
Tab. 2. Nálezy na snímku stagingové magnetické rezonance, které umožní ve většině případů primární resekci. 
CRM – cirkumferenční resekční okraj, EMVI – extramurální vaskulární invaze V ostatních případech se k neoadjuvantní léčbě kloníme, a to jak v případě vyšších stadií, tak i v přítomnosti rizikových radiologických faktorů na MR (tab. 3) [14]. Před započetím léčby provádějí některá pracoviště endoskopickou tetováž ložiska k lepší vizualizaci nádoru po neoadjuvantní terapii.
Tab. 3. Rizikové faktory na MR, které indikují neoadjuvantní léčbu před primární chirurgickou resekcí. 
CRM – cirkumferenční resekční okraje, MR – magnetická rezonance Nálezy se nicméně hodnotí případ od případu individualizovaně v rámci multidisciplinární komise. Chirurg se v tomto kolektivu zaměřuje při indikaci neoadjuvantní léčby na skutečnost, zda je chirurgickou resekcí schopen dosáhnout R0 resekce. Velkým rizikem z hlediska pozitivního cirkumferenčního okraje jsou nádory T3c, T3d a nádory uložené u mužů na přední stěně konečníku, tedy v blízkosti semenných váčků a prostaty.
Po ukončení neoadjuvantní léčby se s odstupem cca 6 týdnů provádí restaging (MR rekta, CT břicha, CT hrudníku) a následná komisionální reevaluace výsledků a stavu. Zjišťujeme, zda nedošlo v průběhu léčby ke generalizaci, na konečníku posuzujeme, zda pacient zareagoval v souladu s RECIST kritérii (Response Evaluation Criteria in Solid Tumors) na léčbu, tedy zda je respondér či non-respondér.
Zatímco specificita a senzitivita vstupního MR rekta je velmi vysoká, u restagingového vyšetření po provedené neoadjuvantní léčbě rekta tyto ukazatele klesají. Je to zejména kvůli problematickému odlišení fibrózy, desmoplastické reakci, edému, zánětu a viabilním nádorovým okrskům v jizevnaté tkáni. Pro správnou interpretaci je naprosto stěžejní srovnání se vstupním MR vyšetřením. Role PET metod v odlišení těchto nálezů je ve stadiu zkoumání. Na základě restagingového MR rekta hodnotíme, zda je možné provést R0 resekci (vč. negativity CRM, tj. vzdálenosti tumoru od fascia recti > 1 mm).
Účinnost neoadjuvantní léčby hodnotíme pomocí MR, PET metod a experimentálně pomocí miRNA [24,25] a ctDNA [26,27].
Vlastní chirurgický výkon se v současnosti provádí odloženě, cca 8–12 týdnů po ukončení radiochemoterapie. U tumorů středního a distálního rekta je indikován resekční výkon s TME (nízká resekce rekta – LAR, či amputace rekta – APR). U tumorů orálního rekta je dostačujícím výkonem resekční výkon s parciální mezorektální excizí (PME), tj. excize mezorekta 5 cm pod distální hranici karcinomu.
Možné současné modifikace neoadjuvantní léčby
U rizikových pacientů je z obavy z možné toxicity neoadjuvantní režim modifikován a provádí se jen samotná radioterapie, a to v režimu „short-course“ na 5 dní. Operace je plánována buď v následujícím týdnu (s cílem snížit riziko lokální recidivy), či s odstupem 6–8 týdnů, očekáváme-li i možný přínos pro operační výkon (downsizing a downstagingu nádoru). Tento efekt však nelze očekávat v takové míře jako u konkomitantní radiochemoterapie.
Naopak u pacientů s rizikem vytvoření včasných vzdálených metastáz (EMVI pozitivní) lze využít intenzifikovaného protokolu neoadjuvantní léčby, ovšem za cenu zvýšení rizika pooperačních komplikací [28].
Chirurgická léčba
Zlatým standardem léčby pokročilých stadií karcinomu rekta v jeho střední a distální části (tzv. extraperitoneálního rekta) je resekce s TME. Součástí výkonu je snaha o zachování sfinkterického aparátu a šetření viscerálních autonomních nervů, pokud to negativně neovlivní radikalitu operace. Ve výjimečných případech lze u tumorů distálního rekta odstranit vnitřní anální svěrač, a to buď částečně (parciální intersfinkterická resekce – p-ISR), nebo úplně (ISR). Operace bývá indikována u biologicky mladých pacientů s dobrou funkcí svěračů a s příznivou biologií nádoru a jeho odezvou na neoadjuvantní léčbu.
V současnosti se resekce rekta s TME provádějí otevřenou cestou nebo minimálně invazivně: laparoskopicky, roboticky nebo transanální cestou (TaTME) (obr. 6). Všechny uvedené operační přístupy umožňují provedení radikální operace a z onkologického hlediska jsou si rovnocenné, pokud jsou realizovány zkušeným chirurgem. Rozdíly jsou pouze v časném pooperačním období ve prospěch minimálně invazivních metod (obr. 7, 8) [29].
Obr. 6. Transanální přístup u resekce rekta – pohled per anum. Elektrokoagulací je natnuta stěna konečníku. 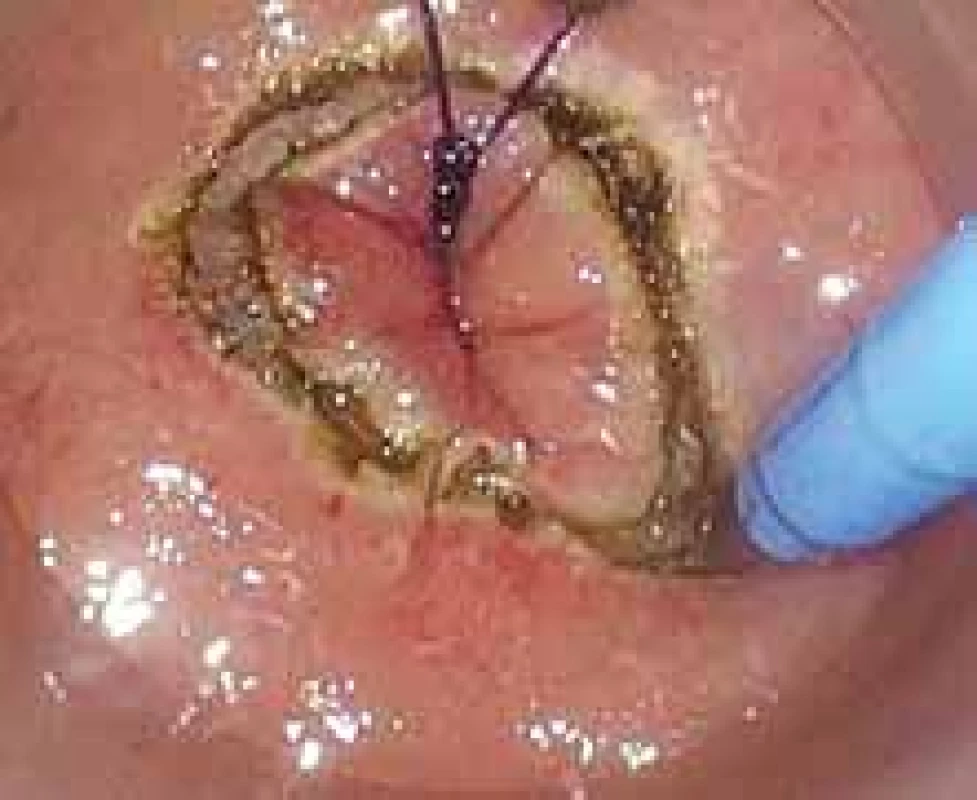
Obr. 7. Výsledný stav po laparoskopické a transanální resekci rekta pro nízko uložený tumor rekta s protektivní ileostomií. 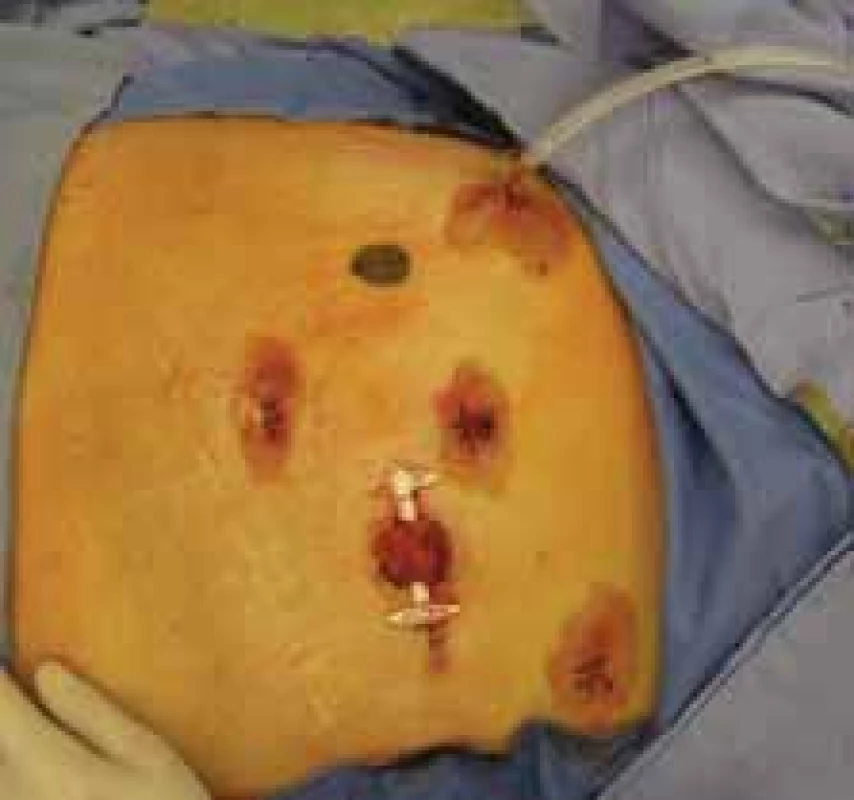
Obr. 8. Resekát rekta po totální mezorektální excizi. 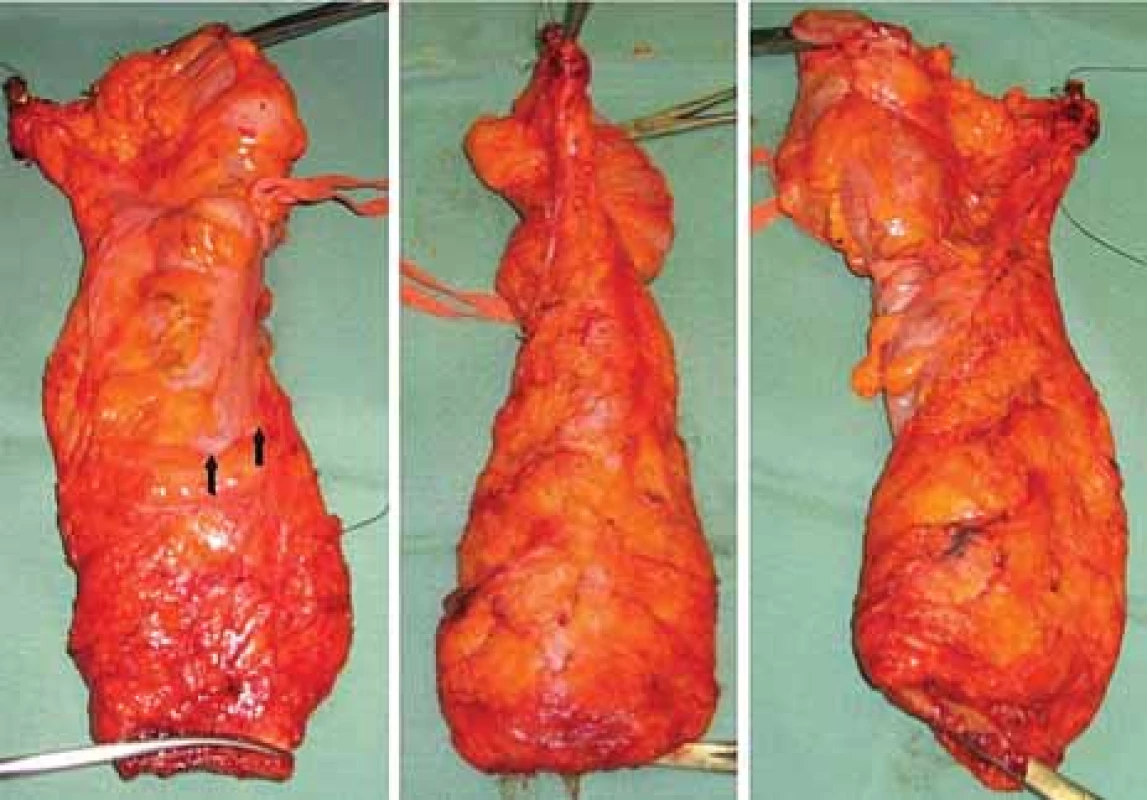
Kvalita výsledku chirurgické resekce je hodnocena negativitou distálního resekčního okraje (DRM), negativitou CRM a především kvalitou provedené excize mezorekta dle Quirkeho. Případná pozitivita CRM nemusí znamenat nekvalitní práci chirurga, ale „pouze“ nepříznivou charakteristiku nádoru, jejímž důsledkem je R1 resekce [18].
Ostatní hodnocené pooperační faktory jsou standardní – v krátkodobém horizontu 90denní morbidita a mortalita, v dlouhodobém zejména onkologické: DFS a 5leté přežívání.
Specifickým faktorem hodnocení kvality pracoviště je počet operací s definitivní stomií u nádorů distálního rekta. Vzhledem ke konsekvencím radiochemoterapie pánve a operace v oblasti pánve a pánevních nervů hodnotíme i urologické a sexuální funkce, kvalitu života a specifické parametry resekce konečníku, jejichž poruchy jsou souhrnně označovány jako syndrom nízké přední resekce rekta (low anterior resection syndrome – LARS) (tab. 4).
Tab. 4. Komplikace resekčních výkonů s totální mezorektální excizí po neoadjuvantní léčbě [26,27]. ![Komplikace resekčních výkonů s totální mezorektální excizí po neoadjuvantní léčbě [26,27].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/46d76a7d5e9e4fe6c498ae88ea4999a9.png)
LARS – syndrom nízké přední resekce rekta Adjuvantní léčba
K současnému standardu léčby pokročilého karcinomu rekta patří i následná adjuvantní léčba po resekčním zákroku. Významným problémem je však nemožnost včasného zahájení adjuvantní léčby u pacientů s pooperačními komplikacemi, zejména anastomotickými. Proto je současným trendem, aby rizikoví pacienti (EMVI+, vysoký grading tumoru) dostali systémovou chemoterapii před operací v rámci intenzivní neoadjuvantní léčby (totální neoadjuvantní léčba).
Otázkou k diskuzi je „timing“ zanoření dočasné protektivní stomie a její vliv na plánování pooperační systémové léčby z pohledu možných komplikací. Na základě ESMO guidelines z roku 2017 rozhoduje o indikaci adjuvantní léčby i kvalita provedení TME. V případě provedení kvalitní TME není nyní u nálezů, kde je některý z parametrů hodnocen jako pT3, CRM > 2 mm, pT4a nad úponem peritonea či pN1 (pozitivních lymfatických uzlin v dostatečné vzdálenosti od radiální resekční linie), indikace adjuvantní léčby nutná [14].
U pokročilých nádorů orálního rekta hodnocených jako T4 se při snaze o snížení rizika peritoneálních metastáz zkouší (s příznivým výsledkem) použití profylaktické hypertermické intraperitoneální chemoterapie (HIPEC), i když zatím spíše v rámci klinických studií [30].
Otázky související s modifikacemi současných doporučených postupů: diskuze
Standardem léčby pokročilého karcinomu konečníku je neoadjuvantní terapie, resekce s TME a následná adjuvantní terapie. Od nejčastější formy neoadjuvance – radiochemoterapie – očekáváme:
- snížení výskytu lokálních recidiv;
- snížení počtu R1 resekcí;
- zvýšení počtu resekcí se zachováním sfinkterického aparátu.
V souvislosti s výše uvedeným schématem se vedly a vedou diskuze nad některými praktickými postupy:
Jak a kdy provádět restaging
Vzhledem k reálnému riziku vzniku vzdálených metastáz i během neoadjuvantní léčby se doporučuje restaging zaměřit nejen lokálně (MR rekta), ale i na oblast případného metastazování, tj. provést CT hrudníku a CT břicha. Diskutuje se i role a indikace PET-MR, která by mohla nahradit trojici nyní prováděných vyšetření. Problematické zůstává zhodnocení kompletní remise nádoru, kritické zůstává především zhodnocení satelitů vitální nádorové tkáně v jizevnaté tkáni původního nádoru [31]. Restaging se provádí cca 6 týdnů od ukončení radiochemoterapie.
Délka intervalu mezi ukončením radiochemoterapie a chirurgickým radikálním výkonem
Chirurgická obec akceptovala doporučení o prodloužení intervalu z dříve praktikovaných 6 týdnů na ≥ 8 týdnů, vycházejíc z „restagingové“ MR po 6 týdnech od ukončení radiochemoterapie. Dle odezvy na neoadjuvantní léčbu můžeme odlišit dvě skupiny pacientů. Pokud na restagingové MR rekta nedošlo k regresi, jedná se o non-respondéry a operační výkon nemá smysl odkládat za hranici 8 týdnů. Pokud však došlo dle MR k významnému downsizingu, doporučuje se interval prodloužit na 10–11 týdnů z důvodu prokázaného pokračování efektu neoadjuvantní terapie až do 11. týdne. Teprve poté se zastavuje. Takto postupujeme zejména v případech, kdy na regresi závisí možnost provedení R0 resekce a zachování sfinkterů.
Rozporuplný je pochopitelně fakt, že prodloužení intervalu bez systémové chemoterapie zvyšuje riziko vzniku vzdálených metastáz.
Protektivní stomie
V rámci chirurgie se diskutuje také role tzv. protektivních stomií a jejich indikací. Tyto stomie se indikují u rizikových pacientů (mužské pohlaví, obezita, diabetes, kuřáctví, anamnéza cévní mozkové či kardiovaskulární příhody aj.). Samotná radiochemoterapie patří k nejzávažnějším rizikovým faktorům pro vznik anastomotické komplikace. Bylo navíc prokázáno, že procento anastomotických komplikací se zvýšilo zavedením techniky TME [32–34].
Anastomotický leak, který je klinicky významný, se většinou pohybuje okolo 10–14 % při MR a endoskopických cílených kontrolách anastomózy [35,36]. Protektivní stomie nezabrání vzniku samotné anastomotické komplikace, ale jejím klinickým konsekvencím, zejména pánevní sepsi.
Založení dočasné stomie předpokládá i její následné odstranění, destomizaci. I když se jedná o relativně banální operaci, jde o další reálnou zátěž pro pacienta spojenou s možnými operačními komplikacemi. Zájmem chirurgických týmů je proto redukce počtu založených protektivních stomií. Jednou z možností, které se zkoumají, je mj. lepší peroperační kontrola prokrvení anastomotického spojení pomocí fluorescence (obr. 9) [37].
Obr. 9. Prokrvení colon descendens před našitím koloanální anastomózy – zeleně svítí prokrvené části. 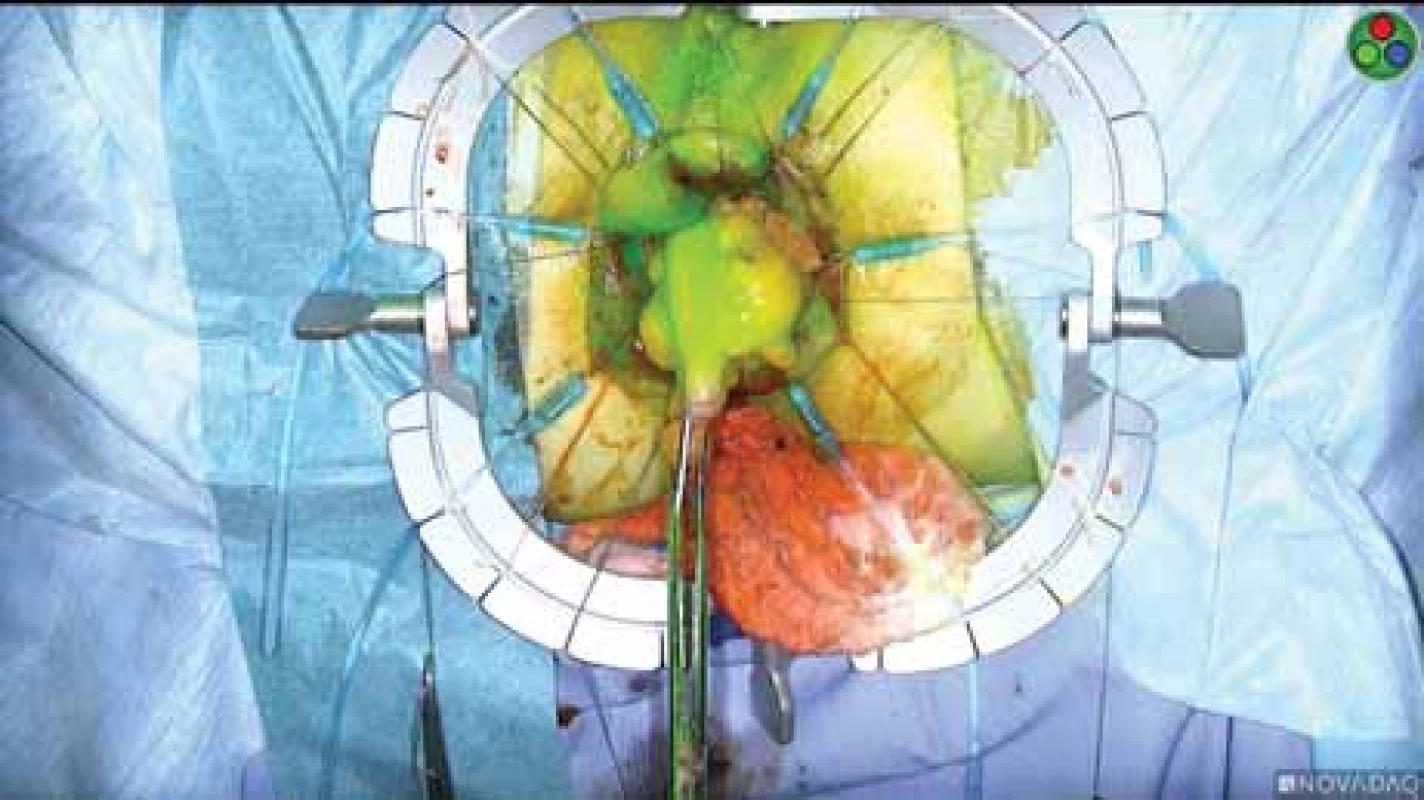
Optimální doba destomizace
Do klasického schématu: neoadjuvance – resekce s TME – adjuvance je nutné vřadit obnovení pasáže GIT zrušením dočasné stomie. Předpokladem je, aby bylo anastomotické spojení po resekci rekta zhojeno. Kontrolu provádíme zpravidla opakovanými anorektoskopiemi. Stran načasování jde vždy o dosažení konsenzu mezi chirurgem a onkologem a stavem pacienta po primárním resekčním výkonu.
Shoda nemusí být jednoduchá. Onkolog má motivaci zahájit včasně adjuvanci, pokud je indikována. Chirurg z funkčního hlediska preferuje včasné zrušení protektivní stomie, a tedy zatížení anastomózy, pokud je prokazatelně zhojená. To bývá asi 6 týdnů od primární operace. Založení derivační stomie a zejména její ponechání déle než 3 měsíce je nezávislý predikční faktor zhoršení kvality života v souvislosti s kontinencí stolice po jejím zrušení [38]. Příčinou je pravděpodobně snížená funkční adaptabilita neorekta po zrušení ileostomie. Zrušení protektivní stomie je tedy doporučováno do 6 týdnů po primárním resekčním výkonu.
Lepší kontrola nad případným vznikem metastáz
V současnosti hledáme v rámci neoadjuvantní léčby nová schémata, od kterých očekáváme především lepší kontrolu nad vzdálenou diseminací. Sauer et al prokázali vznik vzdálených metastáz u lokálně pokročilého karcinomu rekta v 19–34,4 % [39]. Jednou z možností, jak toto procento event. snížit, může být tzv. totální neoadjuvantní terapie (TNT). Jde o přístup, kdy maximum chemoterapie dostává pacient před chirurgickým výkonem, aby se docílilo nejen lokální kontroly, ale i vyšší kontroly mikrometastáz u rizikových pacientů (např. EMVI+).
Dosažení klinické kompletní odpovědi
Již nyní si některé týmy stanovily za cíl neoadjuvantní léčby vymizení tumoru. Samotná klinická kompletní odpověď (clinical complete response – cCR) je definována (zatím ne plně konsenzuálně) jako případ, kdy nádor zcela vymizel a není zjistitelný při klinickém vyšetření (per rectum), na endoskopii ani na zobrazovacích metodách.
Snaze dosáhnout cCR se tedy přizpůsobuje radiochemoterapie jak aplikací vyšších dávek radiace a intenzivnější chemoterapie, tak i prodloužením intervalu restagingu na 15–16 týdnů, kdy se provede celková reevaluace pacienta s tumorem rekta (klinicky, endoskopicky a zobrazovacími metodami). Tímto intenzifikovaným postupem se podařilo zvýšit počet cCR z obvyklých 8–15 % na 20–24 % ve smyslu filozofie „organ sparing“ [40,41].
„Organ sparing“ přístup, který pro pacienty s cCR lokálně pokročilého karcinomu rekta definovala v roce 2004 Habr-Gama [42], rozproudil v oblasti terapie tohoto onemocnění značnou aktivitu, a to nejen u chirurgů (do jejichž řad patří právě prof. Habr-Gama ze Sao Paula), ale zejména u radioterapeutů a onkologů, příp. dalších odborníků a vědců.
„Organ sparing“ přístup se týká dvou různých skupin pacientů:
- Pacientů s dosaženou cCR, kterým nabízíme aktivní sledování („surveillance“, „watch and wait“ přístup). To spočívá v pravidelných (à 3 měsíce) kontrolách klinických, endoskopických a pomocí zobrazovacích metod, v rámci klinických studií při všeobecném konsenzu pacienta a multidisciplinárního týmu lékařů (tab. 5) [43]. Pokud se v průběhu sledování pacienta po dosažení cCR objeví recidiva, nazývaná v tomto případě pojmem „regrowth“, je snaha ji radikálně řešit pomocí chirurgické resekce s TME.
- Pacientů, u kterých sice nedošlo k cCR, ale bylo dosaženo významného downsizingu a downstagingu (Tis, T1N0). V rámci „organ sparing“ přístupu se provádí lokální excize tumoru bez lymfadenektomie u pacientů s nízkým rizikem uzlinových metastáz (příznivý grade atd.).
Tab. 5. Protokol aktivního sledování pacientů po klinické kompletní odpovědi (převzato z [43]). ![Protokol aktivního sledování pacientů po klinické kompletní odpovědi
(převzato z [43]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/d7d307f4001cbfb943a5b40fb5e8b012.png)
CEA – karcinoembryonální antigen, MR – magnetická rezonance Jak postupovat u pacientů, kteří dosáhli cCR
Dosažením cCR však problémy nekončí. I když je samotná cCR prokazatelně nezávislým příznivým prognostickým faktorem, neznamená automaticky i patologickou CR (pCR), kterou prokážeme až histopatologickým hodnocením resekátu. Z toho samozřejmě vyplývají nejednoznačné závěry. K nejzávažnějším problémům patří:
- již zmíněná absence obecně uznávané definice cCR;
- „domnělá“ cCR – část pacientů má velmi časnou recidivu, tzn. „regrowth“, který se dle literatury objevuje u cca 22 % pacientů. Je nasnadě, že spíše než skutečná recidiva je příčinou tohoto stavu nesprávné zhodnocení reakce na léčbu jako cCR. Tomu odpovídá i zjištění, že i pacienti s ypT0 mohou mít pozitivní uzliny N1 (tab. 6) [44]. „Salvage“ resekce je možná v 84–95 % případů [45,46].
Tab. 6. Četnost výskytu pozitivních uzlin u časných karcinomů rekta. Podle National Cancer Database na základě hodnocení 12 271 resekátů pro nádor rekta v letech 2005–2014 [42]. ![Četnost výskytu pozitivních
uzlin u časných karcinomů rekta. Podle National Cancer Database na základě hodnocení 12 271 resekátů pro
nádor rekta v letech 2005–2014 [42].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/e16ac128c274eeb6aa4b471755dd523c.png)
S přihlédnutím k těmto faktům považujeme za velmi zajímavou studii GRECCAR 2 [47] a plánovanou navazující GRECCAR 12, kdy se místo po původním nádoru (jizva na sliznici či projasnění sliznice) exciduje a histologicky se tato excize hodnotí. Tím se zpřesní diagnóza cCR a odliší stadia ypT0, ypTis, ypT1 a vyšší. U stadií ypT0, ypTis se pokračuje v aktivní surveillance v rámci „watch and wait“ přístupu. U stadia ypT2 se vzhledem k riziku uzlinových metastáz indikuje „salvage“ resekce s TME. U ypT1 se postupuje individuálně. Obdobně postupuje tým studie CARTS [48], který v roce 2019 prezentoval dlouhodobé výsledky [49]. V obou studiích je ovšem neoadjuvance indikována u méně pokročilých forem karcinomu rekta.
Významným vedlejším efektem studie GRECCAR 4 pro lokálně primárně neresekabilní karcinom rekta s CRM < 1 mm bylo nejen zjištění, že lokální regrese tumoru nastala o > 50 % u 80 % pacientů, ale že v rameni s následnou radioterapií došlo u téměř 60 % pacientů k prokázané pCR (pacienti byli následně operováni). Z toho vyplývá, že se při přístupu, který by měl vést k „organ sparing“ výsledku, bez radioterapie zcela jistě neobejdeme. Je však také zřejmé, že chemoterapie je při absenci jiných prognostických markerů hlavním ukazatelem příznivé (při odpovědi na její působení) či nepříznivé biologie nádoru, která je pro prognózu zásadním faktorem. Autoři tohoto textu se ztotožňují s návrhem managementu lokálně pokročilého karcinomu rekta, který navrhli Rullier [47] a Rouanet (tab. 7) [10].
Tab. 7. Strategie léčby lokálně pokročilého karcinomu rekta. 
CRM – cirkumferenční resekční okraj Jak zvýšit počty pacientů vhodných pro „organ sparing“ přístup
Jak již bylo řečeno, jednou z cest je intenzifikace neoadjuvantní léčby a dosažení většího počtu kompletních klinických odpovědí, a tyto pacienty pak dále sledovat dle filozofie „watch and wait“. Druhou cestou je indikace lokální excize bez lymfadenektomie u pacientů s ypT0, ypTis, ev. ypT1. Třetí možností je indikace radiochemoterapie i na méně pokročilé formy karcinomu rekta, což teoreticky umožní očekávat dosažení většího počtu cCR i vyššího počtu pacientů vhodných k lokální excizi. Všechny tři přístupy se uplatňují v rámci klinických studií v prostředí multidisciplinární komise a komplexních onkologických center.
V praxi zatím chybí prediktivní faktory umožňující detekovat a z neoadjuvantní léčby eliminovat non-respondéry a vyhnout se jak zdržení operační léčby, tak i negativních vlivů spojených s radiochemoterapií.
V současné klinické praxi se setkáváme s otázkami, na které budeme muset v blízké budoucnosti nalézt uspokojivé odpovědi. Některé zásadní, zejména z pohledu onkochirurga, uvádíme v krátké rekapitulaci:
- Budeme posunovat (oddalovat) dobu restagingu?
- Budeme měnit neoadjuvanci, abychom ovlivnili distální šíření nemoci? – Více indikací totální neoadjuvantní chemoradioterapie? Zahájit ji radioterapií, či chemoterapií?
- Budeme standardně indikovat lokální excize bez lymfadenektomie i pacientům po neoadjuvanci s dobrou odpovědí, ale bez pCR?
- Jak rutinně postupovat u pacientů s pCR?
- Budeme měnit neoadjuvanci s cílem zvýšit podíl pCR?
- Budeme ze stejných důvodů indikovat k neoadjuvanci i včasnější stadia?
- Jak přesněji definovat cCR tak, aby se více blížila pCR a snížila se rizika „regrowth“?
- Jak účinněji sledovat pacienty s cCR?
- Objeví se v dohledné době účinné faktory predikce odpovědi na neoadjuvanci?
V současnosti nelze na většinu položených otázek odpovědět z pohledu medicíny založené na důkazech.
Závěr
Chirurgie vnímá probíhající diskuzi o optimalizaci neoadjuvantní léčby pokročilého karcinomu rekta, která má za cíl další snížení lokálních recidiv a lepší kontrolu nad vznikem vzdálených metastáz. Pro chirurga je zásadní dosažení konsenzu stran intervalu resekčního výkonu od ukončení neoadjuvantní léčby. Některé studie ukazují vhodnost prodloužit současný interval za hranici 8 týdnů, protože regresivní změny mohou probíhat až do 11. týdne bez zásadního vlivu na mortalitu a morbiditu náročného operačního zákroku. Trend dosažení maximální lokální odpovědi a především cCR však tuto hranici intervalu posouvá ještě dále, aniž bychom měli dostatečná data o vlivech na mortalitu a morbiditu takto posunutého chirurgického řešení. Dalším palčivým problémem z pohledu chirurga jsou současná ne zcela jasná doporučení léčby pro pacienty s dosaženou cCR.
„Organ sparing“ filozofie je velmi lákavá, ale chirurgické výsledky u pacientů s „regrowth“ nejsou optimální. Z pohledu chirurga považujeme za zásadní odlišit zdánlivou cCR od té skutečné. Z tohoto úhlu vnímání se jeví jako velmi perspektivní aktivní role chirurga s provedením lokální excize jizvy po tumoru – jakési „makrobiopsie“ po proběhlé účinné radiochemoterapii.
Pokud je součástí neoadjuvantní léčby i systémová chemoterapie u rizikových pacientů (EMVI+), kteří jsou ohroženi vznikem vzdálených metastáz, pak je předoperační chemoterapie větší jistotou než případná adjuvantní pooperační chemoterapie, která se může opozdit u pacientů s pooperačními komplikacemi.
Je logické, že současně s personalizací a precizací neoadjuvantní léčby se bude individualizovat i přístup chirurga. Již nyní je evidentní příklon k „organ sparing“ („watch and wait“ přístup, lokální excize). Pro pacienta je důležitá znalost a schopnost daného pracoviště provádět celou škálu možných operací od lokální excize po extralevátorové amputace rekta, vč. výkonů s TME a intersfinkterických resekcí. Do popředí se dostává miniinvazivní chirurgický přístup – laparoskopie, robotická chirurgie, TaTME. Poslední ze jmenovaných má neocenitelný význam u pacientů obézních a s úzkou pánví. Optimální a v budoucnu k nutnosti konvergující strategie bude sestávat z celé palety terapeuticko-technických možností, vč. zřejmě brzy dostupného speciálního robota pro TaTME. Cílem je, aby i chirurg mohl, stejně jako onkolog či radioterapeut, poskytnout pacientovi s nádorem rekta individualizovaný přístup podle stadia choroby, stagingu, biologie nádoru i odpovědi na případnou neoadjuvantní léčbu.
Práce byla realizována za podpory Agentury pro zdravotnický výzkum MZ ČR pod grantovým číslem AZV 16-31765 A.
This work was supported by the Agency for Healthcare Research of the Ministry of Health of the Czech Republic, grant No. AZV 16-31765 A.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Martin Zatloukal
Chirurgická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: zatloukal.martin@fnbrno.cz
Obdrženo/Submitted: 28. 12. 2019
Přijato/Accepted: 19. 2. 2020
Zdroje
1. Ross A, Rusnak C, Weinerman B et al. Recurrence and survival after surgical management of rectal cancer. Am J Surg 1999; 177 (5): 392–395. doi: 10.1016/s0002-9610 (99) 00080-x.
2. Bertolini F, Scarabelli L, Del Giovane C et al. Locally advanced rectal cancer (LARC): A 12-year experience of multimodality approach. JCO 2011; 29 (4_suppl): 607. doi: 10.1200/jco.2011.29.4_suppl.607.
3. Wang XJ, Chi P, Lin HM et al. Effects of neoadjuvant chemoradiotherapy on the rates of sphincter preserving surgery in lower rectal cancer and analysis of their prognostic factors. Zhonghua Wai Ke Za Zhi 2016; 54 (6): 419–423. doi: 10.3760/cma.j.issn.0529-5815.2016.06.005.
4. Wasserberg N, Kundel Y, Purim O et al. Sphincter preservation in distal CT2N0 rectal cancer after preoperative chemoradiotherapy. Radiat Oncol 2014; 9 : 233. doi: 10.1186/s13014-014-0233-3.
5. Park IJ, Yu CS, Lim S-B et al. Is preoperative chemoradiotherapy beneficial for sphincter preservation in low-lying rectal cancer patients? Medicine (Baltimore) 2016; 95 (18): e3463. doi: 10.1097/MD.0000000000003463.
6. Ihn MH, Kim YH, Kim D-W et al. Effects of preoperative chemoradiotherapy on the likelihood of sphincter preservation surgery in locally advanced distal rectal cancer: a longitudinal study based on pelvic magnetic resonance imaging. Ann Surg Oncol 2015; 22 (7): 2159–2167. doi: 10.1245/s10434-014-4286-1.
7. Gérard J-P, Conroy T, Bonnetain F et al. Preoperative radiotherapy with or without concurrent fluorouracil and leucovorin in T3-4 rectal cancers: results of FFCD 9203. J Clin Oncol 2006; 24 (28): 4620–4625. doi: 10.1200/JCO.2006.06.7629.
8. Richter I, Dvořák J, Bartoš J et al. Aktuální možnosti chemoradioterapie lokálně pokročilého karcinomu rekta. Onkologie 2015; 9 (6): 282–286.
9. Wiltink LM, Chen TYT, Nout RA et al. Health-related quality of life 14 years after preoperative short-term radiotherapy and total mesorectal excision for rectal cancer: report of a multicenter randomised trial. Eur J Cancer 2014; 50 (14): 2390–2398. doi: 10.1016/j.ejca.2014.06.020.
10. Rouanet P, Rullier E, Lelong B et al. Tailored treatment strategy for locally advanced rectal carcinoma based on the tumor response to induction chemotherapy: preliminary results of the French phase II multicenter GRECCAR4 trial. Dis Colon Rectum 2017; 60 (7): 653–663. doi: 10.1097/DCR.0000000000000849.
11. Bachet JB, Lucidarme O, Levache CB et al. FOLFIRINOX as induction treatment in rectal cancer patients with synchronous metastases: results of the FFCD 1102 phase II trial. Eur J Cancer 2018; 104 : 108–116. doi: 10.1016/j.ejca.2018.09.006
12. Bujko K, Nowacki MP, Nasierowska-Guttmejer A et al. Sphincter preservation following preoperative radiotherapy for rectal cancer: report of a randomised trial comparing short-term radiotherapy vs. conventionally fractionated radiochemotherapy. Radiother Oncol 2004; 72 (1): 15–24. doi: 10.1016/j.radonc.2003.12.006.
13. Kulu Y, Ulrich A, Büchler MW. Resectable rectal cancer: which patient does not need preoperative radiotherapy? Dig Dis 2012; 30 Suppl 2 : 118–125. doi: 10.1159/000342040.
14. Glynne-Jones R, Wyrwicz L, Tiret E et al. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018; 29 (Suppl 4): iv263. doi: 10.1093/annonc/mdy161.
15. Heald RJ, Husband EM, Ryall RD. The mesorectum in rectal cancer surgery—the clue to pelvic recurrence? BJS 1982; 69 (10): 613–616. doi: 10.1002/bjs.1800691019.
16. MacFarlane JK, Ryall RDH, Heald RJ. Mesorectal excision for rectal cancer. Lancet 1993; 341 (8843): 457–460. doi: 10.1016/0140-6736 (93) 90207-W.
17. Archampong D, Borowski D, Wille-Jørgensen P et al. Workload and surgeon’s specialty for outcome after colorectal cancer surgery. Cochrane Database Syst Rev 2012; (3): CD005391. doi: 10.1002/14651858.CD005391.pub3.
18. Nagtegaal ID, Quirke P. What is the role for the circumferential margin in the modern treatment of rectal cancer? JCO 2008; 26 (2): 303–312. doi: 10.1200/JCO.2007.12.7027.
19. MERCURY Study Group. Diagnostic accuracy of preoperative magnetic resonance imaging in predicting curative resection of rectal cancer: prospective observational study. BMJ 2006; 333 (7572): 779. doi: 10.1136/bmj.38937.646400.55.
20. Chand M, Swift RI, Tekkis PP et al. Extramural venous invasion is a potential imaging predictive biomarker of neoadjuvant treatment in rectal cancer. Br J Cancer 2014; 110 (1): 19–25. doi: 10.1038/bjc.2013.603.
21. Battersby NJ, Dattani M, Rao S et al. A rectal cancer feasibility study with an embedded phase III trial design assessing magnetic resonance tumour regression grade (mrTRG) as a novel biomarker to stratify management by good and poor response to chemoradiotherapy (TRIGGER): study protocol for a randomised controlled trial. Trials 2017; 18 (1): 394. doi: 10.1186/s13063-017-2085-2.
22. Paspulati RM, Partovi S, Herrmann KA et al. Comparison of hybrid FDG PET/MRI compared with PET/CT in colorectal cancer staging and restaging: a pilot study. Abdom Imaging 2015; 40 (6): 1415–1425. doi: 10.1007/s00261-015-0474-0.
23. Balyasnikova S, Brown G. Optimal imaging strategies for rectal cancer staging and ongoing management. Curr Treat Options Oncol 2016; 17 (6): 32. doi: 10.1007/s11864-016-0403-7.
24. Macháčková T, Grolich T, Fiala L et al. Využití sekvenování nové generace v analýze cirkulujících mikroRNA jako prediktivních biomarkerů u pacientů s lokálně pokročilým karcinomem rekta. Klin Onkol 2019; 32 (Suppl 1): 157–159.
25. Svoboda M, Slyskova J, Schneiderova M et al. HOTAIR long non-coding RNA is a negative prognostic factor not only in primary tumors, but also in the blood of colorectal cancer patients. Carcinogenesis 2014; 35 (7): 1510–1515. doi: 10.1093/carcin/bgu055.
26. Khakoo S, Georgiou A, Gerlinger M et al. Circulating tumour DNA, a promising biomarker for the management of colorectal cancer. Crit Rev Oncol Hematol 2018; 122 : 72–82. doi: 10.1016/j.critrevonc.2017.12.002.
27. Petit J, Carroll G, Gould T et al. Cell-free DNA as a diag-nostic blood-based biomarker for colorectal cancer: a systematic review. J Surg Res 2019; 236 : 184–197. doi: 10.1016/j.jss.2018.11.029.
28. Schiffmann L, Wedermann N, Gock M et al. Intensified neoadjuvant radiochemotherapy for rectal cancer enhances surgical complications. BMC Surg 2013; 13 : 43. doi: 10.1186/1471-2482-13-43.
29. Kala Z, Procházka V, Grolich T et al. Moderní trendy v chirurgii kolorektálního karcinomu aneb co by měl onkolog vědět o práci chirurga. Onkologie 2017; 11 (2): 54–60. doi: 10.36290/xon.2017.012.
30. Arjona-Sánchez A, Barrios P, Boldo-Roda E et al. HIPECT4: multicentre, randomized clinical trial to evaluate safety and efficacy of hyperthermic intra-peritoneal chemotherapy (HIPEC) with mitomycin C used during surgery for treatment of locally advanced colorectal carcinoma. BMC Cancer 2018; 18 (1): 183. doi: 10.1186/s12885-018-4096-0.
31. van der Paardt MP, Zagers MB, Beets-Tan RG et al. Patients who undergo preoperative chemoradiotherapy for locally advanced rectal cancer restaged by using diagnostic MR imaging: a systematic review and meta-analysis. Radiology 2013; 269 (1): 101–112. doi: 10.1148/radiol.13122833.
32. Carlsen E, Schlichting E, Guldvog I et al. Effect of the introduction of total mesorectal excision for the treatment of rectal cancer. Br J Surg 1998; 85 (4): 526–529. doi: 10.1046/j.1365-2168.1998.00601.x.
33. Eriksen MT, Wibe A, Norstein J et al. Anastomotic leakage following routine mesorectal excision for rectal cancer in a national cohort of patients. Colorectal Dis 2005; 7 (1): 51–57. doi: 10.1111/j.1463-1318.2004.00700.x.
34. Karanjia ND, Corder AP, Bearn P et al. Leakage from stapled low anastomosis after total mesorectal excision for carcinoma of the rectum. Br J Surg 1994; 81 (8): 1224–1226. doi: 10.1002/bjs.1800810850.
35. Ma T, Zhong Q, Cao W et al. Clinical anastomotic leakage after rectal cancer resection can be predicted by pelvic anatomic features on preoperative MRI scans: a secondary analysis of a randomized controlled trial. Dis Colon Rectum 2019; 62 (11): 1326–1335. doi: 10.1097/DCR.0000000000001481.
36. Bertelsen CA, Andreasen AH, Jørgensen T et al. Anastomotic leakage after anterior resection for rectal cancer: risk factors. Colorectal Dis 2010; 12 (1): 37–43. doi: 10.1111/j.1463-1318.2008.01711.x.
37. Nascimbeni R, Burgart LJ, Nivatvongs S et al. Risk of lymph node metastasis in T1 carcinoma of the colon and rectum. Dis Colon Rectum 2002; 45 (2): 200–206. doi: 10.1007/s10350-004-6147-7.
38. Pachler J, Wille-Jørgensen P. Quality of life after rectal resection for cancer, with or without permanent colostomy. Cochrane Database Sys Rev 2004; (3): CD004323. doi: 10.1002/14651858.CD004323.pub4.
39. Sauer R, Liersch T, Merkel S et al. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol 2012; 30 (16): 1926–1933. doi: 10.1200/JCO.2011.40.1836.
40. Maas M, Nelemans PJ, Valentini V et al. Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: a pooled analysis of individual patient data. Lancet Oncol 2010; 11 (9): 835–844. doi: 10.1016/S1470-2045 (10) 70172-8.
41. Martin ST, Heneghan HM, Winter DC. Systematic review and meta-analysis of outcomes following pathological complete response to neoadjuvant chemoradiotherapy for rectal cancer. Br J Surg 2012; 99 (7): 918–928. doi: 10.1002/bjs.8702.
42. Habr-Gama A, Perez RO, Nadalin W et al. Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results. Ann Surg 2004; 240 (4): 711–718. doi: 10.1097/01.sla.0000141194.27992.32.
43. Verseveld M, de Graaf EJR, Verhoef C et al. Chemoradiation therapy for rectal cancer in the distal rectum followed by organ-sparing transanal endoscopic microsurgery (CARTS study). Br J Surg 2015; 102 (7): 853–860. doi: 10.1002/bjs.9809.
44. Duchalais E, Glyn Mullaney T, Spears GM et al. Prognostic value of pathological node status after neoadjuvant radiotherapy for rectal cancer. Br J Surg 2018; 105 (11): 1501–1509. doi: 10.1002/bjs.10867.
45. Kong JC, Guerra GR, Warrier SK et al. Outcome and salvage surgery following ‘watch and wait’ for rectal cancer after neoadjuvant therapy: a systematic review. Dis Colon Rectum 2017; 60 (3): 335–345. doi: 10.1097/DCR.0000000000000754.
46. Dossa F, Chesney TR, Acuna SA et al. A watch-and-wait approach for locally advanced rectal cancer after a clinical complete response following neoadjuvant chemoradiation: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol 2017; 2 (7): 501–513. doi: 10.1016/S2468-1253 (17) 30074-2.
47. Rullier E, Rouanet P, Tuech J-J et al. Organ preservation for rectal cancer (GRECCAR 2): a prospective, randomised, open-label, multicentre, phase 3 trial. Lancet 2017; 390 (10093): 469–479. doi: 10.1016/S0140-6736 (17) 31056-5.
48. Verseveld M, de Graaf EJ, Verhoef C et al. Chemoradiation therapy for rectal cancer in the distal rectum followed by organ-sparing transanal endoscopic microsurgery (CARTS study). Br J Surg 2015; 102 (7): 853–860. doi: 10.1002/bjs.9809.
49. Stijns RC, de Graaf EJ, Punt CJ et al. Long-term oncological and functional outcomes of chemoradiotherapy followed by organ-sparing transanal endoscopic microsurgery for distal rectal cancer: the CARTS study. JAMA Surg 2019; 154 (1): 47–54. doi: 10.1001/jamasurg.2018.3752.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek EditorialČlánek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2020 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Editorial
- Současný pohled na možnosti léčby BRAF mutovaného kolorektálního karcinomu
- Dlouhé nekódující RNA a karcinom z renálních buněk
- Výzvy a riešenia v manažmente kardiotoxicity checkpoint inhibítorov
- Systémová liečba hepatocelulárneho karcinómu
- Nové trendy v neoadjuvantní léčbě lokálně pokročilého karcinomu rekta z pohledu chirurga – komentář
- Implementácia imunoterapie do liečby neuroblastómu – skúsenosti jedného centra s podávaním a manažovaním nežiaducich účinkov dinutuximabu
- Skvamocelulárny karcinóm hrubého čreva – kazuistika
- Prvý pacient s COVID-19 na Slovensku
- Extravazace (paravazace) cytostatik – aktualizované doporučení (2020) pro standardní péči v rámci České republiky ze spolupráce Sekce podpůrné léčby České onkologické společnosti ČLS JEP, České hematologické společnosti ČLS JEP, Onkologické sekce České asociace sester a Společnosti pro porty a permanentní katétry
- Entrektinib – tumor-agnostická léčba penetrující do centrálního nervového systému s prokázanou účinností i u pediatrické populace
- Aktuality z odborného tisku
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nové trendy v neoadjuvantní léčbě lokálně pokročilého karcinomu rekta z pohledu chirurga – komentář
- Současný pohled na možnosti léčby BRAF mutovaného kolorektálního karcinomu
- Extravazace (paravazace) cytostatik – aktualizované doporučení (2020) pro standardní péči v rámci České republiky ze spolupráce Sekce podpůrné léčby České onkologické společnosti ČLS JEP, České hematologické společnosti ČLS JEP, Onkologické sekce České asociace sester a Společnosti pro porty a permanentní katétry
- Systémová liečba hepatocelulárneho karcinómu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání