-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současný pohled na možnosti léčby BRAF mutovaného kolorektálního karcinomu
Current perspectives on the treatment of BRAF mutated colorectal carcinoma
Background: Worldwide metastatic colorectal cancer is the second most common cause of death attributable to cancer. Advances in molecular diagnostics led to recognition of several molecular subtypes of this disease. BRAF mutated colorectal cancer define specific challenging subgroup associated with dismal prognosis, lower rate of response rate, shorter progression free survival and overall survival. Current treatment choices are associated with poor outcomes. For the first line treatment doublet or triplet chemotherapy plus antiangiogenic antibody is used. To date, there were no reasonable treatment options in the second line settings. Recently published BEACON trial sets new standard of treatment with combination of encorafenib plus cetuximab, which led to significantly longer overall survival and overall response compared to standard therapy. Furthermore, this combination has shown well-tolerated safety profile with manageable toxicities.
Purpose: The aim of this article is a review of current treatment options for BRAF mutated colorectal cancer.
Keywords:
metastatic colorectal cancer – cetuximab – BRAF V600E – encorafenib – binimetinib – BEACON
Autoři: MUDr. Batko Stanislav
Působiště autorů: Onkologická klinika 2. LF a FN Motol
Vyšlo v časopise: Klin Onkol 2020; 33(5): 328-338
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2020328Souhrn
Východiska: Metastazující kolorektální karcinom je celosvětově druhou nejčastější příčinou úmrtí na nádorová onemocnění. Pokroky v molekulární diagnostice umožnily definovat několik odlišných podskupin tohoto onemocnění. Podskupina tumorů s přítomností mutace BRAF představuje pro lékaře největší výzvu, neboť je spojena s nižší šancí na nádorovou odpověď, kratším přežitím bez progrese i kratším celkovým přežitím. Současné výsledky standardní léčby jsou neuspokojivé. Pro první linii léčby bývá dle charakteristik pacienta doporučován dublet či triplet chemoterapie s antiangiogenní léčbou. Pro předléčené pacienty však dosud nebyla dostupná účinná léčba. V současnosti je na základě výsledků randomizované studie fáze III BEACON pro tyto pacienty k dispozici nová léčebná možnost založená na kombinaci cetuximabu a enkorafenibu, která vedla k významnému prodloužení celkového přežití v porovnání se standardně dostupnými léčebnými režimy. Tato kombinace se navíc vyznačuje příznivým a zvladatelným profilem nežádoucích účinků.
Cíl: Cílem tohoto článku je přehled současných možností léčby BRAF mutovaného kolorektálního karcinomu.
Klíčová slova:
BRAF V600E – metastatický kolorektální karcinom – cetuximab – enkorafenib – binimetinib – BEACON
Epidemiologie
Aktuální data databáze GLOBOCAN z roku2018 celosvětově staví kolorektální karcinom (CRC) na třetí místo v počtu nových případů a na druhé místo v počtu úmrtí na nádorová onemocnění. Promítnuto do absolutních čísel je tak každý rok diagnostikován u 2 mil. lidí a 1 mil. lidí tomuto onemocnění podlehne [1]. Poznatky z molekulární biologie vedly k hlubšímu porozumění CRC, jenž je v současnosti vnímán jako heterogenní onemocnění. Publikace mapující výskyt BRAF mutací udávají incidenci 5–20 % všech CRC v závislosti na charakteristikách studované publikace [2–6]. U Pacientů s BRAF mutovaným CRC lze identifikovat řadu specifických charakteristik sestávající z vyšší incidence u:
- pravostranných tumorů [5] (v jedné práci [7] byla zachycena BRAF mutace až u 36 % nádorů vzestupného tračníku);
- špatně diferencovaných karcinomů (40–60 %);
- mucinózních karcinomů [8,9];
- pacientů > 70 let;
- pacientů ženského pohlaví [10].
Vzorec metastazování BRAF mutovaného CRC zahrnuje vysokou četnost peritoneálních metastáz a naopak nižší výskyt plicních a jaterních metastáz [11–13]. Peritoneální diseminace je velmi často kontraindikací chirurgické resekce jiných orgánových metastáz a navíc vede k rozvoji obtížně ovlivnitelných komplikací, zejména ileózního stavu, jenž je obvykle překážkou podávání další léčby. Byla popsána spojitost mezi nálezem mikrosatelitové instability (MSI) a mutace BRAF (obr. 1). Ukazuje se, že BRAF mutované tumory s MSI a tumory mikrosatelitově stabilní (MSS) představují z hlediska agresivity a odpovědi na léčbu odlišné klinické jednotky.
Obr. 1. Vztah mezi mikrosatelitní nestabilitou a mutací BRAF [14]. ![Vztah mezi mikrosatelitní nestabilitou a mutací BRAF [14].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/56fc074954211143aa4981d9a71246dd.png)
BRAF-mut – mutace BRAF genu, CIMP-H – fenotyp vysoké metylace CpG ostrůvků v promotorových sekvencích DNA, MSI-H – vysoká míra mikrosatelitní nestability Z klinického hlediska je nejdůležitější asociace mezi mutací BRAF a horším celkovým přežitím (overall survival – OS) pacientů. Tato spojitost byla popsána u lokalizovaného onemocnění [15–18] i v rámci metastazujícího onemocnění, kde výsledky subanalýz podskupin dle BRAF statusu provedené ve významných studiích s metastatickým CRC (mCRC) konzistentně ukazují významně kratší OS u BRAF mutovaných tumorů (tab. 1) [19–27].
Tab. 1. Srovnání celkového přežití mezi podskupinami BRAF wild type a BRAF mutace u vybraných studií. 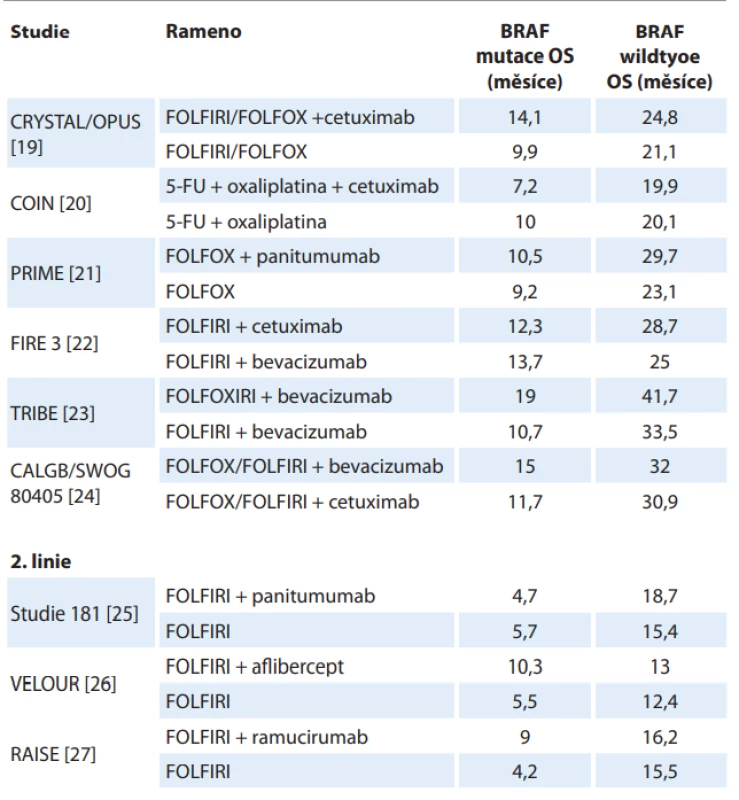
CHT – chemoterapie, FOLFIRI – kalcium folinát + fl uorouracil + irinotekan, FOLFOX – kalcium folinát + fl uorouracil + oxaliplatina, FU – fl uorouracil, OS – celkové přežití Role EGFR signalizační kaskády kolorektálního karcinomu
Signalizační kaskáda RAS-RAF-MEK-ERK, známá také jako MAPK (mitogenem aktivovaná proteinová kináza), se účastní buněčné proliferace, diferenciace, přežití a apoptózy [28]. Kaskáda může být aktivována z více molekulárních úrovní, např. z interních metabolických regulátorů, na základě změny koncentrace intracelulárních proteinů nebo prostřednictvím aktivace transmembránových receptorů či interakcí s jinou buňkou [29]. Tato kaskáda je důležitým bodem terapeutického zásahu, ale také možným dysregulačním místem vedoucím ke zvýšenému malignímu chování [30].
RAS (KRAS, NRAS, HRAS) GTPázová skupina proteinů je aktivována na základně multisignálního přenosu ze stimulovaného transmembránového receptoru epidermálního růstového faktoru (EGFR). RAS kináza dále aktivuje proteinové kinázy RAF (ARAF, BRAF a CRAF). Dominantní substráty pro RAF kinázy jsou MAPK/ERK kinázy MEK1 a MEK2. ERK fosforylují řadu substrátů, vč. transkripčních faktorů regulujících řadu klíčových buněčných aktivit (obr. 2) [31].
Obr. 2. Zjednodušené schéma signální dráhy EGFR signalizace [31]. ![Zjednodušené schéma signální dráhy EGFR signalizace [31].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/d81a9250534ce982552e33c52eb2c19b.png)
EGFR – receptor epidermálního růstového faktoru BRAF
BRAF je serin/threoninová proteinkináza ze skupiny RAF kináz zahrnujících ještě proteiny ARAF a CRAF. Nejvyšší vazebnou kapacitu s RAS proteiny oplývá protein CRAF, naproti tomu BRAF selektivně váže protein KRAS [32]. Aberantní aktivace signalizační kaskády RAS/RAF/MEK/ERK v jakékoli její části může vést k abnormálnímu buněčnému růstu, invazi a metastazování [33]. U metastatického CRC představuje mutace V600E genu BRAF nejčastější variantu mutace tohoto genu [34]. Byly popsány non-V600E mutace BRAF vyskytující se predominantně u levostranných tumorů, lepší prognózou [35] vyplývající ze způsobu, jakým ovlivňují aktivitu signální dráhy.
Podstatou mutace BRAF V600E je záměna thyminu za adenin na pozici 17999 (1799TA) vedoucí k výměně valinu za glutamát. Za fyziologických okolností vede fosforylace RAS proteiny k tvorbě heterodimeru BRAF a CRAF, jenž posléze fosforylací aktivuje protein MEK. Mutace V600E BRAF, jež je nejčastějším typem BRAF mutace představující 90 % všech mutací u CRC vede k tvorbě konstitučně aktivního monomeru s 10× silnější kinázovou aktivitou [36] a bývá označována jako mutace třídy I. Další non-V600E mutace BRAF jsou označovány jako mutace třídy II, pokud navozují kinázovou aktivitu ve formě dimerů, nebo třídy III, pokud amplifikují ERK signalizaci za předpokladu aktivace „upstream“ kinázových proteinů. U ostatních typů nádorů je mutace BRAF V600E nejvýznamněji zastoupena u melanomu (40–60 %), papilárního karcinomu štítné žlázy (45 %) a „low grade“ serózního ovariálního karcinomu (35 %) [37].
Cílená léčba BRAF mutovaného mCRC
Poznání role mutace V600E BRAF proteinu v konstituční aktivaci signální dráhy MAPK vedlo přirozeně k testování terapeutického potenciálu již dříve v praxi používaného inhibitoru BRAF vemurafenibu, který prokázal velmi dobré výsledky u metastatického melanomu s BRAF mutací V600E, kde v monoterapii či v kombinaci s další léčbou dosáhla četnost objektivních odpovědí (ORR) 50–80 %. Výsledky testování tohoto léčiva v monoterapii u pacientů s mCRC však přinesly zklamání. Studie fáze II [38] zkoumající vemurafenib u pacientů s BRAF mutací mCRC předléčených nejméně 1× předchozí linií léčby ukázala parciální odpověď u jediného z 21 léčených pacientů – ORR 5 %, u sedmi dalších došlo ke stabilizaci onemocnění. Medián přežití bez progrese (progression-free survival – PFS) dosáhl pouze 2,1 měsíce. Vysvětlení nedostatečného účinku se ukrývá v mechanizmu odpovědi na inhibici V600E mutovaného BRAF (obr. 3), jež bylo publikováno již v roce 2012 [39–41]. Po ošetření buněčných kultur vemurafenibem sice došlo k poklesu aktivované (fosforylované) formy proteinu ERK, ovšem již po 24 hodinách vystoupaly hladiny na 25–50 % normálních hladin. Souběžně s tím vystoupala hladina fosforylovaného proteinu CRAF ukazující na opětovné nastolení funkční signální dráhy MAPK. Další studie se tudíž ubíraly cestami dubletu blokujícího receptora EGFR a mutovaný BRAF protein a dubletu inhibujícího BRAF a MEK proteiny. Rozpoznání role dráhy PI3K-Akt-mTOR (fostatidylinositol-3-kinázy-akt-mamalian target of rapamycin) v progresi aktivace vedlo k testování kombinací EGFR + BRAF s inhibitorem PI3K alpesilibem. V neposlední řadě byly provedeny studie s tripletem irinotekanu, vemurafenibu a cetuximabu. Publikované studie shrnuje tab. 2 [42–51].
Obr. 3. MAPK signální dráha BRAF mutovaného mCRC a vliv inhibitorů jednotlivých proteinů na její funkci [41]. ![MAPK signální dráha BRAF mutovaného mCRC a vliv inhibitorů jednotlivých proteinů na její funkci [41].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/073f18ae546684b5a35f866902c577f4.png)
BRAF V600E – mutace BRAF genu vedoucí k záměně valinu za kyselinu glutamovou na pozici 600 v proteinovém řetězci B-Raf kinázy, CET – cetuximab, DAB – dabrafenib (nízkomolekulární inhibitor mutované B-Raf kinázy), EGFR – receptor pro epidermální růstový faktor, ENC – enkorafenib (nízkomolekulární inhibitor mutované B-Raf kinázy), ERK – mitogenem aktivovaná serin/treoninová kináza, MAPK – mitogenem aktivovaná proteinová kináza, mCRC – metastatický kolorektální karcinom, MEK – mitogenem aktivovaná tyrozin/treoninová kináza, PAN – panitumumab, RAS – Ras kináza/nízkomolekulární GTPáza, RAF – Raf serin/treoninová kináza, TZRA – trametinib (nízkomolekulární inhibitor MEK kinázy), ULI – ulixertinib (nízkomolekulární inhibitor ERK kinázy), VEM – vemurafenib (nízkomolekulární inhibitor mutované B-Raf kinázy) Tab. 2. Předchozí studie zkoumající inhibici BRAF u metastazujícího kolorektálního karcinomu. 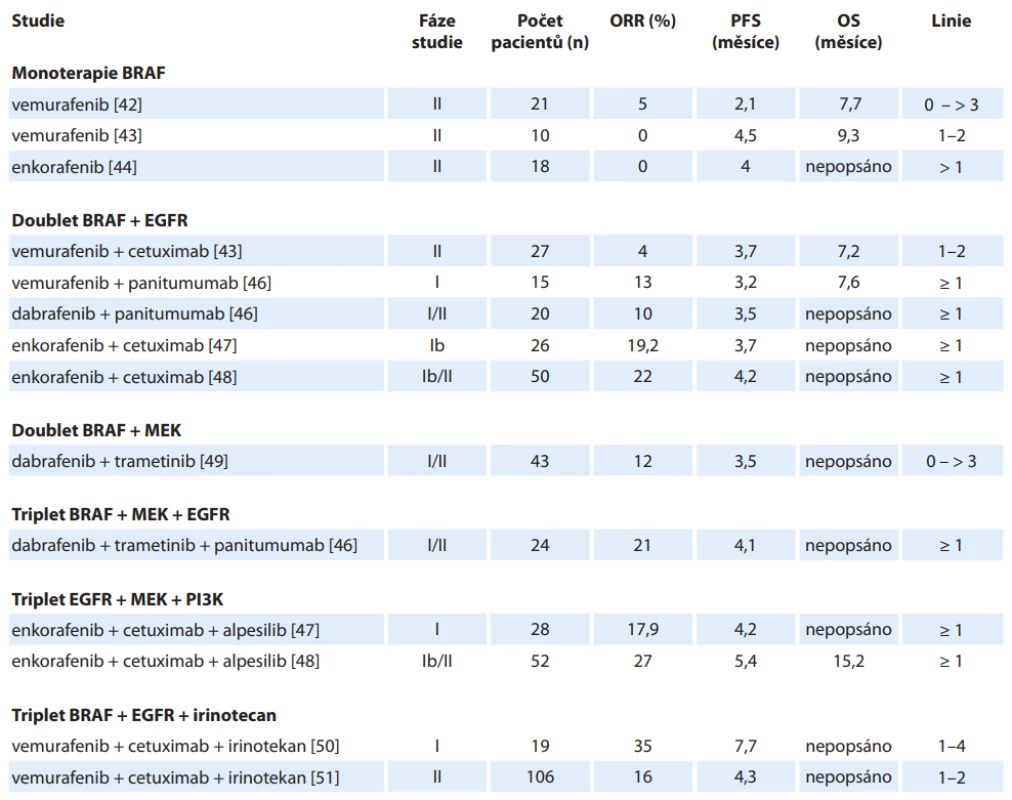
EGFR – receptor epidermálního růstového faktoru, MEK – mitogenem aktivovaná kináza, ORR – celková černost odpovědí, OS – celkové přežití, PFS – přežití bez progrese, PI3K – fosfatidylinozitol-3-kináza Randomizované studie s léčbou cílenou na BRAF představují studie fáze II SWOG 1406 [50] a studie fáze III BEACON [51]. Randomizovaný design přirozeně vyžaduje definování léčby v kontrolním ramenu a s tím souvisí i otázka, zda je mutace BRAF prediktorem účinnosti anti-EGFR protilátek. Pokud by léčba samotnými anti-EGFR protilátkami měla detrimentální vliv na výsledky pacientů, došlo by ke zkreslení výsledků studií ve prospěch experimentálního ramene. Publikovány byly dvě metaanalýzy zkoumající prediktivní roli BRAF mutace na výsledky léčby mCRC. Práce Pietrantonia z roku 2015 [52] neprokázala benefit, ale ani detrimentální efekt přidání anti-EGFR léků ke standardní chemoterapii v parametrech PFS (poměr rizik (hazard ratio – HR) 0,88; 95% CI 0,67–1,14; p = 0,33), OS (HR 0,91; 95% CI 0,62–1,34; p = 0,63) ani četnosti objektivních odpovědí (objective response rate – ORR) (relativní riziko 1,31; 95% CI 0,83–2,08; p = 0,25). K obdobným výsledkům došla i Rowlandova metanalýza [53] ze stejného roku s nálezem stejných výsledků OS u BRAF mutované populace (HR 0,97; 95% CI 0,67–1,41) i PFS (HR 0,86; 95% CI 0,61–1,21) (tab. 3).
Tab. 3. Srovnání celkového přežití mezi podskupinami BRAF wild type a BRAF mutace u vybraných studií [53]. ![Srovnání celkového přežití mezi podskupinami BRAF wild type a BRAF mutace u vybraných studií [53].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/38769403d72d4a866f16875109c4347f.png)
Statistické hodnocení účinnosti: p = 0,88 Heterogenita: I2 = 53 %; p = 0,06 CI – interval spolehlivosti, HR – poměr rizik, OS – celkové přežití Studie SWOG 1406
V randomizované klinické studii fáze II s BRAF V600E mutovaným metastazujícím CRC byli pacienti předléčeni jednou až dvěma liniemi léčby a náhodně byli přiřazeni do ramene s režimem irinotekan + cetuximab nebo do ramene s režimem irinotekan + cetuximab + vemurafenib. Design studie zahrnoval možnost přestupu z kontrolního ramene do experimentálního ramene po progresi onemocnění. Studie si stanovila jako primární cíl investigátory hodnocené PFS. Celkově bylo v době od prosince 2014 do dubna 2016 zařazeno 106 pacientů (54 k irinotekanu + cetuximabu + vemurafenibu). Léčba irinotekanem + cetuximabem + vemurafenibem vedla k výraznému zlepšení v primárním cíli s mediánem PFS 4,4 měsíce (95% CI 3,6–5,7) oproti 2,0 měsíce v rameni s irinotekanem + cetuximabem (95% CI 1,8–2,1; HR = 0,42; 95% CI 0,26–0,66; p < 0,001). V rameni s irinotekanem + cetuximabem + vemurafenibem byla zaznamenána četnost objektivních odpovědí 16 % vs. 4 % v rameni s irinotekanem + cetuximabem (p = 0,09). Celkově bylo dosaženo kontroly onemocnění u 67 % pacientů v rameni s irinotekanem + cetuximabem + vemurafenibem ve srovnání s 22 % v rameni s irinotekanem + cetuximabem (p < 0,001). Nežádoucí účinky stupně ≥ 3 v experimentální skupině zahrnovaly neutropenii (28 % v experimentálním rameni vs. 7 % v kontrolním rameni), anemii (ve stejném pořadí 13 vs. 0 %) a nevolnost (ve stejném pořadí 15 vs. 0 %). Nebyl zaznamenán rozdíl v kožní toxicitě či intenzitě únavy. Data OS nebyla doposud publikována, nicméně vzhledem k možnosti crossoveru je bude nutné hodnotit s opatrností.
Studie BEACON
Tato globální, multicentrická, randomizovaná, otevřená studie fáze III zahrnovala 665 pacientů s BRAF V600E mutovaným mCRC, předléčených jednou či více liniemi léčby. Pacienti byli náhodně přiřazeni v poměru 1 : 1: 1 (224 vs. 220 vs. 221 pacientů) do skupin léčených tripletem (enkorafenib, binimetinib a cetuximab), dubletem (enkorafenib a cetuximab) nebo do kontrolní skupiny k terapii dle preferencí investigátora, který mohl volit cetuximab + irinotekan nebo cetuximab + FOLFIRI. Studie si stanovila jako primární cíl OS a četnost objektivních odpovědí ve skupině pacientů léčených tripletem ve srovnání s kontrolní skupinou. Sekundárním cílem bylo OS ve skupině léčených dubletem ve srovnání s kontrolní skupinou a srovnání skupiny léčené tripletem proti skupině léčené dubletem.
Kombinace enkorafenibu, cetuximabu a binimetinibu vedla k významnému prodloužení OS a PFS v porovnání s léčbou cetuximabem + chemoterapií na bázi irinotekanu. Poslední publikovaná data OS prezentovaná na konferenci Americké společnosti pro klinickou onkologii v roce 2020 (ASCO 2020) s mediánem sledování 12,8 měsíce [54] ukazují medián celkového přežití 9,3 měsíce pro dublet enkorafenib a cetuximab (graf 1), ve skupině léčených tripletem enkorafenib + binimetinib + cetuximab překvapivě také 9,3 měsíce (graf 2), a 5,9 měsíce pro kontrolní rameno (HR triplet vs. kontrolní rameno 0,60; 95% CI 0,47 – 0,75; HR dublet vs. kontrolní rameno 0,61; 95% CI 0,48 – 0,77).
Graf 1. Celkové přežití při léčně dubletem enkorafenib + cetuximab vs. kontrola [54]. ![Celkové přežití při léčně dubletem enkorafenib + cetuximab vs. kontrola [54].](https://pl-master.mdcdn.cz/media/image_pdf/dfc9d3e1b79bff3964b6478967e65884.png?version=1603794481)
Graf 2. Celkové přežití při léčbě tripletem enkorafenib + binimetinib + cetuximab vs. kontrola [54]. ![Celkové přežití při léčbě tripletem enkorafenib + binimetinib + cetuximab vs. kontrola [54].](https://pl-master.mdcdn.cz/media/image_pdf/67981cae0ae13c5c7fe994469271679b.png?version=1603794495)
Na ASCO 2020 byla prezentována aktualizovaná data mapující četnost objektivních léčebných odpovědí (tab. 4), jež činila ve skupině s tripletem 27 % (95% CI 21–33%), ve skupině s dubletem 20 % (95% CI 15–25%) a v kontrolní skupině 2 % (95% CI < 1–5 %). Kompletní odpovědi byly zaznamenány u 4 % pacientů s tripletem, u 3 % pacientů s dubletem a u žádného z pacientů v kontrolním rameni. Kontroly onemocnění bylo dosaženo u 75 % pacientů s tripletem, u 75 % pacientů s dubletem a u 31 % pacientů v kontrolní skupině.
Tab. 4. Celková léčebná odpověď [54]. ![Celková léčebná odpověď [54].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/df36cc736f2d610be9829e4cbe1c4ca4.png)
BINI – binimetinib, CETUX – cetuximab, CI – interval spolehlivosti, ENCO – enkorafenib, RECIST – kritéria pro hodnocení léčebné odpovědi u solidních tumorů V parametru PFS dosáhl medián ve skupině s dubletem medián PFS 4,3 měsíce (HR 0,44; 95% CI 0,35–0,55) (graf 3) oproti kontrolní skupině, v níž byl zaznamenán medián PFS 1,5 měsíce). Přežití bez progrese činilo ve skupině s tripletem 4,5 měsíce (HR 0,42; 95% CI 0,33–0,53 proti kontrolní skupině (graf 4).
Graf 3. Přežití bez progrese při léčbě dubletem enkorafenib + cetuximab vs. kontrola [54]. ![Přežití bez progrese při léčbě dubletem enkorafenib + cetuximab vs. kontrola [54].](https://pl-master.mdcdn.cz/media/image_pdf/b36d5ab28ae27ac649f67052c43f504b.png?version=1603794514)
CETUX – cetuximab , CI – interval spolehlivosti, ENCO – enkorafenib, HR – poměr rizik, PFS – přežití bez progrese Graf 4. Přežití bez progrese při léčbě tripletem tripletem enkorafenib + binimetinib + cetuximab vs. kontrola [54]. ![Přežití bez progrese při léčbě tripletem tripletem enkorafenib + binimetinib + cetuximab vs. kontrola [54].](https://pl-master.mdcdn.cz/media/image_pdf/68443e9d4949b2a31452f574019d91ac.png?version=1603794528)
BINI – binimetinib, CETUX – cetuximab , CI – interval spolehlivosti, ENCO – enkorafenib, HR – poměr rizik, PFS – přežití bez progrese Z analýzy nežádoucích příhod vyplynul příznivý profil léčby tripletem enkorafenib + binimetinib + cetuximab i dubletem enkorafenib + cetuximab (tab. 5). Ve skupině s tripletem nastaly nežádoucí příhody (NP) jakéhokoli stupně závažnosti u 98 % pacientů (n = 217), přičemž u 58 % pacientů byly popsány AE stupně 3 nebo vyššího. Nejčastějšími NP jakéhokoli stupně v rameni tripletu byly průjem (62 %), akneiformní dermatitida (49 %), nauzea (45 %) a zvracení (38 %). V rameni s dubletem mělo 98 % pacientů NP jakéhokoli stupně (n = 212) a 50 % mělo NP stupně ≥ 3. V kontrolní skupině byly NP jakéhokoli stupně zaznamenány u 97 % pacientů (n = 188), přičemž NP stupně ≥ 3 se vyskytly u 61 % pacientů (n = 117). Celkem 7 % pacientů v rameni s tripletem, 8 % v rameni s dubletem a 11 % v kontrolním rameni přerušilo léčbu na základě NP.
Tab. 5. Profi l nežádoucích příhod stupně ≥ 3 v jednotlivých ramenech studie [54] ![Profi l nežádoucích příhod stupně ≥ 3 v jednotlivých ramenech studie [54]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/79f86e74deef9a5d62ca4caf827e9908.png)
BINI – binimetinib, CETUX – cetuximab, ENCO – enkorafenib Závěr
Studie BEACON na robustní populaci 665 pacientů prokázala benefit v OS, PFS, četnosti dosažení kontroly onemocnění i četnosti celkové léčebné odpovědi. Srovnání frekvence výskytu nežádoucích příhod prokazuje příznivý bezpečnostní profil léčby v porovnání s kontrolním ramenem. Autoři studie na ASCO 2020 prezentovali také analýzy kvality života v jednotlivých léčebných ramenech [56] a doby do deteriorace celkového stavu dle dotazníků EORTC QLQ-C30 a FACT-C, přičemž léčba dubletem i tripletem v porovnání s kontrolním ramenem významně prodloužila dobu do deteriorace celkového stavu. Na základě výše uvedených informací a převážně na základě dat získaných ve studii BEACON schválil americký Úřad pro kontrolu léčiv a potravin (FDA) začátkem dubna 2020 jako jediný režim kombinace BRAF inhibitoru – enkorafenib a anti-EGFR protilátky – cetuximab pro předléčené pacienty s BRAF V600E mutovaným mCRC. Krátce poté, 3. června 2020, došlo ke schválení kombinace enkorafenibu + cetuximabu v léčbě BRAF V600E mutovaného mCRC Evropskou lékovou agenturou (EMA).
V současné době probíhá otevřená multicentrická jednoramenná studie fáze II ANCHOR u pacientů s BRAF V600E mutovaným mCRC v první linii léčby testující kombinaci enkorafenib + binimetinib + cetuximab. Primárním cílem je potvrzená celková četnost odpovědí na základě potvrzení investigátora. Sekundární cíle zahrnují centrálně vyhodnocenou ORR, dobu trvání odpovědi, „time in range“, PFS, OS, bezpečnost a kvalitu života. Testované prediktivní biomarkery jsou stav BRAF V600E mutace v cirkulující DNA (ctDNA) a stav MSI. Plánovaný nábor čítá cca 90 pacientů z deseti zemí po celém světě [57].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Stanislav Batko
Onkologická klinika
2. LF a FN Motol
V Úvalu 84
150 06 Praha 6
e-mail: stanislav.batko@fnmotol.cz
Obdrženo/Submitted: 1. 7. 2020
Přijato/Accepted: 29. 9. 2020
Zdroje
1. International Agency for Research on Cancer. WHO, colorectal cancer, Globalcan 2018. [online]. Available from: https: //gco.iarc.fr/today/data/factsheets/cancers/10_8_9-Colorectum-fact-sheet.pdf.
2. Fransén K, Klintenäs M, Osterström A et al. Mutation analysis of the BRAF, ARAF and RAF-1 genes in human colorectal adenocarcinomas. Carcinogenesis 2004; 25 (4): 527–533. doi: 10.1093/carcin/bgh049.
3. De Roock W, Claes B, Bernasconi D et al. Effects of KRAS, BRAF, NRAS, and PIK3CA mutations on the efficacy of cetuximab plus chemotherapy in chemotherapy-refractory metastatic colorectal cancer: a retrospective consortium analysis. Lancet Oncol 2010; 11 (8): 753–762. doi: 10.1016/S1470-2045 (10) 70130-3.
4. Tol J, Nagtegaal ID, Punt CJ et al. BRAF mutation in metastatic colorectal cancer. N Engl J Med 2009; 361 (1): 98–99. doi: 10.1056/NEJMc0904160.
5. Tie J, Gibbs P, Lipton L et al. Optimizing targeted therapeutic development: Analysis of a colorectal cancer patient population with the BRAFV600E mutation. Int J Cancer 2011; 128 (9): 2075–2084. doi: 10.1002/ijc.25555.
6. Sorbye H, Dragomir A, Sundström M et al. High BRAF mutation frequency and marked survival differences in subgroups according to KRAS/BRAF mutation status and tumor tissue availability in a prospective population-based metastatic colorectal cancer cohort. PLoS One 2015; 10 (6): 1–16. doi: 10.1371/journal.pone.0131046.
7. Greystoke A, Mullamitha SA. How many diseases are colorectal cancer? [online]. Available from: https: //www.hindawi.com/journals/grp/2012/564741/.
8. Ogino S, Shima K, Meyerhardt J et al. Predictive and prognostic roles of BRAF mutation in stage III colon cancer: Results from intergroup trial CALGB 89803. Clin Cancer Res 2012; 18 (3): 890–900. doi: 10.1158/1078-0432.
9. Lochhead P, Kuchiba A, Imamura Y et al. Microsatellite instability and BRAF mutation testing in colorectal cancer prognostication. J Natl Cancer Inst 2013; 105 (15): 1151–1156. doi: 10.1093/jnci/djt173.
10. Clancy C, Burke JP, Kalady MF et al. BRAF mutation is associated with distinct clinicopathological characteristics in colorectal cancer: a systematic review and meta-analysis. Colorectal Dis 2013; 15 (12): 711–718. doi: 10.1111/codi.12427.
11. Gonsalves WI, Mahoney MR, Sargent DJ et al. Patient and tumor characteristics and BRAF and KRAS mutations in colon cancer, NCCTG/Alliance N0147. J Natl Cancer Inst 2014; 106 (7): 1–8. doi: 10.1093/jnci/dju106.
12. Yaeger R, Cercek A, Chou JF et al. BRAF mutation predicts for poor outcomes after metastasectomy in patients with metastatic colorectal cancer. Cancer 2014; 120 (15): 2316–2324. doi: 10.1002/cncr.28729.
13. Prasanna T, Karapetis CS, Roder D et al. The survival outcome of patients with metastatic colorectal cancer based on the site of metastases and the impact of molecular markers and site of primary cancer on metastatic pattern. Acta Oncol 2018; 57 (11): 1438–1444. doi: 10.1080/0284186X.2018.1487581.
14. Clarke CN, Kopetz ES. BRAF mutant colorectal cancer as a distinct subset of colorectal cancer: clinical characteristics, clinical behavior, and response to targeted therapies. J Gastrointest Oncol 2015; 6 (6): 660–667. doi: 10.3978/j.issn.2078-6891.2015.077.
15. Roth AD, Tejpar S, Delorenzi M et al. Prognostic role of KRAS and BRAF in stage II and III resected colon cancer: results of the translational study on the PETACC-3, EORTC 40993, SAKK 60-00 trial. J Clin Oncol 2010; 28 (3): 466–474. doi: 10.1200/JCO.2009.23.3452.
16. Samowitz WS, Sweeney C, Herrick J et al. Poor survival associated with the BRAF V600E mutation in microsatellite-stable colon cancers. Cancer Res 2005; 65 (14): 6063–6069. doi: 10.1158/0008-5472.CAN-05-0404.
17. Lochhead P, Kuchiba A, Imamura Y et al. Microsatellite instability and BRAF mutation testing in colorectal cancer prognostication. J Natl Cancer Inst 2013; 105 (15): 1151–1156. doi: 10.1093/jnci/djt173.
18. Sinicrope FA, Mahoney MR, Smyrk TC et al. Prognostic impact of deficient DNA mismatch repair in patients with stage III colon cancer from a randomized trial of FOLFOX-based adjuvant chemotherapy. J Clin Oncol 2013; 31 (29): 3664–3672. doi: 10.1200/JCO.2013.48.9591.
19. Bokemeyer C, Van Cutsem E, Rougier P et al. Addition of cetuximab to chemotherapy as first-line treatment for KRAS wild-type metastatic colorectal cancer: pooled analysis of the CRYSTAL and OPUS randomised clinical trials. Eur J Cancer 2012; 48 (10): 1466–1475. doi: 10.1016/j.ejca.2012.02.057.
20. Maughan TS, Adams RA, Smith CG et al. Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet 2011; 377 (9783): 2103–2114. doi: 10.1016/S0140-6736 (11) 60613-2.
21. Douillard JY, Oliner KS, Siena S et al. Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med 2013; 369 (11): 1023–1034. doi: 10.1056/NEJMoa1305275.
22. Stintzing S, Jung A, Rossius L et al. Mutations within the EGFR signaling pathway: influence on efficacy in FIRE-3–A randomized phase III study of FOLFIRI plus cetuximab or bevacizumab as first-line treatment for wild-type (WT) KRAS (exon 2) metastatic colorectal cancer (mCRC) patients. J Clin Oncol 2014; 32 (3_suppl): 445–445. doi: 10.1200/jco.2014.32.3_suppl.445.
23. Cremolini C, Loupakis F, Antoniotti C et al. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol 2015; 16 (13): 1306–1315. doi: 10.1016/S1470-2045 (15) 00122-9.
24. Innocenti F, Ou FS, Qu X et al. Mutational analysis of patients with colorectal cancer in CALGB/SWOG 80405 identifies new roles of microsatellite instability and tumor mutational burden for patient outcome. J Clin Oncol 2019; 37 (14): 1217–1227. doi: 10.1200/JCO.18.01798.
25. Peeters M, Oliner KS, Price TJ et al. Updated analysis of KRAS/NRAS and BRAF mutations in study 20050181 of panitumumab (pmab) plus FOLFIRI for second-line treatment (tx) of metastatic colorectal cancer (mCRC). [online]. Available from: https: //ascopubs.org/doi/10.1200/jco.2014.32.15_suppl.3568.
26. Maiello E, Pomella V, Wirapati P et al. Aflibercept efficacy according to sidedness, RAS and BRAF mutations. Findings from the VELOUR trial in second line therapy of advanced colorectal cancer patients. [online]. Available from: https: //www.annalsofoncology.org/article/S0923-7534 (20) 34683-4/fulltext.
27. Yoshino T, Obermannova R, Bodoky G et al. Are BRAF mutated metastatic colorectal cancer (mCRC) tumors more responsive to VEGFR-2 blockage? Analysis of patient outcomes by RAS/RAF mutation status in the RAISE study—A global, randomized, double-blind, phase III study. [online]. Available from: https: //ascopubs.org/doi/10.1200/JCO.2018.36.4_suppl.622.
28. Kolch W. Meaningful relationships: the regulation of the Ras/Raf/MEK/ERK pathway by protein interactions. Biochem J 2000; 351 (Pt 2), 289–305.
29. Yang SH, Sharrocks AD, Whitmarsh AJ et al. MAP kinase signalling cascades and transcriptional regulation. Gene 2013; 513 (1): 1–13. doi: 10.1016/j.gene.2012.10.033.
30. Burotto M, Chiou VL, Lee JM et al. The MAPK pathway across different malignancies: A new perspective. Cancer 2014; 120 (22): 3446–3456. doi: 10.1002/cncr.28864.
31. Liu F, Yang X, Geng M et al. Targeting ERK, an Achilles‘ heel of the MAPK pathway, in cancer therapy. Acta Pharm Sin B 2018; 8 (4): 552–562. doi: 10.1016/j.apsb.2018.01.008.
32. Terrel EM, Durrant D, Ritt D et al. RAF binding preferences dictate RAS-mediated tumorigenesis. Cancer Discov 2019; 9 (12): 8. doi: 10.1158/2159-8290.
33. McCubrey JA, Steelman LS, Chappell WH et al. Mutations and deregulation of Ras/Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR cascades which alter therapy response. Oncotarget 2012; 3 (9): 954–987. doi: 10.18632/oncotarget.652.
34. Garcia SE, Argiles G, Elez E et al. BRAF mutant colorectal cancer: prognosis, treatment, and new perspectives. Ann Oncol 2017; 28 (11): 2648–2657. doi: 10.1093/annonc/mdx401.
35. Shimada Y, Tajima Y, Nagahashi M et al. Clinical significance of BRAF Non-V600E mutations in colorectal cancer: A retrospective study of two institutions. J Surg Res 2018; 232 : 72–81. doi: 10.1016/j.jss.2018.06.020.
36. Davies H, Bignell GR, Cox C et al. Mutations of the BRAF gene in human cancer. Nature 2002; 417 (6892): 949–954. doi: 10.1038/nature00766
37. Pakneshan S, Salajegheh A, Anthony R et al. Clinicopathological relevance of BRAF mutations in human cancer. Pathology 2013; 45 (4): 346–356. doi: 10.1097/PAT.0b013e328360b61d.
38. Kopetz S, Desai J, Chan E et al. Phase II pilot study of vemurafenib in patients with metastatic BRAF-mutated colorectal cancer. J Clin Oncol 2015; 33 (34): 4032–4038. doi: 10.1200/JCO.2015.63.2497.
39. Corcoran RB, Ebi H, Turke AB et al. EGFR-mediated re-activation of MAPK signaling contributes to insensitivity of BRAF mutant colorectal cancers to RAF inhibition with vemurafenib. Cancer Discov 2012; 2 (3): 227–235. doi: 10.1158/2159-8290.CD-11-0341.
40. Prahallad A, Sun C, Huang S et al. Unresponsiveness of colon cancer to BRAF (V600E) inhibition through feedback activation of EGFR. Nature 2012; 483 (7387): 100–103. doi: 10.1038/nature10868.
41. Janku F. Advances on the BRAF front in colorectal cancer. Cancer Discov 2018; 8 (4): 389–391. doi: 10.1158/2159-8290.CD-18-0125.
42. Hyman DM, Puzanov I, Subbiah V et al. Vemurafenib in multiple nonmelanoma cancers with BRAF V600 mutations. N Engl J Med 2015; 373 (8): 726–736. doi: 10.1056/NEJMoa1502309.
43. Gomez-Roca CA, Delord J, Robert C et al. 535P – encorafenib (LGX818), an oral BRAF inhibitor, in patients (pts) with BRAF V600E metastatic colorectal cancer (mCRC): results of dose expansion in an open-label, phase 1 study. Ann Oncol 2014; 25 (4 suppl): 182–183.
44. Yaeger R, Cercek A, O’Reilly EM et al. Pilot trial of combined BRAF and EGFR inhibition in BRAF-mutant metastatic colorectal cancer patients. Clin Cancer Res 2015; 21 (6): 1313–1320. doi: 10.1158/1078-0432.CCR-14-2779.
45. Van Cutsem E, Atreya C, Andre’ T et al. LBA-07 Updated Results of the MEK inhibitor trametinib (T), BRAF inhibitor dabrafenib (D), and anti-EGFR antibody panitumumab (P) in patients (pts) with BRAF V600E mutated (BRAFm) metastatic colorectal cancer (mCRC). [online]. Available from: https: //www.annalsofoncology.org/article/S0923-7534 (19) 50919-X/fulltext.
46. van Geel R, Tabernero J, Elez E et al. A phase Ib dose-escalation study of encorafenib and cetuximab with or without alpelisib in metastatic BRAFmutant colorectal cancer. Cancer Discov 2017; 7 (6): 610–619. doi: 10.1158/2159-8290.CD-16-0795.
47. Tabernero J, Geel RV, Guren TK et al. Phase 2 results: encorafenib (ENCO) and cetuximab (CETUX) with or without alpelisib (ALP) in patients with advanced BRAF-mutant colorectal cancer (BRAFm CRC). J Clin Oncol 2016; 34 (15 suppl): 3544–3544. doi: 10.1200/JCO.2016.34.15_suppl.3544.
48. Corcoran RB, Atreya CE, Falchook GS et al. Combined BRAF and MEK inhibition with dabrafenib and trametinib in BRAF V600-mutant colorectal cancer. J Clin Oncol 2015; 33 (34): 4023–4031. doi: 10.1158/2159-8290.CD-17-1226.
49. Hong DS, Morris VK, El Osta B et al. Phase IB study of vemurafenib in combination with irinotecan and cetuximab in patients with metastatic colorectal cancer with BRAFV600E mutation. Cancer Discov 2016; 6 (12): 1352–1365. doi: 10.1158/2159-8290.CD-16-0050.
50. Kopetz, S, McDonough SL, Morris VK et al. Randomized trial of irinotecan and cetuximab with or without vemurafenib in BRAF-mutant metastatic colorectal cancer (SWOG 1406). J Clin Oncol 2017; 35 (4 suppl): 520–520.
51. Kopetz S, Grothey A, Yaeger R et al. Encorafenib, Binimetinib, and Cetuximab in BRAF V600E–Mutated Colorectal Cancer. N Engl J Med 2019; 381 : 1632–1643. doi: 10.1056/NEJMoa1908075.
52. Pietrantonio F, Petrelli F, Coinu A et al. Predictive role of BRAF mutations in patients with advanced colorectal cancer receiving cetuximab and panitumumab: a meta-analysis. Eur J Cancer 2015; 51 (5): 587–594. doi: 10.1016/j.ejca.2015.01.054.
53. Rowland A, Dias MM, Wiese MD et al. Meta-analysis of BRAF mutation as a predictive biomarker of benefit from anti-EGFR monoclonal antibody therapy for RAS wild-type metastatic colorectal cancer. Br J Cancer 2015; 112 (12): 1888–1894. doi: 10.1038/bjc.2015.325.
54. Kopetz S, Grothey A, Van Cutsem E et al. Encorafenib plus cetuximab with or without binimetinib for BRAF V600E metastatic colorectal cancer: Updated survival results from a randomized, three-arm, phase III study versus choice of either irinotecan or FOLFIRI plus cetuximab (BEACON CRC). J Clin Oncol 2020; 38 (15 suppl): 4001–4001.
55. Kopetz S, Grothey A, Van Cutsem E et al. Encorafenib plus cetuximab with or without binimetinib for BRAF V600E-mutant metastatic colorectal cancer: Quality-of-life results from a randomized, three-arm, phase III study versus the choice of either irinotecan or FOLFIRI plus cetuximab (BEACON CRC). J Clin Oncol 2020; 38 (15 suppl): 4039–4039.
56. Kopetz S, Grothey A, Van Cutsem E et al. Encorafenib plus cetuximab with or without binimetinib for BRAF V600E-mutant metastatic colorectal cancer: Quality-of-life results from a randomized, three-arm, phase III study versus the choice of either irinotecan or FOLFIRI plus cetuximab (BEACON CRC). [online]. Available from: https: //ascopubs.org/doi/abs/10.1200/JCO.2020.38.4_suppl.8
57. Grothey A, Yaeger R, Paez D et al. ANCHOR CRC: a phase 2, open-label, single arm, multicenter study of encorafenib (ENCO), binimetinib (BINI), plus cetuximab (CETUX) in patients with previously untreated BRAF V600E-mutant metastatic colorectal cancer (mCRC). [online]. Available from: https: //www.annalsofoncology.org/article/S0923-7534 (19) 30911-1/abstract.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2020 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Editorial
- Současný pohled na možnosti léčby BRAF mutovaného kolorektálního karcinomu
- Dlouhé nekódující RNA a karcinom z renálních buněk
- Výzvy a riešenia v manažmente kardiotoxicity checkpoint inhibítorov
- Systémová liečba hepatocelulárneho karcinómu
- Nové trendy v neoadjuvantní léčbě lokálně pokročilého karcinomu rekta z pohledu chirurga – komentář
- Implementácia imunoterapie do liečby neuroblastómu – skúsenosti jedného centra s podávaním a manažovaním nežiaducich účinkov dinutuximabu
- Skvamocelulárny karcinóm hrubého čreva – kazuistika
- Prvý pacient s COVID-19 na Slovensku
- Extravazace (paravazace) cytostatik – aktualizované doporučení (2020) pro standardní péči v rámci České republiky ze spolupráce Sekce podpůrné léčby České onkologické společnosti ČLS JEP, České hematologické společnosti ČLS JEP, Onkologické sekce České asociace sester a Společnosti pro porty a permanentní katétry
- Entrektinib – tumor-agnostická léčba penetrující do centrálního nervového systému s prokázanou účinností i u pediatrické populace
- Aktuality z odborného tisku
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nové trendy v neoadjuvantní léčbě lokálně pokročilého karcinomu rekta z pohledu chirurga – komentář
- Současný pohled na možnosti léčby BRAF mutovaného kolorektálního karcinomu
- Extravazace (paravazace) cytostatik – aktualizované doporučení (2020) pro standardní péči v rámci České republiky ze spolupráce Sekce podpůrné léčby České onkologické společnosti ČLS JEP, České hematologické společnosti ČLS JEP, Onkologické sekce České asociace sester a Společnosti pro porty a permanentní katétry
- Systémová liečba hepatocelulárneho karcinómu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



