-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Expresia ligandu receptora programovanej bunkovej smrti 1 v bio psii nemalobunkového karcinómu pľúc a jej asociácia s tumor infi ltrujúcimi lymfocytmi a stupňom dezmoplázie
Programmed Death-Ligand 1 Expression in Non-Small Cell Lung Carcinoma Biopsies and Its Association with Tumor Infi ltrat ing Lymphocytes and the Degree of Desmoplasia
Background: Immunotherapy blocking the PD-1/PD-L1 signalling pathway has become a dominant treatment modality for patients with non-small cell lung carcinoma (NSCLC). Programmed death-ligand 1 (PD-L1) expression on the membrane of tumour cells and/or tumour infiltrating lymphocytes (TIL) evaluated immunohistochemically is still the only clinically validated predictive biomarker for immunotherapy, but it has its limitations. TIL in the tumour microenviroment was identified as having predictive value. We retrospectively evaluated 134 NSCLC resection specimens, and analysed the association between PD-L1 expression, the presence of TIL, and the degree of desmoplasia in tumours.
Material and methods: PD-L1 expression on tumour cells and TIL were evaluated immunohistochemically using the anti-PD-L1 antibody (clone 22C3) and the anti-CD3 antibody (polyclone), respectively. PD-L1 was scored using the “tumour proportion score” (TPS) system with three categories: TPS < 1%, 1–49%, and ≥ 50%. TIL were evaluated semiquantitatively using the “percentage of stromal TIL” (PST) system, and categories of PST < 10%, 10–49% and ≥ 50% were recorded. The association between PD-L1 expression in tumour cells and TIL was compared with the PST value. Statistical analysis was conducted using the Cochran-Armitage test, and a p-value < 5% was considered significant.
Results: PD-L1 expression was significantly higher in PST 10–49% and ≥ 50% categories than in the PST < 10% category in grade 1 and grade 2 adenocarcinomas (p = 0.008), grade 3 adenocarcinomas (p = 0.009), and squamous cell carcinomas (p = 0.028). PD-L1 expression in TIL was associated with the PST value in squamous cell carcinomas (p = 0.025) but not in adenocarcinomas. Desmoplastic tumours had particularly low TPS and PST values.
Conclusion: PD-L1 expression in NSCLC is associated with the presence of TIL. Desmoplastic areas in tumours represent immunologically inactive tumour microenviroments. Administration of anti-PD-1/PD-L1 immunotherapy, together with agents blocking the TGF-β signalling pathway, represent a promising combinational therapy for patients with desmoplastic NSCLC.
The authors declare they have no potential confl cts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 25. 11. 2019
Accepted: 8. 12. 2019
Keywords:
programmed death-ligand 1 – non-small cell lung carcinoma – tumour infiltrating lymphocytes – predictive biomarker
Autoři: V. Tancoš 1; M. Grendár 2; A. Farkašová 3; Z. Huťka 1; Z. Kviatkovská 1; L. Plank 1,3
Působiště autorů: Ústav patologickej anatómie JLF UK a UN Martin, Slovenská republika 1; Ústav bio informatiky, Martinské centrum pre bio medicínu, JLF v Martine, UK v Bratislave, Slovenská republika 2; Martinské bio ptické centrum, s. r. o., Martin, Slovenská republika 3
Vyšlo v časopise: Klin Onkol 2020; 33(1): 55-65
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko202055Souhrn
Východiská: Imunoterapia blokujúca signálnu dráhu PD-1/PD-L1 sa za posledné roky stala dominantnou liečebnou modalitou pacientov s nemalobunkovým karcinómom pľúc (non-small cell lung carcinoma – NSCLC). Imunohistochemicky dôkaz expresie ligandu receptora programovanej bunkovej smrti-1 (programmed death-ligand 1 – PD-L1) na membráne nádorových buniek a/alebo tumor infiltrujúcich lymfocytoch (TIL) je stále jediným klinicky validovaným prediktívnym biomarkerom pre indikáciu imunoterapie, ale má svoje limity. Prítomnosť TIL v nádorovom mikroprostredí bola recentne identifikovaná ako komplementárny prediktívny faktor tejto terapie. V tejto retrospektívnej štúdii sme v súbore 134 chirurgických resekátov NSCLC analyzovali asociáciu medzi expresiou PD-L1, prítomnosťou TIL a stupňom dezmoplázie nádoru.
Materiál a metódy: Expresia PD-L1 na membráne nádorových buniek a v TIL bola dokazovaná imunohistochemicky anti-PD-L1 protilátkou (klon 22C3) a prítomnosť TIL použitím protilátky anti-CD3 (polyklon). Expresia PD-L1 bola hodnotená systémom „nádorového proporčného skóre“ (tumour proportion score – TPS), pričom boli vymedzené kategórie TPS < 1 %, TPS 1–49 % a TPS ≥ 50 %. Semikvantitatívne hodnotenie prítomnosti TIL bolo vykonané metódou „percenta stromálnych TIL“ (PST) a rozlišované boli kategórie PST < 10 %, PST 10–49 % a PST ≥ 50 %. Analyzovaná bola asociácia medzi hodnotou expresie PD-L1 v nádorových bunkách a TIL ku hodnote PST. Štatistická analýza bola vykonaná Cochranovým-Armitageovým testom, pričom hodnota p < 0,05 bola pokladaná za signifikantnú.
Výsledky: Expresia PD-L1 v nádorových bunkách bola signifikantne vyššia v kategóriách PST 10–49 % a PST ≥ 50 % v porovnaní s kategóriou PST < 10 % v grade 1 a grade 2 adenokarcinómoch (p = 0,008), v grade 3 adenokarcinómoch (p = 0,009) aj v skvamocelulárnych karcinómoch (p = 0,028). Expresia PD-L1 v TIL bola asociovaná s hodnotou PST v skvamocelulárnych karcinómoch (p = 0,025), ale nie v prípade adenokarcinómov. Nádory s vysokým stupňom dezmoplázie vykazovali obzvlášť nízku hodnotu TPS aj PST.
Záver: Expresia PD-L1 v NSCLC je asociovaná s prítomnosťou TIL. Dezmoplastické oblasti nádoru predstavujú imunologicky neaktívne nádorové mikroprostredie. Podávanie anti PD-1/P-L1 imunoterapie s látkami blokujúcimi signálnu dráhu TGF-β predstavuje perspektívnu kombinovanú terapiu pre pacientov s NSCLC s dezmopláziou.
Klíčová slova:
ligand receptora programovanej bunkovej smrti-1 – nemalobunkový karcinóm pľúc – tumor infiltrujúce lymfocyty – prediktívny faktor
Východiská
Pľúcny karcinóm patrí celosvetovo medzi najčastejšie príčiny úmrtia na nádorové ochorenie, pričom viac ako 85 % prípadov tvoria nemalobunkové karcinómy pľúc (non-small cell lung carcinoma – NSCLC). Ide o heterogénnu skupinou nádorov s početnými histologickými typmi s odlišnými molekulárnymi charakteristikami a biologickým správaním [1].
Imunoterapia sa za posledné roky stala dominantnou liečebnou modalitou pacientov s rôznymi typmi malignít, vrátane NSCLC [2]. Inhibítory imunitných kontrolných bodov, ktoré blokovaním inhibičnej signálnej dráhy PD-1/PD-L1 (programmed death-1 / programmed death-ligand 1) vedú k reaktivácii potlačeného imunitného systému, výrazne zlepšili prognózu pacientov s lokálne pokročilým a metastazujúcim NSCLC [3,4]. V súčasnosti sú pre klinické používanie v európskych krajinách schválené anti-PD-1 protilátky nivolumab a pembrolizumab a anti-PD-L1 protilátky atezolizumab, avelumab a durvalumab [5,6].
Imunohistochemický dôkaz expresie proteínu PD-L1 na membráne nádorových buniek a/alebo imunitných bunkách je stále jediným klinicky validovaným prediktívnym biomarkerom pre indikáciu tejto terapie [7]. Nejde pritom o dokonalý prediktívny faktor, pretože jeho negatívny výsledok nevylučuje možnosť účinnosti inhibítorov imunitných kontrolných bodov. A naopak, bolo zistené, že viac ako polovica pacientov nereaguje priaznivo na túto liečbu napriek vysokej hodnote expresie PD-L1 [8]. Preto je potrebné nájsť nové, komplementárne prediktívne faktory, ktoré by pomohli identifikovať populáciu pacientov, ktorí s najvyššou pravdepodobnosťou budú priaznivo klinicky odpovedať na podávanie tejto terapie.
V posledných rokoch sa ukazuje, že expresia PD-L1 je pravdepodobne len jedným z mnohých determinantov, ktoré predpovedajú účinnosť inhibítorov imunitných kontrolných bodov. Pozornosť sa okrem iného upriamila na charakteristiky nádorového mikroprostredia, predovšetkým na prítomnosť imunitných buniek v nádorovej stróme, ktorá svedčí pre prítomnú protinádorovú imunitnú odozvu a na úlohu „s nádorom asociovaných fibroblastov“, ktoré prispievajú ku imunitnej dysregulácii. Viaceré štúdie poukazujú na to, že tzv. tumor infiltrujúce lymfocyty (TIL) prítomné v nádorovej stróme sú asociované s klinickou účinnosťou inhibítorov imunitných kontrolných bodov [9–11].
Mnoho aspektov nádorového mikroprostredia nie je dodnes plne objasnených. Cieľom našej štúdie bolo analyzovať možnú asociáciu medzi expresiou PD-L1 v tkanive rôznych typov NSCLC s charakteristikami nádorového mikroprostredia, ako je prítomnosť lymfocytov v nádorovej stróme a stupeň desmoplázie. Tieto výsledky by mohli mať potenciálne uplatnenie v klinickej terapeutickej praxi.
Materiál a metódy
Charakteristika vyšetrovaného súboru
Súbor zahrňoval 134 chirurgických resekátov pľúcnych karcinómov, ktoré boli retrospektívne analyzované za účelom stanovenia expresie PD-L1 a prítomnosti TIL. Štúdia bola schválená etickou komisiou Jesseniovej lekárskej fakulty Univerzity Komenského v Martine (EK 136/2018).
Jednotlivé typy a podtypy NSCLC boli kategorizované v súlade s WHO (World Health Organization) klasifikáciou pľúcnych nádorov z roku 2015 [1]. Dva základné typy NSCLC predstavovali adenokarcinómy a skvamocelulárne karcinómy. V prípade adenokarcinómov sa na základe predominantného rastového vzoru rozlišovalo päť podtypov: predominantne lepidické adenokarcinómy, ktoré predstavujú dobre diferencované (grade 1) nádory, predominantne acinárne a predominantne papilárne adenokarcinómy, ktoré predstavujú menej diferencované (grade 2) formy, a predominantne solídne a predominantne mikropapilárne adenokarcinómy, ktoré predstavujú nízko diferencované (grade 3) podtypy.
V súbore boli vyčlenené tri základné skupiny NSCLC, ktoré boli analyzované separátne: skupina grade 1 a grade 2 adenokarcinómov, skupina grade 3 adenokarcinómov a skupina skvamocelulárnych karcinómov. Oblasti karcinómov z troch základných skupín, ktoré sa vyznačovali vysokým stupňom dezmoplázie, boli hodnotené ešte osobitne, pričom dezmoplázia bola definovaná ako pomer nádorovej strómy ku štruktúram tvoreným nádorovými bunkami väčší ako jedna.
Imunohistochemické vyšetrenia
Na imunohistochemickú analýzu expresie proteínu PD-L1 boli použité parafínové rezy bioptického materiálu a na revitalizáciu Pre-treatment Link a roztok „low pH“ (pH 6) pri 96 °C po dobu 20 min. Imunohistochemická reakcia prebiehala v automate Autostainer Link 48 s použitím kitu PD-L1 IHC 22C3 PharmDx (RTU) s monoklonálnou protilátkou anti-PD-L1 (klon 22C3) v riedení 1 : 50 s inkubáciou cez noc. Detekcia reakcie prebehla pomocou detekčného kitu EnVision Flex. Všetky uvedené reagencie a platformy boli zakúpené od spoločnosti Dako/Agilent, Dánsko. Každý beh v staineri prebiehal súčasne s použitím pozitívnej bunkovej kultúry (súčasť kitu), ako aj pozitívnej a negatívnej kontroly vlastného predtým verifikovaného a validovaného prípadu z nášho registra.
Prítomnosť lymfocytov v nádorovej stróme bola detegovaná imunohistochemickým dôkazom expresie antigénu CD3. Na revitalizáciu bol použitý Pre-treatment Link a roztok „high pH“ (pH 9) a imunohistochemická reakcia prebiehala v automate Autostainer Link 48 s monoklonálnou protilátkou anti-CD3 (polyklon). Detekcia reakcie prebehla pomocou detekčného kitu EnVision Flex, high pH (Link) K8000.Všetky uvedené reagencie a platformy boli zakúpené od spoločnosti Dako/Agilent, Dánsko.
Hodnotenie expresie PD-L1 v nádorových bunkách a TILs
Výsledok expresie PD-L1 bol vyjadrený kvalitatívne (pozitívny vs. negatívny výsledok) s použitím systému „nádorového proporčného skóre“ (tumour proportion score – TPS) [12], ktorý predstavuje percentuálny podiel PD-L1 exprimujúcich nádorových buniek z celkovému počtu non-nekrotických nádorových buniek. Ako „PD-L1 pozitívna“ sa označovala nádorová bunka, ktorá vykazovala čiastočné alebo úplné membránové farbenie PD-L1, cytoplazmatická pozitivita do výsledku započítaná nebola. Výsledok bol považovaný za negatívny, ak menej ako 1 % nádorových buniek vykazovalo pozitivitu PD-L1 proteínu. Pozitívne výsledky boli na základe hodnoty TPS rozdelené do kategórie „1–49 %“ a kategórie „50 % a viac“. Analogickým spôsobom bola hodnotená expresia PD-L1 aj v imunitných bunkách prítomných v nádorovej stróme. Pri hodnotení dezmoplastických oblastí boli vymedzené osobitné kategórie TPS „1–9 %“ a „10–49 %“.
Hodnotenie množstva TILs
Hodnotené boli výlučne lymfocyty. Iné mononukleárne bunky ako makrofágy a dendritické bunky, ako aj polymorfonukleárne leukocyty do výsledku zahrnuté neboli. Semikvantitatívne hodnotenie prítomnosti lymfocytov v nádorovej stróme bolo vykonané metódou „percenta stromálnych TIL“ (PST), ktorá je analogická metóde popísanej pri karcinóme prsníka [13]. Percento stromálnych TIL predstavuje percentuálny podiel plochy nádorovej strómy okupovanej lymfocytmi z celkovej plochy nádorovej strómy. Samostatne bol touto metódou hodnotený „invazívny okraj“ nádoru (invasive margin – IM), tj. kompartment nádorovej strómy bezprostredne naliehajúci na ložiská tumoru hraničiace s nenádorovým tkanivom a „centrálna časť“ nádoru (tumor center – TC), tj. kompartment nádorovej strómy naliehajúcej na ložiská tumoru centrálne od invazívneho okraja. Na základe zhody alebo nezhody medzi obidvoma kompartmentmi nádorovej strómy boli jednotlivé karcinómy vo všetkých troch skupinách zaradené do jednej z dvoch podskupín: „PST v IM = PST v TC“ a „PST v IM ≠ PST v TC“. V podskupine „PST v IM = PST v TC“ boli na základe hodnoty PST rozlišované tri kategórie: nádorová stróma s hodnotou PST < 10 % bola hodnotená ako nízke PST, s hodnotou PST 10–49 % ako stredne vysoké PST a s hodnotou PST ≥ 50 % ako vysoké PST. V podskupine „PST v IM ≠ PST v TC“ boli rozlišované dve kategórie: „PST v TC ≥ 10 % / PST v IM 10–49 %“ a „PST v TC 10–49 % / PST v IM ≥ 50 %“. Výsledky príslušných kategórii PST boli porovnávané s hodnotami TPS.
Štatistická analýza
Kontingenčné tabuľky distribúcie jednotlivých typov NSCLC rozdelených podľa hodnoty pozitivity PD-L1 v nádorových alebo imunitných bunkách v kategóriách PST ≥ 10 % a PST ≥ 10 % boli prevedené do podoby mozaikového diagramu. Nulová hypotéza žiadneho vzťahu medzi uvedenými dvoma kategóriami PST bola testovaná Cochranovým-Armitageovým testom trendu, ktorý bol prevedený proti alternatívnej hypotéze, že podiel NSCLC s PD-L1 negatívnymi nádorovými alebo imunitnými bunkami v kategórii PST ≥ 10 % relatívne ku kategórii PST ≥ 10 % bude vyšší. V prípade PD-L1 pozitivity sa očakával obrátený pomer. Hodnota p < 0,05 bola pokladaná za štatisticky významnú. Analyzované dáta boli spracované vo výpočtovom prostredí R, verzia 3.5.0 s použitím knižnice DescTools.
Výsledky
Expresia PD-L1 v analyzovanom súbore NSCLC
Celkovo bolo do tejto štúdie zahrnutých 134 chirurgických resekátov pľúcnych karcinómov. V 87 prípadoch išlo o adenokarcinómy a v 47 prípadoch o skvamocelulárne karcinómy. Z 87 prípadov adenokarcinómov bola expresia PD-L1 v nádorových bunkách zistená v 38 prípadoch (43,7 %) a expresia PD-L1 v TIL v 45 prípadoch (51,7 %). Skupina skvamocelulárnych karcinómov zahrňovala 47 prípadov, pričom pozitívny výsledok expresie PD-L1 v nádorových bunkách bol zistený v 22 prípadoch (46,8 %) a v imunitných bunkách v 27 prípadoch (57,4 %).
Asociácia medzi expresiou PD-L1 a PST v skupine grade 1 a grade 2 adenokarcinómov
Šesťdesiat adenokarcinómov bolo klasifikovaných ako dobre diferencované (grade 1) alebo menej diferencované (grade 2) formy. V 13 prípadoch (26,5 %) bola zistená expresia PD-L1 v nádorových bunkách a v 26 prípadoch (53 %) v TIL.
V podskupine „PST v IM = PST v TC“ bolo 49 prípadov, pričom prevažná časť prípadov (n = 28) patrila do kategórie nízkeho PST. Výsledky sú zhrnuté v tab. 1.
Tab. 1. Distribúcia prípadov skupiny grade 1 a grade 2 adenokarcinómov, skupiny grade 3 adenokarcinómov a skupiny skvamocelulárnych karcinómov rozdelených podľa hodnoty pozitivity PD-L1 v nádorových bunkách (TPS) a v tumor infiltrujúcich lymfocytoch v troch kategóriách percenta stromálnych tumor infiltrujúcich lymfocytov (PST). V týchto prípadoch sa hustota T-lymfocytového infiltrátu v nádorovom centre neodlišovala od invazívneho okraja. 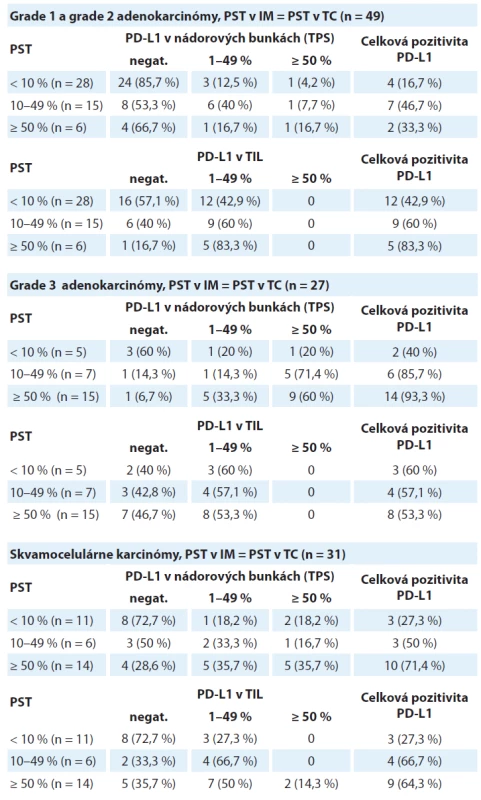
TPS – nádorové proporčné skóre, PST – percento stromálnych tumor infiltrujúcich lymfocytov, IM – invazívny okraj nádoru, TC – centrálna časť nádoru, TIL – tumor infiltrujúce lymfocyty, PD-L1 – ligand receptora programovanej bunkovej smrti 1 Pri analýze expresie PD-L1 v nádorových bunkách v tejto podskupine bolo zistené, že celková pozitivita je signifikantne vyššia v kategóriách s vyšším stupňom lymfocytovej infiltrácie (p = 0,008) (obr. 1A). V kategórii PST ≥ 10 % boli PD-L1 pozitívne len 4 z 28 prípadov (16,7 %), ale v kategórii PST 1–49 % bola expresia PD-L1 zistená v 7 z 28 prípadov (46,7 %) a v kategórii PST ≥ 50 % v 2 zo 6 prípadov (33,3 %). Stúpajúca hodnota PST nekorelovala signifikantne so stúpajúcou hodnotou celkovej pozitivity PD-L1 imunitných buniek (p = 0,082) (obr. 1B). V kategórii nízke PST bola expresia PD-L1 v TIL zistená v 12 z 28 prípadov (42,9 %), v kategórii stredne vysoké PST v 9 z 28 prípadov (60 %) a v kategórii vysoké PST v 5 zo 6 prípadov (83,3 %).
Obr. 1. Grade 1 a grade 2 adenokarcinómy, PST v IM = PST v TC (n = 49). 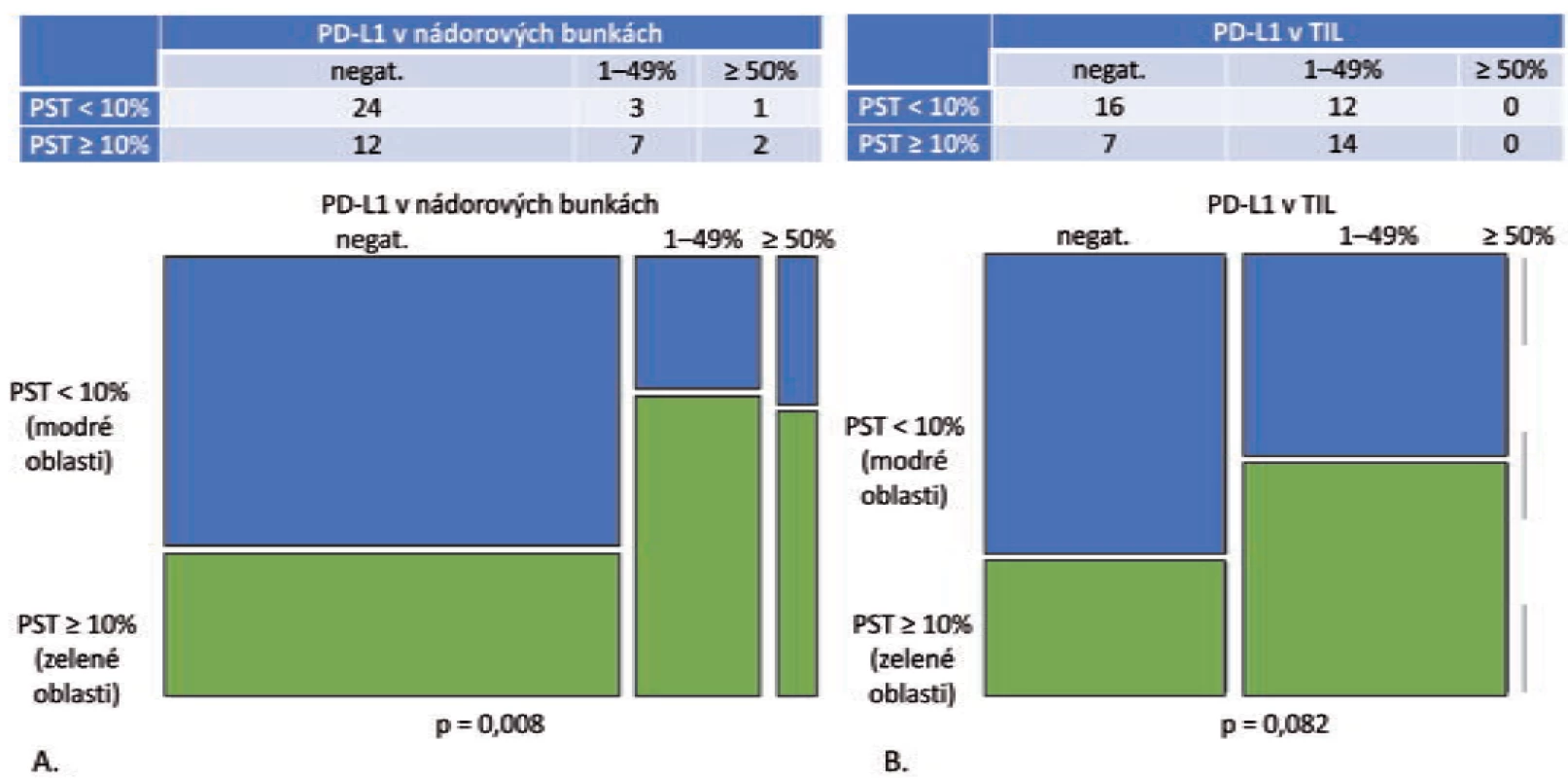
A. Mozaikový diagram, ktorý schematicky znázorňuje, že podiel grade 1 a grade 2 adenokarcinómov s PD-L1 negatívnymi nádorovými bunkami je v kategórii PST < 10 % relatívne ku kategórii PST ≥ 10 % vyšší. Tento pomer je obrátený v prípade PD-L1 pozitívnych prípadoch (p = 0,008).
B. Mozaikový diagram, ktorý schematicky znázorňuje, že podiel grade 1 a grade 2 adenokarcinómov s PD-L1 negatívnymi TIL, ako aj PD-L1 pozitívnymi TIL sa v kategórii PST < 10 % relatívne ku kategórii PST ≥ 10 % signifikantne nelíši (p = 0,082). PST – percento stromálnych tumor infiltrujúcich lymfocytov, IM – invazívny okraj nádoru, TC – centrálna časť nádoru, PD-L1 – ligand receptora programovanej bunkovej smrti 1, TIL – tumor infi ltrujúce lymfocytyV podskupine „PST v IM ≠ PST v TC“ bolo identifikovaných 11 adenokarcinómov – v 10 prípadoch patrili do kategórie „PST v TC ≥ 10 % / PST v IM 10–49 %“ s pozitívnym výsledkom PD-L1 v nádorových bunkách aj TIL v 2 prípadoch (22,2 %). V prípade dvoch adenokarcinómov šlo o kategóriu „PST v TC 10–49 % / PST v IM ≥ 50 %“ s výsledkom pozitívnej expresie PD-L1 v nádorových bunkách a TIL s 50 % prípadov. Výsledky sú zhrnuté v tab. 2.
Tab. 2. Distribúcia prípadov skupiny grade 1 a grade 2 adenokarcinómov a skupiny skvamocelulárnych karcinómov rozdelených podľa hodnoty pozitivity PD-L1 v nádorových bunkách (TPS) a tumor infi ltrujúcich lymfocytoch v troch kategóriách percenta stromálnych tumor infiltrujúcich lymfocytov (PST). V týchto prípadoch sa hustota T-lymfocytového infiltrátu v nádorovom centre odlišovala od invazívneho okraja 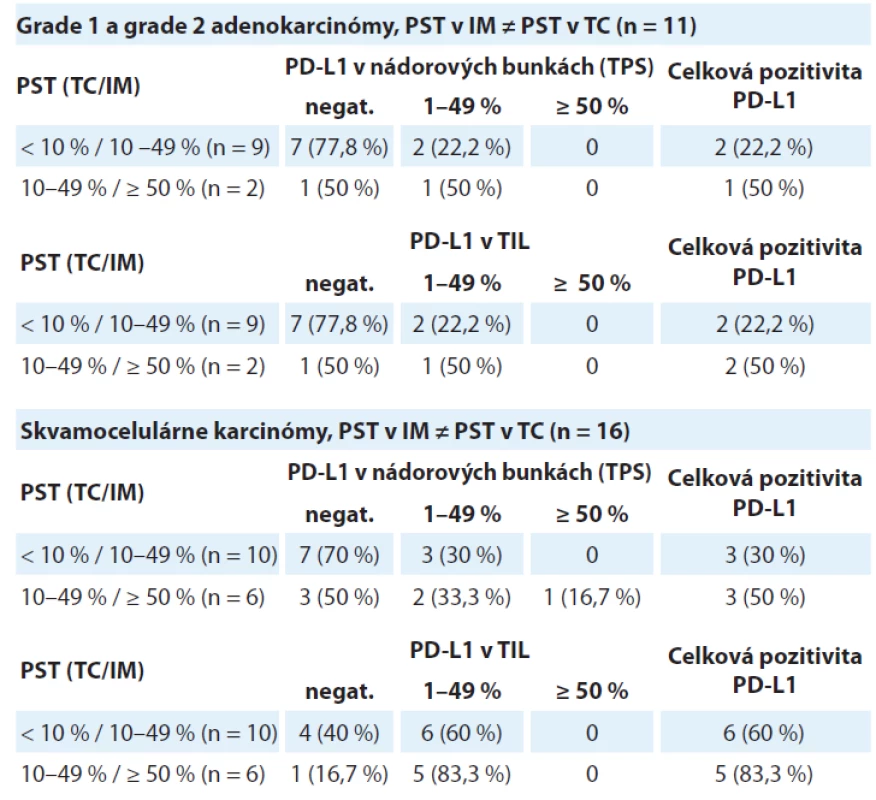
TPS – nádorové proporčné skóre, PST – percento stromálnych tumor infiltrujúcich lymfocytov, IM – invazívny okraj nádoru, TC – centrálna časť nádoru, TIL – tumor infiltrujúce lymfocyty, PD-L1 – ligand receptora programovanej bunkovej smrti 1 Asociácia medzi expresiou PD-L1 a PST v skupine grade 3 adenokarcinómov
Dvadsaťsedem adenokarcinómov bolo klasifikovaných ako nízko diferencované (grade 3) formy. V 22 prípadoch (81,5 %) bola zistená expresia PD-L1 v nádorových bunkách a v 16 prípadoch (55,5 %) v TIL. Pre všetky prípady v tejto skupine platili kritéria „PST v IM = PST v TC“. Výsledky sú zhrnuté v tab. 1.
Podobne ako v prípade grade 1 a grade 2 adenokarcinómov, aj v prípade nízko diferencovaných adenokarcinómov bolo zistené, že celková pozitivita proteínu PD-L1 v nádorových bunkách je signifikantne vyššia v kategóriách s vyšším stupňom lymfocytovej infiltrácie (p = 0,009) (obr. 2A). V kategórii PST ≥ 10 % bola PD-L1 pozitivita zistená v 2 z 5 prípadoch (40 %), v kategórii PST 10–49 % v 6 zo 7 prípadov (85,7 %) a v kategórii PST ≥ 50 % v 14 z 15 prípadov (93,3 %), pričom v 9 prípadoch išlo o TPS s hodnotou ≥ 50 %. Taktiež v prípade nízko diferencovaných foriem adenokarcinómov nebola zistená asociácia medzi hodnotou PST a celkovou pozitivitou PD-L1 v imunitných bunkách (p = 0,428) (obr. 2B). V kategórii PST ≥ 10 % bola expresia PD-L1 v TIL zistená v 3 z 5 prípadov (60 %), v kategórii PST 1–49 % v 3 zo 7 prípadov (51,7 %) a v kategórii PST ≥ 50 % v 8 z 15 prípadov (53,3 %). Vzťah medzi expresiou PD-L1 v nádorových bunkách grade 3 adenokarcinómov a lymfocytovou infiltráciou strómy je zobrazený na obr. 3.
Obr. 2. Grade 3 adenokarcinómy, PST v IM = PST v TC (n = 27). 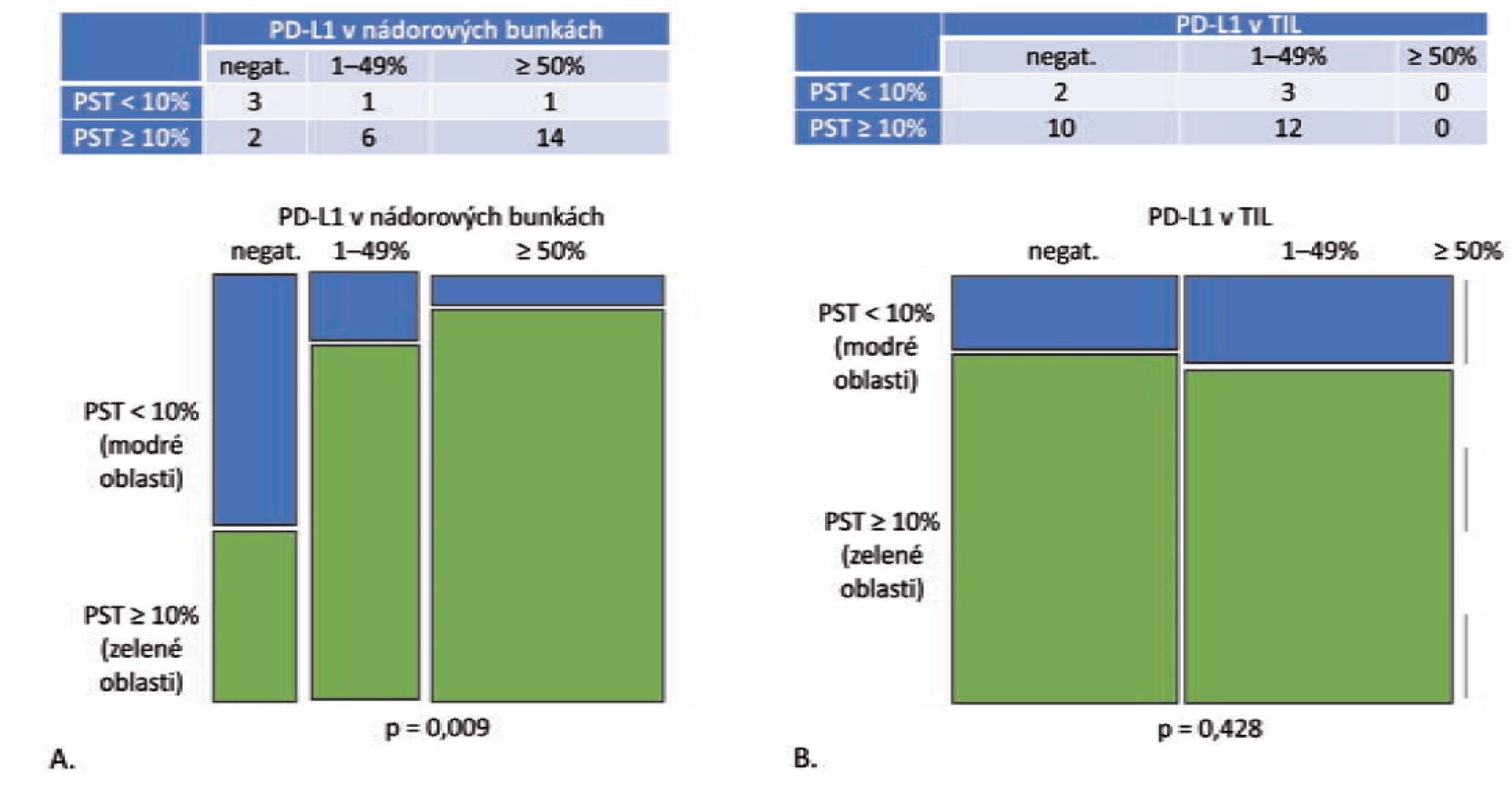
A. Mozaikový diagram, ktorý schematicky znázorňuje, že podiel grade 3 adenokarcinómov s PD-L1 negatívnymi nádorovými bunkami je v kategórii PST < 10 % relatívne ku kategórii PST ≥ 10 % vyšší. Tento pomer je obrátený v prípade PD-L1 pozitívnych prípadoch (p = 0,009). B. Mozaikový diagram, ktorý schematicky znázorňuje, že podiel grade 3 adenokarcinómov s PD-L1 negatívnymi TIL, ako aj PD-L1 pozitívnymi TIL je v kategórii PST < 10 % relatívne ku kategórii PST ≥ 10 % porovnateľný (p = 0,428).
PST – percento stromálnych tumor infiltrujúcich lymfocytov, IM – invazívny okraj nádoru, TC – centrálna časť nádoru, PD-L1 – ligand receptora programovanej bunkovej smrti 1, TIL – tumor infiltrujúce lymfocytyObr. 3. Asociácia medzi infiltráciou nádorovej strómy T-lymfocytmi a expresiou PD-L1 v nádorových bunkách nemalobunkového karcinómu pľúc.
A. Adenokarcinóm s predominantne solídnym rastovým vzorom (20× zväčšenie, hematoxylín a eozín).
B. Rovnaký adenokarcinóm z A., zobrazená je infi ltrácia nádorovej strómy T-lymfocytmi so stredne vysokou hodnotou PST (CD3 imunohistochémia).
C. Rovnaký príklad uvedený v A., zobrazená je expresia PD-L1 v nádorových bunkách s hodnotou TPS 20–30 %.
D. Príklad skvamocelulárneho karcinómu (20× zväčšenie, hematoxylín a eozín).
E. Rovnaký príklad uvedený v D., zobrazená je infi ltrácia nádorovej strómy T-lymfocytmi s vysokou hodnotou PST (CD3 imunohistochémia).
F. Rovnaký príklad uvedený v D., zobrazená je expresia PD-L1 v nádorových bunkách s hodnotou TPS nad 90 %
(E,F – PD-L1 imunohistochémia).
PD-L1 – ligand receptora programovanej bunkovej smrti 1, PST – percento stromálnych tumor infi ltrujúcich lymfocytov, TPS – nádorové proporčné skóre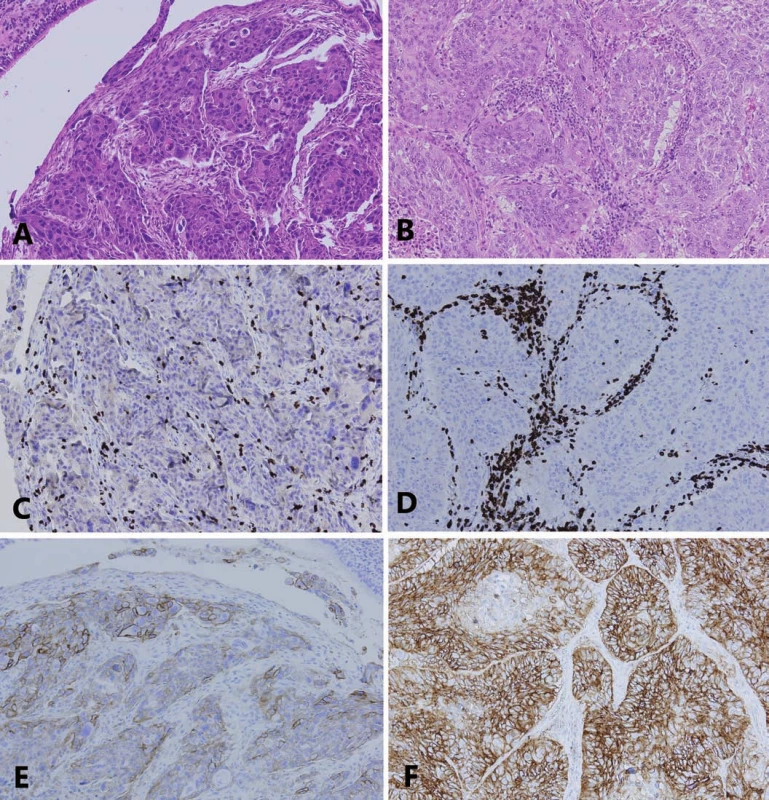
Asociácia medzi expresiou PD-L1 a PST v skupine skvamocelulárnych karcinómov
Súbor obsahoval 47 prípadov klasifikovaných ako skvamocelulárne karcinómy, pričom pozitivita PD-L1 proteínu v nádorových bunkách bola zistená v 22 zo 47 prípadov (46,8 %) a v TIL v 27 zo 47 prípadov (57,4 %).
V kategórii „PST v IM = PST v TC“ bolo 31 prípadov, z ktorých expresia PD-L1 v nádorových bunkách a v TIL bola zistená v 16 z 31 prípadov (51,6 %). Výsledky sú zhrnuté v tab. 1.
Celková pozitivita PD-L1 v nádorových bunkách bola v kategóriách PST 1–49 % a ≥ 50 % signifikantne vyššia v porovnaní s kategóriou PST ≥ 10 % (p = 0,028) (obr. 4A). V kategórii PST ≥ 10 % bola expresia PD-L1 v nádorových bunkách zistená v 3 z 11 prípadov (27,3 %), v kategórii PST 10–49 % v 3 zo 6 prípadov (50 %) a v kategórii PST ≥ 50 % 10 zo 14 prípadov (71,4 %). Celková pozitivita PD-L1 v TIL bola v kategóriách PST 1–49 % a ≥ 50 % signifikantne vyššia v porovnaní s kategóriou PST ≥ 10 % (p = 0,025) (obr. 4B). V kategórii PST ≥ 10 % bola zistená expresia PD-L1 len v 3 z 11 prípadov (27,3%), ale v kategórii PST 10–49 % v 4 zo 6 prípadov (66,7 %) a v kategórii PST ≥ 50% 9 zo 14 prípadov (64,3 %). Vzťah medzi expresiou PD-L1 v nádorových bunkách skvamocelulárnych karcinómov a lymfocytovou infiltráciou strómy je zobrazený na obr. 3.
Tab. 3. Skvamocelulárne karcinómy, PST v IM = PST v TC (n = 31). 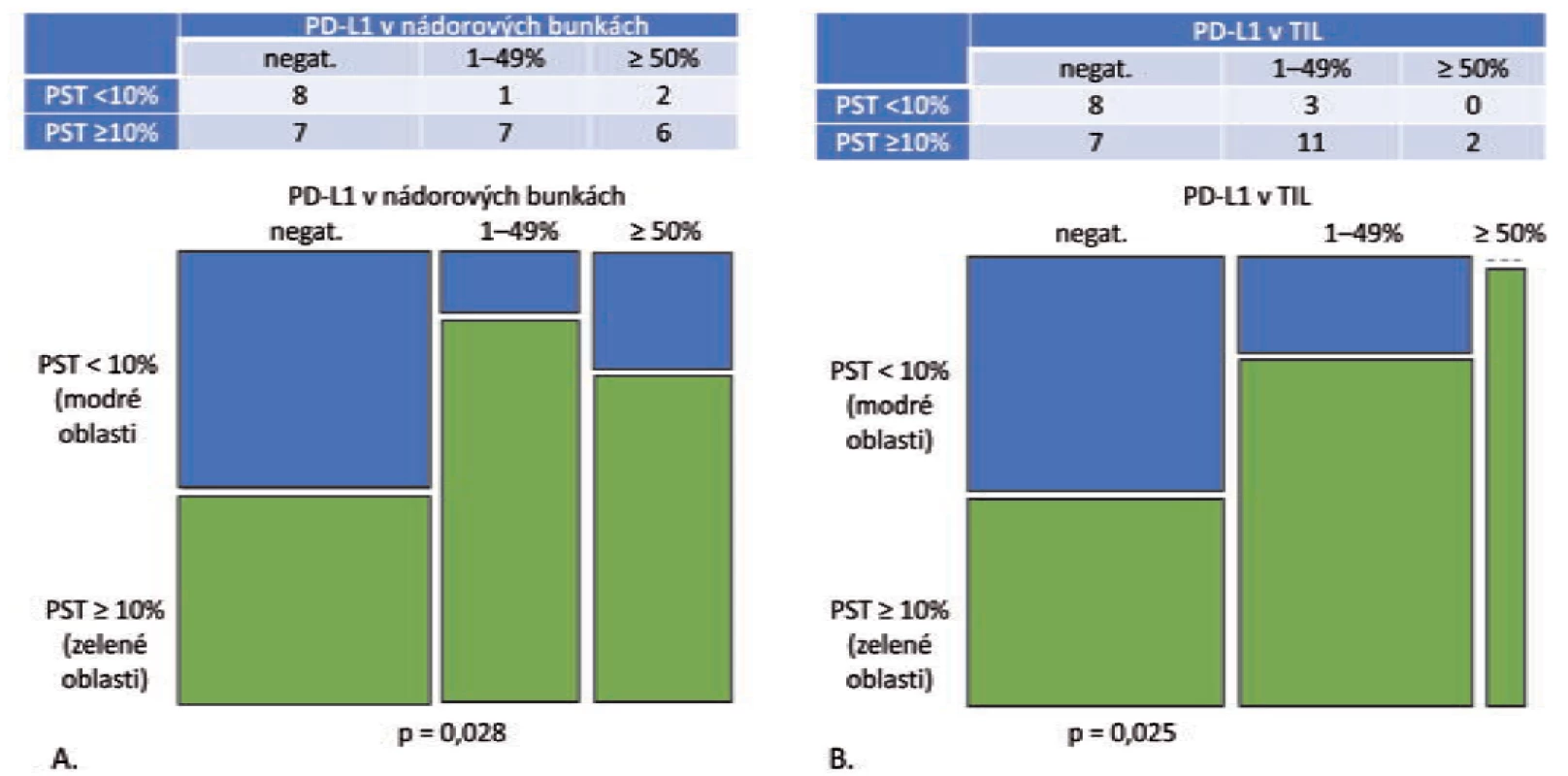
A. Mozaikový diagram, ktorý schematicky znázorňuje, že podiel skvamocelulárnych karcinómov s PD-L1 negatívnymi nádorovými bunkami je v kategórii PST < 10 % relatívne ku kategórii PST ≥ 10 % vyšší. Tento pomer je obrátený v prípade PD-L1 pozitívnych prípadoch (p = 0,028).
B. Mozaikový diagram, ktorý schematicky znázorňuje, že podiel skvamocelulárnych karcinómov s PD-L1 negatívnymi TIL je v kategórii PST < 10 % relatívne ku kategórii PST ≥ 10 % vyšší. Tento pomer je obrátený v prípade PD-L1 pozitívnych prípadoch (p = 0,025).
PST – percento stromálnych tumor infiltrujúcich lymfocytov, IM – invazívny okraj nádoru, TC – centrálna časť nádoru, PD-L1 – ligand receptora programovanej bunkovej smrti 1, TIL – tumor infitrujúce lymfocytyV kategórii „PST v IM ≠ PST v TC“ bolo identifikovaných 19 skvamocelulárnych karcinómov. V 10 prípadoch patrili do kategórie „PST v TC ≥ 10 % / PST v IM 10–49 %“ s pozitívnym výsledkom expresie PD-L1 v nádorových bunkách v 3 prípadoch (30 %) a v TIL v 6 prípadoch (60 %). V 6 prípadoch išlo o kategóriu „PST v TC 10–49 % / PST v IM ≥ 50 %“, pričom expresia PD-L1 v nádorových bunkách bola zistená v 3 prípadoch (50 %) a v TIL v 5 prípadoch (83,3 %). Výsledky sú zhrnuté v tab. 2.
Tab. 4. Distribúcia dezmoplastických oblastí pľúcnych karcinómov rozdelených podľa hodnoty pozitivity PD-L1 v nádorových bunkách v troch kategóriách percenta stromálnych tumor infiltrujúcich lymfocytov. 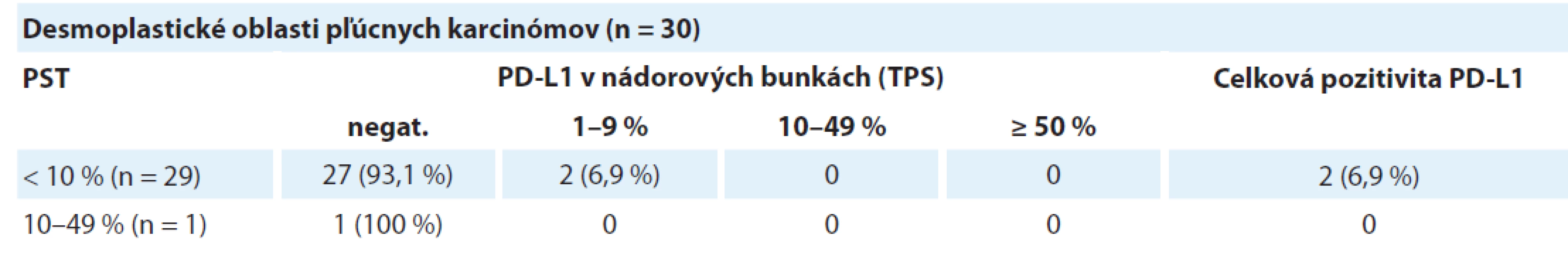
TPS – nádorové proporčné skóre, PST – percento stromálnych tumor infiltrujúcich lymfocytov, PD-L1 – ligand receptora programovanej bunkovej smrti 1 Asociácia medzi expresiou PD-L1 a PST v dezmoplastických oblastiach
Celkovo bolo identifikovaných 30 karcinómov s vysokým stupňom dezmoplázie. Tieto oblasti sa vyznačovali obzvlášť nízkou hodnotou PST a takmer absentujúcou expresiou PD-L1. V 29 prípadoch bola zistená hodnota PST ≥ 10 %, pričom len dve z týchto oblastí (6,9 %) vykazovali pozitivitu PD-L1 proteínu v nádorových bunkách. Jedna dezmoplastická oblasť mala hodnotu PST 10–49 % s negatívnym dôkazom expresie PD-L1. Výsledky sú zhrnuté v tab. 3 a obr. 5 zobrazuje príklady dezmoplastických pľúcnych karcinómov vo vzťahu k lymfocytovej infiltrácii.
Obr. 4. Dezmoplastická nádorová stróma. 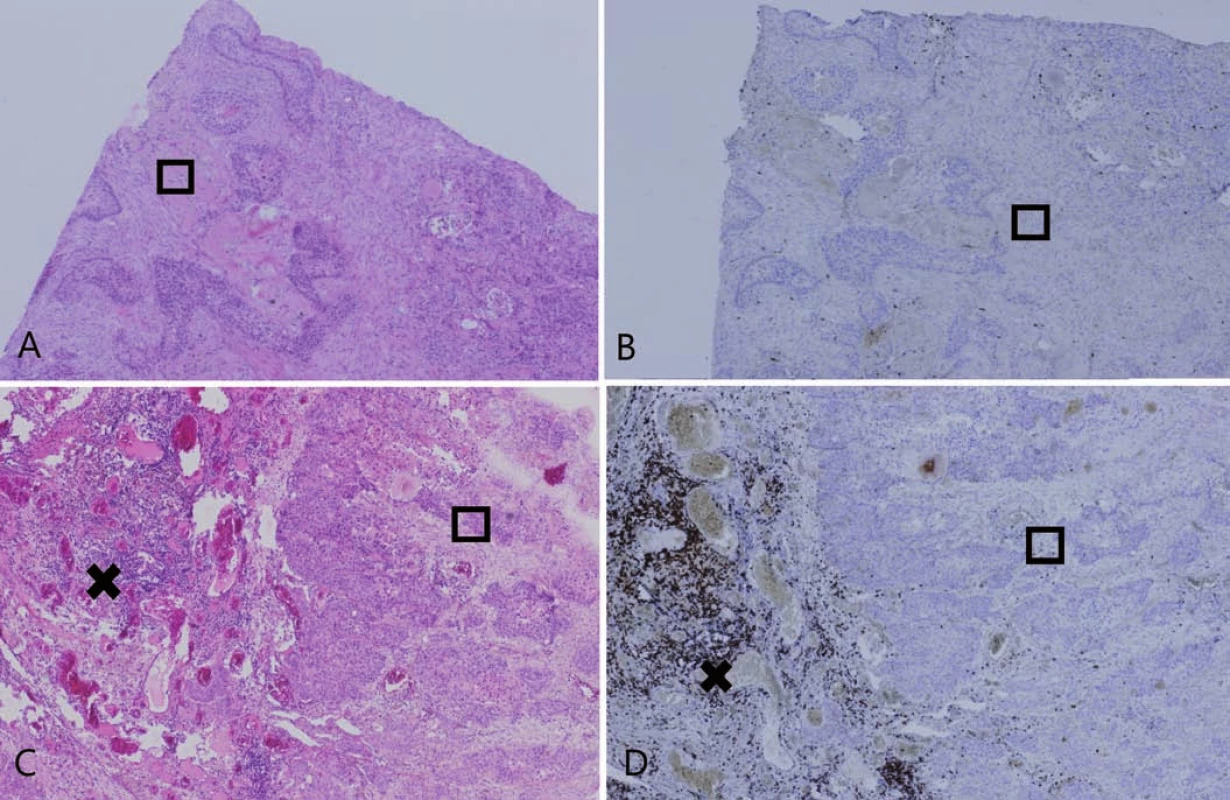
A, B. Príklad pľúcneho karcinómu s vysokým obsahom dezmoplastickej nádorovej strómy (☐) (10× zväčšenie, hematoxylín a eozín). C, D. Dezmoplastická nádorová stróma ( ☐) zabraňuje infiltrácii nádoru T-lymfocytmi, ktoré zostávajú lokalizované peritumorózne (x) (10× zväčšenie, CD3 imunohistochémia). Diskusia
Predkladané dáta objasňujú viaceré aspekty nádorového mikroprostredia NSCLC, ktoré by mohli byť využiteľné pri interpretácii klinickej odpovede pacientov s NSCLC liečených imunoterapiou, tj. mohli by mať potenciálne využitie pri jej indikovaní.
V roku 2015 Teng et al [14] navrhli klasifikovať nádorové mikroprostredie na základe prítomnosti expresie PD-L1 a infiltrácii nádorovej strómy T-lymfocytmi na štyri typy – ako nádorové mikroprostredie typu I označili také, v ktorom nádorové bunky vykazujú pozitivitu PD-L1 proteínu, pričom v nádorovej stróme sú prítomné TIL. Takýto stav signalizuje adaptívnu imunitnú rezistenciu a pacienti s týmto typom nádorového mikroprostredia vykazujú najlepšiu klinickú odpoveď pri podávaní inhibítorov imunitných kontrolných bodov. Nádorové mikroprostredie typu II je označované aj ako imunologicky „vypriahnuté“. Je charakterizované kombináciou PD-L1 negatívnych nádorových buniek ako aj nízkou až absentujúcou T-lymfocytovou infiltráciou, čo signalizuje imunologickú „ignoranciu“. Nádorové mikroprostredie typu III je PD-L1 pozitívne, ale stróma nie je infiltrovaná T-lymfocytmi, čo naznačuje onkogénnu stimuláciu expresie PD-L1 v nádorových bunkách. Nádorové mikroprostredie typu IV je bez expresie PD-L1, ale s prítomnosťou TIL, čo naznačuje alternatívne cesty úniku spod imunitného dozoru [14].
Naše zistenia poukazujú na to, že v prognosticky odlišných skupinách adenokarcinómov je zastúpenie uvedených štyroch typov odlišné. V skupine lepšie diferencovaných, grade 1 a grade 2 adenokarcinómov patrilo 28 zo 49 prípadov (57,1 %) do kategórie PST ≥ 10 %. Z týchto 28 adenokarcinómov bola expresia PD-L1 v nádorových bunkách zistená v 4 z nich (16,7 %). V 24 prípadoch (49 %) mali teda pacienti nádorové mikroprostredie typu II s konfiguráciou „PD-L1 negatívny, TIL negatívny (nízky) “, čo by mohlo znamenať, že sú málo vhodnými kandidátmi pre imunoterapeutické postupy.
Pri analýze tejto skupiny adenokarcinómov bolo tiež zistené, že celková pozitivita PD-L1 v nádorových bunkách je vyššia v kategóriách PST 1–49 % a ≥ 50 % v porovnaní s kategóriou PST ≥ 10 % (p = 0,008). To je v súlade s výsledkami viacerých autorov, ktorí upozorňujú na možnú asociáciu medzi expresiou PD-L1 v nádorových bunkách a infiltráciou nádorovej strómy T-lymfocytmi [15–17].
V skupine nízko diferencovaných, grade 3 adenokarcinómov patrilo 15 z 27 prípadov (55,5 %) do kategórie PST ≥ 50 %. Z týchto 15 adenokarcinómov bola expresia PD-L1 v nádorových bunkách zistená v 9 z nich (60 %). V 9 prípadoch mali teda pacienti nádorové mikroprostredie typu I, s konfiguráciu „PD-L1 pozitívny, TIL vysoký“, čo podporuje názor, že by mali byť vhodnými kandidátmi pre imunoterapeutické postupy. Podobne ako v prípade lepšie diferencovaných adenokarcinómov aj v prípade grade 3 foriem bola pozorovaná asociácia medzi expresiou PD-L1 v nádorových bunkách a stupňom infitrácie nádorovej strómy imunitnými bunkami. Celková pozitivita PD-L1 proteínu bola vyššia v kategóriách PST 1-49 % a ≥ 50 % v porovnaní s kategóriou PST ≥ 10 % (p = 0,009).
S ohľadom na expresiu PD-L1 v TIL nebol v žiadnej z uvedených dvoch skupín adenokarcinómov rozdelených na základe stupňa diferenciácie zistený signifikantný vzťah medzi hodnotou PST a pozitivitou PD-L1 v TIL. Celková pozitivita PD-L1 proteínu v nádorových bunkách v nízko diferencovaných adenokarcinómoch bola vyššia než v prípade lepšie diferencovaných formách (81,5 vs 26,5%). Na túto asociáciu medzi expresiou PD-L1 a stupňom diferenciácie adenokarcinómov upozorňujú aj viacerí autori – expresia PD-L1 bola signifikantne asociovaná s nízko diferencovanými, grade 3 adenokarcinómami klasifikovanými ako predominantne solídne a s kratším celkovým prežívaním [18–23].
V skupine skvamocelulárnych karcinómov nebol zistený výrazný rozdiel v zastúpení jednotlivých kategórii PST – 11 prípadov patrilo do kategórie PST ≥ 10 % a 16 do kategórie PST ≥ 50 %. V skvamocelulárnych karcinómoch bola pozorovaná asociácia medzi celkovou pozitivitou PD-L1 v nádorových bunkách a hodnotou PST (p = 0,028). Taktiež v TIL bol podiel PD-L1 pozitívnych prípadov signifikantne vyšší v kategóriách s vyšším PST (p = 0,025).
Počas analýzy jednotlivých karcinómov sme pozorovali, že dezmoplastické oblasti, tj. časti nádoru s výrazným zastúpením nádorovej strómy, sa vyznačujú obzvlášť nízkou hodnotou PST a takmer absentujúcou expresiou PD-L1 v nádorových bunkách – z celkovo 30 identifikovaných dezmoplastických oblastí patrilo 29 z nich (96,7 %) do kategórie PST ≥ 10 %. V nich bola zistená expresia PD-L1 v nádorových bunkách v dvoch prípadoch (6,9 %), pričom išlo o kategóriu TPS 1–9 %. Podobné charakteristiky imunitne „vypriahnutého“ nádorového mikroprostredia bolo pozorované pri analýze metastatických uroteliálnych karcinómov od pacientov liečených atezolizumabom [24]. Mariathasan et al zistili, že migrácia imunitných buniek do nádorového centra je inhibovaná, ak došlo k aktivácii signálnej dráhy TGF-β vo fibroblastoch lokalizovaných peritumorálne. Imunitné bunky, miesto toho aby infiltrovali nádorové centrum, zostali „uväznené“ v nádorovej stróme invazívneho okraja, bohatej na „s nádorom asociovaných fibroblastov“ a na kolagénové vlákna [24]. Aktivácia signálnej dráhy TGF-β však nevedie len k tvorbe mechanickej bariéry v podobe hustej vrstvy kolagénu – táto dráha zohráva významnú úlohu v procese adaptívnej imunitnej odpovede a jej aktivácia vedie k potlačeniu tvorby interferónu-γ, ktorý je zásadným induktorom expresie PD-L1 v nádorových bunkách. TGF-β tiež inhibuje funkciu cytotoxických CD8+ T-lymfocytov a indukuje v CD4+ T-lymfocytoch expresiu transkripčného faktora FOXP3, čím mení zastúpenie jednotlivých subpopulácii týchto buniek v neprospech Th1 lymfocytov a v prospech regulačných T-lymfocytov [25]. Blokovanie signálnej dráhy TGF-β tak predstavuje perspektívnu komplementárnu terapiu k podávaniu inhibítorov imunitných kontrolných bodov. Odstránenie mechanickej bariéry v podobe kolagénových vláken by umožnilo kontakt imunitných buniek s bunkami nádorovými, ktorý, ako bolo demonštrované, je asociovaný s expresiou prediktívneho markera PD-L1. Nádorové mikroprostredie by sa tak hypoteticky zmenilo z imunitne „vypriahnutého“ typu II na typ I, ktoré vykazuje najvyššiu pravdepodobnosť klinickej odpovede pri podávaní inhibítorov kontrolných bodov. V súčasnosti prebiehajú predklinické štúdie, ktoré testujú kombinovanú terapiu zameranú na blokovanie signálnej dráhy PD-1/PD-L1 spolu s anti-TGF-β terapiou so zatiaľ superiórnymi účinkami oproti monoterapii podávania inhibítorov imunitných kontrolných bodov [24,25].
Záver
Súhrnne, naša štúdia objasňuje mnohé aspekty nádorového mikroprostredia v NSCLC. Expresia PD-L1 má vzťah ku stupňu diferenciácie adenokarcinómov, pričom je vyššia v nízko diferencovaných podtypoch adenokarcinómov grade 3. V skupine adenokarcinómov ako aj skvamocelulárnych karcinómov je celková pozitivita PD-L1 proteínu v nádorových bunkách asociovaná s vyššou hodnotou PST. Expresia PD-L1 v TIL je asociovaná s vyššou hodnotou PST v skvamocelulárnych karcinómoch, ale nie v skupine adenokarcinómov. Dezmoplastické oblasti sa vyznačujú obzvlášť nízkou hodnotou PST a nízkou expresiou PD-L1. Uvedené výsledky majú potenciál pochopiť zložitosť výsledkov liečby pacientov s NSCLC inhibítormi imunitných kontrolných bodov ovplyvňujúcimi signálne dráhy PD-1/PD-L1 a prispieť k zlepšeniu prediktívnej stratifikácie pacientov nielen v rámci existujúcich modalít imunoterapie, ale aj v rámci nových kombinovaných v súčasnosti v klinických štúdiách overovaných postupov.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Lukáš Plank, CSc.
Ústav patologickej anatómie
JLF UK a UN Martin
Kollárova 2
036 01 Martin, Slovenská republika
e-mail: lukas.plank@uniba.sk
Obdržané: 25. 11. 2019
Prijaté: 8. 12. 2019
Zdroje
1. Travis WD, Brambilla E, Burke AP et al (eds). WHO classification of tumours of the lung, pleura, thymus and heart. 4th ed. Lyon: IARC 2015.
2. Bílek O, Bohovicová L, Demlová R et al. Non-small cell lung cancer – from immunobiology to immunotherapy. Klin Onkol 2016; 29 (Suppl 4): 78–87. doi: 10.14735/amko20164S78.
3. Zatloukalová, Pjechová M, Babčanová S et al. The role of PD-1/PD-L1 signaling pathway in antitumor immune response. Klin Onkol 2016; 29 (Suppl 4): 72–77. doi: 10.14735/amko20164S72.
4. Schvartsman G, Ferrarotto R, Massarelli E. Checkpoint inhibitors in lung cancer: latest developments and clinical potential. Ther Adv Med Oncol 2016; 8 (6): 460–473. doi: 10.1177/1758834016661164.
5. Fiala O, Šorejs O, Pešek M et al. Immunotherapy in the treatment of lung cancer. Klin Onkol 2017; 30 (Suppl 3): 22–31. doi: 10.14735/amko20173S22.
6. Yan YF, Zheng YF, Ming PP et al. Immune checkpoint inhibitors in non-small-cell lung cancer: current status and future directions. Brief Funct Genomics 2018; 18 (2): 147–156. doi: 10.1093/bfgp/ely029.
7. Mathew M, Safyan RA, Shu CA. PD-L1 as a biomarker in NSCLC: challenges and future directions. Ann Transl Med 2017; 5 (18): 375. doi: 10.21037/atm.2017.08.04.
8. Gridelli C, Ardizzoni A, Barberis M et al. Predictive biomarkers of immunotherapy for non-small cell lung cancer: results from an Experts Panel Meeting of the Italian Association of Thoracic Oncology. Transl Lung Cancer Res 2017; 6 (3): 373–386. doi: 10.21037/tlcr.2017.05.09.
9. Schalper KA, Brown J, Carvajal-Hausdorf D et al. Objective measurement and clinical significance of TILs in non-small cell lung cancer. J Natl Cancer Inst 2015; 107 (3): pii: dju435. doi: 10.1093/jnci/dju435.
10. Tokito T, Azuma K, Kawahara A et al. Predictive relevance of PD-L1 expression combined with CD8+ TIL density in stage III non-small cell lung cancer patients receiving concurrent chemoradiotherapy. Eur J Cancer 2016; 55 (1): 7–14. doi: 10.1016/j.ejca.2015.11.020.
11. Solomon B, Young RJ, Bressel M et al. Prognostic significance of PD-L1+ and CD8+ immune cells in HPV+ oropharyngeal squamous cell carcinoma. Cancer Immunol Res 2018; 6 (3): 295–304. doi: 10.1158/2326-6066.
12. Hirsch FR, McElhinny A, Stanforth D et al. PD-L1 Immunohistochemistry assays for lung cancer: results from phase 1 of the Blueprint PD-L1 IHC Assay Comparison Project. J Thorac Oncol 2017; 12 (2): 208–222. doi: 10.1016/j.jtho.2016.11.2228.
13. Salgado R, Denkert C, Demaria S et al. The evaluation of tumor-infiltrating lymphocytes (TILs) in breast cancer: recommendations by an International TILs Working Group 2014. Ann Oncol 2015; 26 (2): 259–271. doi: 10.1093/annonc/mdu450.
14. Teng MW, Ngiow SF, Ribas A et al. Classifying cancers based on T-cell infiltration and PD-L1. Cancer Res 2015; 75 (11): 2139–2145. doi: 10.1158/0008-5472.CAN-15-0255.
15. Lin G, Fan X, Zhu W et al. Prognostic significance of PD-L1 expression and tumor infiltrating lymphocyte in surgically resectable non-small cell lung cancer. Oncotarget 2017; 8 (48): 83986–83994. doi: 10.18632/oncotarget.20233.
16. He Y, Rozeboom L, Rivard CJ et al. PD-1, PD-L1 protein expression in non-small cell lung cancer and their relationship with tumor-infiltrating lymphocytes. Med Sci Monit 2017; 23 (1): 1208–1216. doi: 10.12659/MSM.899909.
17. Velcheti V, Schalper KA, Carvajal DE et al. Programmed death ligand-1 expression in non-small cell lung cancer. Lab Invest 2014; 94 (1): 107–116. doi: 10.1038/ labinvest.2013.130.
18. Kim S, Kim MY, Koh J et al. Programmed death-1 ligand 1 and 2 are highly expressed in pleomorphic carcinomas of the lung: comparison of sarcomatous and carcinomatous areas. Eur J Cancer 2015; 51 (17): 2698–2707. doi: 10.1016/j.ejca.2015.08.013.
19. Mori S, Motoi N, Ninomiya H et al. High expression of programmed cell death 1 ligand 1 in lung adenocarcinoma is a poor prognostic factor particularly in smokers and wild-type epidermal growth-factor receptor cases. Pathol Int 2017; 67 (1): 37–44. doi: 10.1111/pin.12489.
20. Koh J, Go H, Keam B et al. Clinicopathologic analysis of programmed cell death-1 and programmed cell death-ligand 1 and 2 expressions in pulmonary adenocarcinoma: comparison with histology and driver oncogenic alteration status. Mod Pathol 2015; 28 (9): 1154–1166. doi: 10.1038/modpathol.2015.63.
21. Cha YJ, Kim HR, Lee CY et al. Clinicopathological and prognostic significance of programmed cell death ligand-1 expression in lung adenocarcinoma and its relationship with p53 status. Lung Cancer 2016; 97 (1): 73–80. doi: 10.1016/j.lungcan.2016.05.001.
22. Shimoji M, Shimizu S, Sato K et al. Clinical and pathologic features of lung cancer expressing programmed cell death ligand 1 (PD-L1). Lung Cancer 2016; 98 (1): 69–75. doi: 10.1016/j.lungcan.2016.04.021.
23. Takada K, Okamoto T, Shoji F et al. Clinical significance of PD-L1 protein expression in surgically resected primary lung adenocarcinoma. J Thorac Oncol 2016; 11 (11): 1879–1890. doi: 10.1016/j.jtho.2016.06.006.
24. Mariathasan S, Turley SJ, Nickles D et al. TGFβ attenuates tumour response to PD-L1 blockade by contributing to exclusion of T cells. Nature 2018; 554 (7693): 544–548. doi: 10.1038/nature25501.
25. Ravi R, Noonan KA, Pham V et al. Bifunctional immune checkpoint-targeted antibody-ligand traps that simultaneously disable TGFβ enhance the efficacy of cancer immunotherapy. Nat Commun 2018; 9 (1): 741. doi: 10.1038/s41467-017-02696-6.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2020 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Neurotoxicita a imunoterapie
- Management imunitně podmíněné endokrinopatie při protinádorové léčbě checkpoint inhibitory
- Toxicita imunoonkologické léčby – myokarditida
- Gastrointestinální toxicita imunoterapie
- Renální toxicita imunoonkologické léčby
- Editorial
- Důležitá role STAT3 v biologii chronické lymfocytární leukemie
- Význam fibroblastů asociovaných s nádorem při patogenezi karcinomů v oblasti hlavy a krku
- Dlouhodobé klinické výsledky IGRT karcinomu prostaty
- Expresia ligandu receptora programovanej bunkovej smrti 1 v bio psii nemalobunkového karcinómu pľúc a jej asociácia s tumor infi ltrujúcimi lymfocytmi a stupňom dezmoplázie
- Novinky z genetiky, molekulární biologie a klinické onkologie sarkomů
- Vzpomínka na prof. MUDr. Vítězslava Kolka, DrSc.
- Prof. MUDr. Stanislav Špánik, CSc. – 60-ročný
- Nežádoucí účinky a efekt imunoterapie
- Aktuality z odborného tisku
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nežádoucí účinky a efekt imunoterapie
- Neurotoxicita a imunoterapie
- Důležitá role STAT3 v biologii chronické lymfocytární leukemie
- Toxicita imunoonkologické léčby – myokarditida
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



