-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaTestování varianty androgenového receptoru AR-V7 pro výběr pacientů s kastračně refrakterním metastazujícím karcinomem prostaty k léčbě novými hormonálními léky
AR-V7 Androgen Receptor Variant as a Predictor of Response to Androgen-receptor Targeting Agents Used to Treat Castration-refractory Metastatic Prostate Cancer
Background:
Several systemic treatment options are currently available for patients with metastatic castration-refractory prostate cancer (mCRPC), including the androgen-receptor targeting agents (ARTA) enzalutamide and abiraterone, the taxanes docetaxel and cabazitaxel, and the radioisotope drug 223-radium dichloride. In some patients with mCRCP, alternative splicing of androgen receptor (AR) mRNA occurs, resulting in the formation of a truncated AR lacking the androgen-binding domain. These receptors activate downstream signalling pathways even without the ligand. Recent studies show that the presence of the AR-V7 (ARV – AR variants) splicing variant is associated with resistance to ARTA. Bec>ause the presence of AR-V7 does not affect the efficacy of other systemic therapies used in mCRCPs, particularly taxanes, AR-V7 is a candidate predictive biomarker for the individualisation of mCRCP treatment. Two types of assays based on mRNA or abnormal protein detection are used to detect AR-V7 in circulating tumour cells.Aim:
To describe the current status of AR-V7 testing in mCRPC and possible applications of this method for predicting outcomes of ARTA therapy.Conclusion:
The percentage of CTC AR-V7+ in ARTA-naive men is relatively low at baseline, but in patients pretreated with ARTA, the prevalence of AR-V7 increases to 19–34%. Given the relatively high expected prevalence, AR-V7 testing may be economically feasible in this population. The proportion of AR-V7+ patients responding to ARTA retreatment appears to be very low, at only 4.8%. AR-V7 testing could thus be useful if an ARTA switch is considered in a patient progressing onto an ARTA drug. Both protein-based tests and mRNA-based tests are currently undergoing clinical validation in prospective studies, with results expected within a year.Key words:
prostate cancer – abiraterone – enzalutamide – alternative splicing – drug resistanceSubmitted:
30. 8. 2017Accepted:
5. 11. 2017
doc. MUDr. Tomáš Büchler, Ph.D. received honorary lectures and publications from Astellas and Janssen and a travel grant from Janssen.
Supported by Ministry of Health, Czech Republic – conceptual development of research organization Thomayer Hospital – TN 0064190.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Autoři: Büchler Tomáš 1; Bobek Vladimír 2,3; Kološtová Katarína 2
Působiště autorů: Onkologická klinika 1. LF UK a Thomayerovy nemocnice, Praha 1; Ústav laboratorní diagnostiky, FN Královské Vinohrady, Praha 2; III. chirurgická klinika 1. LF UK a FN Motol, Praha 3
Vyšlo v časopise: Klin Onkol 2018; 31(1): 9-14
Kategorie: Přehled
doi: https://doi.org/10.14735/amko20189Souhrn
Východiska:
U nemocných s metastatickým kastračně refrakterním karcinomem prostaty (metastatic castration-refractory prostate cancer – mCRPC) existuje několik možností systémové léčby, zahrnující zejména enzalutamid a abirateron, souhrnně nazývané androgen-receptor targeting agents (ARTA), taxany docetaxel a cabazitaxel a radioizotopové léčivo 223-radium dichlorid. U části nemocných s mCRPC dochází během syntézy androgenového receptoru (AR) k alternativnímu sestřihu mRNA se vznikem zkrácené formy AR bez vazebné domény pro androgeny. Na takovou formu AR se nemůže androgen navázat a receptor může aktivovat signální dráhy i bez svého ligandu. V několika pracích z poslední doby se ukázalo, že přítomnost sestřihové varianty androgenového receptoru AR-V7 (ARV – AR varianty) na úrovni proteinu a mRNA je faktorem zhoršujícím celkovou prognózu mCRPC a je spojena s refrakteritou na ARTA. Protože přítomnost AR-V7 neovlivňuje účinnost další skupiny léků využívaných u mCRCP, zejména taxanů, uvažuje se o využití AR-V7 jako prediktivního markeru pro individualizaci léčby mCRPC. K detekci AR-V7 jsou používány dva typy testů pracujících s cirkulujícími nádorovými buňkami – na základě mRNA a na základě detekce abnormálního proteinu.Cíl:
Popsat současný stav testování na přítomnost AR-V7 u mCRPC a perspektivy využití této metody pro výběr nemocných k léčbě ARTA.Závěr:
Procento CTC AR-V7+ pacientů v populaci mužů dosud neléčených ARTA je dle dostupných studií relativně nízké na začátku léčby, ale u pacientů předléčených ARTA se prevalence AR-V7 zvyšuje a dosahuje 19–34 %. Vzhledem k vyšší očekávané prevalenci by v této populaci pravděpodobně bylo testování na AR-V7 ekonomicky přínosné. Procento AR-V7+ pozitivních pacientů odpovídajících na léčbu ARTA ve 2. linii po progresi na jiné léky ze skupiny ARTA se zdá být velmi nízké, jen 4,8 %. Jednou z indikací testování AR-V7 by proto mohla být situace, kdy se u nemocného předléčeného jedním typem ARTA zvažuje léčba jiným lékem z této skupiny. Jak testy na úrovni proteinu, tak testy na úrovni mRNA procházejí v současnosti klinickou validací v prospektivních studiích, jejichž výsledky se očekávají v nejbližším roce.Klíčová slova:
rakovina prostaty – abirateron – enzalutamid – alternativní sestřih – léková rezistenceÚvod
Do léčebných algoritmů pro metastatický kastračně refrakterní karcinom prostaty (metastatic castration-resistant prostate cancer – mCRPC) v poslední době vstoupily léky enzalutamid a abirateron, souhrnně nazývané ARTA (androgen receptor targeting agents) – definice CRPC je uvedena v tab. 1 [1]. Terapeutickým cílem ARTA je androgenový receptor (AR). U části nemocných s mCRPC dochází během syntézy AR k alternativnímu sestřihu mRNA se vznikem zkrácené formy AR bez vazebné domény pro androgeny. Na takovou formu AR se nemůže androgen navázat a receptor může aktivovat signální dráhy i bez svého ligandu.
Tab. 1. Definice kastračně refrakterního karcinomu prostaty podle Evropské urologické asociace [15]. ![Definice kastračně refrakterního karcinomu prostaty podle Evropské urologické asociace [15].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ca854b630654359627f35deff1993ba3.png)
PSA – prostatický specifický antigen AR-V7 a další sestřihové varianty (ARV – AR varianty) jsou produkovány v situacích, kdy buňky reagují na stres způsobený např. androgenní deprivací. Při androgenní deprivaci dochází ke zvýšení transkripce genu pro AR a zároveň zvyšování produkce sestřihových variant. Tato situace je reverzibilní [2,3].
Výskyt sestřihových variant AR koreluje s pokročilostí onemocnění. Existuje mnoho popsaných variant sestřihu AR. Nejprozkoumanější z ARV je varianta AR-V7 vzhledem ke ztrátě celé ligand-vazebné domény AR. V několika pracích z poslední doby se ukázalo, že přítomnost AR-V7 je spojena s refrakteritou na ARTA. Protože přítomnost AR-V7 neovlivňuje účinnost další skupiny léků využívaných u mCRPC, zejména taxanů, uvažuje se o využití AR-V7 jako prediktivního markeru pro individualizaci léčby mCRPC [4,5].
V současnosti je klíčovou otázkou léčby nemocných s mCRPC optimální volba léčebné sekvence [6,7]. Pro léčbu těchto pacientů máme v současnosti k dispozici abirateron, enzalutamid, docetaxel, radium-223, případně sipuleucel-T (u nás nedostupný). Testování AR-V7 bylo vyvinuto s cílem poskytnout vodítko pro volbu mezi terapii ARTA a taxany.
Princip testování AR-V7
Momentálně máme k dispozici dva typy CLIA – certifikovaných testů na přítomnost AR-V7 (podrobně viz tab. 2). Společným krokem u obou typů testů je izolace cirkulujících nádorových buněk (circulating tumor cells – CTC). První z testů vyvinutý skupinou Antonarakise v Johns Hopkins Sidney Kimmel Comprehensive Cancer Center v Baltimore, (Spojené státy) izoluje CTC pomocí imunomagnetické separace (Adnatest, Adnagen, Německo) a detekuje mRNA ke stanovení AR-V7 pomocí RT-PCR (reverse transcriptase-polymerase chain reaction) analýzy [8].
Tab. 2. Popis testů pro detekci AR-V7 v CTC validovaných podle Clinical Laboratory Improvement Amendments (CLIA) [21]. ![Popis testů pro detekci AR-V7 v CTC validovaných podle Clinical Laboratory Improvement Amendments (CLIA) [21].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0ea2a2eb914f8892e60c0e9cab52b10f.png)
CTC – cirkulující nádorové buňky, qPCR – kvantitativní polymerázová řetězová reakce, qRT-PCR – kvatitativní reverzně transkripční polymerázová řetězová reakce, DAPI – 4‘,6-diamidino-2-phenylindole, FAST – Fibre Optic Array Scanning Technology Druhá metoda se opírá o automatizované vysokokapacitní skenování buněk nanesených na mikroskopická skla (Epic Sciences, Spojené státy) a následnou detekci mutantního proteinu AR-V7 specifickou monoklonální protilátku proti AR-V7 (EPR15656; Abcam) v imunofluorescenčním testu. Metoda byla vyvinuta ve spoluráci s Epic Sciences a Memorial Sloan Kettering Cancer Center (MSKCC) v New Yorku [9].
Publikované klinické výsledky
Výsledky testování AR-V7 v dosud publikovaných pracích jsou shrnuty v tab. 3. Antonarakis et al v roce 2014 publikovali průlomovou práci ukazující na zásadní význam AR-V7 pro odpověď na ARTA [8]. Celkem bylo do studie zařazeno 31 pacientů léčených enzalutamidem, z nichž pozitivních na AR-V7 bylo 39 %. Obdobně bylo sledováno 31 pacientů léčených abirateronem a z nich 19 % bylo AR-V7+.
Tab. 3. Frekvence AR-V7 variant jako výsledek certifikovaných algoritmů pro testování AR-V7 v cirkulujících nádorových buňkách (CTC). 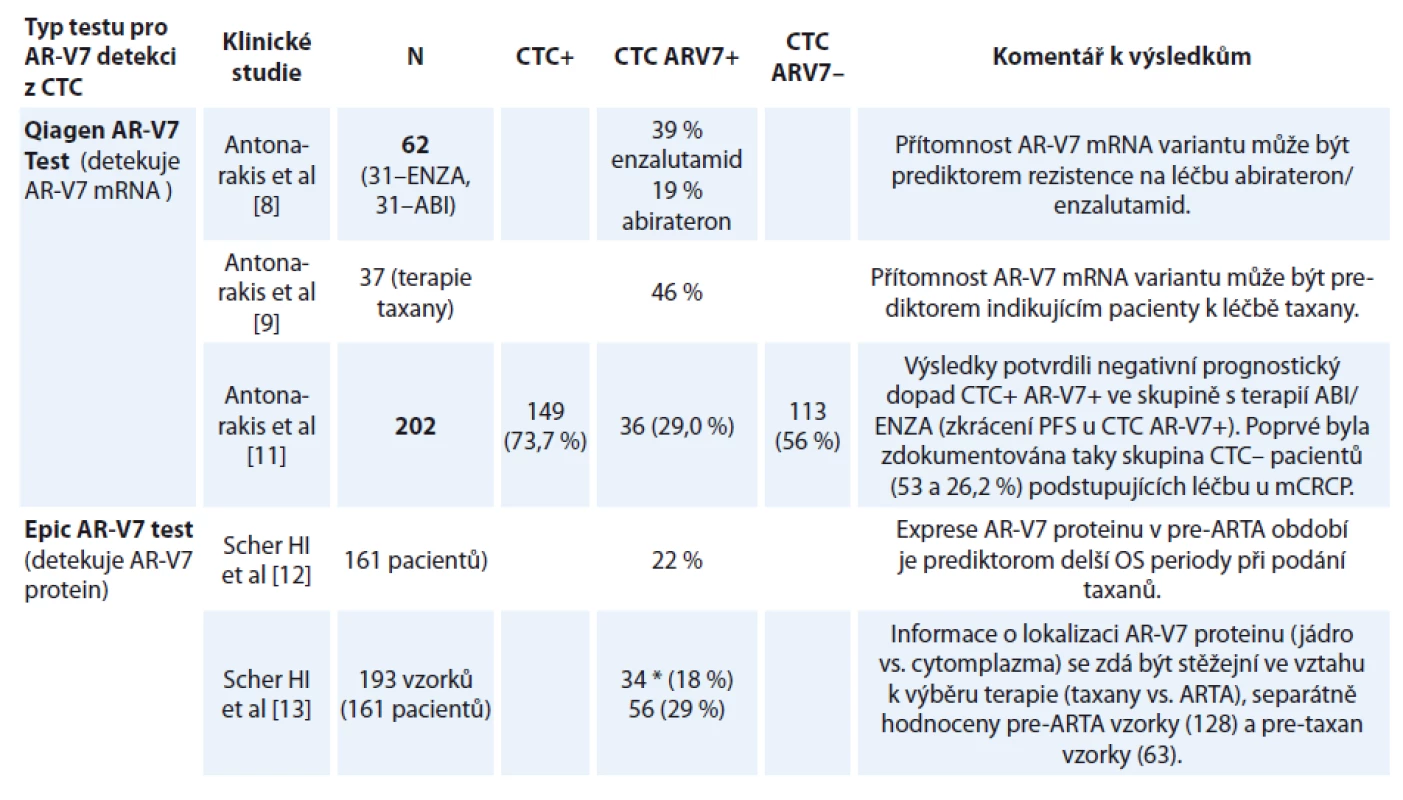
*použité algoritmy zahrnující lokalizaci AR-V7 v buňce CTC – cirkulující nádorové buňky, AR-V7 – varianta androgen receptoru, ENZA – enzalutamid, ABI – abirteron, PFS – přežití bez progrese, OS – celkové přežití, ARTA – androgen-receptor targeting agents Ve skupině léčené enzalutamidem bylo procento odpovědí na léčbu hodnocených pomocí PSA mnohem nižší u AR-V7+ pacientů (0 vs. 53 %, p = 0,004). Tito pacienti měli kratší přežití bez progrese (progression-free survival – PFS) podle PSA (medián 1,4 vs. 6,0 měsíce, p < 0,001) a také celkové přežití (overall survival – OS) (medián 5,5 měsíce vs. medián nedosažen, p = 0,002).
Podobný výsledek byl dosažen u abirateronu – odpověď PSA 0 vs. 68 % (p = 0,004), medián PFS PSA 1,3 měsíce vs. nedosaženo (p < 0,001), medián OS 10,6 měsíce vs. nedosaženo (p = 0,006), ve všech případech jasně lepší výsledky u AR-V7 – pacientů [8].
Do navazující studie bylo přidáno 37 pacientů léčených taxany. Klinické výsledky byly lepší u taxanů ve srovnání s terapií enzalutamidem nebo abirateronem u mužů s CTC+ AR-V7+, zatímco výsledky se u mužů bez přítomného AR-V7 nelišily. U AR-V7+ pacientů byly odpovědi PSA vyšší ve skupině mužů léčených taxany než u mužů léčených enzalutamidem nebo abirateronem (41 % vs. 0 %, p < 0,001). PSA PFS a PFS byly významně delší u mužů léčených taxany (HR 0,19; 95% CI 0,07–0,52 pro PSA PFS; p = 0,001), (HR 0,21; 95% CI, 0,07–0,59 pro PFS, p = 0,003) [9].
Pro prediktivní význam AR-V7 svědčí, že během terapie ARTA může dojít ke konverzi z AR-V7 – do AR-V7+ stavu. Naopak během terapie taxany může dojít k „negativizaci“ AR-V7. Překvapivě došlo ke konverzi do AR-V7 pozitivity i u tří pacientů léčených docetaxelem. Tyto výsledky tedy ukazují na heterogenitu nádoru s náhodnými změnami během terapie taxany a selekčnímu tlaku ke konverzi AR na AR-V7 během terapie ARTA [10]. Nádorové buňky s AR-V7 expresí tedy neztrácejí citlivost na taxany. Během léčby taxany může u pacienta s nádorovými buňkami exprimujícími AR-V7+ dojít k jejich negativizaci, a tedy navození citlivosti na ARTA [10].
Dosud největší klinická studie zahrnující testování CTC na AR-V7 byla publikována opět Antonarakisem et al v roce 2017. Prospektivně bylo sledováno 202 pacientů léčených abirateronem nebo enzalutamidem. Před zahájením léčby bylo provedeno testování AR-V7 v CTC pomocí kombinace imunomagnetické separace (Adnagen) a RT-PCR testu. V této studii se poprvé objevuje skupina pacientů bez detekovatelných CTC (CTC–), tito pacienti byli z předchozích studií vyloučeni. Studie ukázala, že nepřítomnost CTC je signifikantně příznivým prognostickým faktorem. Rozdíly v klinických odpovědích a PFS jsou uvedeny v tab. 4, všechny rozdíly byly statisticky signifikantní [11]. U pacientů s CTC AR-V7+ bylo PFS zkráceno na dobu 4 vs. 10,1 měsíce ve skupine CTC AR-V7–.
Tab. 4. Výsledky studie Antonarakis et al (2017), ukazující prediktivní hodnotu testu na AR-V7 v cirkulujících nádorových buňkách [11]. ![Výsledky studie Antonarakis et al (2017), ukazující prediktivní hodnotu testu na AR-V7 v cirkulujících nádorových buňkách [11].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/906c96d7ae47755cd170ccb7e69da7c8.png)
ARTA – androgen-receptor targeting agents, CTC – cirkulující nádorové buňky, AR-V7 – varianta androgen receptoru , PSA – prostata-specifický antigen, PFS – přežívání bez progrese Skupina z MSKCC používající imunohistochemický test na detekci AR-V7 proteinu v CTC publikovala studii zahrnující 161 pacientů s celkem 193 vzorky odebranými v době rozhodování o změně léčby. V 60,1 % případu šlo o pacienty předléčené ARTA (abirateronem, enzalutamidem nebo apalutamidem).
AR-V7+ CTC byly nalezeny ve 34 vzorcích (18 %), vč. 3 % pacientů před léčbou 1. linie, 18 % před léčbou 2. linie a 31 % u nemocných ve vyšších liniích terapie. Pacienti s CTC AR-V7+ měli oproti CTC AR-V7 – horší výsledky v obou parametrech přežití – medián PFS 2,3 vs. 14,5 měsíce (p < 0,001), medián OS 4,6 měsíce vs. nedosaženo (p < 0,001). Všichni pacienti s detekovanými AR-V7+ CTC byli rezistentní na léčbu ARTA. AR-V7+ pacienti dosahovali na léčbě taxany výrazně lepších výsledků než na ARTA (HR OS 0,24; 95% CI 0,10–0,57; p = 0,035) [12,13].
Přítomnost CTC s jadernou pozitivitou AR-V7 před terapií výrazně predikovala refrakteritu na ARTA, avšak nikoli na taxany. Celkově 12 % vzorků vykazovalo pozitivitu AR-V7 jen v cytoplazmě. Pro cytoplazmatickou pozitivitu AR-V7 korelace s přežitím nebyla prokázána [13]. Toto tvrzení je možné diskutovat na více úrovních. Z pohledu molekulárně biologického je AR standardně funkční (iniciující transkripci) jenom v jádře. Lokalizaci v jádře předchází dimerizace AR receptorů v cytozolu a jejich přesun přes jadernou membránu. Vzhledem k počtu koaktivátorů AR receptorů je důvodné se obávat toho, že dříve nebo později k přesunu AR-V7 do jádra dojde. Z tohoto pohledu může být tedy i přítomnost AR-V7 v cytoplazmě kritická, i když zatím klinickými daty nepodložená.
Mezi publikacemi využívajícími imunohistochemický a RT-PCR test na AR-V7 je sice jistá diskrepance, ale ve výsledku můžeme konstatovat, že pokud jde o závěry týkající se progrese onemocnění a odpovědi na léčbu ve vztahu k AR-V7, jsou tyto práce ve shodě. Celkově je možné pokládat výskyt AR-V7 na úrovni proteinu a mRNA za faktor zhoršující celkovou prognózu mCRPC.
O externí validaci testů na AR-V7 se pokusili Bernemann et al. V kohortě 21 pacientů mCRPC léčených abirateronem nebo enzalutamidem bylo zjištěno, že podskupina šesti pacientů s AR-V7+ CTC měla klinický benefit z léčby abirateronem nebo enzalutamidem. Bernemann et al použili test založený na imunomagnetické separaci (Adnatest, Qiagen) a RT-PCR, ale metodu modifikovali – pro PCR použili jiné primery než Antonarakis et al. Závěrem této práce je, že přítomnost AR-V7 v CTC úplně nepredikuje refrakteritu na abirateron nebo enzalutamid [14]. Je nutné poznamenat, že všechny výše uvedené publikace hodnotily klinické odpovědi na léčbu pomocí hladin PSA.
Přítomnost AR-V7 lze hodnotit nejen v CTC, ale i přímo v metastázách. Efstathiou et al charakterizovali na molekulární úrovni vzorky kostních metastáz u pacientů s mCRPC, u kterých byla indikována léčba enzalutamidem. Prezentovaná data poukazují na to, že AR-V7 exprese v metastázách v kostní dřeni může být prediktivní vzhledem k odpovědi na enzalutamid [15].
Jak testy na úrovni proteinu, tak testy na úrovni mRNA procházejí v současnosti klinickou validací v prospektivních studiích. V rámci testování AR-V7 na CTC – buňkách z důvodu všeobecně vyšší citlivosti molekulárních metod lze podle našeho názoru a při současném stavu vědomostí doporučit spíše metodu detekující AR-V7 na úrovni mRNA. Testování na úrovni mRNA umožňuje přidat v průběhu analýzy CTC další libovolné markery vztahující se k charakteru nádorových buněk, což lze považovat za výhodu.
Testování AR-V7 ve světových guidelines
Doporučení NCCN (The National Comprehensive Cancer Network) uvádí, že zatím neexistují jednoznačné důkazy podporující využití testování AR-V7 pro indikaci léčby ARTA [16]. Konstatuje se zde, že přítomnost AR-V7 v CTC detekovaná z RNA na základě PCR není prediktivním faktorem pro odpověď na taxany, u nichž byl v případě AR-V7 pozitivity léčebný efekt lepší než u ARTA. Doporučení uvádí, že před léčbou mCRPC je prevalence AR-V7+ jen 3 % na základě údajů autorů Scher et al [12], po léčbě ARTA je vyšší a dosahuje 19–34 %. Panel nicméně nedoporučuje testování pacientů po progresi na ARTA, protože považuje sekvenci ARTA-ARTA za málo účinnou a v této situaci doporučuje taxany [16].
Doporučení ESMO (European Society for Medical Oncology) byla naposled aktualizována v roce 2015 a o testování přítomnosti AR-V7 se nezmiňují [17]. Guidelines EAU (European Association of Urology) z roku 2017 se o testování AR-V7 rovněž nezmiňují [18].
Ekonomické analýzy
V podmínkách amerického zdravotnictví byla vypracovaná analýza potenciální úspory nákladů při provádění testů AR-V7 u pacientů s mCRPC před zahájením léčby abirateronem nebo enzalutamidem s vyloučením těchto léků u pacientů s AR-V7+ CTC. Pro srovnání bylo použito současné situace, kdy jsou abirateronem nebo enzalutamidem empiricky léčení všichni pacienti s mCRPC. Autoři zjistili, že k úspoře nákladů dochází, pokud skutečná prevalence AR-V7 dosahuje > 5 % [19].
Závěr a doporučení
Rutinní použití testů na AR-V7 pro výběr léčby nemocných s mCRPC zatím není doporučováno, jelikož se čeká na potvrzující data z prospektivní multicentrické klinické studie. První data by měla být dostupná koncem roku 2017. Slabým místem dosavadních studií je hodnocení odpovědí na léčbu podle PSA. Procento CTC AR-V7+ pacientů v populaci mužů dosud neléčených ARTA je dle dostupných studií relativně nízké na začátku léčby, ale dramaticky stoupá už 3 měsíce po zahájení léčby ARTA. Nicméně AR-V7 test je dostupný v některých zemích Spojených států pro samoplátce právě z důvodu personalizovaného stanovení sekvence léčby.
Z výsledků dosud publikovaných prací vyplývá, že je méně pravděpodobné, aby pacient s CTC AR-V7+ reagoval na léčbu ARTA, přičemž odpověď nemoci na taxany není přítomností AR-V7 ovlivněna [20]. Z tohoto poznatku však zatím nelze vyvodit závěry pro volbu léčby 1. linie v běžné klinické praxi. Důvodem pro opatrnost je zjištění, že účinnost taxanů po předléčení ARTA klesá [21,22], nepoměrně vyšší toxicita léčby taxany ve srovnání s ARTA a faktu, že i menšina AR-V7+ pacientů může být responzivní na terapii ARTA. Pokud je nemocnému s AR-V7+ CTC podána léčba taxany, může být po jejím ukončení opět na tento biomarker vyšetřen, protože u části z nich dochází k negativizaci ARV v CTC.
U pacientů předléčených ARTA se prevalence AR-V7 zvyšuje a dosahuje 19–34 %. Vzhledem k vyšší očekávané prevalenci by v této populaci pravděpodobně bylo testování na AR-V7 ekonomicky přínosné. Procento AR-V7+ pacientů odpovídajících na léčbu ARTA ve 2. linii se zdá být velmi nízké, podle publikace Antonarakise et al pouze 4,8 % (1 pacient z 21) [11]. Proto je možné doporučit testování AR-V7, pokud se u nemocného předléčeného jedním typem ARTA zvažuje léčba jiným lékem z této skupiny.
Prevalence AR-V7 v českých podmínkách není známá a vzhledem k odlišnostem v patofyziologii karcinomu prostaty mezi bílou a černou rasou [23] není vyloučeno, že v české populaci bude prevalence AR-V7 rozdílná oproti populaci americké. Prevalenční studie AR-V7 v české populaci je nutná. V každém případě je testování AR-V7 v CTC u pacientů s mCRPC vstřícným krokem k personalizaci onkologické péče.
Obdrženo: 30. 8. 2017
Přijato: 5. 11. 2017
doc. MUDr. Tomáš Büchler, Ph.D., obdržel honoráře za přednášky a publikace od firem Astellas a Janssen a cestovní grant od firmy Janssen.
Podpořeno MZ ČR – RVO Thomayerova nemocnice – TN 0064190.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Tomáš Büchler, Ph.D.
Onkologická klinika 1. LF UK a Thomayerova nemocnice
Vídeňská 800
140 59 Praha 4
e-mail: tomas.buchler@ftn.cz
Zdroje
1. Richter I, Dvořák J, Hejzlarová V et al. Enzalutamid a abirateron v léčbě metastatického kastračně refrakterního karcinomu prostaty po předchozí chemoterapii. Klin Onkol 2016; 29 (2): 127–132. doi: 10.14735/amko2016127.
2. Liu LL, Xie N, Sun S et al. Mechanisms of the androgen receptor splicing in prostate cancer cells. Oncogene 2014; 33 (24): 3140–3150. doi: 10.1038/onc.2013.284.
3. Watson PA, Chen YF, Balbas MD et al. Constitutively active androgen receptor splice variants expressed in castration-resistant prostate cancer require full-length androgen receptor. Proc Natl Acad Sci U S A 2010; 107 (39): 16759–16765. doi: 10.1073/pnas.1012443107.
4. Wadosky KM, Koochekpour S. Androgen receptor splice variants and prostate cancer: From bench to bedside. Oncotarget 2017; 8 (11): 18550–18576. doi: 10.18632/oncotarget.14537.
5. Antonarakis ES, Armstrong AJ, Dehm SM et al. Androgen receptor variant-driven prostate cancer: clinical implications and therapeutic targeting. Prostate Cancer Prostatic Dis 2016; 19 (3): 231–241. doi: 10.1038/pcan.2016.17.
6. Richter I, Dvořák J, Bartoš J. Možnosti chemoterapie v léčbě karcinomu prostaty. Klin Onkol 2017; 30 (1): 28–33. doi: 10.14735/amko201728.
7. Richter I, Dvořák J, Bartoš J. Sekvence docetaxel–kabazitaxel–enzalutamid ve srovnání se sekvencí docetaxel–enzalutamid u pacientů s metastatickým kastračně rezistentním karcinomem prostaty. Klin Onkol 2017; 30 (4): 289–293. doi: 10.14735/amko2017289.
8. Antonarakis ES, Lu C, Wang H et al. AR-V7 and resistance to enzalutamide and abiraterone in prostate cancer. N Engl J Med 2014; 371 (11): 1028–1038. doi: 10.1056/NEJMoa1315815.
9. Antonarakis ES, Lu C, Luber B et al. Androgen receptor splice variant/ 7 and efficacy of taxane chemotherapy in patients with metastatic castration-resistant prostate cancer. JAMA Oncol 2015; 1 (5): 582–591. doi: 10.1001/jamaoncol.2015.1341.
10. Nakazawa M, Lu C, Chen Y et al. Serial blood-based analysis of AR-V7 in men with advanced prostate cancer. Ann Oncol 2015; 26 (9): 1859–1865. doi: 10.1093/annonc/mdv282.
11. Antonarakis ES, Lu C, Luber B et al. Clinical significance of androgen receptor splice variant-7 mrna detection in circulating tumor cells of men with metastatic castration-resistant prostate cancer treated with first-and second-line abiraterone and enzalutamide. J Clin Oncol 2017; 35 (19): 2149–2156. doi: 10.1200/JCO.2016.70.1961.
12. Scher HI, Lu D, Schreiber NA et al. Association of AR-V7 on circulating tumor cells as a treatment-specific biomarker with outcomes and survival in castration-resistant prostate Cancer. JAMA Oncol 2016; 2 (11): 1441–1449. doi: 10.1001/jamaoncol.2016.1828.
13. Scher HI, Graf RP, Schreiber NA et al. Nuclear-specific AR-V7 protein localization is necessary to guide treatment selection in metastatic castration-resistant prostate cancer. Eur Urol 2017; 71 (6): 874–882. doi: 10.1016/j.eururo.2016.11.024.
14. Bernemann C, Schnoeller TJ, Luedeke M et al. Expression of AR-V7 in circulating tumour cells does not preclude response to next generation androgen deprivation therapy in patients with castration resistant prostate cancer. Eur Urol 2017; 71 (1): 1–3. doi: 10.1016/j.eururo.2016.07.021.
15. Efstathiou E, Titus M, Wen S et al. Molecular characterization of enzalutamide-treated bone metastatic castration-resistant prostate cancer. Eur Urol 2015; 67 (1): 53–60. doi: 10.1016/j.eururo.2014.05.005.
16. NCCN Clinical Practice Guidelines in Oncology. Prostate cancer Version 2.2017. National Comprehensive Cancer Network. [online]. Available from: https: //www.nccn.org/professionals/physician_gls/pdf/prostate.pdf.
17. Parker C, Gillessen S, Heidenreich A et al. Cancer of the prostate: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015; 26 (Suppl 5): v69–v77. doi: 10.1093/annonc/mdv222.
18. Mottet (Chair) N, Bellmunt J, Briers E. Prostate Cancer 2017 Guidelines. European Association of Urology. [online]. Available from: http: //uroweb.org/guideline/prostate-cancer/.
19. Markowski MC, Frick KD, Eshleman JR et al. Cost-savings analysis of AR-V7 testing in patients with metastatic castration-resistant prostate cancer eligible for treatment with abiraterone or enzalutamide. Prostate 2016; 76 (16): 1484–1490. doi: 10.1002/pros.23232.
20. Antonarakis ES, Lu C, Chen Y et al. AR splice variant 7 (AR-V7) and response to taxanes in men with metastatic castration-resistant prostate cancer (mCRPC). JAMA Oncol 2015; 582–591. doi: 10.1001/jamaoncol.2015.1341.
21. van Soest RJ, de Morree ES, Kweldam CF et al. Targeting the androgen receptor confers in vivo cross-resistance between enzalutamide and docetaxel, but not cabazitaxel, in castration-resistant prostate cancer. Eur Urol 2014; 67 (6): 981–985. doi: 10.1016/j.eururo.2014.11. 033.
22. van Soest RJ, van Royen ME, de Morree ES et al. Cross-resistance between taxanes and new hormonal agents abiraterone and enzalutamide may affect drug sequence choices in metastatic castration-resistant prostate cancer. Eur J Cancer 2013; 49 (18): 3821–3830. doi: 10.1016/j.ejca.2013.09.026.
23. Farrell J, Petrovics G, McLeod DG et al. Genetic and molecular differences in prostate carcinogenesis between African American and Caucasian American men. Int J Mol Sci 2013; 14 (8): 15510–15531. doi: 10.3390/ijms140815 510.
24. Lokhandwala PM, Riel SL, Haley L et al. Analytical validation of androgen receptor splice variant 7 detection in a Clinical Laboratory Improvement Amendments (CLIA) laboratory setting. J Mol Diagn 2017; 19 (1): 115–125. doi: 10.1016/j.jmoldx.2016.08.003.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2018 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Kurkumin (Kurkumovník dlouhý – Curcuma longa) jako podpůrný fytoterapeutický prostředek v onkologii
- Kontroverze protonové terapie u nádorů centrálního nervového systému
- Protinádorovou léčbou indukované změny renálních funkcí u pacientů s tumory – update aktuálních poznatků
- Editorial
- Současné postavení checkpoint inhibitorů v léčbě nádorů jícnu a žaludku – přehled studií
- Nemelanómové zhubné nádory kože – klinicko-patologická štúdia pacientov s bazocelulárnym karcinómom a skvamocelulárnym karcinómom
- Chirurgická léčba ampulárního adenokarcinomu – zkušenosti jednoho centra a přehled literatury
- Pacientka se třemi EGFR mutacemi – postupný rozvoj rezistence na předchozí cílenou léčbu
- Stopkované laloky jako jedna z možností rekonstrukce hlavy a krku
-
Organizace a hodnocení kvality onkologické péče v České republice
Věstník Ministerstva zdravotnictví České republiky 2017; 13: 83–92 - Aktuality z odborného tisku
- prof. MUDr. Juraj Švec, DrSc. (16. 1. 1938–17. 2. 2017) K nedožitým 80. narodeninám emeritného prednostu Onkologickej kliniky LF UK v Bratislave
- Testování varianty androgenového receptoru AR-V7 pro výběr pacientů s kastračně refrakterním metastazujícím karcinomem prostaty k léčbě novými hormonálními léky
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chirurgická léčba ampulárního adenokarcinomu – zkušenosti jednoho centra a přehled literatury
- Kurkumin (Kurkumovník dlouhý – Curcuma longa) jako podpůrný fytoterapeutický prostředek v onkologii
- Stopkované laloky jako jedna z možností rekonstrukce hlavy a krku
- Současné postavení checkpoint inhibitorů v léčbě nádorů jícnu a žaludku – přehled studií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



