-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKurkumin (Kurkumovník dlouhý – Curcuma longa) jako podpůrný fytoterapeutický prostředek v onkologii
Curcumine (Turmeric – Curcuma longa) as a Supportive Phytotherapeutic Treatment in Oncology
Background:
Turmeric (Curcuma longa) is mainly known as a constituent of curry spice. The main active ingredient, responsible for most of its biological effects, is the polyphenol curcumin.Aim:
This review aims to provide a comprehensive overview of studies evaluating the benefits of therapeutic curcumin use in oncology. Preclinical studies provide information on the mechanism of action and potential toxicity of curcumin. Clinical studies have so far focused mainly on safety, pharmacokinetics, and determination of the optimal dose of curcumin. However, there are a growing number of trials evaluating the anti-tumor and oncopreventive effects of curcumin and its effect in alleviating the adverse effects of chemotherapeutics and radiotherapy. So far, the results have been optimistic and should encourage further research. The main problem associated with curcumin treatment is its low oral bioavailability, which means it must administrated at high doses to be effective. Therefore, curcumin is more appropriate as a local treatment for areas such as the intestine, mucous membrane, or the skin, where there is no need for a strong systemic effect. Curcumin has a good safety profile when used up to several grams. Curcumin can also be used as a food supplement for people at increased risk of oncological disease, such as heavy smokers or those with pre-cancerous lesions. Due to its good safety profile, curcumin can be recommended to oncological patients who request a natural treatment.Key words:
phytotherapy – drug-herb interactions – cancer – adverse effects – curcumine – turmeric – Curcuma longaSubmitted:
20. 7. 2017Accepted:
25. 9. 2017
This publication was written at Masaryk University as part of the project „Behavioural psychopharmacology and pharmacokinetics in preclinical drug research“, number MUNI/A/1132/2017 with the support of the Specific University Research Grant, as provided by the Ministry of Education, Youth and Sports of the Czech Republic in the year 2018.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Autoři: Z. Frassová; J. Rudá-Kučerová
Působiště autorů: Farmakologický ústav, LF MU, Brno
Vyšlo v časopise: Klin Onkol 2018; 31(1): 15-23
Kategorie: Přehled
doi: https://doi.org/10.14735/amko201815Souhrn
Východiska:
Kurkumovník dlouhý (Curcuma longa) je rostlina, která je známá především jako součást kari koření. Hlavní obsahovou látkou zodpovídající za většinu biologických účinků je polyfenol kurkumin.Cíl:
Tato přehledová práce má za cíl poskytnout ucelený obraz o výsledcích studií, které se věnují léčebnému využití kurkuminu v onkologii. Preklinické studie poskytují informace o mechanizmech účinku a případné toxicitě kurkuminu. Klinické studie jsou zatím zaměřeny především na bezpečnost, farmakokinetiku a stanovení optimální dávky kurkuminu, narůstá ovšem i počet studií, které hodnotí protinádorové a onkopreventivní účinky kurkuminu, případně podpůrný účinek při řešení nežádoucích účinků chemoterapeutik a radioterapie. Jejich výsledky jsou optimistické a povzbuzují k dalšímu výzkumu. Největším problémem léčby kurkuminem je jeho nízká biologická dostupnost, ze které vyplývá nutnost použití vysokých dávek. Z tohoto důvodu se jeví jako nejvýhodnější využít lokálního působení kurkuminu ve střevě, na sliznicích nebo na kůži, tedy tam, kde odpadá nutnost systémového působení. Současné poznatky vyzdvihují zejména bezpečnost kurkuminu, a to až do dávek několika gramů. Dle dostupných informací lze užívání kurkuminu jako doplňku stravy doporučit lidem, kteří mají zvýšené riziko onkologického onemocnění, jako jsou např. silní kuřáci, nebo pacientům s prekancerózními lézemi. Vzhledem k již zmíněné bezpečnosti je možno kurkumin doporučit i onkologickým pacientům, kteří vyžadují přírodní léčbu.Klíčová slova:
fytoterapie – interakce – nádorová onemocnění – nežádoucí účinky – kurkumin – kurkuma – Curcuma longaÚvod
Kurkumovník dlouhý
Kurkumovník dlouhý (Curcuma longa) z čeledi zázvorníkovitých (Zingiberaceae) patří mezi nejslibnější rostliny z hlediska využití v medicíně a je předmětem intenzivního zkoumání. Pochází z jižní Asie, jeho největším producentem je Indie. Používanou částí je kořen a oddenek, který je po vysušení a rozemletý na prášek známý jako žluté koření kurkuma, součást kari koření. Jeho použití v léčitelství má bohatou historii, tradičně se používá v ajurvédské medicíně [1]. Dle EMA (European Medicines Agency) se v současnosti používá jako tradiční léčivo pro léčbu dyspepsie, zejména biliární etiologie [2].
Účinná látka se získává extrakcí z oddenku, jedná se o polyfenol kurkumin (diferuloylmetan ~77 %), který je spolu s demetoxykurkuminem (~18 %) a bisdemetoxykurkuminem (~5 %) součástí směsi kurkuminoidů [3]. Obsah kurkuminu v sušeném oddenku se pohybuje mezi 3 a 5 % [2].
Biologické účinky kurkuminu potvrzené v preklinických studiích
Preklinické in vitro a in vivo studie prokázaly mnoho biologických účinků kurkuminu potenciálně využitelných v medicíně. Patří mezi ně protizánětlivý účinek, ovlivnění oxidačních procesů, zásah do metabolizmu xenobiotik, cytotoxicita, indukce apoptózy, antiangiogenní a antiadhezivní efekt nebo imunomodulační účinek [4].
Protizánětlivý účinek kurkuminu je komplexní. Spočívá v zásahu do metabolizmu kyseliny arachidonové, která je prekurzorem pro syntézu eikosanoidů (prostaglandiny, prostacykliny, tromboxany a leukotrieny), na několika úrovních. Kurkumin inhibuje fosfolipázu A2, která uvolňuje kyselinu arachidonovou z buněčné membrány a zároveň inhibuje aktivitu a expresi cyklooxygenázy-2 a 5-lipoxygenázy. Z následné snížené produkce tromboxanu vyplývá i antiagregační a fibrinolytický účinek kurkuminu, který byl potvrzen in vitro [1]. Mezi další mechanizmy protizánětlivého účinku kurkuminu patří snížení produkce tumor nekrotizujícího faktoru α (TNFα), interleukinu 1β (IL-1β) a snížení aktivace nukleárního faktoru κB (NF-κB), který se podílí jako transkripční faktor na tvorbě dalších prozánětlivých látek. TNFα, IL-1β a NF-κB se kromě jiného podílejí také na indukci exprese genu pro inducibilní syntázu oxidu dusnatého (iNOS), což je molekula, která se může podílet na karcinogenezi. Protizánětlivé účinky kurkuminu se mohou uplatnit při prevenci nebo léčbě onkologického onemocnění, protože jedním ze znaků maligního nádoru je právě zánět.
Vliv kurkuminu na oxidační stres je dvojí – na jedné straně výzkumy potvrzují jeho antioxidační působení, na straně druhé se také mluví o jeho pro-oxidačním účinku, kterým poškozuje nádorové buňky. To, zda bude kurkumin působit anti-nebo prooxidačně, zřejmě závisí na jeho koncentraci a na vlastnostech prostředí, např. na koncentraci vápenatých iontů [5]. V současné době již probíhají studie, které tento účinek využívají pro prevenci karcinogeneze ve střevě nebo na sliznicích dutiny ústní.
Mezi účinky kurkuminu patří i ovlivnění enzymů účastnících se 1. a 2. stupně metabolických reakcí. Inhibice cytochromu P450 (CYP450) může být jedním z mechanizmů, kterým kurkumin působí proti karcinogenezi, inhibice CYP450 totiž může zamezit konverzi prokarcinogenů na karcinogeny. Toto bylo potvrzeno ve studii na kultuře lidských epiteliálních buněk karcinomu prsu, kde kurkumin inhiboval aktivaci karcinogenu dimetylbenzantharacenu zprostředkovanou cytochromem 1A1, následkem čehož došlo ke snížení toxicity daného karcinogenu [6]. Dalším následkem však může být snížené odbourávání léčiv a jejich vyšší toxicita. Naopak u enzymu druhého stadia metabolizmu glutathion S-transferázy (GST) bylo v několika studiích na hlodavcích zjištěno, že kurkumin aktivitu tohoto enzymu zvyšuje. Indukce GST je výhodná z hlediska inaktivace karcinogenů, ale jejím výsledkem může být také rezistence nádorových buněk na cytostatika [4].
Pro potenciální protinádorový účinek je významná i cytotoxicita kurkuminu. In vitro byl potvrzen cytotoxický účinek na několika maligních buněčných liniích. Inhibice proliferace, indukce apoptózy a kumulace buněk ve G2/M fázi buněčného cyklu byla prokázána na buněčných kulturách kolorektálního karcinomu (colorectal cancer – CRC), karcinomu prsu, jater, ledvin, melanomu, lymfoidu, myeloidu a dalších [4]. Studie na kultuře buněk CRC demonstruje jeden z možných mechanizmů, kterým kurkumin zasahuje do růstu maligní buňky. Prostřednictvím stimulace aktivity PPAR-γ (peroxisome proliferator-activated receptor gamma) potlačuje genovou expresi cyklinu D1 a EGFR (epidermal growth factor receptor). Cyklin D1 hraje klíčovou roli v G1/S fázi buněčného cyklu a EGFR se podílí na řadě buněčných procesů důležitých pro další růst a metastazování nádoru [7].
Prokázána byla také indukce apoptózy působením kurkuminu na myších embryonálních fibroblastech, buňkách sarkomu a na lidských buňkách CRC, ledvinného a hepatocelulárního karcinomu. Mezi pozorované znaky apoptózy patřilo svraštění buněk, kondenzace chromatinu a fragmentace DNA [8]. Dalším mechanizmem, kterým kurkumin může indukovat apoptózu nádorových buněk, je ovlivnění mitochondriální membrány. V in vitro studii na mitochondriích jaterních buněk potkana bylo zjištěno, že kurkumin zvyšuje propustnost mitochondriální membrány, což je následováno ztrátou membránového potenciálu, zduřením mitochondrie a zastavením syntézy ATP (adenozin trifosfát) [9].
Účinek kurkuminu byl zkoumán i v souvislosti s růstem a metastazováním již vzniklého nádoru. Působí totiž proti angiogenezi tím, že inhibuje bFGF (basic fibroblast growth factor) [10] a některé metaloproteinázy [11]. Dále bylo prokázáno, že kurkumin ovlivňuje i další proteiny, které jsou důležité pro maligní charakter nádoru, zejména se jedná o molekuly důležité pro růst nádoru, jako je TNFα a IL-1 [12], dále adhezivní molekuly ICAM-1 (intercellular adhesion molecule 1), VCAM-1 (vascular cell adhesion molecule 1) a E-selectin [13].
Kurkumin má také imunomodulační efekt. Působí jako aktivátor makrofágů a NK (natural killer) buněk [14] a moduluje také funkci lymfocytů ve smyslu potlačení jejich funkce [15].
Studie naznačují, že kurkumin může zmírnit nežádoucí účinky (NÚ) onkologické léčby a zároveň zesílit její protinádorový účinek. Na kultuře buněk lidského karcinomu prsu byl prokázán synergizmus účinků kurkuminu a chemoterapeutika paklitaxelu [16]. Podávání kombinace cisplatiny a kurkuminu potkanům s karcinomem mléčné žlázy se projevilo nejen zvýšením protinádorového účinku cisplatiny, ale také zmírněním jejího nefrotoxického působení [17]. Antioxidační působení je možné využít i pro prevenci kardiotoxicity způsobené adriamycinem. Ve studii na potkanech, kteří dostávali adriamycin, kurkumin zmírnil jeho akutní kardiotoxicitu. V experimentální skupině byla nižší tepová frekvence, méně ST elevací a nižší hladina sérové laktátdehydrogenázy a kretinkinázy [18].
Všechny výše uvedené mechanizmy naznačují, že kurkumin disponuje protinádorovými účinky a že je na místě zabývat se jeho účinky i dále v klinických studiích.
Účinná dávka a farmakokinetika kurkuminu
Farmakokinetické charakteristiky kurkuminu nejsou výhodné. Kurkumin je obecně špatně rozpustný ve vodě, podléhá velkému „first pass“ efektu jater a do systémového oběhu se tak dostává jenom velmi malá část účinné látky [3]. Proto je vhodné jeho podávání v upravené formě, která zvýší jeho biologickou dostupnost. Toho je možné docílit několika způsoby. Například přidáním 20 mg piperinu, který inhibuje jaterní a střevní glukuronidaci, ke 2 g kurkuminu se u zdravých dobrovolníků zvýšila systémová dostupnost o 2 000 % [19]. Zvýšená biologická dostupnost je dosažitelná i pomocí lipidových směsí kurkuminu, a to u zdravých lidí i u lidí s osteosarkomem [20]. Dostatečná koncentrace kurkuminu v systémovém řečišti je detekovatelná i po jeho podání ve formě nanočástic [21]. Kurkumin se obvykle podává per os, dávka není přesně stanovena a závisí i od konkrétního podávaného preparátu, ale obvykle se pohybuje v jednotkách gramů [22], např. v klinické studii na pacientkách s karcinomem prsu se udává maximální tolerovatelná dávka 8 g denně [23]. Obecně je kurkumin považován za bezpečné a dobře snášené léčivo. Studie na 34 zdravých dobrovolnících prokázala bezpečnost per os podávaného kurkuminu, a to do dávky 12 g denně. Pozorované NÚ byly málo významné – bolest hlavy, průjem, vyrážka a nebyly dávkově závislé [24].
Pro začlenění kurkuminu do léčby je důležité stanovení dávkování na základě klinických studií pro každou indikaci zvlášť, rozhodující je také volba správné lékové formy kurkuminu, která zabezpečí jeho systémovou, popř. lokální dostupnost.
Klinické studie hodnotící protinádorový účinek kurkuminu
Většina klinických studií na onkologických pacientech hodnotí především bezpečnost a farmakokinetické vlastnosti kurkuminu. Nicméně objevují se i studie, které se zaměřují na jeho účinek ve smyslu jeho použití jako podpůrné protinádorové terapie. Přehled těchto klinických studií uvádí tab. 1.
Tab. 1. Přehled klinických studií hodnotících protinádorový účinek kurkuminu. 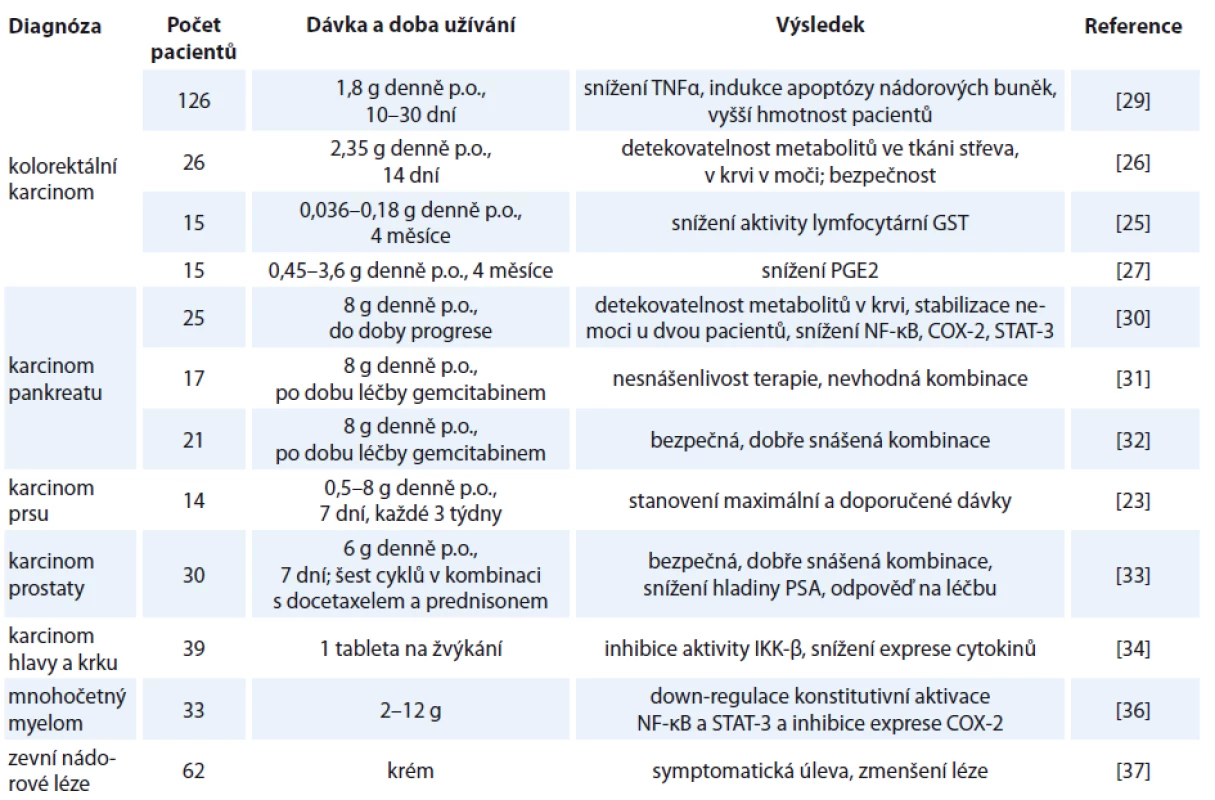
TNFα – tumor nekrotizujícího faktoru α, GTS – glutathion S-transferázy, NF-κB – nukleární faktor kappa B, COX-2 – cyklooxygenáza-2, STAT-3 – signální transduktor a aktivátor transkripce 3, PSA – prostatický specifický antigen V případě CRC bylo provedeno několik klinických studií zaměřených na určení dávkování, bezpečnosti a kinetiky kurkuminu. Z těchto studií vyplývá, že při per os podání se kurkumin dostává do střevní tkáně v množství, které může mít biologický účinek [25], a je v ní detekovatelný i 40 hod po jeho posledním podání. Prokázána byla také bezpečnost a dobrá tolerance kurkuminu až do dávky 3,6 g denně, u některých pacientů byla ale léčba provázena slabými gastrointestinálními obtížemi [26,27].
Další výsledky se zaměřují na protinádorové účinky kurkuminu. Při podávání kurkuminu 15 pacientům s CRC refrakterním na standardní léčbu došlo u 5 ke stabilizaci nemoci po dobu 4 měsíců, u 1 bylo naměřeno snížení hladiny karcinoembryonálního antigenu. U 3 pacientů, kteří dostávali nejnižší dávku kurkuminu, došlo také ke snížení aktivity lymfocytární GST, která se může podílet na rezistenci vůči chemoterapeutikům [28]. Není ale jasné, jestli za snížení aktivity může právě podávání kurkuminu, o kterém se spíše předpokládá, že aktivitu GST zvyšuje [4]. V další podobné studii se změna aktivity GST neprokázala. Autoři této studie udávají snížení hladiny prostaglandinu E2, který ukazuje na aktivitu cyklooxygenázy-2, kurkumin zde tedy působil protizánětlivě [27]. Randomizovaná, placebem kontrolovaná studie na 126 pacientech léčících se s CRC, ve které byl kurkumin experimentální skupině podáván v dávce 360 mg 3× denně po dobu 10–30 dní, ukazuje slibné výsledky. Pacienti užívající kurkumin měli vyšší tělesnou váhu a nižší hladinu sérového TNFα. Ve vzorcích nádorů z experimentální skupiny byla nalezena zvýšená exprese proapoptotických faktorů p53, BAX, nižší hladina antiapoptotického faktoru bcl-2 a vyšší podíl apoptotických buněk. Zdá se tedy, že kurkumin má nejen protinádorové účinky, ale zlepšuje i celkový tělesný stav pacienta [29].
Účinek kurkuminu je zkoumán i v souvislosti se závažným karcinomem pankreatu. Klinická studie provedená na 25 pacientech s pokročilým karcinomem pankreatu prezentuje vícero výsledků. Pacienti dostávali 8 g kurkuminu per os denně po dobu 8 týdnů a současně jim nebyla podávaná chemoterapie ani radioterapie, jenom podpůrná terapie. Pacienti, u kterých po 8 týdnech nedošlo k progresi onemocnění, pokračovali v léčbě kurkuminem. V krvi pacientů byly detekované metabolity kurkuminu ve formě sulfátů a glukuronidů v nízkých, stabilních koncentracích, což potvrzuje jeho nízkou biologickou dostupnost. U dvou pacientů byla pozorována odpověď na léčbu, u jednoho z nich došlo ke stabilizaci nemoci na více než 18 měsíců. Druhý pacient měl krátkou epizodu nádorové regrese (o 73 %) provázenou zvýšenou sérovou hladinou cytokinů, pravděpodobně způsobenou rozpadem nádoru. V mononukleárních buňkách získaných z periferní krve pacientů byla prokázána down-regulace exprese prozánětlivých působků NF-κB, COX-2 a down-regulace fosforylace STAT-3 (signal transducer and activator of transcription 3), který se podílí na karcinogenezi a chemorezistenci. Nicméně laboratorní odpověď na kurkumin ve většině případů nekorelovala s klinickou odpovědí [30]. Výsledky dalších studií, které se zabývaly kombinací kurkuminu s léčbou karcinomu pankreatu, jsou protichůdné. Autoři jedné ze studií udávají, že současné podání kurkuminu a gemcitabinu je problematické, protože při dávce 8 g kurkuminu denně dochází ke zvýšení incidence jeho NÚ ve formě zažívacích obtíží. Při redukci dávky na 4 g denně jsou pak koncentrace kurkuminu v krvi příliš nízké na to, aby mohlo dojít k potenciálnímu protinádorovému účinku kurkuminu [31]. Jiná klinická studie, která se kombinací gemcitabinu a kurkuminu zabývala, ale žádné zvýšení četnosti zažívacích nebo jiných obtíží při dávce 8 g kurkuminu nezaznamenala. Autoři se domnívají, že kombinace chemoterapie na bázi gemcitabinu a kurkuminu je bezpečná a dobře tolerovaná [32]. Vysoké dávky kurkuminu jsou nutné kvůli jeho již uvedené malé biologické dostupnosti. Gastrointestinální obtíže, které jsou při užívaní tak vysokých dávek pozorovány, by mohly být vyřešeny použitím nových forem kurkuminu s lepší biologickou dostupností. Podávané dávky kurkuminu by pak mohly být mnohem nižší a lépe tolerovatelné a zároveň stejně nebo více účinné.
Kombinace kurkuminu a chemoterapeutika byla studována i v souvislosti s pokročilým karcinomem prsu. V této klinické studii byla stanovená maximální tolerovaná dávka kurkuminu v kombinaci s docetaxelem na 8 g, doporučovaná dávka na 6 g denně. Zároveň se kombinace docetaxelu a kurkuminu v této indikace jeví jako výhodná, protože u většiny pacientek došlo ke stabilizaci nemoci nebo k částečné odpovědi na léčbu. Kvůli absenci kontrolní skupiny (docetaxel bez kurkuminu) v této studii ale chybí důkazy o tom, jestli se kurkumin skutečně podílel na protinádorovém účinku [23].
V pilotní studii na 30 pacientech s kastračně rezistentním karcinomem prostaty se zvyšující se hladinou prostatického specifického antigenu (PSA) byla zkoušena kombinace docetaxelu, prednisonu a kurkuminu. Tato léčba byla pacienty dobře tolerovaná, bez NÚ vážících se na kurkumin. U 59 % pacientů bylo dosaženo snížení hladiny PSA nejméně na polovinu předchozí hodnoty, u 14 % pacientů došlo k úplné normalizaci hladiny tohoto markeru. Všech 15 pacientů, u kterých byla přítomna radiologicky hodnotitelná nemoc, z léčby profitovalo, u 6 byla prokázána parciální odpověď na léčbu a u 9 se nemoc stabilizovala [33].
Po podání kurkuminu pacientům s karcinomem hlavy a krku se působení kurkuminu projevilo inhibicí aktivity IκK-β (inhibitor of nuclear factor kappa-B kinase β), který je zodpovědný za funkci prozánětlivého působku NF-κB. Došlo také ke snížení hladiny cytokinů jako IL-2, IL-10, 12p70, interferonu γ, GM-CSF (granulocytární makrofágový colony stimulating factor) a TNFα. Jedná se o další důkaz protizánětlivého účinku kurkuminu [34].
Kurkumin byl použit jako nová léčba i ve studii týkající se dětských onkologických pacientů s relapsem nádoru centrální nervové soustavy (CNS). Na zá-kladě morfoproteomické analýzy bioptického vzorku nádoru byla každému z osmi pacientů vybrána „léčba na míru“ a u jednoho pacienta s multiformním glioblastomem míchy byl součástí léčebné terapie právě kurkumin spolu s chemoterapeutikem prokarbazinem. Kurkumin byl vybrán na základě přítomnosti p-NF-κB v nádorové tkáni, jehož aktivace je kurkuminem inhibována. Nicméně u pacienta došlo k nádorové progresi a léčba pokračovala výměnou za metformin spolu s vinblastinem [35].
Podávání kurkuminu pacientům s mnohočetným myelomem v dávkách 2, 4, 6, 8 nebo 12 g denně jako jediného léčiva nebo v kombinaci s piperinem vedlo k down-regulaci konstitutivní aktivace NF-κB a STAT-3 a k inhibici exprese COX-2 u většiny pacientů. Zdá se tedy, že kurkumin ovlivňuje tyto transkripční faktory i u lidí [36].
Účinek kurkuminu byl zkoumán i při jeho topické aplikaci ve formě alkoholového roztoku nebo masti na zevní nádorové léze. Pozorována byla výrazná úleva od symptomů. Většina pacientů pociťovala redukci zápachu a svědění léze, v 70 % případů měl kurkumin vysušující efekt a u 10 % pacientů dokonce došlo k zmenšení zevního nádorového ložiska a jeho bolestivosti. Tato studie pochází z roku 1987, ale zdá se, že zevní použití kurkuminu by mohlo být pro onkologické pacienty přínosné a je vhodné, aby tento výzkum pokračoval [37].
Z uvedených studií vyplývá, že kurkumin je bezpečnou látkou se slibným protinádorovým účinkem, který je ale nutno dále hodnotit. Jako vhodné se jeví rozšířit výzkum na další možné indikace.
Klinické studie hodnotící onkopreventivní účinek kurkuminu
Využití kurkuminu jako látky, která zabraňuje vzniku nádorového onemocnění, se věnuje poměrně velké množství klinických studií. Některé z nich hodnotí protektivní efekt kurkuminu při působení karcinogenů, jako je arsen nebo tabákový kouř, jiné se zaměřují na konkrétní prekancerózní léze. Přehled dostupných klinických studií je uveden v tab. 2.
Tab. 2. Přehled klinických studií hodnotících onkopreventivní účinek kurkuminu. 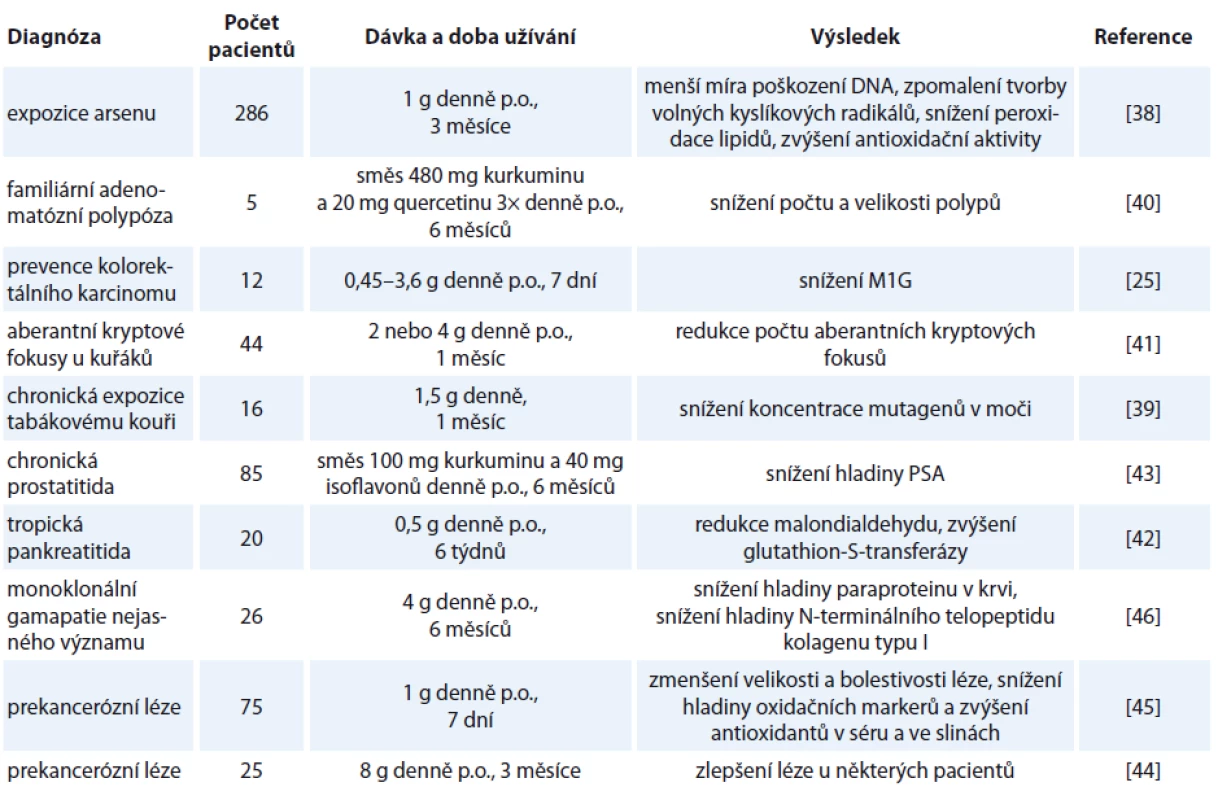
PSA – prostatický specifický antigen Více než 40 milionů lidí žijících v Západním Bengálsku v Indii má zvýšené riziko rozvoje onkologického onemocnění, protože podzemní voda je zde kontaminována arsenem, který je známým karcinogenem způsobujícím rakovinu kůže, plic, močového měchýře, ledvin a jater. Rozvoj onemocnění může přitom nastat i za více než 20 let od expozice. Karcinogenita arsenu spočívá zejména v produkci volných kyslíkových radikálů, které poškozují DNA, proteiny a lipidy. Z lidí, kteří žijí v této oblasti a jsou chronicky exponováni arsenu, bylo vybráno 286 dobrovolníků, polovině byl podáván per os kurkumin s piperinem v dávce 500 mg 2× denně a druhé polovině placebo. Po 3 měsících byla ve skupině lidí užívacích kurkumin zjištěna nižší míra poškození DNA v lymfocytech z periferní krve, zpomalená produkce volných kyslíkových radikálů a vyšší aktivita antioxidačních systémů oproti skupině užívající placebo a oproti výchozím hodnotám naměřeným na začátku experimentu [38]. Pro potenciální onkopreventivní účinek kurkuminu svědčí i studie prováděná na 13 chronických kuřácích, kteří jej užívali denně v množství 1,5 g po dobu 1 měsíce. Po skončení léčby došlo k výraznému poklesu exkrece mutagenů močí. U kontrolní skupiny šesti nekuřáků, kteří kurkumin užívali ve stejném množství, se snížení exkrece mutagenů neprokázalo [39]. Z těchto studií vyplývá, že preventivní užívání kurkuminu může mít pozitivní vliv na zdraví lidí, kteří jsou vystaveni působení rakovinotvorných látek.
Díky prokázané dobré dostupnosti kurkuminu ve střevní tkáni po per os podání se víceré studie věnují využití kurkuminu pro prevenci CRC. Jedním z předpokládaných mechanizmů preventivního působení kurkuminu je antioxidační efekt, který byl potvrzen pomocí DNA aduktu M1G vznikajícího reakcí malondialdehydu a deoxyguaninu při oxidačním stresu. Po týdenním podávání kurkuminu pacientům s diagnostikovaným CRC v dávce 3,6 g denně se koncentrace M1G v následně resekované nádorové tkáni výrazně snížila. Ve zdravé tkáni ale ke snížení M1G nedošlo. Autoři se domnívají, že antioxidační účinek kurkuminu může být využit pro prevenci CRC u pacientů ve zvýšeném riziku, např. pro familiární adenomatózní polypózu (FAP) [25].
FAP je autozomálně dominantní onemocnění charakterizované mnohočetným výskytem polypů v oblasti kolorekta a téměř jistým vznikem CRC. Nesteroidní antiflogistika a inhibitory COX-2 způsobují regresi polypů, ale tato léčiva jsou zatížena vysokou mírou NÚ. Studie na pěti pacientech s FAP, kteří prodělali kolektomii, ale zůstalo jim rektum (čtyři pacienti) nebo byl vytvořen ileoanální pouch (jeden pacient), hodnotila vliv směsi kurkuminu a přírodního antioxidantu quercetinu na počet a velikost polypů ve zbývající části kolorekta. Po půl roce užívání této směsi se počet i velikost polypů snížily o přibližně 60 % oproti hodnotám zjištěným před začátkem terapie [40]. Preventivní působení kurkuminu vůči rozvoji CRC potvrzuje i další studie, ve které byly 4 g kurkuminu podávány kuřákům, kteří měli koloskopicky potvrzené aberantní kryptové fokusy v tlustém střevě. Po 30 dnech terapie došlo ke snížení počtu těchto prekancerózních lézí až o 40 %. Je možné, že terapie kurkuminem je vhodná právě u pacientů, kteří mají patologii ve střevě, protože tu odpadá problém jeho nízké biologické dostupnosti [41].
Chronická pankreatitida, podobně jako jiná chronická zánětlivá onemocnění, může progredovat až do karcinomu. Kombinace 500 mg kurkuminu s 5 mg piperinu snižuje lipidovou peroxidaci a zvyšuje hladinu GST u pacientů s tropickou pankreatitidou. Je tedy možné, že touhle cestou kurkumin může působit proti karcinogenezi v pankreatu [42].
Kurkumin se může uplatnit i při prevenci rozvoje karcinomu prostaty, který se běžně detekuje pomocí měření hladiny PSA. Zvýšená hladina tohoto markeru může taky odrážet přítomnost zánětu v prostatě, který je při chronickém průběhu jedním z rizikových faktorů vzniku karcinomu. V klinické, dvojitě zaslepené, placebem kontrolované studii na 85 pacientech s elevovaným PSA, ale bez přítomnosti neoplazie v bioptickém vzorku z prostaty byl zkoumán potenciální preventivní účinek směsi kurkuminu a isoflavonů ze sóji. Po 6 měsících podávání směsi byl zjištěn signifikantní pokles PSA, ale jenom u pacientů, u kterých byla výchozí hladina PSA > 10 ng/ml. Autoři této studie se domnívají, že užívání kurkuminu a isoflavonů ze sóji může být prospěšné pro pacienty, kteří ještě nemají karcinom prostaty, ale mají zvýšené PSA, a tedy jim hrozí riziko rozvoje nádoru [43].
Chemopreventivní účinek kurkuminu byl posuzován i ve studii na pacientech, u kterých byla přítomná nějaká slizniční prekancerózní léze. Těmto pacientům byl podáván kurkumin per os po dobu 3 měsíců v různé dávce od 500 mg do 12 g, v závislosti na toleranci léčby. Měřeny byly farmakokinetické charakteristiky kurkuminu a také jeho biologická aktivita. Při srovnání bioptických vzorků léze před a po léčbě bylo zjištěno, že u jednoho ze 4 pacientů s cervikální intraepiteliální neoplazií a u 1 ze 7 pacientů s orální leukoplakií se rozvinula malignita. Histologické zlepšení prekancerózní léze bylo pozorováno u 2 ze 7 pacientů s orální leukoplakií, u 1 ze 6 pacientů s intestinální metaplazií žaludku, u 1 ze 2 pacientů s nedávno resekovaným nádorem močového měchýře, u 1 ze 4 pacientů s cervikální intraepiteliální neoplazií a u 2 ze 6 pacientů s Bowenovou nemocí [44]. Podobná studie hodnotila nejen přímý vliv kurkuminu na prekancerózní léze, ale i hladinu markerů oxidace v séru a ve slinách, konkrétně se jednalo o malondialdehyd, který ukazuje na míru peroxidace lipidů, 8-hydroxydeoxyguanosin, který vzniká při rozpadu DNA, a antioxidanty vitamin C a E. Účastnily se jí tři skupiny po 25 pacientech s orální leukoplakií, submukózní fibrózou a lichen planus. Výsledkem studie bylo zmenšení bolestivosti i velikosti léze a zlepšení otevírání úst u pacientů se submukózní fibrózou. Došlo také ke snížení hladiny malondialdehydu a 8-hydroxydeoxyguanosinu a ke zvýšení hladiny vitamínů ve slinách a séru [45]. Zdá se tedy, že potenciální onkopreventivní účinek kurkuminu se týká i pacientů, kteří mají prekancerózní lézi v oblasti dutiny ústní anebo na sliznicích v jiných částech těla.
V hematoonkologii bylo působení kurkuminu zkoumáno v souvislosti s monoklonální gamapatií nejasného významu, která může progredovat až v mnohočetný myelom. U 1/2 pacientů, u kterých byla sérová hladina paraproteinu na začátku terapie > 20 g/l, došlo k jeho poklesu o 12–30 %. Navíc 27 % pacientů mělo v moči o 25 % nižší koncentraci osteoresorpčního markeru N-terminálního telopeptidu kolagenu typu I [46]. Zdá se tedy, že kurkumin může alespoň částečně blokovat osteoresorpci a snižovat tak pravděpodobnost fraktur.
Všechny tyto studie potvrzují, že kurkumin disponuje vlastnostmi, které do určité míry mohou chránit před vznikem onkologického onemocnění. Mohl by se tak stát léčivem indikovaným pro pacienty se zvýšeným rizikem vzniku nádorového onemocnění, např. při diagnóze prekanceróz, či u silných kuřáků. Onkologická léčba je pro pacienta velmi zatěžující svými četnými NÚ. Klinické studie věnující se kurkuminu jako látce, která může tyto NÚ zmírnit, se zaměřují především na její potenciální radioprotektivní účinek, přehled uvádí tab. 3.
Tab. 3. Přehled klinických studií hodnotících účinek kurkuminu na nežádoucí účinky chemoterapeutik. 
V studii na pacientech, kteří podstupovali radioterapii pro nádor v oblasti hlavy a krku, a tedy jim hrozí riziko rozvoje orální mukositidy, byl kurkumin použit ve formě kloktadla. Jeho účinek byl porovnáván s kloktadlem obsahujícím povidon-jodid, které užívali pacienti v kontrolní skupině. Zahrnuto bylo 80 pacientů, u kterých byl hodnocen stav sliznice dutiny ústní, subjektivní potíže a váha po dobu 7 týdnů. Pravidelné hodnocení ukázalo prospěšnost kurkuminu – nástup orální mukositidy byl oddálen, její závažnost byla nižší, méně četné byly i přerušení onkologické léčby a změny ve váze pacientů [47]. Radioprotektivní účinek kurkuminu byl potvrzen i při jeho systémovém podávání 30 ženám, u kterých byla indikována radioterapie pro karcinom prsu. Při dávce 6 g kurkuminu per os denně měly pacientky o téměř 60 % nižší incidenci vlhkých deskvamací oproti kontrolní skupině, došlo tedy ke snížení závažnosti radiační dermatitidy [48].
Uvažuje se i o orexigenním účinku kurkuminu vzhledem k jeho protizánětlivým vlastnostem. Ve studii na pacientech trpících anorexií spojenou s pokročilým nádorovým onemocněním se zkoumala tolerabilita a efekt kombinace výtažků z kurkumy, zázvorovníku lékařského (Zingiber origgicinalis) a hořce žlutého (Gentiana lutea). Ze 17 pacientů, kteří se studie zúčastnili, ji ale dokončilo jenom 7. Důvodem byly především NÚ jako nevolnost, zvracení, únava, průjem nebo nadýmání. Otázkou je, zda bylo hlavním problémem studie nesprávné dávkování, nebo je tato kombinace pro léčbu anorexie u onkologických pacientů nevhodná [49].
Z dostupných studií je zřejmé, že kurkumin se při řešení NÚ onkologických léčiv může uplatnit hlavně jako podpůrná léčba při radioterapii, nejsnadněji právě formou lokálního podání.
Interakce kurkuminu a onkologické léčby
Interakce jsou potenciální problém, pokud se má kurkumin užívat v klinické praxi, protože by mohly způsobit snížení účinku léčby, popř. zvýšit její toxicitu. Jednoznačné důkazy interakcí mezi kurkuminem a chemoterapeutiky nejsou známé. In vitro bylo potvrzeno, že kurkumin inhibuje humánní CYP450, a tedy může zvyšovat toxicitu některých cytostatik, jako je etoposid, paklitaxel, vinblastin nebo vinkristin [50]. Protichůdný výsledek ale uvádí studie, kde kurkumin přímo antagonizoval působení etoposidu na buněčnou kulturu, a tedy snižoval jeho účinek [51]. Tyto poznatky zatím nebyly ověřeny in vivo, ale riziko interakcí je potenciálně závažný problém léčby, který je nutno v klinické praxi brát v úvahu.
Závěr
Zdá se, že kurkumin disponuje účinky, které mohou být výhodné jednak pro onkologické pacienty, ale i pro pacienty se zvýšeným rizikem vzniku nádorového onemocnění. Výzkum kurkuminu je ve stadiu, kdy se objevují první výsledky z klinických studií, desítky dalších studií probíhají (viz www.clinicaltrials.gov). Výsledky velkých randomizovaných studií hodnotících prospěšnost přidání kurkuminu ke standardní onkologické léčbě zatím nejsou k dispozici. V současnosti je důležité výzkum zaměřit zejména na detailní posouzení jeho možných interakcí s onkologickou léčbou a určit indikace pro jeho podání. Dále je nutné definovat optimální lékovou formu podání kurkuminu, díky které by se dosáhlo jeho dobré systémové dostupnosti.
Zařazení kurkuminu do standardní léčby onkologického pacienta zatím není možné, stejně jako přesnější doporučení o jeho kombinování s další onkologickou léčbou. Nicméně výsledky dostupných studií naznačují, že kurkumin má potenciál stát se doplňkem stravy nebo léčivem, které může dílem přispět k boji proti nádorovému onemocnění a též pomoci pacientovi zvládat NÚ onkologické léčby. Současně je možné pacientovi doplňky stravy s kurkuminem nebo užívání rostlinného materiálu (práškovaný oddenek kurkumy) jednoznačně doporučit vzhledem k opakovaně prokázané bezpečnosti kurkuminu a relativně malému množství kurkuminu v těchto zdrojích. Podání čistého kurkuminu ve farmakologických dávkách ale může být spojeno s NÚ, např. případnou krvácivostí, vzhledem k tomu, že kurkumin má jisté antikoagulační a antitrombotické účinky [52].
Obdrženo: 20. 7. 2017
Přijato: 25. 9. 2017
Tato studie vznikla na Masarykově univerzitě v rámci projektu „Behaviorální psychofarmakologie a farmakokinetika v preklinickém výzkumu léčiv“ číslo MUNI/A/1132/2017 podpořeného z prostředků účelové podpory na specifický vysokoškolský výzkum, kterou poskytlo MŠMT v roce 2018.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. PharmDr. Jana Rudá-Kučerová, Ph.D.
Farmakologický ústav LF MU
Kamenice 5
625 00 Brno
e-mail: jkucer@med.muni.cz
Zdroje
1. Perrone D, Ardito F, Giannatempo G et al. Biological and therapeutic activities, and anticancer properties of curcumin. Exp Ther Med 2015; 10 (5): 1615–1623. doi: 10.3892/etm.2015.2749.
2. European Medicines Agency – Find medicine. Curcumae longae rhizoma. [online]. Available from: http: //www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/herbal/medicines/herbal_med_000065.jsp&mid=WC0b01ac058001fa1d.
3. Yallapu MM, Jaggi M, Chauhan SC. Curcumin nanomedicine: a road to cancer therapeutics. Curr Pharm Des 2013; 19 (11): 1994–2010.
4. Sharma RA, Gescher AJ, Steward WP. Curcumin: the story so far. Eur J Cancer 2005; 41 (13): 1955–1968. doi: 10.1016/j.ejca.2005.05.009.
5. Ahsan H, Parveen N, Khan NU et al. Pro-oxidant, anti-oxidant and cleavage activities on DNA of curcumin and its derivatives demethoxycurcumin and bisdemethoxycurcumin. Chem Biol Interact 1999; 121 (2): 161–175.
6. Ciolino HP, Daschner PJ, Wang TT et al. Effect of curcumin on the aryl hydrocarbon receptor and cytochrome P450 1A1 in MCF-7 human breast carcinoma cells. Biochem Pharmacol 1998; 56 (2): 197–206.
7. Chen A, Xu J. Activation of PPAR{gamma} by curcumin inhibits Moser cell growth and mediates suppression of gene expression of cyclin D1 and EGFR. Am J Physiol Gastrointest Liver Physiol 2005; 288 (3): G447–G456. doi: 10.1152/ajpgi.00209.2004.
8. Jiang MC, Yang-Yen HF, Yen JJ et al. Curcumin induces apoptosis in immortalized NIH 3T3 and malignant cancer cell lines. Nutr Cancer 1996; 26 (1): 111–120. doi: 10.1080/01635589609514468.
9. Morin D, Barthélémy S, Zini R et al. Curcumin induces the mitochondrial permeability transition pore mediated by membrane protein thiol oxidation. FEBS Lett 2001; 495 (1–2): 131–136.
10. Arbiser JL, Klauber N, Rohan R et al. Curcumin is an in vivo inhibitor of angiogenesis. Mol Med 1998; 4 (6): 376–383.
11. Thaloor D, Singh AK, Sidhu GS et al. Inhibition of angiogenic differentiation of human umbilical vein endothelial cells by curcumin. Cell Growth Differ 1998; 9 (4): 305–312.
12. Chan MM. Inhibition of tumor necrosis factor by curcumin, a phytochemical. Biochem Pharmacol 1995; 49 (11): 1551–1556.
13. Gupta B, Ghosh B. Curcuma longa inhibits TNF-alpha induced expression of adhesion molecules on human umbilical vein endothelial cells. Int J Immunopharmacol 1999; 21 (11): 745–757.
14. Bhaumik S, Jyothi MD, Khar A. Differential modulation of nitric oxide production by curcumin in host macrophages and NK cells. FEBS Lett 2000; 483 (1): 78–82.
15. Gao X, Kuo J, Jiang H et al. Immunomodulatory activity of curcumin: suppression of lymphocyte proliferation, development of cell-mediated cytotoxicity, and cytokine production in vitro. Biochem Pharmacol 2004; 68 (1): 51–61. doi: 10.1016/j.bcp.2004.03.015.
16. Quispe-Soto ET, Calaf GM. Effect of curcumin and paclitaxel on breast carcinogenesis. Int J Oncol 2016; 49 (6): 2569–2577. doi: 10.3892/ijo.2016.3741.
17. Kumar P, Barua CC, Sulakhiya K et al. Curcumin ameliorates cisplatin-induced nephrotoxicity and potentiates its anticancer activity in SD rats: potential role of curcumin in breast cancer chemotherapy. Front Pharmacol 2017; 8 : 132. doi: 10.3389/fphar.2017.00132.
18. Venkatesan N. Curcumin attenuation of acute adriamycin myocardial toxicity in rats. Br J Pharmacol 1998; 124 (3): 425–427. doi: 10.1038/sj.bjp.0701877.
19. Shoba G, Joy D, Joseph T et al. Influence of piperine on the pharmacokinetics of curcumin in animals and human volunteers. Planta Med 1998; 64 (4): 353–356. doi: 10.1055/s-2006-957450.
20. Gota VS, Maru GB, Soni TG et al. Safety and pharmacokinetics of a solid lipid curcumin particle formulation in osteosarcoma patients and healthy volunteers. J Agric Food Chem 2010; 58 (4): 2095–2099. doi: 10.1021/jf9024 807.
21. Kanai M, Imaizumi A, Otsuka Y et al. Dose-escalation and pharmacokinetic study of nanoparticle curcumin, a potential anticancer agent with improved bioavailability, in healthy human volunteers. Cancer Chemother Pharmacol 2012; 69 (1): 65–70. doi: 10.1007/s00280-011-1673-1.
22. Gupta SC, Patchva S, Aggarwal BB. Therapeutic roles of curcumin: lessons learned from clinical trials. AAPS J 2013; 15 (1): 195–218. doi: 10.1208/s12248-012-9432-8.
23. Bayet-Robert M, Kwiatkowski F, Leheurteur M et al. Phase I dose escalation trial of docetaxel plus curcumin in patients with advanced and metastatic breast cancer. Cancer Biol Ther 2010; 9 (1): 8–14.
24. Lao CD, Ruffin MT, Normolle D et al. Dose escalation of a curcuminoid formulation. BMC Complement Altern Med 2006; 6 : 10. doi: 10.1186/1472-6882-6-10.
25. Garcea G, Berry DP, Jones DJ et al. Consumption of the putative chemopreventive agent curcumin by cancer patients: assessment of curcumin levels in the colorectum and their pharmacodynamic consequences. Cancer Epidemiol Biomark Prev 2005; 14 (1): 120–125.
26. Irving GR, Howells LM, Sale S et al. Prolonged biologically active colonic tissue levels of curcumin achieved after oral administration – a clinical pilot study including assessment of patient acceptability. Cancer Prev Res (Phila) 2013; 6 (2): 119–128. doi: 10.1158/1940-6207.CAPR-12-0281.
27. Sharma RA, Euden SA, Platton SL et al. Phase I clinical trial of oral curcumin: biomarkers of systemic activity and compliance. Clin Cancer Res 2004; 10 (20): 6847–6854. doi: 10.1158/1078-0432.CCR-04-0744.
28. Sharma RA, McLelland HR, Hill KA et al. Pharmacodynamic and pharmacokinetic study of oral curcuma extract in patients with colorectal cancer. Clin Cancer Res 2001; 7 (7): 1894–1900.
29. He ZY, Shi CB, Wen H et al. Upregulation of p53 expression in patients with colorectal cancer by administration of curcumin. Cancer Invest 2011; 29 (3): 208–213. doi: 10.3109/07357907.2010.550592.
30. Dhillon N, Aggarwal BB, Newman RA et al. Phase II trial of curcumin in patients with advanced pancreatic cancer. Clin Cancer Res 2008; 14 (14): 4491–4499. doi: 10.1158/1078-0432.CCR-08-0024.
31. Epelbaum R, Schaffer M, Vizel B et al. Curcumin and gemcitabine in patients with advanced pancreatic cancer. Nutr Cancer 2010; 62 (8): 1137–1141. doi: 10.1080/01635581.2010.513802.
32. Kanai M, Yoshimura K, Asada M et al. A phase I/II study of gemcitabine-based chemotherapy plus curcumin for patients with gemcitabine-resistant pancreatic cancer. Cancer Chemother Pharmacol 2011; 68 (1): 157–164. doi: 10.1007/s00280-010-1470-2.
33. Mahammedi H, Planchat E, Pouget M et al. The new combination docetaxel, prednisone and curcumin in patients with castration-resistant prostate cancer: a pilot phase II study. Oncology 2016; 90 (2): 69–78. doi: 10.1159/000441148.
34. Kim SG, Veena MS, Basak SK et al. Curcumin treatment suppresses IKKβ kinase activity of salivary cells of patients with head and neck cancer: a pilot study. Clin Cancer Res 2011; 17 (18): 5953–5961. doi: 10.1158/1078-0432.CCR-11-1272.
35. Wolff JE, Brown RE, Buryanek J et al. Preliminary experience with personalized and targeted therapy for pediatric brain tumors. Pediatr Blood Cancer 2012; 59 (1): 27–33. doi: 10.1002/pbc.23402.
36. Vadhan-Raj S, Weber DM, Wang M et al. Curcumin downregulates NF-κB and related genes in patients with multiple myeloma: results of a phase I/II study. Blood 2007; 110 (11): 1177.
37. Kuttan R, Sudheeran PC, Josph CD. Turmeric and curcumin as topical agents in cancer therapy. Tumori 1987; 73 (1): 29–31.
38. Biswas J, Sinha D, Mukherjee S et al. Curcumin protects DNA damage in a chronically arsenic-exposed population of West Bengal. Hum Exp Toxicol 2010; 29 (6): 513–524. doi: 10.1177/0960327109359020.
39. Polasa K, Raghuram TC, Krishna TP et al. Effect of turmeric on urinary mutagens in smokers. Mutagenesis 1992; 7 (2): 107–109.
40. Cruz-Correa M, Shoskes DA, Sanchez P et al. Combination treatment with curcumin and quercetin of adenomas in familial adenomatous polyposis. Clin Gastroenterol Hepatol 2006; 4 (8): 1035–1038. doi: 10.1016/j.cgh.2006.03.020.
41. Carroll RE, Benya RV, Turgeon DK et al. Phase IIa clinical trial of curcumin for the prevention of colorectal neoplasia. Cancer Prev Res (Phila) 2011; 4 (3): 354–364. doi: 10.1158/1940-6207.CAPR-10-0098.
42. Durgaprasad S, Pai CG, Vasanthkumar S et al. A pilot study of the antioxidant effect of curcumin in tropical pancreatitis. Indian J Med Res 2005; 122 (4): 315–318.
43. Ide H, Tokiwa S, Sakamaki K et al. Combined inhibitory effects of soy isoflavones and curcumin on the production of prostate-specific antigen. Prostate 2010; 70 (10): 1127–1133. doi: 10.1002/pros.21147.
44. Cheng AL, Hsu CH, Lin JK et al. Phase I clinical trial of curcumin, a chemopreventive agent, in patients with high-risk or pre-malignant lesions. Anticancer Res 2001; 21 (4B): 2895–2900.
45. Rai B, Kaur J, Jacobs R et al. Possible action mechanism for curcumin in pre-cancerous lesions based on serum and salivary markers of oxidative stress. J Oral Sci 2010; 52 (2): 251–256.
46. Golombick T, Diamond TH, Badmaev V et al. The potential role of curcumin in patients with monoclonal gammopathy of undefined significance – its effect on paraproteinemia and the urinary N-telopeptide of type I collagen bone turnover marker. Clin Cancer Res 2009; 15 (18): 5917–5922. doi: 10.1158/1078-0432.CCR-08-2217.
47. Rao S, Dinkar C, Vaishnav LK et al. The indian spice turmeric delays and mitigates radiation-induced oral mucositis in patients undergoing treatment for head and neck cancer: an investigational study. Integr Cancer Ther 2014; 13 (3): 201–210. doi: 10.1177/1534735413503 549.
48. Ryan JL, Heckler CE, Ling M et al. Curcumin for radiation dermatitis: a randomized, double-blind, placebo-controlled clinical trial of thirty breast cancer patients. Radiat Res 2013; 180 (1): 34–43. doi: 10.1667/RR3255.1.
49. Sanatani M, Younus J, Stitt L et al. Tolerability of the combination of ginger (Zingiber officinalis), gentian (Gentiana lutea) and turmeric (Curcuma longa) in patients with cancer-associated anorexia. J Complement Integr Med 2015; 12 (1): 57–60.
50. Ben-Arye E, Samuels N, Goldstein LH et al. Potential risks associated with traditional herbal medicine use in cancer care: a study of Middle Eastern oncology health care professionals. Cancer 2016; 122 (4): 598–610. doi: 10.1002/cncr.29796.
51. Saleh EM, El-awady RA, Eissa NA et al. Antagonism between curcumin and the topoisomerase II inhibitor etoposide: A study of DNA damage, cell cycle regulation and death pathways. Cancer Biol Ther 2012; 13 (11): 1058–1071. doi: 10.4161/cbt.21078.
52. Kim DC, Ku SK, Bae JS. Anticoagulant activities of curcumin and its derivative. BMB Rep 2012; 45 (4): 221–226
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2018 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Kurkumin (Kurkumovník dlouhý – Curcuma longa) jako podpůrný fytoterapeutický prostředek v onkologii
- Kontroverze protonové terapie u nádorů centrálního nervového systému
- Protinádorovou léčbou indukované změny renálních funkcí u pacientů s tumory – update aktuálních poznatků
- Editorial
- Současné postavení checkpoint inhibitorů v léčbě nádorů jícnu a žaludku – přehled studií
- Nemelanómové zhubné nádory kože – klinicko-patologická štúdia pacientov s bazocelulárnym karcinómom a skvamocelulárnym karcinómom
- Chirurgická léčba ampulárního adenokarcinomu – zkušenosti jednoho centra a přehled literatury
- Pacientka se třemi EGFR mutacemi – postupný rozvoj rezistence na předchozí cílenou léčbu
- Stopkované laloky jako jedna z možností rekonstrukce hlavy a krku
-
Organizace a hodnocení kvality onkologické péče v České republice
Věstník Ministerstva zdravotnictví České republiky 2017; 13: 83–92 - Aktuality z odborného tisku
- prof. MUDr. Juraj Švec, DrSc. (16. 1. 1938–17. 2. 2017) K nedožitým 80. narodeninám emeritného prednostu Onkologickej kliniky LF UK v Bratislave
- Testování varianty androgenového receptoru AR-V7 pro výběr pacientů s kastračně refrakterním metastazujícím karcinomem prostaty k léčbě novými hormonálními léky
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chirurgická léčba ampulárního adenokarcinomu – zkušenosti jednoho centra a přehled literatury
- Kurkumin (Kurkumovník dlouhý – Curcuma longa) jako podpůrný fytoterapeutický prostředek v onkologii
- Stopkované laloky jako jedna z možností rekonstrukce hlavy a krku
- Současné postavení checkpoint inhibitorů v léčbě nádorů jícnu a žaludku – přehled studií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



