-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunoterapie zhoubného nádoru ledviny
Immunotherapy of Renal Cell Carcinoma
Treatment of renal cell carcinoma is still palliative. Targeted therapy increases response rates and prolongs overall survival and progression-free survival compared with cytokines and chemotherapy. Checkpoint inhibitors constitute the up-date of therapeutic approaches, and anti-PD-1 antibody, one checkpoint inhibitor, is now well established as a second and/or third palliative treatment for patients with renal cell carcinoma. In this study, we present the latest data from current studies on cytokines, cancer vaccines, ipilimumab, and nivolumab. The therapeutic efficacies of combinations such as targeted therapy with immune checkpoint inhibitors and anti-CTLA-4 with anti PD-1 (-L1) have been reported in many studies. Preliminary results are encouraging but the high toxicities and elevated cost are limiting. Treatments with combinations of bevacizumab and atezolizumab, axitinib and pembrolizumab or avelumab, lenvatinib and pembrolizumab, and nivolumab and ipilimumab (results from study phase I, II, and sometimes III) are reported to be highly effective and to result in long-lasting responses with response-rates of 70–100%. So far, valid predictors for these therapies have not been forthcoming, but considerable work is being exerted in this area. Heng and Memorial Sloan Kettering Cancer Center (MSKCC) models are still being used to select patients for immunotherapy. Immunotherapy will definitely continue to play an important role in the treatment of patients with renal cell carcinoma; however, many questions remain.
Key words:
renal cell carcinoma – immunotherapy – checkpoint inhibitors – target therapy
Supported by MH CZ – DRO (MMCI, 00209805)
This work was supported by program of the Czech Ministry of Health No. P03-15-34 678A.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
16. 8. 2017Accepted:
7. 9. 2017
Autoři: A. Poprach 1; R. Lakomý 1; T. Büchler 2
Působiště autorů: Klinika komplexní onkologické péče a Masarykův onkologický ústav, Brno 1; Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha 2
Vyšlo v časopise: Klin Onkol 2017; 30(Supplementum3): 55-61
Kategorie: Přehled
doi: https://doi.org/10.14735/amko20173S55Souhrn
Léčba metastatického renálního karcinomu je stále paliativní. Cílená terapie v porovnání s cytokiny a chemoterapií dosahuje vyššího počtu odpovědí, prodlužuje celkové přežití a přežití do progrese onemocnění. Checkpoint inhibitory patří mezi novinky v léčbě pacientů s renálním karcinomem, především anti-PD-1 protilátky již prokázaly svoji účinnost u těchto pacientů a brzy budou dostupné pacientům ve 2. anebo 3. linii paliativní léčby (nivolumab). V tomto článku zmíníme recentní data z aktuálních studií s cytokiny, protinádorovými vakcínami, ipilimumabem a nivolumabem. Nově se zkouší v mnoha studiích kombinace jak checkpoint inhibitorů s cílenou terapií, tak i anti-PD-1 (-L1) protilátek s anti-CTLA-4 protilátkami (ipilimumab). Výsledky těchto studií jsou velmi povzbudivé, limitující však bývá toxicita (především u kombinace anti-PD-1 a anti-CTLA-4 protilátek) a cena této terapie. Obzvláště léčba kombinací bevacizumabu s atezolizumabem, axitinibu s pembrolizumabem nebo avelumabem, lenvatinibu s pembrolizumabem a nivolumabu s ipilimumabem (studie fáze I, II, někdy III) je vysoce účinná a odpovědi jsou dlouhodobé. U některých kombinací se počet odpovědí pohybuje mezi 70 a 100 %. Validní prediktivní markery na tuto léčbu zatím nemáme (i když na nich výzkumníci intenzivně pracují), pro výběr pacientů k imunoterapii se stále používají prognostické modely dle Henga či Memorial Sloan Kettering Cancer Center (MSKCC). Jisté však je to, že imunoterapie bude mít své místo v léčbě pacientů s renálním karcinomem, i když je potřeba zodpovědět ještě hodně otázek.
Klíčová slova:
renální karcinom – imunoterapie – checkpoint inhibitory – cílená terapieÚvod
V léčbě metastatického renálního karcinomu (metastatic renal cell carcinoma – mRCC) se podobně jako u jiných onkologických diagnóz čím dál více uplatňuje moderní imunoterapie. Společně s cílenou terapií tvoří dva základní pilíře léčby mRCC. Bohužel se však jedná o léčbu prodlužující život, stále nemůžeme mluvit o úplném vyléčení pacientů, i když některá data ze studií kombinujících cílenou terapii a moderní imunoterapii (tzv. checkpoint inhibitory) dávají určitou naději na dlouhodobou kompletní remisi onemocnění (complete remission – CR) (podobně jako to vidíme u pacientů s maligním melanomem (malignant melanoma – MM)). Incidence renálního karcinomu v ČR je nejvyšší celosvětově, má stále rostoucí tendenci, v roce 2014 to bylo 30,03 případu na 100 000 obyvatel. Mortalita v ČR stagnuje, resp. mírně klesá, v roce 2014 byla 11,1 případu na 100 000 obyvatel [1].
Jak již bylo řečeno, pro pacienty s mRCC máme dvě skupiny léčiv. Cílená terapie přinesla ve srovnání s konvenční chemoterapií a imunoterapií cytokiny (interferon α – IFN-α, interleukin-2 – IL-2) prodloužení doby do progrese onemocnění (progression-free survival – PFS), celkového přežití (overall survival – OS), navíc došlo ke zvýšení počtu odpovědí na léčbu (response rate – RR). Léky této skupiny můžeme zjednodušeně rozdělit do dvou podskupin, v první máme inhibitory různých kináz receptorů související s drahou vaskulárního endotelového růstového faktoru (vascular endotelial growth factor – VEGF), ve druhé podskupině pak jsou tzv. mTOR inhibitory (mammalian target of rapamycin). Ukazuje se, že > 80 % pacientů se sporadickým RCC má přítomnou dysfunkci genu Von-Hippel Lindau (VHL), nejčastěji se jedná o poruchu způsobenou určitou mutací vlastního genu či hypermetylací jeho promotoru (epigenetická změna). Pokud jsou proteiny VHL nefunkční, nedochází k degradaci hypoxií indukovaného faktoru 1-α (hypoxia-inducible factor 1-α – HIF-1α) v proteazomu. HIF reguluje expresi genů účastnících se procesu angiogeneze, buněčného metabolizmu, proliferace, signalizace, chemotaxe či apoptózy. Jedná se především o geny VEGF, rodiny destičkového růstového faktoru (platelet-derived growth factor – PDGF) a rodiny transformujícího růstového faktoru (transforming growth factor – TGF) [2]. Prokázalo se též, že inaktivace VHL genu způsobuje zvýšenou expresi genů MET a AXL. Zvýšené hladiny proteinu MET pak nacházíme u pacientů ve špatné prognostické skupině dle MSKCC 2002, ale též k ní dochází pod vlivem dlouhodobé léčby sunitinibem (může tak být důvodem sekundární rezistence na tento lék), podobné výsledky platí i pro zvýšenou expresi genu AXL [3,4]. Ligandem proteinu MET je hepatocytární růstový faktor (hepatocyte growth factor – HGF), zvýšená aktivita MET vede k supresi apoptózy, zvýšenému nádorovému růstu, akceleraci angiogeneze, invazivitě a metastazování [5]. Ligandem proteinu AXL je Gas6, po jejich vazbě dochází k urychlení buněčného dělení a supresi apoptózy [6]. I proteinová kináza mTOR má velmi důležitou roli v procesech buněčného růstu, proliferace, angiogeneze a apoptózy. Pokud je nadměrně exprimována či stimulována, může dojít k akceleraci karcinogeneze. Pomocí temsirolimu či everolimu dochází k inhibici této serin-threoninové kinázy [7].
Do druhé skupiny léčiv (moderní imunoterapie, tzv. checkpoint inhibitory) řadíme především anti-PD-1/-L1 (programmed death – PD) protilátky a anti-CTLA-4 protilátky (cytotoxic T-lymphocyte-associated antigen 4 – CTLA-4). Vývojově starší anti-CTLA-4 protilátky jsou založené na principu inhibice receptoru CTLA-4. Receptor CTLA-4 po navázání ligandů CD80 a CD86 negativně ovlivňuje funkci T lymfocytů v interakci s antigeny nádorů či normálních tkání předkládaných dendritickými buňkami imunitního systému. Je-li však tento receptor zablokován léčebnou protilátkou (nejčastěji ipilimumab), dochází k odblokování imunitní odpovědi [8]. Anti-PD-1/-L1 protilátky se vážou na receptor či ligand receptoru PD-1, resp. PD-L1. Za normálních okolností interakce mezi receptorem PD-1 a jeho ligandy (PD-L1 a PD-L2) tlumí imunitní odpověď na různé antigeny (např. mikrobiální nebo nádorové). PD-1 receptor je exprimován na aktivovaných T lymfocytech, ale i na B lymfocytech, dendritických buňkách a makrofázích. Nádorové buňky produkující PD-L1 ligand dokážou tedy velmi účinně tlumit odpověď cytotoxických T lymfocytů na reakci vůči sobě samým [9].
Ukazuje se, že i cílená terapie má určitý imunomodulační efekt. Data jsou zatím rozporuplná, i když se u kombinace s anti-CTLA-4 a anti-PD-1/-L1 protilátkami předpokládá synergistický efekt. Bylo prokázáno, že stromální buňky RCC jsou velmi důležitým zdrojem VEGF, který se pak podílí přímo či nepřímo na produkci dalších cytokinů způsobující imunosupresi nádorového mikroprostředí. Vysoké hladiny VEGF působí inhibici maturace dendritických buněk, indukci apoptózy CD8+ T lymfocytů a indukci aktivity T regulačních lymfocytů. VEGF se dále podílí na diferenciaci tumorem asociovaných makrofágů, které cestou zvýšené produkce IL-10 a zpětně VEGF akcentují angiogenezi a pronádorovou imunomodulaci (immune editing). Dále vysoké hladiny VEGF způsobují maturaci myeloidních supresorových buněk, které zhoršují funkci efektorových T lymfocytů a zvyšují aktivitu T regulačních buněk (regulační T lymfocyty s především imunosupresivním a proangiogenním vlivem). Tyrozinkinázové inhibitory (tyrosine kinase inhibitors – TKI) a mTOR inhibitory cestou zablokované funkce receptoru pro VEGF tyto nežádoucí děje inhibují. Sunitinib redukuje počty myeloidních supresorových buněk, při léčbě TKI dochází ke zvýšené citlivosti nádorových buněk na působení NK buněk (natural killers) a snižují se počty T regulačních buněk, moduluje se též aktivita a efektivita T buněk. Rozdíly mezi jednotlivými TKI jsou zřejmě způsobeny selektivní aktivitou ke kinázám FLT3 (fms-related tyrosine kinase 3) a c-kit [10].
V současné době máme v ČR standardně k dispozici k 1. linii léčby pazopanib, sunitinib a bevacizumab (s IFN-α) pro pacienty v dobré a střední prognostické skupině dle MSKCC [11]. Pacientům ve špatné prognostické skupině můžeme nabídnout temsirolimus. Ve 2. linii pak používáme everolimus či axitinib, velmi nadějný kabozantinib (inhibitor jak VEGF dráhy, tak dráhy MET a AXL) zatím čeká na úhradu z veřejného pojištění. Ve 3. linii pak pacienty léčíme everolimem, kabozantinib zatím v této indikaci nemá úhradu [12]. Nivolumab je anti-PD-1 protilátka, který podobně jako kabozantinib stále čeká na úhradu z veřejného zdravotního pojištění. Předpokládá se, že bude hrazen ve 2. nebo 3. linii paliativní léčby mRCC po selhání inhibitorů VEGF či mTOR [12].
V tomto přehledu se budeme věnovat nejnovějším výsledkům studií samotné imunoterapie (vakcíny, checkpoint inhibitory), ale krátce uvedeme i výsledky studií kombinujících imunoterapii a cílenou terapii u pacientů s mRCC. Pro doplnění jen zmiňujeme, že již probíhají studie fáze III s moderní imunoterapií v adjuvantní nebo neoadjuvantní indikaci (např. NCT03024996, NCT03055013).
Cytokiny
Cytokiny byly ještě před 10 lety běžně užívanými preparáty u pacientů s mRCC, ovšem s nejistými výsledky. Jednalo se především o IFN-α a IL-2. Samotný IFN-α dosáhl RR okolo 10–15 %, u pacientů se světlobuněčným RCC (clear cell renal cell carcinoma – CCRCC), po nefrektomii a jen s plicními metastázami to mohlo být až 30–37 %. PFS se však pohyboval okolo 5 měsíců a OS pak mezi 10 a 13 měsíci [11]. V současné době se léčba samotným IFN-α považuje za obsolentní, své uplatnění však nachází u kombinací s jinými preparáty (např. s bevacizumabem). IL-2 se podával v různých aplikačních formách (např. i inhalačně), v nízkých dávkách, však s efektem podobným jako u IFN-α. Jiná je situace u vysokodávkovaného IL-2 (high-dose IL-2 – HD), kde dochází přibližně u 5–10 % pacientů k dlouhotrvajícím odpovědím, např. pacienti s CR či částečnou odpovědí (partial response – PR) měli medián přežití bez relapsu (relaps-free survival – RFS) až 54 měsíců, RR se pak pohybuje okolo 15 %. Vysoká toxicita, cena této léčby, nutnost podávání za monitorace na JIP však prakticky znemožnily podávání této léčby v klinické praxi [13]. Na druhou stranu v roce 2015 publikoval McDermott prospektivní studii zkoumající efekt HD-IL-2 u předem vybraných pacientů s mRCC (jen s CCRCC a vysokou expresí karbonické anhydrázy-9), RR byl 25 %, medián OS pak 42,8 měsíce a PFS 4,2 měsíce [14]. Jen krátce se zmíníme o léčbě kombinující IFN-α s IL-2 a 5-flourouracilem (někdy navíc ještě přidány retinoidy, režim dle Atzpodiena). Tato kombinace se běžně používala do roku 2006 i v ČR, byla taktéž toxická, dle autora režimu se však RR pohybovala mezi 25 a 30 %, medián OS byl přes 20 měsíců, pravděpodobnost 2, 5 a 13letého přežití byla 45, 16 a 9 % [15].
Vakcíny s protinádorovým účinkem
Vzhledem k výše zmíněným imunogenním vlastnostem RCC se předpokládá i možný benefit z léčby protinádorovými vakcínami navozujícími specifickou imunitu. Výhodou je většinou nízká toxicita, léčebné efekty však zatím zůstávají za očekáváním.
Na tomto místě popíšeme studie dvou vakcín, první je IMA901. Tato vakcína je složena z devíti peptidů asociovaných s tumorem prezentovaných s HLA I. třídy (human leukocyte antigen) a jednoho peptidu prezentovaného s HLA II. třídy, které jsou více exprimovány na povrchu buněk RCC. Ve studii fáze III (IMPRINT) se podávala tato vakcína společně s granulocyty a makrofágy stimulujícím faktorem (GM-CSF), cyklofosfamidem a sunitinibem nepředléčeným pacientům s mRCC, v druhém rameni pacienti dostávali samotný sunitinib. Medián OS nebyl v rameni se sunitinibem dosažen během folow-up, v kombinaci to bylo 33,17 měsíce (HR 1,34; 95% CI 0,96–1,86; p = 0,087). Tato studie tedy neprokázala benefit vakcíny na OS v kombinaci se sunitinibem [16]. Druhou vakcínou je pak AGS-003, která je odlišná od IMA901. Jedná se o dendritické buňky pacienta získané leukaferézou, do nichž se ex vivo inkorporují nádorové RNA (z pacientova nádoru) a syntetická RNA ligandu CD40. Při intradermální aplikaci vakcíny dochází k prezentaci pacientových nádorově specifických antigenů v asociaci s HLA I. třídy T lymfocytům ve spádové lymfatické uzlině, navíc kostimulační CD40 ligandy pak vazbou na receptory na povrchu CD8+ lymfocytů indukují produkci IL-12, který má další imunogenní efekt. Nadějné výsledky přinesla studie fáze II, kde byli touto vakcínou (v kombinaci se sunitinibem) léčeni nepředléčení pacienti s mRCC ve střední nebo špatné prognostické skupině dle MSKCC 2002. Mediány PFS a OS byly v celé studiové skupině 11,2 a 30,2 měsíce. Kontrola onemocnění (CR + PR + SD) byla 62 % (CR 0 %, PR 43 %), 52 % pacientů žilo déle než 30 měsíců a 24 % pacientů pak bylo na živu > 5 let od vstupu do studie [17]. Studie fáze III s touto vakcínou (celkem bylo zařazeno 462 pacientů) však byla předčasně ukončena nezávislou komisí, neprokázal se totiž léčebný přínos vakcíny (ADAPT, NCT01582672).
Nivolumab
Nivolumab je humánní protilátka proti receptoru PD-1. Vynikající výsledky tohoto léku ze studií fáze I a II vedly k provedení studie fáze III (CheckMate 025), ve které došlo ke srovnání nivolumabu a everolimu u pacientů s mRCC v rámci 2. nebo 3. linie léčby. Pacienti byli předléčeni VEGF inhibitory, dávka nivolumabu byla 3 mg/kg à 14 dní (410 pacientů), everolimu pak 10 mg/denně (411 pacientů). Stratifikace pacientů proběhla dle prognostických skupin dle MSKCC (2004), geografického původu a počtu předchozích linií léčby. Primárním cílem bylo OS, sekundárními cíli pak PFS, RR, bezpečnost a vztah mezi expresí PD-L1 a OS. OS v rámci 26měsíčního folow-up v rameni s nivolumabem bylo 26 měsíců, v rameni s everolimem pak 19,7 měsíce (HR 0,73; 95% CI 0,61–0,88; p = 0,0006), mediány PFS se nelišily (4,6 u nivolumabu vs. 4,4 měsíce u everolimu; HR 0,88; 95% CI 0,75–1,03; p = 0,11). RR byl statisticky signifikantně vyšší u nivolumabu (25 %) než u everolimu (5 %) (HR 5,98; 95% CI 3,68–9,72; p < 0,001). Neprokázala se souvislost mezi OS a expresí PD-L1. Taktéž toxicita byla nižší v rameni s nivolumabem vs. everolimem, toxicita stupně 3 + 4 se vyskytla u 19 % vs. 37 % pacientů [18]. V roce 2016 byla na konferenci ASCO prezentována data o přežití pacientů léčených i přes radiologickou progresi (celkem 153 pacientů). Prokázalo se, že medián OS pacientů léčených i přes progresi onemocnění je signifikantně delší než u pacientů neléčených přes progresi onemocnění – 28,1 vs. 15 měsíců (HR 0,41; 95% CI 0,29–0,57; p < 0,001). Navíc 50 % pacientů léčených i přes progresi onemocnění dosáhlo při dalších přešetřeních regrese, u 14 % pacientů to bylo ≥ 30% zmenšení onemocnění [19]. Pravděpodobnost 1-a 2letého přežití pacientů ve studii CheckMate 025 je 76 % a 52 % (u everolimu 67 % a 42 %). Nivolumab je účinný napříč rizikovými skupinami pacientů, i když statisticky významný rozdíl v OS u nivolumabu ve srovnání s everolimem byl přítomen jen ve skupině pacientů se špatnou prognózou (mediány OS u nivolumabu a everolimu – 15,3 a 7,9 měsíce), v dobré (nedosaženo a 29 měsíců) a střední (21,8 a 18,4 měsíce) prognostické skupině nebyly rozdíly v OS statisticky významné, bez ohledu na předléčenost či místa metastáz [20]. V roce 2017 na ASCO konferenci skupina italských autorů prezentovala data přežití pacientů léčených nivolumabem v rámci expanded access program (EAP) – jednalo se o 389 pacientů, u 80 pacientů byl nivolumab podán v rámci 2. linie léčby, v rámci 3. a 4. linie pak nivolumab dostalo 137 a 170 pacientů. RR byl 22 % (téměř vše PR, jen 2 pacienti měli CR), u 31 % pacientů došlo ke stabilizaci onemocnění (stable disease – SD), 100 pacientů pokračovalo v léčbě i přes progresi onemocnění (25 pacientů mělo pak následně z léčby benefit – 6 pacientů dosáhlo následně PR, 19 pacientů SD). Medián PFS byl 4,6 měsíce, v rámci follow-up 9,2 měsíce byla pravděpodobnost 6-a 9měsíčního OS 80 % a 73 %, medián OS zatím nebyl dosažen. Opět bylo konstatováno, že z léčby nivolumabem benefitují pacienti napříč různými rizikovými skupinami i pacienti s mozkovými anebo kostními metastázami, s nesvětlobuněčnou histologií a bez ohledu na linii léčby či vyšší věk (≥ 75 let). Nejčastějšími nežádoucími účinky (adverse events – AE) byly únava, teplota a anorexie, toxicita stupně 3 + 4 byla zaznamenána jen u 7 % pacientů, nedošlo k žádnému úmrtí v souvislosti s léčbou [21].
Ipilimumab
Tato protilátka proti CTLA-4 receptoru přinesla průlom v léčbě diseminovaného MM. U pacientů s mRCC se taktéž zkoušela, ve studii fáze II však byl RR při „plné“ dávce 3 mg/kg jen přibližně 10 %, u dávky 3 mg/kg s následnou dávkou 1 mg/kg pak PR dosáhl jen jeden pacient z celkem 21 pacientů. Pokud pacienti měli imunitně podmíněné nežádoucí účinky (immune-related adverse events – irAE), byla i větší pravděpodobnost vyššího RR (s irAE byl RR 30 %, bez irAE 0 %) [22]. Jiná je situace u kombinace ipilimumab + nivolumab, která bude zmíněna níže. Pro přehlednost ještě zmíníme jinou anti-CTLA-4 protilátku – tremelimumab, který se ve studii fáze I zkoušel v kombinaci se sunitinibem u pacientů s mRCC. Studie však byla předčasně zastavena pro časné výskyty renálních selhání, RR však byl až 43 % [23]. Nově se zkouší tremelimumab v neoadjuvantním podání v kombinaci s anti-PD-L1 protilátkou – durvalumabem (studie fáze I, NCT02762006).
Kombinace nivolumab + ipilimumab
Kombinace anti-CTLA-4 protilátky s anti-PD-1 protilátkou představuje racionální snahu o ovlivnění imunitní odpovědi na různé úrovni. Poměrně nedávno prezentoval Hammers et al výsledky studie fáze I (CheckMate 016), šlo poměrně o složitou studii, kde se různě kombinoval nivolumab + ipilimumab v různých dávkách, kromě toho se zde ještě zkoušela kombinace nivolumab + TKI (pazopanib nebo sunitinib). Pacienti s předléčeným či nepředléčeným mRCC dostávali nivolumab 3 mg/kg + ipilimumab 1 mg/kg (N3I1), nebo nivolumab 1 mg/kg + ipilimumab 3 mg/kg (N1I3) anebo nivolumab 3 mg/kg + ipilimumab 3 mg/kg – první čtyři cykly à 3 týdny, poté pokračovali již jen v monoterapii nivolumabem 3 mg/kg à 2 týdny do progrese onemocnění či toxicity. Dlužno podotknout, že rameno s kombinací nivolumab 3 mg/kg + ipilimumab 3 mg/kg bylo předčasně uzavřeno pro toxicitu. Primárním cílem studie byla bezpečnost, sekundárními cíli pak RR, nejlepší léčebná odpověď (best overal response – BOR) (dle RECIST 1.1), trvání léčebné odpovědi (duration of response – DOR), doba do odpovědi a PFS. V rameni N3I1 bylo celkem 25 nepředléčených pacientů, v rameni N1I3 pak 21 pacientů. S léčbou spojené AE všech stupňů toxicity nastaly u 93,6 % studiových pacientů, z toho stupně 3 + 4 se vyskytly u 50 % pacientů. V rameni N3I1 se s léčbou spojená toxicita všech stupňů, resp. stupně 3 + 4, objevila zatím u 91,5 % pacientů (nejčastěji únava, kožní toxicita), resp. 38,3 % pacientů (elevace lipáz, hepatotoxicita), v rameni s N1I3 to bylo u 95,7 % pacientů (únava, kožní toxicita), resp. 61,7 % (elevace lipáz, gastrointestinální toxicita – průjem). Pokud se hodnotily závažné, s léčbou spojené AE všech stupňů (SAEs), v rameni N3I1 se vyskytly u 23,4 % pacientů (nejčastěji průjem a pyrexie), z toho stupně 3 + 4 byly přítomny u 19,1 % (průjmy 4,3 % pacientů), v rameni N1I3 to pak bylo u 34 % pacientů, nejčastěji kolitida, průjmy, hepatopatie (vše stupně 3 + 4, kromě jediného pacienta s průjmem stupně 2). Ze studiové populace pacientů dostalo 61,7 % pacientů v rameni N3I1 imunomodulační léčbu (nejčastěji kortikoidy) ke zvládnutí AE, v rameni N1I3 to bylo 83 % pacientů. V rámci mediánu follow-up 22,3 měsíce pak RR byly v obou ramenech 40,4 %, kontroly onemocnění (to je CR + PR + SD – DCR) byly 80,8 %, resp. 76,6 %. Pravděpodobnost 2letého OS byla v rameni N3I1, resp. N1I3, 67,3 %, resp. 69,6 %, pokračující odpovědi pak jsou přítomny u 42,1 %, resp. 36,8 % pacientů (tab. 1, graf 1). Mediány PFS jsou v rameni s N3I1 7,7 měsíce, u N1I3 9,4 měsíce [9].
Tab. 1. RR studie CheckMate 016. 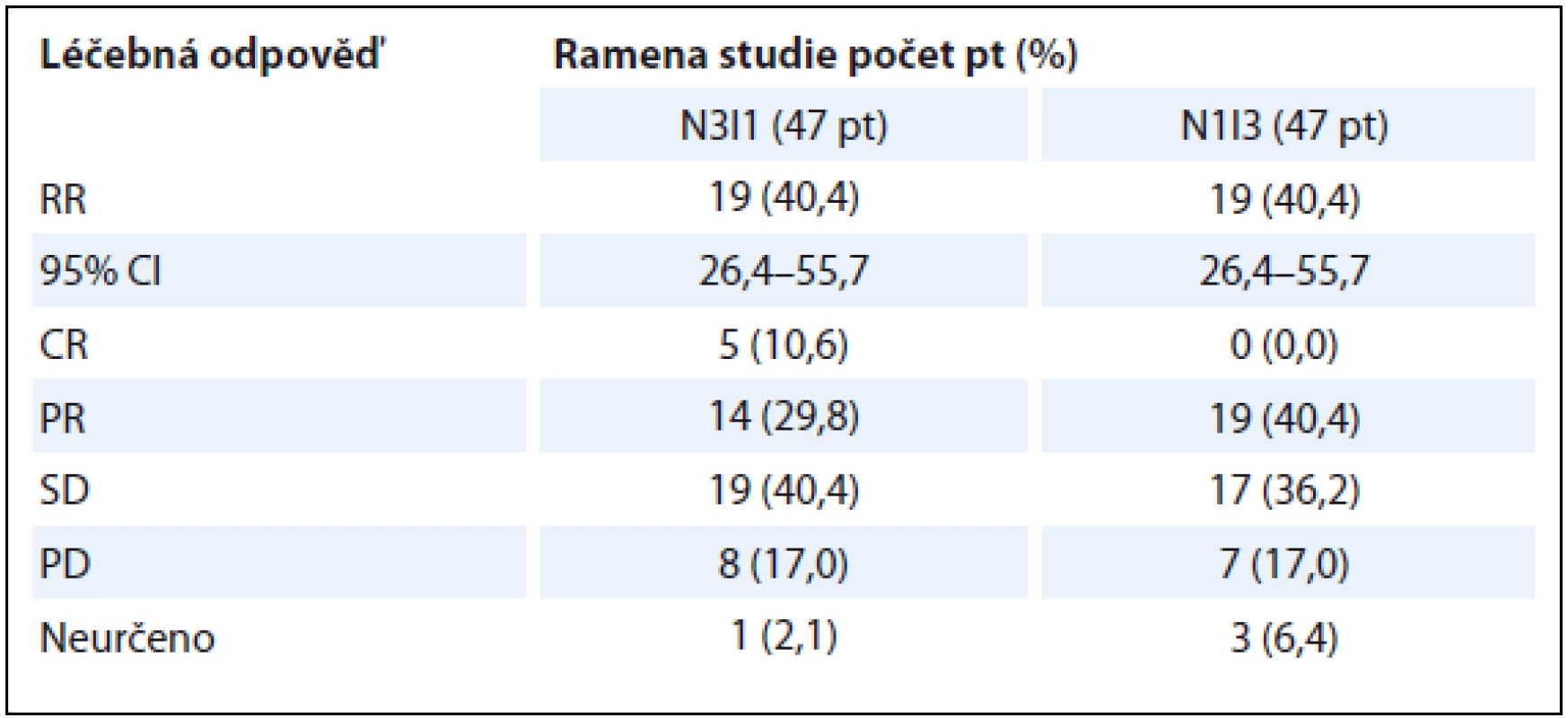
CR – kompletní odpověď, RR – počet odpovědí na léčbu, PR – částečná odpověď, SD – stabilní nemoc, PD – progrese Graf 1. Doba trvání léčebné odpovědi ve studii CheckMate 016 [9]. ![Doba trvání léčebné odpovědi ve studii CheckMate 016 [9].](https://pl-master.mdcdn.cz/media/image/00f90c21c43434cc7f472e6275509b28.png?version=1537791960)
NR – nedosaženo S napětím pak očekáváme výsledky studie fáze III srovnávající kombinaci nivolumab + ipilimumab vs. sunitinib (CheckMate 214, NCT02231749), jejíž první výsledky budou zveřejněny ke konci roku 2017 či začátkem roku 2018.
Kombinace bevacizumab + atezolizumab
Bevacizumab je humanizovaná protilátka proti VEGF, atezolizumab je humanizovaná protilátka proti PD-L1 ligandu. Bevacizumab je indikován u pacientů s mRCC v rámci 1. linie léčby v kombinaci s IFN-α. Dle našeho názoru se jedná o přinejmenším stejně účinnou léčbu v porovnání s TKI (sunitinib, pazopanib) používanými v rámci 1. linie. Cena této léčby v porovnání s jinými TKI a nutnost intravenózního podávání bevacizumabu (resp. podkožního u IFN-α) jsou příčinami omezené indikace. O imunogenním efektu bevacizumabu (resp. inhibitorech VEGF kaskády) jsme se již zmínili v úvodu, zde jen doplníme, že bevacizumab zvyšuje počty periferních CD8+ T lymfocytů, intratumorových CD8+ T lymfocytů i Th1 lymfocytů a dále zvyšuje produkci IL-2 [24]. Společně s anti-PD-L1 protilátkou tak představují kombinaci, kdy kromě zablokování dráhy VEGF očekáváme též augmentaci protinádorové imunitní odpovědi. Ve studii fáze II (IMMOTION 150) došlo ke srovnání atezolizumabu v monoterapii (1 200 mg à 3 týdny) vs. atezolizumab (1 200 mg à 3 týdny) + bevacizumab (15 mg/kg à 3 týdny) vs. sunitinib (50 mg denně, režim 4 + 2) u 305 nepředléčených pacientů s mRCC. V roce 2017 byla publikována data v mediánu follow-up 20,7 měsíce. Mediány PFS byly u kombinace atezolizumab + bevacizumab vs. sunitinib 11,7 vs. 8,4 měsíce (HR 1,00; 95% CI 0,69–1,45; p = 0,982 – tedy statisticky nevýznamný rozdíl), RR 32 vs. 29 %. U pacientů s expresí PD-L1 ≥ 1 % pak byly mediány PFS 14,7 vs. 7,8 měsíce (HR 0,64; 95% CI 0,38–1,08; p = 0,095, tedy opět statisticky nevýznamný rozdíl), RR 46 vs. 27 %. Při srovnání pacientů s expresí PD-L1 ≥ 10 % bylo HR pro PFS v ramenech s kombinací bevacizumab + atezolizumab vs. sunitinib 0,23. Toxicita stupně 3 + 4 byla v rameni s kombinací atezolizumab + bevacizumab přítomna u 63 % pacientů (proteinurie, průjmy). Crossover je v této studii dovolen (78 % pacientů se sunitinibem již dostalo atezolizumab + bevacizumab) [25]. Kombinace atezolizumab + bevacizumab vs. sunitinib je nyní zkoumána ve studii fáze III u nepředléčených pacientů s mRCC (IMMOTION 151, NCT02420821).
Kombinace bevacizumab + pembrolizumab
Pembrolizumab je humanizovaná protilátka proti PD-1 receptoru, který se nyní zkouší jak v monoterapii (KEYNOTE 427, NCT02853344), tak i v kombinaci s různými léky u pacientů s mRCC. Ve studii fáze Ib se podávala kombinace bevacizumab + pembrolizumab předléčeným pacientům s mRCC, zatím zde nebyla zaznamenána toxicita stupně 3 nebo 4, RR byl 71 % [26]. Nyní probíhá studie fáze II se stejnou kombinací léků (bevacizumab 15 mg/kg + pembrolizumab 200 mg à 3 týdny, NCT02348008).
Kombinace nivolumab + pazopanib/sunitinib
Standardně používané léky v 1. linii byly zkoušeny ve studii fáze I u předléčených pacientů s mRCC v kombinaci s nivolumabem. Dávky nivolumabu byly 2 mg/kg (s eskalací na 5 mg/kg), sunitinib byl podáván ve vstupní dávce 50 mg (režim 4 + 2) a pazopanib v dávce 800 mg. Rameno s pazopanibem muselo být předčasně zastaveno pro jaterní toxicitu. Nicméně RR v rameni se sunitinibem, resp. pazopanibem byl 52, resp. 45 %, SD pak byla zaznamenána u 35 %, resp. 33 % pacientů. Toxicita stupně 3 + 4 byla zaznamenána u 73 % pacientů se sunitinibem (elevace ALT, hypertenze), resp. u 60 % v rameni s pazopanibem (elevace ALT/AST, únava). Je třeba podotknout, že autoři studie nyní testují podobnou studii s nižší dávkou pazopanibu [27]. Pro úplnost jen uvedeme, že byla též testována kombinace pazopanib (v různých dávkách, studie fáze I/II) + pembrolizumab u pacientů s mRCC – i přes povzbudivé výsledky v počtu odpovědí docházelo i v této studii k závažným AE (hepatotoxicita), které zřejmě neumožní další testování pazopanibu v kombinaci s checkpoint inhibitory v budoucnu [28].
Kombinace axitinib + pembrolizumab/avelumab
Axitinib je TKI druhé generace užívaný u pacientů s mRCC ve 2. linii paliativní léčby. Kombinace axitinib + pembrolizumab (axitinib 5 mg 2× denně, pembrolizumab 2 mg/kg à 3 týdny) byla testována ve studii fáze I u 52 nepředléčených pacientů s mRCC. Kompletní remise byla dosažena u 5,8 % pacientů, PR mělo 65,4 % pacientů, SD pak 19,2 % pacientů, kontrola onemocnění byla tedy přibližně 90 %. Nejčastějšími AE všech stupňů byly průjem (80,8 % pacientů), únava (76,9 % pacientů) a chrapot (76,9 % pacientů), z AE stupně 3 se nejčastěji vyskytly hypertenze (17,3 % pacientů), průjem (9,6 % pacientů) a únava (5,8 % pacientů). Při zohlednění irAE měli pacienti nejčastěji průjem – 26,9 % pacientů (stupeň 3 – 7,7 % pacientů) a elevaci ALT – 13,5 % pacientů (stupeň 3 – 3,8 % pacientů). Jen dva pacienti měli toxicitu stupně 4 (hyperurikemie a dušnost), úmrtí související s léčbou nebylo ve studii zaznamenáno. Léčbu muselo přerušit jen devět pacientů z důvodů AE léčby, nebyl pozorován výraznější nárůst hepatopatie [29]. V současné době probíhá studie fáze III porovnávající účinnost sunitinibu vs. kombinace axitinib + pembrolizumab u nepředléčených pacientů s mRCC (KEYNOTE-426, NCT02853331).
Ve druhé studii fáze I byl axitinib kombinován s avelumabem (humánní anti-PD-L1 protilátka) – studie JAVELIN Renal 100 (NCT02493751). Do studie bylo zařazeno 55 nepředléčených pacientů s mRCC (axitinib 5 mg 2× denně, avelumab 10 mg/kg à 2 týdny). Na ASCO 2017 byly prezentovány předběžné výsledky studie – CR byla dosažena u 5,5 % pacientů, PR u 52,7 % pacientů, SD pak u 20 % pacientů, progrese onemocnění byla přítomna u 18,2 % pacientů (odpověď u dvou pacientů nebylo možné zhodnotit). Tedy kontroly onemocnění dosáhlo 78,2 % pacientů. Odpovědi jsou opět dlouhodobé, zvýšená exprese PD-L1 ≥ 1 % nebo ≥ 5 % nemá vliv na počet odpovědí. Nejčastějšími AE byly průjem (všechny stupně 56,4 % pacientů, stupeň 3 – 3,6 % pacientů) a hypertenze (všechny stupně 47,3 % pacientů, stupeň 3 – 29,1 % pacientů). Toxicitu stupně 4 mělo 9,1 % pacientů, nejčastěji se jednalo o elevace lipáz (5,5 % pacientů), jeden pacient zemřel na myokarditidu. Z irAE (všechny stupně – 30,9 % pacientů) byla nejčastější porucha štítné žlázy (21,8 % pacientů), vyrážka (5,5 % pacientů) a hepatopatie (3,6 % pacientů), stupeň 3 toxicity byl zaznamenán u 5,5 % pacientů (nejčastěji hepatopatie), žádný pacient neměl toxicitu stupně 4, již zmíněná myokarditida s úmrtím se taktéž považuje za irAE [30]. Na základě těchto dat nyní taktéž probíhá studie fáze III, srovnává se sunitinib s kombinací avelumab + axitinib (JAVELIN Renal 101, NCT02684006).
Další kombinace
Velmi nadějně se jeví též studie kombinující kabozantinib + nivolumab s/bez ipilimumabu (NCT02496208), dále lenvatinib + pembrolizumab. Lenvatinib + pembrolizumab ve studii fáze Ib/II dosáhly u pacientů s předléčeným mRCC 100% kontroly onemocnění, z toho 50 % pacientů mělo PR [31]. Nyní běží studie fáze III testující kombinaci lenvatinib + pembrolizumab vs. sunitinib vs. lenvatinib + everolimus u nepředléčených pacientů s mRCC (NCT02811861). Konečně poslední kombinací, kterou bychom chtěli představit, je pembrolizumab + ipilimumab (studie fáze I, KEYNOTE-029). Výzkum probíhá u předléčených pacientů s mRCC (pembrolizumab 2 mg/kg à 3 týdny – 1 dávka, ipilimumab 1 mg/kg à 3 týdny – 4 dávky) ve studii fáze I. Do studie bylo zařazeno 10 pacientů, 2 pacienti měli PR, 3 pak SD. S léčbou spojené AE všech stupňů se vyskytly u 7 pacientů, z toho stupně 3 + 4 byly přítomny u 5 pacientů (elevace lipáz). Medián DOR zatím nebyl dosažen [32].
Závěr
V tomto stručném přehledu jsme se pokusili nastínit, jak dynamicky se rozvíjí léčba imunoterapií u pacientů s mRCC. Po 10 letech od příchodu TKI jsme svědky nástupu další vysoce účinné terapie. Dochází k vývoji nových checkpoint inhibitorů, zkouší se kombinace s mnoha TKI v různě složitých schématech. Bude zcela jistě nutné (už kvůli finanční nákladnosti, resp. neúnosnosti) pacienty stratifikovat (často zkoumaná exprese PD-L1 zatím nepřináší očekávané výsledky), nalezení prediktivních faktorů se stává nutností. Podobně jako u pacientů s MM stojíme před řadou otázek, např.:
- Je lepší podávat konkomitantní léčbu imunoterapií s TKI, nebo je lepší léčba sekvenční?
- Jak léčit starší pacienty, kteří nám přibývají?
- Co pacienti s mozkovými metastázami?
- Má stále ještě smysl provádět paliativní nefrektomii nebo metastazektomie?
- Pokud ano, kdy?
- Má smysl provádět jiné lokální paliativní metody – radioterapii, kryoterapii (abskopální efekt)?
- Má smysl adjuvantní léčba imunoterapií?
- Co pacienti s nesvětlobuněčným mRCC?
Podobných otázek by se jistě našlo více, na řadu z nich snad odpoví právě probíhající studie, jejichž výsledky s napětím očekáváme.
Podpořeno MZ ČR – RVO (MOÚ, 00209805)
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. P03-15-34 678A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Alexandr Poprach, Ph.D.
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: poprach@mou.cz
Obdrženo: 16. 8. 2017
Přijato: 7. 9. 2017
Zdroje
1. Epidemiologie zhoubných nádorů v České republice. Masarykova univerzita [online]. Dostupné z: http: //www.svod.cz.
2. Ke Q, Costa M. Hypoxia-Inducible Factor-1 (HIF-1). Mol Pharmacol 2006; 70 (5): 1469–1480. doi: 10.1124/mol. 106.027029.
3. Gibney GT, Aziz SA, Camp RL et al. c-Met is a prognostic marker and potential therapeutic target in clear cell renal cell carcinoma. Ann Oncol 2013; 24 (2): 343–349. doi: 10.1093/annonc/mds463.
4. Gustafsson A, Fritz HKM, Dahlbäck B. Gas6-Axl signaling in presence of Sunitinib is enhanced, diversified and sustained in renal tumor cells, resulting in tumor-progressive advantages. Exp Cell Res 2017; 355 (1): 47–56. doi: 10.1016/j.yexcr.2017.03.040.
5. Graveel CR, Tolbert D, Vande Woude GF. MET: a critical player in tumorigenesis and therapeutic target. Cold Spring Harb Perspect Biol 2013; 5 (7): a009209. doi: 10.1101/cshperspect.a009209.
6. Zhou L, Liu XD, Sun M et al. Targeting MET and AXL overcomes resistance to sunitinib therapy in renal cell carcinoma. Oncogene 2016; 35 (21): 2687–2697.
7. Študentová H, Melichar B. Nový mechanizmus v léčbě karcinomu ledviny: m-TOR – nová cílová struktura. Onkologie 2010; 4 (3): 185–188.
8. Hahn AW, Gill DM, Pal SK et al. The future of immune checkpoint cancer therapy after PD-1 and CTLA-4. Immunotherapy 2017; 9 (8): 681–692. doi: 10.2217/imt-2017-0024.
9. Hammers HJ, Plimack ER, Infante JR et al. Safety and Efficacy of Nivolumab in Combination With Ipilimumab in Metastatic Renal Cell Carcinoma: The CheckMate 016 Study. J Clin Oncol 2017; JCO2016721985. doi: 10.1200/JCO.2016.72.1985.
10. Santoni M, Berardi R, Amantini C et al. Role of natural and adaptive immunity in renal cell carcinoma response to VEGFR-TKIs and mTOR inhibitor. Int J Cancer 2014; 134 (12): 2772–2777. doi: 10.1002/ijc.28503.
11. Motzer RJ, Bacik J, Murphy BA et al. Interferon-alfa as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma. J Clin Oncol 2002; 20 (1): 289–296. doi: 10.1200/JCO.2002.20.1.289.
12. Vyzula R, Adámková Krákorová D, Arenberger P (eds). Zhoubný novotvar ledviny (C64). In: Modrá kniha České onkologické společnosti. 23. aktualizace. Brno: Masarykův onkologický ústav 2017 : 116–119.
13. McDermott DF, Regan MM, Clark JI et al. Randomized phase III trial of high-dose interleukin-2 versus subcutaneous interleukin-2 and interferon in patients with metastatic renal cell carcinoma. J Clin Oncol 2005; 23 (1): 133–141. doi: 10.1200/JCO.2005.03.206.
14. McDermott DF, Cheng SC, Signoretti S et al. The high-dose aldesleukin „select“ trial: a trial to prospectively validate predictive models of response to treatment in patients with metastatic renal cell carcinoma. Clin Cancer Res 2015; 21 (3): 561–568. doi: 10.1158/1078-0432.CCR-14-1520.
15. Atzpodien J, Hoffmann R, Franzke M et al. Thirteen-year, long-term efficacy of interferon 2alpha and interleukin 2-based home therapy in patients with advanced renal cell carcinoma. Cancer 2002; 95 (5): 1045–1050. doi: 10.1002/cncr.10783.
16. Rini BI, Stenzl A, Zdrojowy R et al. IMA901, a multipeptide cancer vaccine, plus sunitinib versus sunitinib alone, as first-line therapy for advanced or metastatic renal cell carcinoma (IMPRINT): a multicentre, open-label, randomised, controlled, phase 3 trial. Lancet Oncol 2016; 17 (11): 1599–1611. doi: 10.1016/S1470-2045 (16) 30408-9.
17. Amin A, Dudek AZ, Logan TF et al. Survival with AGS-003, an autologous dendritic cell-based immunotherapy, in combination with sunitinib in unfavorable risk patients with advanced renal cell carcinoma (RCC): Phase 2 study results. J Immunother Cancer 2015; 3 : 14. doi: 10.1186/s40425-015-0055-3.
18. Motzer RJ, Escudier B, McDermott DF et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med 2015; 373 (19): 1803–1813. doi: 10.1056/NEJMoa1510665.
19. Escudier BJ, Motzer RJ, Sharma P et al. Treatment beyond progression with nivolumab (nivo) in patients (pts) with advanced renal cell carcinoma (aRCC) in the phase III CheckMate 025 study. J Clin Oncol 2016; 34 (Suppl 15): abstr. 4509.
20. Escudier B, Sharma P, McDermott DF et al. CheckMate 025 Randomized Phase 3 Study: Outcomes by Key Baseline Factors and Prior Therapy for Nivolumab Versus Everolimus in Advanced Renal Cell Carcinoma. Eur Urol 2017; pii: S0302-2838 (17) 30099-4. doi: 10.1016/j.eururo.2017.02.010.
21. Giorgi D, Scagliarini S, Basso U et al. Safety and efficacy of nivolumab for metastatic renal cell carcinoma (mRCC): Real world data from an Italian expanded access program (EAP). J Clin Oncol 2017; 35 (Suppl 15): abstr. 4577.
22. Yang JC, Hughes M, Kammula U et al. Ipilimumab (anti-CTLA4 antibody) causes regression of metastatic renal cell cancer associated with enteritis and hypophysitis. J Immunother 2007; 30 (8): 825–830. doi: 10.1097/CJI.0b013e318156e47e.
23. Rini BI, Stein M, Shannon P et al. Phase 1 dose-escalation trial of tremelimumab plus sunitinib in patients with metastatic renal cell carcinoma. Cancer 2011; 117 (4): 758–767. doi: 10.1002/cncr.25639.
24. Wallin JJ, Bendell JC, Funke R et al. Atezolizumab in combination with bevacizumab enhances antigen-specific T-cell migration in metastatic renal cell carcinoma. Nat Commun 2016; 7 : 12624. doi: 10.1038/ncomms12624.
25. McDermott DF, Atkins MB, Motzer RJ et al. A phase II study of atezolizumab (atezo) with or without bevacizumab (bev) versus sunitinib (sun) in untreated metastatic renal cell carcinoma (mRCC) patients (pts). J Clin Oncol 2017; 35 (Suppl 6): abstr. 431.
26. Dudek AZ, Sica RA, Sidani A et al. Phase Ib study of pembrolizumab in combination with bevacizumab for the treatment of metastatic renal cell carcinoma: big ten cancer research consortium BTCRC-GU14-003. J Clin Oncol 2016; 34 (Suppl 2): abstr. 559.
27. Amin A, Plimack ER, Infante JR et al. Nivolumab (anti-PD-1; BMS-936558, ONO-4538) in combination with sunitinib or pazopanib in patients with metastatic renal cell carcinoma. J Clin Oncol 2014; 32 (Suppl 5): abstr. 5010.
28. Chowdhury S, McDermott DF, Voss MH et al. A phase I/II study to assess the safety and efficacy of pazopanib (PAZ) and pembrolizumab (PEM) in patients (pts) with advanced renal cell carcinoma (aRCC). J Clin Oncol 2017; 35 (Suppl): abstr. 4506.
29. Atkins MB, Plimack ER, Puzanov I et al. Axitinib in combination with pembrolizumab in patients (pts) with advanced renal cell carcinoma (aRCC): Preliminary safety and efficacy results. Ann Oncol 2016; 27 (Suppl 6): 266–295. doi: 10.1093/annonc/mdw373.01.
30. Choueiri TK, Larkin J, Oya M et al. First-line avelumab + axitinib therapy in patients (pts) with advanced renal cell carcinoma (aRCC): Results from a phase Ib trial. Clin Oncol 2017; 35 (Suppl): abstr. 4504.
31. Taylor M, Dutcus CE, Schmidt E et al. A phase 1b trial of lenvatinib (LEN) plus pembrolizumab (PEM) in patients with selected solid tumors. Ann Oncol 2016; 27 (6): 266–295. doi: 10.1093/annonc/mdw373.04.
32. Choueiri TK, Hodi FS, Thompson JA et al. Pembrolizumab (pembro) plus low-dose ipilimumab (ipi) for patients (pts) with advanced renal cell carcinoma (RCC): Phase 1 KEYNOTE-029 study. J Clin Oncol 2017; 35 (Suppl 6): abstr. 510.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Editorial
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2017 Číslo Supplementum3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Hodnocení zánětlivé celulizace (tumor infiltrujících lymfocytů) u solidních nádorů
- Imunoterapie v léčbě karcinomu plic
- Editorial
- Souhrnné srovnání kritérií RECIST 1.1 a iRECIST pro hodnocení odpovědi na onkologickou léčbu solidních tumorů
- Pokroky v imunoterapii maligního melanomu
- Kombinované režimy v imunoterapii
- Checkpoint inhibitory v léčbě nádorů horního gastrointestinálního traktu
- Imunoterapie zhoubného nádoru ledviny
- Imunoterapie karcinomu močového měchýře
- Imunoterapie nádorů dolní části trávicí trubice
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hodnocení zánětlivé celulizace (tumor infiltrujících lymfocytů) u solidních nádorů
- Souhrnné srovnání kritérií RECIST 1.1 a iRECIST pro hodnocení odpovědi na onkologickou léčbu solidních tumorů
- Imunoterapie nádorů dolní části trávicí trubice
- Imunoterapie v léčbě karcinomu plic
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



