-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunoterapie karcinomu močového měchýře
Immunotherapy for Bladder Cancer
Urothelial carcinoma is the most common urological malignancy. Nonspecific immunotherapy using the Bacillus Calmette-Guerin vaccine has long been the mainstay for the treatment of high-risk superficial bladder carcinoma in an adjuvant setting after transurethral endoscopic resection. In metastatic disease, cisplatin-based chemotherapy remains the main therapeutic modality. In Europe, the standard second-line chemotherapy for patients with cisplatin-refractory tumours is vinflunine. Other systemic treatments with a lower level of evidence include paclitaxel and docetaxel. Studies of tumour microenvironment indicate a significant role for the immune system in the pathogenesis of urothelial tumours and the presence of a CD8 lymphocyte infiltrate is associated with better survival. In urothelial tumours, the correlation between PD-L1 expression in the tumour and the response to PD-1/PD-L1 inhibitors has been repeatedly demonstrated in clinical studies. Several inhibitors of PD-1/PD-L1 pathway are undergoing advanced-phase clinical trials and atezolizumab, nivolumab, pembrolizumab, durvalumab, and avelumab have already have received permanent or temporary registration status in the United States, mostly as second-line treatments for patients progressing on cisplatin-based chemotherapy. Three of these agents are currently registered in Europe: nivolumab for second line treatment and atezolizumab and pembrolizumab for first line treatment in patients not eligible for cisplatin as well as and for second line treatment. These novel immunotherapeutic agents for bladder cancer are relatively well tolerated and therefore potentially useful for patients with contraindications or intolerance to platinum regimens. The main toxicities include asthenia/fatigue, lymphopenia, anaemia, musculoskeletal pain, decreased appetite, and nausea.
Key words:
bladder cancer – imunotherapy – PD-1 receptor – antibodies – monoclonal
This work was supported by the Czech Ministry of Health CR – RVO Thomayer Hospital – TN 0064190.
The author declare he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
29. 8. 2017Accepted:
3. 10. 2017
Autoři: T. Büchler
Působiště autorů: Onkologická klinika 1. LF UK a Thomayerovy nemocnice, Praha
Vyšlo v časopise: Klin Onkol 2017; 30(Supplementum3): 6-9
Kategorie: Přehled
doi: https://doi.org/10.14735/amko20173S6Souhrn
Uroteliální karcinom je nejčastější urologickou malignitou. Uroteliální nádory patří mezi malignity výrazně ovlivnitelné imunoterapií. Nespecifická imunoterapie vakcínou Bacillus Calmette-Guerin se již dlouho používá v léčbě povrchového karcinomu močového měchýře s vysokým rizikem v adjuvanci po jejich odstranění transuretrální endoskopickou resekcí. U metastatického onemocnění je v současnosti hlavní léčebnou modalitou chemoterapie. V 1. linii jsou indikovány kombinované režimy s cisplatinou. U nemocných s nádorem refrakterním na cisplatinu je indikována chemoterapie 2. linie – v Evropě je standardem vinflunin. Dalšími možnostmi systémové léčby s nižší úrovní důkazu než u vinfluninu je paklitaxel nebo docetaxel. Analýzy nádorového mikroprostředí svědčí pro významnou roli imunitního systému v patogenezi uroteliálních nádorů, jejichž prognóza koreluje s přítomností CD8 lymfocytárního infiltrátu. U uroteliálních nádorů se ve studiích opakovaně prokázala dobrá korelace mezi expresí PD-L1 v nádoru a odpovědí na inhibitory PD-1/PD-L1.V klinických studiích pozdních fází se nachází několik inhibitorů dráhy PD-1/PD-L1, z nichž atezolizumab, nivolumab, pembrolizumab, durvalumab a avelumab již mají dočasnou nebo trvalou registraci ve Spojených státech, zejména k léčbě 2. linie u nemocných s progresí na chemoterapii cisplatinou. V Evropě jsou zatim registrovány tři z těchto leků: nivolumab pro lečbu 2. linie a atezolizumab a pembrolizumab v 1. linii pro lečbu nemocných s kontraindikacií cisplatiny a pro léčbu 2. linie. Imunoonkologická léčba karcinomu močového měchýře je relativně dobře snášena a proto by mohla být vhodná i pro nemocné s kontraindikací nebo intolerancí platinových režimů. Mezi její hlavní nežádoucí účinky patří asténie/únava, lymfopenie, anémie, muskuloskeletální bolesti, snížená chuť k jídlu a nauzea.
Klíčová slova:
karcinom močového měchýře – imunoterapie – PD-1 receptor – monoklonální protilátkyÚvod
Karcinom močového měchýře tvoří asi 5 % všech malignit. Jeho incidence i mortalita je za posledních 12 let přibližně stacionární. Incidence v roce 2015 podle údajů z Národního onkologického registru dosáhla 20,4/100 000 obyvatel, mortalita 5,41/100 000 obyvatel [1].
Histologicky se v 90 % případů jedná o uroteliální karcinom. Karcinom močového měchýře častější u mužů. Nejčastější záchyt je v šesté a sedmé dekádě života. Hlavním rizikovým faktorem je kouření. Pro uroteliální karcinom je charakteristický postupný vývoj z dysplastických změn uroepitelu, přes preinvazivní karcinom až do invazivního karcinomu. Protože buněčné atypie postihují celou sliznici močového měchýře, ledvinných pánviček, ureterů a močové trubice („field change“), uroteliální karcinomy se často vyskytují multifokálně (synchronně nebo metachronně).
V počátečních stadiích je volbou léčby chirurgický zákrok, obvykle proveden cystoskopicky. U pokročilejších lokalizovaných stadií je standardní léčbou cystektomie, které může předcházet neoadjuvantní chemoterapie. U metastatického onemocnění je hlavní léčebnou modalitou chemoterapie. V 1. linii jsou indikovány kombinované režimy s cisplatinou. U nemocných s nádorem refrakterním na cisplatinu je indikována chemoterapie 2. linie – v Evropě je standardem vinflunin. Dalšími možnostmi systémové léčby s nižší úrovní důkazu než u vinfluninu je paklitaxel nebo gemcitabin.
Protože uroteliální karcinomy vznikají nejčastěji v močovém měchýři, konvenčně se při popisu systémové léčby používá výraz karcinom močového měchýře jako synonymum pro uroteliální karcinom. Diseminované uroteliální nádory jakékoli primární lokalizace se léčí identicky.
Imunologie karcinomů močového měchýře
Analýzy nádorového mikroprostředí svědčí pro významnou roli imunitního systému v patogenezi uroteliálních nádorů. Přežití bez relapsu (event-free survival – EFS) u pacientů s invazivním karcinomem (stadia T2-4) koreluje s infiltrací CD8+ lymfocyty (vysoká infiltrace > 80 měsíců vs. 13 měsíců nízká infiltrace; p < 0,001) [2]. Imunoterapie se již dlouho používá v léčbě povrchového karcinomu močového měchýře (stadia Ta, T1 a Tis) s vysokým rizikem nebo rekurentních, po jejich odstranění transuretrální endoskopickou resekcí. Instilace suspenze Bacillus Calmette-Guerin (BCG) způsobí povrchový nespecifický zánět, který snižuje riziko rekurence nádoru po transuretrální resekci [3,4]. Pro metastatický uroteliální karcinom je v klinických studiích pokročilé fáze nebo již registrováno několik imunoonkologických léků – inhibitorů dráhy PD-1 (programmed death – PD). U uroteliálních nádorů se ve studiích opakovaně prokázala dobrá korelace mezi expresí PD-L1 v nádoru a odpovědí na inhibitory PD-1/PD-L1 [4].
Inhibitory imunoregulačních receptorů v léčbě karcinomu močového měchýře
V terapii metastatického močového měchýře je intenzivně zkoumána řada inhibitorů imunitních kontrolních bodů. V současnosti je několik z nich registrováno ve Spojených státech agenturou FDA (Food and Drug Administration) (tab. 1) V Evropě jsou t.č. k léčbě uroteliálního karcinomu registrovány dva z těchto léků: nivolumab pro léčbu 2. linie po selhání chemoterapie s platinovými deriváty a atezolizumab pro léčbu 2. linie po selhání chemoterapie s platinovými deriváty nebo nemocné s kontraindikací léčby cisplatinou [5].
Tab. 1. Podmínky registrace imunoonkologických léků v indikaci karcinom močového měchýře ve Spojených státech (stav k 1. 9. 2017). 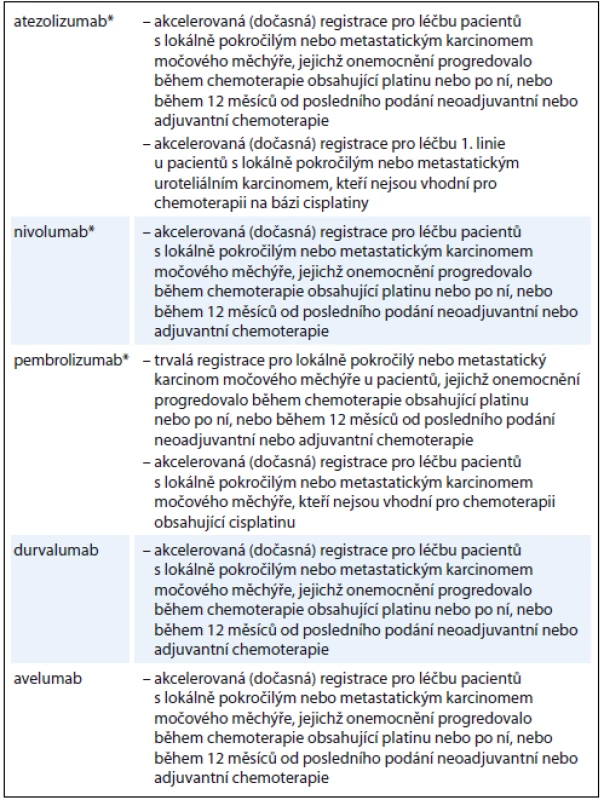
* léky již registrované v Evropě Atezolizumab
Atezolizumab je inhibitor PD-L1. Atezolizumab vykazuje vysokou aktivitu u předléčených pacientů. U nemocných s PD-L1 pozitivními nádory byla pozorována míra objektivní odpovědi (objective response rate – ORR) 43 %. Lék byl relativně dobře snášen, s toxicitou stupně 3–4 jen 4 % [6].
V dubnu 2017 udělila FDA atezolizumabu akcelerovanou registraci pro pacienty, u nichž v 1. linii léčby nelze použít chemoterapii s cisplatinou a pro 2. linii léčby. V září 2017 schválila registraci atezolizumabu v této indikaci i Evropská léková agentura (EMA). Stalo se to na základě výsledků studie fáze II s 310 pacienty IMvigor 210 [7]. V kohortě pacientů, kteří dosud nebyli léčeni chemoterapií a u nichž byla cisplatina kontraindikována (n = 119), dosáhla ORR 24 %, u nemocných předléčených cisplatinou 15 %. Medián trvání léčebných odpovědí po 1,5 roku sledování nebyl dosažen. Nejčastějšími nežádoucími účinky byly únava (31 %) a nauzea (14 %).
V květnu 2017 však výrobce atezolizumabu, firma Roche, oznámila, že studie fáze III IMvigor 211, která hodnotila přípravek u pacientů s dříve léčeným lokálně pokročilým nebo metastazujícím urotheliálním karcinomem nesplnila svůj primární cíl celkového přežití (OS) ve srovnání s chemoterapií (ve srovnávacím rameni byla monoterapie s docetaxelem, paklitaxelem nebo vinfluninem). Navzdory této negativní (nebo alespoň neprokazující superioritu atezolizumabu oproti stávajícím možnostem) studii bude atezolizumab pro karcinom močového měchýře pravděpodobně registrován v Evropě.
Nivolumab
Nivolumab, humánní protilátka anti-PD-1 IgG4, obdržela ve Spojených státech akcelerovanou registraci pro léčbu pacientů s lokálně pokročilým nebo metastatickým uroteliálním karcinomem, kteří měli progresi onemocnění během nebo po chemoterapii obsahující platinu nebo do 12 měsíců od neoadjuvantní nebo adjuvantní chemoterapie obsahující platinu. V Evropě je nivolumab registrován pro léčbu nemocných s progresí na režimu s platinou. Tato registrace je založena na výsledcích studie CheckMate 275, což byla jednoramenná studie s 270 nemocnými. Procento ORR dosáhlo 19,6 %, přičemž medián trvání odpovědi byl 10,3 měsíce [8]. Regrese nádoru korelovala s expresí PD-L1.
Nejčastější nežádoucí příhody vyskytující se u ≥ 20 % pacientů byla asténie/únava, lymfopenie, anémie, muskuloskeletální bolesti, snížená chuť k jídlu a nauzea. Mezi nejčastější nežádoucí příhody stupně 3–4 patřila asténie/únava, infekce močových cest, lymfopenie a anémie.
Pembrolizumab
Pembrolizumab je humanizovaná monoklonální protilátka proti PD-1. U pacientů s uroteliálními nádory probíhá studie KEYNOTE-012 u předléčených pacientů. V této studii dosáhli nemocní léčení pembrolizumabem odpovědi 27, 6 % a mediánu celkového přežití 12,7 měsíce [9].
Pembrolizumab se zkouší v mezinárodní otevřené studii fáze II (KEYNOTE-052) jako léčba 1. linie u dospělých s neresekovatelným nebo metastatickým uroteliálním karcinomem ledvin, pánvičky, močovodu, močového měchýře nebo močové trubice, u nichž není možné podat cisplatinu. ORR byla 29 % (95% CI 24–34), přičemž 25 (7 %) pacientů dosáhlo kompletní regrese a 81 (22 %) parciální regrese nádoru. U dalších 69 nemocných (19 %) došlo k stabilizaci nádoru [10].
Pembrolizumab byl také srovnáván s léčbou dle volby zkoušejícího (paklitaxel, docetaxel nebo vinflunin) ve studii fáze III KEYNOTE-045 u dříve léčeného metastatického uroteliálního karcinomu [11]. Do této studie bylo zařazeno 542 nemocných a v rameni s pembrolizumabem bylo dosaženo OS 10,3 vs. 7,4 měsíce v kontrolním rameni s chemoterapií (HR 0,73; 95% CI 0,59–0,91). Procento nádorových regresí bylo také významně zlepšeno u pembrolizumabu (21,1 vs. 11,4 %; p = 0,0011). V rameni s pembrolizumabem byl vyšší výskyt pruritu (20 vs. 3 %) a, podle očekávání, také incidence imunologicky podmíněných toxicit, jako jsou abnormality funkce štítné žlázy (9 vs. 2 %), pneumonitida (4 vs. 0,4 %) a kolitida (2 vs. 0,4 %).
Durvalumab
Durvalumab je inhibitor PD-L1. Při léčbě durvalumabem se dosáhlo u pacientů předléčených cisplatinou s nádory vysoce exprimujícími PD-L1 ORR 26 % (95% CI 17,8–36,4). Tito pacienti tvořili přibližně 3/4 zařazené populace. Pokud byla exprese PD-L1 nulová nebo nízká, činilo procento ORR jen 4,1 % (95% CI 0,9–11,5) u 73 pacientů s nízkým nebo negativním PD-L1 v nádoru [12]. V důsledku těchto výsledků FDA poskytla tomuto léku akcelerovanou, podmíněnou registraci u pacientů s PD-L1-pozitivním neoperabilním nebo metastatickým uroteliálním karcinomem močového měchýře. Studie fáze III s durvalumabem s nebo bez tremelimumabu vs. standardní chemoterapie probíhá.
Nejčastějšími nežádoucími účinky s výskytem u nejméně 15 % pacientů byla únava, muskuloskeletální bolest, zácpa, snížená chuť k jídlu, nauzea, periferní edém a infekce močových cest. Podle očekávání se u pacientů léčených durvalumabem vyskytly nežádoucí účinky spojené s imunitou, jako pneumonitida, hepatitida, kolitida, poruchy funkce štítné žlázy, adrenální insuficience a diabetes.
Avelumab
Avelumab je další protilátka proti PD-L1. Na základě pozitivních výsledků studie fáze Ib se nyní zkouší ve studii fáze III. Avelumab se liší od ostatních inhibitorů PD-L1 tím, že kromě inhibice PD-L1 vykazuje buněčnou cytotoxicitu zprostředkovanou protilátkou (antibody-dependent cellular cytotoxicity – ADCC), která vede k přímé lýze nádorových buněk [13].
Závěr
Imunoonkologická léčba má naději stát se novým standardem v léčbě pacientů s metastatickým karcinomem močového měchýře. Svůj účinek u nemocných refrakterních na standardní chemoterapii s cisplatinou nebo u pacientů neschopných této chemoterapie prokázalo několik léků (atezolizumab, nivolumab, pembrolizumab, durvalumab a avelumab). Další studie, které mají potvrdit tuto indikaci imunoonkologických léků, v současnosti probíhají.
Podpořeno MZ ČR – RVO Thomayerova nemocnice – TN 0064190.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Tomáš Büchler, Ph.D.
Onkologická klinika 1. LF UK a
Thomayerovy nemocnice
Vídeňská 800
140 59 Praha 4
e-mail: tomas.buchler@ftn.cz
Obdrženo: 29. 8. 2017
Přijato: 3. 10. 2017
Zdroje
1. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. Masarykova univerzita [online]. Dostupné na: http: //www.svod.cz.
2. Sharma P, Shen Y, Wen S et al. CD8 tumor-infiltrating lymphocytes are predictive of survival in muscle-invasive urothelial carcinoma. Proc Natl Acad Sci U S A 2007; 104 (10): 3967–3972. doi: 10.1073/pnas.0611618104.
3. Patard J, Moudouni S, Saint F et al. Tumor progression and survival in patients with T1G3 bladder tumors: multicentric retrospective study comparing 94 patients treated during 17 years. Urology 2001; 58 (4): 551–556. doi: 10.1016/S0090-4295 (01) 01324-3.
4. Lamm DL, Blumenstein BA, Crawford ED et al. A randomized trial of intravesical doxorubicin and immunotherapy with bacille Calmette-Guérin for transitional-cell carcinoma of the bladder. N Engl J Med 1991; 325 (17): 1205–1209. doi: 10.1056/NEJM199110243251 703.
5. National Cancer Institute [online]. FDA Approves Immunotherapy Drugs for Patients with Bladder Cancer [online]. Available from: https: //www.cancer.gov/news-events/cancer-currents-blog/2017/approvals-fda-checkpoint-bladder.
6. Powles T, Eder JP, Fine GD et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer. Nature 2014; 515 (7528): 558–562. doi: 10.1038/nature13904.
7. Rosenberg JE, Hoffman-Censits J, Powles T et al. Atezolizumab in patients with locally advanced and metastatic urothelial carcinoma who have progressed following treatment with platinum-based chemotherapy: a single-arm, multicentre, phase 2 trial. Lancet 2016; 387 (10031): 1909–1920. doi: 10.1016/S0140-6736 (16) 00 561-4.
8. Galsky MD, Retz M, Siefker-Radtke AO et al. Efficacy and safety of nivolumab monotherapy in patients with metastatic urothelial cancer (mUC) who have received prior treatment: Results from the phase II CheckMate 275 study. Ann Oncol 2016; 27 (Suppl 6): abstr LBA31 PR. doi: 10.1093/annonc/mdw435.24.
9. Plimack ER, Bellmunt J, Gupta S et al. Safety and activity of pembrolizumab in patients with locally advanced or metastatic urothelial cancer (KEYNOTE-012): a non-randomised, open-label, phase 1b study. Lancet Oncol 2017; 18 (2): 212–220. doi: 10.1016/S1470-2045 (17) 30007-4.
10. O‘Donnell PH, Grivas P, Vasant Balar AV et al. Biomarker findings and mature clinical results from KEYNOTE-052: First-line pembrolizumab (pembro) in cisplatin-ineligible advanced urothelial cancer (UC). J Clin Oncol 2017; 35 (Suppl): abstr. 4502.
11. Bellmunt J, de Wit R, Vaughn DJ et al. Pembrolizumab as Second-Line Therapy for Advanced Urothelial Carcinoma. N Engl J Med 2017; 376 (11): 1015–1026. doi: 10.1056/NEJMoa1613683.
12. Massard C, Gordon MS, Sharma S et al. Safety and Efficacy of Durvalumab (MEDI4736), an Anti-Programmed Cell Death Ligand-1 Immune Checkpoint Inhibitor, in Patients With Advanced Urothelial Bladder Cancer. J Clin Oncol 2016; 34 (26): 3119–3125. doi: 10.1200/JCO.2016.67.9761.
13. Bellmunt J, Powles T, Vogelzang NJ. A review on the evolution of PD-1/PD-L1 immunotherapy for bladder cancer: The future is now. Cancer Treat Rev 2017; 54 : 58–67. doi: 10.1016/j.ctrv.2017.01.007.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Editorial
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2017 Číslo Supplementum3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Hodnocení zánětlivé celulizace (tumor infiltrujících lymfocytů) u solidních nádorů
- Imunoterapie v léčbě karcinomu plic
- Editorial
- Souhrnné srovnání kritérií RECIST 1.1 a iRECIST pro hodnocení odpovědi na onkologickou léčbu solidních tumorů
- Pokroky v imunoterapii maligního melanomu
- Kombinované režimy v imunoterapii
- Checkpoint inhibitory v léčbě nádorů horního gastrointestinálního traktu
- Imunoterapie zhoubného nádoru ledviny
- Imunoterapie karcinomu močového měchýře
- Imunoterapie nádorů dolní části trávicí trubice
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hodnocení zánětlivé celulizace (tumor infiltrujících lymfocytů) u solidních nádorů
- Souhrnné srovnání kritérií RECIST 1.1 a iRECIST pro hodnocení odpovědi na onkologickou léčbu solidních tumorů
- Imunoterapie nádorů dolní části trávicí trubice
- Imunoterapie v léčbě karcinomu plic
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



