-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Checkpoint inhibitory v léčbě nádorů horního gastrointestinálního traktu
Checkpoint Inhibitors in the Treatment of Upper Gastrointestinal Tract Tumors
Chemotherapy prolongs overall survival (OS) in esophageal (EC) and gastric cancer (GC). Unsatisfactory results of systemic therapy initiated a search for new treatment options. In metastatic disease, a number of targeted drugs were tested; however, several phase III studies assessing receptor tyrosin kinase-related signaling pathways, such as EGFR, MET/HGF or mTOR, failed. Trastuzumab remains the only targeted drug with a known molecular predictor, which extended the OS in metastatic gastric adenocarcinoma and adenocarcinoma of esophago-gastric junction. In the past two years, The Cancer Genome Atlas group published an analysis based on the genomic characteristics of GC and EC. Therefore, a better understanding of tumor biology may be a way towards stratification of treatment based on genetic and molecular characteristics and not merely on anatomical or histological basis. The rapid development in research of anti-tumor immunity and an achievement in the field of checkpoint inhibitors use in malignant melanoma have also enabled research in other cancers, including gastrointestinal malignancies. Checkpoints are part of a comprehensive and complex process of the immune system, and at the same time, the key points in the emergence of tumor tolerance. Their activation protects the organism against autoimmune reactions, but at the same time allows induction of tumor tolerance. Discussing checkpoints include the cytotoxic T-lymphocyte antigen 4 (CTLA-4) and programmed death-1 (PD-1) receptors and the ligand PD-1 receptor, programmed death ligand-1 (PD-L1). In this article, I summarize current findings on the use of anti PD1 agents in EC and GC.
Key words:
esophageal cancer – stomach cancer – checkpoint inhibitors
This work was supported by the project of Ministry of Health of the Czech Republic No. 15 P03 - 17-29389A and by projects LO1413, DRO and LM15089 BBMRI-CZ.
The author declares she has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
17. 9. 2017Accepted:
5. 11. 2017
Autoři: R. Obermannová
Působiště autorů: Lékařská fakulta MU, Brno ; Klinika komplexní onkologické péče Masarykova onkologického ústavu, Brno
Vyšlo v časopise: Klin Onkol 2017; 30(Supplementum3): 50-54
Kategorie: Přehled
doi: https://doi.org/14735/amko20173S50Souhrn
Kombinovaná chemoterapeutická léčba vedla u metastatického karcinomu jícnu (esophageal cancer – EC) a žaludku (gastric cancer – GC) k prodloužení celkového přežití (overall survival – OS). Neuspokojivý přínos terapie klasickými cytostatiky inicioval hledání nových možností léčby. U metastatického onemocnění byla neúspěšně testována řada cílených léků, jako například EGFR protilátky/inhibitory, inhibitory angiogeneze (bevacizumab), multikinázové inhibitory, met inhibitory, mTOR, atd. Trastuzumab zůstává jediným cíleným lékem se známým prediktorem, který prodloužil OS u metastatického adenokarcinomu gastroezofageální junkce (gastroesophageal junction – GEJ) a žaludku. V minulých 2 letech publikovala skupina The Cancer Genome Atlas analýzu založenou na genomické charakteristice GC a EC. Lepší porozumění nádorové biologii může být cestou ke stratifikaci léčby na základě genetických znaků nádorové buňky a nikoliv pouze na podkladě anatomickém nebo histologickém. Rychlý vývoj výzkumu protinádorové imunity poslední dekády a úspěchy na poli využití checkpoint inhibitorů u maligního melanomu umožnily také výzkum jejich účinku u dalších nádorových chorob vč. gastrointestinálních malignit. Checkpoints jsou součástí komplexního a složitého procesu imunitního systému a současně klíčovými body ve vzniku nádorové tolerance. Jejich aktivace chrání organizmus před vznikem autoimunitních reakcí, ale současně umožňuje navození nádorové tolerance. Mezi tyto kontrolní body patří cytotoxický T lymfocytární antigen 4 (CTLA-4) a programmed death-1 (PD-1) receptory a ligand PD-1 receptoru programmed death ligand-1 (PD-L1). V tomto sdělení shrnuji současné poznatky o aktuálních výsledcích léčby checkpoint inhibitory u EC a GC.
Klíčová slova:
karcinom jícnu – karcinom žaludku – checkpoint inhibitoryÚvod
Nádory jícnu a žaludku představují heterogenní skupinu onemocnění. Její společnou charakteristikou jsou omezené léčebné možnosti dané biologickými vlastnostmi a chemorezistencí onemocnění. Důsledkem je celosvětově vysoká mortalita a krátké celkové přežití (overall survival – OS) pacientů s metastatickým onemocněním. Karcinom žaludku (gastric cancer – GC) a jícnu (esophageal cancer – EC) zaujímá v současné době třetí a šesté místo jako příčina smrti na onkologické onemocnění [1]. Dosavadní kombinovaná chemoterapeutická léčba vedla v posledních dekádách pouze ke skromnému prodloužení OS. Neuspokojivý přínos terapie klasickými cytostatiky inicioval hledání nových možností léčby. U metastatického onemocnění byla neúspěšně testována řada cílených léků, jako např. EGFR (epidermal growth factor receptor) protilátky/inhibitory, inhibitory angiogeneze (bevacizumab), multikinázové inhibitory, met inhibitory, mTOR atd. Trastuzumab zůstává jediným cíleným lékem se známým prediktorem, který prodloužil OS u metastatického adenokarcinomu gastroezofageální junkce (gastroesophageal junction – GEJ) a žaludku [2]. Lepší porozumění biologii nádorů otevírá nové léčebné možnosti a znalost biomarkerů umožní personalizaci terapie. Léčba checkpoint inhibitory zasahujícími do komplexních interakcí imunitního systému a nádorové buňky představuje novou léčebnou metodu, která radikálně změnila prognózu maligního melanomu (malignant melanoma – MM) a je dnes standardní součástí jeho léčebného algoritmu. „Checkpoints“ jsou součástí komplexního a složitého procesu imunitního systému a současně klíčovými body ve vzniku nádorové tolerance. Jinými slovy, jejich aktivace chrání organizmus před vznikem autoimunitních reakcí, ale současně umožňuje navození nádorové tolerance. Mezi tyto kontrolní body patří cytotoxický T lymfocytární antigen-4 (CTLA-4) a programmed death-1 (PD-1) receptory a ligand PD-1 receptoru programmed death ligand-1 (PD-L1). PD L1 je u celé řady nádorů upregulován, a ty tímto způsobem unikají imunitní pozornosti. Zablokováním PD-L1 tedy zjednodušeně řečeno dochází k obnovení „normální“ imunitní reakce a protinádorovému efektu [3].
Úspěchy na poli léčby nádorů s vysokou imunogenicitou iniciovaly výzkum i u ostatních malignit, vč. nádorů gastrointestinálních [4].
Komplexní molekulární analýza 295 adenokarcinomů žaludku skupinou The Cancer Genome Atlas (TCGA) [5] identifikovala amplifikované geny zodpovědné za kódování PD-L1 a PD-L2 v podskupině nádorů žaludku a jiné stu-die ověřily PD-L1 expresi imunohisto-chemicky [6].
PD-L je u nádorů horního gastrointestinálního traktu (gastrointestinal tract – GIT) exprimován jak na nádorových buňkách, tak v jeho stromatu napříč histologickými typy (adenokarcinom či spinocelulární karcinom). V recentní práci Thompsona et al [7] 12 % GC exprimovalo membránový PD-L1 a 44 % vykazovalo stromální pozitivitu. Také sledované CD8+ lymfocyty byly více obsaženy v nádoru i imunitním stromatu a jejich přítomnost korelovala s expresí PD-L1. Exprese PD-L1 je teoreticky nositelem horší prognózy a kratšího OS, a tudíž je vhodným potenciálním cílem léčby. Následující text shrnuje současné pokroky léčby checkpoint inhibitory u EC a GC.
Léčba checkpoint inhibitory u metastatického adenokarcinomu gastroezofageální junkce a žaludku
První studií cílenou na adenokarcinom žaludku a GEJ byla studie fáze Ib KEYNOTE-012. Ve studii bylo léčeno 39 pacientů s PD-L1+ GC předléčených minimálně, maximálně jednou linií chemoterapie pembrolizumabem po dobu max. 24 měsíců. K objektivní odpovědi (objective response rate – ORR) došlo u 22 % pacientů, v některých případech však byl zaznamenán dlouhodobý efekt, 6měsíčního OS dosáhlo 64 % pacientů [8]. Na studii fáze I navázala studie fáze II KEYNOTE-059 (NCT02335411), jejíž publikaci fulltextem nyní očekáváme [9]. Jedná se o vícekohortovou studii. V kohortě č. 1 bylo léčeno monoterapií pembrolizumabem 259 pacientů s inoperabilním lokálně pokročilým a metastatickým GC a GEJ. Většina pacientů předléčených min. dvěma liniemi chemoterapie byla neasijského etnika. Nádory s PD-L1 pozitivitou exprimovaly PD-L1 ve ≥ 1 % buněk tumoru nebo nádorového stromatu. Primárním cílem studie bylo zhodnotit celkovou odpověď (overal response – OR), bezpečnost a toleranci.
ORR byla zaznamenána u 11 % pacientů, a to u 15 % ve 3. linii a u 7 % ve 4. linii; medián trvání odpovědi (duration of response – DOR) dosáhl 8 měsíců. Rozdíl v OR byl významný mezi PD-L1+ a PD-L1 – pacienty (15 vs. 6 %), přičemž ve 3. linii činil rozdíl v odpovědi mezi PD-L1+ a PD-L1 – 14 % (21 vs. 7 %).
Stav mikrosatelitní nestability (microsatellite instability – MSI) [10] byl vyšetřen u 174 pacientů, z čehož u sedmi MSI-high pacientů byla zaznamenána ORR 57 %, naopak u MSI-low (n = 167) byla ORR pouze 9 %. Podobně byla testována účinnost další, tentokrát plně humánní monoklonální protilátky – nivolumabu. Efekt nivolumabu v monoterapii u adenokarcinomu žaludku ověřila studie fáze I/II CheckMate-032 [11]. Celkem 59 pacientů bylo léčeno monoterapií nivolumabem, přičemž v 83 % se jednalo o pacienty předléčené dvěma či více liniemi pro metastatické onemocnění. Jako u monoterapie pembrolizumabem došlo k ORR ve14 % případů, s mediánem přežití bez progrese (progression-free survival – PFS) 1,4 měsíce a mediánem OS 5 měsíců. Na rozdíl od studie s pembrolizumabem byla léčba nivolumabem účinná bez závislosti na expresi PD-L1.
Studie fáze III s nivolumabem v monoterapii na skupině pacientů také předléčených dvěma a více liniemi (ONO-4538-12) splnila svůj primární cíl – prodloužení OS (data s cut off v srpnu 2016). Medián OS dosáhl u této předléčené populace 5 měsíců v rameni s nivolumabem vs. 4 měsíce v rameni s placebem (HR 0,63; 95% CI 0,50–0,78; p < 0,0001), s OS v 6 a12 měsících 46 vs. 36 % a 27 vs. 11 % [12].
Také monoklonální protilátka avelumab získala první data v léčbě pokročilého GC. Po studii fáze I na japonské populaci [13] byla na smíšené populaci (západní a korejské) provedena kohortová studie fáze IB, která zaznamenala slibnou aktivitu avelumabu v této indikaci [14]. V současné době probíhají studie fáze III s udržovací monoterapií avelumabem (JAVELIN Gastric 100; NCT02625610 a JAVELIN Gastric 300; NCT02625623).
Tab. 1. Vybrané výsledky klinických studií u karcinomu jícnu a žaludku. 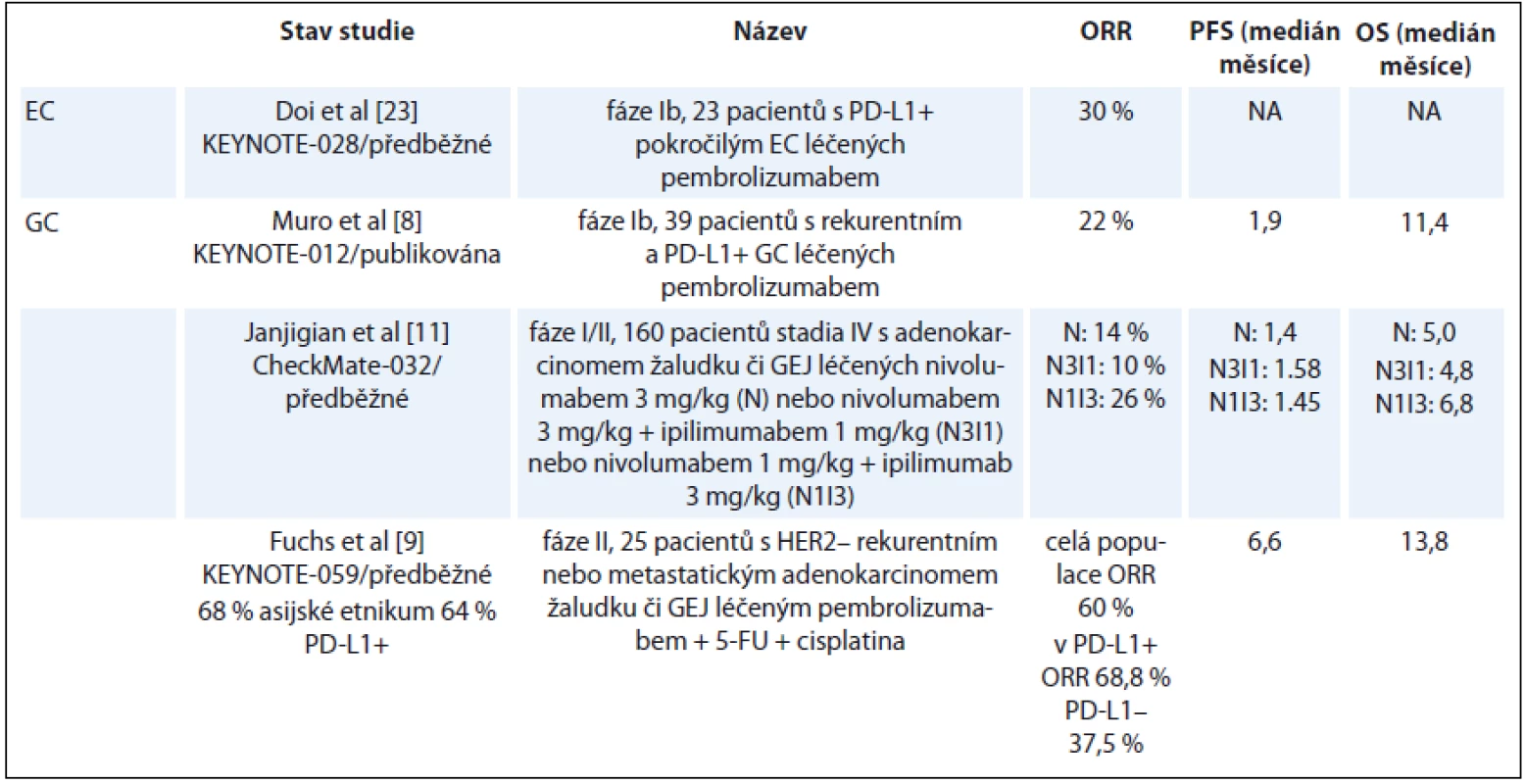
5-FU – 5-fluorouracil, NA – není aplikovatelné, ORR – celková odpověď, OS – celkové přežití, PD-L1 – programmed death ligand-1, PFS – přežití do progrese, GEJ – gastroezofageální junkce, EC – karcinom jícnu, GC – karcinom žaludku Checkpoint inhibitory v léčbě MSI high nádorů jícnu a žaludku
První data byla u gastrointestinálního nekolorektálního origa publikována v roce 2015 [15]. Ve studii fáze II bylo léčeno 41 chemorefrakterních pacientů, z nichž se u 10 jednalo o karcinomy s vysokou MSI/deficientní mismatch-repair stav (MSI-high/dMMR). Zatímco u kolorektálního karcinomu (colorectal cancer – CRC) je dMMR stav zachycen v 15 %, u tumorů žaludku, tenkého střeva a hepatobiliárního origa se pohybuje mezi 2–20 %. Pacienti s dMMR nekolorektálním karcinomem odpovídali podobně jako pacienti s CRC; ORR byla zaznamenána u 71 % pacientů, je však třeba zdůraznit, že hovoříme o velmi malém počtu pacientů (5 ze 7 pacientů), a PFS u 67 % (4 z 6 pacientů). Celogenomové sekvenování odhalilo 1 782 somatických mutací na nádor u dMMR nádorů ve srovnání se 73 u proficientní mismatch repair (pMMR) skupiny. Vysoká mutační nálož byla asociována s prodloužením PFS. Tato práce vedla k vyhodnocení MSI stavu jako spolehlivého prediktoru účinku anti-PD-1 protilátek a Food and Drug Administration (FDA) na základě výsledků z několika studií (KEYNOTE-016 – N = 58, KEYNOTE-164 – N = 61, KEYNOTE-012 – N = 6, KEYNOTE-028 – N = 5 a KEYNOTE-158 – N = 19) s daty z celkového počtu 149 pacientů schválila v letošním roce použití pembrolizumabu u pacientů s dMMR [16].
Checkpoint inhibitory v léčbě metastatického adenokarcinomu žaludku a junkce – kombinovaná terapie u předléčených pacientů
Podklad k použití kombinace nivolumab + ipilimumab vychází z účinnosti kombinace v léčbě nemalobuněčného karcinomu plic (non-small cell lung cancer – NSCLC) [17]. Kombinace s chemoterapií slibuje synergní efekt s anti-PD-L1 protilátkami, mechanizmus je komplexní. Jedním z dějů, který vysvětluje tuto moderní, nově objevenou vlastnost starých cytostatik, je rozpad nádoru a větší expozice antigenů antigen prezentujícím buňkám [18].
Ve studii CheckMate-032 byl nejefektivnější kombinací nivolumab 1 mg/kg + ipilimumab 3 mg/kg. Léčebná odpověď byla dvojnásobná než v případě monoterapie (ORR 26 %), nejvyššího účinku pak dosáhli pacienti, jejichž nádor byl PD-L1+, 44 %, zatímco PD-L1 – pacienti dosáhli ORR pouze v 21 %. Stejná kombinace vedla i k nadějnému mediánu OS 6,9 měsíce a 12měsíčního OS dosáhl 34 % u chemorefrakterních pacientů [11] a 18měsíčního OS dosáhl ve skupině PD-L1 pozitivních pacientů 50 %. V současné době probíhá nábor studie fáze III nivolumab 1 mg/kg + ipilimumab 3 mg/kg u pacientů s metastatickým onemocněním (CheckMate 649; NCT02872116) srovnávající efekt kombinované anti-PD-L a anti-CTLA4 terapie vs. kombinace fluorouracil + oxaliplatina vs. nivolumab + chemoterapie FOLFOX/XELOX. Výsledky se očekávají v roce 2021, tato studie probíhá i v ČR. S pembrolizumabem probíhá studie fáze II (KEYNOTE-059; NCT02335411) srovnávající v 1. linii monoterapii pembrolizumabem vs. kombinaci chemoterapie (5-fluorouracil/kapecitabin + cisplatina) + pembrolizumab/placebo. Na ASCO 2017 Bang et al publikovali první výsledky ze studie [19]. K datu cut off v říjnu 2016 bylo léčeno 25 pacientů, z toho 64 % pacientů v publikované kohortě bylo PD-L1+ a 68 % pacientů bylo asijského etnika, medián follow-up 12,2 měsíce a 84 % pacientů ukončilo léčbu. Dosažená ORR byla 60 % v celé populaci, 69 % ve skupině PD-L1+ pa-cientů a 38 % ve skupině PD-L1 – pacientů. Medián DOR dosáhl 4,6 měsíce (průměr) u všech pacientů, 4,6 měsíce u PD-L1+ pacientů a 5,4 měsíce u PD-L1 – pacientů. Medián PFS 6,6 měsíce; medián OS 13,8 měsíce a dle posteru na konferenci při cut off v lednu 2017 již dosáhl medián OS 20,8 měsíce.
Ve 2. linii pak probíhá studie fáze III (KEYNOTE-061; NCT02370498) srovnávající pembrolizumab s paklitaxelem.
Další kombinace checkpoint inhibitorů jsou testovány, jako příklad uvádím kombinace s antiangiogenní léčbou, studie fáze I ramucirumab a pembrolizumab [20], dále kombinace s cílenou terapií, onkolytickými viry, radioterapií atd.
Checkpoint inhibitory u potenciálně operabilního karcinomu žaludku
Retrospektivní analýza studie MAGIC ukázala souvislost nepříznivé prognózy s metastatickým postižením spádových lymfatických uzlin. Pacienti s N+ mají významně horší OS než pacienti bez postižení spádových lymfatických uzlin. Připravovaná studie EORTC 1707 plánuje srovnat efekt pooperační chemoterapie s kombinací nivolumab + ipilimumab u prognosticky nepříznivé skupiny pacientů, která operací po neoadjuvanci dosáhla pouze R1 resekce, nebo s N+ stavem po operaci. Post-hoc analýza studie MAGIC [21] stejné skupiny autorů provedla rozbor v souvislosti s MSI/dMMR stavem. Pacienti, kteří mají nádory s MSI-high (tato skupina představovala ve zmiňované studii okolo 10 % pacientů), mají lepší prognózu a neprofitují z chemoterapie, naopak analogicky pacienti, kteří nemají MSI-high nebo dMMR, měli benefit z aplikované chemoterapie. Tyto skutečnosti otevírají možnosti pro léčbu checkpoint inhibitory u obou skupin.
Checkpoint inhibitory u skvamózního karcinomu jícnu
Léčba adenokarcinomu distálního jícnu a možnosti terapie checkpoint inhibitory je shrnuta v předchozích odstavcích, protože se shoduje s léčbou adenokarcinomu junkce či žaludku. K terapii spinocelulárního karcinomu by mělo být přistupováno odlišně, neboť se jedná o histologicky, ale i molekulárně odlišné onemocnění. V případě potenciálního použití checkpoint inhibitorů je důležitým faktem PD-L1 a PD-L2 exprese. Až 44 % EC má exprimován PD-L1/L2 a jeho exprese je spojena se špatnou prognózou [22]. Studie fáze Ib KEYNOTE-028 hodnotila v jedné z kohort přínos pembrolizumabu u předléčeného refrakterního nebo relabujícího metastatického EC [23]. Studie omezila nábor na pacienty PD-L1+, přičemž pozitivita byla definována jako exprese v min. 1 % buněk tumoru či tumorózního stromatu. Z 83 pacientů bylo 37 (45 %) PD-L1+ a 23 bylo léčeno pembrolizumabem, v 74 % se jednalo o skvamózní histologii a 1/2 pacientů byla léčena třemi a více liniemi pro metastatické onemocnění. OR bylo dosaženo ve 30 % u skvamózní histologie a 40 % u adenokarcinomu. Součástí studie byla analýza 6 genů zahrnutých do adaptivní imunitní odpovědi a zhodnocení imunitního skóre. Pacienti s vysokým imunitním skóre dobře odpovídali na léčbu, což se promítlo do prodloužení PFS. Celková léčebná odpověď byla pozorována u 43 % „inflamovaných tumorů“ ve srovnání s 11 % „noninflamovaných“ tumorů. Profil genové exprese bude pravděpodobně potenciálním biomarkerem imunitní odpovědi na léčbu checkpoint inhibitory.
Studie ONO-4538-07 je studie fáze II, která hodnotila efekt léčby nivolumabem u pacientů s adenokarcinomem, adenoskvamózním karcinomem či spinocelulárním karcinomem, kteří zprogredovali při chemoterapii s cisplatinou, fluoropyrimidiny a taxany. Nivolumab byl podáván v dávce 3 mg/kg à 14 dní do progrese onemocnění. Primárním cílem studie bylo hodnocení ORR a sekundárním cílem běžné parametry vč. hodnocení OS. Do studie bylo zařazeno 65 pacientů se spinocelulárním EC s mediánem follow-up 11 měsíců. ORR dosáhlo 17 % pacientů se spinocelulárním karcinomem a ve 42 % přinesla léčba kontrolu onemocnění. Medián doby do progrese (time to progression – TTP) byl 1,5 měsíce [24] a medián trvání OS byl 11 měsíců. V současné době probíhají studie testující kombinovanou léčbu nivolumabem a chemoterapií v 1. linii u skvamózního a adenoskvamózního origa.
Závěr
Léčba checkpoint inhibitory představuje renesanci stimulace/modulace imunitní odpovědi nositele proti svému malignímu nádoru. Povzbudivé výsledky u jiných malignit, jako je MM, NSCLC a nádory ledviny, vedl ke studiu imunitní odpovědi také u gastrointestinálních malignit. Dle publikovaných studií vedla monoterapie checkpoint inhibitorem k odpovědi řádově v desítkách procent a k prodloužení OS vysoce předléčených pacientů. Nadějnou se jeví kombinace checkpoint inhibitorů (PD-L1 a CTLA-4), kde ORR dosáhla u PD-L1+ pacientů až 44 %. Také kombinace s chemoterapií bude patrně efektivní. V současné době probíhají studie fáze III. Studované kombinace by však měly být cestou k odkrytí nových biomarkerů/prediktorů, které pomohou lépe stratifikovat pacienty k efektivní léčbě a budou definovat mechanizmy selhání imunitní léčby. Účast pacientů v klinických studiích a hlavně modernizace designu plánovaných klinických studií je podmínkou pokroku v této oblasti. Prvním velmi progresivním krokem FDA bylo schválení indikace léčby checkpoint inhibitory u MSI-high/dMMR karcinomů.
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 15 P03-17 - 29389A a projekty LO1413, DRO (instituce) a LM15089 BBMRI-CZ.
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Radka Obermannová, Ph.D.
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
565 53 Brno
e-mail: obermannova@mou.cz
Obdrženo: 17. 9. 2017
Přijato: 5. 11. 2017
Zdroje
1. Ferlay J, Soerjomataram I, Dikshit R et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136 (5): 359–386. doi: 10.1002/ijc.29210.
2. Bang YJ, Van Cutsem E, Feyereislova A et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastrin or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376 (9742): 687–697. doi: 10.1016/S0140-6736 (10) 61121-X.
3. Freeman GJ, Long AJ, Iwai Y et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med 2000; 192 (7): 1027–1034.
4. Raufi AG, Klempner SJ. Immunotherapy for advanced gastric and esophageal cancer: preclinical rationale and ongoing clinical investigations. J Gastrointest Oncol 2015; 6 (5): 561–569. doi: 10.3978/j.issn.2078-6891.2015.037.
5. Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature 2014; 513 (7517): 202–209. doi: 10.1038/nature13480.
6. Abdel-Rahman O. Immune checkpoints aberrations and gastric cancer; assessment of prognostic value and evaluation of therapeutic potentials. Crit Rev Oncol Hematol 2016; 97 : 65–71. doi: 10.1016/j.critrevonc.2015.08. 015.
7. Thompson ED, Zahurak M, Murphy A et al Patterns of PD-L1 expression and CD8 T cell infiltration in gastric adenocarcinomas and associated immune stroma. Gut 2016; 66 (5): 794–801. doi: 10.1136/gutjnl-2015-310839.
8. Muro K, Chung HC, Shankaran V et al. Pembrolizumab for patients with PD-L1-positive advanced gastric cancer (KEYNOTE-012): a multicentre, open-label, phase 1b trial. Lancet Oncol 2016; 17 (6): 717–726. doi: 10.1016/S1470-2045 (16) 00175-3.
9. Fuchs CS, Doi T, Woo-Jun Jang R et al. KEYNOTE-059 cohort 1: Efficacy and safety of pembrolizumab (pembro) monotherapy in patients with previously treated advanced gastric cancer. J Clin Oncol 2017; 35 (Suppl 15): abstr. 4003.
10. Le DT, Uram JN, Wang H et al. PD-1 blockade in tumors with mismatch-repair deficiency. N Engl J Med 2015; 372 (26): 2509–2520. doi: 10.1056/NEJMoa1500596.
11. Janjigian YY, Bendell JC, Calvo E et al. CheckMate-032: phase I/II, openlabel study of safety and activity of nivolumab (nivo) alone or with ipilimumab (ipi) in advanced and metastatic (A/M) gastric cancer (GC). J Clin Oncol 2016; 34 (Suppl 15): abstr. 4010.
12. Kang YK, Satoh T, Ryu MH et al. Nivolumab (ONO-4538/BMS-936558) as salvage treatment after 2nd or later line chemotherapy for advanced gastric or gastroesophageal junction cancer (AGC): a double-blinded, randomized phase III trial. J Clin Oncol 2017; 35 (Suppl 4): abstr 2. doi: 10.1200/JCO.2017.35.4_suppl.2.
13. Yamada Y, Nishina T, Iwasa S et al. A phase I dose expansion trial of avelumab (MSB0010718C), an anti-PD-L1 antibody, in Japanese patients with advanced gastric cancer. J Clin Oncol 2015; 33 (Suppl 15): abstr 4047.
14. Chung HC, Arkenau HT, Wyrwicz L et al. Avelumab (MSB0010718C; anti-PD-L1) in patients with advanced gastric or gastroesophageal junction cancer from JAVELIN solid tumor phase Ib trial: analysis of safety and clinical activity. J Clin Oncol 2016; 34 (Suppl 15): abstr. 4009.
15. Le DT, Uram JN, Wang H et al. PD-1 blockade in tumors with mismatch repair deficiency. N Engl J Med 2015; 372 (26): 2509–2520. doi: 10.1056/NEJMoa1500596.
16. Registrar Corp.com. [online]. Available from: https: //www.fda.gov/drugs/informationondrugs/approveddrugs/ucm558048.htm.
17. Hellman MD, Rizvi NA, Goldman JW et al. Nivolumab plus ipilimumab as first-line treatment for advanced non-small-call lung cancer (Check Mate 012): results from an open-label, phase I, multicohort study. Lancet Oncol 2017; 18 (1): 31–41. doi: 10.1016/S1470-2045 (16) 30624-6.
18. Hato SV, A Khong A, de Vries IJ et al. Molecular pathways: The immunogenic effects of platinum-based chemotherapeutics. Clin Cancer Res 2014; 20 (11): 2831–2837. doi: 10.1158/1078-0432.CCR-13-3141.
19. Bang YJ, Muro K, Fuchs CS et al. KEYNOTE-059 cohort 2: Safety and efficacy of pembrolizumab (pembro) plus 5-fluorouracil (5-FU) and cisplatin for first-line (1L) treatment of advanced gastric cancer. J Clin Oncol 2017; 35 (Suppl 15): abstr. 4012.
20. Herbst RS, Bendell JC, Isambert N et al. A phase 1 study of ramucirumab (R) plus pembrolizumab (P) in patients (pts) with advanced gastric or gastroesophageal junction (G/GEJ) adenocarcinoma, non-small cell lung cancer (NSCLC), or urothelial carcinoma (UC): phase 1a results. J Clin Oncol 2016; 34 (Suppl 15): abstr. 3056.
21. Smyth EC, Wotherspoon A, Peckitt C et al. Mismatch Repair Deficiency, Microsatellite Instability, and Survival An Exploratory Analysis of the Medical Research Council Adjuvant Gastric Infusional Chemotherapy (MAGIC) Trial. JAMA Oncol 2017; 3 (9): 1197–1203. doi: 10.1001/jamaoncol.2016.6762.
22. Ohigashi Y, Sho M, Yamada Y et al. Clinical significance of programmed death-1 ligand-1 and programmed death-1 ligand-2 expression in human esophageal cancer. Clin Cancer Res 2005; 11 (8): 2947–2953. doi: 10.1158/1078-0432.CCR-04-1469.
23. Doi T, Piha-Paul SA, Jalal SI et al: Updated results for the advanced esophageal carcinoma cohort of the phase Ib KEYNOTE-028 study of pembrolizumab (MK-3475). J Clin Oncol 2016; 34 (Suppl 4): abstr. 7.
24. Kudo T, Hamamoto Y, Kato K et al. Nivolumab treatment for oesophageal squamous-cell carcinoma: an open-label, multicentre, phase 2 trial. Lancet Oncol 2017; 18 (5): 631–639. doi: 10.1016/ S1470-2045 (17) 30181-X.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Editorial
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2017 Číslo Supplementum3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Hodnocení zánětlivé celulizace (tumor infiltrujících lymfocytů) u solidních nádorů
- Imunoterapie v léčbě karcinomu plic
- Editorial
- Souhrnné srovnání kritérií RECIST 1.1 a iRECIST pro hodnocení odpovědi na onkologickou léčbu solidních tumorů
- Pokroky v imunoterapii maligního melanomu
- Kombinované režimy v imunoterapii
- Checkpoint inhibitory v léčbě nádorů horního gastrointestinálního traktu
- Imunoterapie zhoubného nádoru ledviny
- Imunoterapie karcinomu močového měchýře
- Imunoterapie nádorů dolní části trávicí trubice
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hodnocení zánětlivé celulizace (tumor infiltrujících lymfocytů) u solidních nádorů
- Souhrnné srovnání kritérií RECIST 1.1 a iRECIST pro hodnocení odpovědi na onkologickou léčbu solidních tumorů
- Imunoterapie nádorů dolní části trávicí trubice
- Imunoterapie v léčbě karcinomu plic
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



