-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Analýza nákladů na 1. linii léčby metastatického kolorektálního karcinomu při podání režimů s bevacizumabem – data z reálné klinické praxe v České republice
The Cost Study of First - line Treatment of Metastatic Colorectal Carcinoma with Bevacizumab - containing Regimen in the Czech Republic
Background:
Bevacizumab, a humanized monoclonal IgG antibody against the vascular endothelial growth factor (VEGF), is reimbursed in combination with chemotherapy for the first and subsequent‑line treatment of patients with metastatic colorectal cancer (mCRC) in the Czech Republic. However, its high cost is a potentially limiting factor. We assessed the cost of bevacizumab in the treatment of mCRC in a comprehensive cancer center.Patients and Methods:
A total of 218 patients were included in our analysis. Cost data (examination, medication, hospitalization) were collected since the initiation of bevacizumab treatment to any tumor response (RECIST criteria: complete response – CR, partial response – PR, stable disease – SD, progressive disease – PD) and/ or to death. Minimal follow‑up for all patients was 28 months. Costs were valued in Czech crowns (CZK) and converted to EUR (1€ = 25.14 CZK).Results:
PD was recorded in 194 patients (89% of patients). The mean cost of treatment to PD (median TTP 9.1 months) was 1,002,076.30 CZK (39,859.84 EUR). The majority of costs to PD was made by medication – 917,048.60 CZK (36,477.67 EUR) per patient. The mean cost to response PR, CR or SD was 1,105,823.10 CZK (43,986.60 EUR) after median 9.8 months of treatment (recorded for 21 patients), medication formed 1,023,827.70 CZK (40,725.05 EUR). During the study, 170 patients (78%) died. The mean of the total costs since initiation of treatment to death (median OS 18.8 months) was 1,338,874.20 CZK (53,256.70 EUR) – out of that, medication was 1,184,251.10 CZK (47,106.25 EUR) per patient.Conclusion:
Targeted biological therapy is the largest part of the costs of mCRC therapy. Cost of bevacizumab made up to 69% of costs to PD – 687,608.20 CZK ( 27,351.20 EUR ) per patient. The majority of the total cost was formed by targeted drug therapy (bevacizumab in 1st line therapy, cetuximab and panitumumab in 2nd and 3rd line therapy); 58% of total costs since initiation of treatment to death – 778,233.80 CZK (30,956 EUR) per patient.Key words:
drug costs – targeted molecular therapy – bevacizumab – antineoplastic agents – colorectal neoplasms
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
9. 3. 2014Accepted:
19. 5. 2014
Autoři: I. Hradecká 1; B. Říhová 1; R. Horová 2; Demlová R. 1 3
Působiště autorů: Farmakologický ústav, LF MU, Brno 1; Oddělení klinických hodnocení, Masarykův onkologický ústav, Brno 2; Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 3
Vyšlo v časopise: Klin Onkol 2014; 27(4): 255-260
Kategorie: Původní práce
Souhrn
Východiska:
Bevacizumab je rekombinantní chimérická monoklonální protilátka, která se selektivně váže na vaskulární endoteliální růstový faktor. Kombinace bevacizumabu s chemoterapií je hrazena v České republice u pacientů s metastazujícím kolorektálním karcinomem (metastatic colorectal cancer – mCRC) v 1. a vyšších liniích léčby. Pokusili jsme se proto s využitím dat z komplexního onkologického centra náklady na podání bevacizumabu v 1. linii stanovit.Soubor pacientů a metody:
Celkem bylo v naší analýze hodnoceno 218 pacientů. Finanční náklady na výkony, medikaci a hospitalizaci byly kalkulovány od zahájení léčby bevacizumabem do doby hodnocení odpovědi nádoru na léčbu při využití RECIST kritérií (complete response – CR, partial response – PR, stable disease – SD, progressive disease – PD) a/ nebo do úmrtí. Všichni pacienti byli sledováni minimálně po dobu 28 měsíců nebo do úmrtí.Výsledky:
Progrese byla zaznamenána u 194 pacientů (89 % souboru). Průměrné náklady v období do progrese onemocnění (PD; medián doby do progrese 9,1 měsíce) byly 1 002 076,30 Kč, přičemž největší podíl byl vynaložen na medikaci – průměrně 917 048,60 Kč na jednoho pacienta. Medián do dosažení protinádorové odpovědi (PR, SD nebo CR) byl 9,8 měsíce (zaznamenáno u 21 pacientů). Průměrné náklady na jednoho pacienta představovaly 1 105 823,10 Kč, samotná medikace byla 1 023 827,70 Kč. Během sledovaného období zemřelo 170 pacientů (78 % souboru). Průměrné náklady od zahájení léčby bevacizumabem do úmrtí (medián celkového přežití 18,8 měsíce) činily 1 338 874,20 Kč, z toho medikace 1 184 251,10 Kč.Závěr:
Největší podíl přímých nákladů na léčbu mCRC představují náklady na cílenou biologickou léčbu. Náklady na léčbu bevacizumabem v 1. linii léčby byly 687 608,20 Kč na jednoho pacienta (69 % nákladů do PD), veškerá biologická léčba indikovaná od začátku léčby do úmrtí (bevacizumab v 1. linii léčby, panitumumab a cetuximab ve vyšších liniích) tvořila 58 % všech nákladů (průměrně 778 233,80 Kč na jednoho pacienta).Klíčová slova:
náklady na léky – cílená molekulární terapie – bevacizumab – antitumorózní látky – kolorektální nádoryVýchodiska
Zhoubný novotvar kolorekta je podle statistik jednou z nejčastějších onkologických diagnóz v ČR. V evropském i celosvětovém srovnání se ČR řadí k zemím s nejčastějším výskytem i úmrtností na toto onemocnění. V roce 2010 bylo nově nahlášeno 8 265 případů zhoubných novotvarů kolorekta (4 951 případů u mužů a 3 314 u žen). Téměř 25 % zjištěných případů zhoubného novotvaru kolorekta je zachyceno ve IV. klinickém stadiu, tedy ve stadiu vzdálených metastáz [1]. Predikce celkové incidence pro rok 2014 předpovídá obdobnou situaci [2]. Prognóza pacientů s metastatickým karcinomem kolorekta (metastatic colorectal cancer – mCRC) není příznivá. Pětileté přežívání u těchto pacientů se pohybuje pod 15 % [3]. V posledních letech došlo k významnému rozvoji novějších léčebných možností, kdy kromě standardní chemoterapie na bázi fluoropyrimidinů, oxaliplatiny a irinotecanu jsou tyto režimy kombinovány s cílenými protinádorovými léčivy jako bevacizumab, cetuximab a panitumumab [4]. Cílená léčba, jež prokázala v kombinaci s chemoterapií další prodloužení v přežití bez progrese (progression‑free survival – PFS) i v celkovém přežití (overall survival – OS) pacientů s mCRC [5,6], je v ČR doporučována odbornou společností [2] a hrazena ze zdravotního pojištění pouze na specializovaných pracovištích v rámci komplexních onkologických center. V naší práci jsme se zaměřili na bevacizumab, který je v ČR registrován od 1. 7. 2005 a v současnosti hrazen u pacientů s performance status (ECOG PS) 0 – 1 v kombinaci s chemoterapeutickými režimy obsahujícími fluoropyrimidin pro 1. a vyšší linie léčby mCRC [7].
Bevacizumab je rekombinantní chimérická monoklonální protilátka, která se selektivně váže na vaskulární endoteliální růstový faktor (vascular endothelial growth factor – VEGF) a tím inhibuje nádorovou neoangiogenezi [8,9]. Kromě mCRC je v protinádorové léčbě podáván i u pokročilého metastazujícího nebo rekurentního plicního karcinomu, u metastazujícího karcinomu prsu a u metastazujícího karcinomu ledviny. Účinnost a bezpečnost terapie mCRC bevacizumabem byla prokázána randomizovanými klinickými studiemi. Studie AVF 2107 (Hurwitz et al), ve které byl bevacizumab podáván v kombinaci s režimem IFL (irinotekan, bolus 5 ‑ fluorouracil a leukovorin) v 1. linii léčby prokázala statisticky významné prodloužení celkového přežití (OS), přežití bez známek progrese (PFS) a četnost odpovědí na léčbu (response rate – RR) [5]. Studie N016966 (Saltz et al) hodnotící bevacizumab s režimy XELOX (kapecitabin a oxaliplatina) a FOLFOX (fluorouracil, leukovorin a oxaliplatina) v 1. linii léčby potvrdila statisticky významné prodloužení PFS [10]. Studie zaměřená na ověření bezpečnosti a účinnosti bevacizumabu v 1. linii léčby mCRC v běžné klinické praxi s režimem FOLFIRI (infuzní 5 ‑ fluorouracil, leukovorin a irinotekan) zjistila medián PFS 11,1 měsíce a medián OS 22,2 měsíce [11]. Rozsáhlá studie BEAT hodnotící účinnost a bezpečnost bevacizumabu s různými fluoropyrimidinovými režimy (monoterapie fluoropyrimidiny, režimy FOLFIRI, FOLFOX a XELOX v běžné klinické praxi prokázala medián PFS 10,8 měsíce a medián OS 22,7 měsíce, tedy v souladu se závěry předchozích studií fáze III [12]. Byla však publikována i randomizovaná studie fáze III, která neprokázala prodloužení OS u pacientů léčených kombinací irinotekan, leukovorin, 5 ‑ fluorouracil a bevacizumab oproti kontrolní skupině bez bevacizumabu [13]. V ČR proběhla menší studie s 16 pacienty hodnotící účinnost a toleranci bevacizumabu v kombinaci s kapecitabinem a irinotekanem (XELIRI), která prokázala vysokou protinádorovou účinnost – 78 % léčebných odpovědí [14].
Léčba bevacizumabem je ovšem i předmětem diskuzí z důvodů její finanční náročnosti ve vztahu k délce přežívání pacientů [15]. Zdravotnické systémy v různých zemích hledají řešení, jakým způsobem rozhodnout o hrazení nákladné cílené biologické léčby. V ČR není zatím stanovena hranice ochoty platit, jak je obvyklé v některých zemích.
Cílem naší práce bylo zhodnotit náklady na léčbu bevacizumabem u mCRC v reálné klinické praxi s využitím klinických dat a finančních nákladů získaných z komplexního onkologického centra.
Soubor pacientů a metody
Do naší analýzy bylo zahrnuto 218 pacientů z komplexního onkologického centra, u kterých bylo zahájeno podávání bevacizumabu v 1. linii léčby metastatického karcinomu kolorekta (C18 – C20) v období 11/ 2005 – 12/ 2010. Pacienti byli sledováni od zahájení terapie bevacizumabem (podávaným v kombinaci s některým z chemoterapeutických režimů) do progrese onemocnění a/ nebo do úmrtí. Ze zdravotnické dokumentace pacientů byly vybrány a hodnoceny tyto údaje: druh zahájené chemoterapie, délka a důvod ukončení podávání bevacizumabu, doba do progrese onemocnění, doba do dosažení protinádorové odpovědi, terapie po progresi onemocnění včetně případného podání další cílené biologické léčby ve vyšších liniích, doba do úmrtí (pokud bylo zaznamenáno). Náklady byly hodnoceny z pohledu plátce zdravotní péče na základě dat získaných z komplexního onkologického centra. Náklady na zdravotnické výkony, medikaci a případnou hospitalizaci byly zaznamenávány od zahájení léčby bevacizumabem do hodnocení odpovědi nádoru na léčbu dle RECIST kritérií (kompletní odpověď, complete response – CR, částečná odpověď, partial response – PR, stabilizace onemocnění, stable disease – SD, progrese onemocnění, progressive disease – PD) a/ nebo do úmrtí. Všichni pacienti byli sledováni minimálně po dobu 28 měsíců nebo do úmrtí.
Výsledky
Z celkového počtu 218 pacientů bylo 132 mužů (60,6 % souboru), průměrný věk pacientů při zahájení léčby byl 58,3 roku. Nejčastěji indikovaným chemoterapeutickým režimem kombinovaným s bevacizumabem byl XELOX u 55 % pacientů, následovaný režimy FOLFOX u 26 % pacientů a FOLFIRI u 4 % pacientů (tab. 1).
Tab. 1. Základní charakteristika souboru. 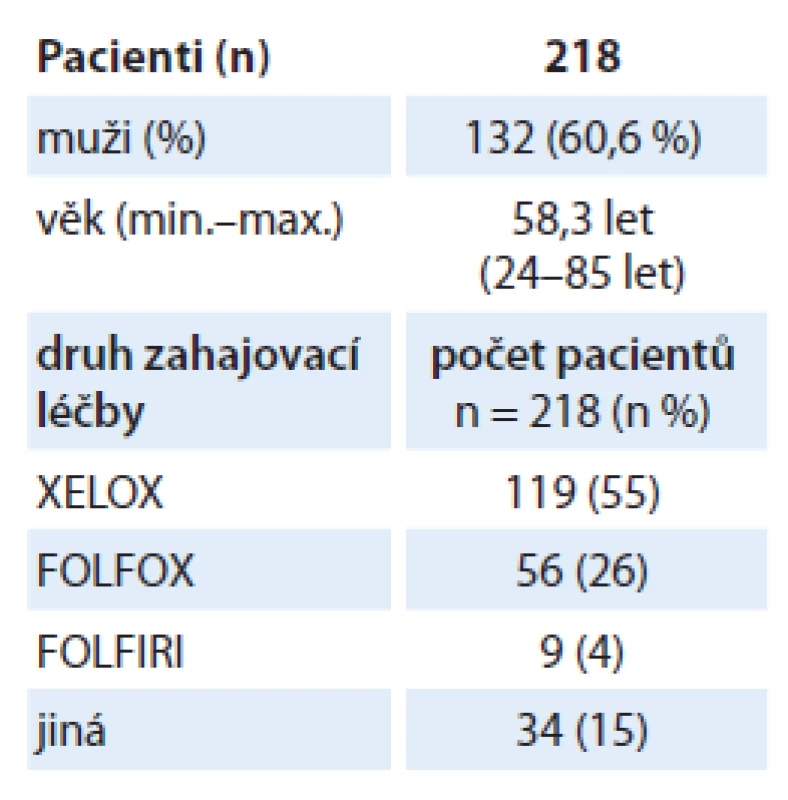
U 64 % pacientů byla léčba ukončena z důvodu progrese onemocnění (139 pacientů), u 10 % bylo dosaženo protinádorové odpovědi (celkem 21 pacientů; konkrétně PR – 1 pacient, SD – 10 pacientů a CR – 10 pacientů). Ukončení podávání bevacizumabu při dosažené kompletní nebo parciální remisi nebo při stabilizaci onemocnění bylo dáno skutečností současného ukončení chemoterapie z důvodů nežádoucích účinků nebo zhoršujícího se performance status. V případě ukončení chemoterapie bylo nutno ukončit i podávání bevacizumabu, protože tento nelze hradit ze zdravotního pojištění při podávání v monoterapii, přestože došlo k dosažení parciální remise nebo stabilizace onemocnění. U dalších 8 % (18 pacientů) byla léčba ukončena z důvodu nežádoucích účinků a u 5 % (12 pacientů) byla léčba přerušena kvůli indikované chirurgické léčbě (graf 1).
Graf 1. Důvody ukončení léčby bevacizumabem (n = 218). 
Během sledovaného období byla zaznamenána progrese u 194 pacientů (89 % souboru). Průměrné náklady na období doby do progrese onemocnění (PD; medián 9,1 měsíce) činily 1 002 076,30 Kč. Největší podíl finančních nákladů do PD byl vynaložen na medikaci – průměrně 917 048,60 Kč na jednoho pacienta, přičemž samotný bevacizumab tvořil 69 % celkových nákladů do PD (687 608,20 Kč) (graf 2).
Graf 2. Struktura nákladů na léčbu do progrese onemocnění (n = 194). 
Medián do dosažení protinádorové odpovědi (PR, SD nebo CR) byl 9,8 měsíce. Průměrné náklady na jednoho pacienta od zahájení léčby do zaznamenání protinádorové odpovědi představovaly 1 105 823,10 Kč.
Po zaznamenání PD byla u některých pacientů i v dalších liniích léčby indikována cílená biologická léčba. Z celkového počtu 170 pacientů sledovaných po progresi do úmrtí bylo 34 pacientů (20 %) léčeno cetuximabem a 18 pacientů (10,6 %) panitumumabem. Náklady na tuto biologickou léčbu vztažené na celý sledovaný soubor byly 144 478,60 Kč na jednoho pacienta a představovaly tak 43 % všech finančních nákladů po progresi onemocnění (graf 3).
Graf 3. Struktura nákladů po progresi onemocnění (n = 170). 
Úmrtí bylo během sledovaného období zaznamenáno u 170 pacientů (78 % souboru). Medián OS pacientů byl 18,8 měsíce. Zjištěné průměrné náklady od zahájení léčby bevacizumabem do úmrtí činily 1 338 874,20 Kč. Samotná medikace za celé sledované období od zahájení léčby bevacizumabem do úmrtí byla 1 184 251,10 Kč (88 % nákladů). Cílená biologická léčba (bevacizumab, panitumumab a cetuximab) byla průměrně 778 233,80 Kč a představovala 58 % všech finančních nákladů od zahájení léčby bevacizumabem do úmrtí pacienta (graf 4). Strukturu nákladů uvádí tab. 2.
Graf 4. Struktura nákladů od zahájení léčby do úmrtí (n = 170). 
Tab. 2. Struktura nákladů na léčbu. 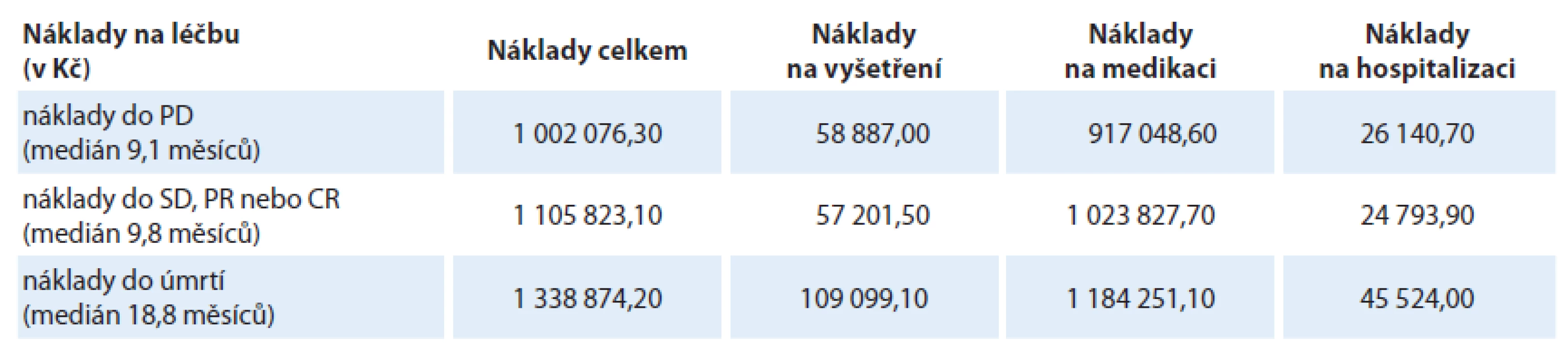
Diskuze
Cílem naší práce bylo zhodnotit finanční náklady na terapii mCRC u pacientů, kterým byla v 1. linii léčby s chemoterapeutickým režimem podávána biologická cílená léčba, v našem případě léčivý přípravek Avastin® (bevacizumab). Cytostatická léčba je z finančního hlediska velmi náročná. Cytostatika (skupina L) zaujímají první místo v distribuci dle finančních objemů. V roce 2012 bylo vydáno na cytostatika 11,56 miliardy Kč, což představovalo 19,7 % všech finančních nákladů vynaložených na léčiva [16]. Samotný bevacizumab obsadil v roce 2012 deváté místo v hodnocení dle finančních objemů distribuovaných přípravků [17]. Cílená biologická léčba představuje novou možnost pro zlepšení nepříznivé prognózy u pacientů s mCRC. Proběhlé studie prokázaly, že v kombinaci s chemoterapií prodlužuje PFS a OS pacientů [5,10,18].
Účinnost bevacizumabu v 1. linii léčby mCRC ve srovnání s chemoterapeutickými režimy prokázaly randomizované klinické studie AVF 2107 a N016966 [5,10], v běžné klinické praxi pak studie BEAT [12]. V ČR pomáhá hodnotit přínos léčby bevacizumabem u mCRC klinický registr Corect [19]. Medián PFS byl 10,6 měsíce [5], 9,4 měsíce [10], 10,8 měsíce [12] a 11,3 měsíce [19]. Medián OS byl 20,3 měsíce [5], 21,3 měsíce [10], 22,7 měsíce [12] a 27,2 měsíce [19]. V naší analýze z reálných klinických dat komplexního onkologického centra byl zjištěn obdobný medián doby do progrese (time to progression – TTP) 9,1 měsíce, avšak kratší medián OS 18,8 měsíce, což si vysvětlujeme kratším obdobím follow‑up (28 měsíců) v naší analýze zaměřené primárně na náklady na léčbu bevacizumabem, tedy na období do PD.
Analýza přímých nákladů na léčbu metastatického karcinomu kolorekta v klinické praxi nebyla v ČR zatím provedena. Dostupné jsou analýzy nákladové efektivity a analýzy dopadu na rozpočet vycházející z klinických studií podání bevacizumabu ve 2. linii léčby, které držitel rozhodnutí o registraci léčivého přípravku Avastin® (bevacizumab) předložil jako součást žádosti o rozšíření indikací hrazených z prostředků zdravotního pojištění [20]. Součástí tohoto správního řízení jsou i analýzy nákladové efektivity vypracované Státním ústavem pro kontrolu léčiv (SÚKL).
Dvě z analýz vypracovaných SÚKL vycházejí z dat studií N016966 a AVF 2107, tedy podání bevacizumabu v 1. linii léčby. Analýza nákladové efektivity podání bevacizumabu s léčebnými režimy XELOX nebo FOLFOX zjistila náklady na medikaci 604 175,10 Kč a inkrementální poměr nákladové efektivity (incremental costs – ICER) 2 206 373 Kč za rok bez progrese onemocnění, přičemž uvažovaná doba podávání terapie byla šest měsíců, tedy významně kratší, než jsme zjistili naší analýzou z reálné klinické praxe. Druhá z analýz nákladové efektivity bevacizumabu byla vypočítána pro režim IFL, kdy náklady na farmakoterapii byly stanoveny ve výši 870 657,50 Kč a ICER činil 1 984 937 Kč za rok bez progrese při délce terapie 9,3 měsíce [20]. Tyto hodnoty již považujeme za srovnatelné s daty našeho souboru pacientů (náklady na medikaci do progrese onemocnění, tj. za 9,1 měsíce, 917 048,55 Kč), avšak je třeba zdůraznit, že v našem souboru aplikace bevacizumabu probíhala až do progrese onemocnění jen u 64 % pacientů.
O úhradě cílené biologické léčby v různých zdravotních systémech ve světě obvykle rozhoduje výsledek inkrementálního poměru nákladové efektivity vyjádřený jako náklady na rok získaného života v plné kvalitě (quality adjusted life year – QALY). Ve Velké Británii byla na žádost NICE (National Institute for Health and Clinical Excellence) vypracována analýza hodnotící přínos bevacizumabu v kombinaci s IFL (irinotekan, 5 ‑ fluorouracil a leukovorin) a v kombinaci s 5 ‑ FU/ LA (5 ‑ fluorouracil a leukovorin) v 1. linii léčby u mCRC. Zjištěné hodnoty 62 857 GBP/ QALY u režimu bevacizumab plus IFL a 88 436 GBP/ QALY pro kombinaci bevacizumab plus 5 ‑ FU/ LA byly nad hranicí ochoty platit (30 000 GBP/ QALY) [21]. V Kanadě bylo podání bevacizumabu v 1. i 2. linii léčby v kombinaci s irinotekanem a 5 ‑ fluorouracilem hodnoceno jako nákladově efektivní (ICER 62 469 CAD/ QALY byl shledán jako akceptovatelný) [22]. Irská studie hodnotící průměrné náklady vynaložené na léčbu mCRC z pohledu plátce zdravotní péče publikovaná v roce 2012 dospěla k částce 39 039 EUR za pacienta diagnostikovaného ve stadiu IV v případě, že 80 % souboru léčených pacientů má indikovanou cílenou biologickou léčbu. Náklady na léčbu pacienta diagnostikovaného ve stadiu IV bez cílené biologické léčby byly 24 040 EUR [23]. V japonské studii nákladové efektivity byla za přijatelnou považována pouze kombinace režimu CAPOX (oxaliplatina, kapecitabin) s bevacizumabem v 1. linii léčby mCRC (ICER 83 000 USD/ LYG), i když hranice ochoty platit není v Japonsku stanovena [24]. Podobně studie vypracovaná v Jižní Koreji připouští podání bevacizumabu v kombinaci s režimem FOLFIRI v 1. linii léčby mCRC jako nákladově efektivní, ačkoliv v této zemi není stanovena hranice ochoty platit [25]. Každá země má jiný systém zdravotní péče, a proto nelze závěry zahraničních studií jednoduše přejímat.
Metastatický karcinom kolorekta patří k onemocněním s velmi špatnou prognózou. Léčba bevacizumabem v kombinaci s chemoterapeutickými režimy prodlužuje čas do progrese (TTP) i celkové přežití (OS) pacientů, ale vede ke zvýšení finančních nákladů na léčbu. Je třeba si uvědomit, že náklady na léčbu mCRC se budou pravděpodobně v dalších letech zvyšovat. Statistický model odhadující počet pacientů léčených protinádorovou terapií v roce 2015 v ČR predikuje, že 3 485 – 4 469 pacientů bude léčeno ve stadiu IV, což by představovalo 34 – 40 % všech pacientů se zhoubným novotvarem kolorekta, kteří budou v roce 2015 léčeni [26]. Je proto třeba hledat kompromisy pro nejvhodnější využití cílené biologické léčby, protože finanční zdroje zdravotního systému jsou omezené.
Závěr
Přidání bevacizumabu k chemoterapeutickému režimu terapie metastatického kolorektálního karcinomu představuje pro plátce zdravotní péče významnou finanční zátěž. Náklady na medikaci zaznamenané v komplexním onkologickém centru do progrese onemocnění (medián doby do progrese 9,1 měsíce) představovaly průměrně 917 048,60 Kč na jednoho pacienta, z toho samotný bevacizumab 687 608,20 Kč, což bylo 69 % celkových nákladů do progrese onemocnění. Cílená biologická léčba ve vyšších liniích léčby (cetuximab a panitumumab) indikovaná u části pacientů (30,6 %) po progresi onemocnění činila v průměru 144 478,60 Kč na jednoho léčeného pacienta.
Průměrná výše nákladů na cílenou biologickou léčbu mCRC zaznamenaná až do úmrtí pacienta (medián OS 18,8 měsíce) tvořila v našem souboru pacientů více než polovinu (58 %) všech přímých nákladů na léčbu (průměrně 1 338 874,20 Kč od zahájení léčby bevacizumabem do úmrtí). Naše výsledky tak potvrzují, že výdaje na nákladnou cílenou biologickou léčbu jsou nejvýznamnější složkou přímých zdravotnických nákladů na léčbu mCRC.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
PharmDr. Irena Hradecká
Farmakologický ústav LF MU Kamenice 753/5
625 00 Brno
e-mail: irena.hradecka@tiscali.cz
Obdrženo: 9. 3. 2014
Přijato: 19. 5. 2014
Zdroje
1. Zvolský M (ed.). Zhoubné nádory v roce 2010. [citováno 18. prosince 2013]. Dostupné z: http:/ / www.uzis.cz/ rychle ‑ informace/ zhoubne ‑ nadory ‑ roce ‑ 2010.
2. Modrá kniha České onkologické společnosti, 18. vyd.Masarykův onkologický ústav 2014. [citováno 1. března 2014]. Dostupné z: http:/ / www.linkos.cz/ informace ‑ pro‑praxi/ modra ‑ kniha/ .
3. Pavlík T, Májek O, Dušek L (eds). Přežití a kvalita péče o pacienty s kolorektálním karcinomem. [citováno 1. března 2014]. Dostupné z: http:/ / www.kolorektum.cz/ index.php?pg=pro‑odborniky ‑ ‑ preziti ‑ a ‑ kvalita ‑ pece ‑ o ‑ pacienty ‑ s ‑ kolorektalni ‑ karcinomem.
4. Grothey A. Optimální léčba metastazujícího kolorektálního karcinomu. [citováno 1. března 2014]. Dostupné z: http:/ / www.linkos.cz/ asco/ chapter/ optimalni ‑ lecba ‑ metastazujiciho ‑ kolorektalniho ‑ karcinomu/ .
5. Hurwitz H, Fehrenbacher L, Novotny W et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004; 350(23): 2335 – 2342.
6. Cutsem EV, Kohne CH, Hitre E et al. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med 2009; 360(14): 1408 – 1417. doi: 10.1056/ NEJMoa0805019.
7. Sukl.cz [internetová stránka]. Státní ústav pro kontrolu léčiv. Avastin, detail léčivého přípravku, ceny a úhrady, indikační omezení. [citováno 30. září 2013]. Dostupné z: http:/ / www.sukl.cz/ modules/ medication/ detail.php?code=0028397&tab=prices.
8. McCormack PL, Keam SJ. Bevacizumab: a review of its use in metastatic colorectal cancer. Drugs 2008; 68(4): 487 – 506.
9. Ema.auropa.eu [homepage on the Internet]. Avastin product information. European Medicines Agency [cited 2013 Sep 30]. Available from: http:/ / www.ema.europa.eu/ ema/ index.jsp?curl=pages/ medicines/ human/ medicines/ 000582/ human_med_000663.jsp&mid=WC0b01ac058001d124.
10. Saltz LB, Clarke S, Díáz ‑ Rubio E et al. Bevacizumab in combination with oxaliplatin‑based chemotherapy as first‑line therapy in metastatic colorectal cancer: a randomized phase iii study. J Clin Oncol 2008; 26(12): 2013 – 2019. doi: 10.1200/ JCO.2007.14.9930.
11. Sobrero A, Ackland S, Clarke S et al. Phase IV study of bevacizumab in combination with infusional fluorouracil, leucovorin and irinotecan (FOLFIRI) in first‑line metastatic colorectal cancer. Oncology 2009; 77(2): 113 – 119. doi: 10.1159/ 000229787.
12. Cutsem EV, Rivera F, Berry S et al. Safety and efficacy of first‑line bevacizumab with FOLFOX, XELOX, FOLFIRI and fluoropyrimidines in metastatic colorectal cancer: the BEAT study. Ann Oncol 2009; 20(11): 1842 – 1847. doi: 10.1093/ annonc/ mdp233.
13. Stathopoulos GP, Batziou C, Trafalis D et al. Treatment of colorectal cancer with and without bevacizumab: a phase III study. Oncology 2010; 78(5 – 6): 376 – 381. doi: 10.1159/ 000320520.
14. Kocáková I, Kocák I, Svoboda M et al. Bevacizumab v kombinaci s kapecitabinem a irinotekanem (XELIRI) v léčbě metastatického kolorektálního karcinomu. Klin Onkol 2009; 22(2): 73 – 76.
15. Garattini L, van de Vooren K, Zaniboni A. Ethics for end‑of‑life treatments: metastatic colorectal cancer is one example. Health Policy 2013; 109(1): 97 – 103. doi: 10.1016/ j.healthpol.2012.08.017.
16. Uzis.cz [internetová stránka]. Ekonomické informace ve zdravotnictví 2012. Ústav zdravotnických informací a statistiky ČR 2012 [citováno 1. března 2014 ]. Dostupné z:http:/ / www.uzis.cz/ publikace/ ekonomicke ‑ informace ‑ ve ‑ zdravotnictvi ‑ 2012.
17. Sukl.cz [internetová stránka]. Státní ústav pro kontrolu léčiv. Hodnocení dodávek distribuovaných léčivých přípravků za rok 2012 [citováno 1. března 2014]. Dostupné z:http:/ / www.sukl.cz/ hodnoceni ‑ dodavek ‑ distribuovanych ‑ lecivych ‑ pripravku ‑ za ‑ rok ‑ 2.
18. Kabbinavar FF, Hambleton J, Mass RD et al. Combined analysis of efficacy: the addition of bevacizumab to fluoro-uracil/ leucovorin improves survival for patients with metastatic colorectal cancer. J Clin Oncol 2005; 23(16): 3706 – 3712.
19. Linkos.cz [internetová stránka]. Klinický registr CORECT [citováno 11. března 2014]. Dostupné z: http: http:/ / www.linkos.cz/ prehled ‑ registru/ klinicky ‑ registr ‑ corect/ .
20. Sukl.cz [internetová stránka]. Státní ústav pro kontrolu léčiv. Dokumentace tvořící spis správních řízení, které se týkají stanovení maximální ceny, stanovení výše a podmínek úhrady. VaPÚ Avastin SUKLS85212/ 2008 [citováno 18. března 2013]. Dostupné z: www.sukl.cz.
21. Tappenden P, Jones R, Paisley S et al. The cost‑effectiveness of bevacizumab in the first‑line treatment of metastatic colorectal cancer in England and Wales. Eur J Cancer 2007; 43(17): 2487 – 2494.
22. Hedden L, Kennecke H, Villa D et al. Incremental cost‑effectiveness of the pre ‑ and post‑bevacizumab eras of metastatic colorectal cancer therapy in British Columbia, Canada. Eur J Cancer 2012; 48(13): 1969 – 1976. doi: 10.1016/ j.ejca.2012.01.012.
23. Tilson L, Sharp C, Usher C et al. Cost of care for colorectal cancer in Ireland: a health care payer perspective. Eur J Health Econ 2012; 13(4): 511 – 524. doi: 10.1007/ s10198 ‑ 011 ‑ 0325 ‑ z.
24. Shiroiwa T, Fukuda T, Tsutani K. Cost‑effectiveness analysis of bevacizumab combined with chemotherapy for the treatment of metastatic colorectal cancer in Japan. Clin Ther 2007; 29(10): 2256 – 2267.
25. Lee EK, Revil C, Ngoh CA et al. Clinical and cost effectiveness of bevacizumab + FOLFIRI combination versus FOLFIRI alone as first‑line treatment of metastatic colorectal cancer in South Korea. Clin Ther 2012; 34(6): 1408 – 1419. doi: 10.1016/ j.clinthera.2012.05.001.
26. Pavlík T, Májek O, Mužík J et al. Estimating the number of colorectal cancer patients treated with anti‑tumour therapy in 2015: the analysis of the Czech National Cancer Registry. BMC Public Health 2012; 12(1): 117. doi: 10.1186/ 1471 ‑ 2458 ‑ 12 ‑ 117.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Aktuality z odborného tiskuČlánek Soutěž o nejlepší práciČlánek Pozitronová emisní tomografie kombinovaná s počítačovou tomografií pro diagnózu synchronních nádorůČlánek Dendritické buněčné vakcíny proti nemalobuněčnému karcinomu plic – nová terapeutická alternativaČlánek Aktuality z odborného tiskuČlánek Liga proti rakovině
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2014 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Aktuality z odborného tisku
- Soutěž o nejlepší práci
- Předpokládaná účinnost HPV vakcinace v profylaxi nongenitálních karcinomů
- Brazilský příběh mutace p53 R337H
- Analýza nákladů na 1. linii léčby metastatického kolorektálního karcinomu při podání režimů s bevacizumabem – data z reálné klinické praxe v České republice
- Screening rizika malnutrice versus ukazatelé nutričního stavu a systémové zánětlivé odpovědi u pacientů s nově diagnostikovaným karcinomem plic
- Vzťah medzi sérovou hladinou karboanhydrázy IX, hypoxiou a rádiorezistenciou nádorov hlavy a krku
- Soutěž na podporu autorských týmů publikujících v zahraničních odborných titulech
- Vliv anakinry na cytokinové profily a profily lymfocytů/ monocytů u pacienta s Erdheim-Chesterovou nemocí
- Pozitronová emisní tomografie kombinovaná s počítačovou tomografií pro diagnózu synchronních nádorů
- Informace z České onkologické společnosti
- Paraneoplastická vaskulitída u pacientky s karcinómom krčku maternice
- Akupunktura v léčbě symptomů onkologického onemocnění v západním světě
- Dendritické buněčné vakcíny proti nemalobuněčnému karcinomu plic – nová terapeutická alternativa
- Aktuality z odborného tisku
- Liga proti rakovině
- Pacient s Cowdenovým syndromem způsobeným mutací v genu PTEN (archiv 2. LF UK a FN v Motole)
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Brazilský příběh mutace p53 R337H
- Akupunktura v léčbě symptomů onkologického onemocnění v západním světě
- Paraneoplastická vaskulitída u pacientky s karcinómom krčku maternice
- Screening rizika malnutrice versus ukazatelé nutričního stavu a systémové zánětlivé odpovědi u pacientů s nově diagnostikovaným karcinomem plic
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



