-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Plazminogen aktivátor systém a jeho klinický význam u pacientů s nádorovým onemocněním
Plasminogen Activator System and its Clinical Significance in Patients with a Malignant Disease
Urokinase (uPA) plays an essential role in the activation of plasminogen to plasmin, a serine protease participating in the activation of matrixmetaloproteinases, latent elastases, growth factors and cytokines involved in the degradation of extracellular matrix elements. Together with its receptor (uPAR), tissue activator (tPA) and urokinase inhibitors (PAI-1, PAI-2, PAI-3 and protease nexin), it forms the plasminogen activator system (PAS), a component of metastatic cascade importantly contributing to the invasive growth and angiogenesis of malignant tumours. Plasminogen activator inhibitor 1 inhibits uPA-dependent invasiveness of some cancer cell lines. The vitronectin-PAI-1 complex inhibits migration of smooth muscle cells by binding αvβ3 integrin to vitronectin. PAI-1 or its deficiency interferes with signalling pathways such as PI3K/Akt and JAK/STAT and it is included in the processes of maintaining the integrity of the endothelial cells and thereby regulation of cell death. PAI-1 affects apoptosis by reducing cell adhesion and functioning of intracellular signalling pathways. The individual components of PAS undoubtedly play an important role in angiogenesis and metastasising of malignant tumours. In the near future, results of published studies with various types of cancer could be reflected in diagnostic and therapeutic algorithms and, at the same time, could serve as the goal for targeted therapies.
Key words:
plasminogen activators – U-PA – U-PA receptor – PAI-1 – PAI-2
This study was supported by the following research programme of the Ministry of Health of the Czech Republic: FUNDIN MO0MOU2005.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
3. 4. 2011Accepted:
20. 9. 2011
Autoři: J. Halámková 1; I. Kiss 1
; J. Tomášek 1
; Z. Pavlovský 2; Z. Čech 3; Š. Tuček 1; L. Hanáková 4; M. Moulis 2; M. Penka 3
Působiště autorů: Klinika komplexní onkologické péče, Masarykův onkologický ústav a LF MU Brno 1; Patologicko-anatomický ústav FN Brno a LF MU 2; Oddělení klinické hematologie FN Brno a LF MU 3; Interní hematoonkologická klinika FN Brno a LF MU 4
Vyšlo v časopise: Klin Onkol 2011; 24(6): 418-423
Kategorie: Přehledy
Souhrn
Urokináza (uPA) hraje zásadní roli v aktivaci plazminogenu na plazmin, který patří mezi serinové proteinázy a současně se podílí na aktivaci matrixmetaloproteináz, latentních elastáz, růstových faktorů a cytokinů, které se účastní degradace elementů extracelulární matrix. Urokináza tvoří společně se svým receptorem (uPAR), tkáňovým aktivátorem (tPA) a inhibitory urokinázy (PAI-1, PAI-2, PAI-3 a protease nexin) plazminogen aktivátor systém (PAS), který je součástí metastatické kaskády a významnou měrou se podílí na invazivním růstu a angiogenezi maligních nádorů. PAI-1 inhibuje uPA dependentní invazivitu buněčných linií některých karcinomů a společně v komplexu vitronectin-PAI-1 inhibuje migraci hladkých svalových buněk blokádou αvβ3 integrinu k vitronectinu. PAI-1 nebo jeho nedostatek také alteruje se signálními cestami, jako např. PI3K/Akt a Jak/STAT, a je zahrnut do procesů udržení integrity endoteliálních buněk, a tím i regulace buněčné smrti, kterou ovlivňuje snížením buněčné adheze a působením na intracelulární signální dráhy. Na základě výsledků již publikovaných studií by některé faktory PAS mohly plnit funkci prognostického parametru a společně se zvýšenou plazmatickou hladinou PAI-1 by měly být brány v úvahu v diagnosticko-terapeutickém procesu vybraných pacientů s nádorovým onemocněním. Zvýšená exprese jednotlivých částí PAS v nádorové tkáni by mohla být využita při plánování léčby šité na míru (tailored therapy) a současně by se jeho jednotlivé složky mohly stát terčem cílené léčby.
Klíčová slova:
plazminogen aktivátor systém – U-PA – U-PA receptor – PAI-1 – PAI-2Fibrinolýza
Jako fibrinolýzu označujeme proces, při kterém dochází k degradaci fibrinu na fibrinové monomery. Hlavním enzymem podílejícím se na fibrinolýze je plazmin, který je produkován v inaktivní formě jako plazminogen v játrech [1]. Tkáňový aktivátor plazminogenu (tPA) a urokináza (uPA) jsou agens konvertující plazminogen na aktivní plazmin (obr. 1).
Obr. 1. Zjednodušené schéma fibrinolýzy. 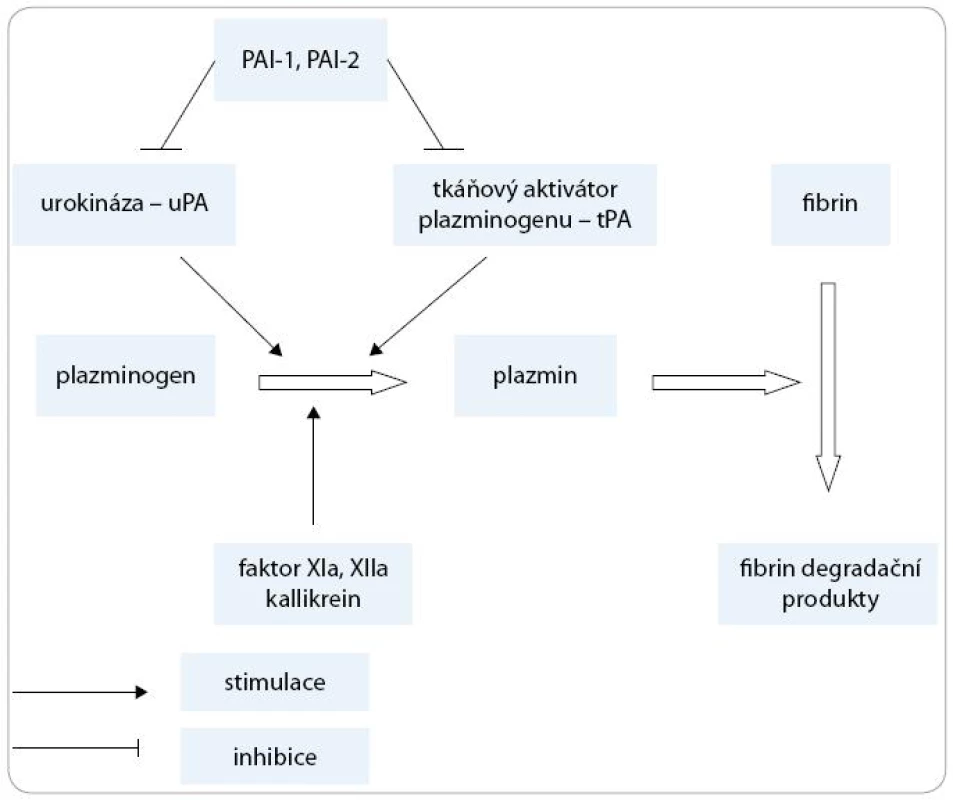
Proces aktivace plazminogenu probíhá ve třech různých cestách:
- Vnitřní aktivační systém (intrinsic) – sestává z faktoru XII, faktoru XI, prekallikreinu, kininogenu.
- Vnější aktivační systém (extrinsic) – hlavními aktivátory jsou tPA (tkáňový aktivátor plazminogenu) a uPA (urokináza).
- Exogenní aktivační systém – aktivátory mohou být některé bakteriální proteiny (streptokináza, stafylokináza) nebo trombolytické léky [1].
Jednotlivé složky plazminogen aktivátor systému
Tkáňový aktivátor plazminogenu (tPA) je serinovou proteinázou, která je přítomna v cévních endoteliích a v buňkách téměř všech parenchymatózních orgánů. V plazmě cirkuluje společně v komplexu s inhibitorem urokinázy 1 (PAI-1) [1]. Urokináza (uPA) je serinová proteináza, která hraje zásadní roli v aktivaci plazminogenu na plazmin. Plazmin společně se svým receptorem (uPAR), tkáňovým aktivátorem (tPA) a inhibitory urokinázy (PAI-1, PAI-2, PAI-3 – identický s inhibitorem proteinu C – a protease nexin) [1] tvoří plazminogen aktivátor systém (PAS), který je součástí metastatické kaskády a významnou měrou se podílí na invazivním růstu a angiogenezi maligních nádorů [2]. Urokináza hraje zásadní roli v degradaci tkání při fyziologických i patologických pochodech, na rozdíl od tPA, který má zásadní význam pro fibrinolýzu.
Receptor urokinázy uPAR je receptor pro uPA. Navázáním uPA k uPAR dochází k aktivaci signální transdukce, jejímž výsledkem je stimulace buněčné proliferace, modulace adheze a zvýšení buněčné migrace [3].
Nejvýznamnějšími specifickými inhibitory jsou PAI-1 a PAI-2, které reagují s receptorem uPA, oba náleží do rodiny serpinů (serine protease inhibitor super-family) [4].
PAI-1 je tvořen převážně v hladké svalovině cév, v megakaryocytech, endoteliích, granulocytech, monocytech, makrofázích a nádorových buňkách. Jedná se o serpin přítomný v plazmě a v α-granulích trombocytů, má schopnost vazby na vitronectin [5–7]. Komplex vitronectin-PAI-1 má delší poločas rozpadu a inhibuje migraci hladkých svalových buněk blokádou αvβ3 integrinu k vitronectinu [8,9]. PAI-1 je nejúčinnějším inhibitorem uPA a tPA. Obvykle je plazmatická hladina PAI-1 nízká a jeho vysoká hladina je asociována s různými typy onemocnění, např. vaskulárními chorobami či maligními tumory.
PAI-2 je známý také jako placentární plazminogen aktivátor inhibitor. Jeho hladina v plazmě je zvýšena u těhotných žen. Kromě toho bylo zjištěno, že hraje určitou roli v procesu růstu maligních tumorů.
I když přesný mechanizmus lokálního růstu a metastazování maligních nádorů dosud není znám, je jasné, že se na něm podílí řada faktorů a především proteolytických enzymů, které narušují extracelulární matrix. Jasným prvním krokem k malignizaci do té doby benigního nádoru se stává destrukce bazální membrány právě prostřednictvím proteolytických enzymů, která napomáhá jak lokální invazivitě tumoru, tak jeho metastazování, což jsou základní procesy maligního růstu tumoru. Tato sekvence přechodu normální tkáň – maligní nádor – metastáza je doprovázena rostoucí expresí uPA, uPAR, PAI-1 a PAI-2 se současným snížením exprese tPA [10,11].
V rámci metastatické kaskády dochází k uvolnění buňky z primárního ložiska, prostupu přes bazální membránu a extracelulární matrix do cévního systému, kterým se dostává na stanovené místo, kde opět prostoupí bazální membránou a extracelulární matrix a založí vzdálenou metastázu. Základním procesem je tedy buněčná adheze zprostředkovaná integriny, kadheriny, kateniny, selektiny, imunoglobuliny a dalšími adhezivními molekulami a extracelulárními proteolytickými enzymy, jako jsou např. matrixmetaloproteinázy, cysteinproteinázy (např. katepsin B, L a D) a serinproteinázy (např. urokináza). Kromě proteolytického efektu byla prokázána účast urokinázy i v procesu angiogeneze, jíž se účastní svou katalytickou funkcí, ale i parakrinně autokrinním efektem na buněčnou migraci [12].
Lze říci, že plazminogenem vázané molekuly hrají zásadní roli v invazi a metastazování tumoru. Aktivace uPA je regulována prostřednictvím urokinázového receptoru (uPAR). Navázáním uPA na uPAR dochází k aktivaci proteintyrozinkináz [13], proteinkinázy C [14] a MAP kinázy [15]. Současně byla popsána i přímá signální cesta Jak/STAT kaskádou s využitím signální transdukce Scr-like proteintyrozinkinázy [16]. Exprese uPAR je regulována řadou růstových faktorů, např. EGF, bFGF a HGF. Extracelulární interakce mezi uPA, uPAR, α5β1 integrinem a fibronektinem iniciuje intracelulární signální kaskádu zprostředkovanou přes epidermální růstový faktor [17]. Systém uPAR/uPA/PAI-1 se také podílí na angiogenezi indukované prostřednictvím VEGF [18].
Klinický význam PAS u nádorových onemocnění
Jednoznačně nejjasnější spojitost jednotlivých součástí PAS s prognózou byla zjištěna u pacientek s karcinomem prsu. Jako první popsal signifikantní korelaci mezi elevací uPA v tkáňovém extraktu tumoru a nádorovou progresí Duffy v roce 1988, následně byl pak tento závěr potvrzen i jinými autory [19–21]. Byla prokázána i signifikantně horší prognóza u pacientek s elevací PAI-1 v tumoru, v kontrastu s tím by měl PAI-2 u těchto nádorů znamenat lepší prognózu [22,23]. Foekens et al publikovali práci, jejímž závěrem bylo, že uPA negativní pacientky měly lepší odpověď na léčbu tamoxifenem. Pacientky s uPA pozitivními a PAI-1 pozitivními tumory měly kratší PFS a celkové přežití [24]. PAI-1 a uPA byly pak označeny za silné, nezávislé prognostické faktory u pacientek s negativními lymfatickými uzlinami [25].
U pacientů s nádory urogenitálního traktu byly signifikantní výsledky publikovány ve vztahu k expresi uPA a PAI-1 v nádoru k prognóze onemocnění u pacientek s karcinomem ovaria, endometria a cervixu. U žen s karcinomem endometria byla zjištěna zvýšená exprese uPA, PAI-1 i PAI-2 v nádorové tkáni pacientek s horší prognózou. Současně bylo potvrzeno, že vysoká stromatická exprese uPA a vysoká exprese PAI-1 na nádorových buňkách znamenala zvýšené riziko postižení lymfatických uzlin [26–29].
Hasui et al v několika studiích prokázali, že uPA je prognostickým faktorem u pacientů s povrchovým nádorem močového měchýře [30]. Hofman et al ve svých výzkumech upozornili na elevaci uPA, uPAR a PAI-1 jako prediktoru časné recidivy a metastáz u pacientů s karcinomem ledviny [31]. Význam jednotlivých složek PAS byl zkoumán i u pacientů s karcinomem prostaty. Zde bylo zjištěno, že u extenzivně rostoucích nádorů se zvyšuje exprese uPA. U těchto typů nádorů byl jako u jedněch z prvních zahájen výzkum léčebné „down regulace“ uPA/uPAR komplexu jako chemopreventivní či terapeutický cíl [32].
Zvýšená exprese uPA a PAI-1 v primárním tumoru byla hodnocena jako nezávislý prognostický faktor také u karcinomu pankreatu, jícnu, žaludku a dutiny ústní [33–36]. PAI-1, uPA a uPAR prokázaly prognostický vztah i u nádorů mozku, plic a měkkých tkání. Vysoká cytoplazmatická hladina uPA byla nalezena u nádorových buněk všech grade 4 a většiny grade 3 mozkových nádorů. Vysoké hladiny uPA byly zjištěny u maligních gliomů, kdy u low-grade nádorů byla nádorová exprese uPA minimální. Pacienti s vysokou expresí uPA v nádorové tkáni měli kratší přežití [37]. U adenokarcinomů plic byla vysoká exprese PAI-1 spojena s kratším celkovým přežitím, zatímco exprese uPA neprokázala signifikantní význam. U dlaždicobuněčných karcinomů plic byla vysoká exprese uPAR spojena s kratším přežitím, ale nebyl nalezen prognostický význam zvýšené exprese uPA a PAI-1 [38]. Zvýšená exprese uPA korelovala s rostoucím grade, nádorovými nekrózami, lokální recidivou a DNA non-diploiditou i u sarkomů měkkých tkání. Vysoká exprese uPA a PAI-1 byla prokázána i u dediferencovaných forem chondrosarkomů [39,40].
U kolorektálního karcinomu studie prokázaly, že uPAR a uPA lze považovat za nezávislé prognostické faktory, zvláště u pacientů stadia Dukes B. Dokonce bylo zjištěno, že zvýšená hladina uPAR v plazmě je spojena s kratším přežitím [41–44]. Exprese uPAR roste s přeměnou adenomu střeva od mírných dysplastických změn po těžkou dysplazii až v karcinom, zvýšená exprese uPAR byla detekována u adenomů v 30 %, u karcinomů pak v 85 % [45–47]. Vysoká exprese uPA a uPAR byla prokázána v resekované tkáni mnoha dalších nádorů, jako např. karcinomu pankreatu, jícnu, ovaria, prsu, žaludku či ledviny [19,33,34,48–52]. Navázání uPA na povrchový receptor uPAR indukuje kaskádu procesů zahrnujících buněčnou proliferaci, migraci, chemotaxi, adhezi a proteolytickou aktivitu nádorové buňky (obr. 2). uPA lze označit také jako proteinázu s funkcí podobnou růstovému faktoru (growth factor-like funkcí) [53].
Obr. 2. Multifunkční potenciál uPA<sup>53</sup>. 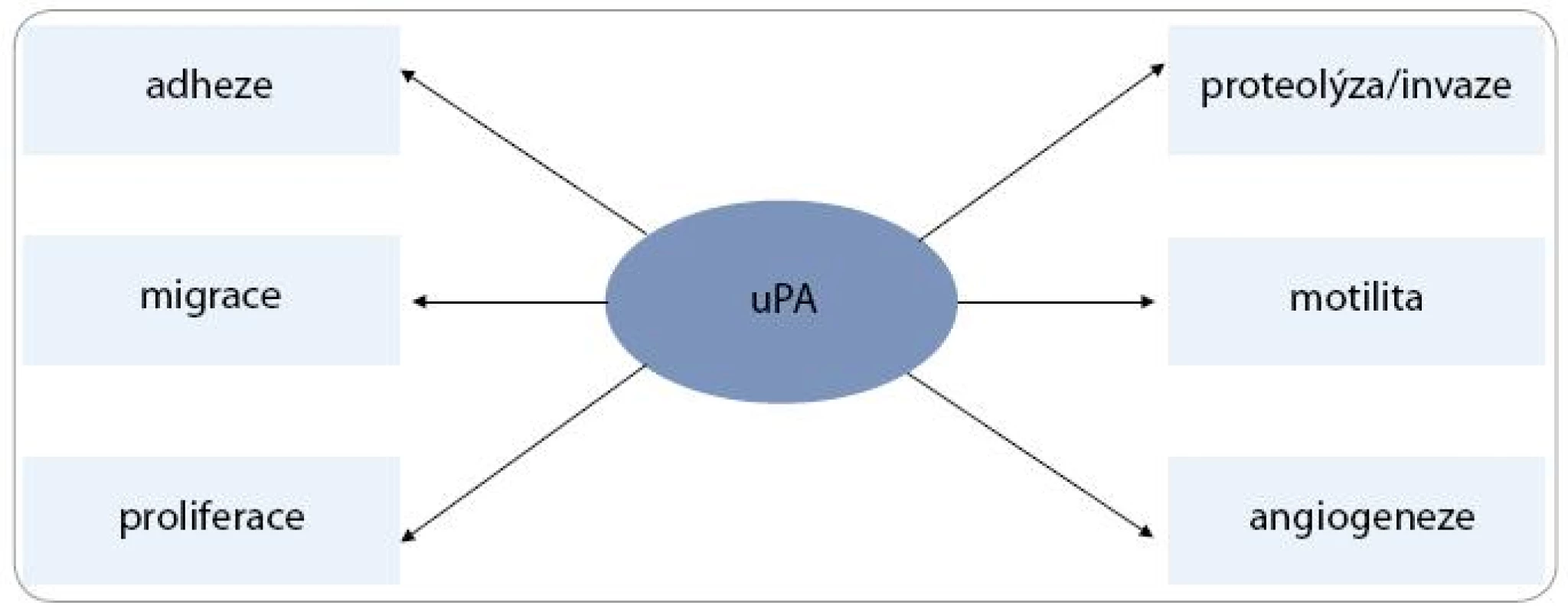
V řadě studií byl podrobně zkoumán význam jednotlivých částí plazminogen aktivátor systému ve vztahu k přežití pacientů s onkologickým onemocněním. Zvýšená exprese uPA, uPAR, PAI-1 a PAI-2 v tumorózní tkáni byla prokázána u řady nádorů, jako např. prsu, ovaria, ledvin, plic a žaludku [34,48–52,54,55], a je jisté, že tyto faktory hrají významnou roli v invazivitě a metastazování tumoru. Nízká exprese PAI-1 v nádorové tkáni u nepokročilých onemocnění je v souladu s teorií, podle níž PAI-1 podporuje invazi tumoru uvolněním nádorových buněk z matrix [56,57].
U jiných nádorů, např. u karcinomu prsu, byla vysoká exprese uPA i PAI-1 hodnocena jako nezávislý prognostický faktor pro kratší přežití [58,59]. A Knoop et al prokázali, že PAI-1 samotný je u těchto pacientek prediktorem pro vzdálenou, nikoliv lokální recidivu, což potvrzuje teorii o významu PAS v metastazování maligních tumorů [60]. V rozporu s tím jsou výsledky studie Itoa et al [61], kteří uvádějí, že PAI-1 negativní zhoubné nádory žaludku prokazují vyšší incidenci jaterních metastáz, a tím i horší prognózu.
Obecně je však u jiných typů nádorů v literatuře popsána spojitost PAI-2 s lepší prognózou, a to zvláště u pacientek s karcinomem prsu [62] nebo u karcinomu žaludku, jak uvádí Maeda et al. Tito pacienti s uPA pozitivní a PAI-2 negativní expresí v tkáni nádoru mají signifikantně horší prognózu než ostatní [63].
Macaluso et al v roce 2006 publikovali práci, v níž prokázali, že specifický fragment PAI-2 promotoru je vázán současně s pRb2/p130, PAI-2 a transkripčním faktorem E2F5 v normálních lidských primárních korneálních buňkách a s pRb2/p130, PAI-2, E2F5 v normálních lidských primárních konjunktiválních epiteliálních buňkách. Tyto skutečnosti naznačují hypotézu, že pRb2/p130 a PAI-2 mohou spolupracovat v modulaci PAI-2 genové exprese v normálních korneálních a konjunktiválních buňkách [64]. PAI-2 tedy může zesilovat tumorsupresorovou aktivitu Rb genu. PAI-2 tak lokalizovaný s Rb v jádře inhibuje jeho změnu (aktivní/inaktivní), která vede ke zvýšení hladiny Rb proteinu, a tím i Rb-zprostředkovaným procesům [65]. PAI-2 by tedy měl mít ochranný charakter, což je potvrzeno u nádorů prsu, plic či pankreatu [66–68], kde je vysoká exprese PAI-2 spojena s ochranou před invazivním nádorovým růstem, a měla by být tedy markerem dobré prognózy u těchto pacientů. Proč je jeho vysoká exprese spojena s horší prognózou u pacientů s kolorektálním karcinomem a karcinomem žaludku či karcinomem endometria, jak bylo popsáno v literatuře [69,70], zatím není zcela jasné. Zdá se, že by PAI-2 mohl mít u maligních nádorů zásadnější význam v růstu a metastazování než PAI-1. Ve vztahu jednotlivých faktorů PAS a dalších klinicko-patologických parametrů tumoru, jako je např. grade nádoru, jsou výsledky nejednoznačné a kontroverzní. Minisini et al uvádí, že negativní exprese uPA u karcinomu prsu je spojena s vyšším grade tumoru [71]. Dublin et al však publikovali práci, v níž prokázali, že naopak zvýšená exprese uPA a PAI-1 je významně svázána s vysokým grade tumoru [72]. Cai et al ve své práci vztah uPA a PAI-1 ke grade u karcinomu ovarií vůbec neprokázali [73]. Naopak u karcinomu štítnice byla zvyšující se exprese uPA a PAI-1 u vyšších grade tumorů statisticky významně prokázána [74], stejně jako u high grade gliomů [75]. U hepatocelulárního karcinomu byl prokázán statisticky signifikantní vztah grade tumoru a exprese uPA, PAI-1 a PAI-2 v tumoru [76]. Důvod těchto rozporuplných výsledků zatím není znám, možným vysvětlením by mohla být hypotéza, podle níž by vztah jednotlivých složek PAS a grade tumoru mohl být závislý na způsobu šíření, tedy na tom, zda se nádor šíří převážně hematogenní, či lymfogenní cestou. Pro takové závěry je však zatím velmi malé množství dat. Pozitivní korelaci mezi expresí uPA a PAI-1 v tkáni tumoru a grade prokázal i Papadopoulou et al [77] a byla prokázána i u jiných nádorů, jako např. karcinom prostaty [78] či prsu [79]. Herszényi et al ve svém souboru pacientů prokázali vztah mezi přežitím pacientů a hladinou PAI-1 v plazmě, a dokonce i význam PAI-1 v plazmě nejen u invazivně rostoucího kolorektálního karcinomu, ale také v progresi kolorektálních nekancerogenních lézí v karcinom [80].
Byly také popsány výsledky léčby tamoxifenem u pacientek s metastatickým karcinomem prsu, u kterých byla exprese uPA v nádorové tkáni prediktivním faktorem odpovědi, délky trvání odpovědi a celkového přežití. U tumorů s nízkou expresí uPA byla zaznamenána lepší odpověď na tamoxifen než u těch s vysokou expresí uPA [81]. Stejně tak byla zjištěna horší odpověď na léčbu tamoxifenem u pacientek s recidivou karcinomu prsu, bez předchozí léčby tamoxifenem, u nichž byla zjištěna zvýšená exprese PAI-1 v nádorové tkáni [81]. Heiss et al popsali, že pacienti s karcinomem žaludku a s negativními uzlinami, u kterých byla zjištěna vysoká exprese PAI-1 a uPA, mají benefit z adjuvantní chemoterapie oproti pacientům s pozitivními lymfatickými uzlinami a s PAI-1 nízkou expresí [82]. Tyto závěry naznačují, že jednotlivé součásti PAS by se mohly stát prediktivními faktory odpovědi na léčbu.
Z literatury je také známo, že u kolorektálního karcinomu se zvyšuje exprese uPA ve srovnání s normální tkání střeva či adenomy, a existuje řada studií, ve kterých byl zkoumán vztah mezi expresí uPA v tumorózní tkáni a prognózou pacienta [83–86]. Mulcahy et al [43], Seetoo et al [87], Sato et al [88] a Langenskiöld et al [89] zvyšující se expresi uPA prokázali jako negativní prognostický faktor, zato Ganesh et al [42] tento vztah nepotvrdili. Kammori et al ve své práci týkající se pacientů s karcinomem žaludku publikovali, že u pacientů s vyšší expresí PAI-2 v nádorové tkáni byla vyšší pravděpodobnost recidivy i u časných stadií tohoto onemocnění [70].
Díky těmto poznatkům se v současnosti výzkum zaměřuje na několik cest, kterými by bylo možno ovlivnit PAS a tím i procesy, kterých se v rámci nádorového růstu účastní. Zatím jsou však zkoušeny preparáty zaměřující se na PAS spíše u jiných než nádorových onemocnění, jako např. Tiplaxtinin – inhibitor PAI-1(PAI-039), malá molekula, která oslabuje remodelaci cév, ke které dochází např. při aktivaci systému renin-angiotenzin u arteriální hypertenze. První výsledky jsou však publikovány s pozitivním efektem i na tumorózní angiogenezi u zvířecích modelů [90].
Závěr
Jednotlivé součásti PAS nepochybně hrají významnou úlohu v angiogenezi a metastazování maligních nádorů. Výsledky publikovaných studií by se u jednotlivých typů nádorů mohly v blízké budoucnosti odrazit v diagnosticko-terapeutických algoritmech a současně by se do budoucna jeho jednotlivé složky mohly stát terčem cílené léčby.
Tato práce byla podpořena výzkumným záměrem Ministerstva zdravotnictví ČR: FUNDIN MZ0MOU2005.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Jana Halámková, Ph.D.
Klinika komplexní onkologické péče
Masarykův onkologický ústav a LF MU Brno
Žlutý kopec 7
656 53 Brno
e-mail: jana.halamkova@mou.cz
Obdrženo: 3. 4. 2011
Přijato: 20. 9. 2011
Zdroje
1. Brummel-Ziedins K, Orfeo T, Swords Jenny N et al. Blood coagulation and fibrinolysis. In: Greer JP, Foerster J, Rodgers JM et al (eds). Wintrobe’s Clinical Hematology. 12th ed. Baltimore: Lippincott Wiliams & Wilkins 2009 : 528–619.
2. Schmitt M, Harbeck N, Thomssen C et al. Clinical impact of the plasminogen activation system in tumor invasion and metastasis: prognostic relevance and target therapy. Thromb Haemost 1997; 78 : 285–296.
3. Duffy MJ. The urokinase plasminogen activator system: role in malignancy. Curr Pharm Des 2004; 10(1): 39–49.
4. Pyke C, Kristensen P, Ralfkiaer E et al. The plasminogen activation system in human colon cancer: messenger RNA for the inhibitor PAI-1 is located in endothelial cells in tumor stroma. Cancer Res 1991; 51(15): 4067–4071.
5. Fay WP, Shapiro AD, Shih JL et al. Brief report: complete deficiency of plasminogen-activator inhibitor type 1 due to a frame-shift mutation. N Engl J Med 1992; 327(24): 1729–1733.
6. Carmeliet P, Stassen JM, Schoonjans L et al. Plasminogen activator inhibitor-1 gene-deficient mice. II. Effect on haemostasis, thrombosis and thrombolysis. J Clin Invest 1993; 92(6): 2756–2760.
7. Hill SA, Shaughnessy SG, Joshua P et al. Differential mechanisms targeting type 1 plasminogen activator inhibitor and vitronectin into the storage granules of a human megakaryocytic cell line. Blood 1996; 87(12): 5061–5073.
8. Stefansson S, Peticlerc E, Wong MK et al. Inhibition of angiogenesis in vivo by plasminogen activator inhibitor-1. J Biol Chem 2001; 276(11): 8135–8141.
9. Stefansson S, Lawrence DA. The serpin PAI-1 inhibits cell migration by blocking integrin alpha V beta 3 binding to vitronectin. Nature 1996; 383(6599): 441–443.
10. Ganesh S, Sier CF, Heerding MM et al. Urokinase receptor and colorectal cancer survival. Lancet 1994; 344(8919): 401–402.
11. Verspaget HW, Sier CF, Ganesh S et al. Prognostic value of plasminogen activators and theirs inhibitors in colorectal cancer. Eur J Cancer 1995; 31A(7–8): 1105–1109.
12. Mignatti P, Rifkin DB. Plasminogen activators and matrix metalloproteinases in angiogenesis. Enzyme Protein 1996; 49(1–3): 117–137.
13. Resnati M, Guttinger M, Valcamonica S et al. Proteolytic cleavage of the urokinase receptor substitutes for the agonist-induced chemotactic effect. EMBO J 1996; 15(7): 1572–1582.
14. Busso N, Masur SK, Lazega D et al. Induction of cell migration by pro-urokinase binding to its receptor: possible mechanism for signal transduction in human epitelial cells. J Cell Biol 1994; 126(1): 259–270.
15. Nguyen DH, Hussaini IM, Gonias SL. Binding of urokinase-type plasminogen activator to its receptor in MCF-7 cells activates extracellular signal-regulated kinase 1 and 2 which is required for increased cellular motility. J Biol Chem 1998; 273(14): 8502–8507.
16. Dumler I, Weis A, Mayboroda OA et al. The Jak/Stat pathway and urokinase receptor signaling in human aortic vascular smooth muscle cells. J Biol Chem 1998; 273(1): 315–321.
17. Durand MK, Bødker JS, Christensen A et al. Plasminogen activator inhibitor-1 and tumour growth, invasion and metastasis. Tromb Haemost 2004; 91(3): 439–449.
18. Prager GW, Breuss JM, Steurer S et al. Vascular endothelial growth factor receptor-2-induced initial endothelial cell migration depends on the presence of the urokinase receptor. Circ Res 2004; 94(12): 1562–1570.
19. Jänicke F, Schmitt M, Ulm K et al. Urokinase-type plasminogen activator antigen and early relapse in breast cancer. Lancet 1989; 2(8670): 1049.
20. Duffy MJ, O’Grady P, Devaney D et al. Urokinase-plasminogen activator, a marker for aggressive breast carcinomas. Preliminary report. Cancer 1988; 62(3): 531–533.
21. Jänicke F, Schmitt M, Haftner R et al. Urokinase-type plasminogen activator (uPA) antigen is a predictor of early relapse in breast cancer. Fibrinolysis 1990; 4 : 69–78.
22. Duggan C, Maguire T, McDermott E et al. Urokinase plasminogen activator and urokinase plasminogen activator receptor in breast cancer. Int J Cancer 1995; 61(5): 597–600.
23. Foekens JA, Buessecker F, Peters HA et al. Plasminogen activator inhibitor 2: prognostic relevance in 1012 patients with primary breast cancer. Cancer Res 1995; 55(7): 1423–1427.
24. Foekens JA, Look MP, Peters HA et al. Urokinase-typ plasminogen activator and its inhibitor PAI-1: predictors of poor response to tamoxifen therapy in recurrent breast cancer. J Natl Cancer Inst 1995; 87(10): 751–756.
25. Look MP, van Putten WL, Duffy MJ et al. Pooled analysis of prognostic impact of urokinase-type plasminogen activator and its inhibitor PAI-1 in 8377 breast cancer patients. J Natl Cancer Inst 2002; 94(2): 116–128.
26. Kuhn W, Pache L, SchmalfeldT B et al. Urokinase (uPA) and PAI-1 predict survival in advanced ovarian cancer patients (FIGO III) after radical surgery and platinum-based chemotherapy. Gynecol Oncol 1994; 55(1): 401–409.
27. Fredstorp-Lidebring M, Bendahl PO, Brünner N et al. Urokinase plasminogen activator and its inhibitor, PAI-1, in association with progression-free survival in early stage endometrial cancer. Eur J Cancer 2001; 37(18): 2339–2348.
28. Kobayashi H, Fujishiro S, Terao T et al. Impact of urokinase-type plasminogen activator and its inhibitor type 1 on prognosis in cervical cancer of uterus. Cancer Res 1994; 54(24): 6539–6548.
29. Gleeson N, Gonsalves R, Bonnar J et al. Uterine fibrinolytic enzymes in endometrial cancer. Eur J Gynaecol Oncol 1993; 14(5): 369–373.
30. Hasui Y, Marutsuka K, Asada Y et al. Prognostic value of urokinase-type plasminogen activator in patients with superficial bladder cancer. Urology 1996; 47(1): 34–37.
31. Hofmann R, Lehmer A, Buresch M et al. Clinical relevance of urokinase plasminogen activator, its receptor, and its inhibitor in patients with renal cell carcinoma. Cancer 1996; 78(3): 487–492.
32. Ahmad A, Kong D, Sarkar SH et al. Inactivation of uPA and its receptor uPAR by 3,3‘-diindolylmethane (DIM) leads to the inhibition of prostate cancer cell growth and migration. J Cell Biochem 2009; 107(3): 516–527.
33. Xue A, Scarlett CJ, Jackson CJ et al. Prognostic significance of growth factors and the urokinase-type plasminogen activator system in pancreatic ductal adenocarcinoma. Pancreas 2008; 36(2): 160–167.
34. Nomiya T, Nemoto K, Miyachi H et al. Significance of plasminogen-activation system in the formation of macroscopic types and invasion in esophageal carcinoma. Anticancer Res 2002; 22(5): 2913–2916.
35. Kaneko T, Konno H, Baba M et al. Urokinase-type plasminogen activator expression correlates with tumor angiogenesis and poor outcome in gastric cancer. Cancer Sci 2003; 94(1): 43–49.
36. Hundsdorfer B, Zeilhofer HF, Bock KP et al.Tumour-associated urokinase-type plasminogen activator (uPA) and its inhibitor PAI-1 in normal and neoplastic tissues of patients with squamous cell cancer of the oral cavity - clinical relevance and prognostic value. J Craniomaxillofac Surg 2005; 33(3): 191–196.
37. Hsu DW, Efird JT, Hedley-Whyte ET et al. Prognostic role of urokinase-type plasminogen activator in human gliomas. Am J Pathol 1995; 147(1): 114–123.
38. Pappot H, Pedersen AN, Brünner N et al. The complex between urokinase (uPA) and its type-1 inhibitor (PAI-1) in pulmonary adenocarcinoma: relation to prognosis. Lung Cancer 2006; 51(2): 193–200.
39. Choong PF, Fernö M, Akerman M et al. Urokinase-plasminogen-activator levels and prognosis in 69 soft-tissue sarcomas. Int J Cancer 1996; 69(4): 268–272.
40. Morii T, Yabe H, Morioka H et al. Prognostic relevance of urokinase type plasminogen activator, its receptor and inhibitors in chondrosarcoma. Anticancer Res 2000; 20(5A): 3031–3036.
41. Stephens RW, Nielsen HJ, Christensen IJ et al. Plasma urokinase receptor levels in patients with colorectal cancer: relationship to prognosis. J Natl Cancer Inst 1999; 91(10): 869–874.
42. Ganesh S, Sier CF, Heerding MM et al. Contribution of plasminogen activators and their inhibitors to the survival prognosis of patients with Duke’s stage B and C colorectal cancer. Br J Cancer 1997; 75(12): 1793–1801.
43. Mulcahy HE, Duffy MJ, Gibbons D et al. Urokinase-type plasminogen activator and outcome in Dukes’ B colorectal cancer. Lancet 1994; 344(8922): 583–584.
44. Graziano F, Cascinu S. Prognostic molecular markers for planning adjuvant chemotherapy trials in Dukes’ B colorectal cancer patients: how much evidence is enough? Ann Oncol 2003; 14(7): 1026–1038.
45. Sier CF, Vloedgraven HJ, Ganesh S et al. Inactive urokinase and increased levels of its inhibitor type 1 in colorectal cancer liver metastasis. Gastroenterology 1994; 107(5): 1449–1456.
46. Suzuki S, Hayashi Y, Wang Y et al. Urokinase type plasminogen activator receptor expression in colorectal neoplasms. Gut 1998; 43(6): 798–805.
47. Ganesh S, Sier CF, Griffioen G et al. Prognostic relevance of plasminogen activators and their inhibitors in colorectal cancer. Cancer Res 1994; 54(15): 4065–4071.
48. Nekarda H, Siewert JR, Schmitt M et al. Tumour-associated proteolytic factors uPA and PAI-1 and survival in totally resected gastric cancer. Lancet 1994; 343(8889): 117.
49. Zemzoum I, Kates RE, Ross JS et al. Invasion factors uPA/PAI-1 and HER2 status provide independent and complementary information on patient outcome in node-negative breast cancer. J Clin Oncol 2003; 21(6): 1022–1028.
50. Hildenbrand R, Schaaf A, Dorn-Beineke A et al. Tumor stroma is the predominant uPA-, uPAR-, PAI-1-expressing tissue in human breast cancer: prognostic impact. Histol Histopathol 2009; 24(7): 869–877.
51. Sakakibara T, Hibi K, Koike M et al. Plasminogen activator inhibitor-1 as a potential marker for the malignancy of colorectal cancer. Br J Cancer 2005; 93(7): 799–803.
52. Ohba K, Miyata Y, Kanda S et al. Expression of urokinase-type plasminogen activator, urokinase-type plasminogen activator receptor and plasminogen activator inhibitors in patients with renal cell carcinoma: correlation with tumor associated macrophage and prognosis. J Urol 2005; 174(2): 461–465.
53. Schmitt M, Wilhelm O, Reuning U et al. The urokinase plasminogen activator system as a novel target for tumour therapy. Fibrinol Proteol 2000; 14 : 114–132.
54. Pedersen H, Grøndahl-Hansen J, Francis D et al. Urokinase and plasminogen activator inhibitor type 1 in pulmonary adenocarcinoma. Cancer Res 1994; 54(1): 120–123.
55. Konecny G, Untch M, Pihan A et al. Association of urokinase-type plasminogen activator and its inhibitor with disease progression and prognosis in ovarian cancer. Clin Cancer Res 2001; 7(6): 1743–1749.
56. Waltz DA, Natkin LR, Fujita RM et al. Plasmin and plasminogen activator inhibitor type 1 promote cellular motility by regulating the interaction between the urokinase receptor and vitronectin. J Clin Invest 1997; 100(1): 58–67.
57. Deng C, Curriden SA, Wang S et al. Is plasminogen activator inhibitor-1 the molecular switch that governs urokinase receptor-mediated cell adhesion and release? J Cell Biol 1996; 134(6): 1563–1571.
58. Grøndahl-Hansen J, Christensen IJ, RosenquisTC et al. High levels of urokinase-type plasminogen activator and its inhibitor PAI-1 in cytosolic extracts of breast carcinomas are associated with poor prognosis. Cancer Res 1993; 53(11): 2513–2521.
59. Jelisavac-Cosic S, Sirotkovic-Skerlev M, Kulic A et al. Prognostic significance of urokinase-type plasminogen activator (uPA) and plasminogen activator inhibitor (PAI-1) in patients with primary invasive ductal breast carcinoma - a 7.5-year follow-up study. Tumori 2011; 97(4): 532–539.
60. Knoop A, Andreasen PA, Andersen JA et al. Prognostic significance of urokinase-type plasminogen activator and plasminogen activator inhibitor-1 in primary breast cancer. Br J Cancer 1998; 77(6): 932–940.
61. Ito H, Yonemura Y, Fujita H et al. Prognostic relevance of urokinase-type plasminogen actiator (uPA) and plasminogen activator inhibitor PAI-1 and PAI-2 in gastric cancer. Virchows Arch 1996; 427(5): 487–496.
62. Bouchet C, Spyratos F, Martin PM et al. Prognostic value of urokinase-type plasminogen activator (uPA) and plasminogen activator inhibitors PAI-1 and PAI-2 in breast carcinomas. Br J Cancer 1994; 69(2): 398–405.
63. Maeda K, Chung YS, Sawada T et al. Combined evaluation of urokinase-type plasminogen activator and plasminogen activator inhibitor-2 expression in gastric carcinoma. Int J Oncol 1996; 8(3): 499–503.
64. Macaluso M, Montanari M, Marshall CM et al. Cytoplasmic and nuclear interaction between Rb family proteins and PAI-2: a physiological crosstalk in human corneal and conjunctival epithelial cells. Cell Death Differ 2006; 13(9): 1515–1522.
65. Darnell DA, Antalis TM, Johnstone RW et al. Inhibition of retinoblastoma protein degradation by interaction with the serpin plasminogen activator inhibitor 2 via a novel consensus motif. Mol Cell Biol 2003; 23(18): 6520–6532.
66. Sumiyoshi K, Serizawa K, Urano T et al. Plasminogen activator system in human breast cancer. Int J Cancer 1992; 50(3): 345–348.
67. Nagayama M, Sato A, Hayakawa H et al. Plasminogen activators and their inhibitors in non-small cell lung cancer. Low content of type 2 plasminogen activator inhibitor associated with tumor dissemination. Cancer 1994; 73(5): 1398–1405.
68. Smith R, Xue A, Gill A et al. High expression of plasminogen activator inhibitor-2 (PAI-2) is a predictor of improved survival in patients with pancreatic adenocarcinoma. World J Surg 2007; 31(3): 493–502.
69. Nordengren J, Fredstorp Lidebring M, Bendahl PO et al. High tumor tissue concentration of plasminogen activator inhibitor 2 (PAI-2) is an independent marker for shorter progression-free survival in patients with early stage endometrial cancer. Int J Cancer 2002; 97(3): 379–385.
70. Kammori M, Kaminishi M, Kobayashi K et al. Immunohistochemical analysis of PAI-2 (plasminogen activator inhibitor type 2) and p53 protein in early gastric cancer patients with recurrence: a preliminary report. Jpn J Clin Oncol 1999; 29(4): 187–191.
71. Minisini AM, Fabbro D, Di Loreto C et al. Markers of the uPA system and common prognostic factors in breast cancer. Am J Clin Pathol 2007; 128(1): 112–117.
72. Dublin E, Hanby A, Patel NK et al. Immunohistochemical expression of uPA, uPAR, and PAI-1 in breast carcinoma. Fibroblastic expression has strong associations with tumor pathology. Am J Pathol 2000; 157(4): 1219–1227.
73. Cai Z, Li YF, Liu FY et al. Expression and clinical significance of uPA and PAI-1 in epithelial ovarian cancer. Ai Zheng 2007; 26(3): 312–317.
74. Horvatić Herceg G, Herceg D, Kralik M et al. Urokinase-type plasminogen activator and its inhibitor in thyroid neoplasms: a cytosol study. Wien Klin Wochenschr 2006; 118(19–20): 601–609.
75. Muracciole X, Romain S, Dufour H et al. PAI-1 and EGFR expression in adult glioma tumors: toward a molecular prognostic classification. Int J Radiat Oncol 2002; 52(3): 592–598.
76. Itoh T, Hayashi Y, Kanamaru T et al. Clinical significance of urokinase-type plasminogen activator activity in hepatocellular carcinoma. J Gastroenterol Hepatol 2000; 15(4): 422–430.
77. Papadopoulou S, Scorilas A, Yotis J et al. Significance of urokinase-type plasminogen activator and plasminogen activator inhibitor-1 (PAI-1) expression in human colorectal carcinomas. Tumour Biol 2002; 23(3): 170–178.
78. Cozzi PJ, Wang J, Delprado W et al. Evaluation of urokinase plasminogen activator and its receptor in different grades of human prostate cancer. Hum Pathol 2006; 37(11): 1442–1451.
79. Manders P, Tjan-Heijnen VC, Span PN et al. Complex of urokinase-type plasminogen activator with its type 1 inhibitor predicts poor outcome in 576 patients with lymph node-negative breast carcinoma. Cancer 2004; 101(3): 486–494.
80. Herszényi L, Farinati F, Cardin R et al. Tumor marker utility and prognostic relevance of cathepsin B, cathepsin L, urokinase-type plasminogen activator, plasminogen activator inhibitor type-1, CEA and CA 19-9 in colorectal cancer. BMC Cancer 2008; 10 : 194.
81. Foekens JA, Look MP, Peters HA et al. Urokinase-type plasminogen activator and its inhibitor PAI-1: predictors of poor response to tamoxifen therapy in recurrent breast cancer. J Natl Cancer Inst 1995; 87(10): 751–756.
82. Heiss MM, Allgayer H, Gruetzner KU et al. Clinical value of extended biologic staging by bone marrow micrometastases and tumor-associated proteases in gastric cancer. Ann Surg 1997; 226(6): 736–745.
83. de Bruin PA, Verspaget HW, Griffioen G et al. Plasminogen activator activity and composition in human colorectal carcinomas. Fibrinolysis 1987; 1 : 57–62.
84. de Bruin PA, Griffioen G, Verspaget HW et al. Plasminogen activators and tumor development in the human colon: activity levels in normal mucosa, adenomatous polyps, and adenocarcinomas. Cancer Res 1987; 47(17): 4654–4657.
85. Mytnik M, Stasko J. D-dimer, plasminogen activator inhibitor-1, prothrombin fragments and protein C – role in prothrombotic state of colorectal cancer. Neoplasma 2011; 58(3): 235–238.
86. Halamkova J, Kiss I, Pavlovsky Z et al. Clinical significance of the plasminogen activator system in relation to grade of tumor and treatment response in colorectal carcinoma patients. Neoplasma 2011; 58(5): 377–385.
87. Seetoo DQ, Crowe PJ, Russell PJ et al. Quantitative expression of protein markers of plasminogen activation system in prognosis of colorectal cancer. J Surg Oncol 2003; 82(3): 184–193.
88. Sato T, Nishimura G, Yonemura Y et al. Association of immunohistochemical detection of urokinase-type plasminogen activator with metastasis and prognosis in colorectal cancer. Oncology 1995; 52(4): 347–352.
89. Langenskiöld M, Holmdahl L, Angenete E et al. Differential prognostic impact of uPA and PAI-1 in colon and rectal cancer. Tumour Biol 2009; 30(4): 210–220.
90. Leik CE, Su EJ, Nambi P et al. Effect of pharmacologic plasminogen activator inhibitor-1 inhibition on cell motility and tumor angiogenesis. J Thromb Haemost 2006; 4(12): 2710–2715.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2011 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Pozitronová emisní tomografie v diagnostice a sledování pacientů s neseminomovými germinálními nádory
- Plazminogen aktivátor systém a jeho klinický význam u pacientů s nádorovým onemocněním
- Castlemanova choroba
- Prediktivní hodnota ultrazvukových parametrů, CA-125 a indexu rizika malignity u pacientek s karcinomem ovarií
- Naše päťročné výsledky in vitro testovania chemorezistencie u onkologických pacientov
- Aktuálne charakteristiky deskriptívnej epidemiológie nádorov žalúdka v Slovenskej republike v kontexte medzinárodného porovnania
- Neskoré následky u pacientov liečených alogénnou transplantáciou kmeňových krvotvorných buniek
- Dlouhodobé sledování pacienta s eozinofilním granulomem žebra
- Použití chemoterapie v kombinaci s cílenou biologickou léčbou u diseminovaného kolorektálního karcinomu: kazuistika dlouhodobé a výrazné klinické odpovědi
- Erratum
- Lékový registr – trabectedin
- Srovnání pegylovaného lipozomálního doxorubicinu a karboplatiny s paklitaxelem a karboplatinou v léčbě pacientek s pozdním relapsem platina-senzitivního karcinomu ovaria
- HER2 pozitivní T1N0M0 tumor: Čas pro změnu?
- Nový způsob smýšlení o rakovině (Poznámky k ESMO 2011)
- Zápis ze schůze výboru České onkologické společnosti ČLS JEP dne 18. 10. 2011 ve Fakultní Thomayerově nemocnici v Praze
- Zápis videokonference a schůze výboru České onkologické společnosti dne 4. 11. 2011 na MOÚ v Brně
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Castlemanova choroba
- Dlouhodobé sledování pacienta s eozinofilním granulomem žebra
- Lékový registr – trabectedin
- Prediktivní hodnota ultrazvukových parametrů, CA-125 a indexu rizika malignity u pacientek s karcinomem ovarií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



