-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Laboratorní aspekty COVID-19. Diagnostika, epidemiologie, prognóza pacientů.
Laboratory aspects of COVID-19. Diagnosis, epidemiology, prognosis of patients.
This review deals with laboratory aspects of pandemic disease COVID-19. Our educational and retrospective work contents the basic knowledge on diagnostics, epidemiology, biochemistry and hematology of biomarkers in this disease. Brief characteristics of methods, results and their clinical interpretations are also the part of this communication. Currently published literature about this theme was the source and inspiration for this work.
Keywords:
SARS-CoV-2 – anti-SARS-CoV-2 – RT-PCR – Serology – routine laboratory tests
Autoři: B. Friedecký 1; J. Kratochvíla 2
Působiště autorů: Ústav klinické biochemie a diagnostiky FN Hradec Králové 1; SEKK spol. s r. o., Pardubice 2
Vyšlo v časopise: Klin. Biochem. Metab., 28, 2020, No. 3, p. 97-105
Souhrn
Předmětem tohoto přehledného sdělení jsou laboratorní aspekty pandemie COVID-19. V této edukační, retrospektivní práci shrnujeme základní poznatky o diagnostice, sérologii, biochemii a hematologii nemoci. Sledujeme vývoj od dob počátečního důrazu na kvantitativní stránku po současnost s již zvládanými zásadami řízení kvality pomocí autorizace metod a externího hodnocení kvality laboratoří. Snažíme se zachytit základní aspekty preanalytické, analytické i postanalytické fáze příslušných laboratorních vyšetření. Jde o přehled poznatků, získaný z publikací, které považujeme za zvláště instruktivní a edukačně cenné. Součástí práce je proto i poměrně rozsáhlá biografie.
Klíčová slova:
SARS-CoV-2 – anti-SARS-CoV-2 – RT-PCR – sérologie – rutinní laboratorní parametry
Na konci května 2020 byla v elektronické podobě uvolněna, a v první dekádě června i vytištěna, práce pracovní skupiny IFCC (Taskforce International Federation of Clinical Chemistry and Laboratory Medicine for COVID-19) shrnující zásady diagnostiky, sérologie a sledování změn rutinních laboratorních parametrů u této nemoci [1, 2]. Naše sdělení je formulováno v podstatě na bázi stejného myšlenkového postupu, jako toto shrnutí a má nezávisle vytvořenou, shodnou strukturu. K jeho publikaci v českém jazyce jsme se rozhodli z edukačních důvodů a je určeno zejména pracovníkům rutinních klinických laboratoří. Letitá absence genomických metod v klinických laboratořích je v podstatě vyřadila při pandemii ze hry, což může mít v budoucnu negativní následky. Je tedy třeba se aspoň dobře orientovat v problému laboratorních aspektů COVID-19, lépe řečeno, je to povinnost laboratorního personálu. Zejména, chceme-li potvrdit, že klinická biochemie je součástí (a ne ledajakou) skutečné laboratorní medicíny. Naší publikací jsme se snažili této nutnosti nápomoci ze všech sil, které máme k dispozici a dostat se ve sféře profesionální vzdělanosti tam, kde bychom se sami rádi viděli a kde by nepochybně nás rád viděl i nový prezident IFCC [1].
Schéma laboratorního testování COVID-19
Je uvedené v Tabulce 1, vytvořené na bázi grafického schématu, pocházejícího z http://www.ifcc.org/ifcc-news/2020-03-26-ifcc-information-guide-on-covid-19 „IFCC Information Guide on COVID-19“.
Tab. 1. Laboratory testing in COVID-19 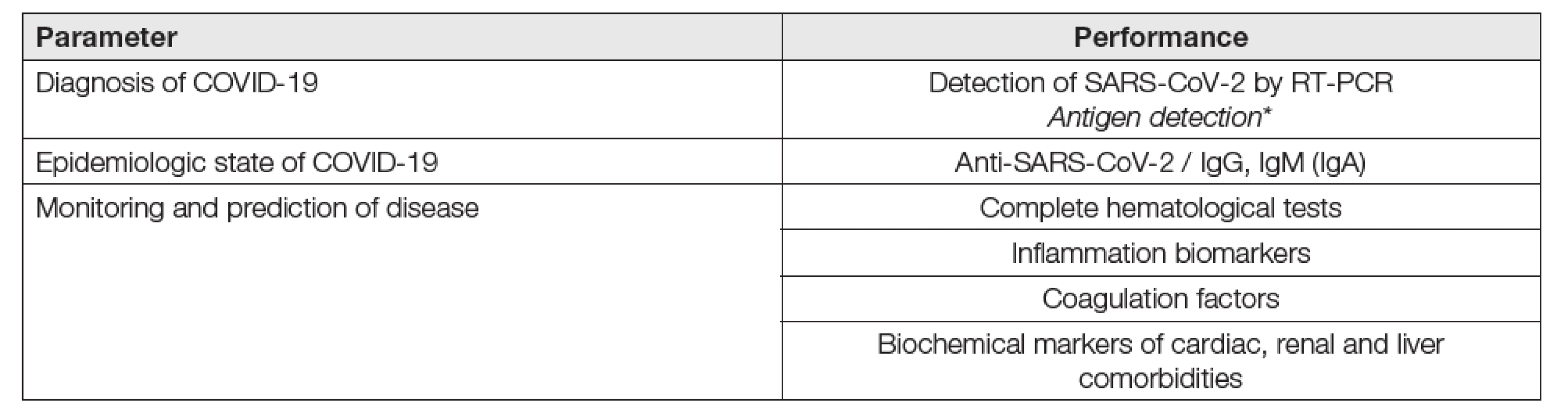
*Only seldom used. V následujících Tabulkách 2 a 3 jsou stručně uvedeny principy detekce SARS-CoV-2 a protilátek.
Tab. 2. General principles for detection of SARS-CoV-2 
Tab. 3. General principles for anti-SARS-CoV-2 detection 
Molekulární metody detekce SARS-CoV-2 a jejich problémy
Znalost genetické sekvence viru SARS-CoV-2, uveřejněné čínskými autory před polovinou ledna 2020, umožnila rychlý vývoj testovacích souprav. Vzhledem ke stavu pandemie bylo nutné pokrýt potřebu obrovské kvantitativní produkce výsledků jak pomocí testovacích souprav, tak zejména na počátku testy, vyvinutými samotnými laboratořemi (LDT – Laboratory Developed Method). O obvyklých preanalytických a analytických chybách při stanovení viru SARS-CoV-2 pojednává práce Lippiho a spol. [3].
Preanalytické problémy se vzorky, odběrem, transportem a podmínkami zacházení s nimi lze shrnout do následujících bodů:
- dostatečný objem odebraného stěru z horních cest dýchacích
- vhodnost odběrových kontejnerů a medií, v nich obsažných, k transportu z místa odběru do laboratoře
- podmínky transportu, teplota, čas
- problémy s identifikací, podmíněné také nedostatečnou digitalizací laboratoří (to bylo nápadné například při odběrech pro populační studie protilátek v ČR a dělalo problémy v počátečních fázích pandemie i mezi laboratořemi WHO a v Číně).
Za referenční je považován odběr vzorků z nosohltanu. Kritické pro transport do laboratoře je použití vhodného média, daného obvykle vhodnou transportní soupravou. Zásadní pro tento odběr je stručný text Státního zdravotního ústavu nazvaný: „Odběr klinického materiálu z horních cest dýchacích pro diagnostiku COVID-19“ [4]. Detaily provádění odběru, transportu z odběrového místa do testující laboratoře, skladování a teploty jsou k dispozici v preanalytických částech laboratorních příruček mikrobiologických laboratoří. Důležité jsou shrnující práce [5, 6], zmiňující také problémy rozdílů mezi různými materiály horních a dolních cest dýchacích a rozdílnými odběrovými soupravami, které mohou být signifikantní. Jen rozdílnost výsledků u stejných metod RT-PCR mezi různými materiály (nasofarynx, orofarynx) a různými transportními soupravami, kterých je v používání a na trhu celá řada může dosáhnout až 11 % poklesu klinické senzitivity. Závislost citlivosti detekce viru SARS-CoV-2 na typu biologického materiálu je značná [7]. Podle autorů od 93 % u bronchoalveolární laváže přes 62 % u nosních výtěrů až po 1 % v krevním séru a nulovou citlivost u moči. Optimální doba od transportu vzorku do doby analýzy nemá přesahovat 24 hodin, teplota transportu má být v rozmezí 2 až 6 stupňů C. Přesto se setkáváme s nabídkami testujících laboratoří k analýze i v případech, kdy v důsledku vzdálenosti a doby transportu nemůže být požadovaných preanalytických podmínek dosaženo.
Bezpečnost práce a ochrana zdraví laboratorního personálu při odběru, transportu a analýze jsou předmětem Doporučení WHO [8]. V podrobněji rozpracované podobě byly publikovány pracovní skupinou (Task Force) EFLM (European Federation of Clinical Chemistry and Laboratory Medicine) a IFCC [9].
Jednoznačně dominantní metodou detekce SARS-CoV-2 jsou metody RT-PCR. Snaha o pokrytí obrovských kvantitativních požadavků na testování měla za následek příliš velký počet testovacích souprav a navíc mnoha „in-house“ postupů LDT (Laboratory Development Methods). Ke konci května lze nalézt na webové stránce www.finddx.org hodně přes 300 různých metod RT-PCR detekce SARS-CoV-2. Počáteční minimum validačních, komparačních a kontrolních dat podmínilo úvahy a možnosti nedostatečné kvality u některých z nich. O tom se intenzivně začíná diskutovat až na konci května, ačkoliv problém bylo možné očekávat už od počátku.
Zajímavým zdrojem informací je databáze FIND (Foundation for Innovative New Diagnostics; Ženeva, Švýcarsko), s činností úzce svázanou se Světovou zdravotnickou organizací WHO. Na její webové adrese lze vyhledat seznam testovacích souprav a parametrů jejich senzitivit a specifičností. Pocházejí z nezávislého testování metod a souprav, vedeného se souhlasem výrobců [10,11]. Typické pro data metod jsou vysoké rozptyly hodnot senzitivity v rozmezí 20 až 90 % a vysoké, ale rovněž velmi rozdílné hodnoty specifičnosti. Data hodnot klinické senzitivity a specifičnosti jsou uvedena formou grafů [11]. Rozdíly mezi testovanými soupravami jsou neúnosně veliké, klíčovým problémem je klinická senzitivita postupů, problémy specifičnosti jsou významně nižší.
Jak upozornil Westgard [12], okolnosti vedly zpočátku k rozvolnění požadavků na kvalitu testovacích souprav, izolace, prob, primerů, k nutnosti improvizací při nedostatku reagencií, aby byl naplněn požadavek dostatečné intenzity testování stůj co stůj. To bylo sice kompatibilní s potřebou vypořádat se rychle s enormním tlakem pandemického stavu, avšak harmonizace výsledků měření různých metod a laboratoří by měla být jako u všech laboratorních vyšetření ze zásadních důvodů zajištěna. Kvalita měření jednoznačně podmiňuje validitu výsledků a také kompetenci testujících laboratoří. Jsou zapotřebí testy s dobře definovaným účelem (velký problém testovaní protilátek, kde přetrvává nejasně definovaný účel), s potvrzenou validitou, s prověřenou kvalitou a srovnatelností.
Zhruba od počátku května 2020 se začíná v literatuře prosazovat častěji přístup, hledající harmonický vztah mezi kvantitou a kvalitou testů. Počáteční situace si sice vyžádala rozvoj „in house“ metod LDT a obrovské osobní nasazení laboratorního personálu, ale vyvolala i potřebu jejich budoucí harmonizace a požadavky na certifikace FDA, CE-IVD. Jak se vzletně píše: „LDT test today, FDA approved of tomorrow!“ [13]. Současná situace prostě vyžaduje velké úsilí v harmonizaci ve všech směrech [14]. Podstatným základem harmonizace je certifikace FDA-EUA (Emergency Use Authorization), protože požadavky na ni by měly zlepšení kvality a harmonizace významně usnadnit. Podle údajů z 5. 5. 2020 existovalo v té době 35 takto značených testovacích souprav pro stanovení SARS CoV-2 metodou analýz nukleových kyselin (NAAT – Nucleic acid amplification test). Na podkladě dokumentu „Policy for diagnostic tests of coronavirus“ ze 4. května 2020 jsou metody s certifikátem EUA preferovány [15,16]. Podmínky FDA-EUA vyžadují poskytnutí validačních dat [16]:
- LoD
- senzitivity
- specifičnosti
- křížových reakcí.
Metody LDT nedisponující značením FDA-EUA by měly být validovány porovnáním s metodami FDAEUA a měla by u nich již být, stejně jako u ostatních, vyžadovaná účast v programech EHK (externí hodnocení kvality).
Zatímco senzitivita detekce SARS-CoV-2 závisí na vzorku použitého materiálu a na druhu cílového genu a pohybuje se zhruba v intervalu 70 až 90 %, specifičnost by měla být blízká hodnotě 100 %, aby byly eliminovány interference jiných virů respiračních chorob. Optimalizace a harmonizace metod detekce SARSCoV - 2 jsou procesy, které by měly pokračovat v každé laboratoři a konkretizuje je opět Westgard [12]:
- validací primerů
- validací extrakce RNA
- dostatečnou kontrolou kvality
- přiměřenou orientací laboratorních pracovníků v literatuře.
Zajímavý přehled preanalytiky, metod zacházení se vzorky k analýze SARS-CoV-2 a anti-SARS-CoV-2 z hlediska klinických mikrobiologů je k dispozici v práci [17]. Tamtéž je zdůrazněn popis klíčového trendu pro budoucnost detekce SARS-CoV-2, kterým je zásadní redukce doby analýzy, dosažitelná pokrokem v měřící technologii integrací extrakce RNA, amplifikace a detekce, tedy formou reagenčních kazet a senzorů.
Již se konečně objevují i validační a multicentrické studie. Sledují například srovnatelnost výsledků různých, hlavně progresivních metod s použitím čipových a „cartridge“ technik (Cepheid Xpress, ePlex), patřících do kategorie „rychlých“ testů s dobou obratu pod 60 minut s původní CDC “referenční„ metodou [18, 19, 20]. Hodnotí se parametry senzitivity, specifičnosti, hodnoty meze detekce (LoD) jako počty kopií/test, mL, µL, hodnoty počtů nutných replikačních cyklů (Ct) detekovaných genů. Jsou k dispozici validační studie, ukazující schopnost některých metod RT-PCR pracovat s různými matricemi analyzovaných materiálů: nosohltanového výtěru, krčního výtěru, bronchiální laváže, sputa a dalších [21].
Různé metody používají detekce různých genů, resp. různých kombinací genů (tabulka 2). Doporučuje se multiplexní přístup založený na detekci minimálně dvou genů. Rozdílnost cílových genů může působit i rozdílnost hodnot mezí detekce (LoD), senzitivity i různou úroveň negativity / pozitivity výsledků měření. Senzitivita je však ovlivněna nejen typem cílových genů, ale i materiálem vzorků, jeho virovou náloží a kvalitou odběru. O tom svědčí často zjišťované a na veřejnosti poněkud zmateně komentované rozdíly mezi opakovanými výsledky u stejných osob. Nejnižší hodnoty Ct, odpovídající nejvyšší senzitivitě jsou zjišťovány u genů E, nejvyšší u RdRpa a je prokázána vyšší klinická citlivost detekce genu N ve srovnání s genem ORF-1 [22]. Seznam důležitých testovacích souprav k detekci SARS-CoV-2 s certifikací FDA-EUA uvádíme pro představu v Tabulce 4.
Tab. 4. FDA-EUA US kits for detection SARS-CoV-2 according to database FIND to the end of May 2020 
Explanation: The state from the end of May 2020: Here are not included some other methods with low probability of use in Czech republic and methods, certified by Korean, China, Australia FDA offices. Total number of FDA-EUA kits was 35 (at the end of May 2020). Vysoká specifičnost (blízká 100 %) znamená nepřítomnost významných interferencí virů jiných respiračních chorob. Nižší citlivost detekce SARS-CoV-2 klade otázku, kolik negativních výsledků detekce SARS-CoV-2 je zapotřebí, aby bylo možné potvrdit s 95% statistickou jistotou nepřítomnost COVID-19. Autoři vypočítávají na podkladě bayesiánské statistiky potřebu tři negativních výsledků ze tří odběrů pro metody se senzitivitou kolem 70 %, zatímco oficiální požadavek jsou dva negativní výsledky [23]. V praxi byla místy zaznamenána potřeba i devíti negativních výsledků k rozhodnutí. V Tabulce 5 jsou uvedeny podle situace z konce května 2020 testovací soupravy s hodnotou senzitivity nad 85 %.
Tab. 5. Kits for detection SARS-CoV-2 with sensitivity > 85 % according to database FIND at the end of May 2020 
Senzitivita detekce cílových genů klesala podle výsledků prvního cyklu EHK INSTAND v květnu 2020 v souladu s očekáváním v pořadí E, ORF, N, S, RdRp. Kanadské laboratoře vytvořily již v březnu 2020 síť s harmonizovanou extrakcí RNA a harmonizovaným výpočtem hodnot LoD. Parametry laboratorních testů k detekci viru publikovaly společně i s daty zahrnujícími LoD, přístroje, reagencie, cílové geny [24]. Ukazuje se, že již od počátku pandemie šlo dobře harmonizovat laboratorní činnost, pokud byl zájem a aktivita laboratorních profesionálů.
Snahy o řešení časové náročnosti metod RT-PCR vedou k vývoji „rychlotestů“ pro detekci viru SARS-CoV-2 alternativními amplifikačními metodami s fluorescenční detekcí RT-LAMP (Loop Mediated Isothermal Amplification [25]), nebo RT-RPA (recombinase polymerase amplification [26]). Metody dosahují dob odezvy 20 až 100 minut (oproti 4 až 8 hodinám u RT-PCR), vyznačují se integrací jednotlivých fází postupů, používají občas velmi efektivních reagencií (CRISPR-Cas-12), mohou být adaptovány k telemedicínskému provedení. Validace těchto metod byla však zatím provedena jen na malém počtu vzorků a jejich kapacita je nízká. Jejich budoucí uplatnění bude spočívat nejspíš v oblasti měření systémy POCT, která budou pro budoucnost detekce COVID-19 nezbytná stejně jako je tomu v případech infekcí HIV, Zika, Ebola, WNF a dalších. Na závěr odstavce o molekulární detekci (RT-PCR) viru SARS-CoV-2 k diagnostice COVID-19 uvádíme shrnující Tabulku 6, zachycující nástroje koordinace metod prostřednictvím mezinárodních a národních institucí [2]. Tato institucionální a regulativní aktivita nebyla v ČR zatím výrazně pozorovatelná.
Tab. 6. List of countries with coordination of SARS-CoV-2 detection 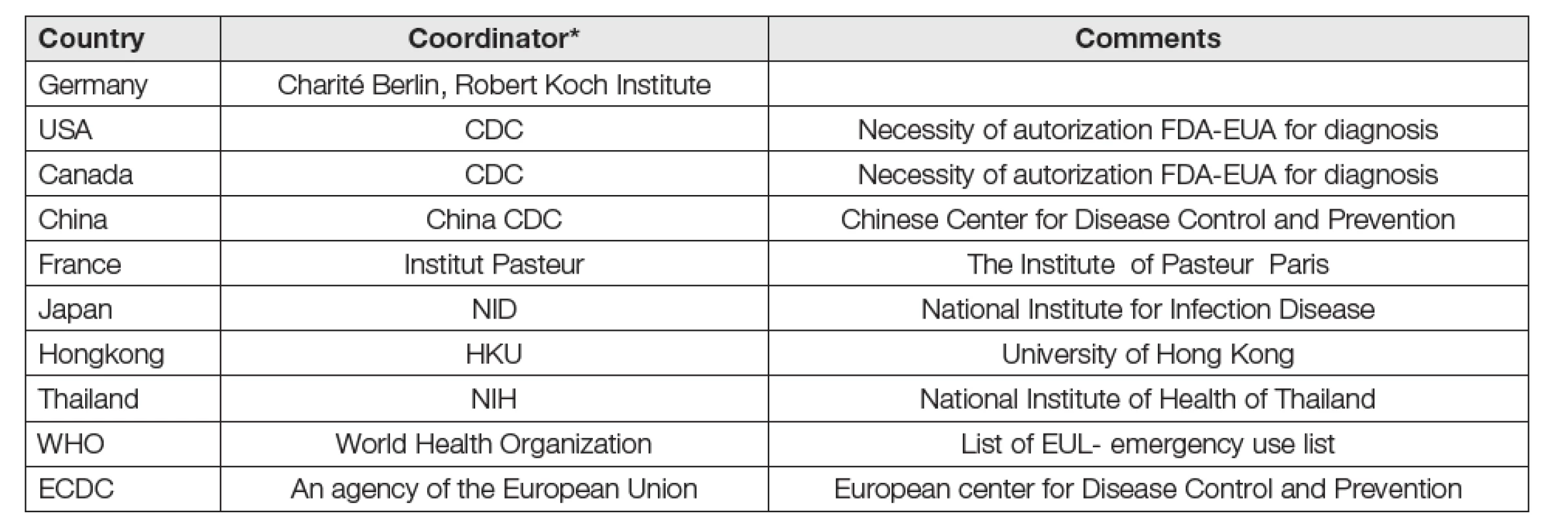
Other countries with coordination activities: Australia, Brasil, Singapur, Korea, Russia, but not Czech republic Sérologie COVID-19
Stejně jako u metod detekce viru SARS-CoV-2 byl na počátku enormní počet různých metod, viz seznam FIND [10, 11] bylo ke konci května 2020 přes 350 metod detekce protilátek, většinou nedostatečně validovaných, s neúměrnými rozptyly hodnot senzitivity a specifičnosti. Tento fakt a jeho negativní důsledky komentuje práce Farnswortha a Andersena [27]. Dat, získaných donedávna hodnocením testovacích souprav ke stanovení protilátek, bylo opravdu velmi málo. Velký počet metod a výrobců, malý stupeň validace, absence externího hodnocení kvality a hodnocení bez zohlednění bayesovské statistiky vedou k velké frekvenci nesprávných výsledků stanovení protilátek [28].
Jako výjimečná ukázka dobře provedené validace mohla sloužit donedávna ojedinělá validace chemiluminiscenční metody MAGLUMI Snibe italskými autory [29]. Ústředním problémem jsou u stanovení anti - SARS-CoV-2 data kinetiky jejich tvorby. Podle velmi pečlivé validační studie testovací soupravy EUROIMMUN anti-SARS-CoV-2 /IgG, IgA ELISA je doba, potřebná k dosažení maximální citlivosti u IgA 14 dnů u IgG dokonce 20 dní [30]. Výsledky kinetiky u ostatních studií jsou podobné. Při testování soupravy Maccura (imunochromatograficky s barevnou detekcí) bylo dosaženo u sérokonverze po době nad sedm dní při pozitivní PCR hodnot PPV = 81 % při vyhodnocení protilátek IgG nebo IgM, ale pokud se braly do úvahy vzorky IgG a IgM společně, bylo dosaženo již PPV = 100 % [31].
Klinické laboratoře jsou nyní konfrontovány s řadou nabídek testovacích souprav globálních výrobců k automatizovanému, velkosériovému stanovení anti-SARS-CoV-2 např. firem BioRad, DiaSorin, Roche, Ortho Diagnostics, Siemens, Beckman, s pracovními postupy adaptovanými na jejich vlastní vysokokapacitní analytické přístrojové platformy s chemiluminiscenční detekcí. Právě zde je možné očekávat rychlé zvládnutí analytických postupů v rutinních klinických laboratořích bez zvláštních nároků na přístrojové a personální vybavení. Některé z těchto produktů byly již aktuálně validovány, a to zejména jejich analytická část [33, 34, 35], jiné podstupují proces certifikace FDA-EUA. Srovnávací studie pěti metod ELISA a CLIA (chemiluminiscenční imunoanalýza) při detekci SARS-CoV-2 /IgG protilátek ukázala hodnoty mezilehlých precizností CV = 4 až 10 % a klinické srovnatelnosti mezi jednotlivými testovacími soupravami 61 až 98 % [36]. Byly testovány soupravy ELISA Wantai a Euroimmun a soupravy CLIA Maglumi Snibe, Liaison DiaSorin a iFLASH. Další srovnávací experiment postoupila souprava Roche Anti-SARS-CoV-2, prováděná na Elecsys (Cobas 801) a srovnávaná se soupravou EDI na bázi ELISA. Zatímco testovací souprava Roche udává, že stanovuje celkové protilátky (IgG, IgM, IgA), souprava EDI pak obvyklou kombinaci IgG a IgM [39]. Souprava Roche dosahuje 100 % senzitivity mezi 15. až 22. dnem po prokázané pozitivitě PCR detekce. Testovací soupravy ke stanovení protilátek mají v podstatě kvalitativní charakter, i když někdy používají k hodnocení kvantitativních údajů. Například u Roche je to hodnota COI (cut-off index).
Prevalence protilátek, získané různými diagnostickými soupravami jsou různé. Hodnoty publikované u systému Abbott byly 1,8 %, u české studie se soupravou Euroimmun 2,2 % [35]. Pozoruhodná je práce Sooda a spol., který určil prevalenci anti-SARS-CoV-2 s korekcí na citlivost a specifičnost použité metody s respektováním bayesiánské statistiky (pozitivních a negativních predikčních hodnot) a s ohledem na věk, etnicitu a intenzitu symptomů překonaného COVID-19 [32]. Výsledná prevalence byla 4,06 %, po nastavení na hodnoty citlivosti a specifičnosti se zvýšila na 4,65 %. Podle věku byly diference mezi skupinami dospělých lišících se o asi dvacet let v rozmezí 2,14 % (18 až 34 let) až 4,46 % (34 až 55 let). Velké rozdíly byly zaznamenány podle etnických skupin. U Hispánců to bylo 2,1 %, u Afroameričanů 6,94 %. U pacientů s intenzivními symptomy COVID-19 až 12,7 % po dvou měsících od odeznění.
Problém kvality stanovení protilátek je k zajištění výpovědi o stavu imunity zcela klíčový. Proto je povzbudivé, že po počáteční anarchii přinesl květen 2020 do situace světlejší body [36, 37, 38], směřující k harmonizaci stanovení.
- FDA mění zásadně koncepci kvality měření protilátek, uděluje vybraným metodám označení FDA-EUA jako při průkazu viru
- Po výrobcích se důsledně vyžadují validační data.
Požadavky pro certifikát EUA jsou shrnuty v pracích [37, 38, 39]:
- Křížové reakce
- Senzitivita, specifičnost
- PPV, NPV (pozitivní / negativní predikční hodnota)
O prvních diagnostických soupravách, dodaných do ČR na počátku pandemie nebylo patrně známo o validačních datech mnoho podstatného. Situace kolem certifikátů FDA-EUA se velmi rychle měnila a její stav počátkem června 2020 zachycuje Tabulka 7. Z dat tabulky je zřejmá velká pestrost detekovaných protilátek a již inzerované (a snad i dosažené) vysoké hodnoty NPV i PPV. Soupravy velkých globálních výrobců by mohly být velmi zajímavé zejména pro rutinní klinické laboratoře, disponující příslušnými přístrojovými platformami a znalostmi verifikačních postupů a mohla by to být i výzva k jejich aktivnímu používání v oblasti COVID-19. Mohlo by to vést k vyjasnění řady přetrvávajících rozporů a k lepší orientaci v klinické interpretaci výsledků.
Tab. 7. FDA-EUA kits in June, 5, 2020 www.fda.org 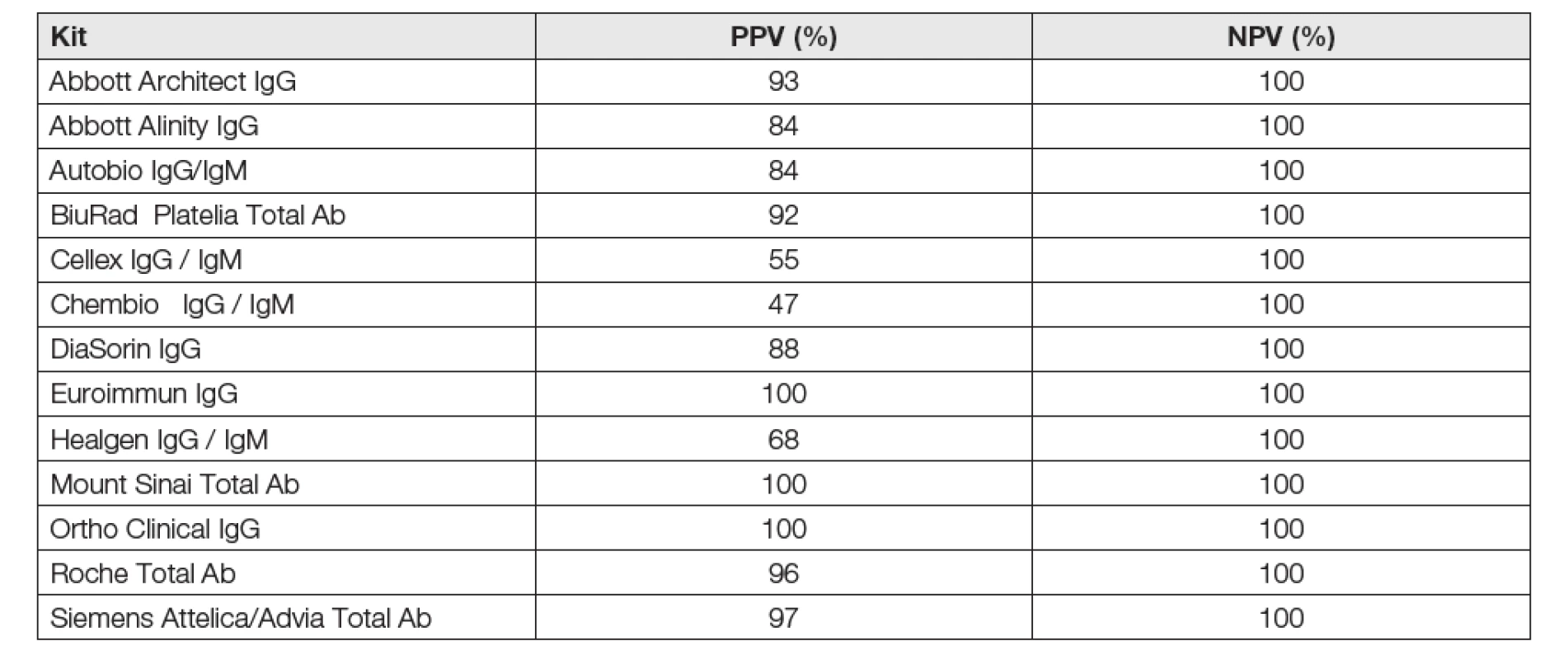
Rutinní laboratorní vyšetření u COVID-19
Výsledky první metaanalytické studie, založené na čínských a singapurských datech, zpracovaných britskými a italskými autory [40] jsou shrnuty v Tabulce 8.
Tab. 8. Changes in routine biochemical and hematological analytes COVID-19. Metaanalytic study 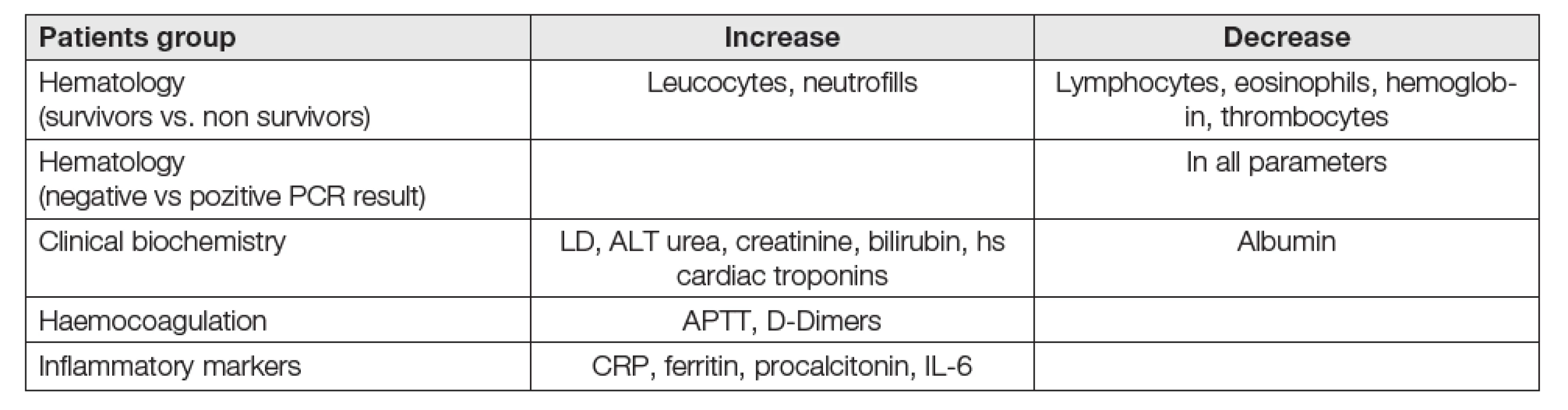
U hematologických parametrů jsou podstatné rozdíly u skupin bez SARS-CoV - 2 a s ním [41] a u pacientů přeživších a nepřeživších těžký průběh COVID-19. Důležitými indikátory těžkého až fatálního průběhu u COVID-19 jsou trombocytopenie a lymfocytopenie. Zvýšení počtu leukocytů je poměrně málo citlivý indikátor a je typické jen pro velmi těžký průběh choroby [42]. Hematologické parametry jako biomarkery predikce těžkých stavů COVID-19 a stratifikace mírného a těžkého průběhu jsou také shrnuty v retrospektivní čínské studii [43]. Příslušnými ukazateli predikce stavu jsou:
- zvýšení leukocytů,
- zvýšení neutrofilů,
- snížení lymfocytů.
Italští autoři považují za významné k predikci a stratifikaci rizika velmi těžkého průběhu COVID-19 u hospitalizovaných pacientů zvýšení koncentrací prokalcitoninu a presepsinu. U prokalcitoninu je hodnota OR (odds ratio) v metaanalytické studii, založené hlavně na pracích čínských autorů v průměru 4,8, což představuje asi pětinásobek rizika osob s prokalcitoninem nad hodnotu horní hranice referenčního intervalu [44]. Za velmi dobrý predikční marker už v rané fázi choroby těžkého průběhu COVID-19 by mohl sloužit presepsin. Typická je zde nízká korelace s hodnotami CRP a prokalcitoninem [45]. Doporučení DGKL (Deutsche Vereinte Gesellschaft für Klinische Chemie und Laboratoriumsmedizin e. V.) obsahuje [46]:
Průběžné sledování stavu hospitalizovaných pacientů:
- leukocyty, neutrofilie, lymfopenie, trombocytopenie,
- LD, ALT, celkový bilirubin, kreatinin, albumin, urea, cTn,
- CRP, D-Dimery, APPT, prokalcitonin
Prognózu těžkých stavů COVID-19:
- zvýšení leukocytů, neutrofilů, prokalcitoninu, CRP
- snížení lymfocytů a trombocytů.
Sledování pacientů s COVID-19 rutinními laboratorními testy k predikci budoucího průběhu choroby je považováno za kriticky důležité k prognóze stavu pacienta a názor kanadských autorů na ně je uveden v Tabulce 9 [47].
Tab. 9. Key laboratory tests for COVID-19 patients prognosis 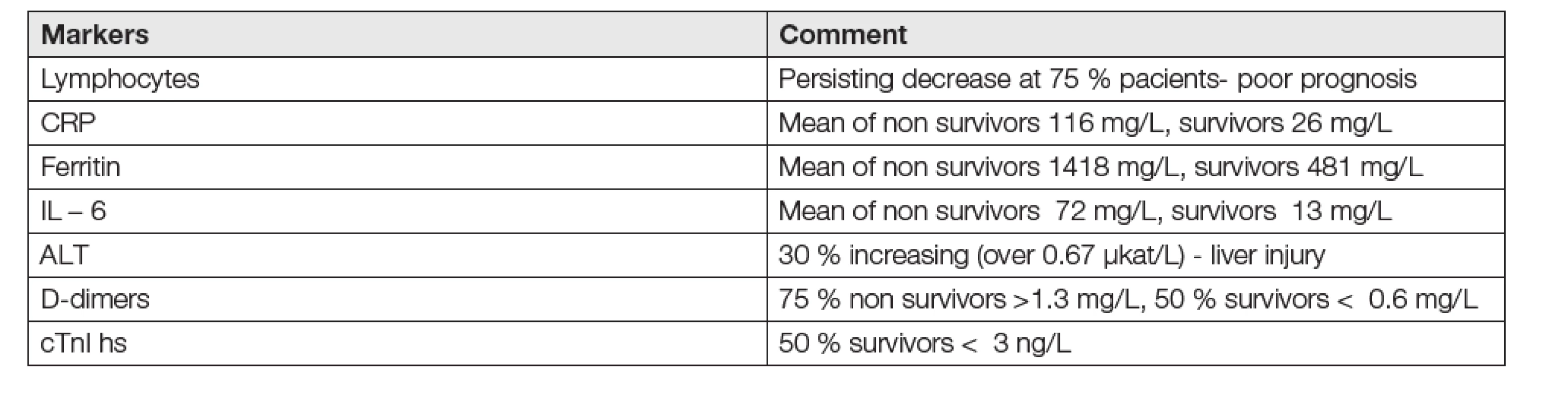
Iránští autoři získali obvyklé výsledky laboratorních parametrů, tedy zvýšení ALT, AST, neutrofilů, lymfocytů, CRP, urey a pokusili se je hodnotit ROC analýzou.Ta ukázala hodnoty AUC nad 0,5 (tedy významné) jen u ALT, AST, LD, neutrofilů, urey, CRP. Tyto parametry považují za prediktory stavu choroby. Hodnoty albuminu, lymfocytů, a leukocyty poskytly hodnoty AUC pod 0,5, nemají tedy v dané situaci prediktivní schopnosti [48]. Typický je u pacientů s COVID-19 častý výskyt zvýšení koncentrací kardiálních troponinů [50, 51]. Má to být znakem zvýšené mortality (12 %), nejvyšší z hodnot u pacientů s COVID-19 ze všech kritických komorbidit [49]. I jiní autoři považují zvýšení hodnot cTn za měřítko, úměrné závažnosti nemoci. Údajně znamená zvýšení hodnoty hs cTn 23krát vyšší riziko těžkého průběhu choroby a 11krát vyšší riziko mortality [50]. Rolí laboratoří při zabezpečení komplexního vyšetřování koagulačních faktorů, potřebného k zajištění terapeutické interference a zábrany anémii u těžkých případů COVID-19 se zabývá Baron, Harenberg a Favarolo [51, 52]. Zcela aktuální metaanalytická studie, založená na řadě literárních zdrojů [53], shrnuje dosavadní výsledky a potvrzuje u pacientů s COVID-19 snížení hematologických parametrů a albuminu a zvýšení enzymů, spojených s funkcí jater (ALT, AST, LD), zánětlivých a koagulačních markerů (CRP, prokalcitonin, IL-6, D-dimer).
Externí hodnocení kvality a testy způsobilost (EQA a PT)
Programy externího hodnocení kvality jsou v případě detekce SARS-CoV a anti-SARS-CoV-2 zcela nezbytné [1, 14, 22] a jejich počty se rychle zvyšují.
První program EHK připravovala Jižní Korea KEQAS (Korean Association of External Quality Assessment Service) za spoluúčasti dalších organizací (KFDA, Ko-rean Food and Drug Administration; KLAP, Korean Laboratory Accreditation Program) už v únoru 2020 a koncem března byl již k dispozici všem 96 laboratořím, stanovujícím SARS-CoV-2. Vzorky připravovány ve směsi plasmidových DNA (geny E, PdPp a jejich směsi). Efekt: možnost rychlého zvýšení testovací kapacity (na 20 000 testů za den) za podmínek zajištění kvality pomocí korejského systému EHK a KFDA soustavou pokynů a metodických návodů metod RT-PCR na bázi FDA-EUA. Cílem bylo zajistit vysokou kapacitu vyšetření za současných podmínek dosažení jejich potřebné kvality [54].
Seznam fungujících programů EQA / PT k 1. 6. 2020 je stručně uveden v Tabulce 10.
Tab. 10. Some external quality assessment schemes for SARS-CoV-2 to Juni 1, 2020 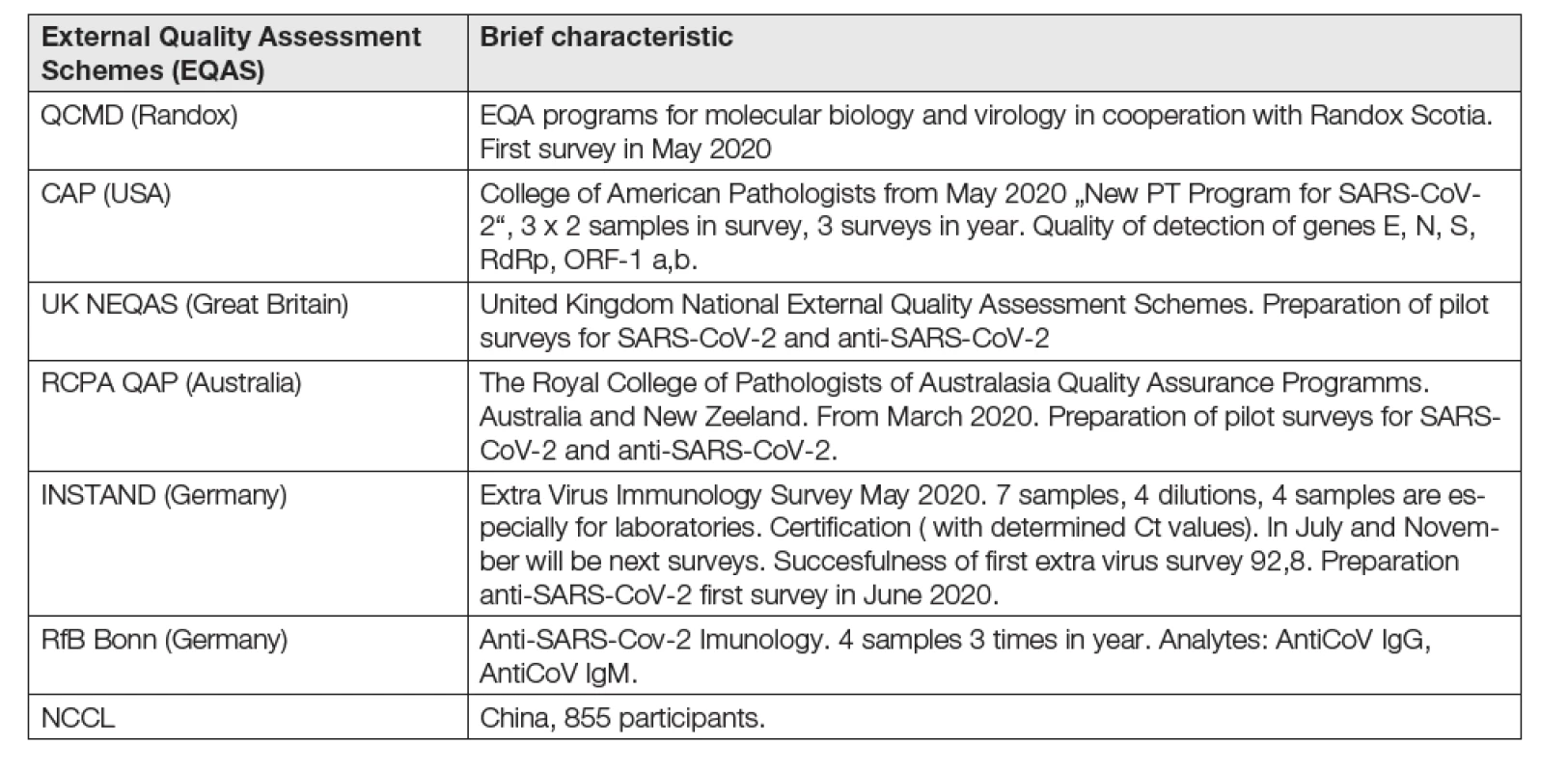
Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 16. 6. 2020.
Adresa pro korespondenci
RNDr. Bedřich Friedecký, Ph.D.
Střelničná 1680
182 00 Praha 8
e-mail: friedecky@sekk.cz
Zdroje
1. Adeli, K. Critical role of laboratory medicine in the global response to the COVID-19 pandemic. Clin. Chem. Lab. Med., 2020, 58/7 : 1019-1020.
2. Bohn, M. K., Lippi, G., Horvath, A., Sethi, S., Koch, D. et al. Molecular, serological and biochemical diagnosis and monitoring of COVID-19. IFCC taskforce evaluation of the latest evidence. Clin. Chem. Lab. Med., 2020, 58/7 : 1037-1052.
3. Lippi, G., Simundic, A. H., Plebani, M. Potential preanalytical and analytical vulnerabilities in the laboratory diagnosis of coronavirus disease 2019. Clin. Chem. Lab. Med., 2020, 58/7 : 1070-1076.
4. Odběr klinického materiálu z horních cest dýchacích pro diagnostiku COVID-19. Dostupné na webové adrese: http://www.szu.cz
5. Tang, Y. W., Schmitz, J. E., Persing, D. H., Stratton, C. W. The Laboratory Diagnosis of COVID-19 Infection: Current Issues and Challenges. J Clin. Microbiol., 20, doi:10.1128/JCM.00512-20.
6. Péré, H., Podglajen, I., Wack, M., Flamarion, E., Mirault, T. et al. Nasal swab sampling for SARS-CoV-2: A convenient alternative in time of nasopharyngeal swab shortage. J Clin. Microbiol., 2020, doi:10.1128/JCM.00721-20.
7. Wang, D., Wang, H., Li, S., Ren, T., Cao, Z. et al.The sampling locations are closely related to the positive rate of novel Coronavirus nucleic acid detection. Clin. Lab., 2020, doi:10.7754/Clin.Lab.2020.200431.
8. WHO. Laboratory Biosafety Guidance related to coronavirus disease 2019(COVID-19). May, 13, 2020.
9. Lippi, G., Adeli, K., Ferrari, M., Horvath, A. R., Koch, D. et al. Biosafety measures for preventing infection from COVID-19 in clinical laboratories: IFCC taskforce recommendations. Clin. Chem. Lab. Med., 2020, 58/7 : 1053-1062.
10. SARS-CoV-2. Diagnostic pipeline. www.finddx.org.
11. SARS - CoV-2. Diagnostic performance criteria. www.finddx.org.
12. Westgard, J., Westgard, S. COVID-19 Testing: Maintaining quality in a state of Emergency. Dostupné na: www.westgard.com
13. Dietzen, D. J. Unleashing the Power of Laboratory Developed Tests: Closing gaps in COVID diagnosis and beyond. J Appl. Lab. Med., 2020, doi:10.1093/jalm/jfaa.077/5827001.
14. Plebani, M., Lippi, G. Molecular diagnostics at the times of SARS-CoV-2 outbreak. Diagnosis, 2020, doi:10.1515/dxx-2020-0050.
15. Greene, D. N. Selecting a SARS-CoV-2/COVID molecular testing for your laboratory. J Appl. Lab. Med., 2020, doi:10.1093/jalm/jfaa076/5827000.
16. Policy for diagnostic tests for Coronavirus Disease-2019 tests during the public heath emergency (revised). Immediately in effect guidance for clinical laboratories, commercial manufacturers, and food and drug administration staff. May 4, 2020 U.S.Departement of Health and Human Service. Dostupné na: www.aacc.org.
17. Loeffelholz, M. J., Tang, Y. W. Laboratory diagnosis of emerging human coronavirus infections -The state of the art. Emerg. Microbes. Infect., 2020, 9, 747-756.
18. Loeffelholz, M. J., Alland, D., Butler-Wu, S. M., Pandey, U., Perno, C. F. et al. Multicenter Evaluation of the Cepheid Xpert Xpress SARS-CoV-2 test. J Clin. Microbiol., 2020, doi:10.1128/JCM.00926-20.
19. Uhteg, K., Jarreth, J., Richards, M., Howard, C., Morehead, E. et al. Comparing the analytical performance of three SARS-CoV-2 molecular diagnostic assays. J Clin. Virol., 2020, http://doi.org/10.1016/jcv.2020.104384.
20. CDC 2019. Novel Coronavirus(2019-nCoV) Real-Time RT-PCR Diagnostic Panel. Revision 3. Center for Disease Control and Prevention.Division of Viral Diseases. Atlanta 2020. https://www.fda.gov/media/1349221/download.
21. Perchetti, G. A., Nalla, H. K., Huang, M. L., Zhu, H., Wei, Y. et al. Validation of SARS-CoV-2 detection across multiple specimen type. J Clin. Virol., 2020, https:// doi.org.10.1016/jcv.2020.104438.
22. Nalla, A. K., Často, A. H., Huang, M. L., Perchetti, G. A., Sampoleo, R. et al. Comparative performance of SARS-CoV-2. Detection assays using seven different primers/probe sets and one assay kit. J Clin. Microbiol., 2020, doi:10.1128/JCM.00557-20.
23. Raschke, R. A., Curry, S. C., Glenn, T., Gutierrez, S., Iyengar, S. et al. A bayesian analysis of strategies to rule out COVID-19 using Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR). Arch. Pathol. Lab. Med., 2020, doi:10.5858/arpa.2020-0196-LE
24. LeBlanc, J., Gubbay, J. B., Li, Y., Needle, R., Arneson, S. R. et al. Real-timer PCR-based SARS-CoV-2 detection in Canadian laboratories. J Clin. Virol., 2020, doi:10.1016/jcv.2020.104433.
25. Broughton, J. P., Deng, X., Yu, G., Fasching, C. L., Servellita, V. et al. CRISPR-Cas12 based detection of SARS-CoV-2. Nat. Biotechnol., 2020, doi:10.1038/s41587-020-0513-4.
26. Behrmann, O., Bachmann, I., Spiegel, M., Schramm, M., El-Wahed, A. A. et al. Rapid detection of SARS-CoV-2 by low volume real time single tube reverse transcription recombinant polymerase amplification using and exo probe with an internally linked quencher (exo-IQ). Clin. Chem., 2020, 66/8 : 1047-1059.
27. Farnsworth, Ch. W., Andersen, N. W. SARS-CoV-2 Serology much hype, little data. Clin. Chem., 2020, 66/7 : 875-877.
28. Ismail, A. A. Serological tests for COVID-19 antibodies: Limitations must be recognized. Ann. Clin. Biochem., 2020, doi:10.1177/0004563220927053.
29. Padoan, A., Cosma, C., Sciacovelli, L., Faggian, D., Plebani, M. Analytical performance of a chemiluminiscence immunoassay for SARS-CoV-2 IgG/IgM and antibody kinetics. Clin. Chem. Lab. Med., 2020, 58/7 : 1081-1088.
30. Okba, N. M. A., Mueller, M. A., Li, W., Wang, Ch., Geurtsvan Kessel, Ch. et al. Severe Acute Respiratory Syndrome Coronavirus 2-Specific Antibody Responses in Coronavirus Disease 2019 Patients. Emerg. Infect. Dis., 2020, doi:10.3201/eid267.200841.
31. Bernasconi, L., Oberle, M., Gisler, V., Ottiger, C., Fankhauser, H. et al. Diagnostic performance of a SARS-CoV-2 IgG/IgM lateral flow immunochromato-graphy assay in symptomatic patients presenting to the emergency department. Clin. Chem. Lab. Med., 2020, http//doi.orf/10.1515/cclm-2020-0635.
32. Sood, N., Simon, P., Ebner, P., Eichner, D., Reynolds, J. et al. Seroprevalence of SARS-CoV-2–specific antibodies among adults in Los Angeles county, California. JAMA 2020, 323/23 : 2425-2427.
33. Bryan, A., Pepper, G., Wener, M. H., Fink, S. R., Morishima, Ch. et al. Performance characteristics of the Abbott Architect SARS-CoV-2-IgG Assay and Seroprevalence in Boise Idaho. J Clin. Microbiol., 2020, doi:10.1128/JCM 00941-20.
34. Tré-Hardy, M., Wilmet, A., Beukinga, I., Dogné, J. M., Douxfils, J. et al. Validation of a chemiluminiscent assay for specific SARS-CoV-2 antibody. Clin. Chem. Lab. Med., 2020, 58/8 : 1357-1364.
35. Krátká, Z., Luxová, Š., Malíčková, K., Furst, T., Šimková, H. Testování COVID-19 a co bychom měli mít na paměti. Čas. Lék. Čes., 2020,159 : 72-77.
36. Plebani, M., Padoan, A., Negrini, D., Carpinteri, D., Sciacovelli, L. Diagnostic performance and thresholds the key to harmonization in serological SARS-CoV-2 assays? Clin. Chim. Acta, 2020, https://doi.org/101015/j.cca.2020.05.050.
37. Egger, M., Bundschuh, Ch., Wiesinger, K., Gabriel, Ch., Clodi, M. et al. Comparison of the Elecsys Anti-SARS-CoV-2 immunoassay with the EDI enzyme linked immunosorbent assays for the detection of SARS-CoV-2 antibodies human plasma. Clin. Chim. Acta, 2020, 509 : 18-21.
38. AACC Smart Brief. Special report. 5. May 2020: FDA Issues Revised Policy on Antibody Tests. Dostupné na: www.aacc.org.
39. AACC. Recommendation for SARS-CoV-2 Serology testing issues. Recommendations on the Use of COVID-19 Antibody Tests. May 18, 2020.
40. Henry, B. M., de Oliveira, M. H. S., Benoit, S., Plebani, M., Lippi, G. Hematologic, biochemical and immune biomarker abnormalities associated with severe illness and mortality in coronavirus disease 2019 (COVID-19): a meta-analysis. Clin. Chem. Lab. Med., 2020, 58/7 : 1021-1028.
41. Ferrari, D., Motta, A., Strollo, M., Banfi, G., Locatelli, M. Routine blood tests as a potential diagnostic tool for COVID-19. Clin. Chem. Lab. Med., 2020, 58/7 : 1095-1099.
42. Frater, J., Zini, G., d’Onofrio, G., Rogers, H. J. COVID-19 and the clinical hematology laboratory. Int. J. Lab. Hematol., 2020, https://doi-org/10.1111/ijlh.13229.
43. Zheng, Y., Zhang, Y., Chi, H., Chen, S., Peng, M. et al. The hemocyte counts as a potential biomarker for predicting disease progression in COVID-19: a retrospective study. Clin. Chem. Lab. Med., 2020, 58/7 : 1106-1115.
44. Lippi, G., Plebani, M. Procalcitonin in patients with severe coronavirus disease (COVID-19): A meta-analysis. Clin. Chim. Acta, 2020, 505 : 190-191.
45. Zanimotto, M., Mion, M. M., Cosma, C., Rinaldi, D., Plebani, M. Presepsin in risk stratification of SARS-CoV-2 patients. Clin. Chim. Acta, 2020, 507 : 161-163.
46. Von Ahsen, N. Interpretationshilfe zu Laborwerten bei der COVID-19 Erkrangung. Dostupné na: www.dgkl.de
47. Kavsak, P. A., DeWit, K., Worster, A. Emerging key laboratory tests for patiens with COVID-19.Clin. Biochem., 2020, 81 : 13-14.
48. Mardani, R., Vasmehjani, A. A., Zali, F., Gholami, A., Nasab, S. D. M. et al. Laboratory Parameters in Detection of COVID-19 Patients with Positive RT-PCR. A diagnostic accuracy study. Arch. Acad. Emerg. Med., 2020, Apr: 4 : 8(1):e43. eCollection.
49. Gaze, D. C. Clinical Utility of Cardiac Troponin Measurement in COVID-19 Infection. Ann. Clin. Biochem., 2020, doi:10.1197(000456322091888.
50. Aggarval, G., Cheruiyot, I., Aggraval, S., Wong, J., Lippi, G. et al. Association of cardiovascular disease with coronavirus disease 2019 (COVID -19) severity. A meta-analysis. Curr. Probl. Cardiol., 2020, doi: 10.1016/j.cpcardiol.2020.100617.
51. Baron, D. H., Franchini, M., Goobie, S. M., Javidroozi, M., Klein, A. A. et al. Patient blood management during the COVID-19 pandemic: A narrative review. Anaesthesia, 2020, doi: 10.1111/anae.15095.
52. Harenberg, J., Favarolo, E. COVID-19 progression of disease and intravascular coagulation, present status and future perspectives. Clin. Chem. Lab. Med., 2020, 58/7 : 1029-1036.
53. Zhang, Z. L., Hou, I. L., Li, D. T., Li, F. Z. Laboratory findings of COVID-19, a systematic review and meta-analysis. Scand. J Clin. Lab. Invest., 2020, http://doi.org/10.1080/00365513.2020.1768587.
54. Sung, H., Yoo, H. K., Han, M. G., Lee, S. W., Lee, H. et al. Preparedness and rapid implementation of external quality assessment helped quickly increase COVID-19 testing capacity in the Republic of Korea. Clin. Chem., 2020, 66/7 : 979-981.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek Editorial
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2020 Číslo 3- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Význam výživy v léčbě nehojících se ran – prakticky a v kostce
-
Všechny články tohoto čísla
- Vitamin D - prevence a léčba u dětí a dospívajících
- Vitamin D a kardiovaskulární choroby. Co víme v roce 2020?
- Vitamin D 2019 - standardizace i chaos. Miniaturní model prezentace vědy v současnosti.
- Současný stav kontinuálního sledování glukózy. Minirewiew.
- Kapalné biopsie se přibližují rutinním klinickým laboratořím
- Čestné členství ČSKB pro doc. RNDr. Kristiana Šafarčíka
- Editorial
- Laboratorní diagnostika COVID-19
- Laboratorní aspekty COVID-19. Diagnostika, epidemiologie, prognóza pacientů.
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Laboratorní diagnostika COVID-19
- Vitamin D - prevence a léčba u dětí a dospívajících
- Vitamin D 2019 - standardizace i chaos. Miniaturní model prezentace vědy v současnosti.
- Vitamin D a kardiovaskulární choroby. Co víme v roce 2020?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



