-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nefrokalcinóza po transplantaci ledviny jako vzácný projev karcinomu příštítných tělísek
Nephrocalcinosis after kidney transplantation as a rare manifestation of parathyroid carcinoma
In our case report we present a case of parathyroid carcinoma in a kidney transplant recipient, which manifested as nephrocalcinosis of the kidney graft, diagnostic and treatment process of the patient. Even though hyperparathyroidism is very frequently encountered in patients with advanced kidney disease including kidney transplant recipients, a case of parathyroid carcinoma is extremely rare. In the commentary, diagnostic and therapeutic possibilities are discussed.
Keywords:
kidney transplantation – nephrocalcinosis – parathyroid neoplasms
Autoři: I. Zahrádka 1; V. Petr 1; T. Roháľ 1; J. Malušková 2; C. Povýšil 3; O. Viklický 1
Působiště autorů: Klinika nefrologie, Transplancentrum, Institut klinické a experimentální medicíny, Praha 1; Pracoviště klinické a transplantační patologie, Transplantcentrum, Institut klinické a experimentální medicíny, Praha 2; Ústav patologie 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice, Praha 3
Vyšlo v časopise: Klin. Biochem. Metab., 28, 2020, No. 1, p. 15-19
Souhrn
V naší práci je prezentován případ karcinomu příštítných tělísek u pacienta po transplantaci ledviny, který se manifestoval nefrokalcinózou štěpu ledviny, jeho diagnostika a terapie. Ačkoliv je hyperparathyreóza u pacientů s pokročilým onemocněním ledvin, potažmo po transplantaci ledviny, velmi častá, případ karcinomu příštítného tělíska je raritou. V komentáři jsou pak shrnuty možnosti diagnostiky a terapie tohoto onemocnění.
Klíčová slova:
nefrokalcinóza – transplantace ledviny – novotvary parathyroidey
Popis případu
48letý pacient s chronickým onemocněním ledvin na podkladě fokálně segmentální glomerulosklerózy (FSGS) byl přijat k provedení druhé transplantace kadaverózní ledviny. Základní onemocnění bylo zjištěno při rozvoji nefrotického syndromu ve 30 letech. I přes dva roky trvající imunosupresivní terapii došlo k terminálnímu selhání funkce ledvin a pacient byl zařazen do pravidelného dialyzačního léčení. Po dalších pěti letech byla provedena první transplantace kadaverózní ledviny. Již dva měsíce po transplantaci došlo k rekurenci FSGS, štěp fungoval další dva roky, poté selhal a byla provedena graftektomie.
Sedm let po graftektomii byla provedena parathyroidektomie s odstraněním tří příštítných tělísek. V histologii byly známky uzlovité hyperplazie z různých buněčných typů. Odstraněno bylo levé dolní, levé horní a pravé horní příštítné tělísko.
V polovině roku 2018 byl pacient přijat k provedení druhé transplantace kadaverózní ledviny. Vzhledem k tomu, že šlo o retransplantaci a v důsledku obav z rekurence FSGS, byl zvolen individuální indukční imunosupresivní protokol (výměna plazmy před transplantací, poté denně desetkrát, 700 mg rituximabu první pooperační den, antithymocytární globulin (v celkové dávce 6,2 mg/kg) a standardní trojkombinace (prednison, takrolimus, mykofenolát mofetil).
Operační výkon byl nekomplikovaný, studená ischemie 14 hodin. Po transplantaci se funkce štěpu ale nezačala rozvíjet. Sedmý den po transplantaci proto byla provedena biopsie štěpu, v níž byly morfologické známky akutní tubulární nekrózy (ATN) a četné kalcium-fosfátové krystaly v tubulech (obr. 1 a 2). V den biopsie byla přítomna hyperfosfatémie 2,55 mmol/L, hyperkalcémie 2,58 mmol/L a vysoká hladina parathormonu (PTH) 44 pmol/L. Byly proto zahájeny denní hemodia filtrace a byl podáván parikalcitol 1 µg denně. Tento postup sice snížil fosfatémii na 1,7 mmol/L a kalcémii na 2,5 mmol/L, ale k rozvoji funkce štěpu nedošlo. V této době byla zahájena diagnostika tohoto stavu. Bylo zjištěno, že se koncentrace parathormonu dále zvýšila na 85 pmol/L. Proto byla provedena scintigrafie, která ukázala na suspektní zvětšené tělísko vpravo, které bylo ponecháno při předchozí parathyroidektomii. Na CT nebyl tento nález potvrzen, konzultovaný chirurg však přesto indikoval parathyroidektomii. Bylo exstirpováno suspektní příštítné tělísko, výkon však nebyl úspěšný, po výkonu k poklesu PTH nedošlo. Po dalších dvou dnech byla provedena další chirurgická revize s použitím radionuklidové sondy, revize ale nebyla úspěšná pro příliš velký signál pozadí. Při této revizi bylo ovšem nalezeno tělísko v oblasti pravého laloku štítné žlázy, které bylo následně exstirpováno. Dvacet částic tělíska bylo implantováno do svalů levého předloktí. Po této intervenci došlo k rychlému poklesu PTH (z 86 pmol/L na 5 pmol/L) a k poklesu kalcémie s nutností parenterální suplementace.
Obr. 1. Renal tubules with flattened lining and ATN morphology, copious amount of calcium-phosphate microcalculi in the lumen (hematoxylin and eosin staining with elastic). 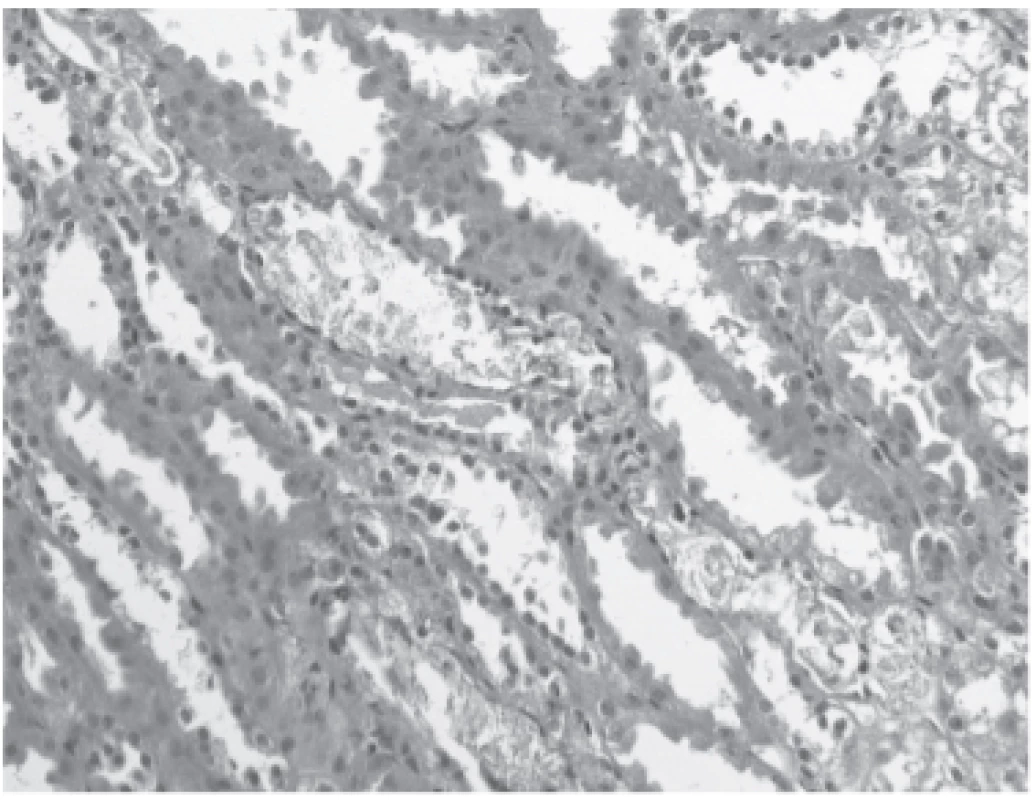
Obr. 2. Proof of calcium-phosphate salts in the microcalculi in the tubular lumina (black, von Kossa staining). 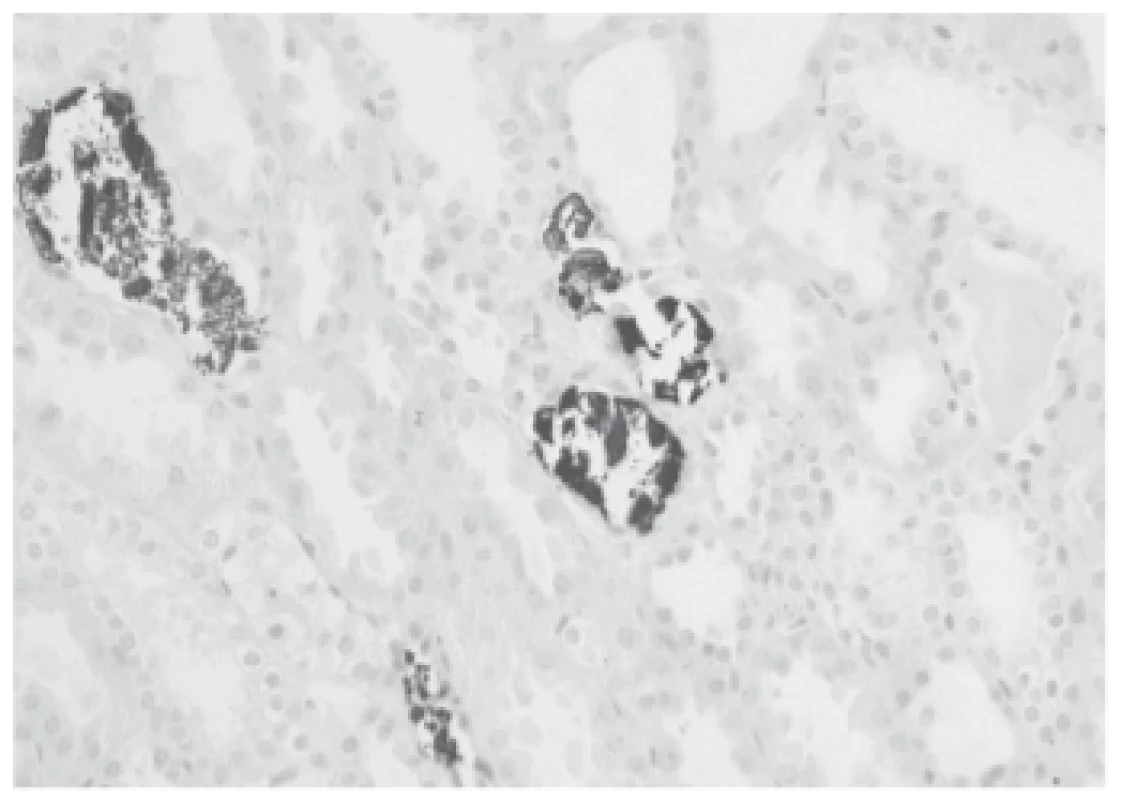
Protože dále nedocházelo k rozvoji funkce štěpu ledviny, byla 17. den po transplantaci provedena druhá biopsie štěpu, kde přetrvávala morfologie ATN, četné kalcium-fosfátové krystaly a dále nově intersticiální rejekce IB. Vzhledem k tomuto nálezu bylo podáno 1,5 g methylprednisolonu. Pro přetrvávající afunkci jsme 23. den provedli třetí biopsii, kde byla popsána odeznívající celulární rejekce IB a přetrvávající četné kalcium-fosfátové krystaly v tubulech. O den později byl telefonicky sdělen výsledek histologie příštítného tělíska, kde byl popsán dobře diferencovaný karcinom příštítného tělíska s invazí do sousední tukově vazivové tkáně a s expresí parathormonu (obr. 3) – struktura původního příštítného tělíska byla z valné části nahrazena ložisky atypické tkáně příštítného tělíska, známky invaze do okolní tkáně jsou spolehlivým dokladem malignity.
Obr. 3. Core mass of the parathyroid carcinoma. Obvious basophilia and completely different structure is a sign of malignant process. Additionally, there are signs of invasion into adjacent fibrous tissue (hematoxylin and eosin staining) 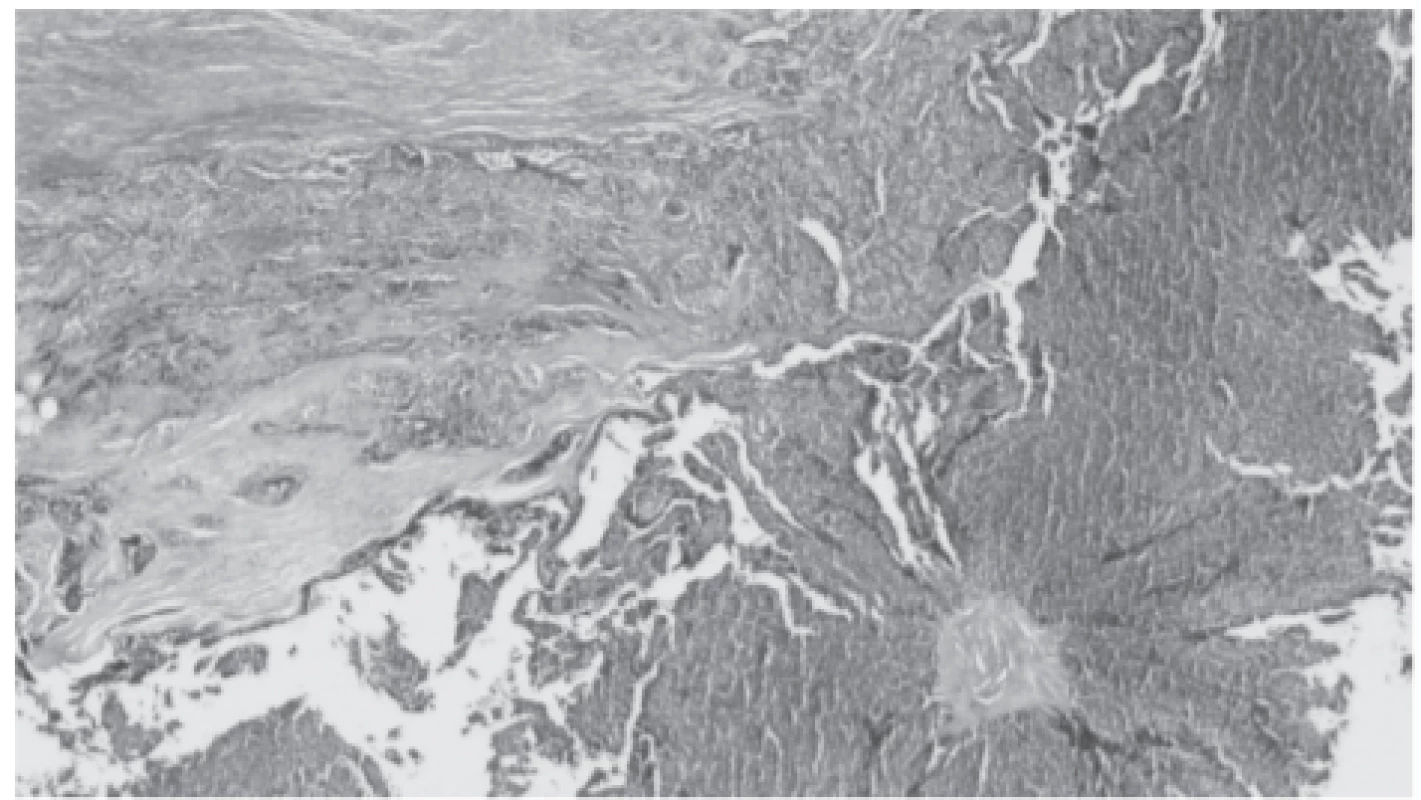
Vzhledem k afunkci štěpu a nálezu invazivního karcinomu, přičemž tato tkáň byla implantována do předloketních svalů, bylo rozhodnuto o zastavení antirejekční terapie. S cílem kompletního odstranění nádoru byla měsíc po transplantaci provedena revize oblasti štítné žlázy, dále odstranění implantovaných částic příštítného tělíska z předloktí a graftektomie afunkčního štěpu, v němž byla histologicky popsána akutní celulární rejekce. V tubulech již kalcium-fosfátové krystaly popsány nebyly. V tukově vazivové tkáni krku byla nalezena reziduální drobná ložiska karcinomu stejné histologické struktury se zřetelnou pozitivitou parathor-monu (obr. 4), nebylo možno se vyjádřit k tomu, zda byla resekce radikální. Histologický preparát svaloviny předloktí neprokázal přítomnost nádorových buněk.
Obr. 4. Metastatic foci of cancer with positive staining with antibody against parathormone in lipomatous tissue. 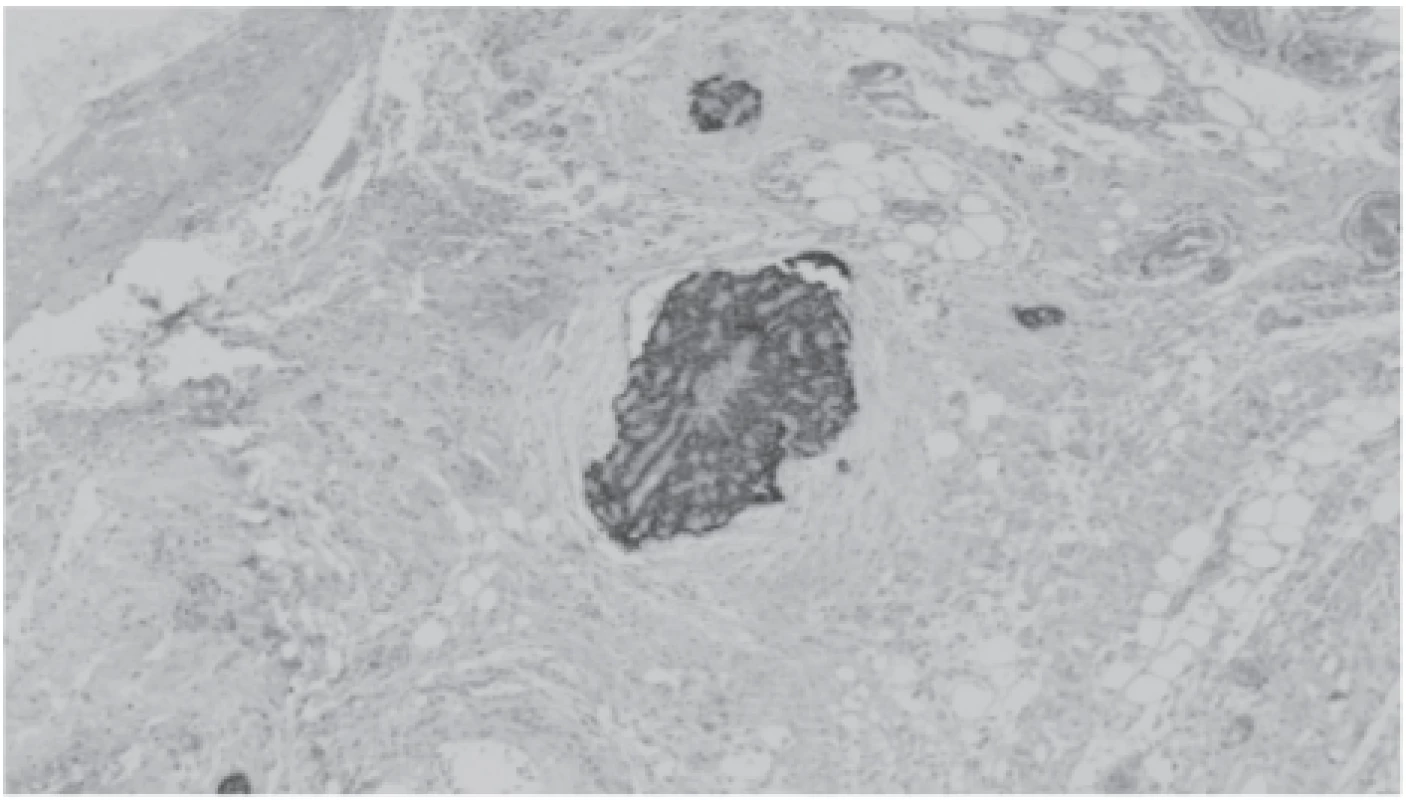
V současnosti je pacient sledován na onkologii a v naší ambulanci, je chronicky dialyzovaný. Půl roku po resekci karcinomu je hladina PTH nízká. Laboratorně jsou patrné sklony k hypokalcémii a známky zvýšeného kostního obratu, a proto bylo zahájeno podávání kalcitriolu.
Článek – komentář
Náš případ popisuje komplikovaný potransplantační průběh pacienta s hyperparathyreózou. Hyperparathyreózy jsou stavy definované nadměrnou sekrecí PTH. Primární hyperparathyreóza je primární poruchou příštítných tělísek, která autonomně a neregulovaně secernují PTH. Hlavními příčinami jsou adenom a hyperplazie příštítných tělísek. Naproti tomu v případě sekundární hyperparathyreózy je zvýšená sekrece PTH dána kompenzační odpovědí příštítných tělísek na stimuly, zejména stavy asociované s nízkou hladinou sérového vápníku. Sekundární hyperparathyreóza je dominantní problematikou a častou komplikací chronického onemocnění ledvin. Hyperparathyreóza je přítomna u více než 80 % pacientů s glomerulární filtrací pod 20 ml/min [1].
Terciární hyperparathyreóza je důsledkem dlouhotrvající sekundární hyperparathyreózy. Oba tyto stavy jsou důsledkem chronických stimulů vedoucích k sekreci PTH, v případě terciární hyperparathyreózy ale chronická stimulace příštítných tělísek vede ke ztrátě schopnosti adekvátně reagovat na podněty a příštítná tělíska začnou secernovat PTH autonomně a neregulovaně podobně jako v případě hyperparathyreózy primární. Stejně jako u primární je typickou známkou terciární hyperparathyreózy hyperkalcémie a klinické příznaky z ní pramenící, zatímco v případě sekundární hyperparathyreózy je koncentrace kalcia v plazmě normální nebo snížená. Kromě klasického klinického a laboratorního obrazu musí být diagnóza terciární hyperparathyreózy podpořena další poruchou jako je již zmiňované dlouhotrvající chronické onemocnění ledvin.
Karcinom příštítných tělísek je vzácné onemocnění, které se může manifestovat jako primární hyperparathyreóza. Reportovaná incidence se v evropské a americké literatuře pohybuje kolem 0,5 – 1,0 % z primárních hyperparathyreóz, některé japonské studie udávají incidenci až 5 % [2]. Až 90 % karcinomů je hormonálně aktivních a v době diagnózy jsou klinicky manifestní [3]. Případy hormonálně afunkčního, a tedy dlouho asymp-tomatického, karcinomu jsou velmi vzácné a mají podstatně horší prognózu. Rychlý nástup klinických symptomů, těžká hyperparathyreóza s vysokými hodnotami PTH a významnou symptomatickou hyperkalcemií ve formě až hyperkalcemické krize, spolu s fyzikálním vyšetřením hmatné masy na krku, by měly vést k podezření na karcinom příštítných tělísek a následnou adekvátní diagnostiku a terapii.
Diagnostika karcinomu příštítných tělísek je obtížná. Při podezření by měla diagnostika maligního onemocnění předcházet chirurgickému výkonu ve všech případech chirurgického řešení. Sonografie krku a 99mTc sestamibi scintigrafie jsou základními zobrazovacími metodami v diagnostice benigních onemocnění. Sonografie krku je levné a dostupné vyšetření, které může podat základní informace o struktuře a umístění léze příštítných tělísek. Scintigrafické vyšetření potom může odhalit ektopická tělíska na krku i v jiných lokalizacích. V případě souhlasného nálezu na sonografii a sestamibi scintigrafii u adenomu příštítných tělísek může být pozitivní prediktivní hodnota lokalizace až 97 % [4]. V případě maligního onemocnění je ale nutné zvolit zobrazovací modalitu s vysokým anatomickým rozlišením. Výpočetní tomografie (CT) i magnetická rezonance (MR) s gadoliniem a potlačením signálu tukové tkáně jsou obě běžně dostupné a vhodné metody k diagnostice. CT poskytuje detailní informace o lokalizaci léze a vzájemných anatomických vztazích, zatímco MR poskytuje lepší obraz měkkých tkání krku [5, 6]. Použití MR je v případě rekurentního onemocnění výhodnější než CT, kdy ponechané chirurgické svorky mohou tvořit v CT obraze četné artefakty [7]. Význam a přínos metod nukleární medicíny, jako single-photon emission tomography (SPECT) nebo positron emission tomography (PET) a eventuálně modifikace s CT zobrazením (PET/CT, SPECT/CT) není oproti konvenčním metodám dosud jasný a tato vyšetření nejsou rutinně prováděna. Vzhledem k vysoké senzitivitě těchto vyšetření ale existují klinické situace, kdy při diagnostických rozpacích může jejich použití přinést další informace. V takových případech je pak důležité myslet na specifika těchto vyšetření. Například tzv. hnědé kostní tumory, typická kostní komplikace hyperparathyreózy, budou při PET/CT vyšetření s fluorodeoxyglukózou (FDG-PET/CT) zobrazeny jako ložiska s vysokou akumulací FDG a mohou být zaměněny za kostní metastázy [8]. Obtížné je také hodnocení lokální rekurence základního onemocnění, neboť nespecifické zánětlivé změny v tkáních po operačním výkonu mohou způsobovat falešně pozitivní výsledek. Z tohoto důvodu by PET/CT mělo být prováděno nejdříve za 3-6 měsíců po výkonu [9].
Biopsie tenkou jehlou není v případě podezření na karcinom doporučována. Je to jednak z důvodu rizika diseminace maligních buněk a jednak pro omezenou a nespolehlivou informaci, kterou by cytologie mohla přinést [5].
Problematické je i definitivní stanovení karcinomu v histologickém preparátu. U části pacientů lze diagnózu karcinomu stanovit až na základě lokální rekurence po předchozí operaci adenomu. Kritéria, která byla navrhnuta k odlišení benigních a maligních lézí, nejsou dle současné literatury dostatečně specifická ani senzitivní. Kupříkladu mitotická aktivita může být přítomna i v benigních lézích, zatímco invaze pouzdra a vaskulární invaze jsou přítomny jen u části karcinomů. Ačkoliv v posledních letech přinesly značný pokrok nové metody jako imunohistochemické barvení, nebyl zatím nalezen jediný spolehlivý marker [5]. Z těchto důvodů i konečná histologická diagnóza karcinomu příštítných tělísek zůstává výzvou. Chtěli bychom zde zdůraznit důležitost multidisciplinárního diagnostického přístupu, který by měl zohlednit všechny klinické, laboratorní, zobrazovací a histologické nálezy konkrétního pacienta.
Terapie onemocnění sestává ze dvou hlavních pilířů – pokus o úplné vyléčení onemocnění a, v případě selhání, paliativní péče mířící na potlačení symptomatologie onemocnění. Doporučovaným léčebným postupem s nejvyšší úspěšností v dosažení permanentní remise je radikální chirurgická en bloc resekce bez porušení pouzdra s dostatečným bezpečnostním lemem [10]. Adjuvantní chemo - a radioterapie neprokázala dostatečnou účinnost a rutinně se nepoužívá [5, 10]. Prostá tumorektomie je asociovaná s podstatně větším rizikem rekurence a nižším celkovým přežitím [11, 12]. Biologicky se sice jedná o nádor spíše indolentního charakteru s pomalou progresí, ale je nutno dodat, že i při adekvátním chirurgickém výkonu je riziko rekurence vysoké. Rekurence onemocnění je asociována s horší prognózou a při případné reoperaci se výrazně snižuje šance na úplnou remisi onemocnění [5].
Úmrtí v případě karcinomu příštítných tělísek nastává v důsledku symptomů pramenících z hormonální aktivity nádoru, paliativní terapie proto cílí na terapii hyperkalcémie, snížení tvorby PTH nádorem a inhibici jeho efektu na cílové tkáně. Z chirurgického hlediska je vhodné mířit na co největší redukci masy biologicky aktivní tkáně, debulking lze provádět opakovaně [13]. V této době nejšířeji užívanou farmakologickou léčbou je antiresorpční léčba bisfosfonáty. V literatuře se objevují spekulace o užití některých kalcimimetik jako například cinakalcet. Cinakalcet se váže na receptor pro kalcium (calcium-sensing receptor) buněk příštítných tělísek a snižuje senzitivitu receptoru k aktivaci extracelulárním kalciem, což dále vede ke snížení sekrece PTH [2]. Bohužel, data o použití u metastatického nádoru příštítných tělísek chybí. Další variantou pro pacienty s refrakterní hyperkalcémií by mohl být denosumab, humánní monoklonální protilátka proti RANKL (ligand pro receptor aktivátoru nukleárního faktoru κB), která inhibuje tvorbu a aktivitu osteoklastů, a tak snižuje odbourávání kostí [14, 15].
Je důležité také zmínit, že po operačním výkonu se může rozvinout až tzv. syndrom hladové kosti. Skokový pokles PTH může vést k tomu, že těžce demineralizovaný skelet začne excesivně vychytávat kalcium, což může vést k těžkým, symptomatickým až život ohrožujícím hypokalcémiím. Po výkonu je tedy nutné pečlivé sledování pacientů s pravidelnými kontrolami sérového kalcia a adekvátní intravenózní suplementací kalcia, která může trvat až týdny. Dlouhodobé sledování parametrů kalciofosfátového metabolismu pak může být důležitým vodítkem k časnému odhalení recidivy základního onemocnění.
V případě pacientů se sekundární a terciární hyperparathyreózou po transplantaci ledviny je situace ještě výrazně složitější. Téměř všichni pacienti mají různě závažnou míru onemocnění. Zatímco u větší části pacientů hyperparathyreóza po transplantaci a po obnovení ledvinné funkce vymizí, přibližně u 15-50 % pa-cientů se odhaduje, že významná hyperparathyreóza přetrvává i po transplantaci [16]. To je způsobeno přetrváváním strukturálních změn příštítných tělísek, jako je hyperplazie nebo adenom, navzdory odstranění chronických stimulů vedoucích k tvorbě PTH.
Karcinom příštítných tělísek v terénu chronického onemocnění ledvin je vzácné onemocnění, které je v literatuře popisováno spíše jen kazuisticky a po transplantaci ledviny je téměř raritní [2, 17]. To může v populaci s velmi vysokou prevalencí hyperparathyreózy činit diferenciálně diagnostické problémy. Stejně jako v obecné populaci, i u pacientů po transplantaci by závažné příznaky hyperparathyreózy měly vyvolat podezření na malignitu. V případě našeho pacienta byla varovným signálem afunkce štěpu s opakovaným nálezem četných kalcium-fosfátových krystalů v biopsii.
Doporučené postupy u karcinomu příštítných tělísek u pacientů po transplantaci ledviny neexistují. U nádorových onemocnění je potřeba vždy zvážit přínos zastavení imunosupresivní terapie, a tedy riziko ztráty štěpu při rejekční epizodě, oproti riziku progrese maligního onemocnění s ponechanou imunosupresí. Je nutno zmínit, že maligní onemocnění u pacientů po transplantaci mají sklon k rychlejšímu a závažnějšímu průběhu než v běžné populaci, pravděpodobně kvůli modifikaci imunitní odpovědi imunosupresí [18]. Na druhou stranu je výhodou, že pacienti před transplantací podstupují intenzivní onkologický screening, a tak je diseminované maligní onemocnění v časné potransplantační době spíše raritou. Vzhledem k tomu, že je adekvátní chirurgická intervence u lokální formy karcinomu příštítných tělísek považována za metodu kurabilní [3], není přerušení imunosuprese vždy nezbytně nutné. Rozhodnutí o imunosupresi u našeho nemocného bylo jednoduché v tom, že u nemocného se funkce štěpu nerozvinula. I když šlo očekávat opožděný rozvoj funkce štěpu, rizika spojená s imunosupresí byla velká. Proto jsme se rozhodli ke graftektomii a k ukončení imunosuprese. Vzhledem k nárůstu léčby hyperparathyreózy cinacalcetem, kalcimimetika zvyšující citlivost calcium-sensing receptoru a v důsledku k úbytku operačního řešení sekundární hyperparathyreózy, je možné předpokládat, že budeme v blízké budoucnosti konfrontováni s podobnými případy.
Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 8. 10. 2019
Adresa pro korespondenci:
MUDr. Ivan Zahrádka
Institut klinické a experimentální medicíny
Klinika nefrologie, Transplantcentrum
Vídeňská 1958/9
140 21 Praha 4
e-mail: ivan.zahradka@ikem.cz
Zdroje
1. Levin, A., Bakris, G. L., Molitch, M., et al. Prevalence of abnormal serum vitamin D, PTH, calcium, and phosphorus in patients with chronic kidney disease: Results of the study to evaluate early kidney disease. Kidney Int., 2007, 71(1), p. 31-38.
2. Khan, M. W., Worcester, E. M., Straus, F. H., et al. Parathyroid carcinoma in secondary and tertiary hyperparathyroidism. J Am Coll Surg., 2004, 199(2), p. 312–319.
3. Wei, C. H., Harari, A. Parathyroid carcinoma: update and guidelines for management. Curr Treat Options Oncol., 2012, 13(1), p. 11–23.
4. Kunstman, J. W., Kirsch, J. D., Mahajan, A., et al. Clinical review: Parathyroid localization and implications for clinical management. J Clin Endocrinol Metab., 2013, 98(3), p. 902–912.
5. Givi, B., Shah, J. P. Parathyroid Carcinoma. Clin Oncol R Coll Radiol G B., 2010, 22(6), p. 498–507.
6. Khan, A. A., Hanley, D. A., Rizzoli, R., et al. Primary hyperparathyroidism: review and recommendations on evaluation, diagnosis, and management. A Canadian and international consensus. Osteoporos Int., 2017, 28(1), p. 1–19.
7. Weber, A. L., Randolph, G., Aksoy, F. G. The thyroid and parathyroid glands. CT and MR imaging and correlation with pathology and clinical findings. Radiol Clin North Am., 2000, 38(5), p. 1105–1129.
8. Kemps, B., van Ufford, H. Q., Creyghton, W., et al. Brown tumors simulating metastases on FDG PET in a patient with parathyroid carcinoma. Eur J Nucl Med Mol Imaging., 2008, 35(4), p. 850.
9. Evangelista, L., Sorgato, N., Torresan, F., et al. FDG-PET/CT and parathyroid carcinoma: Review of literature and illustrative case series. World J Clin Oncol., 2011, 2(10), p. 348–354.
10. Wilhelm, S. M., Wang, T. S., Ruan, D. T., et al. The American Association of Endocrine Surgeons Guidelines for Definitive Management of Primary Hyperpara-thyroidism. JAMA Surg., 2016, 151(10), p. 959–968.
11. Koea, J. B., Shaw, J. H. Parathyroid cancer: biology and management. Surg Oncol., 1999, 8(3), p. 155–165.
12. McClenaghan, F., Qureshi, Y. A. Parathyroid cancer. Gland Surg., 2015, 4(4), p. 329–38.
13. Witteles, R. Parathyroid carcinoma. In: Surgery of the thyroid and parathyroid glands. Philadelphia: Saunders, 2003, p. 578–590.
14. Long, K. L., Sippel, R. S. Current and future treatments for parathyroid carcinoma. Int J Endocr Oncol., 2018, 5(1), IJE06.
15. Vellanki, P., Lange, K., Elaraj, D., Kopp, P. A., El Muayed, M. Denosumab for management of parathyroid carcinoma-mediated hypercalcemia. J Clin Endocrinol Metab., 2014, 99(2), p. 387–390.
16. Julian, B. A., Quarles, L. D., Niemann, K. M. Musculoskeletal complications after renal transplantation: pathogenesis and treatment. Am J Kidney Dis Off J Natl Kidney Found., 1992, 19(2), p. 99–120.
17. Kim, B. S., Ryu, H. S., Kang, K. H., Park, S. J. Parathyroid carcinoma in tertiary hyperparathyroidism. Asian J Surg., 2016, 39(4), p. 255–259.
18. Wong, G., Chapman, J. R., Craig, J. C. Death from cancer: a sobering truth for patients with kidney transplants. Kidney Int., 2014, 85(6), p. 1262–1264.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek Doporučení ČSKBČlánek RNDr. Ivan Bilyk
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2020 Číslo 1- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Význam výživy v léčbě nehojících se ran – prakticky a v kostce
-
Všechny články tohoto čísla
- Progresivní familiární intrahepatální cholestáza v dospělosti: 60leté sledování
- Nefrokalcinóza po transplantaci ledviny jako vzácný projev karcinomu příštítných tělísek
- RNDr. Ivan Bilyk
- Zpráva o biotinu a jeho interferencích u imunoanalytických metod
- Doporučení České společnosti klinické biochemie k jednotkám výsledků měření
- Doporučení České společnosti klinické biochemie a České myelomové skupiny k laboratorní diagnostice monoklonálních gamapatií
- Doporučení ČSKB
- Doporučení: Systém externího hodnocení kvality (EHK)
- Nový koronavirus 2019. Pár základních informací a jejich dostupnost.
- Patobiochemie inhibinu A a jeho využití ve screeningu vrozených vývojových vad.
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení: Systém externího hodnocení kvality (EHK)
- Doporučení ČSKB
- Doporučení České společnosti klinické biochemie k jednotkám výsledků měření
- Patobiochemie inhibinu A a jeho využití ve screeningu vrozených vývojových vad.
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



