-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučení České společnosti klinické biochemie a České myelomové skupiny k laboratorní diagnostice monoklonálních gamapatií
Autoři: J. Vávrová; P. Kušnierová; V. Maisnar; L. Šolcová
Vyšlo v časopise: Klin. Biochem. Metab., 28, 2020, No. 1, p. 26-34
Úvod
Dokument je přirozeným důsledkem i součástí celosvětového úsilí o harmonizaci a směřování laboratorní medicíny k precizní medicíně [1-4]. Mohl by být efektivním nástrojem k diagnostice, přičemž diagnostika sama přesahuje hranice tohoto doporučení a není možné obě věci zaměňovat navzájem. Doporučení si neklade za cíl řešit klinické indikace dané doporučeními odborných společností průběžně aktualizovanými na mezinárodní úrovni [5], nýbrž chce přispět ke srovnatelnému přístupu analytického i postanalytického laboratorního vyšetření parametrů laboratorní diagnostiky monoklonálních gamapatií. Laboratorní pracovníci poskytují rutinně základní a mnohdy zásadní informace o podezření na přítomnost monoklonálního gradientu, jeho průkazu, typizaci a následné kvantifikaci. Tato vyšetření jsou pro další léčbu pacienta mnohdy klíčová a včasnost léčby také závisí na požadování vyšetření praktickými lékaři, či oblastními specialisty. Popis a interpretace laboratorních výsledků by měly být mezilaboratorně srovnatelné a poskytnout klinickému lékaři jasné informace, potřebné jak pro přesnou diagnostiku, tak odpovídající léčbu jeho pacientů. Výsledkové listy musí obsahovat informace umožňující posouzení dat podle klinických kritérií.
Za základní klinicko-biochemické vyšetření je považováno stanovení koncentrace celkové bílkoviny, elektroforéza frakcí sérových proteinů a k určení imunoglobulinové třídy a antigenního typu lehkých řetězců paraproteinů pak imunofixační elektroforéza. Své místo v algoritmu laboratorních metod používaných u monoklonálních gamapatií zaujímá také stanovení koncentrace volných lehkých řetězců (nesekretorický myelom, AL amyloidóza, onemocnění z lehkých řetězců). Z řady prognostických faktorů byla vybrána kombinace β2-mikroglobulinu a albuminu, v paletě laboratorních vyšetření je třeba myslet také na doplňující stanovení viskozity séra a průkaz kryoglobulinů [6, 7].
Nomenklatura
- Monoklonální komponenta v sérovém elektroforetickém profilu je kvalitativně popisována synonymy „monoklonální imunoglobulin“, „monoklonální gradient“ nebo „paraprotein“.
- Termín monoklonální volné lehké řetězce je preferován před názvem „Bence-Jonesova bílkovina“, odkazuje-li na monoklonální volné lehké řetězce v séru.
- Monoklonální komponenta v moči je označována obecně jako „Bence-Jonesova bílkovina“, „paraprotein“ nebo jako „monoklonální volné lehké řetězce v moči“.
- Oligoklonální profil nálezu odkazuje na dvě nebo více linií v gama frakci imunofixační elektroforézy sérových proteinů; rozlišení monoklonálních a polyklonálních pásů se v rutinní diagnostice neprovádí.
Požadovaná laboratorní vyšetření související s diagnostikou a sledováním monoklonálních gamapatií [5]
- Laboratorní vyšetření, která by měl provést obvodní (praktický) lékař u nemocných s podezřením na mnohočetný myelom
Hematologie:
- Sedimentace erytrocytů. Velmi vysoká sedimentace u nemocných s mnohočetným myelomem souvisí s přítomností monoklonálního imunoglobulinu.
- Kompletní krevní obraz. Mnohočetný myelom mohou provázet jak anémie, tak případně trombocytopenie, ale i neutropenie.
Klinická biochemie:
- Celková bílkovina a albumin v séru.
- Urea, kreatinin, elektrolyty včetně kalcia v séru.
- Elektroforéza bílkovin séra (detekuje monoklonální imunoglobulin ve vyšších koncentracích, spolehlivě nad 5 g/L).
- Kvantitativní vyšetření imunoglobulinů v séru (izolované zvýšení jednoho typu imunoglobulinu se současným snížením jednoho nebo všech ostatních typů dalších se označuje jako imunoparéza a je častým nálezem při diagnóze mnohočetného myelomu).
- Vyšetření přítomnosti lehkých řetězců v moči (Bence-Jonesova bílkovina).
Pokud jsou přítomny příznaky a některé z vyšetření budí podezření na mnohočetný myelom, musí být takový pacient ihned odeslán na specializované pracoviště s možností toto podezření konfirmovat.
2. Rozsah vyšetření prováděných ve specializovaných centrech s cílem potvrdit mnohočetný myelom, stanovit klinické stadium nemoci a její prognózu
Základní biochemická vyšetření:
- Urea, kreatinin, kyselina močová, Ca, ionizované Ca, Na, K, Cl, P, bilirubin, ALT, AST, ALP, glykémie, CRP a LDH.
- Koncentrace celkové bílkoviny a albuminu v séru.
- Kvantitativní proteinurie ze sběru moči za 24 hodin.
- Vyšetření glomerulární filtrace.
Speciální vyšetření bílkovin:
- Elektroforéza séra a zahuštěné moči.
- Typizace paraproteinu imunofixací (IFE) v séru i v moči. Vyšetření je nutno provést vždy i u pacientů, u nichž je podezření na tuto chorobu a elektroforéza je negativní.
- Kvantitativní denzitometrické stanovení monoklonálního imunoglobulinu.
- Kvantitativní denzitometrické stanovení lehkých řetězců v moči buď v náhodném vzorku moči se vztažením ke koncentraci kreatininu v tomto vzorku, nebo měřené ve vzorku moči ze sběru za 24 hodin.
- Kvantitativní stanovení polyklonálních (neizotypických) imunoglobulinů.
- Volné lehké řetězce v séru včetně stanovení indexu κ/λ.
- Stanovení koncentrace β2-mikroglobulinu v séru.
Metodické přístupy k laboratorním vyšetřením související s diagnostikou a sledováním monoklonálních gamapatií
Metody stanovení základních rutinních laboratorních vyšetření jsou v laboratořích používány frekventně a jsou povinně v každé laboratoři zajištěny dlouhodobým sledováním v systémech vnitřní kontroly kvality i v rámci externího hodnocení kvality daných analytů. V souvislosti s mezinárodním úsilím o standardizaci v oblasti monoklonálních gamapatií je proto zde diskutována pouze otázka metody stanovení albuminu v séru [8].
Stanovení koncentrace albuminu v séru – doporučena metoda s bromkrezolovým purpurem
Současná situace v harmonizaci postupů pro měření koncentrace albuminu v séru a její dopad pro lékařská rozhodování prokazují významné rozdíly mezi imunochemickými, BCG (bromcresol green) a BCP (bromcresol purple) metodami. Ze spektra rutinně nabízených možností měření jsou statisticky významně úspěšnější BCP postupy. Má-li být dosaženo harmonizace, pak doporučení a výpočty pro klinická hodnocení funkce ledvin a dalších nemocí musí zvážit volbu a používání metody pro měření albuminu [8, 9].
Detekční systém pro elektroforézu proteinů
- Elektromigrační metody dělení frakcí proteinů v uspořádání na agarózovém gelu a v uspořádání kapilární zónové elektroforézy (CZE) jsou srovnatelné a jsou vhodnými postupy pro elektroforézu proteinů v séru.
- Frakce sérových proteinů se kvantifikují na gelu denzitometricky nebo skenováním, u CZE je detekčním místem průchod frakce proteinů detekčním okénkem, kde dochází ke snímání fotometrického signálu, pro kvantifikaci se zaznamenává plocha pod křivkou. Kvantitativně se hodnoty uvádí v g/L.
- Elektroforetický systém musí mít vysoké rozlišení, aby byl schopen detekovat malé monoklonální pásy (nebo monoklonální imunoglobuliny o nízké koncentraci), které mohou migrovat s ostatními proteiny v oblasti frakce beta nebo případně i ve frakci alfa. Doporučuje se používání diagnostik dělících sérové proteiny na frakce albumin, alfa 1, alfa 2, beta 1, beta 2 a gama.
- Pro elektroforézu proteinů není doporučována elektroforéza na acetátu celulózy vzhledem k nízkému rozlišení.
- Lékaři by měli požadovat sledování koncentrace paraproteinu u jednotlivých pacientů vždy stejnou metodou, přičemž výhodou je dlouhodobé využívání služeb stejné laboratoře disponující dlouhodobou databází výsledků s kumulativním laboratorním nálezem téhož pacienta.
- Vzorky vyžadující typizaci IFE by měly být předány k dovyšetření do referenční laboratoře, pokud laboratoř metodu IFE sama neprovádí, nebo neprovádí-li ji v plném rozsahu s antiséry IgG, IgA, IgM, IgD, IgE, kappa a lambda.
Možné příčiny falešně negativního výsledku elektroforézy [6]
- Paraprotein tvoří komplexy s ostatními bílkovinami plazmy, což mění pohyblivost v elektrickém poli nebo maskuje přítomnost PP.
- Elektroforetický obraz může být modifikován přítomností monomerů, dimerů nebo polymerů IgM, polymerů IgA nebo agregátů IgG.
- Bílkoviny mohou simulovat přítomnost M proteinu, jako tzv. pseudoparaproteiny (fibrinogen, CRP, lyzozym, komplex hemoglobinu s haptoglobinem, migrační artefakty apod.), proto spolehlivý průkaz monoklonálních Ig v séru anebo v moči poskytuje až imunofixace.
- Elektroforetická analýza paraproteinů v jiných tělesných tekutinách než v séru obvykle vyžaduje úpravu analyzovaného materiálu. Nejčastěji se jedná o analýzu bílkovin moči. Moč se pro elektroforetickou analýzu sbírá 24 hod, vhodná je její konzervace azidem sodným (2 mg/L) proti růstu bakterií, nebo může být použit k analýze druhý ranní vzorek moči. Stanoví se koncentrace bílkoviny a kreatininu, podle potřeby se provede zahuštění, případně naředění moči.
Kvantitativní hodnocení frakcí elektroforézy proteinů v séru (SPE)
- Kvantitativní hodnocení frakcí SPE se vyjadřuje jako podíl frakce z celku a při znalosti koncentrace celkové bílkoviny v séru stanovené rutinní biochemickou metodou se přepočítává na hmotnostní zastoupení této frakce v g/L.
- SPE a CZE mohou dávat v důsledku odlišného detekčního systému rozdílné výsledky při vysokých koncentracích imunoglobulinů. Obecně je detekční systém CZE považován za citlivější a nezávislý na interakcích protein - gel – barvivo.
- Při hodnocení SPE je potřebné kvantitativně vyhodnotit:
- Koncentraci celkového proteinu (rutinní analytickou metodou v g/L).
- Hodnotu albuminu z elektroforetického záznamu:
- jako podíl z jedné, případně jako procentuální zastoupení z celku všech rozdělených frakcí,
- jako hmotnostní koncentraci albuminu v g/L(podíl frakce albuminu z celku se násobí naměřenou koncentrací celkové bílkoviny.
- Hodnotu frakce gama-globulinů (zastoupení z celku, nebo hmotnostní zastoupení frakce gama-globulinů; hodnotí se stejně jako albumin jako podíl z celku, nebo hmotnostně přenásobením podílu z jedné hodnotou naměřené koncentrace celkové bílkoviny v g/L).
- V případě nálezu pozitivity paraproteinu(ů) se hodnotí hmotnostní zastoupení PP opět přepočtem zastoupení PP z celkové bílkoviny v g/L.
Kvantitativní hodnocení paraproteinu odečtem ze SPE
- Paraproteiny v oblasti gama se kvantifikují z profilu frakcí sérových proteinů, kvantitativně se hodnoty uvádí v g/L a zaokrouhlují se na jedno desetinné místo.
- Paraproteiny viditelné na SPE nebo CZE o kvantitě do 1 g/L nemohou být spolehlivě kvantifikovány, pokud jsou obklopeny polyklonálním gamaglobulinovým pozadím, a měly by být proto vykazovány jako „<1 g/L“ nebo „stopa“ s event. komentářem, že „malý pás nemůže být spolehlivě kvantifikován.
- Kromě stanovení celkového proteinu v moči se doporučuje, aby laboratoř poskytovala také informaci, zda se jedná o glomerulární a/nebo tubulární proteinurii, a poznámku, zda je BJP detekován či nikoliv.
- Koncentraci BJP je vhodné vyjadřovat ve vztahu ke koncentraci kreatininu v moči - BJP / kreatinin v mg/mmol (= g/mol).
- Předpokladem pro uvedený postup je současné stanovení hodnoty kreatininu v moči, hodnota koncentrace PP v moči v mg/L je vydělena hodnotou koncentrace kreatininu v moči v mmol/L.
- Pro porovnatelnost výsledků v databázi centrálního registru pacientů s MM je požadováno vydávání výsledků koncentrace PP v moči v jednotkách mg/24 hod. Podmínkou pro uvedené zadání je správný sběr moči v období 24 hod. podle instrukcí laboratoře. V moči je stanovena koncentrace celkové bílkoviny rutinně používanou fotometrickou metodou. Postupem UPE a IFE je typizován PP a kvantifikován jako podíl koncentrace celkové bílkoviny ve vzorku moči sbírané 24 hodin.
- Kvantifikace paraproteinů pomocí SPE a imunochemických metod neposkytuje vždy srovnatelný výsledek. Metody imunonefelometrie (INA)/imunoturbidimetrie (ITA) měří jak monoklonální, tak polyklonální imunoglobuliny, zatímco hodnocení PP z elektroforeogramu je pro paraprotein specifičtější. Kvantifikace imunoglobulinů pomocí INA/ ITA může poskytnout výsledky odlišné od SPE, což může být způsobeno vlastnostmi monoklonálních proteinů nebo přítomností jiných polyklonálních imunoglobulinů stejné třídy jako paraprotein.
- INA nadhodnocuje IgM při vyšších koncentracích, pravděpodobně díky pentamerní struktuře IgM, IgG a IgA mohou být také metodami INA a ITA nadhodnocovány.
- Nejvýraznější důsledky nelinearity se vyskytují při velmi vysokých koncentracích paraproteinu, kde sérové ředění vzorků může mít za následek vyšší hladiny než koncentrace globulinu.
Typizace paraproteinů
- IFE nebo imunosubtrakce jsou nezbytnými postupy pro typizaci všech nových pásů v profilu sérových proteinů a pro potvrzení jejich monoklonality.
- Vyšetření IFE je nutné k potvrzení absence dříve prokázaného paraproteinu - „kompletní remise“.
- Vyšetření IFE není nezbytné při každém následujícím odběru, pokud není viditelný nový pás v SPE nebo pokud není výslovně požadováno IFE.
- U malých paraproteinů v non-gama oblasti nebo v polyklonálním pozadí je třeba provádět průkaz přítomnosti paraproteinu metodou IFE při každém odběru.
- Pokud je paraprotein detekován v séru pouze imunofixací, je třeba to uvést v komentáři.
- Pokud je paraprotein detekován v moči pouze imunofixací, je třeba uvést hodnocení kvalitativní pozitivity, případně komentář, že je viditelný pouze imunofixací.
- Problematické vzorky vyžadující upřesnění identifikace malých proteinových pásů v UPE je třeba předat do referenční laboratoře pro IEF, pokud laboratoř tuto metodu neprovádí.
- V případě polymerizace některých monoklonálních proteinů je výsledkem „monoklonální“ frakce ve všech drahách imunofixační analýzy. V tomto případě je třeba opakovat analýzu po inkubaci vzorku s 2-merkaptoetanolem, případně s jiným redukčním činidlem (např. dithiotreitolem). Postup s přídavkem roztoku fluidilu není v těchto případech 100% úspěšný [11].
- Inkubace s ME, případně fluidilem se používá také k ředění viskózních vzorků nebo vzorků, které vykazují kryogenní vlastnosti.
Kryoproteiny
Kryoproteiny jsou sérové proteiny, které precipitují při teplotách nižších než 37 °C a při zahřátí se opět rozpouštějí. Kryoprecipitace je jev velmi variabilní. Kryo-precipitační vlastnosti mohou mít monoklonální imunoglobuliny, polyklonální imunoglobuliny nebo může jít o smíšenou kryoglobulinemii (mixed cryoglobulinemia) obou těchto složek. Rozeznávají se dva typy kryoproteinů, a to kryoglobuliny a kryofibrinogeny. Kryoglobuliny jsou imunoglobuliny, které precipitují v séru i v plazmě. Kryofibrinogeny precipitují jenom v plazmě a jsou tvořeny komplexy fibrinogen-fibrin. Kryoglobuliny se dělí podle komponent tvořících kryoprecipitát na tři typy:
- Kryoglobuliny typu I jsou tvořeny monoklonálním imunoglobulinem (paraproteinem), precipitují obvykle již do 24 hodin v ledničce při 2-8 °C, bývají provázeny hyperviskozitou a jejich koncentrace bývá vyšší než 5 g/L.
- Kryoglobuliny typu II jsou tvořeny monoklonální komponentou, obvykle paraproteinem IgM s protilátkovou aktivitou proti polyklonálním imunoglobulinům, obvykle proti IgG. Precipitují většinou do 24 hodin při 2-8 °C a jejich koncentrace bývá nižší než u typu I (≥ 1g/L).
- Kryoglobuliny typu III jsou tvořeny polyklonálními imunoglobuliny, k jejich precipitaci je zapotřebí několika dnů při 2-8 °C a jejich koncentrace bývá nízká (≤ 1g/L).
Je-li v séru prokázán kryoglobulin, měl by být vzorek séra určený pro elektroforézu a imunofixaci předehříván na 37 °C. Toto opatření nevyžaduje CZE, která probíhá při 35 °C. Vzorek séra s kryoglobulinem je vhodné pro tyto analýzy ošetřit inkubací s 2-merkaptoetanolem. V řadě postupů je v současnosti k inkubaci doporučován uživatelsky příjemnější roztok fluidilu, nicméně při inkubaci vzorků s kryogenními vlastnostmi není tento postup 100% úspěšný [11]. Kryoglobulin může být falešně pozitivní u nemocných s antikoagulační terapií, ale jeho koncentrace je nízká (kolem 1–2 g/L). U monoklonálních kryoglobulinů bývá prakticky vždy vyšší než 5 g/L [10].
Hyperviskózní séra
U pacientů s monoklonálními gamapatiemi je stanovení viskozity séra indikováno při vysoké koncentraci paraproteinu, a to u IgM nad 40 g/L a u IgG nad 60 g/L. Toto stanovení je nutné také u pacientů s klinickými příznaky hyperviskózního syndromu (oronazální krvácení, nevysvětlitelné městnavé srdeční selhávání, poruchy vizu a další neurologická symptomatologie). Hyperviskozita je nejčastěji pozorována u Waldenströmovy makroglobulinemie ve spojení s vysokou koncentrací monoklonálního IgM (až v 33 % pozorování). V mnohem menší frekvenci je hyperviskozita spojena s vysokou koncentrací monoklonálních IgG a IgA. Poměr mezi hodnotami sérové viskozity a koncentrací paraproteinu IgM je nelineární a závisí na molekulárních charakteristikách a na stupni agregace paraproteinu [6].
Volné lehké řetězce
Denní produkce volných polyklonálních lehkých řetězců imunoglobulinů u zdravých jedinců je asi 500 mg. Tyto lehké řetězce jsou vylučovány glomeruly a prakticky kompletně absorbovány v proximálních tubulech, takže denně je vylučováno močí asi 1–10 mg volných lehkých řetězců. Zvýšené hodnoty polyklonálních volných lehkých řetězců mohou být spojeny s autoimunitními onemocněními. Zvýšené hodnoty monoklonálních volných lehkých řetězců a jejich indexu κ/λ (kappa/lambda) jsou spojovány s maligní proliferací plazmatických buněk, AL amyloidózou a nemocí z lehkých řetězců.
U nemocných s MM s paraproteinem tvořeným volnými lehkými monoklonálními řetězci, u AL amyloidózy a zejména u pacientů s obtížně diagnostikovatelným nesekretorickým myelomem se jeví sledování FLC v séru výhodné. Ve většině tuzemských laboratoří používaná metoda používá protilátku zaměřenou na vnitřní epitop lehkého řetězce, a tak odliší volné lehké řetězce od vázaných.
Molekuly volných lehkých řetězců jsou obvykle monomery a dimery, často se však mohou vyskytovat také polymerní formy. Tyto pak při imunoprecipitačních testech způsobují urychlení tvorby agregátů vedoucí k nadhodnocení koncentrací antigenu. Naopak elektroforetické analýzy mohou podceňovat koncentrace polymerizovaných monoklonálních volných lehkých řetězců, důsledkem toho může polymerací dojít k rozostření monoklonálních linií na gelech. Kombinace těchto faktorů způsobuje, že u některých pacientů dochází k nesouladu mezi průkazem na ELFO a kvantitativním měřením.
- Měření volných lehkých řetězců imunoglobulinů (FLC) v séru se v diagnostice a léčbě pacientů s MM stalo praktickou možností dostupného, mezilaboratorně porovnatelného stanovení, u něhož hodnota FLC představuje některé výhody oproti tradičnímu elektroforetickému hodnocení, kde se nepříznivě odráží nižší citlivost a subjektivní hodnocení přítomnosti volných lehkých řetězců. Testy FLC jsou citlivé k identifikaci abnormální produkce FLC a jsou tedy velmi důležitým indikátorem závažného renálního postižení.
- Přestože FLC je citlivější metodou pro diagnostiku onemocnění ve srovnání s UPEP [12], pro screening je i nadále metodou dostupné volby UPEP [5].
- Monitorování a hodnocení pacientů měřením FLC v séru by měly zajišťovat minimálně laboratoře při hematoonkologických centrech.
β2-mikroglobulin
Stanovení koncentrace β2-mikroglobulinu (B2M) je důležitým prognostickým faktorem u pacientů s MM. Koncentrace B2M v séru i v moči je závislá na funkci ledvin. Protože snížená glomerulární filtrace zvyšuje hodnoty B2M v séru a poškození tubulů naopak snižuje jeho hodnoty v séru, musí být hodnoty B2M posuzovány ve vztahu k funkci ledvin. Hodnoty B2M spolu s koncentrací albuminu v séru jsou využívány v mezinárodním stážovacím systému (ISS) doporučeném International Myeloma Working Group [5,7].
Seznam zkratek
BJP Bence-Jonesova bílkovina (Bence Jonesův protein)
B2M β2-mikroglobulin
CZE kapilární zónová elektroforéza
CMG Česká myelomová skupina
FLC volné lehké řetězce
FISH fluorescenční in situ hybridizace
IFE imunofixační elektroforéza
INA imunonefelometrická analýza
ITA imunoturbidimetrická analýza
ISS mezinárodní prognostický index
LDH laktátdehydrogenáza
mAb monoklonální protilátka
MM mnohočetný myelom
MIG monoklonální imunoglobulin
PP paraprotein
SPE elektroforéza proteinů v séru
UPE elektroforéza proteinů v moči
Výborem České společnosti klinické biochemie ČLS JEP schváleno 23. 10. 2019.
Autoři děkují za spolupráci a cenné připomínky kolegům: MUDr. Zdeňce Čermákové, Ph.D., Mgr. Janě Gottwaldové, MUDr. Tomáši Fraňkovi, Ph.D., RNDr. Pavlu Lochmanovi, Ph.D., MUDr. Martině Slavětínské a MUDr. Janu Lackovi.
Přílohy:
Tab. 1. Iniciální vyšetření u pacienta s mnohočetným myelomem 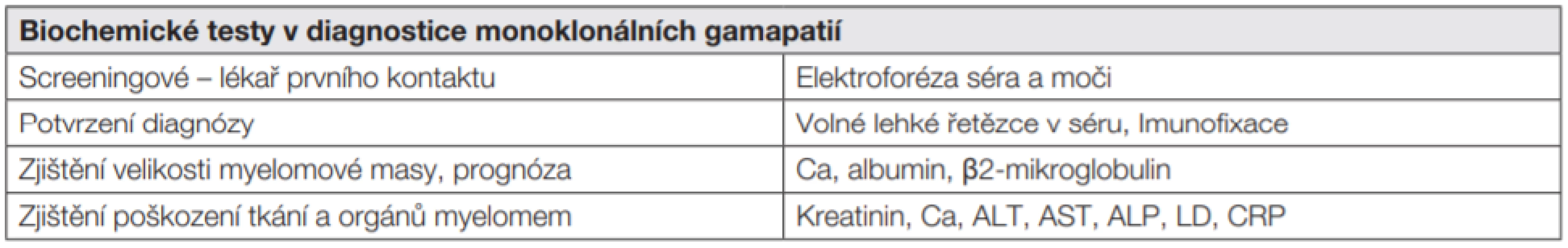
Tab. 2. Srovnání kritérií MGUS, asymptomatického a symptomatického mnohočetného myelomu [5]. ![Srovnání kritérií MGUS, asymptomatického a symptomatického mnohočetného myelomu [5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/f0e2882b081536259ff45d742c0e8ae9.png)
Tab. 3. Mezinárodní prognostický index (ISS a R-ISS) pro mnohočetný myelom [5, 7] ![Mezinárodní prognostický index (ISS a R-ISS) pro mnohočetný myelom [5, 7]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/94cf412d4682aa8eda5ffce67cb04435.png)
Tab. 4. Klasifikace monoklonálních gamapatií neurčeného významu [5]. ![Klasifikace monoklonálních gamapatií neurčeného významu [5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b615078a7861000c8689de356dd40caa.png)
Tab. 5. Kritéria hodnocení klinické odpovědi pro mnohočetný myelom (MM) v kontextu s obvyklým laboratorním algoritmem průkazu a kvantifikace paraproteinu. 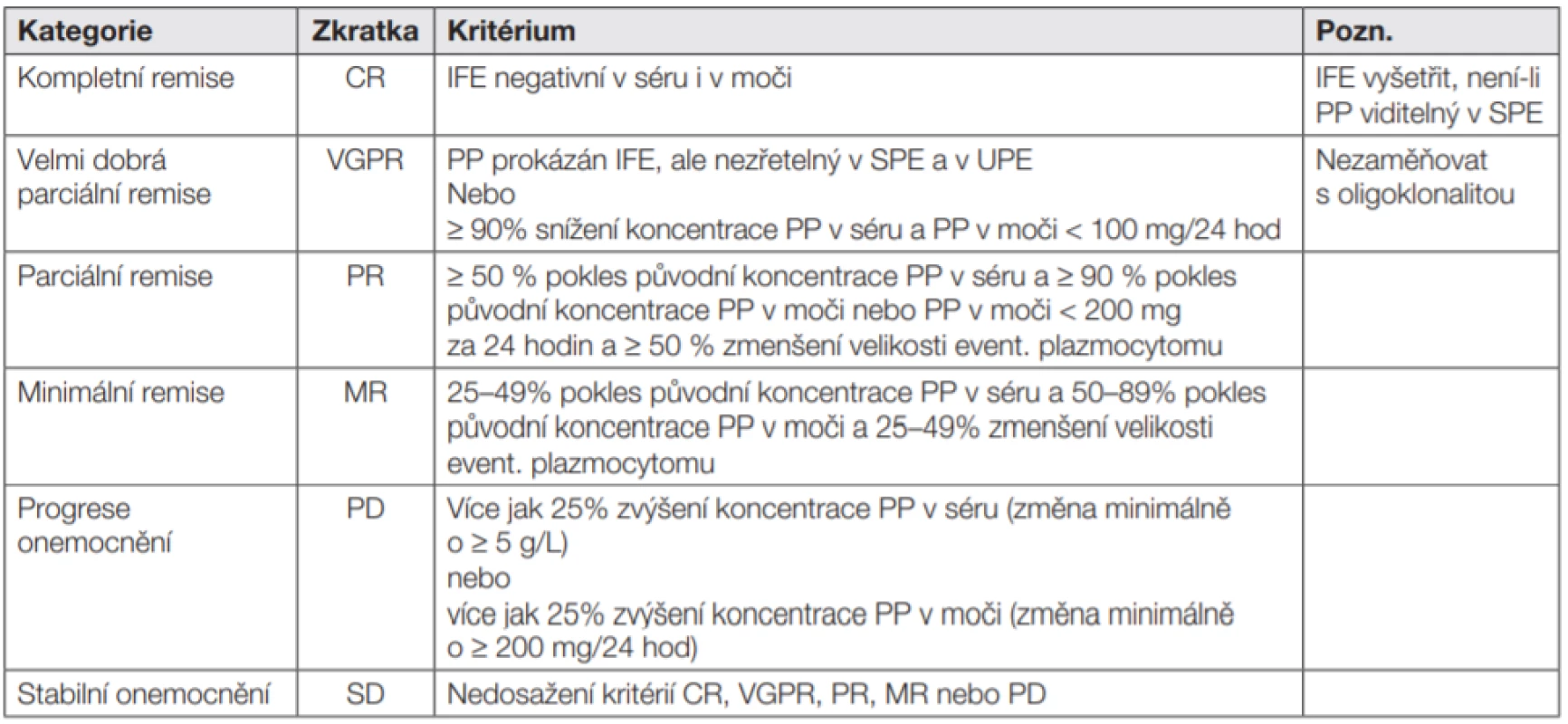
SPE, elektroforéza sérového proteinu; UPE, elektroforéza proteinů v moči; IFE, imunofixační elektroforéza; FLC, volné lehké řetězce; PP, paraprotein Tab. 6. Obecná interpretační doporučení: všechny vzorky 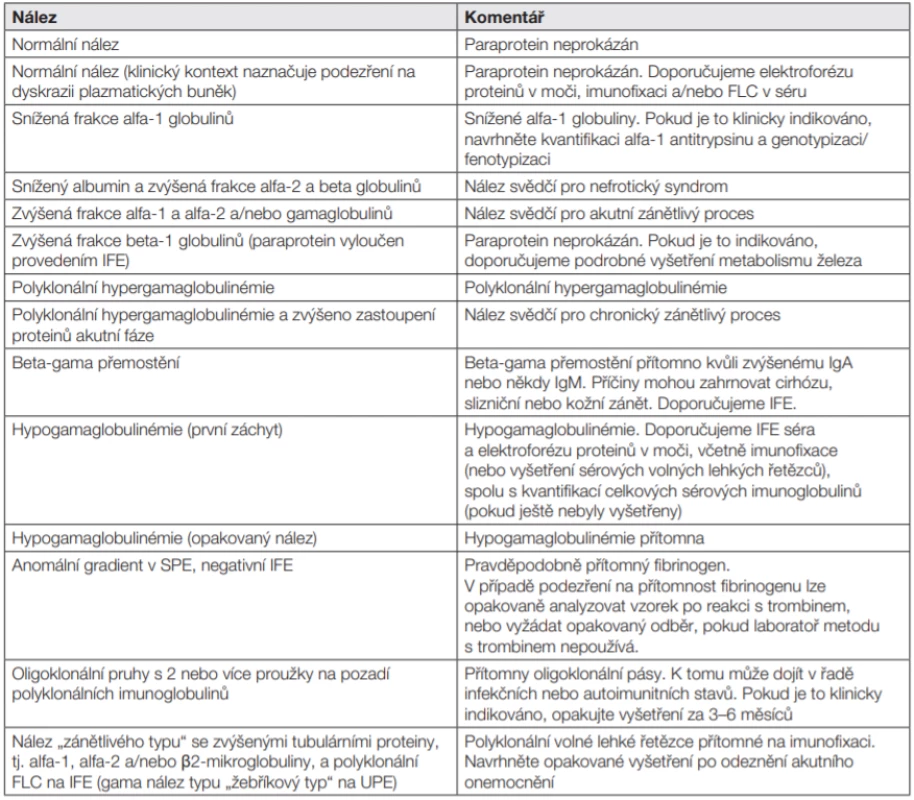
Nejčastěji užívaná synonyma pro kvalitativní popis přítomnosti monoklonální komponenty: monoklonální imunoglobulin (MIG), paraprotein (PP). Tab. 7. Standardizovaný text závěru IFE vyšetření 
Nejčastěji užívaná synonyma pro kvalitativní popis přítomnosti monoklonální komponenty: monoklonální imunoglobulin (MIG), paraprotein (PP) Tab. 8. Postup laboratoře a komentáře k laboratornímu nálezu 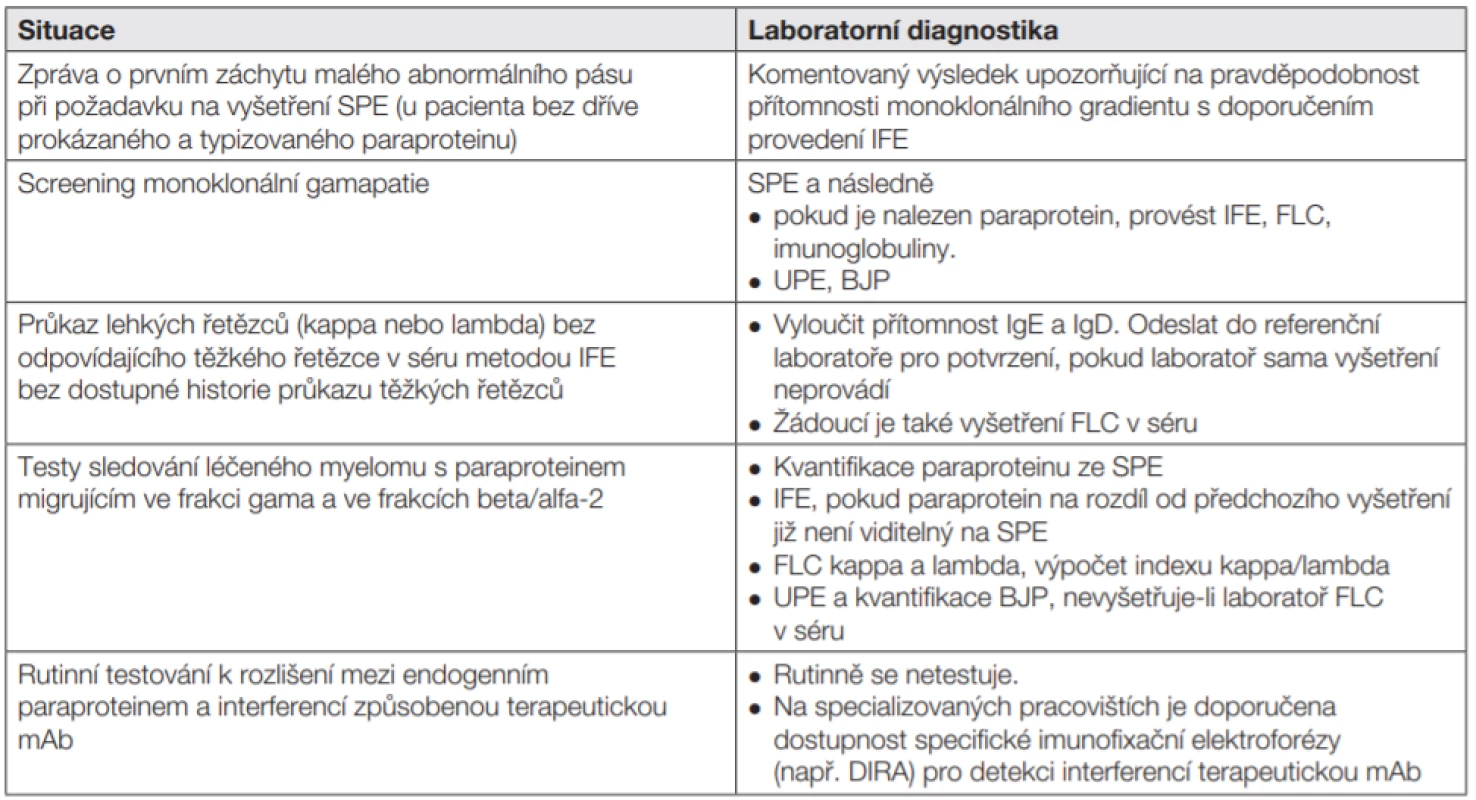
Tab. 9. Obecné interpretační komentáře: vzorky s paraproteinem a/nebo malým abnormálním pásmem 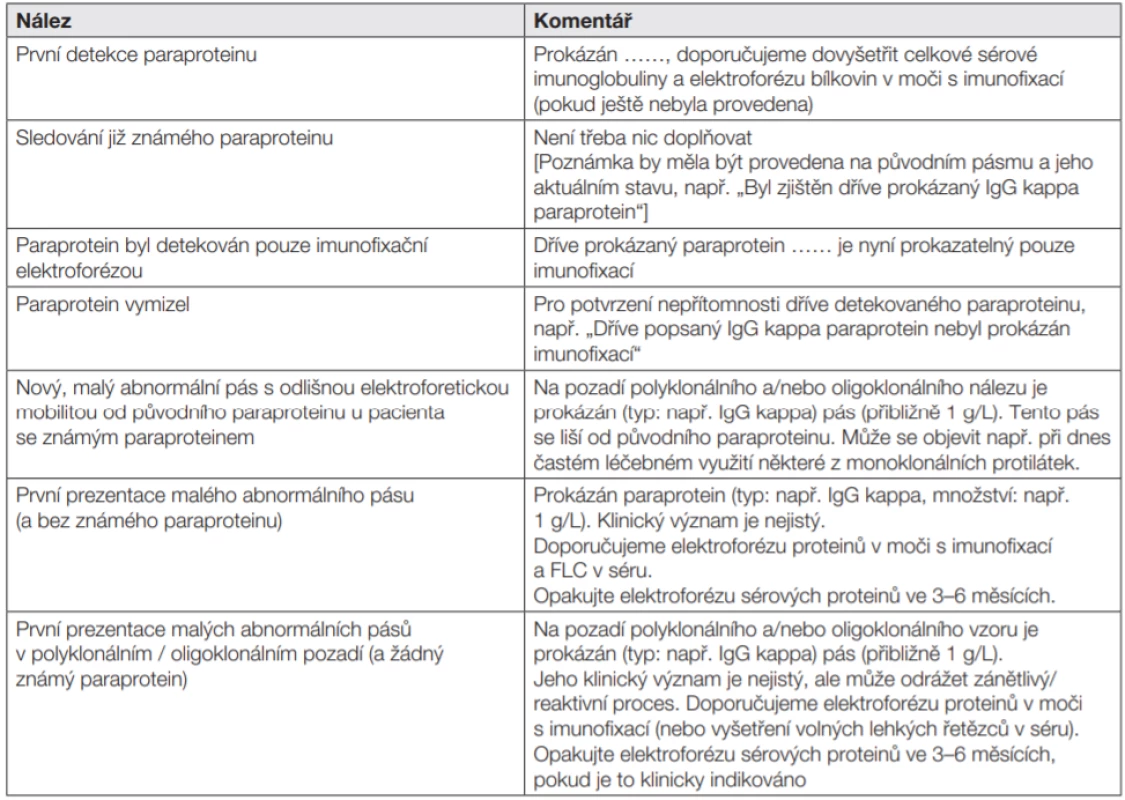
Nejčastěji užívaná synonyma pro kvalitativní popis přítomnosti monoklonální komponenty: monoklonální imunoglobulin (MIG), paraprotein (PP). Tab. 10. Certifikace cyklu GP v systému SEKK EHK 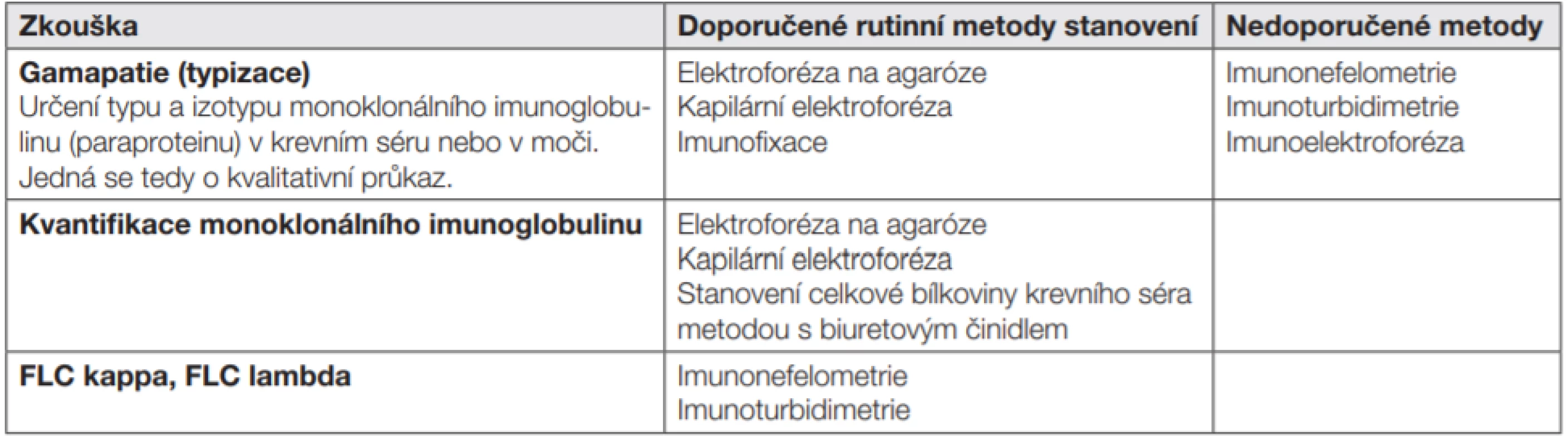
Hodnotí se konsenzem účastníků. Zprávy pro účastníky: osvědčení o účasti, certifikát, výsledkový list (kvalitativní výsledky), výsledkový list (kvantitativní výsledky), histogramy (ev. komplexní statistika). Hodnotí se konsenzem účastníků. Zprávy pro účastníky: osvědčení o účasti, certifikát, výsledkový list (kvalitativní výsledky), výsledkový list (kvantitativní výsledky), histogramy (ev. komplexní statistika).
Zdroje
1. Tate, J. R. et al. Recommendations for standardized reporting of protein electrophoresis in Australia and New Zealand. Ann. Clin. Biochem., 2012, 49, p. 242–256.
2. Tate, J. R., Smith, J. D., Wijeratne, N., Moleel, P. Peropose addendum to 2012 recommendations for standardized reporting of protein electrophoresis in Australia and New Zeeland. Clin. Biochem. Rew., 2019, 40, p. 23-30.
3. Genzen, J. R. et al. Screening and Diagnosis of Monoclonal Gammopathies. An International Survey of Laboratory Practice. Arch. Pathol. Lab. Med., 2018, 142, p. 507-515.
4. Wijeratne, N., Tate, J. R., Wienholt, L., Mollee, P. Report of the Survey Conducted by RCPAQAP on Current Practice for Paraprotein and Serum Free Light Chain Measurement and Reporting: a Need for Harmonisation. Clin. Biochem. Rev., 40(1) 2019, p. 31-42.
5. Hájek, R. (ed.) et al.: Doporučení vypracované Českou myelomovou skupinou, Myelomovou sekcí České hematologické společnosti a Slovenskou Myelómovou Spoločností pro diagnostiku a léčbu mnohočetného myelomu. Transfuze Hematol dnes 2018, 24, suplement 1, p. 2-157.
6. Tichý, M., Maisnar, V.: Laboratorní průkaz monoklonálních imunoglobulinů. Vnitř. Lék. 2006, 52, S2, p. 41-45.
7. Tichý, M., Friedecký, B., Vávrová, J. et al. Standardizace biochemických laboratorních vyšetření u mnohočetného myelomu. Klin. Biochem. Metab., 2006, 14 (35), p. 8–13.
8. Bachmann, L. M. et al. State of Harmonization of 24 Serum Albumin Measurement Procedures and Implications for Medical Decisions. Clin. Chem., 2017, 63, 3, p. 770–779.
9. Friedecký, B., Kratochvíla, J. Stanovení albuminu v séru a plasmě. Harmonizace vysledků měření a kli-nická doporučení u pacientů s renálními chorobami. Klin. Biochem. Metab., 25 (46), 2017, No. 3, p. 108–111.
10. Tichý, M., Maisnar, V., Hrnčíř, Z. et al. Kryoglobuliny v souboru 3 392 monoklonálních imunoglobulinů. Klin. Biochem. Metab., 17 (38), 2009, No. 2, p. 77–78.
11. Čermáková, Z., Gottwaldová, J. Kryoglobulinémie a její rizika při laboratorním vyšetřování – kazuistika. Klin. Biochem. Metab., 17 (38), 2009, No. 2, p. 79–80.
12. Dejoie, T., Corre, J., Caillon, M. et al. Serum free light chains, not urine specimens should be used to evaluate response in light-chain multiple myeloma. Blood 2016,128, p. 2941-2948.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek RNDr. Ivan BilykČlánek Doporučení ČSKB
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2020 Číslo 1- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Efektivita léčby a možné indikace liraglutidu v gynekologii
-
Všechny články tohoto čísla
- Progresivní familiární intrahepatální cholestáza v dospělosti: 60leté sledování
- Nefrokalcinóza po transplantaci ledviny jako vzácný projev karcinomu příštítných tělísek
- RNDr. Ivan Bilyk
- Zpráva o biotinu a jeho interferencích u imunoanalytických metod
- Doporučení České společnosti klinické biochemie k jednotkám výsledků měření
- Doporučení České společnosti klinické biochemie a České myelomové skupiny k laboratorní diagnostice monoklonálních gamapatií
- Doporučení ČSKB
- Doporučení: Systém externího hodnocení kvality (EHK)
- Nový koronavirus 2019. Pár základních informací a jejich dostupnost.
- Patobiochemie inhibinu A a jeho využití ve screeningu vrozených vývojových vad.
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení: Systém externího hodnocení kvality (EHK)
- Doporučení ČSKB
- Doporučení České společnosti klinické biochemie k jednotkám výsledků měření
- Patobiochemie inhibinu A a jeho využití ve screeningu vrozených vývojových vad.
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



