-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Laboratorní diagnostika pacientů s MGUS a výsledky jejich sledování v regionální biochemické laboratoři v průběhu 10 let
Laboratory diagnostics of patients with MGUS and results of their monitoring in a regional biochemical laboratory within 10 years
ted B-cells producing the monoclonal immunoglobulin (MIG). Monoclonal immunoglobulin (M - protein, M – component, paraprotein) consists of both an intact immunoglobulin molecule or also only of the structural component, i.e. light chain kappa or lambda, rarely heavy chain. The basic investigative methods of detection of the monoclonal immunoglobulin belong electrophoresis of serum protein and immunofixation electrophoresis including the determination of free light chains. Our report refers to the actual observation of MGUS (monoclonal gammopathies of uncertain significance) laboratory diagnosed in our regional laboratory and their development over 10 years.
Keywords:
free light chains – monoclonal gammopathy – monoclonal immunoglobulin – immunofixation electrophoresis – mo-noclonal gammopathy of undetermined significance (MGUS).
Autoři: L. Šolcová 1,3; J. Šimková 1; V. Maisnar 2
Působiště autorů: Oddělení klinické biochemie, ON Trutnov a. s. 1; IV. interní hematologická klinika, FN a LF UK Hradec Králové 2; Ústav klinické biochemie a diagnostiky, Fakultní nemocnice Hradec Králové 3
Vyšlo v časopise: Klin. Biochem. Metab., 27, 2019, No. 3, p. 112-115
Souhrn
Monoklonální gamapatie jsou heterogenní skupinou onemocnění, pro kterou je typická proliferace nejčastěji jednoho klonu diferencovaných B-lymfocytů produkujících tzv. monoklonální imunoglobulin (MIG). Monoklonální imunoglobulin (synonyma M – protein, M – komponenta, paraprotein) se může skládat jak z intaktní imunoglobulinové molekuly nebo také jen z jejích strukturálních komponent, tj. lehkých řetězců kappa či lambda, vzácněji z těžkých řetězců. Mezi základní vyšetřovací metody detekce monoklonálního imunoglobulinu řadíme elektroforézu proteinů séra a imunofixační elektroforézu včetně stanovení volných lehkých řetězců. Naše sdělení informuje o vlastním pozorování MGUS (monoklonálních gamapatií nejasného významu) laboratorně diagnostikovaných v naší regionální laboratoři a jejich vývoji v průběhu 10 let.
Klíčová slova:
monoklonální gamapatie – monoklonální imunoglobulin – imunofixační elektroforéza – volné lehké řetězce – monoklonální gamapatie nejasného významu (MGUS).
Úvod
Monoklonální gamapatie nejasného významu (MGUS) je definována jako klinicky němý bezpříznakový stav, při kterém nejsou splněna diagnostická kritéria mnohočetného myelomu, M. Waldenström, AL-amyloidózy nebo jiného zhoubného lymfoproliferativního onemocnění. Poprvé byla popsána v roce 1978 prof. Kylem a Greippem [1, 2]. Monoklonální gamapatie nejasného významu je nejčastější monoklonální gamapatií. Její prevalence v celé populaci dospělých osob se pohybuje kolem 1 % pozorování za rok [3, 4, 5]. Incidence MGUS je oproti nejčastější maligní monoklonální gamapatii, kterou je mnohočetný myelom, přibližně 100x vyšší [6]. V mladších věkových skupinách (pod 50 let) je poměrně vzácná (zde dokonce méně než 1 %). Frekvence výskytu dále stoupá s věkem a u lidí nad 50 let je přítomna zhruba u 3 % populace, v případě mužů nad 80 let je pak prevalence více než 8 % [4, 6]. Muži jsou postiženi o něco málo častěji než ženy. Přibližně 70 % MGUS je typu IgG, následuje typ IgM (cca 15-20 %), nejméně často se vyskytuje typ IgA (cca 11 %) [2]. Typově převažují lehké řetězce kappa (62 %) nad lambda (38 %) [3]. V současné době je na MGUS nahlíženo jako na prekancerózu [1, 4, 7, 2]. Riziko progrese MGUS do malignity dle rizikových skupin je shrnuto v Tabulce 1.
Tab. 1. Risk of MGUS progression to malignancy (Kyle 2008) 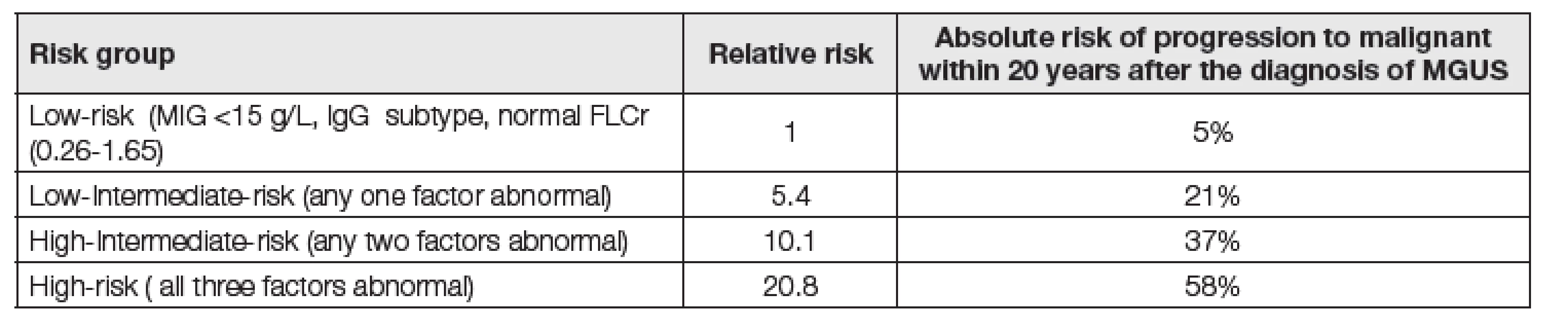
Tab. 2. Number of patients with malignant monoclonal gammopathy - dependence of progression from MGUS in malignant monoclonal gammopathy in defined time period (N = 91, 16.4% of 555 patients) 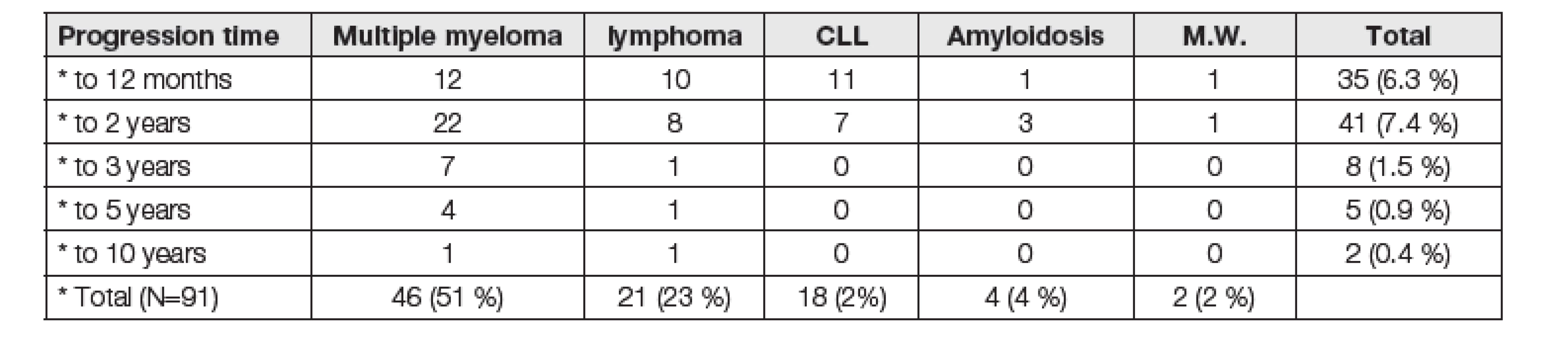
Předmětem našeho sdělení je analýza souboru pacientů s nově diagnostikovanými monoklonálními gamapatiemi nejasného významu v naší regionální laboratoři v časovém období od 1. 8. 2008 do 1. 8. 2018, a to včetně sledování jejich dalšího vývoje v čase.
Metody stanovení
V naší regionální biochemické laboratoři používáme k diagnostice monoklonálních gamapatií metody, které jsou k tomuto účelu doporučované a nezbytné. Základem laboratorní diagnostiky MGUS je nadále průkaz přítomnosti monoklonálního imunoglobulinu elektroforézou bílkovin s následnou imunofixací [3, 8].
Imunofixace je zcela nezbytná pro určení typu MIG a detekuje v séru koncentrace M-Ig již od 0,2 g/L a v moči kolem 0,04 g/L. Pokud je imunofixace negativní s antiséry proti imunoglobulinům G, A a M a současně jsou přítomny monoklonální lehké řetězce kappa nebo lambda, je velmi důležité následné provedení imunofixace i s antiséry proti IgD a IgE [3, 8]. Součástí laboratorní diagnostiky monoklonálních gamapatií v naší regionální laboratoři je též stanovení volných lehkých řetězců (FLC) nefelometricky. Jejich stanovení včetně určení vzájemného poměru (FLCr) provádíme rutinně od roku 2009 [4, 9]. U každého nového případu MGUS a obecně u všech monoklonálních gamapatií kvantitativně stanovujeme také imunoglobuliny (IgG, IgA, IgM). Nezbytnou součástí panelu biochemických vyšetření u všech monoklonálních gamapatií je také stanovení sérové koncentrace beta-2-mikroglobulinu, albuminu, celkové bílkoviny, kyseliny močové, kalcémie, renálních funkcí a případně dalších biochemických parametrů [3, 6, 8].
Výsledky
U každého pacienta s nově diagnostikovanou MGUS byla vždy provedena typizace MIG, stanoveny sérové koncentrace MIG, celkové bílkoviny, albuminu, beta-2-mikroglobulinu, kreatininu, případně dalších parametrů jako kyseliny močové, vápníku, event. LDH. U 282 pacientů z celkového počtu 555 pacientů s MG byla zároveň stanovena hladina FLC lambda i kappa včetně určení FLCr (FLC index), které byly pravidelně monitorovány i v rámci dalších laboratorních kontrol.
V období od 1. 8. 2008 do 1. 8. 2018 se nám podařilo přítomnost monoklonálního imunoglobulinu nově identifikovat u celkem 555 pacientů. Nejčastěji pozorovaným typem monoklonálního imunoglobulinu byl typ IgG kappa. Průměrný věk nově diagnostikovaných pacientů s monoklonálními gamapatiemi byl 63 let, při věkovém rozmezí od 12 do 94 let. Nejpočetnější byla skupina nemocných s kvantitou M-Ig do 5 g/l (252; 45,4 %). U 16,4 % (91/555) sledovaných osob s MGUS došlo v průběhu sledování k transformaci do maligního onemocnění. Celkové riziko progrese v námi sledovaném souboru bylo 1,6 % za rok. Při 1-, 2-, 3-, 5 - a 10letém sledování od stanovení diagnózy MGUS bez ohledu na rizikové faktory bylo riziko progrese 6,3 %, 7,4 %, 1,5 %, 0,9 % a 0,4 %. V Tabulce 3 jsou přehledně uvedeni nemocní, u nichž došlo k vývoji MGUS do maligní monoklonální gamapatie v rámci pěti časově definovaných úseků. Ve většině případů došlo k progresi do 24 měsíců od stanovení diagnózy MGUS (76/91; 83,5 %).
Tab. 3. Distribution of individuals with MGUS according to Rajkumar stratification system and number of transforming individuals over 10 years 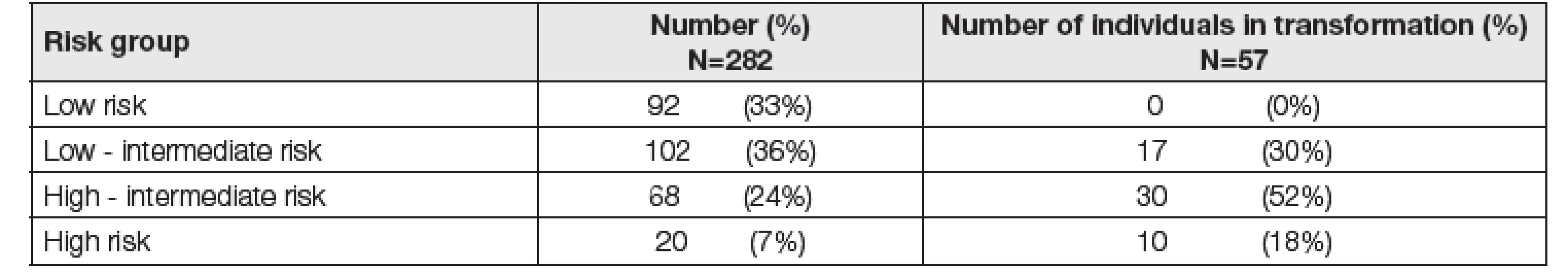
Nejčastěji došlo k progresi do mnohočetného myelomu, a to celkově v 46 (8,3 %) případech z celkového počtu 555 pacientů, ve 21 (3,8 %) případech se jednalo o lymfom, u 18 nemocných (3,2 %) byla nově diagnostikována chronická lymfatická leukémie. Dále byl ve čtyřech případech (0,7 %) zaznamenán výskyt amyloidózy a u dvou (0,4 %) pacientů došlo k progresi do obrazu Waldenströmovy makroglobulinémie.
V následném kroku jsme u nemocných, u nichž byly k dispozici výsledky stanovení sérových hladin FLC kappa i lambda včetně jejich poměru, provedli ověření stratifikačního systému dle Rajkumara (viz Tabulka 2). Do tohoto hodnocení bylo zahrnuto celkem 282 pacientů. Transformace do obrazu maligní monoklonální gamapatie ve skupině nízkého rizika nebyla zaznamenána. Ve skupině nízké-střední riziko byl prokázán přechod do maligní MG u 30 % jedinců, ve skupině vysoké-střední riziko se jednalo již o 52 % jedinců z celkového počtu 282 pacientů. V kategorii vysokého rizika došlo k transformaci MGUS do maligní monoklonální gamapatie u 10 % nemocných. Nejčastěji byl u nemocných, u nichž došlo k transformaci do obrazu maligní MG, diagnostikován mnohočetný myelom, a to u 28 pa-cientů z 282, tj. u 10 % z celkového počtu pacientů, u kterých byly k dispozici výsledky stanovení FLC.
Diskuse
V rámci analýzy byla zpracována data od 555 pa-cientů s nově diagnostikovanou monoklonální gamapatií. Základními charakteristikami sledovaného souboru byly věk pacienta při stanovení diagnózy MGUS, jeho pohlaví a vstupní koncentrace MIG. Soubor byl dále rozčleněn na dvě skupiny, a to pacienty s MGUS bez progrese a s progresí v maligní monoklonální gamapatii. Progredující nemocní byli dále rozdělení dle definovaných časových úseků, kdy k transformaci došlo, a to na čas progrese do 1 roku, 2, 3, 5 a 10 let. Medián věku sledovaných osob byl 63 let, přičemž věkové rozpětí se pohybovalo od 12 do 94 let. Základní charakteristiky našeho souboru byly podobné jako v původní sestavě z Mayo Clinic (našich 66 % MIG IgG oproti 69,7 % z Mayo Clinic) [10, 11].
U 16,4 % (u 91 z 555) sledovaných osob s MGUS došlo k transformaci do maligního onemocnění. Z tohoto celkového počtu došlo v 8,3 % (46/555) k transformaci do mnohočetného myelomu. Obdobné výsledky přinesla i další analýza z našeho prostředí, a to dr. Sandecké se spoluautory, která zpracovala data 1887 pacientů z registru monoklonálních gamapatií. Ta zaznamenala ve své práci zaměřené na vytvoření prognostického panelu u nově diagnostikovaných monoklonálních gamapatií transformaci do maligního onemocnění u 8,6 % (162/1887) sledovaných osob s MGUS [12].
U většiny pozorovaných případů progrese v rámci našeho souboru nemocných došlo k progresi do maligní monoklonální gamapatie do dvou let od stanovení diagnózy MGUS. Obecně se uvádí, že riziko progrese MGUS v maligní monoklonální gamapatii stoupá s délkou sledování (vyšší incidence - 16,5 % při 10letém a 26,5 % při 15letém sledování). Průměrný počet nově diagnostikovaných MM uváděný v článcích zabývajících se obdobnou problematikou je 5,1 % [12 - 16].
Výsledky, které jsme získali, se tak shodují v četnosti typu MIG u MGUS, mediánu věku sledovaných osob i v celkovém riziku progrese. Mírně se liší v zastoupení četnosti jednotlivých maligních monoklonálních gamapatií a také v rychlosti progrese MGUS do maligní monoklonální gamapatie v definovaném časovém úseku. Tyto rozdílné výsledky jsou nejspíše ovlivněny menší velikostí našeho souboru oproti studiím prováděným Českou myelomovou skupinou, kde byl zahrnut jak vyšší počet pacientů, tak i další prognostické markery. Naše výsledky jsou rozdílné i při srovnání s výsledky z Mayo Clinic [10, 11, 14], kdy opět může jít o ovlivnění rozdílnou velikostí analyzovaného souboru. Nedostatkem našeho souboru je také fakt, že u 273 pacientů z MGUS nebyla vstupně vyšetřena koncentrace FLC, jelikož tato metoda nebyla ještě v roce 2008 rutinně zavedena jako součást vyšetřovacího panelu. Z tohoto důvodu potom soubor MGUS v stratifikačním systému dle Rajkumara zahrnuje méně pacientů než soubor celkový. I přesto však je podle nás možné považovat získané výsledky za přínosné, vypovídající o zlepšení kvality práce v rámci regionální biochemické laboratoře, která je odpovědná za první záchyt a přesnou diagnostiku přítomného MIG.
Je proto velmi důležité, aby se na správné diagnostice a interpretaci výsledků podílel nejen klinický lékař, ale i odborník z oboru klinická biochemie. Klinicko-biochemická spolupráce je důležitá jak z hlediska diagnostiky, tak i případného včasného zahájení léčby u pa-cientů. Proto i Česká společnost klinické biochemie nyní připravuje nové guidelines laboratorní diagnostiky monoklonálních gamapatií, které budou obdobou klinických guidelines České myelomové skupiny, které se již řadu let osvědčují v každodenní klinické praxi. Včasná a správná identifikace zejména vysoce rizikových pacientů s MGUS je do budoucna nezbytná [17].
Doporučení pro laboratorní diagnostiku a sledování nemocných s MGUS a pro stratifikaci rizika přechodu do mnohočetného myelomu
- Nezbytným, důležitým a stále častěji využívaným vyšetřením zůstává elektroforéza bílkovin séra i moče s imunofixací. Ta by tak měla být součástí vyšetření v ordinacích praktických lékařů i specializovaných poraden.
- Po vyloučení jiného typu monoklonální gamapatie musí být pro stanovení diagnózy MGUS splněna kritéria IMWG.
- Na základě stanovení typu monoklonálního imunoglobulinu, jeho koncentrace a poměru lehkých řetězců by mělo být určeno riziko transformace (Mayo model) a na jeho základě by měla být určena frekvence sledování.
- Frekvence sledování v prvním roce od první diagnostiky upřesňuje dynamiku MGUS např. i odhalí tranzientní paraproteinémii. Interval 1. kontroly od prvního záchytu MIG by měl být v řádu 2-4 měsíců. Kontrolní vyšetření od druhého roku sledování by pak měla být v intervalech od 2-4 měsíců do 12-18 měsíců, a to v závislosti na míře rizika transformace. Z praktického hlediska by pak zřejmě optimální dobou pro použití v rámci dalšího sledování pacientů s MGUS v rámci klinické praxe mohl být časový interval 1 roku.
- Důležité je dlouhodobé sledování pacientů s MGUS, abychom včas rozpoznali případný přechod do maligní monoklonální gamapatie. Je nutné si uvědomit, že jde o prekancerózu.
Závěr
Regionální biochemická laboratoř představuje často první záchytný bod v rámci diagnostiky monoklonálních gamapatií. Za desetileté sledované období se nám v prostředí regionální biochemické laboratoře podařilo nově detekovat monoklonální imunoglobulin u 555 pacientů. Přitom každým rokem frekvence nově stanovených monoklonálních gamapatií dále roste. Následné sledování, dispenzarizace a případná léčba těchto pacientů jsou dále vedeny ve spolupráci s hematologickým oddělením oblastní nemocnice v Trutnově a IV. interní hematologickou klinikou FN v Hradci Králové. V každém případě je třeba si uvědomit, že MGUS představuje prekancerózu, a proto je třeba ji pravidelně sledovat, abychom včas odhalili její případný přechod do maligní formy monoklonální gamapatie. Čím dříve bude pacient s maligní monoklonální gamapatií léčen, tím vyšší šanci na uzdravení má.
Autoři nejsou ve střetu zájmů
Do redakce došlo: 22. 5. 2019
Adresa pro korespondenci:
MUDr. Lucie Šolcová
Oddělení klinické biochemie
Oblastní nemocnice Trutnov a.s.
Gorkého 77
541 01 Trutnov
e-mail: lucie.solc@post.cz
Zdroje
1. Landgren O., Kyle R. A., Rajkumar S. V. From mye-loma precursor disease to multiple myeloma: new diagnostic concepts and opportunities for early intervention. Clin Cancer Res, 2011, 17(6), 2011, s. 1243-1252.
2. Landgren O. Monoclonal gammopathy of undetermined significance and smoldering multiple myeloma:biological insights and early treatment strategies. Hematology, 2013, p. 478-487.
3. Maisnar V., Tichý M. a kol. Monoklonální imunoglobuliny – výskyt, význam a možnosti jejich průkazu. 1. vydání Nucleus HK, Praha 2012, 129 s.
4. Maisnar V. Riziko přechodu monoklonální gamapatie nejasného významu do maligní monoklonální gamapatie. Klin Biochem Metab, 2013, 21(2), s. 93-96.
5. Van den Donk N. W. C. J., Mutis T., Poddighe P. J., Lokhorst H. M., Zweegman S. Diagnosis, risk stratification and management of monoclonal gammopathy of undetermined significance and smoldering multiple myeloma. Int J Lab Hematol, 2016, 38(Suppl.1), p. 110-122.
6. Kyle R. A., Rajkumar S. V. Monoclonal gammopathy of undetermined significance. Br J Haematol 2006, 134, p. 573-589.
7. Landgren O., Kyle R. A., Pfeiffer R. M., Katzmann J. A., Caporaso N. E., Hayes R. B., Dispenzieri A., Kumar S., Clark R. J., Baris D., Hoover R., Rajkumar S. V. Monoclonal gammopathy of undetermined significance (MGUS) consistently precedes multiple myeloma: a prospective study. Blood, 2009, p. 5412-17.
8. Tichý M. Laboratorní analýza monoklonálních imunoglobulinů Tichý M. Laboratorní analýza mono-klonálních imunoglobulinů (paraproteinů). 1. vydání Finidr, Český Těšín 1997, 96 s.
9. Tichý M., Vávrová J., Friedecký B., Maisnar V. Přehled metod na stanovení volných lehkých řetězců. Klin Biochem Metab, 2008, 16(37), s. 93-96.
10. Kyle R. A., Therneau T. M., Rajkumar S. V. et al. A long-term study of prognosis in monoclonal gammopathy of undetermined significance. N Eng J Med, 2002, 346(8), p.564-569.
11. Kyle R. A., Therneau T. M., Rajkumar S. V. et al. Long-term follow-up of 241 patients with monoclonal gammopathy of undetermined significance: the original Mayo Clinic series 25 years later. Mayo Clin Proc, 2004, 79(7), p.859-866.
12. Sandecká V. et al. A first Czech analysis of 1887 cases with monoclonal gammopathy of undetermined significance. Eur J Haematol. 2017; 99(1): 80-90.
13. Rajkumar S. V. Multiple myeloma:update on diagnosis, risk-stratification and management. Am J Hematol 2016; 91(7):19-34.
14. Kyle R. A., Rajkumar S. V., Therneau T. M. et al. Prognostic factors and predictors of outcome of immunoglobulin M monoclonal gammopathy of undetermined significance. Clinn Lymphoma, 2005, 5(4), p.257-260.
15. Hájek R., Maisnar V. et al. Diagnostika a léčba mnohočetného myelomu. Transfúze a hematologie dnes, 2018, Suppl, s.151-154.
16. Maisnar V. Nová diagnostická kritéria mnohočetného myelomu. Klin Biochem Metab, 2016, 24(45), s. 127-128.
17. Sandecká V., Pour L., Adam Z. et al. Monoklonální gamapatie nejasného významu. Klin Onkol, 2018, 31(4), s.270-276.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2019 Číslo 3- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Efektivita léčby a možné indikace liraglutidu v gynekologii
-
Všechny články tohoto čísla
- Deregulace vybraných mikroRNA u karcinomu sinonasálních dlaždicových buněk související s HPV
- Stanovení methylovaných derivátů glycinu u pacientů s metabolickým syndromem a prediabetem
- Laboratorní diagnostika pacientů s MGUS a výsledky jejich sledování v regionální biochemické laboratoři v průběhu 10 let
- Harmonizace v klinických laboratořích. Pojmy a problémy. Metrologická návaznost, standardizace, harmonizace
-
Klinické laboratoře na rozcestí
(23. IFCC EFLM Evropský kongres klinické chemie a laboratorní medicíny) - Sborník a Abstrakta přednášek a posterů
- XIV. celostátní sjezd České společnosti klinické biochemie
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Laboratorní diagnostika pacientů s MGUS a výsledky jejich sledování v regionální biochemické laboratoři v průběhu 10 let
- XIV. celostátní sjezd České společnosti klinické biochemie
- Harmonizace v klinických laboratořích. Pojmy a problémy. Metrologická návaznost, standardizace, harmonizace
- Deregulace vybraných mikroRNA u karcinomu sinonasálních dlaždicových buněk související s HPV
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



