Realimentační syndrom po paleodietě
Zeman M.: Refeeding syndrome after paleodiet
Objective:
To describe a case of refeeding syndrome in a patient after two months of diet with significant restriction or even absence of saccharides and to point out the threat of severe diets and return to common diet.
Design:
Case report.
Setting:
General Teaching Hospital Prague.
Material and Methods:
Description of a case including laboratory results with comments.
Results:
The work shows severe metabolic changes (hypophosphatemia, hypokalemia, elevation of transaminases and of creatine kinase) with clinical consequences after saccharide intake followed by their two-months significant restriction.
Conclusion:
Refeeding syndrome represents a potential problem not only in patients after operations, patients with tumours and in the elderly, but may threat also after enormous changes of the diet.
Keywords:
paleodiet, refeeding syndrome, hypophosphatemia, elevation of transaminases and of creatine kinase.
Autoři:
M. Kalousová 1; J. Macášek 2; M. Zeman 2
Působiště autorů:
Ústav lékařské biochemie a laboratorní diagnostiky, 1. lékařská fakulta, Univerzita Karlova a Všeobecná, fakultní nemocnice v Praze
1; IV. interní klinika – klinika gastroenterologie a hepatologie, 1. lékařská fakulta, Univerzita Karlova a Všeobecná, fakultní nemocnice v Praze
2
Vyšlo v časopise:
Klin. Biochem. Metab., 26, 2018, No. 4, p. 185-188
Souhrn
Cíl studie:
Popsat případ realimentačního syndromu u nemocné po dvouměsíční dietě se značným omezením až vynecháním sacharidů a upozornit tak na úskalí striktních diet a návratu k běžné stravě.
Typ studie:
Rozbor kazuistiky.
Název a sídlo pracoviště:
Všeobecná fakultní nemocnice Praha.
Materiál a metody:
Popis případu nemocné včetně výsledků laboratorních vyšetření a jeho rozbor.
Výsledky:
Práce ukazuje závažné metabolické změny (hypofosfatémie, hypokalémie, elevace transamináz a kreatinkinázy) s klinickými následky u nemocné po opětovném přísunu sacharidů po jejich dvouměsíční významné restrikci.
Závěr:
Realimentační syndrom představuje potenciální problém nejen u nemocných v pooperačním období, onkologických a geriatrických nemocných, ale může být hrozbou také při významných změnách diety.
Klíčová slova:
paleodieta, realimentační syndrom, hypofosfatémie, elevace transamináz a kreatinkinázy.
Úvod
Lidé se ve snaze zhubnout či si vylepšit zdraví a zlepšit kondici uchylují k nejrůznějším dietám. Jednou z oblíbených diet je v poslední době tzv. paleodieta, která představuje návrat ke stravovacím zvyklostem paleolitického člověka. Tito lidé byli lovci a sběrači, tzn. živili se masem ulovených zvířat (divoká zvířata, ptáci, ryby) a sběrem jedlých rostlin a jejich částí – semen, kořínků, plodů. Navíc měli v souvislosti s obstaráváním potravy také značnou fyzickou aktivitu. Popisuje se, že tito lidé netrpěli civilizačními chorobami jako je vysoký krevní tlak, cukrovka, obezita, srdeční onemocnění, mrtvice, psychická onemocnění či rakovina, a proto někteří lidé považují za vhodný návrat k takovémuto způsobu života. Paleodieta je tak založena na konzumaci ovoce, zeleniny, masa, ryb a ořechů. Naopak za nevhodné jsou považovány např. mléko, obilniny, rafinované oleje a jednoduché cukry [1].
V práci popisujeme případ pokusu o aplikaci paleodiety a následný návrat k běžné stravě.
Kazuistika
44letá vysokoškolsky vzdělaná žena se rozhodla vyzkoušet paleodietu a současně nevynechat obvyklou významnou fyzickou aktivitu. Zahájení diety naplánovala po běžné preventivní prohlídce, která zahrnovala komplexní interní vyšetření včetně antropometrického a laboratorního vyšetření. Nebyly zjištěny žádné zdravotní problémy. Hodnoty základních biochemických a hematologických vyšetření byly prakticky v referenčním rozmezí a dotyčná byla hodnocena jako zcela zdravá. Do zahájení diety udávala konzumaci běžné stravy a byla zvyklá na velkou fyzickou zátěž (několikakilometrové běhy včetně půlmaratónu). Vstupně vážila 63,6 kg při výšce 175 cm. Tabulka 1 uvádí příklad několika dní paleodiety, tak jak si ji pacientka sama dle různých doporučení sestavila, a doprovodnou fyzickou aktivitu. Strava obsahovala především maso, vejce, zeleninu, ořechy a různá semínka (dýně, mák), tedy velké množství bílkovin, tuků a vlákniny, ale významně redukované až zcela vynechané sacharidy. Někdy pila navíc černou kávu (1-2 šálky/den), kterou prý pít neměla. Během diety měla občas nadmuté břicho a asi po měsíci diety uváděla poprvé pocit nabytí energie. Zhruba v této době se jí zdálo, že více zadržuje vodu, nicméně asi po třech dnech začala více močit a problémy vymizely. Během šesti týdnů od začátku diety začaly problémy se spánkem a pozorovala výpadky paměti. Navíc pozorovala, že zvládání fyzické aktivity v dosavadním rozsahu je pro ni stále náročnější a výjimečně si asi tři dny dala i něco sladkého (med, sušenky). Po celkem dvou měsících, při váze 57,6 kg (tzn. 6 kg váhový úbytek) se rozhodla dietu ukončit. Pociťovala nezvladatelnou touhu po sladkém a dále již nebyla schopna tuto touhu překonávat. Jídelníček v následujících třech dnech po skončení paleodiety je ukázán v Tabulce 2. I když měla nemocná snahu přejít na běžnou stravu, ve stravě tentokrát převažují sacharidy, které doposud omezovala. Ihned po změně diety začala nemocná otékat, přestávala močit, 3. den měla cca o 10 kg více, špatně se jí dýchalo a měla epizodu intenzivních bolestí břicha. Přemýšlela, zda volat rychlou zdravotnickou pomoc, ale nakonec vydržela a k lékaři přišla až 5. den po změně diety. Při odebírání anamnézy v nemocnici bylo dále zjištěno, že během konce období, kdy dodržovala zásady paleodiety, se u ní objevil i transientní amentní stav. Pacientka subjektivně udávala dušnost, svalovou slabost, která ji omezovala v chůzi, pocit tíhy a otoku dolních končetin, bolestivé napětí ve svalech dolních končetin a bolestivé nadmutí břicha, které se zhoršilo vždy po příjmu sacharidů. Fyzikálním vyšetřením byly zjištěny tyto odchylky: hyperhydratace, bledý kožní kolorit a vzedmuté břicho. Laboratorně byla patrná hypokalémie (3,7 mmol/l), hypofosfatémie (0,53 mmol/l), magnézium při dolní hranici referenčního rozmezí (0,72 mmol/l) a elevace transamináz (ALT 3,98 µkat/l, AST 2,37 µkat/l), močovina a kreatinin byly v referenčním rozmezí (4,8 mmol/l a 54 µmol/l), podobně též natrium (143 mmol/l) a chloridy (103 mmol/l). Stav byl zhodnocen jako realimentační syndrom a pacientka byla přijata k hospitalizaci. Po přijetí k hospitalizaci byla z důvodu bolesti břicha a svalové slabosti vyšetřena též pankreatická amyláza, která byla v referenčním rozmezí, a kreatinkináza, která byla zvýšena zhruba 6,7krát oproti horní hranici referenčního rozmezí, další marker myoglobin byl kupodivu v referenčním rozmezí. Dále byla zjištěna snížená hodnota kyseliny listové s makrocytózou v krevním obraze, hraničně snížená celková bílkovina a zvýšená hodnota hydrogenuhličitanu a base excess (vyšetřena pouze venózní krev 3. den hospitalizace: pH 7,359, pCO2 7,97 kPa, HCO3 aktuální 32,8 mmol/l, HCO3 standardní 28,3 mmol/l, base excess aktuální 6,1 mmol/l, současně Na 142 mmol/l, K 4,9 mmol/l, Cl 102 mmol/l, celková bílkovina 65,2 mmol/l). pH moče se v průběhu léčby zvyšovalo (6,0…7,0). Ostatní laboratorní hodnoty byly bez pozoruhodnosti. Vzhledem k bolestem břicha a elevaci jaterních testů bylo doplněno UZ břicha, při kterém nebyla zjištěna žádná patologie. Byla doplněna serologická vyšetření na hepatotropní agens a vyšetření autoprotilátek, vše s negativním výsledkem. Během hospitalizace byla pacientce podána infúzní terapie k suplementaci draslíku, hořčíku a fosfátu, zároveň s opatrnou diuretickou terapií vzhledem k retenci tekutin. Během této terapie došlo ke zlepšení subjektivních obtíží, poklesu jaterních enzymů a váhovému úbytku z důvodu navození negativní bilance tekutin a pacientka byla propuštěna ve stabilním stavu do domácí péče.
Po dimisi byla nemocné doporučena diabetická dieta, kterou ale vzhledem k nezvladatelné touze po sladkém měla problém dodržet, stejně jako nastavit pravidelný jídelní režim. Postupně ale došlo k úzdravě a pacientka se byla schopna vrátit do běžného života, k běžné stravě, práci i běžným aktivitám. Při následných ambulantních kontrolních vyšetřeních nebyly zjištěny kromě mírných intermitentních perimaleolárních otoků žádné patologické nálezy.
Diskuse
Dle uznávaných doporučení WHO (World Health Organiozation, Světová zdravotnická organizace) by běžná strava měla obsahovat 15-30 % tuků, 55-75 % z celkové energie by mělo být kryto sacharidy a 10 až 15 % proteiny. Monosacharidy a disacharidy by přitom měly tvořit méně než 10 % [2]. V prezentovaném případě se jednalo především o značnou redukci až úplné vynechání sacharidů ve stravě. Dieta s omezením sacharidů, především rafinovaných cukrů nemusí být vždy zcela špatná. Běžně je v lékařské praxi užívána diabetická dieta s definovaným množstvím sacharidů či ketogenní dieta. Ketogenní dieta je metodou volby u některých metabolických onemocnění jako je deficit glukózového transportéru typu 1, deficit pyruvát dehydrogenázy a defekty mitochondriálního komplexu I a může být účinná i u některých epileptických stavů. Nemocní musí být v průběhu diety monitorováni ve speciálních centrech, aby se minimalizovaly nežádoucí účinky. K těm patří gastrointestinální symptomy, hyperlipidémie a hyperkalciurie a v dlouhodobém horizontu pak nefrolithiáza, snížená kostní denzita a jaterní steatóza [3]. Jsou diskutovány i další oblasti, kde by kontrolovaná ketogenní dieta mohla představovat ko-adjuvantní terapii [4].
Striktní omezení sacharidů u pacientky bylo následováno zvýšeným příjmem sacharidů vedoucím k realimentačnímu syndromu. I když je tento syndrom znám více než 70 let, stále neexistuje jeho jednoznačná definice. Jedná se o soubor klinických příznaků a laboratorních změn objevujících se převážně v průběhu prvních 72 hodin po zahájení příjmu potravy/nutriční terapie se závažnými klinickými následky. Základním charakteristickým znakem je hypofosfatémie, obvykle <0,5 mmol/l, i když hodnoty se v literatuře značně liší (od cca 0,87 mmol/l po 0,32 mmol/l). Důležitá je přitom nejen absolutní hodnota fosfátů, ale též dynamika změn – za významný je považován pokles o více než 30 % či 0,16 mmol/l. Dalšími změnami mohou být hypokalémie, hypomagnezémie, metabolická alkalóza především při hypokalémii a hypoproteinémii a celkově poruchy vodního a iontového hospodářství a energetického metabolismu. Za fyziologických okolností je pro většinu buněk hlavním zdrojem energie glukóza. Během hladovění je glukóza získávána štěpením glykogenu vlivem glukagonu (zásoby glykogenu stačí asi na 24-48 hodin) a je aktivována glukoneogeneze z aminokyselin získaných především proteolytickým štěpením svalových bílkovin a z mastných kyselin. Následně se hlavním energetickým zdrojem stávají mastné kyseliny a ketolátky. Dochází rovněž k úbytku vitamínů a intracelulárních iontů, i když jejich hladiny v séru mohou zůstávat v referenčním rozmezí. Po zahájení realimentace dochází ke zvýšení glykémie a stimulaci sekrece inzulinu. Tyto děje vedou k rychlému přesunu glukózy a iontů (fosfáty, kalium, magnesium) intracelulárně, což má za následek hypofosfatémii. Sekundárně pak dochází k intracelulární depleci fosfátů a s tím souvisejícímu nedostatku ATP a poruchám energetického metabolismu. Objevuje se rovněž hypokalémie a hypomagnezémie a následkem možných arytmií, svalové slabosti a rhabdomyolýzy. Zvyšuje se také retence sodíku a vody, což vede k otokům a srdeční nedostatečnosti [5,6].
Konkrétně u naší pacientky došlo vlivem bezsacharidové diety v kombinaci s náročnou fyzickou aktivitou k depleci glykogenu v myocytech i hepatocytech. Po realimentaci sacharidy byla aktivována intenzivní syntéza glykogenu, což způsobilo přesun fosforu intracelulárně. Dále došlo k nadměrné retenci vody intracelulárně vlivem nově vzniklého glykogenu v hepatocytech a myocytech s jejich následným poškozením. Tyto biochemické pochody vedoucí k poškození myocytů a hepatocytů měly jak laboratorní, tak klinický korelát v podobě elevace transamináz, elevace kreatinkinázy, vzniku svalové slabosti společně s bolestivostí svalů a přírůstku váhy. Hodnota sérového myoglobinu byla v referenčním rozmezí na rozdíl od zvýšené hodnoty kreatinkinázy. Důvodem byl zřejmě kratší biologický poločas myoglobinu v porovnání s kreatinkinázou a jeho rychlá eliminace při zachované funkci ledvin.
Realimentační syndrom představuje potenciální problém především u nemocných v pooperačním období, onkologických a geriatrických nemocných. Ukazuje se ale, že může být hrozbou také při výrazných změnách diety. Byl popsán např. u 28letého kulturisty, jehož běžná strava se skládala z 500 g libového masa a 1000 g různých semínek. V průběhu čtyř měsíců postupně eliminoval sacharidy a poslední měsíc před soutěží nekonzumoval vůbec žádné. V den soutěže a pět dní po ní změnil stravu na 800 g sacharidů denně (čokoládové tyčinky a podobně). Do nemocnice byl přijat s paralýzou dolních končetin a těžkými metabolickými změnami (kalium 1,5 mmol/l, fosfáty 0,20 mmol/l, magnézium 0,77 mmol/l, hyperglykémie, elevace kreatinkinázy a mírná elevace transamináz). Během tří dnů léčby se postupně zlepšily únava i svalová slabost a následně byl propuštěn bez jakýchkoli reziduí [7]. Sportovci s větším množstvím svalové hmoty tak mohou představovat další rizikovou skupinou stran rozvoje realimentačního syndromu vzhledem k většímu množství glykogenu vytvořeného po obnovení příjmu sacharidů.
Při jakékoli dietě je podstatné, jak ji pacient pojme a též jaký je jeho výchozí stav. Nejde tedy jen o to, co si přečte či co je mu prezentováno, ale též o to, co z toho vnímá, resp. co je schopen vnímat, a co nakonec zrealizuje. Proto i jakákoli dobře míněná rada odborníka se může minout účinkem a pacient se jí nebude řídit. Přístup nemocné k paleodietě byl zřejmě značně extrémní a je otázkou, zda je toto skutečně doporučováno (Tabulka 1). Druhým extrémem byla strava po ukončení paleodiety (Tabulka 2), která nakonec vedla k realimentačnímu syndromu. Ukazuje se, že zásadním problémem jsou především extrémní výkyvy a že jakékoli změny je třeba dělat pozvolna. Nemocné byla dále po zvládnutí akutního stavu doporučena diabetická dieta, aby byla šance k postupné adaptaci na běžnou stravu. Pacientka ovšem touhu po sladkém nebyla schopna překonat, a proto nedodržovala opakovaně doporučované postupy. Podobně problematické bylo i nastavení pravidelného jídelního režimu.
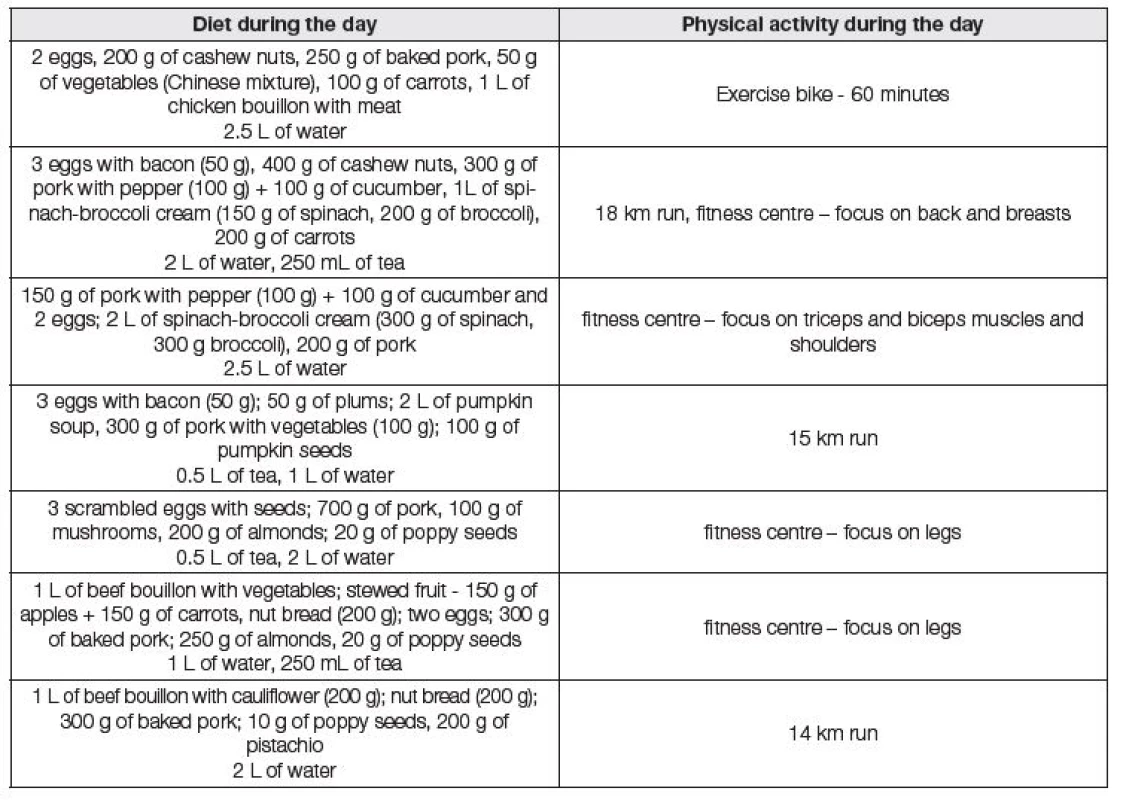
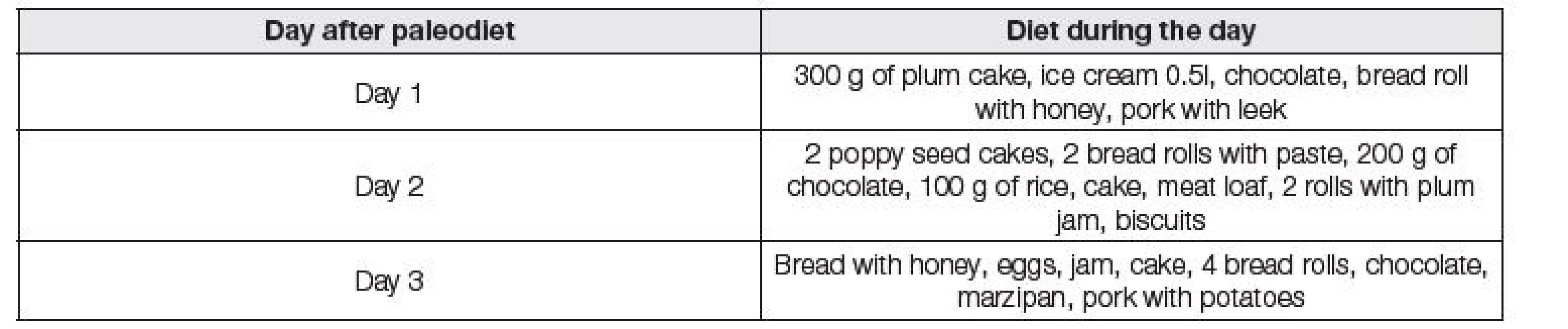
Dle nemocné zkoušely podobnou dietu také její dvě známé, avšak u nich se žádné problémy nevyskytly ani v průběhu diety ani po přechodu na běžnou stravu. Obě byly podstatně silnější konstituce než prezentovaná nemocná, jejich dieta nebyla tak striktní a nevysilovaly se tak významnou fyzickou aktivitou. Tzn. v jejich případě se zřejmě jednalo v podstatě o přechod na zdravější stravu, ve které byly omezovány především monosacharidy či přepalované tuky. Tyto dietní změny byly provázeny mírně zvýšenou pohybovou aktivitou, takže výsledný efekt pro ně byl příznivý a celkově se cítily velmi dobře. Jakékoli extrémní pojetí různých „diet“ může být velmi škodlivé, a proto jejich realizace musí být vždy přísně individuální.
V paleolitu byl život jistě velmi náročný a člověk musel být v dobré formě, aby přežil. V současné době je ovšem životní styl odlišný. Zdravá strava a pohyb jako přirozená součást života je jistě na místě, nicméně přílišné zaměření na jednostrannou změnu složení stravy může vést k závažným fyzickým, ale i psychosociálním problémům [8].
Závěr
Realimentační syndrom představuje potenciální problém nejen u malnutričních nemocných s nejrůznějšími patologickými stavy (onemocnění gastrointestinálního traktu, v pooperačním období, onkologičtí a geriatričtí pacienti), ale může být také hrozbou u zdravých jedinců při nevhodných významných změnách diety.
Autoři prohlašují, že nejsou ve střetu zájmů.
Práce byla podpořena výzkumnými záměry MZ ČR VFN64165 a Progres Q25.
Do redakce došlo 18. 6. 2018
Adresa pro korespondenci:
MUDr. Jaroslav Macášek, Ph.D.
IV. interní klinika – klinika gastroenterologie a hepatologie, 1.LF UK a VFN
U Nemocnice 499/2
128 08 Praha 2
e-mail: jaroslav.macasek@vfn.cz
Zdroje
1. http://www.paleodieta.cz/
2. Svačina, S., et al. Poruchy metabolismu výživy. Praha: Galén, 2010, s.505.
3. Elia, M., Klepper, J., Leiendecker, B., Hartmann, H. Ketogenic Diets in the Treatment of Epilepsy. Curr Pharm Des., 2017, 23(37), p. 5691-5701.
4. Branco, A.F., Ferreira, A., Simões, R.F., Magalhães-Novais, S., Zehowski, C., Cope, E., Silva, A.M, Pereira, D., Sardão, V.A., Cunha-Oliveira, T. Ketogenic diets: from cancer to mitochondrial diseases and beyond. Eur J Clin Invest., 2016, 46(3), p. 285-98.
5. Friedli, N., Stanga, Z., Sobotka, L., Culkin, A., Kondrup, J., Laviano, A., Mueller, B., Schuetz, P. Revisiting the refeeding syndrome: Results of a systematic review. Nutrition., 2017, 35, p. 151-160.
6. Ševela, S., Novák, F., Kazda, A., Brodská, H. Realimentační syndrom. Čas Lék Čes., 2016, 155(2), p.34-40.
7. Lapinskienė, I., Mikulevičienė, G., Laubner, G., Badaras, R. Consequences of an extreme diet in the professional sport: Refeeding syndrome to a bodybuil-der. Clin Nutr ESPEN., 2018, 23, p. 253-255.
8. Papežová, H. Spektrum poruch příjmu potravy. Praha: Grada, 2010, p.424.
Štítky
Biochemie Nukleární medicína Nutriční terapeutČlánek vyšel v časopise
Klinická biochemie a metabolismus

2018 Číslo 4
- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Efektivita léčby a možné indikace liraglutidu v gynekologii
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
Nejčtenější v tomto čísle
- Hyponatrémie – frekvence, příčiny, patobiochemie, klinika a terapie
- Hemolytický index jako nástroj ke stanovení volného hemoglobinu v plazmě
- Realimentační syndrom po paleodietě
- Urolitiáza - efekt terapie indapamidem – kazuistika
