-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Porovnání různých elektroforetických systémů v laboratorní diagnostice monoklonálních gamapatií
Comparison of different electrophoretic systems in the laboratory diagnosis of monoclonal gammopathy
Objective:
Comparison of densitometric/absorbance values of individual electrophoretic fractions and paraprotein concentrations using three electrophoretic systems.
Type:
Methodical study. Material and methods: 206 samples of patients with suspected or diagnosed monoclonal gammopathy that had been sent for serum protein electrophoresis to the Dept. of Clinical Biochemistry, Institute of Laboratory Diagnostics, University Hospital Ostrava, were included in the study. For serum protein electrophoresis, three systems were used: Hydrasys, Capillarys 2 Flex - Piercing and Interlab G-26 Easy-Fix. For statistical analysis, programme MedCalc Version 16.1.2 was used.
Results:
T-test showed that best precision in condition of repeatability had been achieved by Capillarys (CV < 4.1 %) followed by Interlab G26 (CV < 5.7 %) and Hydrasys (CV <10 %). For the analysis of differences between the instruments by a non-parametric Friedman´s test, statistically significant differences were found in each comparison for albumin, α2-, β1 - and β2-globulins. For α1-globulins, no significant difference was found between Interlab G26 and Hydrasys; for γ-globulins, no significant difference was found between Interlab G26 and Capillarys. Monoclonal komponent was found in 79 samples by all the systems used. No significant differences in paraprotein concentrations between Hydrasys and Interlab G26 were found, and these concentrations were not dependent on the paraprotein type.
Conclusion:
Systems working on the principle of gel electrophoresis provide comparable results and they are interchangeable.
Keywords:
serum protein gel electrophoresis, capillary electrophoresis, monoclonal gammopathy.
Autoři: P. Kušnierová 1,2; D. Zeman 1,2; I. Faruzelová 1; F. Všianský 1; Z. Švagera 1,2; K. Šafarčík 1,2
Působiště autorů: Ústav laboratorní diagnostiky, Oddělení klinické biochemie, Fakultní nemocnice Ostrava 1; Katedra biomedicínských oborů, Lékařská fakulta, Ostravská univerzita 2
Vyšlo v časopise: Klin. Biochem. Metab., 26, 2018, No. 2, p. 82-86
Souhrn
Cíl studie:
Porovnání denzitometrických/absorbančních hodnot jednotlivých elektroforetických frakcí a koncentrací přítomných paraproteinů s využitím tří elektroforetických systémů.
Typ studie:
Metodická studie.
Materiál a metody:
Do studie bylo zařazeno 206 pacientských vzorků Oddělení klinické biochemie, Ústavu laboratorní diagnostiky, Fakultní nemocnice Ostrava s podezřením/diagnostikovanou monoklonální gamapatií. K elektroforetické separaci proteinů v séru byly použity tři analytické systémy: Hydrasys, Capillarys 2 Flex-Piercing a Interlab G26 Easy Fix. Ke statistickému zpracování dat byl využit program MedCalc, verze 16.1.2.
Výsledky:
Pomocí t-testu bylo prokázáno, že nejlepší výsledky preciznosti za podmínek opakovatelnosti vykazuje Capillarys (CV < 4,1 %), následován Interlabem G26 (CV < 5,7 %) a Hydrasysem (CV < 10 %). Při hodnocení vzájemných diferencí mezi přístroji pomocí neparametrického Friedmanova testu byl u pacientských vzorků zjištěn statisticky významný rozdíl mezi všemi třemi analyzátory u frakce albuminu, α2-, β1 - a β2-globulinů. V případě frakce α1-globulinů nebyl prokázán statisticky významný rozdíl mezi Interlabem G26 a Hydrasysem, u γ-globulinů mezi Interlabem G26 a Capillarysem. Monoklonální komponenta byla prokázána u 79 studovaných vzorků všemi třemi systémy. Koncentrace paraproteinů nevykazovaly statisticky významné rozdíly mezi Hydrasysem a Interlabem G26 a nebyly závislé na typu paraproteinu.
Závěr:
Systémy pracující na principu gelové elektroforézy poskytují srovnatelné výsledky a jsou vzájemně zaměnitelné.
Klíčová slova:
gelová elektroforéza sérových proteinů, kapilární elektroforéza, monoklonální gamapatie.
Úvod
Pojem monoklonální gamapatie (MG) představuje komplexní spektrum onemocnění, projevující se klonální proliferací plazmatických nebo lymfoplazmocytoidních buněk (imunokompetentních buněk), většinou provázené tvorbou homogenního imunoglobulinu (M-proteinu, paraproteinu) nebo jeho úplné nebo i neúplné strukturní komponenty. Proliferace produkujícího klonu má maligní nebo potenciálně maligní charakter [1-4]. V naprosté většině případů průkazu MG jde o tzv. benigní paraproteinémii, monoklonální gamapatii nejistého významu (MGUS), s prokázaným monoklonálním proteinem, který může být přítomen v séru již deset let před stanovením diagnózy mnohočetného myelomu (MM) [5-6]. Detekce, charakterizace a kvantifikace M-proteinů je důležitá pro stanovení diagnózy, stratifikaci rizika progrese a monitorování léčebné odpovědi [1]. Za tímto účelem mají mimořádný a nezastupitelný význam biochemická vyšetření jako je elektroforéza proteinů v séru a moči, stanovení koncentrace monoklonálního imunoglobulinu v séru a moči, volných lehkých řetězců imunoglobulinů v séru a stanovení třídy a antigenního typu monoklonálního imunoglobulinu [7].
K elektroforetické separaci proteinů séra a moči (SPE, UPE) se v klinické praxi nejčastěji využívá elektroforéza na gelových nosičích, především na agaróze, nebo kapilární elektroforéza. Stanovení koncentrace monoklonálního imunoglobulinu pak provádíme u gelové elektroforézy z denzitometrického záznamu, u kapilární elektroforézy ze záznamu absorbanční křivky při 200 nm.
Sofistikované počítače a specializované softwary automaticky vymezují hlavní zóny: albumin, alfa1-globuliny, alfa2-globuliny, beta (beta1-/ beta2-) globuliny, gama-globuliny a současně umožňují manuální či automatické vymezení přítomného monoklonálního imunoglobulinu [8]. Citlivost záchytu monoklonální komponenty je závislá na použité metodě (gelová/kapilární elektroforéza), na účinnosti separace (metody s vysokým rozlišením separují proteiny do β1 - a β2 - frakce; metoda s nízkým rozlišením jen do β - frakce) a na pohyblivosti monoklonální komponenty (alfa, beta či gama-frakce) [9-10]. Naším cílem bylo porovnání různých elektroforetických systémů, jimi získaných denzitometrických/absorbančních hodnot jednotlivých frakcí a koncentrace prokázaných paraproteinů.
Metodika
Do studie bylo zařazeno 206 vzorků pacientů s podezřením/diagnostikovanou monoklonální gamapatií z Fakultní nemocnice Ostrava. K elektroforetické separaci proteinů v séru byly použity tři analytické systémy a příslušné diagnostické soupravy: Hydrasys (Hydragel 30 Protein β1-β2, kat. č: S-4141, SEBIA), Capillarys 2 Flex-Piercing (Capillarys Protein(E) 6, kat. č. 2003, SEBIA) a Interlab G26 Easy Fix (Kit for B1-B2 serum proteins and concentrated urines, kat. č. SRE 603K, INTERLAB). K posouzení preciznosti a pravdivosti analyzátorů byl použit kontrolní materiál: Normal Control Serum, kat. č. 4785, SEBIA. Ke statistickému zpracování dat byl využit program MedCalc, verze 16.1.2. U všech použitých testů byla statistická významnost posuzována na hladině p = 0,05.
Výsledky
Při vzájemném hodnocení preciznosti jednotlivých analyzátorů pomocí t-testu bylo prokázáno, že nejnižší variační koeficienty pro jednotlivé frakce poskytl analyzátor Capillarys, následován Interlabem G26 a Hydrasysem (Tabulka 1). K ověření správnosti metody byl použit kontrolní materiál firmy Sebia s atesty pro Hydrasys a Capillarys. Výsledky byly posuzovány vzhledem k přijatelným rozdílům v procentech pro kvantitativní zkoušky programu externí kontroly kvality SEKK pro parametry albumin (elfo) a γ-globuliny (elfo). Oba analyzátory poskytly uspokojivé výsledky (Tabulka 2).
Tab. 1. Precision assessment of individual analyzers, (H) Hydrasys, (C) Capillarys, (I) Interlab G26. 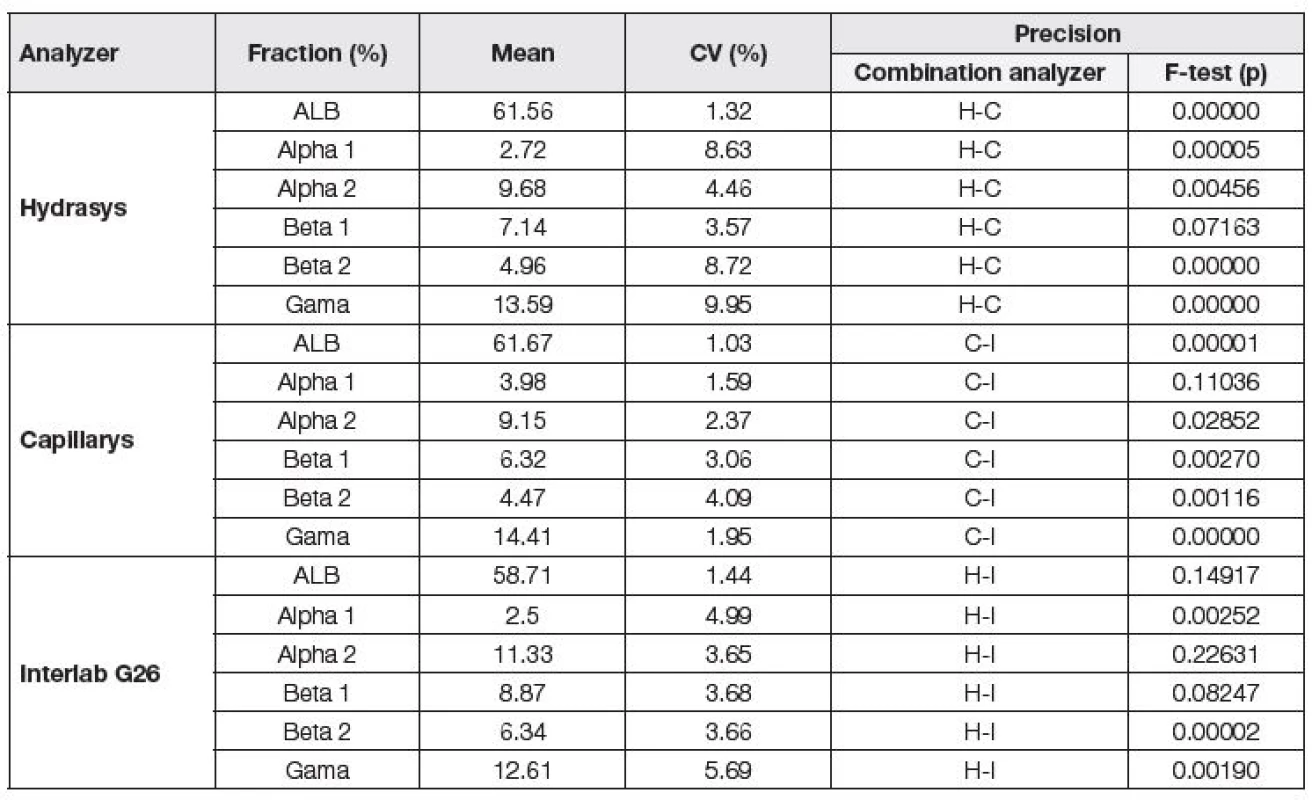
Tab. 2. Assessment of trueness of analyzers Hydrasys and Capillarys. 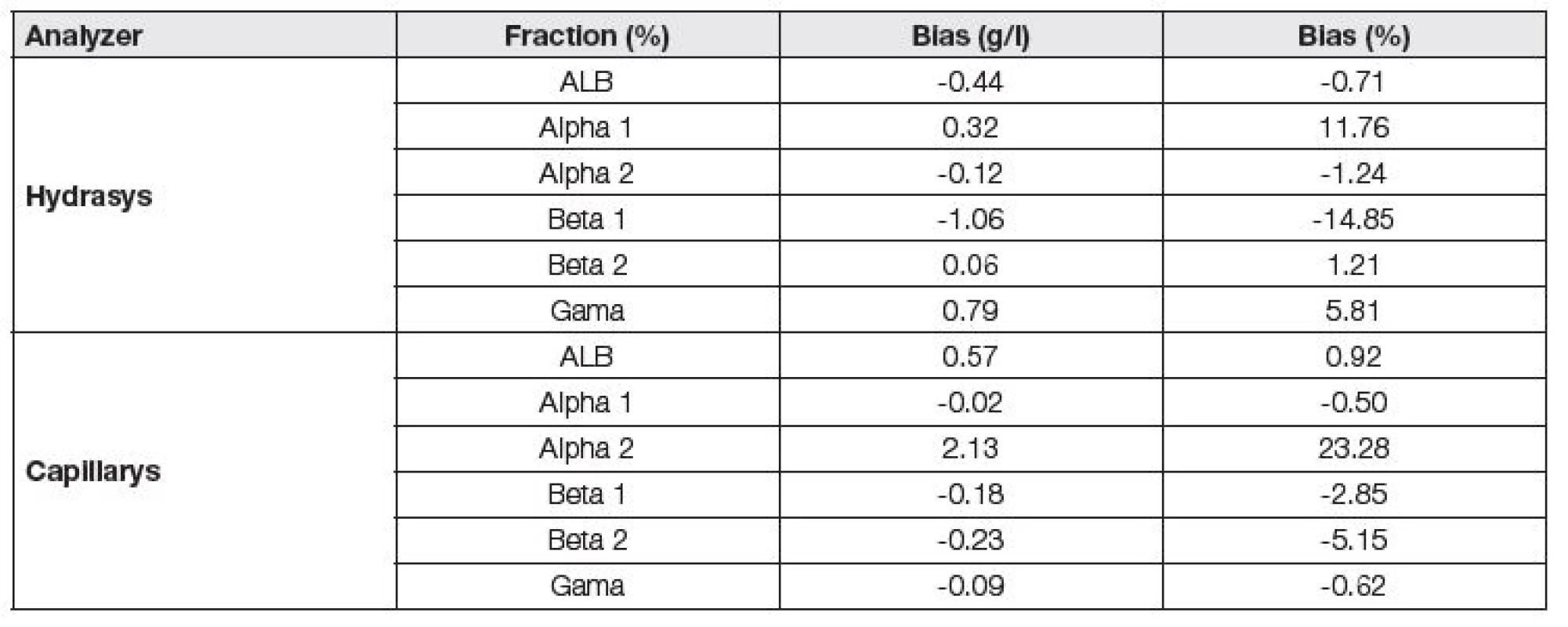
Při hodnocení vzájemných diferencí výsledků pacientských vzorků pomocí neparametrického Friedmanova testu byl zjištěn statisticky významný rozdíl mezi všemi třemi analyzátory v případě frakce albuminu, α2-, β1 - a β2-globulinů (Tabulka 3). V případě frakce α1-globulinů nebyl prokázán statisticky významný rozdíl mezi Interlabem G26 a Hydrasysem, u gama-globulinů mezi Interlabem G26 a Capillarysem.
Tab. 3. Results of comparison of the electrophoretic fractions between the three electrophoretic systems using non-parametric Friedman’s test. (H) Hydrasys, (C) Capillarys, (I) Interlab. 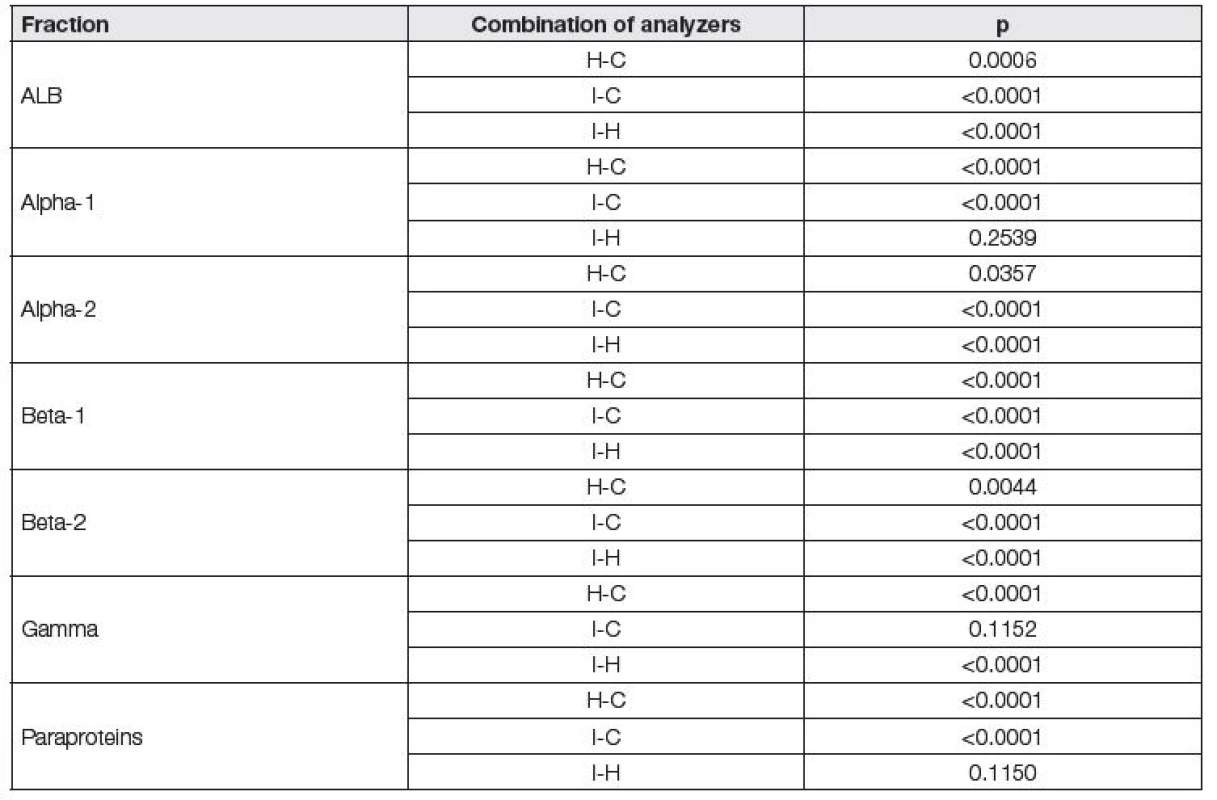
U 79 vzorků byl prokázán všemi třemi systémy monoklonální imunoglobulin. U 35 z nich se jednalo o paraprotein IgG kappa, u 24 IgG lambda, u 6 IgA kappa, u 5 IgA lambda, u 5 IgM kappa a u 4 IgM lambda. Při porovnání denzitometrických/absorbančních hodnot jednotlivých paraproteinů nebyl prokázán statisticky významný rozdíl mezi Hydrasysem a Interlabem G26 a současně bylo prokázáno, že tyto rozdíly nejsou závislé na typu paraproteinu (Tabulka 4, obr. 1). Nicméně při hledání a denzitometrickém vyhodnocení monoklonální komponenty z jednotlivých elektroforetických záznamů bylo patrné, že Capillarys je citlivější než testované systémy pracující na principu gelové elektroforézy, jejichž citlivost/separační účinnost se lišila v závislosti na typu paraproteinu a s ním související migrační pohyblivosti (obr. 2).
Tab. 4. Dependency of differences among analyzers on the type of paraprotein using one-way ANOVA. 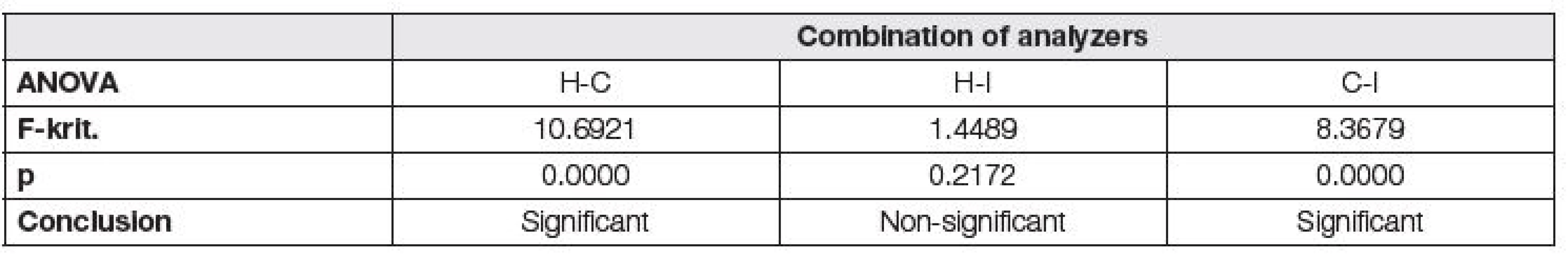
Obr. 1. Assessment of mutual differences between analyzers on the type of paraprotein using parallel coordinates plot and boxplots. 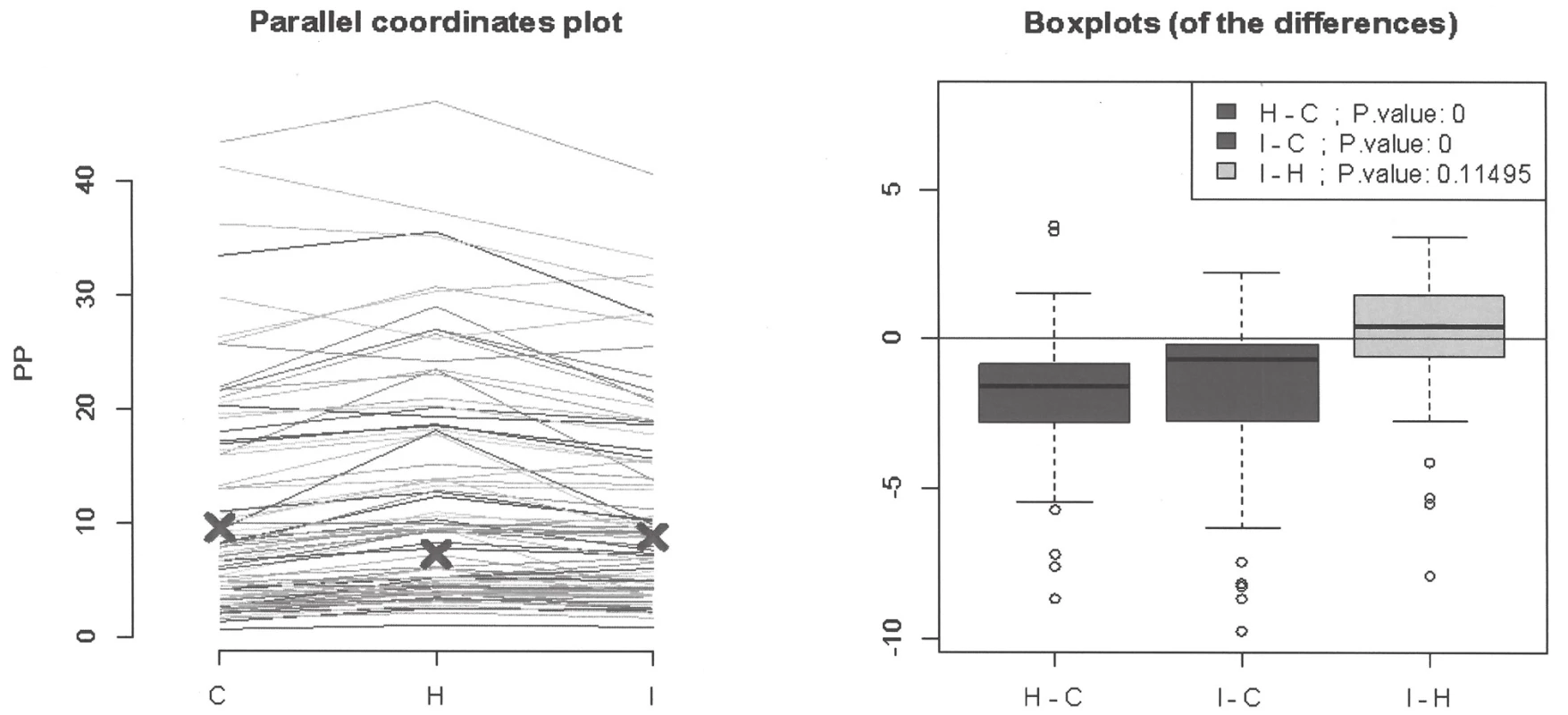
Obr. 2. Assessment of mutual differences between analyzers on the type of paraprotein using parallel coordinates plot and boxplots. 
Diskuse
Byly testovány a srovnávány tří elektroforetické systémy, dva pracující na principu gelové elektroforézy, Hydrasys (SEBIA) a Interlab G26 Easy Fix (INTERLAB), a jeden na principu kapilární elektroforézy, Capillarys (SEBIA). V případě elektroforézy sérových proteinů, jsou všechny tři systémy uživatelsky přívětivé. Hydrasys je poloautomatický systém vyžadující manuální nanesení vzorků do aplikátorů a jejich umístění do migrační části analyzátorů. Po automatizovaném nanesení vzorků na gel, elektroforetické migraci a sušení vyžaduje manuální přenesení gelové plotny k barvení, odbarvování a osušení do druhé části analyzátoru. Naproti tomu Interlab G26 je plně automatizovaný systém umožňující automatické pipetování vzorků z primárních zkumavek společně s identifikací vzorku pomocí čárového kódu, identifikaci gelu a příslušné metody pomocí čárového kódu, automatickou aplikaci vzorků na gel, migraci, denaturaci, barvení, odbarvení a skenování, vše v jednom běhu bez zásahu obsluhy. Oba tyto systémy umožňují pomocí uvedených diagnostických souprav paralelní analýzu vzorků moči, ať už nativních či zahuštěných pomocí speciálních koncentrátorů moči, což je výhodné především při pátrání po přítomné monoklonální komponentě v séru a moči téhož pacienta.
Na rozdíl od toho Capillarys 2 Flex-Piercing je multikapilární elektroforetický plně automatizovaný systém, umožňující rychlou a účinnou separaci sérových proteinů s vysokým rozlišením a pravděpodobně i vyšším záchytem paraproteinů. Obtížnější a časově náročnější je pak analýza proteinů v moči vyžadující v několika krocích odsolení/zkoncentrování vzorků, odstředění, postupné naředění destilovanou vodou či dialyzačním tlumivým roztokem, trvající cca 2 hod. Další nevýhodou je separátní analýza močových vzorků za použití speciálních dilučních segmentů neumožňující porovnání přítomné monoklonální komponenty s nálezem v séru.
V případě imunofixační elektroforézy umožňují oba gelové systémy Hydrasys a Interlab G26 typizaci monoklonální komponenty s možností použití antisér proti IgD, IgE a volným lehkým řetězcům free kappa, free lambda, zatímco systém Capillarys typizaci těchto monoklonálních komponent neumožňuje. Takže v případě podezření na paraprotein třídy IgD či IgE nebo nemoc lehkých řetězců je nutné opět využít gelový elektroforetický systém.
Závěr
Všechny tři testované analyzátory jsou precizní a uživatelsky přívětivé. Na základě získaných výsledků lze konstatovat, že systémy pracující na principu gelové elektroforézy poskytují srovnatelné výsledky a jsou vzájemně zaměnitelné. Naproti tomu multikapilární elektroforetický systém je s gelovou elektroforézou nezaměnitelný, nicméně vyniká svou rychlostí a účinnou separací a eliminuje možné chyby způsobené barvením a denzitometrickým hodnocením. V případě volby nejvhodnějšího analyzátoru, je nutné přihlédnout k portfoliu nabízených metod.
Střet zájmů: Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 3. 10. 2017
Adresa pro korespondenci:
RNDr. Pavlína Kušnierová, Ph.D.
OKB, Ústav laboratorní diagnostiky
Fakultní nemocnice Ostrava
17. listopadu 1790/5, 708 52 Ostrava-Poruba
e-mail: pavlina.kusnierova@fno.cz
Zdroje
1. Katzmann, J. A. Screening Panels for Monoclonal Gammopathies: Time to Change. Clin Biochem Rev., 2009, 30(3), p. 105-111.
2. Attaelmannan, M., Levinson, S. S. Understanding and identifying monoclonal gammopathies. Clin Chem., 2000, 46(8), p. 1230-1238.
3. Sethi, S., Rajkumar, S. V. Monoclonal gammopathy-associated proliferative glomerulonephritis. Mayo Clin. Proc., 2013, 88(11), p. 1284-1293.
4. Pika, T., Lochman, P., Minařík, J., Bačovský, J., Ščudla, V. Úskalí interpretace výsledků společné analýzy hladin volných lehkých řetězců a elektroforézy séra. Klin. Biochem. Metab., 2012, 20(41), p. 59–62.
5. Landgren, O., Kyle, A. R., Pfeiffer, R. M., Katzmann, J. A., Caporaso, N. E., Hayes, R. B., Dispenzieri, A., Kumar, S., Clark, R. J., Baris, D., Hoover, R., Rajkumar, S. V. Monoclonal gammopathy of undetermined significance (MGUS) consistently precedes multiple myeloma: a prospective study. Blood, 2009, 113(22), p. 5412–5417.
6. Maisnar, V. Riziko přechodu monoklonální gamapatie nejasného významu do maligní monoklonální gamapatie. Klin. Biochem. Metab., 2013, 21(42), p. 93–96.
7. Keren, D. F., Schroeder, L. Challenges of measuring monoclonal proteins in serum. Clin. Chem. Lab. Med., 2016, 54(6), p. 947-961.
8. Katzmann, J. A., Snyder, M. R., Rajkumar, S. V., Kyle, R. A., Therneau, T. M., Benson, J. T., Dispen-zieri, A. Long-Term Biological Variation of Serum Protein, Electrophoresis M-Spike, Urine M-Spike, and Monoclonal Serum Free Light Chain Quantification: Implications for Monitoring Monoclonal Gammopathies. Clin. Chem., 2011, 57(12), p. 1687–1692.
9. Mussap, M., Pietrogrande, F., Ponchia, S., Stefani, P. M., Sartori, R., Plebani, M. Measurement of serum monoclonal components: comparison between densitometry and capillary zone electrophoresis. Clin. Chem. Lab. Med., 2006, 44(5), p. 609-611.
10. Schild, C., Wermuth, B., Trapp-Chiappini, D., Egger, F., Nuoffer, J. M. Reliability of M protein quantification: comparison of two peak integration methods on Capillarys 2. Clin. Chem. Lab. Med., 2008, 46(6), p. 876-877.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek EditoriálČlánek Abstrakta posterůČlánek Jmenný rejstříkČlánek Sborník
ProgramČlánek Abstrakta přednášek
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2018 Číslo 2- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Efektivita léčby a možné indikace liraglutidu v gynekologii
-
Všechny články tohoto čísla
- Abstrakta posterů
- Jmenný rejstřík
- Editoriál
- Neurofilamenta u traumatického poškození mozku – současné znalosti
- Definice sepse a septického šoku
- Glykovaný albumin v krevním séru/plasmě. Stručný přehled současného stavu.
- Porovnání různých elektroforetických systémů v laboratorní diagnostice monoklonálních gamapatií
- Specifikace analytických požadavků v programech externího hodnocení kvality
-
Sborník
Program - Abstrakta přednášek
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Definice sepse a septického šoku
- Glykovaný albumin v krevním séru/plasmě. Stručný přehled současného stavu.
- Neurofilamenta u traumatického poškození mozku – současné znalosti
- Porovnání různých elektroforetických systémů v laboratorní diagnostice monoklonálních gamapatií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



