-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Specifikace analytických požadavků v programech externího hodnocení kvality
Specification of analytical requirements in programmes of external data evaluation.
Objective: Review on the determination of harmonized analytical performance specification. Methods: Based on the studies of EFLM Working Group for specification of analytical performance and the elucidation of their sense. Results: Clinical outcomes, biological variation and state-of-art are three possible methods for derivation of analytical performance criteria-APS. Standardization methods, commutability of control materials and suitable target. Values (means, reference method values) are necessary conditions for this specification. Discussion: Current state of analytical performance shows large differences in individual EQA programs. This fact means impossibility for objective analytical quality assessment and should be immediately improved. Keywords: analytical performance specification, clinical outcomes, biological variation, State of the art, harmonization.
Autoři: B. Friedecký; J. Kratochvíla
Působiště autorů: SEKK s. r. o., Pardubice
Vyšlo v časopise: Klin. Biochem. Metab., 26, 2018, No. 2, p. 87-91
Souhrn
Cíl:
Přehled současné situace stanovení kritérií analytické kvality v programech externího hodnocení kvality.
Metody:
Informace o obsahu studií pracovní skupiny EFLM pro specifikaci požadavků na analytickou kvalitu (TF-PS) a dalších recentních prací, pojednávajících o tomto problému.
Výsledky:
Požadavky na analytickou kvalitu měření při hodnocení programů EHK mají být harmonizované a odvozené od klinických požadavků, biologické variability, nebo na základě současného stavu analytické technologie a výkonnosti laboratoří (State of the art). Základem odvození jsou střední hodnoty výsledků měření nebo výsledky referenčních metod, podmínkou hodnocení je dostatečná úroveň standardizace metod a komutability kontrolních materiálů.
Diskuse:
Současný stav je charakterizován neúnosně velkými rozdíly mezi požadavky, kladenými na analytickou kvalitu v různých programech EHK a znemožňuje obecně platné objektivní hodnocení analytické kvality.
Klíčová slova:
kritéria odvození požadavků na kvalitu, harmonizace, biologická variabilita, klinické cíle, State of the art.
Stockholmská konference, milánské definice, pracovní skupiny EFLM
Kontrolní meze/limity programů EHK (analytical performance specifications, dále APS) jsou velmi odlišné v různých programech EHK v různých zemích. V tabulce 1 je tento fakt uveden zcela jasně (ukazuje intervaly hodnot APS programů z Německa -Rilibäk, USA - CAP (College of American Pathologists), Francie, Belgie, České republiky - SEKK, Austrálie a Oceánie - RCPA QAP (Royal College of Pathologists of Australasia - Quality Assurance Programs). Hodnoty APS se liší u jednotlivých analytů běžně až trojnásobně. Potřeba harmonizovat jejich hodnoty je akutní, ale harmonizace sama je dosud velmi vzdálená [1]. Za počátek ucelené strategie pokusů o harmonizaci hodnot APS lze považovat konferenci ve Stockholmu v roce 1999 [2]. Patnáct let po stockholmské konferenci došlo k inovaci zásad stanovení APS na první strategické konferenci EFLM (European Federation of Clinical Chemistry and Laboratory Medicine) v Miláně [3, 4]. Byly formulovány tři základní metody určení hodnot APS:
- Na podkladě klinických cílů a potřeb (clinical outcomes).
- Na podkladě biologických variabilit.
- Na podkladě současného stavu kvality a analytiky (State of the art).
Tab. 1. Currently used values (%) of quality specifications for general serum analytes 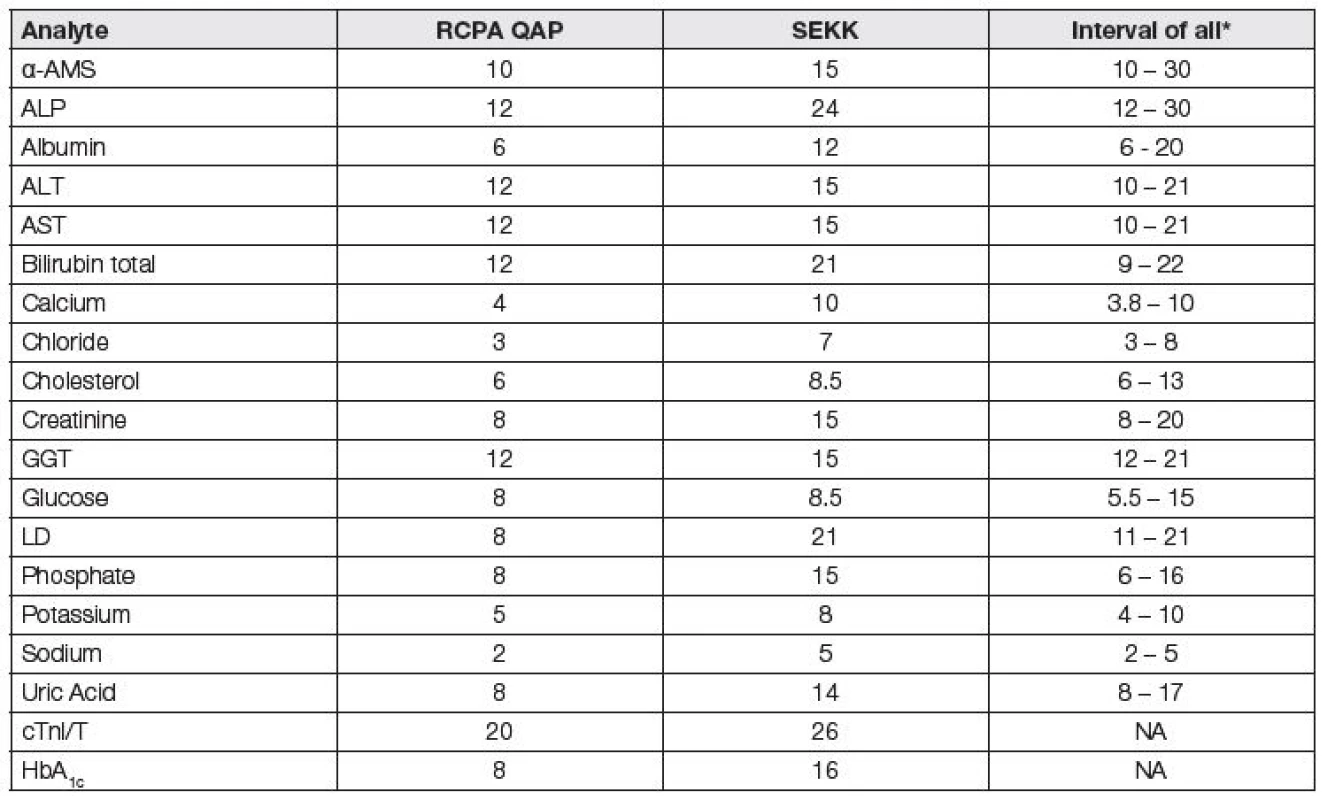
*obtained from France, Belgium, Australasia, Czech Republic, USA (CLIA), Germany (Rilibäk) Dotazník, zjišťující jaké postupy volí různé programy EHK k tvorbě APS, na který odpovědělo 29 organizátorů (včetně SEKK Pardubice), ukázal metodu State of the art jako nejčastější (61 %). Klinické cíle a potřeby a biologické variability byly používány shodně v 24 % případů. 56 % organizátorů použilo k definici APS „mínění expertů“, tedy více méně subjektivní metodu určení [5, 6].
Milánská konference EFLM 2014 ustanovila k řešení problémů APS pracovní skupinu Task Force on Performance Specifications in Laboratory Medicine (TF-PS). Předmětem činnosti skupiny jsou následné problémy, pro jejichž řešení byly i utvořeny pracovní podskupiny:
- Kontrolní limity pro programy EHK.
- Celková chyba měření a nejistota.
- Indikátory kvality extraanalytických fází.
- Harmonizace určení biologické variability a tvorba aktualizované biodatabáze.
Různé hodnoty APS způsobují, že různé programy EHK v Evropě poskytují nesrovnatelné informace o analytické kvalitě. V Tabulce 2 uvádíme, nakolik mohou různé hodnoty APS ovlivnit hodnocení kvality práce laboratoří.
Tab. 2. Influence of control limit value on the succesfulness of EQA participants 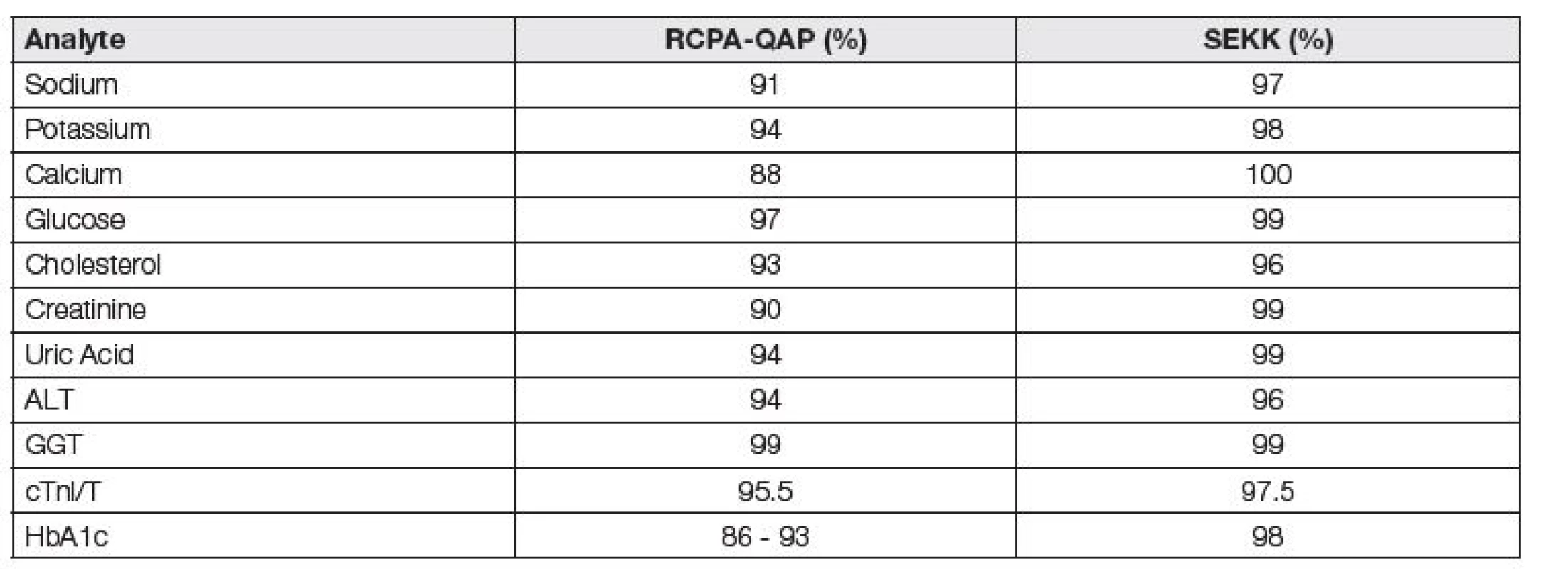
Jedním ze zajímavých následků je, že často uváděná dramatická a atraktivní data o původu až 80 % četnosti chyb celého procesu měření v preanalytické fázi nemohou být exaktně potvrzena, pokud je úspěšnost v programech EHK za současného stavu jejího hodnocení považována za indikátor kvality procesu, jak často uvádějí i publikace z dílen autorských kolektivů špičkových expertů jednotlivých pracovních skupin EFLM [7, 8].
APS a klinické cíle
Požadavky na analytickou kvalitu by měly být harmonizované s existujícími, mezinárodně akceptovanými klinickými doporučeními. A právě z textů těchto doporučení by měly být odvozovány implicitně (někdy i explicitně) hodnoty APS pro jednotlivé programy EHK. Příkladem explicitních požadavků klinických doporučení na analytickou kvalitu je například požadovaná preciznost stanovení cTnI/T CV ≤ 10 %, bias měření cholesterolu b ≤ 4 %, bias měření LDL cholesterolu b ≤ 8 % a bias eGFR b ≤ 10 %. Seznam takových laboratorních vyšetření je spolu s příslušnými doporučeními uveden v Tabulce 3 [9].
Tab. 3. Possible application for derivation of analytical performance specifications from clinical outcomes 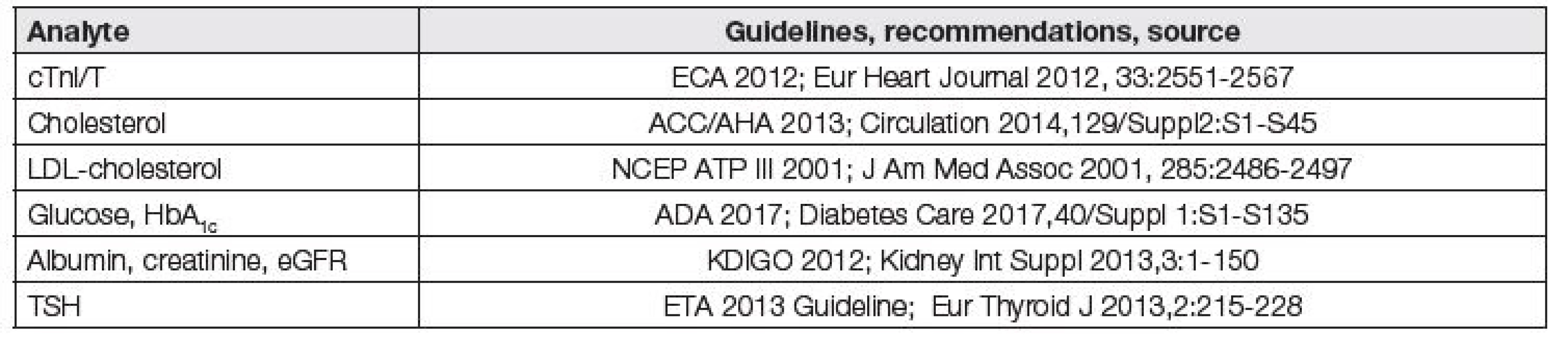
V současnosti jsou hodnoty APS programů EHK RCPA QAP (Austrálie a Oceánie) považovány za poměrně „referenční“ pro ostatní programy. Srovnáním hodnot z Tabulky 1 je zřejmé, že s výjimkou stanovení glukózy a cholesterolu jsou limity v programu SEKK u analytů, vhodných k použití APS, odvozených z klinických požadavků, podstatně benevolentnější a příliš současné klinické požadavky nerespektují. Tak tomu ale je i u řady evropských a světových programů EHK (např. Francie, Belgie, USA (CAP), Německo (Rilibäk - https://www.rfb.bio/pdf/Rili-BAEK-2014.pdf/), Velká Británie (UK NEQAS - https://ukneqas.org.uk/) a další).
Biologická variabilita
Hodnoty intraindividuálních (CVi) a interindividuálních variabilit (CVg) a z nich odvozených hodnot APS, definovaných jako celkové chyby měření (TE – total error) a vypočtených z hodnot CVi a CVg, jsou již řadu let volně přístupné ve Westgardově biodatabázi (https://www.westgard.com/biodatabase1.htm). Nová pracovní skupina EuBIVAS, patřící do výše uvedené TF-PS se zabývá vedle standardizovaného určení biologických variabilit právě zásadním problémem odvozování APS jako celkových chyb (TE), vypočtených z nich. Recentně uveřejnila několik zajímavých prací [10 – 13] s výpočty odvození robustních hodnot biologických variabilit a APSTE v krevním séru pomocí praktických měření 91 zdravých osob (ze 7 evropských zemí). Ukázala velké neshody mezi výsledky stanovení biologických variabilit u různých autorských kolektivů i pro rutinní analyty a v roce 2017 publikovala jejich inovované hodnoty zatím pro enzymy a elektrolyty.
Westgardova biodatabáze oznamuje postupné převzetí těchto hodnot EuBIVAS na své stránky, namísto dosavadních, na španělských měřeních (Carmen Ricós a spol.) založených dat biologických variabilit. Tabulka 4 názorně ukazuje na devíti vybraných analytech i to, že rozdíly v hodnotách APS lze někde pozorovat u různých dat, získaných na bázi stejného principu (enzymy).
Tab. 4. Control limits (here as APSTE) derived from biological variation obtained in study EuBIVAS, comparized with Westgard TE values (Westgard biodatabase) and with RCPA – QAP allowable limits of performance, all data are in % 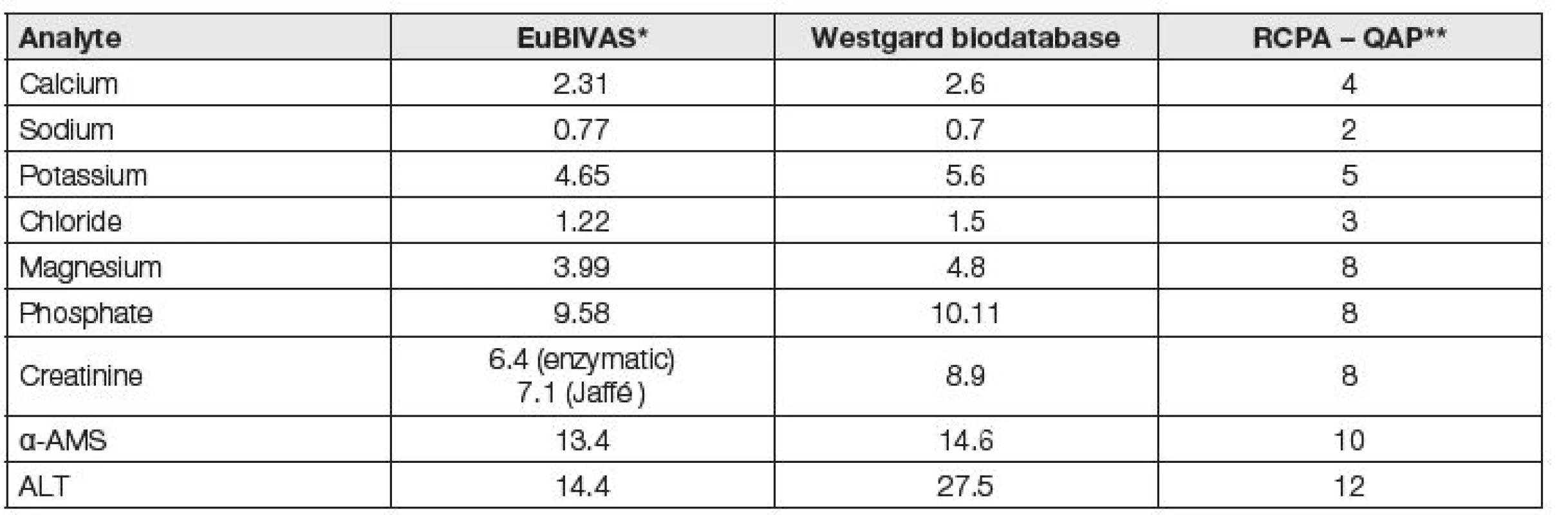
* presented data are arithmetical mean from the 95 % confidence interval (11,12,13)
** determined on the basis of total errorState of the art
Jsou hodnoty APS určeny na podkladě soudobého stavu analytické technologie a současné úrovně analytické kvality účastníků EHK. Jsou získávané statistickým postupem, nejčastěji jako násobné hodnoty směrodatných odchylek 2 až 3 SD. Určovány jsou ex post na základě randomizovaných studií. Je to dominantní metoda tam, kde není dostatečná úroveň standardizace a ani harmonizace a tam, kde nejsou k dispozici komutabilní kontrolní materiály. De facto tyto hodnoty tvoří vlivem současného stavu analytiky poměrně značnou část používaných hodnot APS. Jejich harmonizace je a bude obzvlášť obtížná.
Obecné problémy kontrolních limitů (APS) v programech EHK
Bias a chyba měření jsou ideálními kritérii analytické kvality v programech měření. K tomu je ale nezbytné mít:
- dostatečnou referenci a kvalitně určené hodnoty referenčních měření s metrologickou návazností
- dostatečný stupeň standardizace metod
- dostatečnou komutabilitu kontrolních materiálů
- cílové hodnoty, nezávislé na metodě
- harmonizované hodnoty APS, zajišťující harmonizovanou úroveň hodnocení analytické kvality.
Zájmy výrobců nejsou kompatibilní s požadavky harmonizace podmínek programů EHK, jak ukazuje i charakter mnoha „firemních“ programů EHK, zásadně používajících k hodnocení kvality metodických skupin peer groups a pracujících bez potřebného respektu k závěrům pracovních skupin EFLM a IFCC (International Federation of Clinical Chemistry and Laboratory Medicine). Edukační charakter správně fungujících programů EHK, spočívající v detekci příčin chyb, ve zlepšování úrovně standardizace, k zajištění zkušenosti laboratoří je zde potlačován na úkor administrativních úkonů, potřebných k papírovým potvrzením o analytické kvalitě, certifikaci, akreditaci osob, výrobců a metod. To lze demonstrovat na příkladu firemního programu RIQAS Randox (obdobně ale i firemní programy Sysmex, BioRad a další), kdy je k hodnocení laboratoří využíváno zbytečně a nelogicky jako cílových hodnot průměrů příslušných skupin metod/platforem, ačkoliv jsou vlivem standardizace téměř totožné se středními hodnotami všech účastníků (Tabulka 5). Specifikace požadavků na analytickou kvalitu mají skutečný smysl, pokud jsou vztaženy ke kvalitně určené cílové hodnotě, nezávislé na metodě měření.
Tab. 5. Peer group Advia vs robust means of all results in commercial EQA scheme Randox 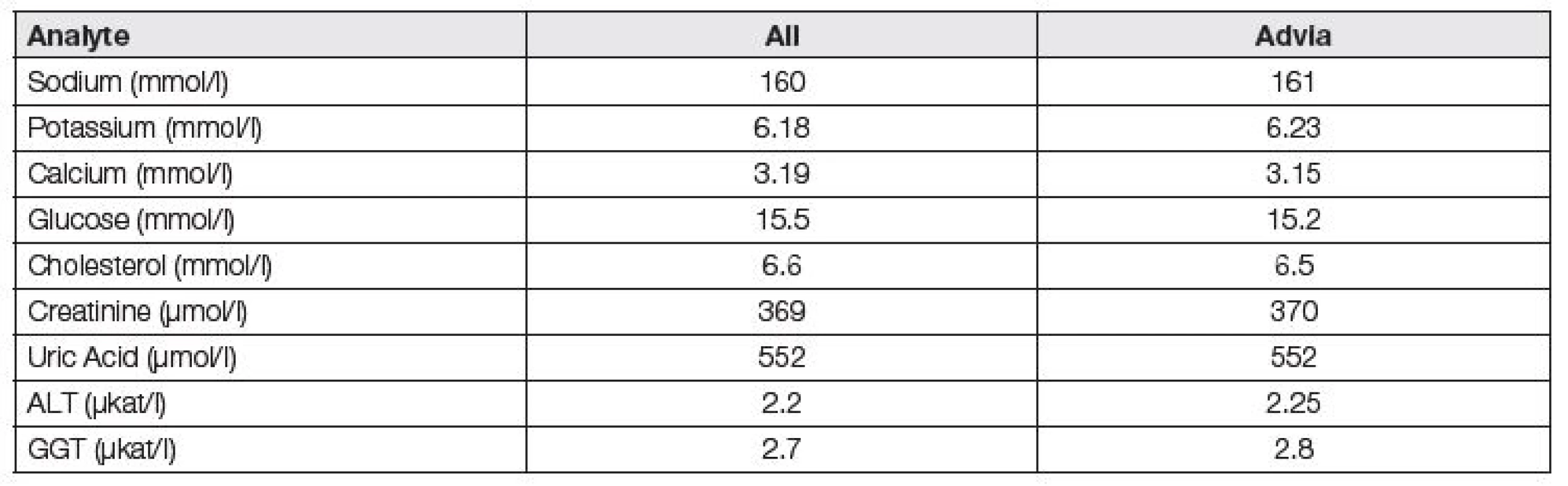
State of the art hodnoty APS by měly být rezervované jen pro metody s nedostatečnou standardizací a nízkou úrovní celosvětové harmonizace.
Arteficiální kontrolní vzorky (lyofilizáty aj.) mohou v řadě případů poskytovat stejnou výpověď o kvalitě, jako nativní komutabilní vzorky, je však třeba respektovat při jejich vyhodnocení stupeň jejich komutability [14]. Srovnání výsledků, dosažených v programu SEKK a výsledky mezinárodní studie INPUtS jasně ukazuje, že tam, kde byly zjištěny významné diference, byly jejich zdroje podmíněny podstatně více nedostatečnou standardizací, než pouze matricovými vlivy [15].
Komutabilita by měla být posuzována pro každou šarži kontrolního materiálu a pro každý analyt a metodu zvlášť, přičemž by nativní kontrolní materiály s oficiálně testovanou komutabilitou měly být referenční pro vzorky artificiálního původu. Příkladem může být nová mezinárodní studie EHK (Report EurA1c 2016) o stanovení glykovaného hemoglobinu HbA1c, kde jsou testovány nativní a artificiální materiály v evropských laboratořích souběžně [16].
Strategie pracovní skupiny EFLM a hodnoty APS-zásadní sdělení
V nově připraveném textu o strategii EFLM [17], čerstvě uveřejněném zcela recentně je rozšířen způsob specifikace APS na podkladě klinických požadavků na dvě části:
- určení na základě klinických cílů a potřeb získaných přímým studiem dopadu laboratorních vyšetření na klinické cíle a potřeby
- určení na základě klinických cílů a potřeb nepřímým studiem dopadu výsledků laboratorních vyšetření pomocí klinických klasifikačních rozhodnutí, pomocí pravděpodobnostního počtu na základě poznatků „big data“ či simulací a analýz rozhodování atd.
Tento nový aspekt zaměření na kvalitu informací získaných statistickým studiem velkých souborů dat a jejich simulací by měl umožnit i diskriminaci specifikace APS na různých úrovních kvality metody měření - minimální, žádoucí a optimální).
Takový nový přístup umožní také výrobcům IVD pracovat na zlepšení kvality testů a vyšetření nad rámec jejich obchodních zájmů ve prospěch pacientů a medicíny. Obecně by měla být vždy navržená kritéria APS podložena důkazy a klinickým doporučením spolu s uvedením zdůvodnění a jeho zdrojem. Kooperace pracovníků laboratoří (ať už analytiků nebo laboratorních lékařů) s kliniky je nezbytná víc, než kdy jindy.
Současný stav problematiky analytických požadavků na hodnocení laboratoří a metod v programech EHK lze tedy shrnout následovně:
- jsou dobře známy výsledky jen pro málo analytů a parametrů (základních analytů krevního séra, stanovení glykovaného hemoglobinu HbA1c, troponiny), a ani u nich není standardizace v plném rozsahu zajištěna, například u enzymů [14, 15]
- data analytické kvality, zjištěná ve speciálních stu-diích s použitím komutabilních materiálů jsou uvedená v dostatečné míře v recentních studiích [14, 15]
- v programech EHK je žádoucí používat v maximální možné míře harmonizovaných hodnot APSTE, odvozených z klinických požadavků, nebo biologických variabilit, protože State of the art hodnoty APS u standardizovaných metod jsou zcela obsoletní (nicméně v řadě programů, zejména firemních stále intenzivně využívané)
- komutabilita arteficiálních kontrolních materiálů by měla být ověřována pomocí oficiálně validovaných komutabilních nativních kontrolních materiálů pro každý vzorek, analyt a metodu [14, 16]
- uvedená strategie stanovení APS a hodnocení analytické kvality by měla být obecně respektována pracovníky klinických laboratoří jako závažný progres v této oblasti
Zatím problémy specifikace analytických požadavků na programy EHK dobře zapadají do kontextu legendárního Ioannidisova textu z roku 2005 o vysokém stupni nespolehlivosti (a neobjektivity) publikovaných dat. Bylo by ale velmi dobré tuto situaci zásadně změnit [18].
Střet zájmů: Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 31. 10. 2017
Adresa pro korespondenci
RNDr. Bedřich Friedecký, Ph.D.
Střelničná 1680
182 00 Praha 8
e-mail: friedecky@sekk.cz
Zdroje
1. Jones, G. R. Analytical performance specifications for EQA schemes-need for harmonization. Clin. Chem. Lab. Med., 2015, 53, p. 919-924.
2. Kenny, D., Fraser, C. G., Petersen, P. H., Kallner, A. Consensus Agreement. Strategies to set global analytical quality specifications in laboratory medicine Scand J Clin. Lab. Invest, 1999, 59, p. 585.
3. Panteghini, M., Sandberg, S. Defining analytical performance specifications 15 years after the Stockholm conference. Clin. Chem. Lab. Med., 2015, 53, p. 829-833.
4. Sandberg, S., Fraser, C. G., Horvath, A. R., Jansen, R., Jones, G., Oosterhuis, W. et al. Defining analytical performance specification: Consensus statement from the 1st strategic conference of the European Federation of Clinical Chemistry and Laboratory Medicin. Clin. Chem. Lab. Med., 2015, 53, p. 833-836.
5. Jones, G. R. D., Albarede, S., Kesseler, D., McKenzie, F., Mammen, J., Petersen, M. et al. Analytical performance specifications for external quality assessment-definitions and descriptions. Clin. Chem. Lab. Med., 2017, 55, p. 945-955.
6. Jones, G. R. Common performance specification in EQA-is it possible? EQALM Symposium, Bergen, Norway 2015. http://www.eqalm.org
7. Lippi, G., Banfi, G., Church, S., Cornes, M., De Carli, G., Grankvist, K. et al. Preanalytical quality improvement. In pursuit of harmony, on behalf of European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) working group for preanalytical phase (WG-PRE). Clin. Chem. Lab. Med., 2015, 53, p. 357-370.
8. Plebani, M., Astion, M. L., Barth, J. H., Chen, W., de Oliveira Caloro, C. A., Ibarz Escuer, M. et al. Harmonization of quality indicators in laboratory medicine. A preliminary consensus. Clin. Chem. Lab. Med., 2014, 52, p. 951-958
9. Ceriotti, F., Fernandez-Cale, P., Klee, G. G., Nordin, G., Sandberg, S., Streichert, T. et al. Criteria for assigning laboratory measurands to models for analytical performance specifications defined in the 1st EFLM strategic conferences. Clin. Chem. Lab. Med., 2017, 55, p. 189-194.
10. Carobene, A. Reliability of biological variation data available in an online database: need for improvement. Clin. Chem. Lab. Med., 2015, 53, p. 871-877.
11. Carobene, A., Marino, I., Guerra, E., Jonker, N., Barla, G., Barlett, W. A. et al. Biological variation estimates obtained from 91 healthy subjects for six electrolytes in serum. Ebiovar study of the EFLM working group on biological variation. Clin. Chem. Lab. Med., 2017, 55/Suppl1, S170.
12. Carobene, A., Roraas, T., Solvik, U., Sylte, M. S., Sandberg, S., Guerra, E. et al. Biological variation estimates obtained from 91 healthy study participants for 9 enzymes in serum. Clin. Chem., 2017, 63, p. 1141-1150.
13. Carobene, A., Marino, I., Coskum, A., Serteser, M., Unsal, I., Guerra, E. et al. The EuBivas project within - and between - subject biological variation data for serum creatinine using enzymatic and alkaline picrate methods and implications for monitoring. Clin. Chem., 2017, 63/9, p. 1527-1536.
14. Friedecký, B., Kratochvíla, J. Harmonizace programů externího hodnocení kvality v čase harmonizace výsledků laboratorních vyšetření. Klin. Biochem. Metab., 2017, 25(46)/2, p. 64-71.
15. Weykamp, C., Secchiero, S., Plebani, M., Thelen, M., Cobbaert, C., Thomas, A. et al. Analytical performance of 17 general chemistry analytes across countries and across manufacturers with INPUtS project of EQA organizers in Italy, the Netherlands, Portugal, United Kingdom and Spain. Clin. Chem. Lab. Med., 2016, 55, p. 203-211
16. Friedecký, B., Kratochvíla, J. Soudobá úroveň analytické kvality měření HbA1c v Evropě. Fons 2017,4 : 29-31.
17. Panteghini, M., Ceriotti, F., Jones, G., Oosterhuis, W., Plebani, M., Sandberg, S. et al. Strategies to define performance specifications in laboratory medicine: 3 years on from the Milan Strategic Conference. Clin. Chem. Lab. Med., 2017, DOI:org/10.1515/cclm-2017-0772.
18. Ioannidis, J. P. Why most published research findings are false? PLoS Med 2005,2/8:e124.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek EditoriálČlánek Porovnání různých elektroforetických systémů v laboratorní diagnostice monoklonálních gamapatiíČlánek Abstrakta posterůČlánek Jmenný rejstříkČlánek Sborník
ProgramČlánek Abstrakta přednášek
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2018 Číslo 2- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Význam výživy v léčbě nehojících se ran – prakticky a v kostce
-
Všechny články tohoto čísla
- Abstrakta posterů
- Jmenný rejstřík
- Editoriál
- Neurofilamenta u traumatického poškození mozku – současné znalosti
- Definice sepse a septického šoku
- Glykovaný albumin v krevním séru/plasmě. Stručný přehled současného stavu.
- Porovnání různých elektroforetických systémů v laboratorní diagnostice monoklonálních gamapatií
- Specifikace analytických požadavků v programech externího hodnocení kvality
-
Sborník
Program - Abstrakta přednášek
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Definice sepse a septického šoku
- Glykovaný albumin v krevním séru/plasmě. Stručný přehled současného stavu.
- Neurofilamenta u traumatického poškození mozku – současné znalosti
- Porovnání různých elektroforetických systémů v laboratorní diagnostice monoklonálních gamapatií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



