-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučení k diagnostice chronického onemocnění ledvin (odhad glomerulární filtrace a vyšetřování proteinurie)
České nefrologické společnosti ČLS JEP a České společnosti klinické biochemie ČLS JEP
Autoři: T. Zima; J. Racek; V. Tesař; O. Viklický; V. Teplan; O. Schück; J. Janda; B. Friedecký; Z. Kubíček; J. Kratochvíla; D. Rajdl; T. Šálek; M. Kalousová; J. Granátová
Vyšlo v časopise: Klin. Biochem. Metab., 22 (43), 2014, No. 3, p. 138-152
OBSAH
1. Definice a klasifikace chronického onemocnění ledvin
2. Vyšetření glomerulární filtrace- 2.1 Úvod
- 2.2.1 Metody vyšetření GF se sběrem moči
- 2.2.2 Metody měření GF bez sběru moči
- 2.3 Současný stav analytiky kreatininu a cystatinu C, analytické vlastnosti a problémy
- 2.3.1 Stanovení kreatininu
- 2.3.2 Stanovení cystatinu C
- 2.4 Doporučený postup pro odhad GF u dospělých
- 2.5 Doporučený postup pro odhad GF u dětí
- 2.6 Vyšetření GF při změně funkce ledvin ve stáří
- 2.6.1 Změny ve funkci ledvin ve stáří
- 2.6.2 Akutní poškození ledvin
- 2.6.3 Vyšetření u nemocných s chronickým onemocněním ledvin
3. Vyšetřování proteinurie
- 3.1 Úvod
- 3.2 Fyziologie vylučování bílkovin do moči
- 3.3 Klasifikace zvýšeného vylučování bílkovin do moči
- 3.4 Analytika a výsledky stanovení proteinů v moči
- 3.4.1 Základní pravidla
- 3.4.2 Stanovení albuminu a ACR
- 3.4.3 Stanovení celkových proteinů a PCR
- 3.4.4 Semikvantitativní stanovení albuminu a celkových proteinů testovacími proužky
- 3.4.5 Klasifikace proteinurie
- 3.4.6 Vyšetření dalších proteinů v moči
- 3.4.7 Hodnocení hematurie
- 3.5. Význam vyšetření proteinurie u chronických onemocnění ledvin
- 3.6 Doporučení pro vyšetření tubulární a prerenální proteinurie
Seznam zkratek
Literatura
1. Definice a klasifikace chronického onemocnění ledvin
Chronické onemocnění ledvin (CKD) je definováno jako funkční nebo strukturální abnormalita ledvin, která trvá déle než tři měsíce a má dopad na zdraví nositele. Kritéria pro CKD (jakékoliv z následujících přítomné déle než tři měsíce):
- přítomnost poškození ledvin nebo
- pokles funkce ledvin (pod 1,0 ml.s-1.1,73 m-2)
Ukazatele poškození ledvin jsou:
- Albuminurie: ≥ 30 mg/24 hodin nebo poměr albumin/kreatinin ≥ 3,0 mg/mmol (fyziologická albuminurie je < 1,0 mg/mmol kreatininu)
- Nález v močovém sedimentu (např. erytrocytární válce, leukocytární válce, granulované válce)
- Nález ukazující na renální tubulární poruchy = elektrolytové a jiné poruchy vnitřního prostředí způsobené tubulárními poruchami (např. renální tubulární acidóza, renální tubulární proteinurie)
- Histologický nález při biopsii
- Nález zjištěný zobrazovacími metodami (např. polycystické ledviny, hydronefróza způsobená obstrukcí)
- Anamnéza transplantace ledvin
Klasifikace (STAGING)
- Pacient s CKD by měl být klasifikován podle:
- Příčiny (např. diabetické CKD, CKD způsobené amyloidózou)
- Kategorie GF (G1, G2, G3a, G3b, G4, G5)
- Kategorie albuminurie (A1, A2, A3)
Tab. 1. Kategorie CKD podle GF - podle [1] ![Kategorie CKD podle GF - podle [1]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/76f868f7fd78ef2a29137c4c1e9b5fd1.png)
Není-li přítomno poškození ledvin, kategorie G1a G2 nesplňují kritéria CKD. 2. Vyšetření glomerulární filtrace
2.1 Úvod
Funkční vyšetření ledvin umožňuje posoudit, zda je funkce ledvin fyziologická či snížená, a určit stupeň tohoto snížení. K základním metodám patří vyšetření glomerulární filtrace (GF), kdy stupeň snížení GF slouží jako klasifikační marker stupně závažnosti poškození ledvin.
Glomerulární filtrace je (spolu s tubulární resorpcí a sekrecí) jedním ze základních mechanismů sloužících k udržení homeostázy vnitřního prostředí. Faktory rozhodující o filtraci v glomerulárních kapilárách jsou: rozsah kapilárního řečiště (velikost filtrační plochy), permeabilita kapilár a gradienty hydrostatických a onkotických tlaků přes kapilární stěnu.
Tab. 2. Kategorie CKD podle albuminurie a porovnání s proteinurií – podle [1]. ![Kategorie CKD podle albuminurie a porovnání s proteinurií – podle [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/9b81aff33b6504f714419bff790c7e1f.png)
V současné době měříme GF pomocí clearance endogenního nebo exogenního markeru filtrace. Všechny metody pro clearance jsou dosti složité, hlavním limitujícím faktorem je správný sběr moče. Proto je v klinické praxi GF nejčastěji odhadována ze sérové koncentrace kreatininu, popřípadě sérové koncentrace cystatinu C.
Tab. 3. Kategorie CKD podle GF a ACR sdružené do skupin se srovnatelnou prognózou – podle [1]: ![Kategorie CKD podle GF a ACR sdružené do skupin se srovnatelnou prognózou – podle [1]:](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f5f0434c1f603c3f16fb4712fe5e908f.png)
*)nebo bez CKD - nemá-li jiné známky poškození ledvin 2.2 Metody vyšetření glomerulární filtrace
2.2.1 Metody měření GF se sběrem moči
Renální clearance endogenního kreatininu (včetně korigované hodnoty)
U zdravého dospělého člověka clearance kreatininu (Ckr) pouze lehce přesahuje GF (o 10 až 20 %) v důsledku nevelké tubulární sekrece kreatininu v proximálním tubulu. U jedinců s chronickým renálním onemocněním (CKD 4 až 5) se tubulární sekrece kreatininu relativně zvyšuje (vzhledem k velmi snížené glomerulární filtraci) a v konečných stádiích chronického selhání ledvin může Ckr přesahovat GF o 100 i více procent. Renální clearance kreatininu se určuje na podkladě měření močového vylučování kreatininu (Ukr . V) ve sledovaném období a sérové koncentrace kreatininu Skr. Výpočet se provádí dle vzorce:
Kde je: Ukr ... koncentrace kreatininu v moči v µmol/l
V... objem moči vytvořený za sledovanou časovou jednotku v ml/s
Skr ... koncentrace kreatininu v krevním séru v µmol/l
Hodnota Ckr poskytuje lepší představu o GF než odhad na základě Skr, protože tato veličina není ovlivněna extrarenálními faktory působícími na hodnotu Skr. Jde o extrarenální vylučování kreatininu především střevem u jedinců v pokročilejším stadiu CKD (chronic kidney disease), změny distribučního prostoru kreatininu (zvláště u jedinců s velkými otoky), a zejména rozdíly v objemu svalové hmoty, event. i příjmu masa. Produkce kreatininu závisí též na funkci jater. V játrech je tvořen kreatin, který je uvolňován do cirkulace, vychytáván ve svalech, kde je neenzymaticky přeměněn na kreatinin. Hodnoty Ckr se přepočítávají na ideální tělesný povrch (1,73 m2).
Jak je zřejmé ze vzorce pro výpočet Ckr, je pro stanovení této veličiny nutný přesný sběr moči. Tato okolnost je v denní praxi často velkým problémem a chyby v neúplném sběru moči znemožňují posoudit správně Ckr. To je jedním z hlavních důvodů, proč řada kliniků raději volí odhad GF na podkladě hodnocení Skr nebo užije výpočtové metody.
Clearance inulinu
Při správném provedení poskytuje nejpravdivější hodnotu GF (inulin se v glomerulech volně filtruje, při průchodu tubuly se jeho množství nemění), vyžaduje však přesné a metodicky poměrně náročné laboratorní vyšetření za standardních podmínek hydratace.
Měření renální clearance inulinu je založeno na principu přesného měření vyloučeného množství inulinu do moči za časovou jednotku za podmínek stabilizované plasmatické koncentrace. Je nutný přesný sběr moči.
2.2.2 Metody měření GF bez sběru moči
Koncentrace kreatininu v séru
Hodnota sérového kreatininu je samotná nepřesně prediktivní. Významné je její užití ve výpočtových vzorcích pro stanovení GF či Ckr. Je ovlivněna množstvím svalové hmoty (rozdíl hodnot u mužů, žen a dětí, ale též s ohledem na věk, když ve stáří svalové hmoty ubývá) a příjmem proteinů a aminokyselin.
Stanovení kreatininu se provádí nejčastěji dvěma základními metodami:
- Stanovením kreatininu jako chromogenu Jaffého reakcí. Reakcí kyseliny pikrové v alkalickém prostředí vzniká oranžový komplex, který však není specifický pouze pro kreatinin; s kyselinou pikrovou reaguje také glukóza, kyselina močová, askorbát, acetacetát, pyruvát, ale i léky reagují jako kreatinin – např. cefalosporiny, trimetoprim, cimetidin.
- Enzymové stanovení kreatininu, které je specifičtější, avšak nákladnější.
Referenční metoda stanovení kreatininu
Referenční metodou stanovení kreatininu je plynová chromatografie s izotopovou dilucí a hmotnostní spektrometrií. Byly vytvořeny referenční materiály, od kterých se odvozují komerční soupravy pro stanovení kreatininu, které mají eliminovat nízkou specifičnost stanovení.
Posouzení GF na podkladě Skr (koncentrace kreatininu v séru) vychází ze zjištění, že mezi GF a Skr je významná hyperbolická závislost. S klesající GF stoupá Skr. Vzhledem k tomu, že závislost je hyperbolická (nikoli lineární), je vzestup Skr při poklesu GF z hodnot normálních k hodnotám středně sníženým relativně malý, a proto i významný pokles GF může uniknout rozpoznání na podkladě pouhého sledování Skr. Zvláště je toto důležité u pacientů se svalovou atrofií, malnutricí a závažnějším jaterním postižením. Zatímco hodnota interindividuální variability Skr je velká, malá intraindividuální variabilita dovoluje užít jeho stanovení při sledování vývoje onemocnění v čase.
Podrobnější statistická analýza této závislosti prokazuje, že citlivost Skr rozpoznat pokles GF pod dolní hranici normy se pohybuje okolo 60 %. Naproti tomu zvýšení Skr nad horní hranici normy u jedinců s normální hodnotou GF je relativně málo časté; specifičnost je tedy vysoká a přesahuje 90 %. Hodnota Skr není dostatečně validní pro určení GF, avšak slouží k základnímu nefrologickému vyšetření a vysoké hodnoty spolurozhodují o zahájení dialyzační léčby. Je doporučeno GF nehodnotit pomocí samotné sérové koncentrace kreatininu, ale za použití výpočtových metod pro odhad GF (viz následující kapitola).
Výpočtové metody odhadu GF na podkladě stanovení sérového kreatininu (eGF)
Cílem všech výpočtových vzorců je odhad glomerulární filtrace bez sběru moči. Přesný sběr moči představuje největší zdroj chyb u clearance kreatininu. Další možnou chybou je nesprávné stanovení kreatininu (viz kap. 2.3.1). Obecně platí, že malá chyba ve stanovení koncentrace kreatininu se projeví velkou chybou odhadu GF.
Hodnota eGF podléhá stejným analytickým (interference) a biologickým (neadekvátní svalová hmota, malnutrice, jaterní postižení) limitům jako stanovení sérového kreatininu.
Výpočtové metody pro eGF vycházející ze stanovení sérového kreatininu je možno užít jen za podmínek stabilizované plazmatické koncentrace kreatininu. Při náhlých změnách renální funkce (např. v akutních stavech) jsou nepoužitelné.
Odhad clearance kreatininu dle Cockcrofta a Gaulta
Tento odhad je již považován za obsoletní a neměl by se tudíž užívat.
Odhad GF pomocí vzorců MDRD a CKD-EPI
V posledních letech se celosvětově nejvíce doporučovalo používat pro eGF metodu vypracovanou na podkladě velké multicentrické studie, která sledovala vliv příjmu bílkovin v potravě na rychlost progrese renálních onemocnění. Tato studie se označuje MDRD. Na podkladě této studie byl krokovou multivariantní regresní analýzou odvozen následující vzorec, uvedený jako R3.
MDRD rovnice ovšem zahrnovala pouze pacienty s chronickým onemocněním ledvin a měla i další nevýhody. Proto byla stejnými autory snaha vytvořit rovnici novou, která bude použitelná i pro zdravou populaci. Výsledkem byla v roce 2009 rovnice CKD-EPI. Rovnice CKD-EPI poskytuje výsledky nejbližší reálné GF a je doporučené ji v současnosti preferovat před rovnicí MDRD.
V níže uvedených rovnicích R2 až R10 jsou použity následující zkratky a symboly:
věk ... roky
Skr ... koncentrace kreatininu v krevním séru v µmol/l
Surea ... koncentrace močoviny v krevním séru v mmol/l
Salb... koncentrace albuminu v krevním séru v g/l
Scyst … koncentrace cystatinu C v krevním séru
(ženy) a (černá populace) ... příslušný koeficient se použije pouze pro odpovídající populaci
Rovnice MDRD
Vzorec pro výpočet eGF [ml.s-1.1,73 m-2]
2,83 . (Skr . 0,0113)-0,999 . věk-0,176 . (Surea . 2,8)-0,170 . (Salb . 0,1)0,318 . 0,762 (ženy) . 1,18 (černá populace)
R2
jednoduchou úpravou dostaneme:
100,6339 . Skr-0,999 . věk-0,176 . Surea-0,170 . Salb0,318 . 0,762 (ženy) . 1,18 (černá populace)
Následně bylo mezinárodně doporučováno používat zjednodušenou rovnici MDRD se čtyřmi členy:
Vzorec pro výpočet eGF [ml.s-1.1,73 m-2]
3,1 . (Skr . 0,0113)-1,154 . věk-0,203 . 0,742 (ženy) . 1,21 (černá populace)
R3
jednoduchou úpravou dostaneme:
547,1535 . Skr-1,154 . věk-0,203 . 0,742 (ženy) . 1,21 (černá populace)
V souvislosti se zaváděním standardizované metody stanovení kreatininu, kdy výsledky měření jsou metrologicky návazné na mezinárodní standard, a použitím metody stanovení ID-MS z roku 2005 je rovnice modifikována a v této podobě platí pouze při stanovení kreatininu standardizovanou metodou:
Vzorec pro výpočet eGF [ml.s-1.1,73 m-2]
2,92 . (stand Skr . 0,0113)-1,154 . věk-0,203 . 0,742 (ženy) . 1,21 (černá populace)
R4
jednoduchou úpravou dostaneme:
515,3832 . (stand Skr)-1,154 . věk-0,203 . 0,742 (ženy) . 1,21 (černá populace)
U vypočtených hodnot vyšších než 1,5 ml.s-1.1,73 m-2 se doporučuje uvádět hodnotu ≥ 1,5 ml.s-1.1,73 m-2 vzhledem k nepřesnosti rovnice v této oblasti. Hodnoty 1,0 až 1,5 ml.s-1.1,73 m-2 je nutno individuálně hodnotit ve vztahu ke klinickému obrazu. Hodnota eGF dle MDRD nižší než 1,0 ml.s-1.1,73 m-2 je považována za hodnotu patologickou.
Rovnice CKD-EPI z roku 2009 (kreatinin) 
Tyto metody poskytují pravdivější odhad GF než Skr nebo metoda Cockcroftova a Gaultova. Obecně je eGF pomocí rovnice MDRD a CKD-EPI ze sérového kreatininu doporučována jako základní metoda. Doporučuje se, aby lékaři dobře chápali principy odhadu GF pomocí výpočtů založených na Skr a nepoužívali tyto metody odhadu GF u nestabilizovaných pacientů.
Odhad GF pomocí vzorců MDRD a CKD-EPI není vhodné používat u dětí a těhotných.
Pro odhad GF ze sérového kreatininu u dětí a mladistvých je doporučeno používat rovnici podle Schwartze z roku 1987 a 2009:
Vzorec pro výpočet eGF [ml.s-1.1,73 m-2]
Kde je: F ... faktor dle následující tabulky:
Výpočtové metody odhadu GF na podkladě stanovení koncentrace cystatinu C v séru
Cystatin C je mikroprotein (Mr 13,5 kDa), který patří do velké rodiny inhibitorů cysteinových proteáz. Tato látka je vytvářena všemi jadernými buňkami, volně prochází glomerulární membránou a je zachycována tubulárními buňkami. Molekuly cystatinu C, které pronikly do nitra tubulárních buněk, jsou v jejich nitru metabolizovány, takže do peritubulární extracelulární tekutiny žádný cystatin C nepřechází. Výsledkem toho je, že očišťování extracelulární tekutiny od cystatinu C je přímo úměrné GF.
Pro odhad glomerulární filtrace ze sérového cystatinu C u dospělých lze využít rovnici CKD-EPI z roku 2012, cystatin C musí být stanoven metodou metrologicky navázanou na referenční materiál DA ERM 471/IFCC, viz dále rovnice R7:
<i>Rovnice CKD-EPI z roku 2012 (cystatin C)</i> 
Kombinovaná rovnice pro odhad ze sérového krea-tininu a cystatinu C (rovnice R8). Kreatinin i cystatin C byly měřeny standardizovanými metodami s metrologickou návazností výsledků měření.
<i>Rovnice CKD-EPI z roku 2012 (kreatinin a cystatin C)</i> 
Pro stanovení cystatinu C a odhadu GF podle jeho sérové koncentrace platí:
- Hodnota eGF má vyšší výpovědní hodnotu, než samotná hodnota cystatinu C.
- Výsledky stanovení cystatinu C v séru a hodnoty eGFcys by se měly vydávat společně.
- K výpočtu eGFcys se má používat rovnice CKD-EPI 2012.
- Výsledky cystatinu C a eGF se mají uvádět na dvě desetinná místa.
V pediatrii lze aplikovat výpočet eGF z cystatinu C (rovnice R9, [1]):
1,178 . (Scyst)-0,931 [ml/s] R9
Sérové koncentrace cystatinu C (Scyst) jsou v průběhu dne téměř konstantní.
Cystatin C by měl být využit zejména v následujících situacích:
- U pacientů, kteří ztratili svalovou hmotu (nemají adekvátní svalovou hmotu vzhledem ke svému věku pohlaví a rase), např. při dlouhodobé imobilizaci, svalové dystrofii, malnutrici či ztrátě významné části končetiny.
- K potvrzení chronického onemocnění ledvin: GF pod 1,0 ml.s-1.1,73 m-2 podle odhadu ze sérového kreatininu, zejména nejsou-li přítomné markery poškození ledvin.
- U stavů, kde koncentrace kreatininu v séru je významně ovlivněna (těhotné, generalizované otoky, malé děti, rychlé změny stavu aj.)
Cystatin C je lepší prediktor kardiovaskulárních příhod a mortality než kreatinin.
Výpočet GF pomocí koncentrace cystatinu C v séru nelze použít při podávání glukokortikoidů (zvyšují koncentraci cystatinu C v závislosti na dávce), u pacientů s nekompenzovanou hypertyreózou (zvýšení cystatinu C) či hypotyreózou (snížení cystatinu C), u pacientů s progresí melanomu, lymfoproliferativních procesů a kolorektálního karcinomu (zvýšení cystatinu C). Řada prací nasvědčuje tomu, že sérové hladiny cystatinu C se zvyšují při malém poklesu GF dříve než Skr, a proto je tato látka považována za citlivější indikátor mírného poklesu GF. Za normálních okolností se tedy veškerý profiltrovaný cystatin zpětně vstřebává, jeho nález v definitivní moči ukazuje na tubulopatii. V pediatrii lze stanovením cystatinu C v krvi plodu posoudit funkci jeho ledvin - cystatin C totiž oproti kreatininu neprochází fetoplacentární bariérou (krev plodu je možno získat kordocentézou při amnioskopii). Výhodou stanovení cystatinu C u dětí je nezávislost jeho hladiny na věku resp. tělesné výšce, což je zásadní rozdíl proti hladině sérového kreatininu, která je u dětí významně závislá na tělesné výšce.
Izotopové metody vyšetření GF – 99mTc-DTPA (diethyl-triaminopentaoctová kyselina), 51Cr-EDTA (ethylen-diaminotetraoctová kyselina), 125I-thalamát
Radionuklidové metody používané k vyšetření renálních funkcí umožňují posoudit vylučování izotopem značených látek z organismu ledvinami. Rychlost poklesu aktivity v plazmě je dána velikostí GF, resp. tubulární sekrece. Při dynamické scintigrafii je také možnost posoudit odděleně funkci pravé a levé ledviny. V klinické praxi však tyto metody užívány nejsou.
2.3 Současný stav analytiky kreatininu a cystatinu C, analytické vlastnosti a problémy
2.3.1 Stanovení kreatininu
Měření kreatininu v séru je nutné provádět metodami o dostatečné specifičnosti, metrologicky návaznými na mezinárodní referenční materiál SRM-NIST 967 [2,3].
Metody stanovení mají vykazovat co nejnižší hodnotu bias a ta má být stanovena srovnáním s referenční metodou hmotnostní spektrometrie ID-GC(LC)/MS. Doporučuje se vydávat výsledky kreatininu při použití jednotky µmol/l zaokrouhlené na celá čísla. Výsledky eGF (ml.s-1.1,73 m-2) pak mají být vydávané zaokrouhlené na dvě desetinná místa. Výsledky eGF nižší než 1 ml.s-1.1,73 m-2 mají být v laboratorním výsledkovém protokolu označeny slovním komentářem snížená hodnota.
Návaznost k mezinárodním referenčním materiálům a referenčním metodám je popsána v materiálech JCTLM, uvedených na webových stránkách www.bipm.org nebo www.ifcc.org. Ideální by bylo používat enzymatické rutinní metody stanovení, které vykazují nejlepší preciznost, nejnižší bias a nejnižší zatížení interferencemi [4, 5].
Pokud se z ekonomických důvodů používá Jaffého metoda, je minimálním požadavkem na ni verifikace její metrologické návaznosti na referenční materiál (SRM 967) a referenční metodu (ID-GC/MS). To znamená, že Jaffého metoda musí být navíc matematicky korigována pomocí odečtu hodnoty pseudokreatininových chromogenů.
Bias stanovení je kritický pro výpočet eGFkrea. Bias stanovení kreatininu má být stanoven jako diference od IDMS metody.
Doporučení IFCC k zlepšení kvality (snížení nejistoty) hodnot výpočtu eGF předpokládá dosažení preciznosti měření CV ≤ 2,2 % a hodnoty bias pro interval koncentrací 80 až 133 µmol/l; b < 4,4 µmol/l. To odpovídá hodnotě b = 5,5 % (pro 80 µmol/l) a b = 3,3 % (pro 133 µmol/l).
Za těchto podmínek nepřesáhne odhad nejistoty výpočtu eGF hodnotu uc = 10 % [6].
Pokud uvažujeme použití korigované Jaffého metody a mezinárodně validovaného systému měření, lze učinit v současnosti závěr, že problémy standardizace stanovení kreatininu v séru a výpočtu eGF jsou vyřešeny a požadavky doporučení kliniků v nefrologii a diabetologii jsou splněny. Při stanovení kreatininu v moči lze enzymatické a Jaffého metody považovat za rovnocenné.
Referenční intervaly sérového kreatininu
Ke stanovení jejich hodnot byla použita metaanalytická studie [4]. Byly vyhodnoceny údaje databáze Medline za posledních dvacet let. Autoři vybrali z velkého počtu dat jen ty studie, které měly exaktně definované soubory referenčních jedinců a které používaly metody s prokázanou návazností na referenční metodu ID-GC(LC)-MS.
Hodnoty byly určeny pro věk 18 až 64 let:
Muži: 64 (63 - 66) až 104 (99 - 107) µmol/l
Ženy: 49 (46 - 55) až 90 (83 - 103) µmol/l
Hodnoty v závorkách představují 90% intervaly spolehlivosti referenčních mezí určené z 2,5 a 97,5 percentilu.
2.3.2 Stanovení cystatinu C
Stanovení cystatinu C v séru je nezbytné provádět pouze metodou, jejíž pracovní kalibrátor je metrologicky návazný na mezinárodní referenční materiál ERM DA 471/IFCC [7]. Použití nestandardizovaného stanovení cystatinu C bez metrologické návaznosti pracovního kalibrátoru na ERM-DA 471/IFCC je zcela obsoletní.
Přesto není tato standardizace cystatinu C pomocí nového referenčního materiálu u některých metod ně-kterých výrobců doposud provedena.
Preciznost měření lze při měření koncentrací kolem 1 mg/l charakterizovat hodnotou CV = 3 až 5,6 % a při měření v koncentračním intervalu 2 až 4 mg/l cystatinu C je hodnota CV = 1,1 až 3,5 %.
2.4 Doporučený postup pro odhad GF u dospělých
Na základě současných poznatků Česká nefrologická společnost ČLS JEP a Česká společnost klinické biochemie ČLS JEP doporučují pro výpočet odhadu glomerulární filtrace používat rovnici CKD-EPI pro kreatinin (R5).
2.5 Doporučený postup pro odhad GF u dětí
Na základě současných poznatků Česká pediatrická společnost, Česká nefrologická společnost a Česká společnost klinické biochemie ČLS JEP doporučují pro výpočet odhadu glomerulární filtrace u dětí používat rovnici podle Schwartze, kterou je možné použít do 18 let věku (R6).
Z praktického hlediska se u dětí a dorostu běžně používá stanovení tzv. maximální koncentrace sérového kreatininu pro jedince dané tělesné výšky Skr(max) - to je poslední ještě normální hladina sérového kreatininu při dolní hranici glomerulární filtrace (což je 1,5 ml.s-1.1,73 m-2):
Skr(max) = výškacm . F [µmol/l] R10
F je faktor lišící se dle pohlaví a věku dítěte následujícím způsobem:
Vychází se ze Schwartzova vzorce a za eGF se dosazuje poslední ještě normální hodnota eGF = 1,5 ml.s-1.1,73 m-2 resp. 90 ml.min-1.1,73 m-2.
Pro orientační odhad hladiny sérového kreatininu má znalost Skr(max) značný praktický význam, např. u tříletého dítěte s výškou 100 cm je maximální hodnota Skr pouze 54 µmol/l, u dítěte dvouletého s výškou 86 cm ale pouze 46,5 µmol/l!
Přestože jsou enzymatické a neenzymatické metody považovány za přijatelné pro stanovení kreatininu u pediatrických pacientů, enzymatické metody jsou obecně preferovány.
2.6 Vyšetření GF při změně funkce ledvin
Vyšetření glomerulární filtrace je relativně snadné a přesné za standardních podmínek. V klinické praxi se však stále více setkáváme s nutností určit hodnotu GF za změněných podmínek.
2.6.1 Změny ve funkci ledvin ve stáří
Od 40 let věku nastává pozvolný pokles GF (přibližně o 0,17 ml.s-1.1,73 m-2 za 10 let života), která ve věku 80 až 90 let dosahuje přibližně poloviční hodnoty proti jedincům mezi 20 a 30 roky. Tento pokles GF je zřejmě důsledkem poklesu průtoku krve ledvinou. Vedle neschopnosti ledvin starších jedinců vytvářet dostatečně hypertonickou moč je nutno přihlédnout k další důležité skutečnosti, že nejsou schopni dostatečně rychle vyloučit podanou vodní nálož.
2.6.2 Akutní poškození ledvin
Akutní poškození ledvinné tkáně se vyvíjí hodiny až dny a časnou diagnostikou a účinnou léčbou můžeme tíži poškození významně ovlivnit. Naprostá většina nemocných je nyní hospitalizována na jednotkách intenzivní péče či anesteziologicko-resuscitačních odděleních, která umožňují přesnou monitoraci stavu nemocných včetně biochemických parametrů a měření hodinové diurézy. To umožnilo vypracovat nová kritéria pro hodnocení poškození funkce ledvin a místo označení akutní selhání ledvin (ASL) je nově užíván termín acute kidney injury (AKI), akutní poškození ledvin. Vzhledem k obtížnosti přesného měření glomerulární filtrace byly vybrány pro základní laboratorní charakteristiku definující stádia poškození ledvin hodnoty sérového kreatininu a diurézy. Stádia poškození ledvin jsou rozdělena dle RIFLE kritérií (2004) a AKIN (2007) dále dle tíže poškození do tří stadií. Kritéria RIFLE a stádia akutního poškození ledvin dle nové klasifikace jsou v přehledu uvedena v následující tabulce.
Pokles (vzestup) se týká vždy změny od výchozí hodnoty, tj. hodnoty GF či Skr před příhodou, vedoucí k poškození ledvin.
Měření GF u nemocných s AKI může být obtížné a nepřesné, neboť se mohou rychle měnit parametry vnitřního prostředí, hydratace a perfuze. Často je nemožný přesný sběr moči či je přítomna oligurie nebo dokonce anurie. Vyšetření pomocí kreatininové clearance se provádí při diuréze větší než 500 ml/24 h, výpočtové vzorce lze užít i bez ohledu na diurézu. V poslední době se věnuje pozornost užití cystatinu C, který je vhodnější při rychlých změnách složení tělesných tekutin.
2.6.3 Vyšetření u nemocných s chronickým onemocněním ledvin
Dlouhodobé monitorování funkce u nemocných s CKD3 je velmi důležité z hlediska určení rychlosti progrese onemocnění i úspěšnosti léčebných postupů. Vzhledem k možnosti nepřesností při sběru moči doporučujeme užít metod výpočtových a dle možnosti přímého měření se sběrem za standardních kontrolovaných podmínek. Vyšetření reziduální GF u pacientů v predialyzačním období a u dialyzovaných a transplantovaných pacientů má být prováděno na specializovaných pracovištích.
Při vyšetření u transplantovaných si musíme být vědomi, že vyšetřujeme pouze jednu ledvinu (reziduální funkce vlastních ledvin bývá většinou velmi nízká a je přítomna pouze u časných a preemptivních transplantací). Po transplantaci ledviny běžně postačuje stanovení sérového kreatininu, protože se sledují trendy jeho změn. Po transplantaci se stanovuje denně v průběhu první hospitalizace a následně při každé ambulantní kontrole. V delším odstupu po transplantaci provádíme vyšetření GF podobně jako u jiných nemocných s CKD.
Tab. 4. Kritéria RIFLE a stádia akutního poškození ledvin dle nové klasifikace: 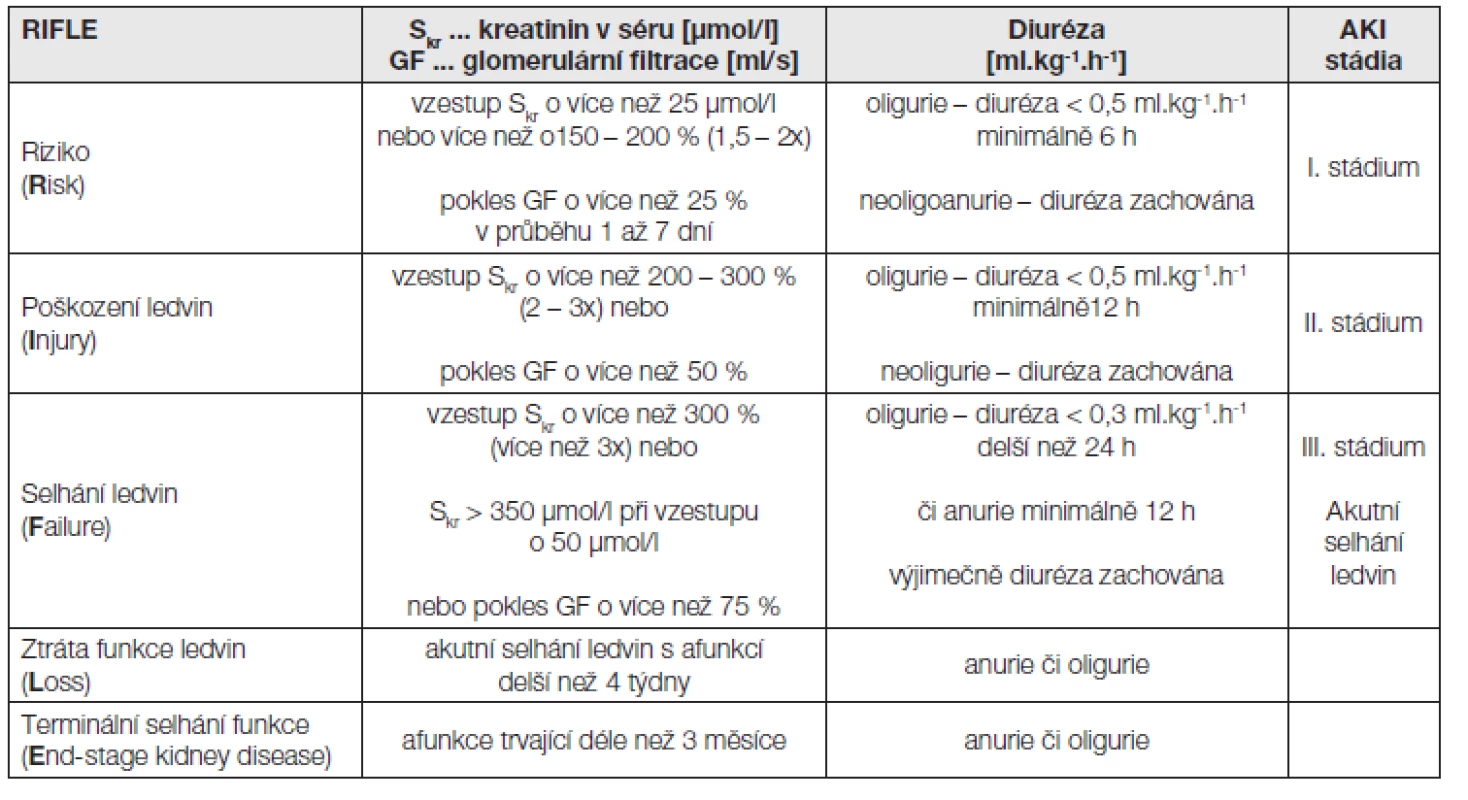
Zvláštní pozornost je třeba věnovat přesnému vyšetření glomerulární filtrace u živého potencionálního dárce. Při vyšetření renální funkce u žijícího dárce ledvin je třeba ověřit, že je GF>1,33 ml/s/1,73 m2 u dárců mladších 50 let. Pro posouzení funkce ledvin u žijících dárců se vysloveně nehodí rovnice MDRD, a proto má být používána rovnice CKD-EPI. Při hraničních nálezech je nutné vyšetřit GF metodami nezávisejícími na stanovení kreatininu. Bližší informace jsou k dispozici v [8].
Přesné stanovení GF je rovněž nezbytné pro indikaci kombinovaných transplantací ledviny s dalším orgánem, kdy metody závisející na kreatininu nejsou vhodné.
Tab. 5. Doporučená frekvence sledování nemocného podle hodnoty GF a ACR [1]. ![Doporučená frekvence sledování nemocného podle hodnoty GF a ACR [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/62c5f031ec896331aa5e3cc96e5c8fef.png)
3. Vyšetřování proteinurie
3.1 Úvod
Vyšetření močových bílkovin stále zůstává jedním ze základních vyšetření v nefrologii. Nezastupitelné místo má jak v časné diagnostice nemocí ledvin, tak v monitorování jejich aktivity, odpovědi na léčbu a odhadu rizika vývoje selhání ledvin i kardiovaskulárního rizika. Současná diagnostika je založena na vyšetření celkové bílkoviny a albuminu v moči, méně často je vyšetřována močová exkrece jednotlivých dalších močových proteinů. V poslední době se doporučuje stanovovat poměr bílkovina/kreatinin (PCR) nebo častěji albumin/kreatinin (ACR) v náhodném vzorku moči (nejlépe v prvním ranním vzorku) – viz Tabulka 2. Pro včasné odhalení počínajícího postižení ledvin u diabetiků a hypertoniků má význam stanovení albuminu. Pojem mikroalbuminurie recentní KDIGO2012 doporučují přestat používat, protože jakákoliv albuminurie představuje riziko vzniku kardiovaskulárních komplikací. Pro diagnostiku tubulární a prerenální proteinurie musí být v moči kvantitativně stanoven vhodný mikroprotein, nejlépe α1-mikroglobulin nebo cystatin C, nebo prokázán kvalitativně protein způsobující prerenální proteinurii – myoglobin, hemoglobin, volné lehké řetězce imunoglobulinů.
3.2 Fyziologie vylučování bílkovin do moči
Glomerulární kapilární stěna (zejména glomerulární bazální membrána) efektivně brání průniku bílkovin v závislosti na jejich molekulové hmotnosti (velikosti), náboji (usnadňuje vylučování kationických a znesnadňuje vylučování anionických bílkovin) a tvaru. Bílkoviny s molekulovou hmotností větší než albumin (69 kD, efektivní průměr 3,6 nm) pronikají do moči velmi omezeně, zatímco se snižující se molekulovou hmotností a efektivním průměrem se filtrace dané makromolekuly progresivně zvyšuje (selektivita podle velikosti event. tvaru molekuly).
Vzhledem k bohaté přítomnosti proteoglykanů (zejména heparansulfátu) v glomerulární bazální membráně, které fungují jako polyanionty, pronikají do moči nejsnáze bílkoviny s převahou bazických aminokyselin (chovají se jako polykationty). Většina plazmatických bílkovin (např. albumin) se za fyziologického pH chová jako polyanionty.
Nízkomolekulární bílkoviny, které jsou volně filtrovány v glomerulech, jsou účinně resorbovány a následně katabolizovány v proximálním tubulu a jejich koncentrace v moči jsou minimální. Zdravými ledvinami při běžném průtoku krve 1,2 l/min proteče cca 40 až 45 kg albuminu denně, z tohoto množství se do ultrafiltrátu dostává asi 2 až 3 g albuminu; většina profiltrovaného albuminu (99 %) je ale katabolizována v tubulech, takže močí se fyziologicky vyloučí méně než 30 mg albuminu denně. Nejvýznamnější součástí tzv. fyziologické proteinurie je tzv. Tammův-Horsfallův protein (uromodulin) – mukoprotein, který je secernován tubulárními buňkami v tlusté části vzestupného raménka Henleho kličky (cca 30 až 50 mg/24 h). Dalšími složkami jsou albumin, IgG a sekreční IgA a volné polyklonální lehké řetězce imunoglobulinů.
Při běžné svalové aktivitě nepřesáhne fyziologická proteinurie 50 až 80 mg/24 h, při větší svalové aktivitě, prolongované ortostáze a sníženém příjmu tekutin může být vyšší – horní hranice fyziologické proteinurie je arbitrárně definována na 150 mg/24 h.
Podle posledních prací je permeabilita glomerulární kapilární stěny podstatně vyšší, než se obecně předpokládá. Vzhledem k velmi efektivní tubulární resorpci je však v moči zdravých osob přítomno pouze minimální množství albuminu.
3.3 Klasifikace zvýšeného vylučování bílkovin do moči
Z hlediska etiologie lze proteinurii dělit do několika základních skupin (Engliš, 2007; Žabka, 2007):
a. Funkční proteinurie je přechodná proteinurie, která se může vyskytnout u osob se zdravými ledvinami, např. při těžší práci nebo cvičení, při emočním stresu. Mechanismus této glomerulární proteinurie je pravděpodobně hemodynamický, je tedy nejspíše glomerulárního původu. Hemodynamickou příčinu má zřejmě také tzv. ortostatická proteinurie, která se vyskytuje u asi 2 až 5 % mladých, jinak zdravých jedinců, častěji mužů, a je charakterizována malou proteinurií (zpravidla menší než 1 g/24 h) vstoje a nezvýšenou proteinurií vleže. Je-li zvýšena i proteinurie v nočním vzorku (tj. z doby, kdy pacient ležel), je nutno vyloučit organické onemocnění ledvin.
b. Prerenální proteinurie je vyvolána zvýšenou plazmatickou koncentrací nízkomolekulárních, snadno filtrovatelných proteinů, jejichž filtrace překročí resorpční kapacitu proximálního tubulu, např. vylučováním lehkých řetězců imunoglobulinů u některých monoklonálních gamapatií, myoglobinu u rhabdomyolýzy, hemoglobinu u akutní hemolýzy, lyzozymu u některých typů leukémie či β2-mikroglobulinu u některých malignit (zejména hematologických), také tkáňových katabolitů, event. proteinů akutní fáze.
c. Glomerulární proteinurie může být způsobena: a) ztrátou negativního náboje glomerulární bazální membrány (ztráta selektivity podle náboje); důsledkem je zejména albuminurie, jde tedy o tzv. selektivní proteinurii, typicky u tzv. nefrotického syndromu s minimálními změnami glomerulů; b) těžším poškozením glomerulární membrány se vznikem rozsáhlejších defektů, kterými procházejí i proteiny s velkou molekulovou hmotností (ztráta selektivity podle velikosti), např. IgG (tzv. neselektivní proteinurie).
d. Tubulární proteinurie vzniká a) při porušené zpětné resorpci profiltrovaných nízkomolekulárních bílkovin v proximálním tubulu; může být projevem tubulointersticiální nefropatie (např. při pyelonefritidě), při toxickém poškození (gentamycin, NSAID, rtuť, kadmium), ischemii, metabolických dysbalancích (hypokalémie, hyperkalcémie, hyperurikémie) nebo jako součást tzv. Fanconiho syndromu např. u mnohočetného myelomu, Wilsonovy choroby; b) na podkladě metabolického poškození – hyper-urikémie, hyperoxalurie, při obstrukční uropatii či c) při překročení resorpční kapacity buněk proximálního tubulu (viz odstavec Prerenální proteinurie).
e. Postrenální proteinurie je způsobena sekrecí bílkovin do moči ve vývodných močových cestách (krvácení, zánět); typická je přítomnost α2-makroglobulinu a IgM.
f. Arteficiální proteinurie je charakterizována přítomností cizorodé bílkoviny, kterou z nějakého důvodu pacient do moči přidal. Nejčastěji se jedná pro snadnou dostupnost o vaječný bílek. Průkaz se provádí elektroforeticky, případně imunochemicky.
Podle velikosti ztrát bílkovin do moči za 24 h se proteinurie dělí na malou (0,15 – 1,5 g/24 h), střední (1,5 – 3,5 g/24 h) a velkou (> 3,5 g/24 h).
3.4 Analytika a výsledky stanovení proteinů v moči
3.4.1 Základní pravidla
Podle doporučení KDIGO 2012 přichází v úvahu k diagnóze chronické renální choroby a k její klasifikaci a léčbě následující stanovení:
- kvantitativní stanovení albuminu a albumin-kreatininového kvocientu (ACR) v moči,
- kvantitativní stanovení celkového proteinu a protein-kreatininového kvocientu (PCR) v moči,
- event. orientační semikvantitativní stanovení proteinu testovacími proužky v moči.
Tyto tři základní uvedené testy jsou seřazeny podle klesající výpovědní schopnosti.
Několik základních pravidel k používání těchto vyšetření:
- Výsledky albuminu je doporučeno uvádět jako poměr ACR (mg/mmol) i jako koncentrace (mg/l).
- Výsledky celkového proteinu je doporučeno uvádět jako PCR (mg/mmol) i jako koncentrace (g/l).
- Preferují se jednorázové vzorky močí před vzorky časovanými.
- Pozitivní výsledky semikvantitativních stanovení albuminu a celkového proteinu je nezbytné potvrdit opakovanou kvantitativní analýzou v klinické laboratoři.
- Pokud se u náhodného vzorku stanoví hodnota ACR ≥ 3 mg/mmol, je zapotřebí vyšetření opakovat s použitím vzorku první ranní moče.
- Časované vzorky jsou zatížené prakticky neodstranitelnou chybou sběru. Doporučuje se je používat pouze v přísně indikovaných případech.
- Nejvyšší výpovědní hodnotu a současně nejnižší biologickou variabilitu vykazují vzorky první ranní moči.
3.4.2 Stanovení albuminu a ACR
Dominantní roli v analýze proteinů u chronické renální choroby zaujímá stanovení albuminu v moči. Albumin v moči je citlivějším a specifičtějším ukazatelem změn glomerulární permeability než celkový protein. Albumin navíc hraje významnou roli i v diagnostice srdečních chorob a při posouzení stavu diabetu. Hodnoty ACR stratifikují populaci do tří kategorií podle stupně renální choroby (viz výše).
U zdravé populace nepřesahuje koncentrace albuminu v moči hodnotu 30 mg/24 hodin, a proto také může být patologické zvýšení albuminu v moči (ACR) detekováno i při nezvýšeném množství celkového proteinu v moči, jehož stanovení je mnohem méně analyticky citlivé. Albumin vykazuje ve srovnání s celkovým proteinem významně vyšší analytickou citlivost a větší analytickou specifičnost. Hodnota ACR vykazuje nižší biologickou variabilitu než hodnoty albuminu v časovaných vzorcích a má rovněž vyšší výpovědní hodnotu. Doporučuje se zaokrouhlovat výsledek ACR na jedno desetinné místo [9].
Imunochemické metody stanovení albuminu (imunoturbidimetrie/imunonefelometrie) vykazují mez detekce 2 až 10 mg/l (pro srovnání: mez detekce celkového proteinu v moči pomocí stanovení testovacími proužky je asi 150 mg/l). Požadovaná mezilaboratorní reprodukovatelnost měření je CV < 15 %.
V roce 2012 popsala pracovní skupina IFCC pro standardizaci albuminu v moči současný stav referen-čního systému [10]. Za referenční metodu se považuje postup LC-MS/MS po předchozí tryptické digesci vzorku moči (metoda byla vyvinuta na Mayo Clinic).
V roce 2013 byla publikována studie, která srovnává výsledky stanovení albuminu v moči, dosažené imunoanalytickými metodami všech hlavních výrobců, s metodou LC-MS/MS [11]. Diference jsou významné. Přesahují 10 % u vzorků se zvýšenými koncentracemi albuminu a dosahují až 35 % u vzorků s koncentracemi albuminu kolem 15 mg/l.
Pro rutinní měření albuminurie je nejvhodnější skladování vzorků před analýzou v lednici při +2° až +8 °C a temperování vzorků před měřením na pokojovou teplotu k odstranění případných precipitací. Stabilita při této teplotě je minimálně 7 dní. Zamrazování se nedoporučuje, protože není dostatečně prostudovaná případná sorpce na stěny odběrových zkumavek ani jiné ovlivňující faktory.
3.4.3 Stanovení celkových proteinů a PCR
Metody stanovení celkového proteinu nejsou dostatečně standardizované. Není k dispozici mezinárodní referenční materiál. Výsledky měření jsou silně závislé na složení vzorku. Turbidimetrické a fotometrické metody, obecně k stanovení používané, vykazují mnohem vyšší analytickou citlivost k albuminu než ke globulinům. Metody také postrádají dostatečnou preciznost v oblastech nižších koncentrací a vykazují nižší úroveň mezilaboratorní preciznosti v důsledku diferencí výsledků mezi výrobci testovacích souprav, kterých je velké množství. V indikovaných případech je však zapotřebí preferovat stanovení PCR před ACR (například u monoklonálních gamapatií). Dostatečně podrobný přehled analytických metod je obsažen v citaci [12].
3.4.4 Semikvantitativní stanovení albuminu a celkových proteinů testovacími proužky
Semikvantitativní stanovení celkového proteinu testovacími proužky má jen orientační význam. Je málo citlivé, s nestandardizovanými barevnými škálami, rozdílnými u různých výrobců. Hodnota „1“ odpovídá u různých výrobců koncentraci 0,1 až 0,3 g/l proteinu. Albumin vykazuje mnohem vyšší citlivost při reakcích testovacích proužků než globuliny, což způsobuje velkou závislost výsledků měření na složení analyzovaných vzorků. Dalším zdrojem chybných výsledků je alkalické pH vzorku moči. Při vizuálním odečtu proteinurie testovacími proužky může navíc silně interferovat intenzivní zbarvení vzorku moči.
Nově se objevují testovací proužky, jimiž lze stanovit v režimu POCT albumin s dostatečnou citlivostí a dokonce i ACR. Dosud je však s nimi málo zkušeností a omezený počet studií.
U pacientů s pozitivním nálezem při vyšetření testovacím proužkem má být přítomnost proteinurie nebo albuminurie vždy ověřena kvantitativním stanovením poměru ACR nebo PCR.
3.4.5 Klasifikace proteinurie
U pacientů se dvěma nebo více pozitivními nálezy proteinurie při kvantitativním vyšetření má být diagnostikována perzistentní proteinurie a tito pacienti mají podstoupit další vyšetření (a event. léčbu) chronického onemocnění ledvin. Při monitorování proteinurie mají být používány kvantitativní metody.
Měření koncentrace albuminu v moči je důležité u nemocných s diabetem, s arteriální hypertenzí a ICHS.
U diabetiků vykazuje nález albuminurie riziko pro budoucí vznik kardiovaskulárních komplikací a odráží přítomnost diabetické nefropatie. Pacienti s diabetem by měli být testováni na přítomnost diabetického onemocnění ledvin jednou ročně. Screening by měl začít u pacientů s diabetem 1. typu 5 let po stanovení diagnózy diabetu a u pacientů s diabetem 2. typu ihned po stanovení diagnózy. Screening zahrnuje stanovení poměru albumin/kreatinin v prvním ranním vzorku moči. Vyšetření albuminu v moči sbírané 24 hodin se nedoporučuje, je však možné vyšetřit albuminurii ve vzorku moči sbíraném během klidu na lůžku v noci; výsledek je pak vydáván v µg/min. V praxi se však dává přednost vyšetření v jednorázovém vzorku moči, výsledek se vztahuje ke koncentraci kreatininu v moči (mg/mmol kreatininu). Vzhledem k vysoké intraindividuální variabilitě (až 30 %) by pro diagnózu albuminurie měly být pozitivní alespoň 2 ze 3 vzorků moče vyšetřených v průběhu 3 až 6 měsíců; vyšetření by nemělo být prováděno při současné infekci močových cest, po zvýšené fyzické námaze a při menses.
Diabetické onemocnění ledvin je přítomno ve formě incipientní diabetické nefropatie vždy, je-li prokázána albuminurie A2. Zlepšení metabolické kompenzace diabetu, uspokojivá korekce hypertenze a léčba inhibitory angiotenzin konvertujícího enzymu (ACEI) výrazně snižují riziko progrese postižení ledvin. Pacienti s albuminurií (i nediabetici) mají výrazně zvýšené kardiovaskulární riziko. Albuminurie je u těchto nemocných zřejmě markerem generalizované endotelové dysfunkce. V poslední době se ukazuje, že zvýšené renální i kardio-vaskulární riziko mají i osoby s tzv. vysokou normální albuminurií.
Na jiné než diabetické onemocnění ledvin by mělo být pomýšleno, pokud není přítomna diabetická retinopatie, je výrazně snížená nebo rychle klesající glomerulární filtrace, rychle roste proteinurie a/nebo se rozvíjí nefrotický syndrom, u refrakterní hypertenze, patologického močového sedimentu, při známkách systémového onemocnění a při poklesu glomerulární filtrace o více než 30 % do tří měsíců po zahájení léčby inhibitorem ACE.
Podrobněji viz společné doporučení České společnosti klinické biochemie a České diabetologické společnosti Diabetes mellitus - laboratorní diagnostika a sledování pacientů [13].
Tab. 6. Klasifikace proteinurie a albuminurie dle KDIGO 2012. Porovnání s albuminurií a proteinurií za 24 h viz také Tabulka 1. 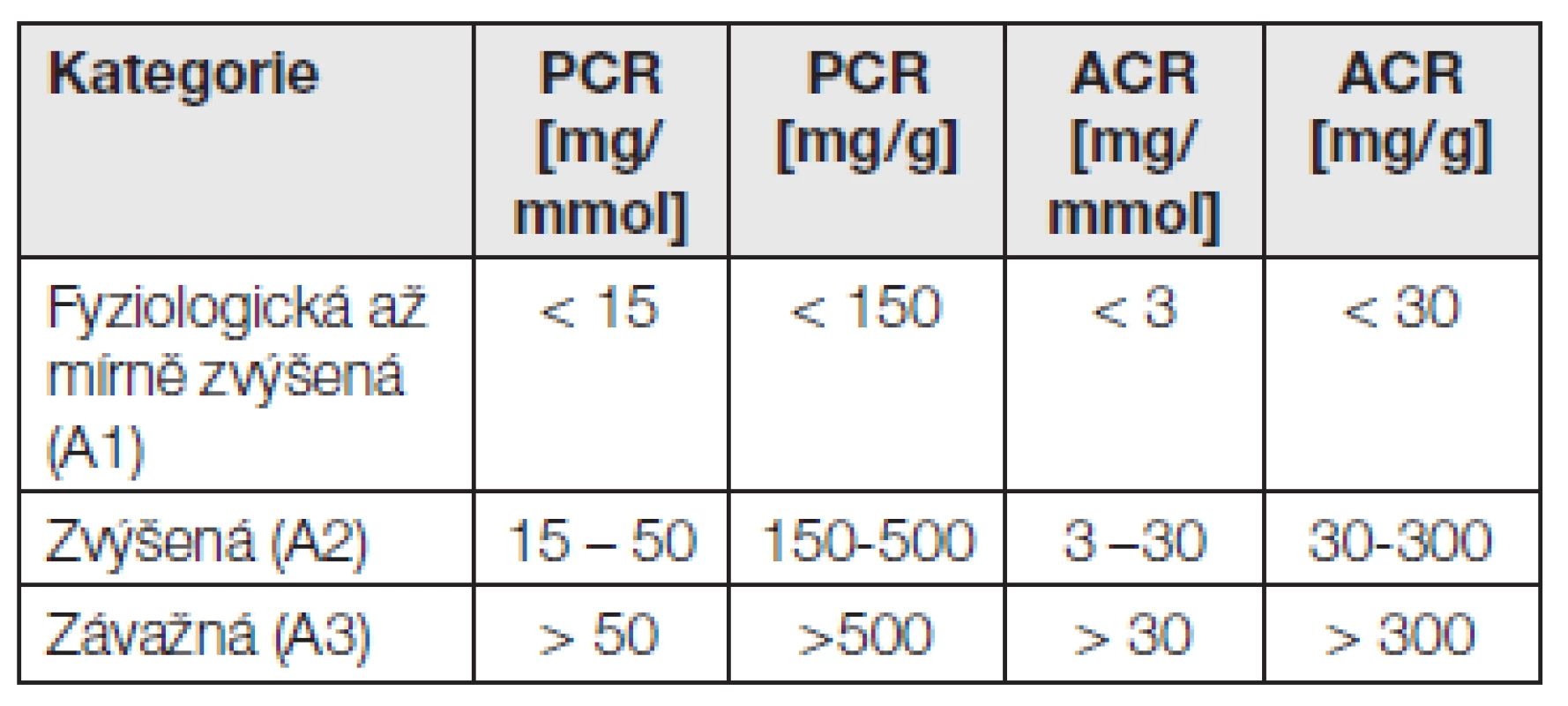
3.4.6 Vyšetření dalších proteinů v moči
Kvantitativní analýza
Pro hodnocení složení proteinurie je třeba vyšetřit i exkreci dalších proteinů v moči: α1-mikroglobulinu (dále jen a1m), imunoglobulinu G (IgG), α2-makroglobulinu (A2M), event. transferinu, cystatinu C, pro diferenciální diagnostiku tubulárního poškození může být cenným i stanovení N-acetyl-β-D-glukosaminidázy (NAG) v moči.
Zatímco a1m je možné vyšetřovat imunoturbidimetricky nebo imunonefelometricky, IgG, transferin a A2M v moči vzhledem k nízkým koncentracím pouze imunonefelometricky. V moči jsou a1m, IgG, transferin i A2M stabilní minimálně 1 týden při teplotě +2 až +8 °C, není doporučeno vzorky mrazit – po následném rozmražení klesá koncentrace IgG v moči až o 30 %. Stanovení β2-mikroglobulinu (b2m) v moči se nedoporučuje, neboť je nestabilní v kyselém prostředí.
Kvalitativní analýza
Kvalitativní pohled na proteinurii poskytují elektroseparační techniky, většinou založené na principu elektroforézy, event. v kombinaci s monoklonálními protilátkami. Poskytují informaci o přítomnosti některých vylučovaných proteinů – albuminu, transferinu, IgG, α1-mikroglobulinu, hemoglobinu, event. monoklonálních volných lehkých řetězců imunoglobulinů (mFLC) – u mFLC v závislosti na jejich koncentraci v séru, maximální kapacitě tubulární resorpce a renálních funkcích (pozn.: negativní nález v elektroforéze a event. imunofixaci moči nevylučuje přítomnost mFLC v séru nemocného). Umožňují dále diferencovat proteinurii na glomerulární, prerenální, smíšenou glomerulo-tubulární, event. tubulární. Tubulární proteinurie vzhledem k fyzikálně-chemickému složení proteinů (většinou glykoproteiny s obtížnější barvitelností v elektroforéze) jsou u některých typů elektroforéz (zejména u prosté elektroforézy v agarózovém gelu) hůře detekovatelné, resp. tyto metody neumožňují jejich časnou diagnostiku. Kvalitativní stanovení nezohledňuje míru koncentrace moče; hraniční nálezy mohou být u některých nemocných s koncentrovanou močí falešně pozitivní, naopak s velmi zředěnou močí falešně negativní. Hodnocení selektivity je velmi orientační, zejména u hraničních (neprůkazných) nálezů.
Je možné provádět elektroforézu moči v nativní nezahuštěné moči (rozdělení bílkovin podle jejich náboje) po barvení genciánovou violetí, elektroforézu močových proteinů v polyakrylamidovém gelu s přídavkem laurylsíranu sodného (sodium dodekasulfát, SDS), tzv. SDS-PAGE (rozdělení bílkovin podle jejich molekulové hmotnosti), v agarózovém gelu s přídavkem SDS, event. na alkalicky pufrovaném agarózovém gelu v kombinaci s monoklonálními protilátkami proti vybraným proteinům – b2m, a1m, albuminu, A2M, IgG, těžkým řetězcům imunoglobulinů a lehkým řetězcům imunoglobulinů (volným i vázaným).
Tab. 7. Rozhodovací limity vybraných proteinů v moči [14] ![Rozhodovací limity vybraných proteinů v moči [14]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3a7d2831ce0d64d03043bc7ba82c7d14.png)
Stabilita moči pro vyšetření elektroforézy je minimálně 1 týden při teplotě +2 až +8 °C, není doporučeno vzorky mrazit.
Metodou budoucnosti by mohlo být hodnocení proteomu v moči; proteomika moče je v současné době předmětem výzkumu, výsledky nejsou zatím aplikovatelné v běžné praxi.
Použití „indikátorových proteinů“
Kvalitativní (elektroforetické) techniky hodnotí nález na podkladě porovnání s typickými obrazy glomerulární selektivní a neselektivní, tubulární a glomerulotubulární proteinurie; vyžadují značnou zkušenost. Je doporučené hodnotit elektroforetický nález v kontextu klinickém a společně s dalšími nálezy. U elektroforézy kombinované s monoklonálními protilátkami jsou porovnávány proužky s imunoprecipitáty s odpovídajícími abnormálními frakcemi a typickými nálezy.
Kvantitativní hodnocení vychází z teorie tzv. „indikátorových proteinů“ (viz Hofmann et al., 1993 – 2000). Indikátorové proteiny jsou bílkoviny o různé velikosti molekuly, s různým chováním v ledvině, fyziologicky přítomné v definitivní moči ve velmi nízkých koncentracích (mg/l); jsou-li hodnoceny jako celek, jejich zvýšená exkrece močí ukazuje na určitý typ onemocnění ledvin a/nebo vývodných močových cest. α1-mikroglobulin je ukazatelem poškození tubulů a/nebo tubulointersticia ledviny, albumin je základním glomerulárním ukazatelem, IgG je ukazatelem glomerulárního poškození, zánětlivé syntézy v intersticiu ledviny nebo postrenální proteinurie; jako doplňkový ukazatel pro rozlišení mírné glomerulární a tubulární proteinurie slouží transferin v moči. α2-makroglobulin jako postrenální ukazatel je fakultativně využíván při hodnocení hematurie.
Při hodnocení jsou vzájemně porovnávány koncentrace vybraných močových proteinů, vyjádřené jako poměr ke koncentraci kreatininu v moči (event. poměr albumin k IgG a albumin k a1m) formou indexů, grafů, event. expertních systémů. Tento typ hodnocení na podkladě distribucí jejich exkrecí umožňuje rozlišit glomerulopatii primární (glomerulonefritidy), glomerulopatii sekundární (nejčastěji při diabetu a/nebo hypertenzi), pokročilé smíšené glomerulotubulární poškození, intersticiální poškození, čisté poškození tubulů, pre - a postrenální proteinurii.
Selektivitu glomerulární proteinurie hodnotí poměr IgG k albuminu (index ≤ 0,03 svědčí pro selektivní, vyšší než 0,04 pro neselektivní proteinurii). Hodnotit selektivitu proteinurie má v praxi význam především u nefrotické proteinurie v dg. minimal change nephritis (MCN). Albumin, IgG a a1m by měly tvořit alespoň 60 % celkové patologické proteinurie, při jejich nižším zastoupení tzv. proteinový gap ukazuje na prerenální proteinurii s přítomností nejčastěji volných lehkých řetězců imunoglobulinů, event. myoglobinu či hemoglobinu. Stanovení NAG v kombinaci s koncentrací albuminu v moči umožní rozlišit u tubulárního poškození, zda se jedná o akutní nebo chronické poškození tubulů.
Kvantitativní stanovení jednotlivých proteinů a jejich vzájemné zhodnocení umožňuje:
- časnou diagnostiku a diagnostiku patologického složení celkové proteinurie ještě fyziologické velikosti
- diferenciální diagnostiku mezi glomerulárním a tubulárním, akutním a chronickým typem poškození zejména u neznámého nemocného
- diagnostiku typu postižení zejména u mladších nemocných, s velkou proteinurií, měnící se atypicky v čase
- posoudit míru postižení tubulointersticia, a tak ovlivnit rozhodování mezi konzervativní a nekonzervativní terapií a posoudit nutnost neakutní biopsie u velmi pokročilých stadií postižení ledvin
- monitorování vývoje postižení v čase i hodnocení terapeutické odezvy.
3.4.7 Hodnocení hematurie
Stanovení typu hematurie, zejména rozlišení, zda se jedná o hematurii glomerulární nebo neglomerulární, pomáhá lékaři v diagnostice a diferenciální diagnostice onemocnění ledvin a/nebo vývodných močových cest (např. glomerulární hematurie může podpořit diagnózu glomerulonefritidy) nebo ho upozornit na event. rizika (např. neglomerulární hematurie u tubulointersticiální ne-fropatie může svědčit pro nádor vycházející z urotelu).
Jako tzv. „zlatý standard“ bylo považováno vyšetření erytrocytů ve fázovém kontrastu světelného mikroskopu. Pro glomerulární hematurii svědčí nález 80 a více % tzv. dysmorfních erytrocytů a/nebo 5 % akantocytů, event. erytrocytárních válců. Pro neglomerulární hematurii svědčí nález 80 a více % eumorfních erytrocytů. Hodnocení vyžaduje zkušenost, je vždy subjektivní a mezilaboratorní srovnatelnost výsledků je nízká. Nález závisí na kvalitě moči, resp. její buněčnosti, je doporučeno hodnotit moč do 15 min po mikci. Mezi jednoznačně glomerulárním a neglomerulárním nálezem je široká šedá zóna, ve které mohou být i klinicky závažné nálezy. Diagnostická citlivost pro glomerulární hematurii je při vyšetření erytrocytů ve fázovém kontrastu uváděna 53 – 74 % při specifičnosti 50 – 98 %.
Proteinové indexy mohou být metodou volby. V praxi lze použít tzv. albuminový index, hodnotící koncentraci albuminu v moči k celkové proteinurii [15]. Při zvolené hodnotě cut-off umožňuje rozlišit glomerulární typ hematurie (index ≥ 0,59) od neglomerulárního typu (index < 0,40). U smíšených hematurií nebývá hodnocení jednoznačné, je doporučováno opakované vyšetření. Diagnostická citlivost pro glomerulární hematurii je uváděna různými autory v rozmezí 71 – 97 % při specifičnosti 71 – 100 %. Hodnocení podle indexů indikátorových proteinů (albuminu, IgG, α1-mikroglobulinu, α2-makroglobulinu) [16] umožňuje na podkladě kombinace tří indexů odlišit postrenální typ hematurie od renálního glomerulárního a tubulointersticiálního, včetně hodnocení smíšených hematurií, s diagnostickou citlivostí vyšší než 90 % (93 – 97 %) při specifičnosti 80 – 85 % pro glomerulární hematurii. Hodnocení je limitováno koncentrací albuminu v moči alespoň 100 mg/l.
Tab. 8. Hodnocení typu hematurie podle indexů indikátorových proteinů [16] ![Hodnocení typu hematurie podle indexů indikátorových proteinů [16]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/113c26c8d4a637d76212771e5ad82b5b.png)
A2M = α2-makroglobulin; a1m = α1-mikroglobulin; IgG = imunoglobuliny G; A = albumin 3.5 Význam vyšetření proteinurie u chronických onemocnění ledvin
Velikost proteinurie resp. albuminurie má těsný vztah k riziku renálnímu (tj. riziku vývoje selhání ledvin) i kardio-vaskulárnímu (tj. riziku kardiovaskulárních komplikací) [17]. Redukce proteinurie léky inhibujícími systém renin-angiotenzin-aldosteron snižuje u pacientů s chronickým onemocněním ledvin obě rizika, opakované vyšetřování proteinurie je u těchto pacientů důležité pro monitorování efektu léčby a odhad prognózy a rychlosti vývoje selhání ledvin i rizika kardiovaskulárních komplikací.
Tzv. mikroalbuminurie má význam pro včasnou diagnostiku poškození ledvin u nemocných s diabetem a arteriální hypertenzí.
Nemocní s proteinurií vyšší než 3,5 g/24 h (tzv. ne-frotická proteinurie) jsou ohroženi vznikem nefrotického syndromu (s hypoproteinémií, hypoalbuminémií, hyperlipidémií – zejm. hypercholesterolémií, u těžších forem i hypertriacylglycerolémií, tendencí k trombotickým komplikacím) a otoky; dochází také ke ztrátám transportních plazmatických bílkovin s klinickými projevy. Hypoalbuminémie nekoreluje s velikostí albuminurie.
3.6 Doporučení pro vyšetření tubulární a prerenální proteinurie
Metoda vyšetření proteinurie testovacími proužky, založená na proteinové chybě acidobazického indikátoru, ale i většina metod pro stanovení proteinurie na podkladě měření zákalu po denaturaci proteinů stanovuje hlavně albumin. Při tubulární a prerenální proteinurii je nález často negativní. Tubulární a prerenální proteinurie bývají často kvantitativně nízké, i nižší než 150 mg/24 h (tedy v oblasti kvantitativně fyziologické proteinurie), proto nebývají někdy diagnostikovány.
Při podezření na prerenální proteinurii je třeba podle klinického stavu hledat příslušný protein (myoglobin, hemoglobin – oba dávají pozitivní reakci na krev pomocí testovacího močového proužku; volné lehké řetězce imunoglobulinů – imunofixační elektroforézou v moči, současně v séru hledáme M-protein a vyšetříme poměr volných lehkých řetězců kappa/lambda).
Při podezření na tubulární proteinurii je třeba v moči kvantitativně stanovit některý z tubulárních proteinů, nejlépe α1-mikroglobulin nebo cystatin C.
Seznam zkratek
a1m = α1-mikroglobulin
A2M = α2-makroglobulin
ACR = Poměr albumin/kreatinin
AKI = Acute kidney injury, Akutní poškození ledvin
AKIN = Acute Kidney Injury Network
ASL = Akutní selhání ledvin
b2m = β2-mikroglobulin
CAP = College of American Pathologists (USA), Společnost amerických patologů (nejvýznamnější organizátor EHK v USA)
CKD = Chronic kidney disease, Chronické onemocnění ledvin
CKD-EPI = Chronic Kidney Disease Epidemiology Collaboration
CRM = Certified Reference Material, Certifikovaný referenční materiál
D = Diuréza
DTPA = Kyselina diethyltriaminopentaoctová
EDTA = Kyselina ethylendiaminotetraoctová
eGF = Odhad glomerulární filtrace, Estimated glomerular filtration (rate)
EHK = Externí hodnocení kvality
EMU = Early morning urine, První ranní moč
EPI = Rovnice pro odhad glomerulární filtrace (viz CKD-EPI)
ERM = European Reference Material, Evropský referenční materiál
ERPF = Efektivní průtok plazmy ledvinami
EU = Evropská unie
GF = Glomerulární filtrace
HPLC = High Performance Liquid Chromatography, Vysokoúčinná kapalinová chromatografie
CHRI = Chronická renální insufïcience
ID-GC-MS = Isotope Dilution-Gas Chromatography-Mass Spectrometry, Plynová chromatografie s izotopovou dilucí a hmotnostní spektrometrií
ID-MS = Isotope Dilution Mass Spectrometry, Hmotnostní spektrometrie s izotopovou dilucí
IFCC = International Federation of Clinical Chemistry and Laboratory Medicine, Mezinárodní fede-race klinické chemie a laboratorní medicíny (www.ifcc.org)
IgG = Imunoglobulin třídy G
KDIGO 2012 = Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease (2012)
K/DOQI = Kidney Disease Outcome Quality Initiative Guidelines
LC = Liquid Chromatography, Kapalinová chromatografie
MAG 3 = Komplex Mercapto Acetyl Tri Glycine a 99mTc
MDRD = Modification of Diet in Renal Disease
mFLC = Volné lehké řetězce (monoklonální)
NIST = National Institute of Standards and Technology (USA), Národní ústav pro normalizaci a technologie (dříve NBS) (www.nist.gov)
NKDEP = National Kidney Disease Education Program (www.nkdep.nih.gov)
NKF = National Kidney Foundation
PCR = Poměr bílkovina/kreatinin
PU = Proteinurie
RfB = Referenz Institut für Bioanalytik (Bonn, Německo)
RIFLE = Risk, Injury, Failure, Loss, and End-Stage Kidney Disease, Klasifikace poškození ledvin
SRM = Standard Reference Material (obdoba CRM) (USA), Standardní referenční materiál NIST
TER = Tubular Extraction Rate
V Praze dne 26. března 2014
Dokument byl připraven společně odborníky České nefrologické společnosti a České společnosti klinické biochemie ČLS JEP a v roce 2014 je uveřejněn zároveň v časopisech Aktuality v nefrologii a v časopise Klinická biochemie a metabolismus.
Zdroje
1. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter. Suppl. 2013 (3), p. 1–150.
2. Myers, G. L. Standardization of serum creatinine measurement: theory and practice. Scand. J Clin. Lab. Investig. Suppl., 2008, 241, p. 57–63.
3. Myers, G. L., Miller, W. G., Coresh, J., Fleming, J., Greenberg, N., Greene, T. et al. Recommendations for improving serum creatinine measurement: a report from the Laboratory Working Group of the National Kidney Disease Education Program. Clin. Chem., 2006, 52 (1), p. 5–18.
4. Ceriotti, F., Boyd, J. C., Klein, G., Henny, J., Que-raltó, J., Kairisto, V. et al. Reference intervals for serum creatinine concentrations: assessment of available data for global application. Clin. Chem., 2008, 54 (3), p. 559–66.
5. Greenberg, N., Roberts, W. L., Bachmann, L. M., Wright, E. C., Dalton, R. N., Zakowski, J. J. et al. Specificity Characteristics of 7 Commercial Creatinine Measurement Procedures by Enzymatic and Jaffe Me-thod Principles. Clin. Chem., 2012, 1, 58(2), p. 391–401.
6. Delanghe, J. R., Cobbaert, C., Harmoinen, A., Jansen, R., Laitinen, P., Panteghini, M. Focusing on the clinical impact of standardization of creatinine measurements: a report by the EFCC Working Group on Crea-tinine Standardization. Clin. Chem. Lab. Med., CCLM FESCC, 2011, 49 (6), p. 977–82.
7. Grubb, A., Blirup-Jensen, S., Lindström, V., Schmidt, C., Althaus, H., Zegers, I. First certified reference material for cystatin C in human serum ERM-DA471/IFCC. Clin. Chem. Lab. Med., 2010, 1, 48(11). Available from: http://www.degruyter.com/view/j/cclm.2010.48.issue-11/cclm.2010.318/cclm.2010.318.xml
8. European Renal Best Practice Transplantation Guideline Development Group. ERBP Guideline on the Management and Evaluation of the Kidney Donor and Recipient. Nephrol. Dial. Transplant., 2013, 28 (2), p. 1-71.
9. Miller, W. G., Bruns, D. E., Hortin, G. L., Sandberg, S., Aakre, K. M., McQueen, M. J. et al. Current issues in measurement and reporting of urinary albumin excretion. Clin. Chem., 2009, 55 (1), p. 24–38.
10. Lieske, J. C., Bondar, O., Miller, W. G., Bachmann, L. M., Narva, A. S., Itoh, Y. et al. A reference system for urinary albumin: current status. Clin. Chem. Lab. Med., CCLM FESCC, 2013, 51(5), p. 981–9.
11. Bachmann, L. M., Nilsson, G., Bruns, D. E., McQueen, M. J., Lieske, J. C., Zakowski, J. J. et al. State of the Art for Measurement of Urine Albumin: Comparison of Routine Measurement Procedures to Isotope Dilution Tandem Mass Spectrometry. Clin. Chem., 2013, 26, 1-21.
12. Lamb, E. J., MacKenzie, F., Stevens, P. E. How should proteinuria be detected and measured? Ann. Clin. Biochem., 2009, 46 (3), p. 205–17.
13. Friedecký, B., Zima, T., Kratochvíla, J., Springer, D. Diabetes mellitus - laboratorní diagnostika a sledování stavu pacientů. Klin. Biochem. Metab., 2012, 20 (2), p. 97–107.
14. Hofmann, W., Guder, W. G. A diagnostic programme for quantitative analysis of proteinuria. J Clin. Chem. Clin. Biochem. Z Für Klin. Chem. Klin. Biochem., 1989, 27 (9), p. 589–600.
15. Ohisa, N., Kanemitsu, K., Matsuki, R., Suzuki, H., Miura, H., Ohisa, Y. et al. Evaluation of hematuria using the urinary albumin-to-total-protein ratio to differentiate glomerular and nonglomerular bleeding. Clin. Exp. Nephrol., 2007, 11(1), p. 61–5.
16. Guder, W. G., Hofmann, W. Differentiation of proteinuria and haematuria by single protein analysis in urine. Clin. Biochem., 1993, 26 (4), p. 277–82.
17. Ibsen, H., Olsen, M. H., Wachtell, K., Borch-Johnsen, K., Lindholm, L. H., Mogensen, C. E. et al. Reduction in albuminuria translates to reduction in cardiovascular events in hypertensive patients: losartan intervention for endpoint reduction in hypertension study. Hypertension, 2005, 45 (2), p.198–202.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2014 Číslo 3- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Efektivita léčby a možné indikace liraglutidu v gynekologii
-
Všechny články tohoto čísla
- Harmonizace referenčních intervalů
- Validní referenční intervaly a rozhodovací limity zcela závisí na úrovni harmonizace výsledků laboratorních měření
- Pozitivní asociace adiponektinu s adipocytárním proteinem vázajícím mastné kyseliny u pacientů s nepříznivým dyslipidemickým fenotypem
- Srovnání clearance kreatininu a odhad glomerulární filtrace u pacientů s chronickým onemocněním ledvin
- Požadavky na kvalitu stanovení glykovaného hemoglobinu HbA1c a možnost využití jeho výsledků pro diagnostické účely
- Sjednocení a validace referenčních intervalů – pilotní studie
-
Doporučení k diagnostice chronického onemocnění ledvin (odhad glomerulární filtrace a vyšetřování proteinurie)
České nefrologické společnosti ČLS JEP a České společnosti klinické biochemie ČLS JEP - Doporučení: Systém externího hodnocení kvality (EHK)
- Doporučení k použití, výběru a kontrole glukometrů
- Pracovní zasedání redaktorů časopisů oborů laboratorní medicíny
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
Doporučení k diagnostice chronického onemocnění ledvin (odhad glomerulární filtrace a vyšetřování proteinurie)
České nefrologické společnosti ČLS JEP a České společnosti klinické biochemie ČLS JEP - Srovnání clearance kreatininu a odhad glomerulární filtrace u pacientů s chronickým onemocněním ledvin
- Doporučení k použití, výběru a kontrole glukometrů
- Sjednocení a validace referenčních intervalů – pilotní studie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání








