-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prevence náhlé srdeční smrti u pacientů do 40 let věku
Prevention of sudden cardiac death in patients up to 40 years of age
In an unselected population it is difficult to identify patients at risk of sudden cardiac death, in selected subgroups of patients risk stratification might be feasible. In the group of young patients under 40 years of age, the following diagnosis should be considered as increased risk of sudden cardiac death: hypertrophic cardiomyopathy, arrhythmogenic cardiomyopathy and long QT syndrome. However, around 30% of sudden cardiac deaths remains unexplained. Specific population groups are athletes, where the “Seattle score” is a very useful tool in identifying patients at risk. Drug-induced long QT syndrome might portend significant risk of sudden cardiac death even in young patients. It is necessary to be familiar with particular risk medications, such as antipsychotics, azole antimycotics and macrolide antibiotics, and measure the QT interval properly. Screening for the risk of sudden cardiac death is helpful within the subgroup of athletes and people in occupational risk. For patients already identified with a higher risk of sudden cardiac death there are both pharmacological and non-pharmacological means of prevention. The strongest effect on the risk reduction of sudden cardiac death is achieved with betablockers, while implantation of transvenous or subcutaneous implantable cardioverter-defibrillator is the most common method of non-pharmacological prevention of sudden cardiac death, and catheter ablation can be performed in selected patients/disease.
Key words:
sudden cardiac death – hypertrophic cardiomyopathy – arrhythmogenic cardiomyopathy – long QT syndrome – subcutaneous implantable cardioverter-defibrillator
Autoři: J. Plášek
Působiště autorů: Kardiovaskulární oddělení, FN Ostrava Lékařská fakulta OU, Ostrava
Vyšlo v časopise: Kardiol Rev Int Med 2018, 20(2): 96-103
Souhrn
Náhlá srdeční smrt (NSS) odpovídá za 50 % kardiovaskulární mortality a v Evropě umírá na NSS přibližně 2 500 osob denně. V neselektované populaci je velmi obtížné predikovat riziko NSS, v selektovaných skupinách onemocnění již je riziková stratifikace možná. U mladých pacientů do 40 let přicházejí v úvahu jako rizika NSS především tato onemocnění: hypertrofická kardiomyopatie, arytmogenní kardiomyopatie a syndrom dlouhého QT. Kolem 30 % NSS zůstává neobjasněných. Specifickou subpopulací jsou v této věkové skupině aktivní sportovci/atleti, kde je k odhadu rizika velmi užitečné „Seattle skóre“ hodnotící EKG abnormity. Velkým rizikem, které ohrožuje i mladé pacienty, je léky indukované prodloužení QT intervalu. Je nutné znát nejrizikovější skupiny léků z řad psychofarmak, azolových antimykotik, makrolidových antibiotik a QT interval správně měřit. Screening na rizikové faktory NSS je možný jen u subpopulací, jako jsou sportovci nebo rizikové profese. U pacientů ve vyšším riziku NSS máme k dispozici farmakologické a nefarmakologické postupy prevence dle úrovní rizika. Nejsilněji redukují riziko NSS betablokátory, z nefarmakologických postupů pak implantace transvenózního, subkutánního kardioverter-defibrilátoru, u vybraných pacientů/chorob katetrizační ablace.
Klíčová slova:
náhlá srdeční smrt – hypertrofická kardiomyopatie – arytmogenní kardiomyopatie – syndrom dlouhého QT – subkutánní implantabilní kardioverter-defibrilátorÚvod
Náhlou srdeční smrt (NSS) definujeme jako náhlé neočekávané úmrtí ze srdeční příčiny do ≤ 1 hod od začátku symptomů. Způsob tohoto úmrtí je hodnocen jako neočekávaný v neočekávané chvíli u osoby se známým onemocněním srdce nebo bez něj [1]. NSS odpovídá za 50 % kardiovaskulární (KV) mortality (450 000 úmrtí/ rok v USA [2], 70 000 úmrtí/ rok ve Velké Británii [3]), počet náhlých srdečních úmrtí převyšuje součet úmrtí na karcinom plic, prsu, AIDS a cévní mozkové příhody (CMP) dohromady.
Ve věkové skupině do 40 let je incidence NSS méně častá, ale nastane-li, má devastující dopad na rodinu zemřelého i komunitu. Populační studie u obyvatel amerického státu Minnesota ve věku 20 – 40 let prokázala incidenci NSS 6,2 na 100 000 obyvatel/ rok [4]. Retrospektivní demografická a autoptická studie více než 6 milionů sledovaných amerických vojáků ve věku 18 – 35 let prokázala incidenci NSS 13 na 100 000 osoboroků [5]. Na druhé straně studie u atletů jak z Itálie [6], tak z USA vykazovaly nepoměrně nižší incidenci NSS: 2,1, resp. 0,5 na 100 000 osoboroků (tab. 1) [7]. Při zkoumání incidence vycházíme vždy z retrospektivních analýz nebo prospektivních screeningů zaměřených na předdefinované kohorty, protože riziko NSS v obecné populaci se odhaduje velmi špatně. Bohužel právě v obecné populaci je největší absolutní počet NSS, na rozdíl od pacientů s jasně definovanými KV riziky (dysfunkce levé komory, stav po infarktu myokardu apod.), kde je sice vysoká incidence, ale vztaženo k obecné neselektované populaci nízký absolutní počet případů. Tomuto fenoménu říkáme Myerburgův paradox (graf 1).
Tab. 1. Souhrn studií zkoumajících incidenci náhlé srdeční smrti na předdefinovaných kohortách nebo populacích/n odpovídá počtu mrtvých, počet celé populace v tabulce není uveden. Upraveno dle [4,5,28,29]. ![Souhrn studií zkoumajících incidenci náhlé srdeční smrti na předdefinovaných kohortách nebo populacích/n odpovídá počtu mrtvých, počet celé populace v tabulce není uveden. Upraveno dle [4,5,28,29].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ed489d26c176112533c7a31f1252f562.jpeg)
Graf 1. Incidence náhlé srdeční smrti vztažené na různé populační skupiny, data ze Spojených států amerických. Převzato z [46]. ![Incidence náhlé srdeční smrti vztažené na různé populační skupiny, data ze Spojených států amerických. Převzato z [46].](https://pl-master.mdcdn.cz/media/image/9620e867c334c201ee79cff02be8c170.jpeg?version=1533280450)
ICHS – ischemická choroba srdeční, EF LK – ejekční frakce levé komory, KPCR – kardiopulmonální resuscitace, IM – infarkt myokardu Celá řada onemocnění, přechodných vlivů a rizikových faktorů může vést k NSS, nejčastější etiologií jsou akutní i chronické formy ischemické choroby srdeční (ICHS), které odpovídají až za 80 % NSS [8]. Příčiny NSS můžeme racionálně rozdělit do několika celků, NSS s prokázaným KV onemocněním (KVO), NSS u specifických skupin (atleti), NSS vlivem podané medikace. Přes veškerou snahu zůstává kolem 20 – 30 % NSS neobjasněných (tab. 1).
Náhlá srdeční smrt s prokázaným KVO
Následující KVO mohou být příčinou NSS:
- strukturální srdeční onemocnění – ze získaných nejčastěji ICHS, resp. přímo ischemická kardiomyopatie, kongenitální strukturální srdeční onemocnění a heterogenní skupina neischemických kardiomyopatií;
- hereditární arytmické syndromy – syndrom dlouhého QT – LQTS, syndrom krátkého QT, Brugada syndrom (BrS), katecholaminergní polymorfní komorová tachykardie;
- myokarditidy a zánětlivé kardiomyopatie;
- abnormality koronárního řečiště.
Problémem je většinou především presymptomatické, resp. oligosymptomatické období onemocnění a otázka, u kterých populačních skupin dělat screening a jaký.
Vrozené a získané kardiomyopatie
Mezi vrozené kardiomyopatie s vysokým rizikem NSS náleží: hypertrofická kardiomyopatie (HKMP), nonkompaktní kardiomyopatie, arytmogenní kardiomyopatie, dilatační kardiomyopatie (2/ 3 zánětlivé kardiomyopatie s průkazem virového genomu z endomyokardiální biopsie) a sarkoidóza. Jakmile jsou tato onemocnění již diagnostikována, mají poměrně jasnou rizikovou stratifikaci primární prevence NSS. O varovných symptomech onemocnění bude ještě řeč dále. V případě hypertrofické kardiomyopatie se jedná o specifický skórovací systém (tab. 2) použitelný výhradně pro toto onemocnění, konkrétně počítá 5leté riziko NSS [9]. Tento skórovací systém by neměl být užíván pro:
- děti pod 16 let věku;
- kompetitivní atlety;
- pacienty se střádavým onemocněním (M. Fabry, Noonan syndrom);
- pacienty s anamnézou odvrácené NSS a/ nebo setrvalou komorovou tachykardií, kteří již jsou kandidáti ICD ze sekundární prevence [9,10].
Tab. 2. Stratifikace rizika NSS u HKMP. Převzato z [9,10]. ![Stratifikace rizika NSS u HKMP. Převzato z [9,10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ca20bbae40a5353b3034b23dfc30cb06.jpeg)
NSS – náhlá srdeční smrt, KMP – kardiomyopatie, LK – levá komora V případě takto vypočteného 5letého rizika NSS ≥ 6 % a zároveň pravděpodobnosti přežití nad 1 rok by měla být zvážena implantace kardioverter-defibrilátoru (ICD) [10]. U pacientů s nonkompaktní a dilatovanou kardiomyopatií postupujeme v primární prevenci NSS jako u neischemických kardiomyopatií, tj. pacienti se srdečním selháním ve funkční třídě NYHA II – III, EF LK ≤ 35 % na min. 3měsíční optimální medikamentózní léčbě [11]. Arytmogenní kardiomyopatie (ARVC) je vrozené desmozomální onemocnění související s poškozením interkalárních disků. Diagnóza spočívá ve splnění kombinace:
- a) morfologických kritérií (globální/ regionální akineze, dysfunkce pravé komory dle echokardiografie či magnetické rezonance);
- b) abnormalit depolarizace/ kondukce (epsilon vlna – nízkoamplitudový signál od konce QRS komplexu do začátku T vlny, terminální aktivace QRS nad 55 ms, pozdní potenciály);
- c) arytmie – setrvalé nebo nesetrvalé komorové tachykardie s tvarem blokády levého Tawarova raménka a inferiorní osou;
- d) rodinná anamnéza ARVC [12,13].
Poměrně typickým EKG projevem ARVC je inkompletní blokáda pravého Tawarova raménka s negativními vlnami T v prekordiálních svodech. Diagnostika onemocnění může být svízelná, pokud ještě nejsou patrné morfologické/ funkční změny ani na magnetické rezonanci, přesto tito pacienti mohou mít komorové arytmie a být již ve zvýšeném riziku NSS. V této fázi může být užitečné genetické testování asociovaných genů pro desmozomální proteiny (aktuálně 13), genetické testování ale nehraje zásadní roli v rizikové stratifikaci NSS u ARVC [13]. Riziková stratifikace je založena na klinických a paraklinických nálezech: přítomnost (ne)setrvalých komorových arytmií, synkopa, dysfunkce pravé komory. Dle rozsahu a charakteru splněných kritérií stratifikujeme riziko jako vysoké, intermediární a nízké. U pacientů s vysokým a intermediárním rizikem je racionální implantovat ICD, protože ARVC nese primárně riziko arytmické NSS, až později riziko selhání pravé komory.
Hereditární arytmické syndromy
K hereditárním arytmickým syndromům nesoucím zvýšené riziko náleží LQTS, syndrom krátkého QT, BrS a katecholaminergní polymorfní komorová tachykardie. V případě LQTS se jedná buď o vrozený, nebo získaný stav prodloužení QT intervalu na povrchovém EKG vedoucí ke zvýšenému riziku NSS v důsledku komorových arytmií typu torsade de pointes. Za 65 % geneticky determinovaných LQTS odpovídají 3 geny: 2 kódují jednotky draslíkového kanálu Iks a Ikr (KCNQ1, KCNH2), třetí natriový kanál Nav1.5(SCN5A) [15]. Mutace v 13 identifikovaných genech vedou ke kanalopatiím ovlivňujícím myokardiální repolarizaci, event. disperzi repolarizace. Nejčastější vrozené formy LQTS mají specifické EKG projevy a spouštěcí mechanizmy (tab. 3). Genetické testování na uvedené kandidátní geny je doporučováno v případě QTc nad 500 ms a u členů rodiny pacienta s prokázanou kauzální mutací LQTS [16]. Bohužel jsou popsány i případy, kdy má pacient potvrzenou kauzální genovou mutaci pro LQTS, ale má normální QTc interval. Kumulativní pravděpodobnost NSS je u těchto jedinců o něco menší než u jedinců s korigovaným prodlouženým QT intervalem (4 vs. 15 %) [17]. Diagnostická kritéria pro LQTS jsou založena na rodinné anamnéze a EKG nálezu (tab. 4) [18]. Základními specifickými opatřeními jsou: u LQTS1 zákaz namáhavější/ kompetitivní sportovní aktivity (obzvláště plavání a vodní sporty), vyvarovat se náhlým hlasitým zvukům (zvonění budíku) u LQTS2 a všem lékům prodlužujícím QT interval, což platí univerzálně pro všechny LQTS. Z léků jsou velmi efektivní betablokátory v případě LQTS1, méně již u LQTS2 a LQTS3 [19]. U vysoce rizikových pacientů je s výhodou levostranná denervace srdečního sympatiku (left cardiac sympathetic denervation – LCSD); největší studie (n = 147 pacientů) u extrémně rizikových pacientů (QTc 543±65 ms) prokázala 91% redukci srdečních příhod [20]. Doporučené postupy HRS/ EHRA/ APHRS z roku 2013 nedoporučují implantaci ICD u asymptomatických pacientů s LQTS, u kterých nebyl vyzkoušen betablokátor krom zvláštních případů:
- QTc > 550 ms krom LQTS1;
- ženy s LQTS2 a QTc > 500 ms;
- Jervell Lange-Nielsen syndrom;
- rozsáhlá rodinná anamnéza LQTS [21].
Tab. 4. Schwartzova kritéria pro diagnózu syndromu dlouhého QT. 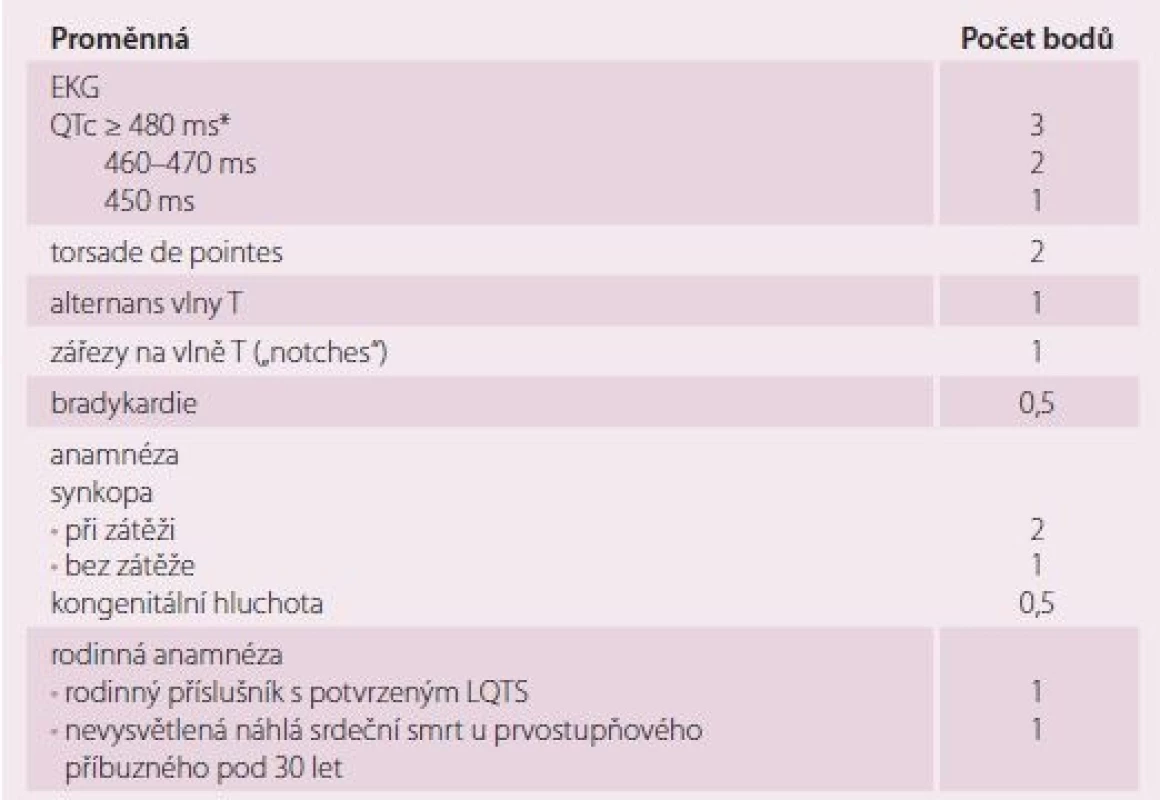
< 1 – nízkápravděpodobnost; 2–3 – střední pravděpodobnost; ≥ 4 – vysoká pravděpodobnost LQTS (syndrom dlouhého QT)
*QTc dle Bazzetova vzorce (QTc = QT/RR interval)Brugada syndrom je vzácné vrozené onemocnění původně popsané jako autozomálně dominantní primárně elektrická porucha bez strukturálního srdečního onemocnění projevující se ST elevacemi, negativními T v prekordiálních svodech; postupně byly popsány tři typy dle povrchového EKG (obr. 1). Onemocnění se vyznačuje zvýšeným rizikem NSS na fibrilaci komor, obzvláště při teplotách nebo ve spánku [22]. EKG obraz se u jednotlivého pacienta může měnit, demaskovat typický EKG projev (typ I) lze pomocí ajmalinového testu, který ale není zcela bez rizika indukce maligní arytmie. Později byly u BrS popsány i strukturální změny, hlavně pravé komory. Tímto se otevřela diskuze o patofyziologii, rizikové stratifikaci, typu možné léčby, ale i úloze nejčastěji zmiňované „kauzální“ mutace (je známo již přes 100 mutací) genu SCN5A, který kóduje α-podjednotku natriového kanálu [23]. Genetické testování je doporučeno u rodinných příslušníků pacienta s prokázanou kauzální mutací v genu SCN5A [16]. Léčebné možnosti BrS tkví v implantaci ICD – ze sekundární prevence u pacientů, kteří prodělali fibrilaci komor; z primární prevence u pacientů se spontánním BrS typem 1 na povrchovém EKG a synkopou. Z léků se používá chinidin, a to i v případě elektrické bouře [22]. Jako viabilní léčebná varianta u vybraných nemocných se prosazuje katetrizační ablace – modifikace epikardiálního substrátu ve výtokovém traktu pravé komory [24,25]. Jsou-li pacienti s LQTS nebo BrS indikování k ICD, můžeme s výhodou využít podkožní variantu, tzv. subkutánní ICD (S-ICD), jelikož tito pacienti většinou nemají bradykardickou indikaci (rozuměj, nepotřebují stimulační funkce) ani indikaci k srdeční resynchronizační léčbě. S-ICD je výhodné hned z několika důvodů:
- je-li infekční komplikace, nemá riziko infekční endokarditidy jako transvenózní systém;
- nemůže dojít k tzv. sublavian „crush“ syndrom – což je mechanické porušení integrity elektrody v podklíčkové oblasti;
- není závislost na průchodnosti centrálního žilního systému a anulujeme také případné trombózy či žilní uzávěry;
- pacient nemůže mít periprocedurální komplikace jako pneumothorax, dislokace elektrody (pokud dojde k dislokaci, nemá tak závažné konsekvence) nebo v nejhorším případě hemoperikard při perforaci pravé komory [26].
Obr. 1. EKG projevy Brugada syndromu, jediný „diagnostický“ je typ 1, tj. ST elevace ≥ 2 mm následovaná negativní vlnou bez izoelektrické nebo s minimální izoelektrickou linií, zvaný také „Coved type“; další dva typy nazýváme „Saddle back“ – typ 2 má mít výše J bod než T vlnu, typ 3 naopak. Upraveno dle [21,22]. ![EKG projevy Brugada syndromu, jediný „diagnostický“ je typ 1, tj. ST elevace ≥ 2 mm následovaná negativní vlnou bez izoelektrické nebo s minimální izoelektrickou linií, zvaný také „Coved type“; další dva typy nazýváme „Saddle back“ – typ 2 má mít výše J bod než T vlnu, typ 3 naopak. Upraveno dle [21,22].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7fad8bd4a22cce4d2f6238ef02ff5fdf.jpeg)
Katecholaminergní polymorfní komorová tachykardie je vzácné arytmogenní onemocnění, které se projevuje adrenergně indukovanou bidirekční nebo polymorfní komorovou tachykardií při nepřítomnosti strukturálního srdečního onemocnění. Mortalita do 30 let je až 31 %, pokud je pacient zcela bez léčby, čím dřív se onemocnění projeví synkopou, tím horší je prognóza. Kauzální spojení s mutací genu pro ryanodinový receptor (RYR2) nebo srdeční calsequestrin (CASQ2) je nalezeno jen u 50 – 60 % probandů, zřejmě se na tomto maligním onemocnění budou podílet ještě jiné geny [27]. Na klidovém EKG většinou nejsou zásadní změny, při zátěži nebo infuzi izoproterenolu se objevuje komorová ektopie tvaru blokády pravého Tawarova raménka s alternující deviací osy. Ve farmakoterapii se uplatňují zejména betablokátory a flecainid, implantace ICD je indikována v případě setrvalé komorové tachykardie a/ nebo synkopy na medikaci betablokátorem [21]. Mimo hereditární syndromy pak stojí idiopatická fibrilace komor, jejíž nositelé mají výrazně zvýšené riziko NSS. Tato arytmie je většinou spouštěna komorovými extrasystolami vycházejícími z Purkyňových vláken [24], katetrizační ablace výrazně snižuje riziko rekurencí, ačkoli většina pacientů z kardiocenter odchází s implantovaným ICD.
Náhlá srdeční smrt atletů
Úmrtí atletů většinou přitahují velkou mediální pozornost, jelikož se jednak často jedná o globální celebrity, jednak jsou to mladí lidé, kteří v očích veřejnosti nemají umírat. Incidence NSS je u atletů velmi variabilní v závislosti na studované populaci od 1 : 3 000 do 1 : 917 000 [28].
Etiologie NSS je u atletů nejčastěji neobjasněná, a to až ve 30 % případů; v tom se shodují jak data z Anglie a Walesu [29], tak z Národní asociace univerzitních atletů v USA (NCAA – National Collegiate Athletic Assciation) [30].V kontradikci jsou pak:
- italské registry z oblasti Benátek [6], které vykazují u atletů do 2 % neobjasněných NSS;
- celoamerické registry neatletů [31], kde autopticky neobjasněnou NSS nalezneme jen u 10 %;
- pouhé 3 % v registru amerických kompetitivních atletů [32].
Z hereditárních kardiomyopatií jsou nejčastější příčinou NSS atletů hypertrofická a arytmogenní kardiomyopatie, ačkoli jejich distribuce se v různých souborech odlišuje (graf 2) [6,28 – 32]. Není také zcela jasné, je-li profesionální sportovní aktivita modifikovatelný faktor NSS. Adrenergní stimulace se jeví jako logický rizikový faktor u HKMP, ARVC, LQTS a anomálních odstupů koronárních tepen, případně myokardiálních můstků [28]. Preparticipační screening zacílený na tato onemocnění by měl potenciál redukovat riziko NSS u atletů. Navíc úmrtí u pacientů s ARVC nastávala u atletické populace v dřívějším věku než u neatletů [6], což odpovídá urychlení progrese choroby při fyzické zátěži, tj. objemově-tlakovém přetěžování pravé i levé komory. Mezi nejrizikovější sporty v sestupném pořadí náleží fotbal, basketbal a plavání [6].
Graf 2. Etiologie náhlé srdeční smrti u atletů ve srovnání s neatlety. Upraveno dle [28–32]. ![Etiologie náhlé srdeční smrti u atletů ve srovnání s neatlety. Upraveno dle [28–32].](https://pl-master.mdcdn.cz/media/image/83672f395466c9c4f8311b053f85932b.jpeg?version=1533280461)
AMT – aneuryzma mozkové tepny, ARVC – arytmogenní kardiomyopatie, EAP – akutní embolizace do plicnice, LQTS – syndrom dlouhého QT, HKMP – hypertrofi cká kardiomyopatie, DKMP – dilatační kardiomyopatie, ICMP – ischemická cévní mozková příhoda, ICHS – ischemická choroba srdeční, LK – levá komora, WPW – Wolff -Parkonson-White syndrom Identifikace rizikových faktorů i patologických paraklinických nálezů je komplikovaná, protože mnoho atletů má EKG nálezy, které by v obecné populaci byly hodnoceny jako patologické. Existuje konsenzus autorů nazývající se „Seattle kritéria“, který vymezuje fyziologické a abnormální EKG nálezy u atletů [33].
Náhlá srdeční smrt a farmakoterapie
Principiálně můžeme léky rozdělit dichotomicky na ty, které mají potenciál NSS preventovat, a ty, které ji mohou „způsobit“ nebo spíše facilitovat. Psychofarmaka patří k nejčastěji zmiňované lékové skupině v kontextu zvýšeného rizika NSS. Z velkých populačních studií vyplývá, že riziko NSS je u pacientů užívajících psychofarmaka oproti neselektované populaci 2 – 3× vyšší. Souvisí to se schopností některých antipsychotik (pipamperon, haloperidol), ale i antidepresiv (jak skupina tricyklických/ tetracyklických antidepresiv, tak selektivní blokátory zpětného vstřebávání serotoninu – mezi nimi i oblíbený citalopram) prodlužovat QT interval. Na molekulární úrovni je pravděpodobně zodpovědný za léky-indukovanou prolongaci QT intervalu inhibice Ikr kanálu, který je částečně zodpovědný za repolarizaci komorových myocytů [34]. Nová atypická antipsychotika jako risperidon a olanzapin se jeví bezpečnější stran rizika NSS [35]. Mezi známé rizikové faktory prolongace QT u psychofarmak patří ženské pohlaví, bradykardie a hypokalemie. K další skupině léků s potenciálně vysokým rizikem prodloužení QT intervalu náleží azolová antimykotika, makrolidy, ketolidy, fluorochinolony a antimalarika. Seznam léků dle rizik prolongace QT naleznete na https:/ / crediblemeds.org/ , nikoli na www.qtdrugs.com, což je stránka firmy zabývající se analýzou EKG u pacientů s LQTS. Na druhé straně spektra jsou léky snižující riziko NSS; opět je možné je rozdělit na skupinu antiarytmik, u kterých se tento efekt očekává, a léky bez primárního antiarytmického efektu. Nejefektivnější skupinou antiarytmik v prevenci arytmické NSS jsou betablokátory, což je známo již ze studie CIBIS II, kde došlo k redukci relativního rizika NSS o 44 % [36]. Ze skupiny neurohormonálních modulátorů (primárně nearytmik) dosáhl překvapivých výsledků sakubitril/ valsartan, který redukoval riziko NSS dokonce nezávisle na přítomnosti ICD, snížení relativního rizika NSS dosáhlo 20 % oproti větvi s enalaprilem [37,38]. Blokátory mineralokortikoidního receptoru ve studii RALES dosáhly signifikantní redukce relativního rizika (RRR) NSS o 29 % oproti placebu [39]. Tyto výsledky byly potvrzeny, jak ve studii EPHESUS [40], kde došlo k RRR NSS o 21 %, tak ve studii EMPHASIS-HF [41], kde došlo k RRR NSS o 24 %. V subanalýze studie DEFINITE prokázaly statiny RRR NSS o neuvěřitelných 78 %, jednalo se ale o post-hoc analýzu [42]. Metaanalýza 29 studií, které porovnávaly vždy statin proti kontrole, prokázala redukci relativního rizika NSS o 10 % [43].
Jak identifikovat mladé pacienty v riziku NSS?
Nejspolehlivějším „symptomem“ je odvrácená NSS, rekurence srdeční zástavy/ fibrilace komor je u těchto pacientů velmi pravděpodobná [28]. U těchto pacientů často nezjistíme příčinu a odcházejí s vágní diagnózou „idiopatická fibrilace komor“, v drtivé většině s implantovaným ICD. Typickými symptomy souvisejícími se zvýšeným rizikem NSS jsou: synkopy, vertigo, palpitace, přechodné výkyvy tlaku a pulzu a bolest na hrudi. Tyto symptomy ale bohužel mívají i zdravé děti/ adolescenti [44]. Výjimku tvoří námahová synkopa, která má ve většině případů nějakou vážnější příčinu (aortální stenóza, HKMP atd.) [45]. Screenin-gové testy v celé populaci jsou neproveditelné, proto je nutné provést screening u vybraných podskupin, jako jsou sportovci, pacienti s pozitivní rodinnou anamnézou, případně lidé vykonávající rizikové profese – piloti, vojáci, profesionální řidiči. Mimo screening je kritické věnovat pozornost QT intervalu, obzvláště pokud pacient užívá medikaci se zvýšeným rizikem prolongace QT intervalu.
Závěr
Prevence NSS u pacientů do 40 let věku v celé populaci je obtížná, stále nás stíhá Myerburgův paradox. Vybrané skupiny rizikových pacientů s vysokou incidencí NSS umíme identifikovat i relativně účinně léčit, ale v obecné populaci, kde je absolutní počet vysoký, ale nízká incidence NSS, zatím není jak vyhledat ty rizikovější. U zdravých jedinců je třeba se zaměřit na varovné symptomy. Přibližně kolem 30 % NSS zůstává neobjasněných a můžeme jen spekulovat, jedná-li se o čisté elektrické poruchy související s mutacemi iontových kanálů. Nejčastější příčiny NSS jsou akutní a chronické formy ICHS, v mladší populaci a populaci aktivních sportovců ale naopak převažují HKMP a ARVC, v menší míře pak anomální odstupy koronárních tepen a myokardiální můstky. Logickým opatřením by mělo být v případě sportovců, pacientů v rizikových profesích a pacientů s varovnými příznaky pátrání po těchto nejčastějších chorobách. V případě potvrzení diagnóz ARVC, HKMP pak riziková stratifikace. U profesionálních sportovců by měl jednoznačně proběhnout preparticipační screening, kdy nejjednodušší metodou je EKG screening dle „Seattle kritérií“ (tab. 5). K metodám prevence NSS patří:
- farmakoterapie – a) léky s přímým antiarytmickým účinkem – nejčastěji betablokátor, který je u většiny diagnóz nejefektivnější; b) léky neurohormonálně modulační (sakubitril-valsartan, blokátory mineralokortikoidního receptoru, statiny);
- implantace ICD – buď klasického transvenózního, nebo v indikovaných případech S-ICD;
- katetrizační ablace, která má potenciál snížit riziko NSS u pacientů s idiopatickou fibrilací komor a BrS
Doručeno do redakce: 17. 5. 2018
Přijato po recenzi: 29. 5. 2018
MU Dr. Jiří Plášek, Ph.D., FESC
Zdroje
1. Engelstein ED, Zipes DP. Sudden cardiac death. In: Alexander RW, Schlant RC, Fuster V. (eds.) The Heart, Arteries and Veins. New York, NY: McGraw-Hill; 1998 : 1081 – 1112.
2. Zheng ZJ, Croft JB, Giles WH et al. Sudden cardiac death in the United States, 1989 to 1998. Circulation 2001; 104(18): 2158 – 2163.
3. Implantable cardioverter defibrillators and cardiac resynchronisation therapy for arrhytmias and herat failure. National Institute for Health and Clinical Excellence (NICE). Available at: https:/ / www.nice.org.uk/ guidance/ ta314/ resources/ implantable-cardioverter-defibrillators-and-cardiac-resynchronisation-therapy-for-arrhythmias-and-heart-failure-pdf-82602426443461.
4. Shen WK, Edwards WD, Hammill SC et al. Sudden unexpected nontraumatic death in 54 young adults: a 30-year population-based study. Am J Cardiol 1995; 76(3): 148 – 152.
5. Eckart RE, Scoville SL, Campbell CL et al. Sudden death in young adults: a 25-year review of autopsies in military recruits. Ann Intern Med 2004; 141(11): 829 – 834.
6. Corrado D, Basso C, Rizzoli G et al. Does sport activity enhance the risk of sudden death in adolescents and young adults? J Am Coll Cardiol 2003; 42(11): 1959 – 1963.
7. Maron BJ, Gohman TE, Aeppli D. Prevalence of sudden cardiac death during competitive sports activities in Minnesota high school athletes. J Am Coll Cardiol 1998; 32(7): 1881 – 1884.
8. Kozák M. Náhlá srdeční smrt. Interní Med 2009; 11(5): 211 – 214.
9. O'Mahony C, Jichi F, Pavlou M et al. Hypertrophic Cardiomyopathy Outcomes Investigators. A novel clinical risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy (HCM risk-SCD). Eur Heart J 2014; 35(30): 2010 – 2020. doi: 10.1093/ eurheartj/ eht439.
10. Elliott PM, Anastasakis A, Borger MA et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the task force for the Diagnosis and Management of hypertrophic cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35(39): 2733 – 2779. doi: 10.1093/ eurheartj/ ehu284.
11. Špinar J, Hradec J, Špinarová L et al. Souhrn doporučených postupů ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2016. Cor Vasa 2016; 58(5): e530 – e568.
12. Marcus FI, McKenna WJ, Sherrill D et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/ dysplasia: proposed modification of the task force criteria. Circulation 2010; 121(13): 1533 – 1541. doi: 10.1161/ CIRCULATIONAHA.108.840827.
13. Wang W, James CA, Calkins H. Diagnostic and therapeutic strategies for arrhythmogenic right ventricular dysplasia/ cardiomyopathy patient. Europace 2018. Ahead of print. doi: 10.1093/ europace/ euy063.
14. Corrado D, Wichter T, Link MS et al. Treatment of arrhythmogenic right ventricular cardiomyopathy/ dysplasia: an international task force consensus statement. Eur Heart J 2015; 36(46): 3227 – 3237. doi: 10.1093/ eurheartj/ ehv162.
15. Medeiros-Domingo A, Iturralde-Torres P, Ackerman MJ. Clinical and genetic characteristics of long QT syndrome. Rev Esp Cardiol 2007; 60(7): 739 – 752.
16. Ackerman MJ, Priori SG, Willems S et al. HRS/ EHRA expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies this document was developed as a partnership between the Heart Rhythm Society (HRS) and the European Heart Rhythm Association (EHRA). Heart Rhythm 2011; 8(8): 1308 – 1339. doi: 10.1016/ j.hrthm.2011.05.020.
17. Goldenberg I, Horr S, Moss AJ et al. Risk for life--threatening cardiac events in patients with genotype-confirmed long-QT syndrome and normal-range corrected QT intervals. J Am Coll Cardiol 2011; 57(1): 51 – 59. doi: 10.1016/ j.jacc.2010.07.038.
18. Schwartz PJ, Moss AJ, Vincent GM et al. Diagnostic criteria for the long QT syndrome. An update. Circulation 1993; 88(2): 782 – 784.
19. Schwartz PJ, Priori SG, Spazzolini C et al. Genotype-phenotype correlation in the long-QT syndrome: gene-specific triggers for life-threatening arrhythmias. Circulation 2001; 103(1): 89 – 95.
20. Schwartz PJ, Priori SG, Cerrone M et al. Left cardiac sympathetic denervation in the management of high-risk patients affected by the long-QT syndrome. Circulation 2004; 109(15): 1826 – 1833. doi: 10.1161/ 01.CIR.0000125523.14403.1E.
21. Priori SG, Wilde AA, Horie M et al. HRS/ EHRA/ APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes. Heart Rhythm 2013; 10(12): 1932 – 1963. doi: 10.1016/ j.hrthm.2013.05.014.
22. Mizusawa Y, Wilde AA. Brugada syndrome. Circ Arrhythm Electrophysiol 2012; 5(3): 606 – 616. doi: 10.1161/ CIRCEP.111.964577.
23. Priori SG, Napolitano C, Giordano U et al. Brugada syndrome and sudden cardiac death in children. Lancet 2000; 355(9206): 808 – 809. doi: 10.1016/ S0140-6736(99)05277-0.
24. Kautzner J, Peichl P. Catheter ablation to prevent sudden cardiac death. Int J Cardiol 2017; 237 : 29 – 33. doi: 10.1016/ j.ijcard.2017.03.135.
25. Nademanee K, Hocini M, Haïssaguerre M. Epicardial substrate ablation for Brugada syndrome. Heart Rhythm 2017; 14(3): 457 – 461. doi: 10.1016/ j.hrthm.2016.12.001.
26. Sponder M, Khazen C, Dichtl W et al. Specific indications and clinical outcome in patients with subcutaneous implantable cardioverter-defibrillator (ICD). A nationwide multicentre registry. Eur J Intern Med 2018; 48 : 64 – 68. doi: 10.1016/ j.ejim.2017.09.038.
27. Leenhardt A, Denjoy I, Guicheney P. Catecholaminergic polymorphic ventricular tachycardia. Circ Arrhythm Electrophysiol 2012; 5(5): 1044 – 1052. doi: 10.1161/ CIRCEP.111.962027.
28. Ackerman M, Atkins DL, Triedman JK. Sudden cardiac death in the young. Circulation 2016; 133(10): 1006 – 1026. doi: 10.1161/ CIRCULATION AHA.115.020254.
29. Papadakis M, Sharma S, Cox S et al. The magnitude of sudden cardiac death in the young: a death certificate-based review in England and Wales. Europace 2009; 11(10): 1353 – 1358. doi: 10.1093/ europace/ eup229.
30. Harmon KG, Drezner JA, Maleszewski JJ et al. Pathogeneses of sudden cardiac death in National Collegiate Athletic Association athletes. Circ Arrhythm Electrophysiol 2014; 7(2): 198 – 204. doi: 10.1161/ CIRCEP.113.001376.
31. Meyer L, Stubbs B, Fahrenbruch C et al. Incidence, causes, and survival trends from cardiovascular-related sudden cardiac arrest in child-ren and young adults 0 to 35 years of age: a 30-year review. Circulation 2012; 126(1): 1363 – 1372. doi: 10.1161/ CIRCULATIONAHA.111.076810.
32. Maron BJ, Doerer JJ, Haas TS et al. Sudden deaths in young competitive athletes: analysis of 1866 deaths in the United States, 1980 – 2006. Circulation 2009; 119(8): 1085 – 1092. doi: 10.1161/ CIRCULATIONAHA.108.804617.
33. Drezner JA, Ackerman MJ, Anderson J et al. Electrocardiographic interpretation in athletes: the 'Seattle criteria'. Br J Sports Med 2013; 47(3): 122 – 124. doi: 10.1136/ bjsports-2012-092067.
34. Kallergis EM, Goudis CA, Simantirakis EN et al. Mechanisms, risk factors, and management of acquired long QT syndrome: a comprehensive review. ScientificWorldJournal 2012; 2012 : 212178. doi: 10.1100/ 2012/ 212178.
35. Liperoti R, Gambassi G, Lapane KL et al. Conventional and atypical antipsychotics and the risk of hospitalization for ventricular arrhythmias or cardiac arrest. Arch Intern Med 2005; 165(6): 696 – 701.
36. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet 1999; 353(9146): 9 – 13.
37. Desai AS, McMurray JJ, Packer M et al. Effect of the angiotensin-receptor-neprilysin inhibitor LCZ696 compared with enalapril on mode of death in heart failure patients. Eur Heart J 2015; 36(30): 1990 – 1997. doi: 10.1093/ eurheartj/ ehv186.
38. Erath JW, Hohnloser SH. Drugs to prevent sudden cardiac death. Int J Cardiol 2017; 237 : 22 – 24. doi: 10.1016/ j.ijcard.2017.03.066.
39. Pitt B, Zannad F, Remme WJ et al. The randomized aldactone evaluation study investigators. The effect of spironolactone on morbidityand mortality in patients with severe heart silure. N Engl J Med 1999; 341(10): 709 – 717. doi: 10.1056/ NEJM199909023411001.
40. Pitt B, Remme WJ, Zannad F et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348(14): 1309 – 1321.
41. Zannad F, McMurray JJ, Krum H et al. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med 2011; 364(1): 11 – 21. doi: 10.1056/ NEJMoa1009492.
42. Goldberger JJ, Subacius H, Schaechter A et al. DEFINITE Investigators. Effects of statin therapy on arrhythmic events and survival in patients with nonischemic dilated cardiomyopathy. J Am Coll Cardiol 2006; 48(6): 1228 – 1233. doi: 10.1016/ j.jacc.2006.05.053.
43. Rahimi K, Majoni W, Merhi A et al. Effect of statins on ventricular tachyarrhythmia, cardiac arrest, and sudden cardiac death: a meta-analysis of published and unpublished evidence from randomized trials. Eur Heart J 2012; 33(13): 1571 – 1581. doi: 10.1093/ eurheartj/ ehs005.
44. Friedman KG, Alexander ME. Chest pain and syncope in children: a practical approach to the diagnosis of cardiac disease. J Pediatr 2013; 163(3): 896 – 901. doi: 10.1016/ j.jpeds.2013.05.001.
45. Tretter JT, Kavey RE. Distinguishing cardiac syncope from vasovagal syncope in a referral population. J Pediatr 2013; 163(3): 1618 – 1623.e1. doi: 10.1016/ j.jpeds.2013.07.023.
46. Myerburg RJ, Kessler KM, Castellanos A. Sudden cardiac death. Structure, function, and time-dependence of risk. Circulation. 1992; 85 (1 Suppl): I2 – I10.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek Arytmie u mladých dospělýchČlánek Juvenilní hypertenze
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2018 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Juvenilní hypertenze
- Chronická žilní insuficience a varixy dolních končetin u mladých osob
- Význam a léčba dyslipidemie u mladých dospělých
- Diabetes mellitus a kardiovaskulární onemocnění
- Možnosti ovlivnění inzulinové rezistence u jedinců s diabetem 1. typu
- Klinická štúdia ODYSSEY OUTCOMES
- Kyslíková terapie při podezření na akutní infarkt myokardu – studie DETO2X-AMI
- Fixní kombinace rosuvastatinu s ezetimibem – lékový profil
- Manažment hypertenzikov s končatinovocievnou artériovou chorobou
- Kongres srdečního selhání – Vídeň 2018
- Arytmie u mladých dospělých
- Prevence náhlé srdeční smrti u pacientů do 40 let věku
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Arytmie u mladých dospělých
- Juvenilní hypertenze
- Fixní kombinace rosuvastatinu s ezetimibem – lékový profil
- Chronická žilní insuficience a varixy dolních končetin u mladých osob
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




![Nejčastější typy syndromu dlouhého QT a jejich EKG manifestace. Upraveno dle [5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/97709a27d42eb46fa3950ab75a19e880.jpeg)
![Seattle kritéria – abnormální EKG nálezy u atletů [32].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/e60355fef42933b0e70b21d27f8ccd48.jpeg)