-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Orgánové komplikace arteriální hypertenze a riziko kardiovaskulárních onemocnění
End organ damage in arterial hypertension and cardiovascular risk
Arterial hypertension leads to a subclinical end organ damage, which increases patients‘ total cardiovascular risk. Hypertensive heart disease can be diagnosed as left ventricular hypertrophy by echocardiography or several electrocardiographic indices. Arterial wall damage is assessed by carotid ultrasound by a measurement of intima-media thickness, as well as by carotid-femoral pulse-wave velocity or ankle-brachial index. Albuminuria and estimated glomerular filtration rate are evaluated to diagnose hypertensive nephropathy. Cerebrovascular damage, including microangiopathic changes, is best diagnosed by magnetic resonance imaging. In case of confirmed subclinical organ damage, antihypertensive drug treatment should be initiated immediately and the type of drug chosen accordingly, usually including an inhibitor of the renin-angiotensin system.
Keywords:
hypertension – end organ damage – target organ damage – left ventricular hypertrophy – nephropathy – vasculopathy – cardiovascular risk
Autoři: J. Václavík
Vyšlo v časopise: Kardiol Rev Int Med 2013, 15(4): 211-217
Kategorie: Preventivní kardiologie
Souhrn
Arteriální hypertenze vede k subklinickému postižení orgánů, které výrazně zvyšuje kardiovaskulární riziko pacienta. Hypertenzní postižení srdce ve formě hypertrofie levé komory lze diagnostikovat echokardiograficky nebo pomocí elekrokardiografických indexů. Postižení tepen je možné verifikovat ultrazvukovým vyšetřením karotid s měřením jejich intimomediální tloušťky, vyšetřením rychlosti karotidofemorální pulzní vlny nebo indexu kotník-paže. Ke zjištění postižení ledvin se provádí vyšetření albuminurie a odhad glomerulární filtrace. Cerebrovaskulární postižení včetně časných mikroangiopatických změn se nejlépe diagnostikuje magnetickou rezonancí. Při nálezu orgánového postižení je indikována okamžitá farmakologická léčba hypertenze a dle typu orgánového postižení volíme vhodné antihypertenzivum, nejčastěji inhibitor systému renin-angiotenzin.
Klíčová slova:
hypertenze – orgánové komplikace – postižení cílových orgánů – hypertrofie levé komory – nefropatie – vaskulopatie – kardiovaskulární rizikoÚvod
Arteriální hypertenze je nejčastějším kardiovaskulárním onemocněním, které je vzhledem k prevalenci více než 40 % přítomno asi u 3,8 milionu dospělých v ČR [1]. Přestože je většina pacientů asymptomatická a nepociťuje žádné obtíže, dochází při trvající hypertenzi k postupnému rozvoji orgánových komplikací a následně se může manifestovat ve formě manifestního kardiovaskulárního onemocnění, jako je např. cévní mozková příhoda nebo ischemická choroba srdeční.
Orgány, které bývají při hypertenzi postiženy nejčastěji, jsou cévy, srdce, mozek a ledviny (tab. 1) [2].
Tab. 1. Reverzibilní a ireverzibilní orgánové poškození u arteriální hypertenze. ICHS – ischemická choroba srdeční, upraveno dle [2]. ![Reverzibilní a ireverzibilní orgánové poškození u arteriální hypertenze.
ICHS – ischemická choroba srdeční, upraveno dle [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/97e684f9d0b2a88c10043c07852c68d3.png)
Orgánové komplikace způsobují, že pacienti s hypertenzí přežívají průměrně o pět let méně než pacienti s normotenzí [3]. Je proto důležité orgánové postižení včas diagnostikovat a vhodným způsobem léčit, neboť tím můžeme oddálit vznik kardiovaskulárních příhod, případně jim úplně zabránit. V následujících statích se proto podrobněji podíváme na klinické projevy a diagnostiku postižení jednotlivých orgánů.
Hypertenzní postižení srdce
Při hypertenzi dochází v srdci k řadě funkčních a strukturálních změn. Dlouhodobě zvýšený afterolad při hypertenzi vede ke zvýšení počtu a/nebo velikosti sarkomer v kardiomyocytech, a tím k rozvoji hypertrofie levé komory (LK).
Hypertrofie LK je definována jako zvýšení hmotnosti LK nad normu (u mužů > 115 g/m2, u žen > 95 g/m2 tělesného povrchu) [4]. Bývá poměrně časným důsledkem hypertenze, neboť je echokardiograficky prokazatelná již u dětí a adolescentů s hraničním zvýšením krevního tlaku [5]. Framinghamská studie ukázala, že zvýšená hmotnost LK může být dokonce zobrazovacími metodami prokazatelná ještě před manifestací hypertenze [6]. V rozvoji hypertenze i hypertrofie LK totiž hraje významnou roli systém renin-angiotenzin a zejména aktivita angiotenzin konvertujícího enzymu (ACE) v srdci (přítomnost polymorfizmu genu pro receptor angiotenzinu II-1332G/A je asociována s častějším výskytem hypertrofie LK) [7,8]. Dále se na rozvoji hypertrofie LK podílí zvýšená aktivita sympatického nervového systému, rasa (častější výskyt hypertrofie LK u černochů) a další dědičné faktory (např. proteinkináza C, receptor bradykininu 2).
Rizikovými faktory pro rozvoj hypertrofie LK jsou nadměrný vzestup tlaku (TK) při mentálním stresu nebo fyzické zátěži, absence poklesu TK v nočních hodinách a zvýšená tzv. „tlaková zátěž“: čím má pacient vyšší procento krevního TK při ambulantním monitorování nad normu (tj. v denních hodinách > 135/85 mmHg a v noci > 120/80 mmHg), tím více disponuje ke vzniku hypertrofie LK.
Hypertrofii LK je možné diagnostikovat pomocí EKG a zobrazovacích vyšetření. Na EKG vede hypertrofie LK ke zvýšené voltáži a delšímu trvání QRS komplexu, deviaci osy srdeční doleva, změnám v repolarizaci (deprese ST úseku a inverze vlny T) a změnám síňové aktivity (prodloužení trvání vlny P nad 120 ms v končetinových svodech a/nebo bifázické P ve svodu V1). I při používání nových diagnostických kritérií (obr. 1) je však při specificitě 95 % senzitivita EKG pro diagnózu hypertrofie LK nízká – kolem 25 % [9]. Falešně pozitivní bývá EKG u mladých hubených jedinců, u nichž je voltáž na EKG z důvodu tenké hrudní stěny vyšší, falešně negativní naopak u obézních a pacientů s CHOPN.
Obr. 1. Obraz hypertrofie levé komory na EKG. Pro hypertrofii LK svědčí Sokolowovy-Lyonovy indexy (součet hloubky kmitu S ve svodu V1 a výšky R ve V5 nebo V6 je zde 4,1 mV, velikost kmitu R ve svodu aVL 1,2 mV) i Cornellův produkt ( je 270 mV msec). Lze si povšimnout, že na prvním EKG byla v končetinových svodech přístrojem automaticky zvolena nižší voltáž 5 mm/mV, záznam z hrudních svodů na dalším EKG vpravo je natočen se standardní voltáží 10 mm/mV. 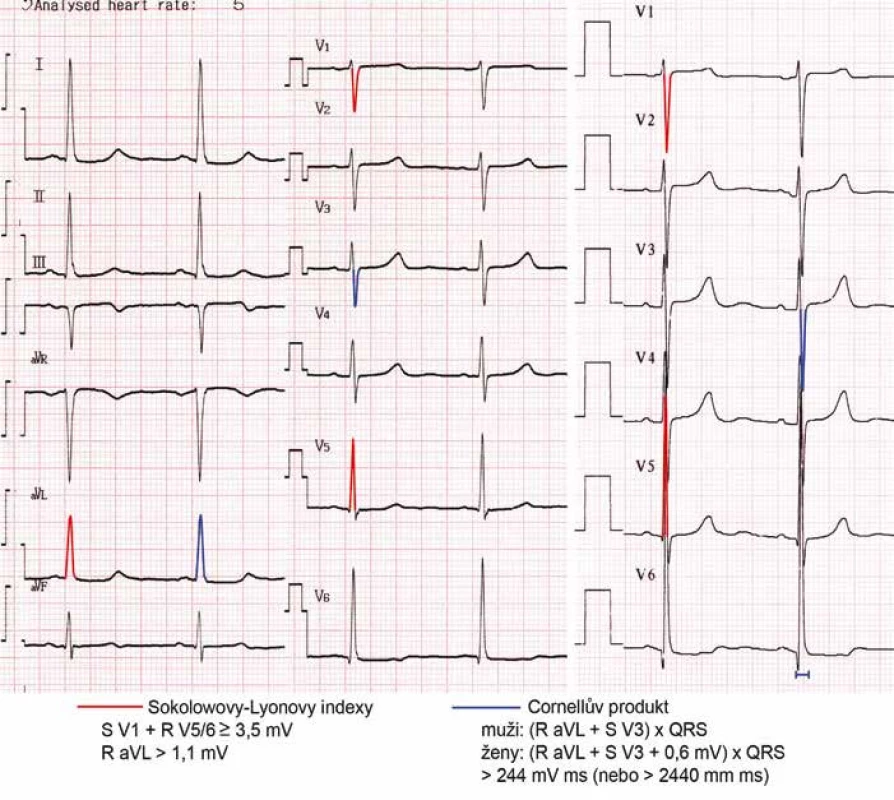
Zlatým standardem pro diagnostiku hypertrofie LK je echokardiografie. Kromě rozměrů srdečních oddílů umožňuje posoudit i jejich geometrii, systolickou a diastolickou funkci.
Hmotnost LK lze stanovit dvěma způsoby. Jednodušší metoda vychází ze standardního měření šířky enddiastolického a endsystolického rozměru LK, komorového septa a zadní stěny LK M-módem nebo lineárním měřením v 2D v parasternální projekci v dlouhé ose na úrovni chord. Hmotnost LK (obr. 2a,b) bývá přístrojem automaticky vypočítána z rozdílu objemů protáhlého elipsoidu tvořeného epikardem a endokardem dle rovnice doporučované Americkou echokardiografickou společností [10,11].
LVmass = 0,8 × {0,5[(IVS + LKD + ZS)3 – LKD3]} + 0,8 g
Výsledky tohoto vzorce dobře korelují s hmotností LK zjištěnou nekropticky (korelační koeficient r = 0,90). Tato kalkulace ale předpokládá, že u pacienta není přítomna žádná výraznější alterace geometrie LK. I malá chyba v měření rozměrů vede vzhledem k umocnění na třetí k velké chybě ve výsledně kalkulované hmotnosti LK.
Novější echokardiografické přístroje umožňují přesnější volumometrická měření hmotnosti LK (obr. 2c,d) [10,11]. K získání indexu hmotnosti LK (left ventricular mass index – LVMI, jednotka g/m2) se zjištěná hodnota LVM vydělí plochou tělesného povrchu. V praxi je využití této metody často limitováno horší transtorakální vyšetřitelností, zejména u obézních pacientů.
Obr. 2. Echokardiografické stanovení hmotnosti levé komory. Standardní měření šířky svaloviny septa, zadní stěny a enddiastolického rozměru levé komory v parasternální projekci v dlouhé ose (a), ze kterých většina echokardiografických přístrojů automaticky kalkuluje hmotnost levé komory na základě modelu protáhlého elipsoidu (b). Volumometrické stanovení hmotnosti levé komory využívá „obtažení“ endokardu a epikardu v parasternální projekci v krátké ose na úrovni papilárních svalů (c) a změření délky levé komory v apikální 4dutinové projekci (d), echokardiografický přístroj následně sám kalkuluje hmotnost levé komory podle vzorce plocha- délka. 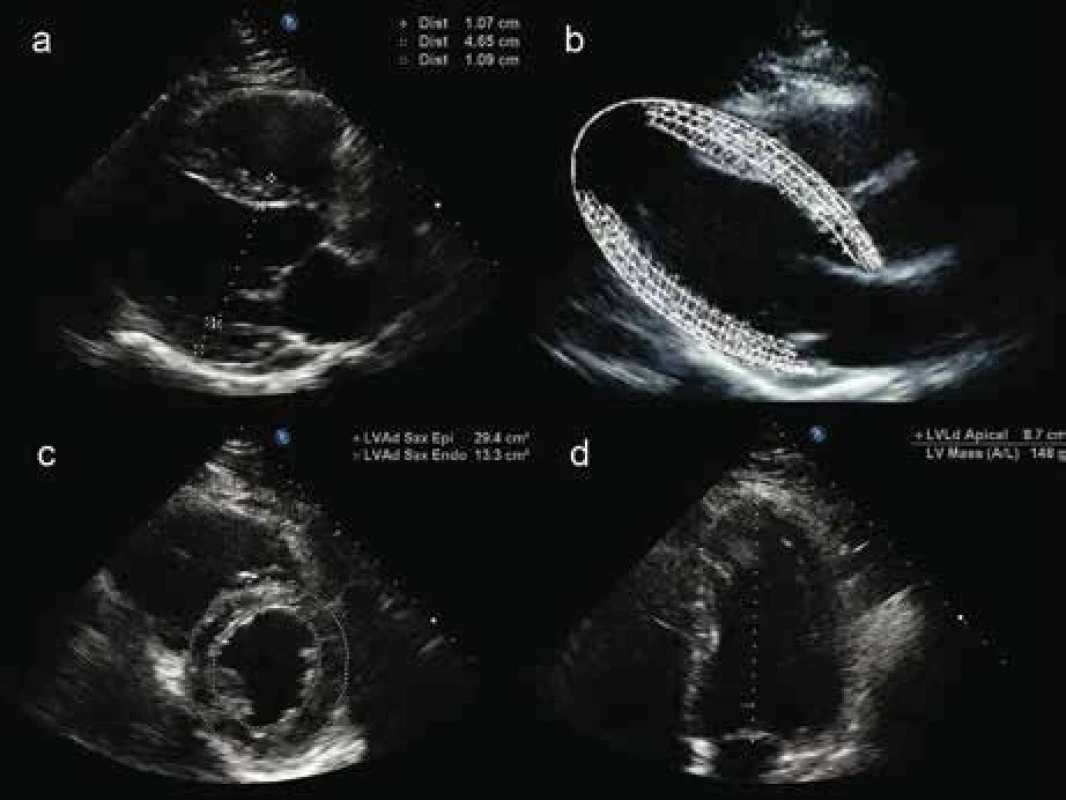
Z rozměrů stěn šíře LK z parasternálních projekcí lze stanovit také relativní tloušťku stěny LK (relative wall thickness – RWT, obr. 3). Pro praxi je důležité, že pacienti s normální hmotností LK, kteří mají koncentricou remodelaci při zvýšené relativní tloušťce stěny, mají srovnatelně zvýšené riziko výskytu kardiovaskulárních příhod a úmrtí jako pacienti s koncentrofickou hypertrofií LK, nezávisle na hodnotách krevního tlaku [12,13].
Obr. 3. Klasifikace geometrie levé komory. Relativní tloušťka stěny LK (RWT) je kalkulována ze šířky zadní stěny levé komory (ZS) a rozměru LK v enddiastole (LKd) podle vzorce RWT = 2 × ZS / LKd. Alternativně je možno místo dvojnásobku šíře zadní stěny použít součet rozměrů komorového septa a zadní stěny v enddiastole, upraveno dle [11,13]. ![Klasifikace geometrie levé komory. Relativní tloušťka stěny LK (RWT) je kalkulována ze šířky zadní stěny levé komory (ZS) a rozměru LK v enddiastole (LKd) podle vzorce RWT = 2 × ZS / LKd. Alternativně je možno místo dvojnásobku šíře zadní stěny použít součet rozměrů komorového septa a zadní stěny v enddiastole, upraveno dle [11,13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/fe1b5d5c2e452f336bbdab0a817f2319.jpg)
Hypertrofie LK je u hypertoniků velmi důležitý negativní prognostický faktor. Pacienti s hypertrofií LK mají zhruba dvojnásobně vyšší výskyt kardiovaskulárních příhod a náhlé smrti. Nárůst kardiovaskulárního rizika je úměrný stupni hypertrofie LK – každé zvýšení LVMI o 39 g/m2 je spojeno se 40% zvýšením výskytu KV příhod [14].
Zvýšené KV riziko je částečně na vrub myokardiální ischemie, ke které vede snížená denzita kapilár a snížená vazodilatační schopnost arteriol při hypertrofii LK [15]. Následná remodelace LK vede ke vzniku diastolické a systolické dysfunkce a v pozdějších stadiích ke vzniku srdečního selhání. Elektrická remodelace při hypertrofii LK je asociována s častějším výskytem fibrilace síní, komorových arytmií (zejména typu torsade de pointes) a náhlé smrti.
Regresi hypertrofie LK je možné navodit léčbou a vede ke snížení kardiovaskulárního rizika, zlepšení systolické i diastolické funkce a snížení výskytu arytmií. Z nefarmakologických opatření je doložen příznivý efekt redukce hmotnosti a snížení příjmu soli. V antihypertenzní terapii se u hypertrofie doporučuje podávání sartanů, ACE-inhibitorů a blokátorů kalciových kanálů (zejména verapamilu, diltiazemu a amlodipinu), které vedou k výraznější regresi hypertrofie LK než diuretika a betalokátory [16].
Hypertenzní poškození cév (vaskulopatie)
Hypertenze vede k remodelaci cévní stěny a přispívá k rozvoji endoteliální dysfunkce. V důsledku toho se snižuje vazodilatační schopnost rezistenčních cév, což může přispívat ke snížení koronární rezervy a rozvoji anginy pectoris. Vysoký krevní tlak společně s akcelerací projevů aterosklerózy vede jak ke vzniku aterosklerotických plátů a ischemickým komplikacím v důsledku stenotizace tepen, tak ke vzniku aneuryzmat a aortální disekce, zejména v oblasti abdominální aorty [2].
Ztluštění stěny karotidy (zvýšení tloušky intimy a medie, tzv. intima-media thickness, IMT) > 0,9 mm při měření ultrazvukem je preklinickým projevem aterosklerozy a je podobně jako přítomnost aterosklerotického plátu asociováno se zvýšeným výskytem CMP i infarktu myokardu (obr. 4) [4,17,18].
Obr. 4. Tloušťka stěny karotidy (IMT) je ultrazuvokovým přístrojem automaticky měřena v 10 mm dlouhém úseku na zadní straně arteria carotis communis (ACC) před bifurkací na a. carotis interna (ACI) a a. carotis externa (ACE) (a – místo měření IMT vyznačeno růžově; b – ze 150 automatických měření mezi žlutou a červenou linií je vypočítána průměrná hodnota IMT). Za aterosklerotický plát jsou dle mezinárodního konsenzu považována místa, kde je cévní stěna širší > 1,5 mm (b-1), zužuje lumen o > 0,5 mm (b-2) nebo se IMT oproti okolním místům rozšiřuje o > 50 % (b-3), upraveno dle [18]. ![Tloušťka stěny karotidy (IMT) je ultrazuvokovým přístrojem automaticky měřena v 10 mm dlouhém úseku na zadní straně arteria carotis communis (ACC) před bifurkací na a. carotis interna (ACI) a a. carotis externa (ACE) (a – místo měření IMT vyznačeno růžově; b – ze 150 automatických měření mezi žlutou a červenou linií je vypočítána průměrná hodnota IMT). Za aterosklerotický plát jsou dle mezinárodního konsenzu považována místa, kde je cévní stěna širší > 1,5 mm (b-1), zužuje lumen o > 0,5 mm (b-2) nebo se IMT oproti okolním místům rozšiřuje o > 50 % (b-3), upraveno dle [18].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/172673ddf79e1d4d6fe109bc7d003cde.jpg)
S rostoucím věkem se zvětšuje tuhost periferních cév, což vede k nárůstu systolického a pulzního tlaku a vzniku izolované systolické hypertenze. Ke zhodnocení tuhosti aorty je používáno vyšetření karotidofemorální rychlosti pulzní vlny (pulse wave velocity – PWV). Jelikož tužší cévní stěna vede pulzní vlnu rychleji, PWV > 10 m/s je považována za patologickou a je také nezávislým prediktorem KV příhod u hypertoniků [4]. Ultrazvukové vyšetření karotid a vyšetření PWV je vhodné provádět zejména u asymptomatických osob se středně vysokým KV rizkem, protože nám řadu pacientů umožní překlasifikovat do vyšších kategorií rizika.
Index kotník-paže (ankle-brachial index – ABI) je definován jako poměr systolického TK naměřeného na kotníku k systolickému tlaku na paži (vyšší naměřená hodnota z měření TK na levé a pravé paži). Jeho nízká hodnota < 0,9 svědčí pro přítomnost hemodynamicky významné stenózy v tepnách dolních končetin a obecně po pokročilou aterosklerózu a signalizuje dvojnásobně zvýšené desetileté riziko KV příhod a úmrtí [4]. Při výrazných kalcifikacích periferních tepen při pokročilé ischemické chorobě dolních končetin jsou tepny špatně stlačitelné, hodnota ABI > 1,2 je proto rovněž považována za patologickou a měla by být indikací k podrobnějšímu vyšetření periferních tepen. Krevní tlak na kotníku je možné měřit pomocí rtuťového sfygmomanometru a kontinuálního dopplerovského vyšetření, ale v naší praxi většinou používáme poloautomatický oscilometrický tonometr nasazený na kotník s čidlem v manžetě umístěným za vnitřním kotníkem.
Nejdůležitější v léčbě hypertenzní vaskulopatie je účinné a výrazné snížení krevního tlaku. Většina antihypertenziv snižuje cévní rezistenci velkých tepen, betablokátory však méně. Ve studii CAFE bylo při obdobném periferním krevním tlaku na paži v atenololové větvi pozorováno méně výrazné snížení centrálního tlaku než v amlodipinové větvi, což je jedním z vysvětlení nižší mortality pacientů v amlodipinové větvi ve studii ASCOT [19].
Hypertenzní poškození mozku a sítnice
Arteriální hypertenze je nejdůležitější příčinou vzniku cévní mozkové příhody (CMP), která je v 80–90 % způsobena ischemickým infarktem. Kromě makroangiopatických může hypertenze vést také ke vzniku mikroangiopatických lézí – lakunárních infarktů a mozkových mikrohemoragií.
Lakunární infarkty jsou malé nekortikální infarkty (velikosti 0,2–15 mm), které jsou většinou lokalizovány v bazálních gangliích, subkortikální bílé hmotě a pontu. Vznikají okluzí některé drobnější penetrujcí větve velké cerebrální arterie. U hypertoniků je jejich výskyt 1,6× častější [20]. Jsou příčinou 15–25 % ischemických CMP, jejichž klinická manifestace bývá vzhledem k menšímu rozsahu mírnější (často čistě motorická hemiparéza nebo čistě senzorický deficit) a krátkodobá prognóza lepší než u jiných příčin CMP. Mohou ale také proběhnout asymptomaticky. Ke zobrazení lakunárních infarktů je vhodnější magnetická rezonance (MR), která je zachytí lépe než vyšetření na CT [21,22].
Nejčastějším nálezem na MR bývají tzv. hyperintenzity bílé hmoty. Společně s mikrohemoragiemi a lakunárními infarkty mohou být příčinou poklesu kognitivních funkcí a rozvoje vaskulární demence. Měli bychom proto po nich pátrat zejména u hypertoniků s poruchami paměti nebo jinými nervovými poruchami [4].
Mikrovaskulární postižení mozku je rovněž nezávislým rizikovým faktorem spojeným s 2–4násobně vyšším rizikem vzniku CMP a 2,6násobným rizikem vaskulárního úmrtí [23,24]. Prostřednictvím MR mozku je detekovatelné častěji (44 %) než subklinické postižení srdce (21 %) a ledvin (24 %), ale vysoká cena a omezená dostupnost vyšetření MR zatím neumožňují její plošné používání.
Vyšetření očního pozadí již není doporučováno u mírných a středně těžkých hypertoniků k detekci časných stadií hypertenzní retinopatie, protože nález časných stadií stupně I a II je málo reproducibilní a nedostatečně koreluje s hodnotami krevního tlaku [4,25]. Svou roli však stále fundoskopie má u emergentních hypertenzních stavů (k potvrzení hypertenzní encefalopatie) a u rezistentní hypertenze, u které jsou nálezy stupně III (retinální hemoragie a exsudáty) a IV (edém papily) spojeny s vyšším KV rizikem [4].
Hypertenzní nefropatie
Hypertenze a diabetes jsou v rozvinutých zemích nejčastější příčinou vzniku chronického onemocnění ledvin (chronic kidney disease – CKD). CKD je definováno jako abnormality struktury nebo funkce ledvin přetrvávající déle než tři měsíce. K diagnóze musí být splněno alespoň jedno z následujících kritérií: přítomnost albuminurie s poměrem albumin/kreatinin (ACR) ≥ 30 mg/g (nebo ≥ 3 mg/mmol), snížená glomerulární filtrace (GFR) < 60 ml/min/1,73 m2, abnormality v močovém sedimentu nebo při histologickém vyšetření, strukturální změny při zobrazovacích vyšetřeních, anamnéza transplantace ledvin nebo elektrolytové abnormality v důsledku tubulárních poruch [26].
CKD by mělo být dle nových doporučení KDIGO z roku 2012 (Kidney disease improving global outcomes) klasifikováno podle příčiny (v kontextu anamnézy, fyzikálního vyšetření a laboratorních a zobrazovacích vyšetření, např. „hypertenzní a diabetická nefropatie“), kategorie GFR a albuminurie (obr. 5). Dřívější stadium 3 při GFR < 60 ml/min/1,73 m2 bylo nově rozděleno na dvě podskupiny, 3a a 3b, umožňující přesnější funkční i prognostickou stratifikaci (obr. 5) [26].
Obr. 5. Klasifikace a prognóza chronického onemocnění ledvin (CKD) dle doporučení KDIGO z roku 2012. Zeleně – nízké riziko (pokud nejsou jiné známky onemocnění ledvin, nejedná se o CKD), žlutě – středně zvýšené riziko, oranžově – vysoké riziko, červeně – velmi vysoké riziko, upraveno dle [26]. ![Klasifikace a prognóza chronického onemocnění ledvin (CKD) dle doporučení KDIGO z roku 2012. Zeleně – nízké riziko (pokud nejsou jiné známky onemocnění ledvin, nejedná se o CKD), žlutě – středně zvýšené riziko, oranžově – vysoké riziko, červeně – velmi vysoké riziko, upraveno dle [26].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b6b73a78800264fff7f444111898aeaf.jpg)
Glomerulární filtrace (GFR) od čtvrté dekády fyziologicky klesá s věkem asi o 1 ml/min/rok. Přítomnost hypertenze a diabetu rychlost jejího poklesu urychlují až desetinásobně. Stanovení GFR se většinou provádí odhadem na základě výpočtu ze sérového kreatininu, věku, pohlaví a rasy. V našich podmínkách je nejčastěji používán výpočet GFR dle rovnice MDRD [27], její výsledky při hodnotách GFR > 60 ml/min jsou však méně přesné, a proto řada laboratoří zejména v USA přešla na výpočet dle novější rovnice CKD-EPI [28]. V případě hraniční odhadované GFR z kreatininu v rozmezí 45–60 ml/min/1,73 m2 a absence dalších ukazatelů poškození ledvin je doporučeno stanovení cystatinu C a výpočtu glomerulární filtrace z cystatinu C, které jsou přesnější a umožní potvrzení diagnózy CKD [26].
Ke vzniku albuminurie dochází při patologickém zvýšení permeability glomerulární membrány a dalších strukturálních a funkčních změnách v glomerulech. Termín mikroalbuminurie by se již neměl používat, protože v lékaři falešně evokuje pocit, že poškození ledvin je „minimální“. Stejně jako snížená GFR < 60 ml/min/1,73 m2 je ale i albuminurie významným prediktorem rozvoje renálního selhání i vzniku KV komplikací, významem srovnatelná s diagnózou ICHS nebo diabetes mellitus. Ke stanovení albuminurie je zapotřebí pozitivní nález alespoň ve dvou ranních vzorcích moči s poměrem albumin/kreatinin > 30 mg/g (nebo > 3 mg/mmol) [26]. K přesnému zhodnocení proteinurie a albuminurie je vhodné provedení 24hodinového sběru moči.
V antihypertenzní léčbě pacienta CKD s albuminurií je kromě restrikce příjmu proteinů a soli preferováno podávání ACE-inhibitorů nebo sartanů. Kombinace obou těchto tříd k prevenci progrese CKD již doporučována není, stejně jako není doporučováno podávání antagonistů aldosteronu u CKD [4,26]. Při poklesu GFR < 30–40 ml/min/1,73 m2 ztrácí thiazidová diuretika účinnost a měla by být nahrazena kličkovými [4,29].
Orgánové komplikace hypertenze a kardiovaskulární riziko
Před volbou terapie hypertonika bez přidružených onemocnění (prodělané KV příhody, diabetes nebo CKD) bychom měli stanovit jeho celkové kardiovaskulární riziko dle modelu SCORE [4]. Neméně důležité je pátrat po projevech orgánového postižení, protože jeho přítomnost nám umožní přesněji zhodnotit riziko pacienta a predikuje úmrtí na KV onemocnění nezávisle na SCORE (obr. 6) [30].
Obr. 6. Hodnocení kardiovaskulárního rizika u hypertonika a zahajování farmakologické léčby. RF – rizikový faktor, OP – orgánové postižení, KVO – kardiovaskulární onemocnění, upraveno dle [4,30]. ![Hodnocení kardiovaskulárního rizika u hypertonika a zahajování farmakologické léčby. RF – rizikový faktor, OP – orgánové postižení, KVO – kardiovaskulární onemocnění, upraveno dle [4,30].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6b1afbea3687de5af58e8b19b3489795.png)
U všech hypertoniků by mělo být provedeno vyšetření EKG, vyšetření albuminurie, kreatininu a odhad GFR. Individuálně lze zvážit doplnění echokardiografického vyšetření, ultrazvukové vyšetření karotid, vyšetření rychlosti karotidofemorální pulzní vlny nebo indexu kotník-paže [4]. V přítomnosti orgánového postižení je ihned nasazována antihypertenzní medikace, odvíjí se od něj volba vhodného antihypertenziva a případně i nasazení dalších léků příznivě ovlivňujících prognózu (např. statinů).
Doručeno do redakce: 14. 10. 2013
Přijato po recenzi: 4. 11. 2013
doc. MUDr. Jan Václavík, Ph.D.
I. Interní klinika – kardiologická LF UP a FN Olomouc
vaclavik.j@centrum.cz
Zdroje
1. Cífková R, Bruthans J, Adámková V et al. Prevalence základních kardiovaskulárních rizikovych faktorů v české populaci v letech 2006–2009. Studie Czech post-MONICA. Cor Vasa 2011; 53 : 220–229.
2. Schmieder RE. End organ damage in hypertension. Dtsch Arztebl Int 2010; 107 : 866–873.
3. Franco OH, Peeters A, Bonneux L et al. Blood pressure in adulthood and life expectancy with cardiovascular disease in men and women: life course analysis. Hypertension 2005; 46 : 280–286.
4. Mancia G, Fagard R, Narkiewicz K et al. 2013 Practice guidelines for the management of arterial hypertension of the European Society of Hypertension (ESH) and the European Society of Cardiology (ESC): ESH/ESC Task Force for the management of arterial hypertension. J Hypertens 2013; 31 : 1925–1938.
5. Daniels SD, Meyer RA, Loggie JM. Determinants of cardiac involvement in children and adolescents with essential hypertension. Circulation 1990; 82: 1243–1248.
6. Post WS, Larson MG, Levy D. Impact of left ventricular structure on the incidence of hypertension. The Framingham Heart Study. Circulation 1994; 90: 179–185.
7. Dzau VJ. Tissue renin-angiotensin system in myocardial hypertrophy and failure. Arch Intern Med 1993; 153 : 937–942.
8. Alfakih K, Maqbool A, Sivananthan M et al. Left ventricle mass index and the common, functional, X-linked angiotensin II type-2 receptor gene polymorphism (-1332 G/A) in patients with systemic hypertension. Hypertension 2004; 43 : 1189–1194.
9. Alfakih K, Walters K, Jones T et al. New gender-specific partition values for ECG criteria of left ventricular hypertrophy: recalibration against cardiac MRI. Hypertension 2004; 44 : 175–179.
10. Lang RM, Bierig M, Devereux RB et al. Recommendations for chamber quantification. Eur J Echocardiogr 2006; 7 : 79–108.
11. Armstrong AC, Gidding S, Gjesdal O et al. LV mass assessed by echocardiography and CMR, cardiovascular outcomes, and medical practice. JACC Cardiovasc Imaging 2012; 5 : 837–848.
12. Milani RV, Lavie CJ, Mehra MR et al. Left ventricular geometry and survival in patients with normal left ventricular ejection fraction. Am J Cardiol 2006; 97 : 959–963.
13. Devereux RB, Roman MJ, Ganau A et al. Cardiac and arterial hypertrophy and atherosclerosis in hypertension. Hypertension 1994; 23 : 802–809.
14. Verdecchia P, Carini G, Circo A et al. Left ventricular mass and cardiovascular morbidity in essential hypertension: the MAVI study. J Am Coll Cardiol 2001; 38 : 1829–1835.
15. Beache GM, Herzka DA, Boxerman JL et al. Attenuated myocardial vasodilator response in patients with hypertensive hypertrophy revealed by oxygenation-dependent magnetic resonance imaging. Circulation 2001; 104 : 1214–1217.
16. Klingbeil AU, Schneider M, Martus P et al. A meta-analysis of the effects of treatment on left ventricular mass in essential hypertension. Am J Med 2003; 115 : 41–46.
17. Chambless LE, Folsom AR, Clegg LX et al. Carotid wall thickness is predictive of incident clinical stroke: the Atherosclerosis Risk in Communities (ARIC) study. Am J Epidemiol 2000; 151 : 478–487.
18. Touboul PJ, Hennerici MG, Meairs S et al. Mannheim carotid intima-media thickness and plaque consensus (2004-2006-2011). An update on behalf of the advisory board of the 3rd, 4th and 5th watching the risk symposia, at the 13th, 15th and 20th European Stroke Conferences, Mannheim, Germany, 2004, Brussels, Belgium, 2006, and Hamburg, Germany, 2011. Cerebrovasc Dis 2012; 34 : 290–296.
19. Williams B, Lacy PS, Thom SM et al. Differential impact of blood pressure-lowering drugs on central aortic pressure and clinical outcomes: principal results of the Conduit Artery Function Evaluation (CAFE) study. Circulation 2006; 113 : 1213–1225.
20. Chen X, Wen W, Anstey KJ et al. Prevalence, incidence, and risk factors of lacunar infarcts in a community sample. Neurology 2009; 73 : 266–272.
21. Arboix A, Martí-Vilalta JL, Pujol J et al. Lacunar cerebral infarct and nuclear magnetic resonance. A review of sixty cases. Eur Neurol 1990; 30 : 47–51.
22. Jokinen H, Kalska H, Mäntylä R et al. White matter hyperintensities as a predictor of neuropsychological deficits post-stroke. J Neurol Neurosurg Psychiatry 2005; 76 : 1229–1233.
23. Vermeer SE, Longstreth WT Jr, Koudstaal PJ. Silent brain infarcts: a systematic review. Lancet Neurol 2007; 6 : 611–619.
24. Conijn MM, Kloppenborg RP, Algra A et al. Cerebral small vessel disease and risk of death, ischemic stroke, and cardiac complications in patients with atherosclerotic disease: the Second Manifestations of ARTerial disease-Magnetic Resonance (SMART-MR) study. Stroke 2011; 42 : 3105–3109.
25. van den Born BJ, Hulsman CA, Hoekstra JB et al. Value of routine funduscopy in patients with hypertension: systematic review. BMJ 2005; 331 : 73.
26. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int 2013; 3 (Suppl): 136–150.
27. Levey AS, Coresh J, Greene T et al. Using standardized serum creatinine values in the modification of diet in renal disease study equation for estimating glomerular filtration rate. Ann Intern Med 2006; 145 : 247–254.
28. Levey AS, Stevens LA, Schmid CH et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009; 150 : 604–612.
29. Sarafidis PA, Bakris GL. Resistant hypertension: an overview of evaluation and treatment. J Am Coll Cardiol 2008; 52 : 1749–1757.
30. Filipovský J, Widimský J jr, Špinar J. Doporučení ESH/ESC pro diagnostiku a léčbu hypertenze – verze 2013. Zkrácený překlad. Hypertenze Kardiovask Prevence 2013; 5 : 4–18.
Štítky
Angiologie Dětská kardiologie Chirurgie cévní Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2013 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Preventivní kardiologie a důležitost spolupráce mezi odborníky – editorial
- Orgánové komplikace arteriální hypertenze a riziko kardiovaskulárních onemocnění
- Aktuální pohled na možnosti primární a sekundární prevence ischemických cévních mozkových příhod
- Význam zobrazovacích metod v prevenci kardiovaskulárních onemocnění
- Psychosociální rizikové faktory kardiovaskulárních onemocnění a možnosti jejich ovlivnění
- Akutní kardiogenní poškození jater a levosimendan
- Léčba levosimendanem jako „bridge therapy“ u pacienta s metastatickým tumorem varlete a těžkým systolickým srdečním selháním – soutěžní kazuistika
- Synkopa multifaktoriální etiologie nebo několik příznaků jedné choroby? – soutěžní kazuistika
- Zasnouben se špičkovou kočkou aneb ENGAGEd to TOPCAT
- Mechanizmus pleiotropního účinku sulodexidu
- Galerie autorů
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Orgánové komplikace arteriální hypertenze a riziko kardiovaskulárních onemocnění
- Synkopa multifaktoriální etiologie nebo několik příznaků jedné choroby? – soutěžní kazuistika
- Význam zobrazovacích metod v prevenci kardiovaskulárních onemocnění
- Mechanizmus pleiotropního účinku sulodexidu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



