-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba levosimendanem jako „bridge therapy“ u pacienta s metastatickým tumorem varlete a těžkým systolickým srdečním selháním – soutěžní kazuistika
Levosimendan treatment as a „bridge therapy“ in a patient with metastatic testicular cancer and severe systolic heart failure - competition case report
We report a case of a young male with non-ischemic cardiomyopathy who was admitted to our clinic with severe systolic heart failure. Etiology was unclear, ischemic heart disease was not confirmed. Subsequently, hemoptysis occurred and examinations revealed a disseminated tumor of testicular origin. During the course of cancer treatment, as well as during the current remission of the tumor, the patient requires rehospitalization for decompensation of heart failure, managed with levosimendan. According to hemodynamic and laboratory parameters this treatment is highly efficient, quickly helps to stabilize the patient and increases his chances of being placed on the waiting list for heart transplantation, as soon as the complete remission of the tumor has prevailed for five years. A possible association of the tumor and rapid onset of heart failure is also discussed.
Keywords:
heart failure – levosimendan – hemodynamics – testicular cancer
Autoři: MUDr. Marie Pavlušová 1,2; MUDr. Roman Miklík, Ph.D. 1,3; prof. MUDr. Jindřich Špinar, CSc.; Fesc 1,2,3; MUDr. Šárka Bohatá, Ph.D. 4; MUDr. Mgr. Et Jiří Pařenica, Ph.D. 1,2,3
Působiště autorů: Interní kardiologická klinika FN Brno 1; LF MU v Brně 2; Mezinárodní centrum klinického výzkumu FN u sv. Anny v Brně 3; Radiologická klinika FN Brno 4
Vyšlo v časopise: Kardiol Rev Int Med 2013, 15(4): 240-246
Kategorie: Preventivní kardiologie
Souhrn
V naší kazuistice popisujeme případ mladého muže s neischemickou kardiomyopatií přijatého na kardiologické oddělení s těžkým systolickým srdečním selháním. Etiologie selhání nebyla přesně zjištěna, ischemická choroba srdeční nebyla potvrzena. Při podrobném došetřování následné hemoptýzy byl diagnostikován diseminovaný tumor mající origo v pravém varleti. V průběhu terapie tumoru i v současném období remise pacient vyžaduje hospitalizace pro dekompenzaci srdečního selhání, během nichž opakovaně podáváme levosimendan. Dle hemodynamických i laboratorních hodnot je tato léčba vysoce účinná, pacienta pomáhá brzy stabilizovat a zvyšuje jeho šance na zařazení na čekací listinu pro transplantaci srdce po uplynutí pětiletého období kompletní remise tumoru. Diskutována je také možná souvislost nádoru se vznikem srdečního selhání.
Klíčová slova:
srdeční selhání – levosimendan – hemodynamika – tumor varleteÚvod
Navzdory tomu, že se dlouhodobá prognóza pacientů se srdečním selháním v posledním desetiletí zlepšuje, zemře polovina nemocných se systolickým srdečním selháním do čtyř let od stanovení diagnózy a více než 50 % nemocných se srdečním selháním NYHA IV umírá do jednoho roku. Celkem 40 % pacientů ze všech hospitalizovaných s diagnózou akutního srdečního selhání je během jednoho roku buď rehospitalizováno, nebo zemře [1]. Hospitalizační mortalita u pacientů s akutním srdečním selháním se pohybuje v různých registrech v závislosti na spektru sledovaných pacientů od 4 do 20 % (ALARM-HF, FINN-AKVA, EHFS I, II, ADHERE aj.) [2]. Dle českého registru akutního srdečního selhání AHEAD je hospitalizační mortalita 12,7 %, roční mortalita 34 % a během tří let zemře 47 % pacientů [3,4].
Prognózu pacientů kromě vysokého věku ovlivňují přítomné komorbidity, mezi nimiž dominují: renální insuficience, chronická obstrukční pulmonální nemoc, anemie, hypertenze nebo diabetes mellitus. V již zmíněném českém registru AHEAD má systolické srdeční selhání významně vyšší mortalitu než selhání se zachovalou systolickou funkcí levé komory.
Žádný z nám známých registrů prospektivně nevyhodnocoval výskyt tumorů v souvislosti se srdečním selháním. Dá se předpokládat, že prognóza pacientů s koincidencí srdečního selhání a nádorového onemocnění je výrazně horší. Z klinické praxe víme, že přítomné srdeční selhání limituje možnosti diagnostiky (invazivní došetřování, celková anestezie) a léčby nádoru (kardiotoxicita léků), a naopak, přítomný tumor je kontraindikací srdeční transplantace. Tito komplexní pacienti vyžadují mezioborovou spolupráci a správné načasování léčebných zákroků.
Popis případu
Diagnóza srdečního selhání: 1. hospitalizace 19.–29. září 2006 pro srdeční selhání
Mladý muž (36 let), povoláním zedník, z rizikových faktorů pouze kouření 30 cigaret za den (konzumace alkoholu jen příležitostná), byl v roce 2006 krátce hospitalizován v periferní nemocnici a pátý den přeložen na naši kliniku pro rychle progredující dušnost, kašel, únavu, otoky nohou a břicha. Posledních čtrnáct dnů udával běžné nachlazení, praktickým lékařem byl předepsán amoxicilin. Subfebrilie kolem 37 °C po několika dnech ustoupily, ale ani změna antibiotik za klarithromycin nevedla k ústupu dušnosti. Při přijetí na naši kliniku byl pacient ortopnoický, s nepřízvučnými chrůpky v obou dolních plicních polích, zvýše-nou náplní jugulárních žil a již bez zjevných oto-ků končetin po zaléčení v periferní nemocnici. Trvala sinusová tachykardie 118 tepů/min bez dalších EKG abnormalit (obr. 1), krevní tlak okolo 110/60 mmHg, klidová saturace 02 96 %. Bylo zahájeno došetřování etiologie srdečního selhání: kompletní mikrobiologie bez průkazu akutní bakteriální nebo virové infekce, antimyokardiální protilátky negativní, laboratorně výrazná elevace Nt-proBNP 4045 pg/ml (norma 0–300), lehce zvýšená hodnota C-reaktivního proteinu 10 mg/l (norma CRP 0–5) a laktát dehydrogenázy 6 µkat/l (norma LD 2,25–3,75). Troponin I rovněž negativní. Rozšířený kardiothorakální index 0,59, při echokardiografickém vyšetření (ECHOkg) patrná těžká systolicko-diastolická dysfunkce levé srdeční komory s ejekční frakcí 15 % a pseudonormalizací plnění levé komory, bez významné chlopenní vady. Hladkostěnné koronární tepny při koronarografii vyloučily ischemickou chorobu srdeční, etiologicky zvažována zánětlivá myokarditida nebo dilatační kardiomyopatie. Po stabilizaci stavu byla provedena pravostranná katetrizace, termodiluční metodou byl zjištěn výrazně snížený srdeční index (CI) 0,8 l/min/m2 (norma 2,5–4,5), zvýšený tlak v zaklínění (PCWP) 22 mmHg a zvýšený střední tlak v plicní arterii (AP mean) 30 mmHg – hodnoty prokazující přítomnost středně těžké postkapilární plicní hypertenze. O srdeční biopsii k diagnostice akutní myokarditidy se tehdy neuvažovalo.
Obr. 1. EKG při přijetí v roce 2006. 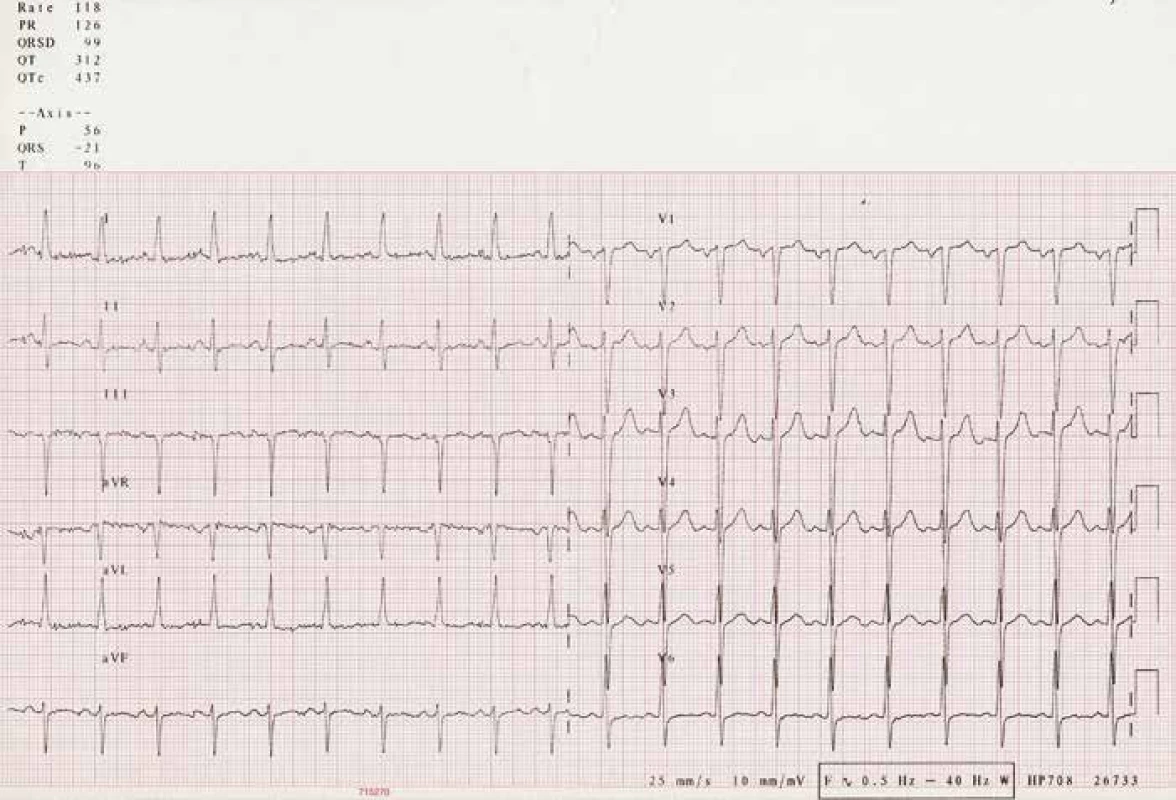
Pacient byl zaléčen intravenózním furosemidem, kalii kankreonátem a postupně dle tolerance byla nastavena léčba carvediolem (2 × 6,25 mg), ramiprilem (1 × 2,5 mg) a perorálními diuretiky (furosemid 40mg a spironolakton 25mg denně). Při propuštění byla dušnost hodnocena jako NYHA II, úbytek na váze činil 11 kg. Dle neinvazivního echokardiografického vyšetření před dimisí byl CI zlepšen na 2,2 l/min/m2 s odhadem mírné plicní hypertenze. Bylo naplánováno další ambulantní sledování a v případě progrese stavu došetření s úvahou o zařazení na listinu čekatelů na transplantaci srdce.
Druhá hospitalizace pro srdeční selhání: 6.–20. listopadu 2006 s aplikací levosimendanu
Po dvouměsíčním pobytu v domácím prostředí dochází u pacienta k akutní dekompenzaci srdečního selhání, která byla pravděpodobně vyvolána bronchitidou provázenou mírným nárůstem CRP na 13 mg/l. Klinický stav i laboratorní hodnoty byly podobné jako při předchozí hospitalizaci, opět byl nasazen klarithromycin bez většího efektu. Dle kontrolního echokardiografického vyšetření byl zjištěn pokles CI na 1,8 ml/kg/min, restrikční plnění levé komory a odhadována těžká plicní postkapilární hypertenze (systolický tlak v AP 70 mmHg). Na rentgenovém snímku bylo patrné žilní městnání bez zřetelné infiltrace v tomto terénu. Po pěti dnech intravenózní diuretické terapie bylo poprvé přistoupeno k aplikaci levosimendanu bez úvodního bolusu v dávce 0,2 µg/kg/min v trvání 22 hod, kterou pacient dobře toleroval, nebyl pozorován pokles krevního tlaku nebo arytmie. Pro omezenou spolupráci pacienta nebylo možné přesně stanovit diurézu. Kontrolní echokardiografické měření prokázalo zlepšení srdečního výdeje, CI vzrostl na 2,2 ml/kg/min a zlepšila se diastolická funkce LK hodnocená podle tkáňového dopplerovského zobrazení pohybu mitrálního anulu (E/e = 14,5 před aplikací a E/e = 12,6 po aplikaci). Ejekční frakce kulovitě remodelované levé komory zůstala nezměněna (15 %). Došlo k výraznému poklesu Nt-proBNP ze vstupní hodnoty 2 616 pg/ml na 942 pg/ml, který odpovídal subjektivnímu zlepšení stavu pacienta. Pravostranná srdeční katetrizace se neprováděla z důvodu krátké doby od předchozího měření (cca dva měsíce). Pacient byl propuštěn s medikací: furosemid 40 mg, ramipril 2,5 mg, s navýšenou dávkou carvediolu 2 × 25 mg, spironolactonu 2 × 25mg a nově nasazeným hydrochlorothiazidem 12,5 mg denně. Součástí medikace nebyla antiagregační ani antikoagulační léčba, hodnoty LD byly nadále mírně nad normou, pro odebrání onkomarkerů nebyl klinický korelát.
Spiroergometrie
V rámci ambulantního sledování byla ve stabilizovaném stavu provedena bicyklová spiroergometrie s nálezem maximální spotřeby kyslíku 14 ml/kg/min odpovídající třem metabolickým ekvivalentům (3 METS) opravňující zvažování zařazení pacienta na čekací listinu pro transplantaci srdce [5].
Diagnóza tumoru varlete: hospitalizace pro hemoptýzu 4.–8. června 2007
Po osmi měsících od poslední hospitalizace je pacient kardiálně stabilní na zavedené medikaci. Nyní přichází pro hemoptýzu a expektoraci četného sputa bez doprovodných febrilií. Při fyzikálním vyšetření není shledána patologie, v laboratoři je zvýšená hodnota LD (11,4 µkat/l) a CRP (48 mg/l). Znovu je nasazen klarithromycin. Podle RTG snímku plic jsou nově patrná kulovitá ložiska ve všech plicních polích charakteru metastáz, proto bylo doplněno CT hrudníku (obr. 2). Z odebraných onkomarkerů je extrémně zvýšená hodnota choriogonadotropinu (hCG, 109 000 U/l, norma 0–5), ostatní onkomarkery včetně alfafetoproteinu jsou nezvýšené. Po dalších provedených stagingových vyšetřeních (tomografie břicha a pánve, scintigrafie skeletu, urologie, pneumologie, onkologie) je stanovena diagnóza tumoru varlete s mnohočetnými metastázami do plic, jater a s rozsáhlým periaortálním infiltrátem v retroperitoneu, bez postižení mozku dle magnetické rezonance. Vzhledem k těžkému srdečnímu selhání a ASA skóre 3 (American society of anesthesia) byla kontraindikována biopsie z ložisek, bylo vysloveno podezření na seminom (pozitivní LD, retroperitoneální infiltrát) nebo choriokarcinom varlete (vysoké hCG, malý objem nádoru, negativní AFP) v pokročilém stadiu T1N2M1SIIIc dle TNM klasifikace s výhledem nepříznivé prognózy [6].
Obr. 2. CT hrudníku v roce 2007 – na transverzálním řezu v plicním okně jsou sledovatelná mnohočetná kulovitá ložiska v náhodné distribuci, typická pro plicní metastázy. 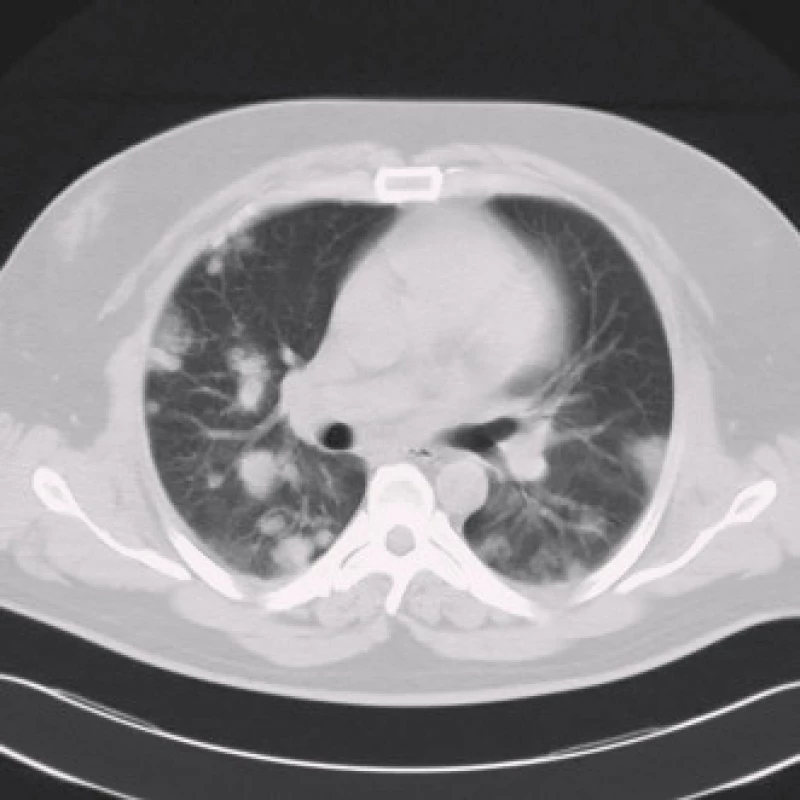
Léčba nádoru varlete: červen 2007–květen 2008
Pacient absolvoval v průběhu následujících dvou měsíců čtyři cykly chemoterapie PEB protokolu: cisplatina + etoposid + bleomycin. Ani jeden z preparátů není považován za kardiotoxický. Postupně došlo k vymizení plicních nodularit, jaterních metastáz a úspěšně byla provedena pravostranná orchiektomie, ale již bez záchytu maligních buněk. Rychlý pokles hCG koreloval s uspokojivými nálezy zobrazovacích vyšetření počítačovou i pozitronovou emisní tomografií. Vzhledem k trvalému retroperitoneálnímu infiltrátu byla aplikována radioterapie v dávce 38 Grayů. Následné kontroly opakovaně prokázaly kompletní remisi tumoru. Pro zařazení na čekací listinu pro srdeční transplantaci je vyžadována pětiletá kompletní remise [1].
Třetí hospitalizace pro srdeční selhání: 25. 1.–8. 2. 2013 s aplikací levosimendanu
Po šesti letech stability dochází u pacienta začátkem roku 2013 k progresi dušnosti, vzniku otoků dolních končetin a nechutenství vedoucí k další hospitalizaci na naší klinice. V mezidobí byl diagnostikován diabetes mellitus 2. typu s recentně zahájenou inzulinoterapií. Pacient vykazuje všechny známky plně rozvinutého oboustranného srdečního selhání dopředu i dozadu: kongestivní hepatopatii, otoky dolních končetin, ascites, výrazné plicní městnání s dilatací srdečního stínu oběma směry s predilekcí doleva dle RTG snímku (kardiotorakální index 0,61) (obr. 3), laboratorně retence dusíkatých látek, zvýšení jaterních enzymů, koagulopatie, elevace CRP na 46 mg/l (tab. 1). Dle EKG je nově zjištěn blok levého Tawarova raménka (obr. 4), v průběhu telemetrické monitorace se objevují četné běhy nesetrvalých komorových tachykardií (obr. 5). Po dobu tří dnů je postupně navyšována diuretická terapie intravenózním furosemidem a kalii kankreonátem společně s perorálně podáváným hydrochlorothiazidem 25 mg denně. Čtvrtý den je zahájeno kontinuální podávání furosemidu v dávce až 800 mg/24 hod vzhledem k trvale pozitivní bilanci tekutin. Dochází k lehkému poklesu systolického krevního tlaku na hodnoty okolo 90 mmHg, trvá sinusová tachykardie 100–110 tepů/min a zhoršují se renální i jaterní funkce (tab. 1). Pacient je nadále klidově dušný se saturací kyslíku 90 %. Carvediol, ramipril i hydrochlorothiazid jsou pro hypotenzi přechodně vysazeny. Pro obraz nízkého srdečního výdeje provázeného hypotenzí a oligourií je zahájeno pravostranné invazivní hemodynamické monitorování a je indikována další aplikace levosimendanu (tab. 2). Ten je zahájen v dávce 0,1 µg/kg/min po dobu 2 hod a dále je pokračováno v dávce 0,2 µg/kg/min v délce trvání 15 hod. Po třech hodinách infuze byla nastartována výrazná diuréza (celkem 8 000 ml/48 hod) s progresí hyponatremie, hypokalemie a hypomagnezemie, které byly intravenózně substituovány. Kontinuální podávání furosemidu bylo zastaveno. Pacient začíná opět rehabilitovat, zlepšují se laboratorní parametry a podle pravostranného monitorování dochází ke zvýšení srdečního indexu, snížení plicní i systémové vaskulární rezistence a nárůstu tepového objemu. Je zahájena léčba digitalisem 0,25 mg a navrácen carvediol v dávce 2 × 3,125 mg (7. den hospitalizace). Pro nemožnost navýšení dávky betablokátoru pro hypotenzi byl do medikace přidán ivabradin 2 × 5 mg (8. den), dále je v chronické medikaci furon 40 mg denně, spironolakton 25 mg a hydrochlorothiazid 12,5 mg denně. Pro přetrvávající spastický bronchitický nález, elevaci CRP a pozitivní bakteriologickou kultivaci sputa je pacient přeléčen antibiotickou terapií podle citlivosti (cefuroxim).
Obr. 3. RTG snímek s dilatací srdečního stínu oběma směry s predilekcí doleva, kardiothorakální index 0,61 při přijetí v roce 2013. 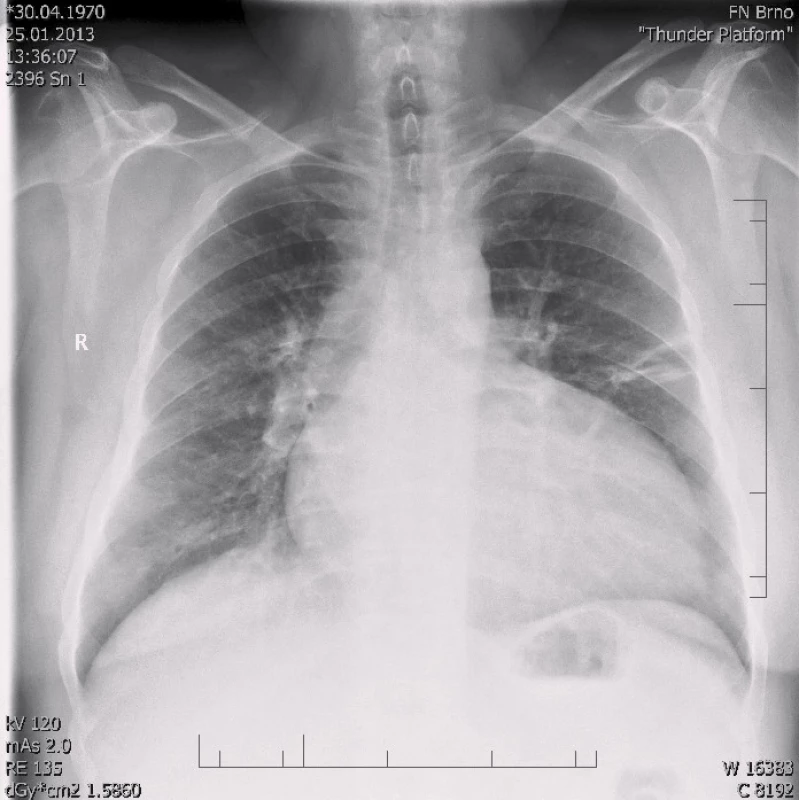
Tab. 1. Vývoj laboratorních hodnot před a po aplikaci levosimendanu za hospitalizace v roce 2013, fialovým písmem vyznačen počátek podávání levosimendanu (BNP – brain natriuretic peptide, ALT – alaninaminotransferáza, AST – aspartátaminotransferáza, GGT – gamaglutamyltransferáza, ALP – alkalická fosfatáza). 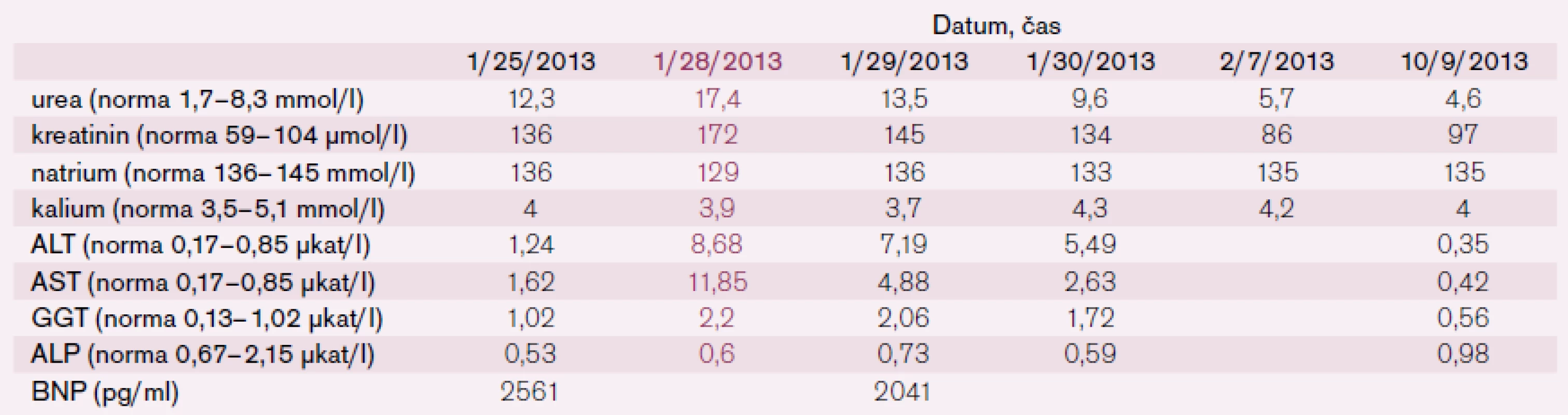
Obr. 4. EKG s nově zjištěným blokem levého Tawarova raménka v roce 2013. 
Obr. 5. EKG – strip se záznamem nesetrvalé komorové tachykardie v roce 2013. 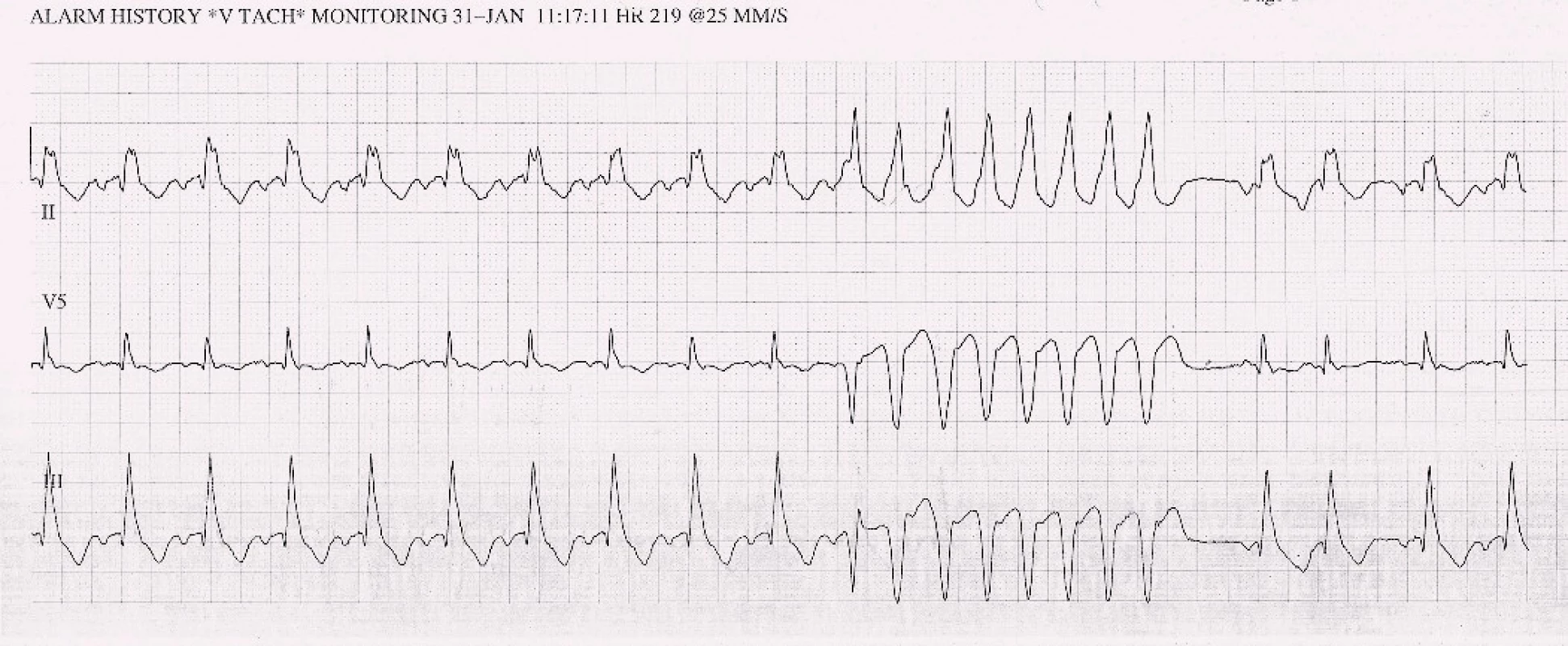
Tab. 2. Vývoj hemodynamických parametrů před a po aplikaci levosimendanu za hospitalizace v roce 2013 (TK – krevní tlak, TF – tepová frekvence, CI – cardiac index, CVP – centrální venózní tlak, PVR – plicní venózní rezistence, SVR – systémová vaskulární rezistence, SV – srdeční výdej). 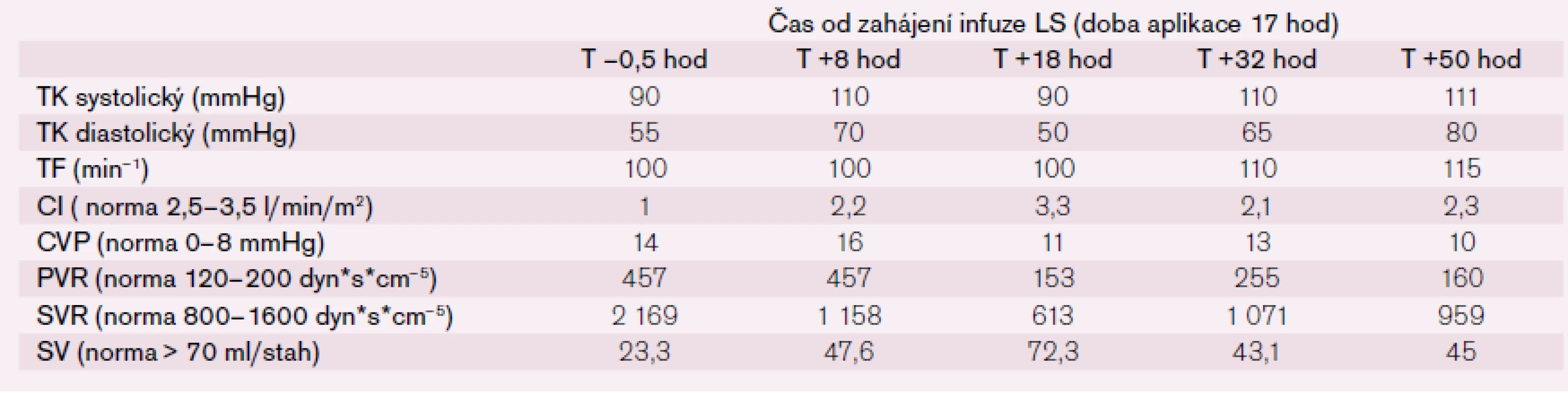
Opět je nastolena otázka srdeční transplantace. Z onkologického hlediska se nadále jeví kompletní remise tumoru, nicméně mezioborovou indikační komisí (onkolog, kardiolog, kardiochirurg, transplantolog) je rozhodnuto o dalším onkologickém sledování po dobu dvanácti měsíců, tj. o zařazení na waiting list k ortotopické transplantaci srdce se bude znovu diskutovat v květnu roku 2014. Plicní vaskulární rezistence odpovídá 3,2 Woodovým jednotkám (PVR < 3,5 W. j. je akceptovatelná), jiná než onkologická kontraindikace transplantace není v současnosti zřejmá. Vzhledem ke komorovým arytmiím na EKG, levoraménkové blokádě (obr. 4, 5) a těžké systolické dysfunkci levé komory je pacient za téže hospitalizace zajištěn „bridge“ biventrikulárním kardiovertrem-defibrilátorem (bivICD). Bez dalších komplikací je propuštěn do domácího ošetřování a ambulantního sledování.
V říjnu 2013 byla provedena kontrolní echokardiografie, nález je beze změn oproti předchozím vyšetřením (obr. 6). Taktéž bylo provedeno CT hrudníku, kde je na transverzálním řezu v měkkotkáňovém okně patrná dilatace levé komory a pleurální výpotek vpravo (obr. 7). Medikace zůstává stejná, vzhledem k hypotenzi dosud nebyl nasazen zpět ramipril. Stav je kompenzovaný, subjektivně přetrvává dušnost NYHA III, pacient je v plném invalidním důchodu a čeká na zařazení mezi čekatele na srdeční transplantaci.
Obr. 6. ECHOkg v říjnu roku 2013 (parasternální projekce – dlouhá osa) s výraznou dilatací levé komory, její průměr v diastole 75 mm. 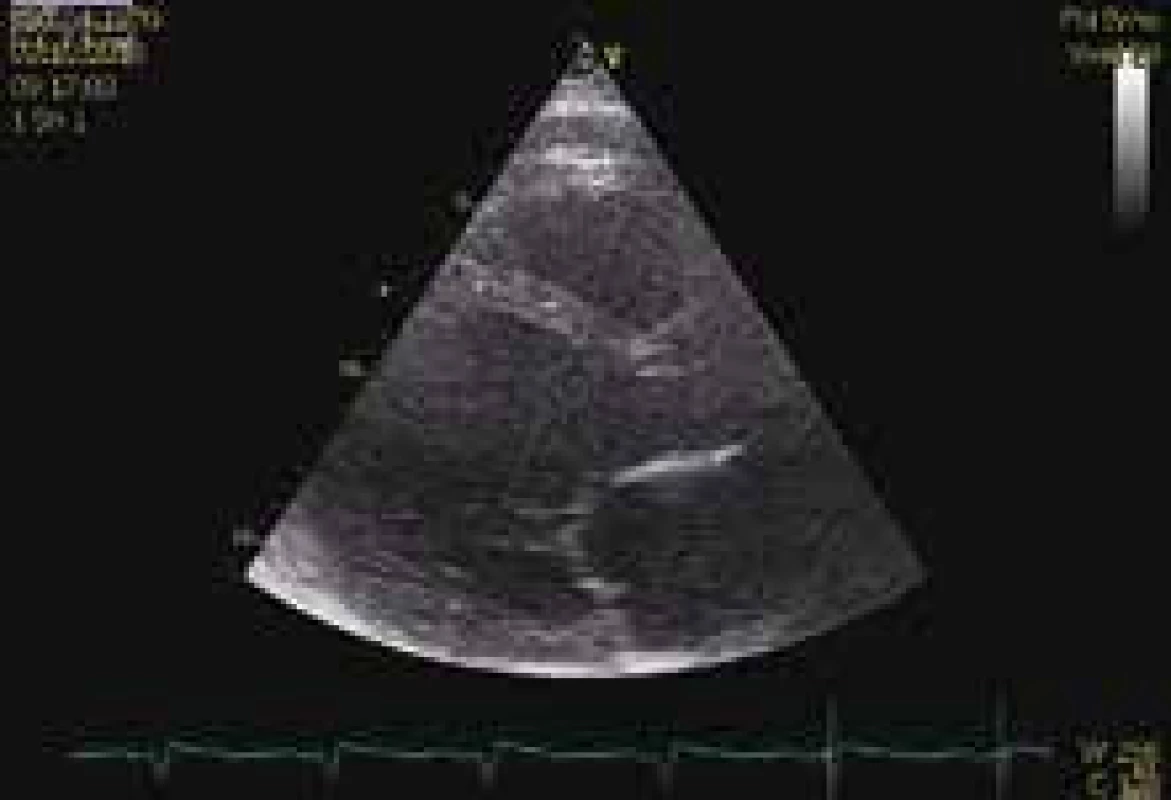
Obr. 7. CT hrudníku z roku 2013 – na transverzálním řezu v měkkotkáňovém okně sledovatelná dilatace levé komory a pleurální výpotek vpravo (šipky). 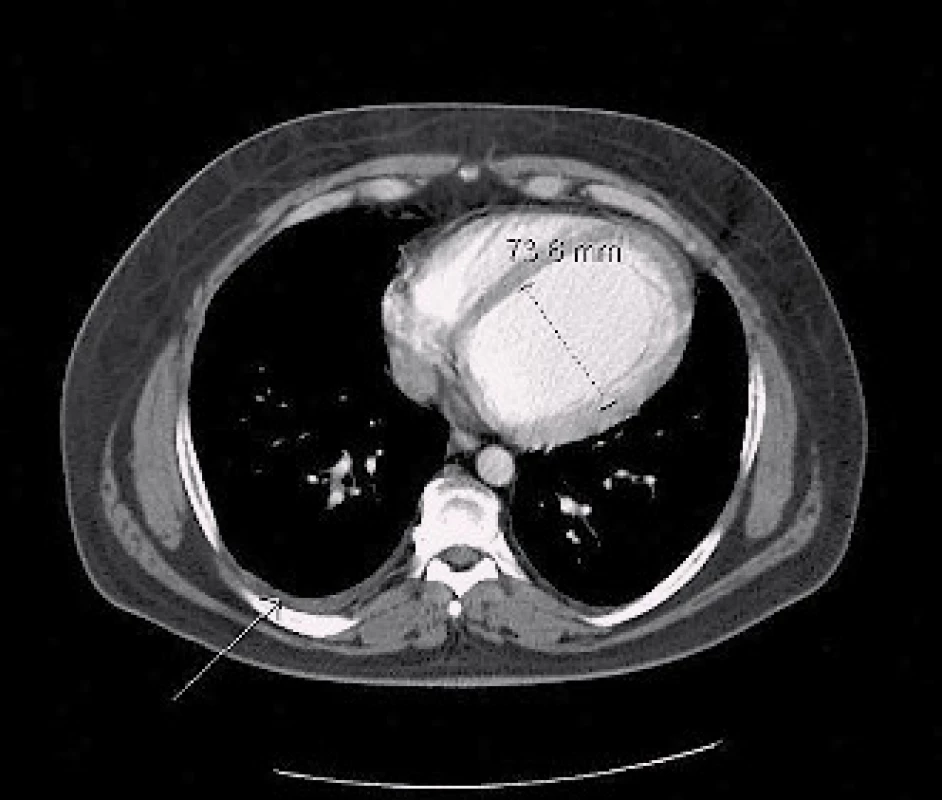
Diskuze
Pacienti se srdečním selháním neischemické etiologie mají zpravidla lepší dlouhodobou prognózu v porovnání s ischemickou etiologií, přesto přítomnost těžké systolické dysfunkce, diabetes mellitus a zhoršené renální funkce, které se u našeho pacienta postupně rozvinuly, výrazně snižují šanci dlouhodobého přežití [3]. Podle skórovacích rizikových modelů vytvořených na základě dlouhodobého sledování pacientů se srdečním selháním je riziko úmrtí našeho pacienta do jednoho roku 7 % a riziko pětiletého úmrtí je 29 % [7]. Každý další negativní faktor, kterým bezesporu nádorové onemocnění je, může progresi onemocnění urychlit.
Náš pacient od stanovení diagnózy srdečního selhání i přes opakované kardiální dekompenzace a souběžné nádorové onemocnění přežívá již sedm let. První ataka selhání byla léčena tradiční diuretickou terapií dle doporučených postupů, bohužel s krátkodobým efektem.
Při druhé a následně třetí hospitalizaci pro srdeční selhání byl aplikován levosimendan – kalciový senzitizér, který vede ke zvýšení citlivosti kontraktilních proteinů myokardu k vápníku, má pozitivně inotropní, vazodilatační a kardioprotektivní účinek [8] a nezvyšuje spotřebu kyslíku v myokardu. Velké klinické studie prokázaly jeho příznivý hemodynamický a stabilizační efekt jak u pacientů s de novo selháním, tak především u dekompenzací chronického selhávání [9]. Výsledky shrnuje tab. 3. Recentní metaanalýza 45 randomizovaných studií prokázala významně vyšší přežívání pacientů po aplikaci levosimendanu ve srovnání s placebem (o 20 %) i dobutaminem (o 32 %) [10]. Dle našich zkušeností umožňuje rychlejší zlepšení stavu nemocných po aplikaci levosimendanu časnější nastavení chronické medikace [11]. U našeho pacienta jsme v obou případech pozorovali rychlý ústup klinických symptomů, zlepšení hemodynamických parametrů – nárůst srdečního indexu, zlepšení diastolické funkce levé komory (echokardiografická monitorace v prvním případě), ale také pokles systémové i plicní vaskulární rezistence a zvýšení tepového objemu bez výrazného snížení systémového tlaku. Promptně byla nastartována diuréza, kterou nebylo možné navodit kombinací diuretik. Pozitivní efekt přetrvával po 30 hod od ukončení aplikace, kdy bylo monitorování přerušeno. Zlepšení hemodynamiky bylo provázeno normalizací hodnot jaterních enzymů, dusíkatých látek i koagulačních parametrů. V obou případech došlo k dlouhodobé stabilizaci srdečního selhání.
Tab. 3. Přehled klinických studií s levosimendanem u pacientů s akutním srdečním selháním, souhrn nejdůležitějších závěrů. 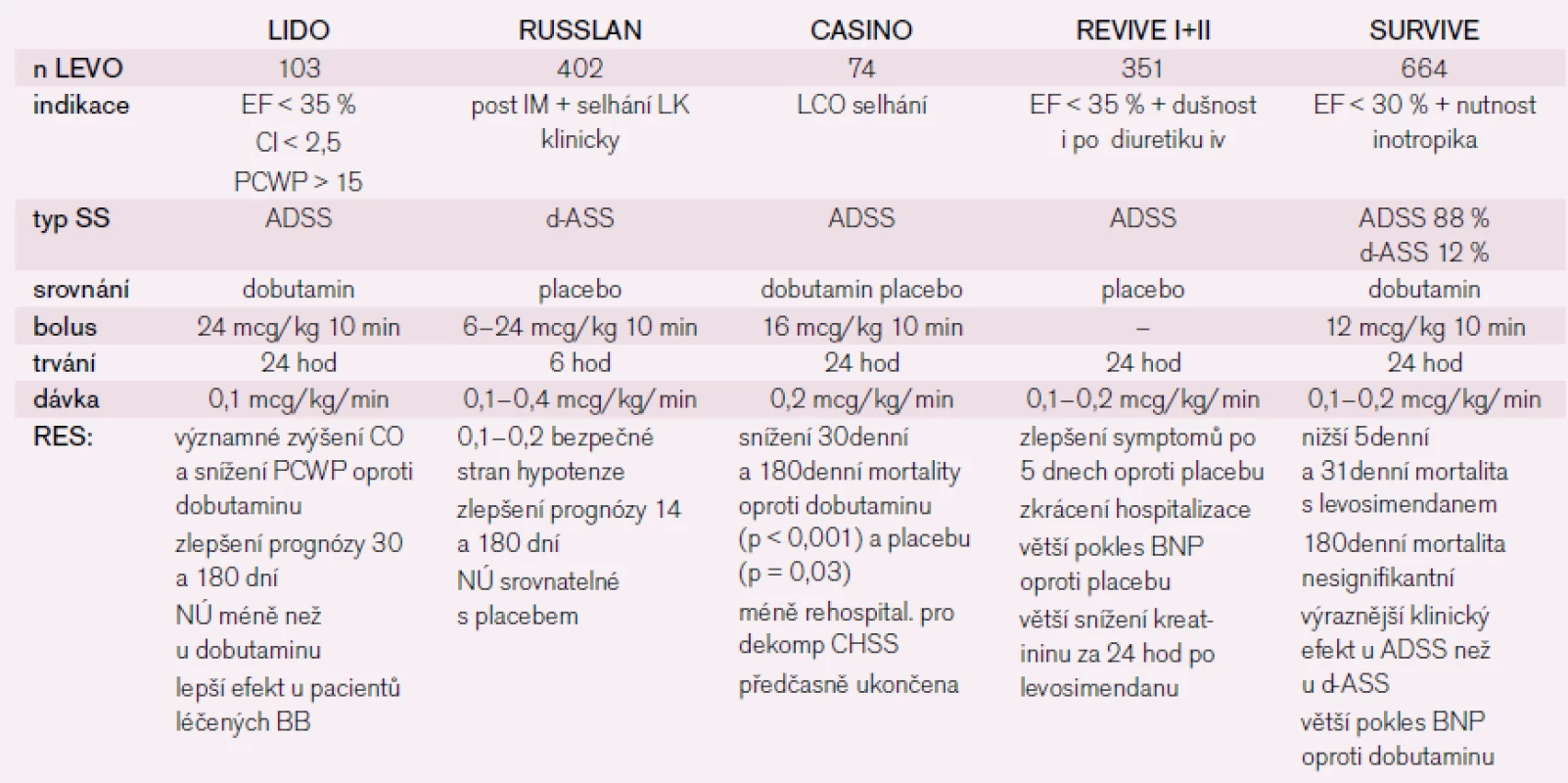
Z dnešního pohledu na vazodilatační léčbu u pacientů s akutní dekompenzací srdečního selhání by bylo zřejmě vhodné zahájit léčbu levosimendanem časněji, např. do 16 hod od přijetí [12], a předejít tak dalšímu poškození orgánů prezentovaném v našem případě progresí renální insuficience a nárůstu jaterních enzymů, které jsou výrazným negativním prognostickým faktorem [13]. Zajímavým retrospektivním zjištěním u našeho mladého pacienta je fakt, že již od samého počátku srdečních potíží měl trvale zvýšenou hodnotu laktátdehydrogenázy. Ačkoli je to parametr nespecifický, často zvýšený u hemolýz, lymfomů nebo svalových a jaterních onemocnění, je také často zvýšen u negerminativních nádorů, například choriokarcinomu [6]. Je tedy možné, že tumor byl přítomen v raném stadiu již při první atace srdečního selhání. Existují ojedinělé práce, které spojují vzniklé těžké srdeční selhání s probíhajícím tumorem, například neuroblastomem [14] či právě choriokarcinomem [15]. Jak již bylo zmíněno v úvodu, registry srdečního selhání informace o souběžných tumorech a/nebo časových rozpětích od stanovení diagnózy malignity po manifestaci srdečního selhání nesbírají. Přitom je jednoznačně prokázána imunomodulační aktivita maligních tumorů využívaná jak v jejich diagnostice (četná skupina onkomarkerů), tak v terapii některých nádorů (biologická léčba). Také srdeční selhání je provázeno zvýšenou aktivací B i T lymfocytů s prokázaným negativním vlivem na prognózu pacientů, který má svůj patofyziologický podklad [16,17]. Fakt, že reakce organizmu na zánětlivé agens, jako jsou viry nebo bakterie, může vyvolat akutní i chronickou myokarditidu s trvalou dysfunkcí levé komory, je známý již dlouhou dobu. Je teoreticky možné se domnívat, že rozvoj srdečního selhání s obrazem dilatační kardiomyopatie a diagnóza malignity u našeho pacienta spolu nějak souvisí. Je samozřejmě jenom naší spekulací, zda existuje něco jako „nádorová kardiomyopatie“.
Odpověď v současnosti neznáme, pozitivní zprávou je ale skutečnost, že díky důsledné léčbě srdečního selhání a onkologické terapii má náš pacient nadále šanci podstoupit srdeční transplantaci a navrátit se do normálního života.
Závěr
Srdeční selhání je závažná diagnóza se špatnou dlouhodobou prognózou. V léčbě pacientů je nutné využít všech možných léčebných prostředků. Ty (pokud nenavodí regresi přechodné srdeční dysfunkce) co nejdéle nemocného stabilizují, prodlouží dobu mezi akutními dekompenzacemi a – podobně jako u našeho pacienta – umožní definitivní řešení v podobě srdeční transplantace. Levosimendan je lékem ze skupiny inotropních dilatátorů a jeho aplikace zlepšuje hemodynamické parametry, čímž navozuje zvýšení diurézy, umožňuje časné nasazení perorální terapie, jeho efekt je dlouhodobý a dle našich zkušeností jej lze s úspěchem využívat v průběhu rehospitalizací. Komorbidity těchto pacientů jsou časté a navzájem se negativně ovlivňují. Nakolik je diagnóza tumoru varlete spjatá s rychlou progresí srdečního selhání u našeho pacienta již nezjistíme, ale imunologická reakce organizmu na nádor, která by mohla vést k srdečnímu selhání, by mohla být námětem k zamyšlení a k podrobnějšímu zkoumání.
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 65269705 (FN Brno) a projektem European Regional Development Fund – Projekt Fakultní nemocnice u sv. Anny v Brně a ICRC (No. CZ.1.05/1.1.00/02.0123).
Publikace byla podpořena grantem MUNI//A/0914/2012.
Doručeno do redakce: 6. 11. 2013
Přijato po recenzi: 27. 11. 2013
MUDr. Marie Pavlušová1,2
MUDr. Roman Miklík, Ph.D.1,3
prof. MUDr. Jindřich Špinar, CSc., FESC1,2,3
MUDr. Šárka Bohatá, Ph.D.4
MUDr. et Mgr. Jiří Pařenica, Ph.D.1,2,3
1 Interní kardiologická klinika FN Brno
2 LF MU v Brně
3 Mezinárodní centrum klinického výzkumu FN u sv. Anny v Brně
4 Radiologická klinika FN Brno
marie.pavlusova@fnbrno.cz
Zdroje
1. Špinar J, Vítovec J, Hradec J et al. Czech Society of Cardiology guidelines for the diagnosis and treatment of chronic heart failure 2011. Cor Vasa 2012; 54: e113–e134.
2. Miklík R, Špinar J, Pařenica J et al. Registry akutního srdečního selhání. Kardiologia pre prax 2010; 8 : 67–73.
3. Parenica J, Spinar J, Vitovec J et al. Long-term survival following acute heart failure: the Acute Heart Failure Database Main registry (AHEAD Main). Eur J Intern Med 2013; 24 : 151–160.
4. Spinar J, Parenica J, Vitovec J et al. Baseline characteristics and hospital mortality in the Acute Heart Failure Database (AHEAD) Main registry. Critical Care 2011; 15: R291.
5. Málek I. Výběr nemocných k ortotopické transplantaci srdce. In: Pirk J, Málek I. Transplantace srdce. Praha: Karolinum 2008 : 76–77.
6. Albers P, Albrecht W, Algaba F et al. EAU Guidelines on testicular cancer: 2011 update. European Association of Urology. Actas Urol Esp 2012; 36 : 127–145.
7. Levy WC, Mozaffarian D, Linker DT et al. The Seattle Heart Failure Model: prediction of survival in heart failure. Circulation 2006; 113 : 1424–1433.
8. Špinar J, Vítovec J. Levosimendan – Revised indications and posology. Cor Vasa 2007; 49 : 108–110.
9. De Luca L, Colucci WS, Nieminen MS et al. Evidence-based use of levosimendan in different clinical settings. Eur Heart J 2006; 27 : 1908–1920.
10. Landoni G, Biondi-Zoccai G, Greco M et al. Effects of levosimendan on mortality and hospitalization. A meta-analysis of randomized controlled studies. Crit Care Med 2012; 40 : 634–646.
11. Miklík R, Pařenica J, Felšöci M et al. Levosimendan v léčbě akutního srdečního selhání – zkušenosti z kardiologické kliniky. Cor Vasa 2009; 51 : 507–512.
12. Teerlink JR, Cotter G, Davison BA et al. Serelaxin, recombinant human relaxin-2, for treatment of acute heart failure (RELAX-AHF): a randomised placebo-controlled trial. Lancet 2013; 381 : 29–39.
13. Metra M, Cotter G, Davison BA et al. Effect of serelaxin on cardiac, renal, and hepatic biomarkers in the Relaxin in Acute Heart Failure (RELAX-AHF) development program: correlation with outcomes. J Am Coll Cardiol 2013; 61 : 196–206.
14. Carlson P, Jefferies JL, Kearney D et al. Refractory dilated cardiomyopathy associated with metastatic neuroblastoma. Pediatr Blood Cancer 2010; 55 : 736–738.
15. Kay S, Schneider V, Litt J. Choriocarcinoma of the mesosalpinx masquerading as congestive heart failure: ultrastructural observations of the tumor. Int J Gynecol Pathol 1983; 2 : 72–87.
16. Koller L, Richter B, Goliasch G et al. CD4+ CD28(null) cells are an independent predictor of mortality in patients with heart failure. Atherosclerosis 2013; 230 : 414–416.
17. Cordero-Reyes AM, Youker KA, Torre-Amione G. The role of B-cells in heart failure. Methodist Debakey Cardiovasc J 2013; 9 : 15–19.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2013 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Preventivní kardiologie a důležitost spolupráce mezi odborníky – editorial
- Orgánové komplikace arteriální hypertenze a riziko kardiovaskulárních onemocnění
- Aktuální pohled na možnosti primární a sekundární prevence ischemických cévních mozkových příhod
- Význam zobrazovacích metod v prevenci kardiovaskulárních onemocnění
- Psychosociální rizikové faktory kardiovaskulárních onemocnění a možnosti jejich ovlivnění
- Akutní kardiogenní poškození jater a levosimendan
- Léčba levosimendanem jako „bridge therapy“ u pacienta s metastatickým tumorem varlete a těžkým systolickým srdečním selháním – soutěžní kazuistika
- Synkopa multifaktoriální etiologie nebo několik příznaků jedné choroby? – soutěžní kazuistika
- Zasnouben se špičkovou kočkou aneb ENGAGEd to TOPCAT
- Mechanizmus pleiotropního účinku sulodexidu
- Galerie autorů
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Orgánové komplikace arteriální hypertenze a riziko kardiovaskulárních onemocnění
- Synkopa multifaktoriální etiologie nebo několik příznaků jedné choroby? – soutěžní kazuistika
- Význam zobrazovacích metod v prevenci kardiovaskulárních onemocnění
- Mechanizmus pleiotropního účinku sulodexidu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



