-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pacientka po transplantaci srdce s plicní formou invazivní aspergilózy
Heart Transplant Patient with Invasive Pulmonary Aspergillosis
Heart Transplant Patient with Invasive Pulmonary Aspergillosis. Invasive aspergillosis is a rare, but serious disease with high mortality rates especially immunodefecient patients. Early diagnoses, appropriate therapy and monitoring of disease activity are most important aspects in successful outcomes. We present a case of 41-year old woman three months after heart transplantation, in the time frame when these infectious complications are likely to occur. We would like to highlight insidious onset of the disease process, the nonrepresentative Chest X-ray, the opportunity of noninvasive diagnostic methods specifically the use of the fungal galactomanan cell wall antigen detection. Because of therapy for infectious complications in the immunosuppressed host occurs not only in transplant centers but in other medical facilities, we would like to highlight the importance of drug interactions between immunosuppressives and antibiotics and antimycotics leading to needed controls of blood concentrations.
Keywords:
orthotopic heart transplantation – invasive aspergillosis – drug interaction – tacrolimus – voriconazole – galactomanan
Autoři: P. Šajgalík 1; L. Špinarová 1; P. Hude 1; J. Krejčí 1; J. Godava 1; M. Tošková 2; Z. Ráčil 2; J. Vítovec 1; P. Němec 3
Působiště autorů: I. interní kardioangiologická klinika LF MU a Mezinárodní centrum klinického výzkumu FN u sv. Anny v Brně – ICRC 1; Interní hematoonkologická klinika LF MU a FN Brno 2; Centrum kardiovaskulární a transplantační chirurgie Brno 3
Vyšlo v časopise: Kardiol Rev Int Med 2012, 14(2): 130-132
Kategorie: Soutěžní kazuistika
Souhrn
Invazivní aspergilóza je vzácné, ale závažné onemocnění ohrožující zejména imunokompromitované pacienty vysokou mortalitou. Pro úspěšnou léčbu jsou zásadní časné stanovení diagnózy, účinná terapie a nezbytná monitorace léčby. Prezentujeme průběh léčby 41leté ženy tři měsíce po transplantaci srdce, u které se vyskytla tato infekční komplikace. Naší snahou je upozornit na možný plíživý počátek choroby, zcela nevýtěžný prostý RTG hrudníku, možnost neinvazivní diagnostiky využitím detekce antigenů buněčné stěny houby v séru – tzv. galaktomananů. Tímto sdělením chceme také připomenout nutnost pamatovat na lékové interakce imunosupresiv a antibiotik nebo antimykotik a z toho vyplývající nezbytné kontroly hladin léčiv, protože léčba infekcí se děje i mimo transplantační centra.
Klíčová slova:
ortotopická transplantace srdce – invazivní aspergilóza – lékové interakce – takrolimus – vorikonazol – galaktomananÚvod
Incidence invazivní aspergilózy u pacientů po transplantaci solidních orgánů v prvním roce je udávána 4,8 případů/1 000 pacientů [1]. Mortalita kolísá zejména v závislosti na orgánovém postižení. Celková mortalita je udávaná kolem 58 % [2], dle výsledků TRANSNET 12 měsíců se dožívá 59 % pacientů [3].
Kazuistika
Naše pacientka měla v době stanovení diagnózy 41 let, byla tři měsíce po ortotopické transplantaci srdce (OTS) pro dilatační kardiomyopatii (březen 2010). Před transplantací prodělala pacientka akutní srdeční selhání se známkami kardiogenního šoku, pro který jí byla urgentně implantována biventrikulární podpora centrifugální pumpou. Po 42 dnech jí byla provedena plastika mitrální chlopně a biventrikulární podpora změněna na levostrannou. Transplantace byla provedena po 68 dnech mechanické srdeční podpory. Celý průběh období na mechanické srdeční podpoře byl doprovázen celou řadou zejména neuropsychických a infekčních komplikací. Časný potransplantační průběh byl nekomplikovaný, akutní celulární rejekce opakovaně gr. IB, časně i gr. II, přeléčené pulzní dávkou methylprednisolonu, s dobrou funkcí štěpu s ejekční frakcí levé komory (EF LK) 65 %. Z dlouhodobé imobilizace před OTS přetrvával dekubitus sakra, potransplantačně se rozvinul steroidní diabetes mellitus 2. typu. Z dalších komorbidit měla pacientka hyperlipidemii, hypertenzní nemoc, renální insuficienci mírného stupně, difuzní velkokapénkovou steatózu jater, chronickou žilní insuficienci, stav po flebotrombóze levé dolní končetiny v roce 2005 a depresivní syndrom. Pacientka byla léčena takrolimem 19 mg/den, mykofenolát mofetilem 2,5 g/den, prednisonem 35 mg/den. Dále užívala ciprofloxacin 1 000 mg/den, valganciclovir 900 mg/den, klotrimazol spray 4krát denně do dutiny ústní, Biseptol (trimethoprim, sulfamethoxazol) 960 mg/den, metformin 2 000 mg/den, Actrapid 26 j./den, Mixtard 12 j./den, metoprolol succinas 50 mg/den, ramipril 5 mg/den, fluvastatin 80 mg/den, kys. acetylsalicylová100 mg/den, quetiapin 600 mg/den, citalopram 40 mg/den.
Pacientka byla přijata elektivně ke kontrolní endomyokardiální biopsii (EMB) po třech měsících od OTS. Posledních 14 dní udávala suchý kašel, mírně zvýšenou teplotu, absentovaly dušnost, zimnice, třesavka. Při přijetí TK 130/95 mmHg, puls 98/min, sinusový rytmus, saturace O2 periferním oxymetrem 89 %, dechová frekvence 22/min, teplota 37,3°, dýchání bilaterálně alveolární, difuzně v expíriu vrzoty, dekubitus sakra s podminovaným okrajem.
Laboratorně v krevním obraze: erytrocyty 3,2 × 1012/l, hematokrit 0,31, hemoglobin 100 g/l, trombocyty 70 × 109/l, leukocyty 0,6 × 109/l, neutrofily 62 %, absolutní počet 0,3 × 109/l, lymfocyty 25 %, absolutní počet, 0,1 × 109/l, monocyty 12,7 %, absolutní počet, 0,1 × 109/l, eozinofily, bazofily – 0, CRP 80 mg/l.
Vzhledem k dřeňovému útlumu a klinickému stavu byly vysazeny takrolimus a mykofenolát, imunosupresivní terapie převedena pouze na methylprednisolon intravenózně. Pro závažnou neutropenii byl podáván růstový faktor filgrastim. V diagnostické rozvaze jsme uvažovali o plicní infekci, uroinfekci vs infekci dekubitu. Antibiotická terapie byla empiricky upravena na meropenem, Biseptol a flukonazol. V pátrání po zdroji infekce jsme provedli následující vyšetření:
- kultivace moče – pozitivní Klebsiella pneumoniae, negativní antigen pneumokoka, legionelly
- serologie atypických pneumonií negativní (viry chřipky, adenoviry, RS viry, Mycoplasma pneumoniae, legionella, chlamydophila, coxiella burnetii)
- ale pozitivní galatomanan a glukan v séru
- stěr z dekubitu: Pseudomonas aeruginosa
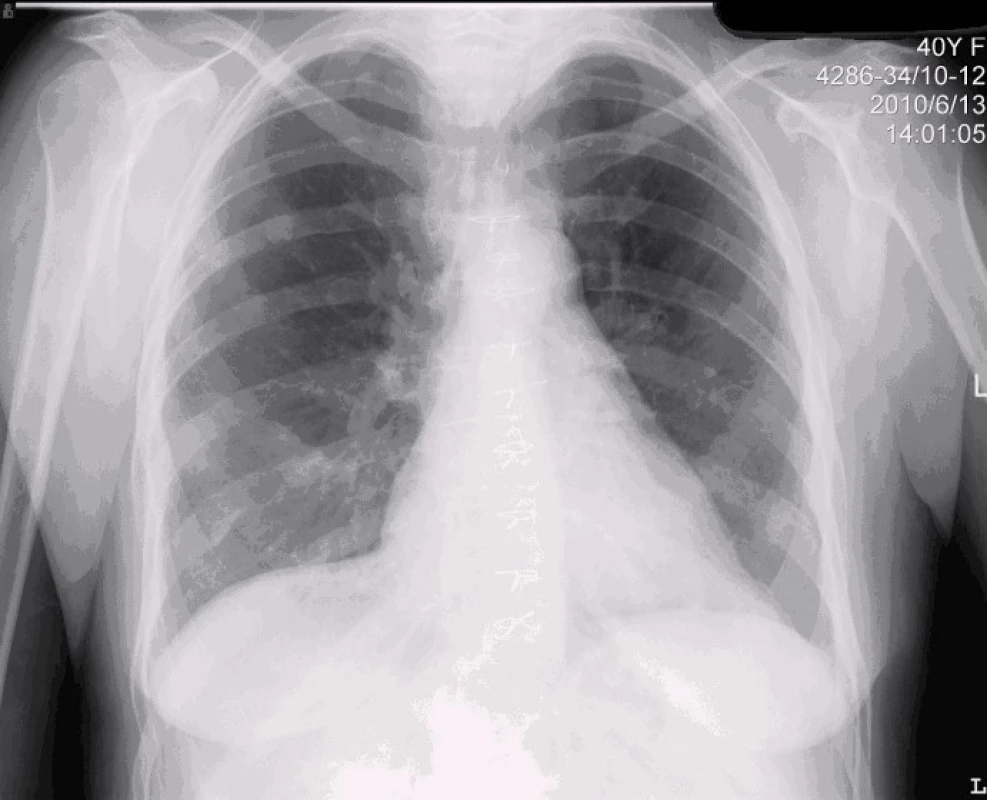
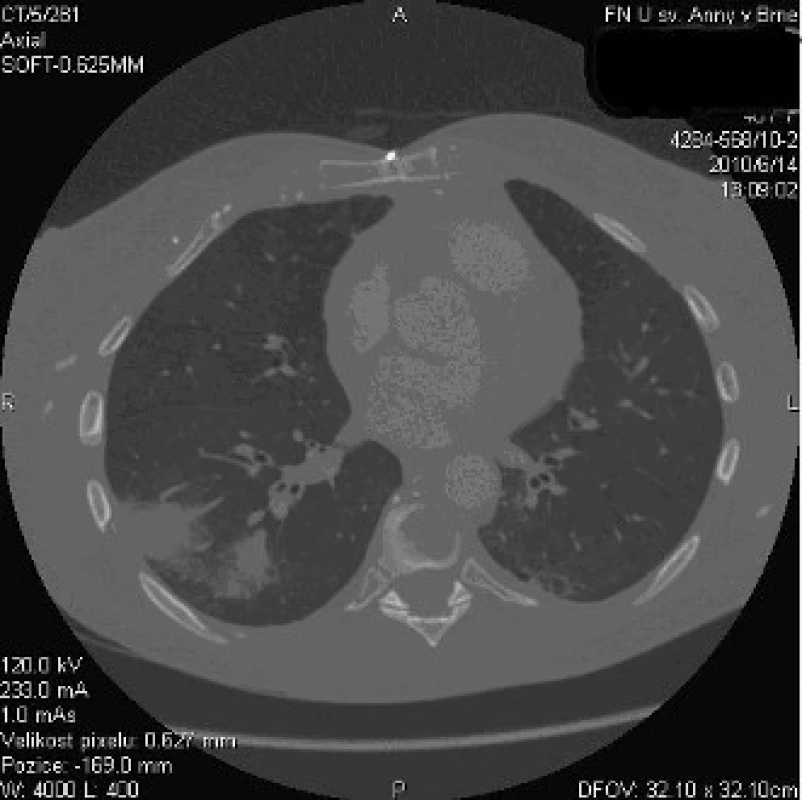
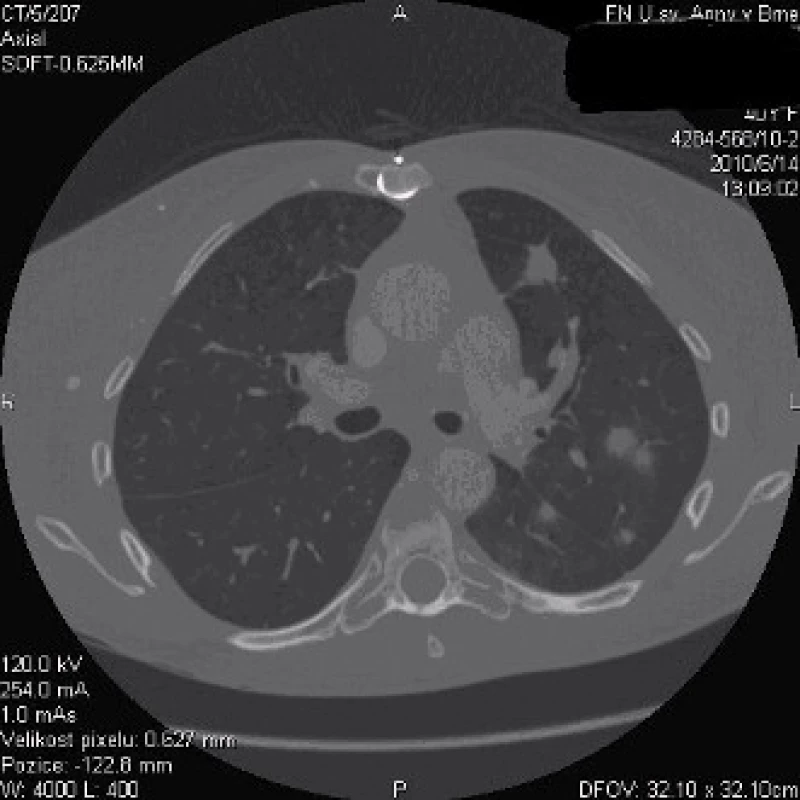
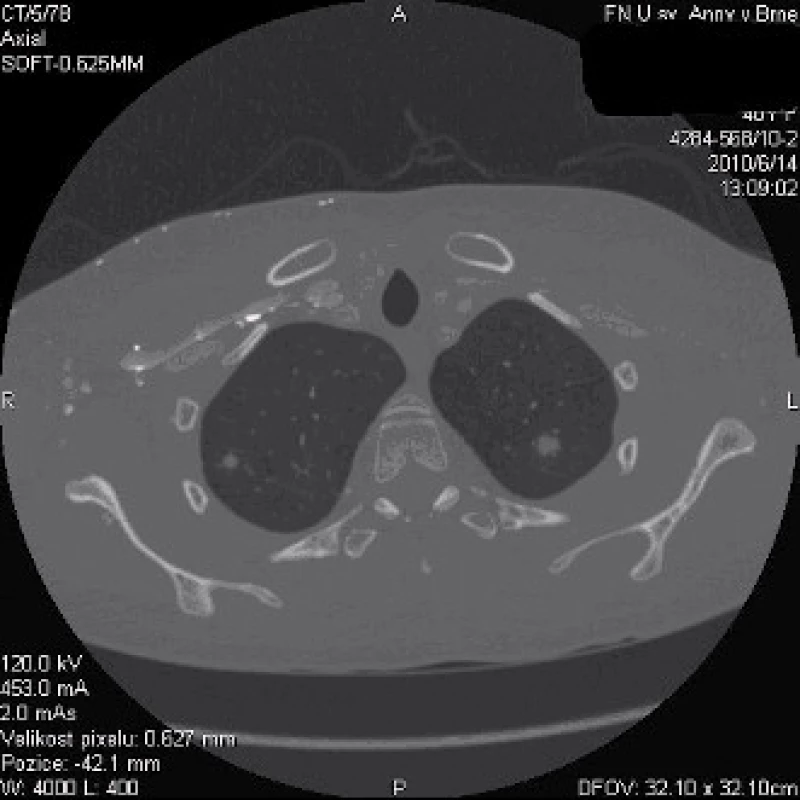
Na RTG hrudníku nebyly zachyceny jasné infiltrace parenchymu – obr. 1, nicméně pro trvající podezření na respirační origo infekce bylo doplněno CT plic, které mělo zásadní význam. Prokázalo difuzně bilaterálně mnohočetné ložiskové infiltráty – největší ložisko v průměru 25 mm, uzliny mediastina do 18 mm (obr. 2–4).
Vzhledem k nálezu ložiskových infiltrátů plic na CT byla provedena bronchoalveolární laváž (BAL) s nálezem viz tab. 1.
Tab. 1. Nález z bronchoalveolární laváže. 
Na základě výsledků byla zavedena adekvátní terapie. Zaměnili jsme flukonazol za vorikonazol – t. č. jako lék první volby ve standardním dávkování 6 mg/kg a 12 hod i. v. 1. den, dále 4 mg/kg a 12 hod i. v. na týden, pak přechod na p. o. formu 200 mg 2krát denně V-Fendu (délka i. v. podávání není přesně doporučena, kontraindikována je u závažné renální insuficience). Následně došlo k poklesu CRP, ústupu teplot, byla vysazena antibiotická terapie, ponechán pouze Biseptol k profylaxi pneumocystové pneumonie.
Pacientce se vedlo lépe, další dávkování vorikonazolu bylo titrováno podle sérových hladin, za současné monitorace léčebné odpovědi pomocí měření indexu pozitivity (IP) galaktomananů (GM) v séru, kde jsme pozorovali pokles do negativních hodnot. Graf 1 zobrazuje vztah sledovaných parametrů v průběhu osmi měsíců od nasazení terapie.
Graf 1. Hladiny indexu pozitivity galaktomananů a sérových hladin vorikonazolu. 
CT plic za měsíc od započetí účinné antimykotické terapie ovšem prokázalo spíše mírnou progresi infiltrátů. Doplnili jsme kontrolní BAL, kde přetrvával cytologicky obraz syndromu alveolární hemoragie. Případ byl konzultován na interdisciplinární komisi za přítomnosti pneumologa, chirurga a radiologa. Zvažovány byly video-asistovaná torakoskopie (VATS) či punkce ložiska pod CT kontrolou. Vzhledem k tomu, že se ale pacientce klinicky vedlo lépe, byla bez systémových známek zánětu, v periferní krvi byla nízká antigenní nálož, ponechali jsme zavedenou terapii a další sledování.
Na kontrolním HRCT 4,5 měsíce od začátku léčby byla zaznamenána významná regrese nálezu, pacientka byla nadále asymptomatická. Po zvládnutí akutní infekce jsme zpět do terapie vrátili takrolimus, což si vyžádalo redukci dávky V-Fendu pro vzestup hl. vorikonazolu. Vzestup je dán silnou interakcí na úrovni izoenzymu 3A4 cytochromu P450, kde azoly jsou výrazným inhibitorem tohoto izoenzymu [4,5]. Pacientka byla dále léčena ambulantně s častějšími kontrolami hladiny takrolimu, vorikonazolu a galaktomananů v periferní krvi. Naší snahou bylo maximálně redukovat dávky kortikoidů jako rizikového faktoru invazivní aspergilózy. Ve štěpu ovšem přetrvávala mírná akutní celulární rejekce IB, proto dávka neklesla pod 10 mg prednisonu na den.
Vorikonazol byl vysazen v březnu 2011 – po devíti měsících užívání terapie při stále negativních titrech galaktomananů v séru. Kontrolní CT za měsíc u zcela asymptomatické pacientky opět prokázalo cípovité solidní infiltráty bilaterálně difuzně do 10 mm, opět pozitivní serologický záchyt. Vorikonazol byl od dubna 2011 opět nasazen, kontrolní CT po čtyřech měsících užívání V-Fendu zcela negativní. Cílená antimykotická terapie ponechána ještě měsíc, do 12. 9. 2011. Na dalších pravidelných kontrolách jsme již nezaznamenali známky reaktivace onemocnění ani serologicky ani radiologicky.
Diskuze a závěr
Nabízí se několik otázek k řešení. Jednou z nich je délka léčby. Optimální délka léčby není známá. Dle doporučení Cell – The Czech Leukemia Study Group for Life by měla léčba trvat do dosažení kompletní léčebné odpovědi a vymizení imunodeficientního stavu, který vedl ke vzniku onemocnění [2]. Vymizení imunodeficientního stavu není u pacientů po orgánové transplantaci reálné. Je tedy snaha o vysazení v době normálního počtu neutrofilů a minimální terapie kortikoidy. Dále je často zvažován invazivní odběr materiálu s cílem zrychlení diagnostického procesu a získání přesnější informace o etiologickém agens. Toto musí být posuzováno striktně individuálně, kde významným faktorem je jednak lokalizace patologického ložiska, ale také celkový stav pacienta, např. přítomnost sekundární koagulopatie či trombocytopenie, závažná anémie, respirační insuficience apod. Možnosti neinvazivní diagnostiky pomocí galaktomananů nám poskytují cenné informace vedoucí k urychlenému stanovení diagnózy a s jistým omezením vedou k optimalizaci vedení terapie [6,7].
Průběh infekčních onemocnění u imunokompromitovaných pacientů bývá protrahovaný, vyžaduje časté kontroly radiologické a pacienty zatěžuje. Důslednou monitorací terapie se snažíme pacienty účinně léčit a nevyvolat rezistenci infekčního agens, na druhé straně nepoškodit toxicitou léčby. Pro dobré výsledky léčby u této specifické skupiny pacientů je nutná mezioborová spolupráce mezi kardiology, pneumology, mikrobiology, imunology a v případě invazivní fungální infekce i s hematoonkology.
Článek byl vypracován s grantovou podporou European Regional Development Fund – Project FNUSA – ICRC (No. CZ.1.05/1.1.00/02.0123).
Doručeno do redakce 26. 3. 2012
Přijato po recenzi 2. 4. 2012
MUDr. Pavol Šajgalík1
prof. MUDr. Lenka Špinarová, Ph.D.1
MUDr. Petr Hude, Ph.D.1
MUDr. Jan Krejčí, Ph.D.1
MUDr. Július Godava1
MUDr. Martina Tošková2
doc. MUDr. Zdeněk Ráčil, Ph.D.2
prof. MUDr. Jiří Vítovec, CSc.1
doc. MUDr. Petr Němec, CSc., MBA, FETCS3
1 I. interní kardioangiologická klinika LF MU a Mezinárodní centrum klinického výzkumu FN u sv. Anny v Brně – ICRC
2 Interní hematoonkologická klinika LF MU a FN Brno
3 Centrum kardiovaskulární a transplantační chirurgie Brno
palo.sajgalik@gmail.com
Zdroje
1. Minari A, Husni R, Avery RK et al. The incidence of invasive aspergillosis among solid organ transplant recipients and implicationsfor prophylaxis in lung transplants. Transpl Infect Dis 2002; 4 : 195–200.
2. Ráčil Z, Mayer J, Bartáková H et al. Invazivní aspergilóza: současné možnosti diagnostiky. Vnitř Lék 2007; 53 (Suppl): S1–S27.
3. Pappas PG, Alexander BD, Andes BD et al. Invasive fungal infections among organ transplant recipients: results of the Transplant-Associated Infection Surveillance Network (TRANSNET). Clin Infect Dis 2010; 50 : 1101–1111.
4. Špinarová L, Vítovec J. Imunosupresivní léčba po transplantaci srdce. Kardiol Rev 2009; 11 : 63–65.
5. Špinarová L, Vítovec J. Kombinační léčba po transplantaci srdce. Remedia 2006; 16 : 268–273.
6. Ráčil Z, Kocmanová I, Wagnerová B et al. Využití detekce galaktomananů pro diagnostiku unvazivní aspergilozy u hematoonkologikcých nemocných. Vnitř Lék 2008; 54 : 45–52.
7. Ráčil Z, Kocmanová I, Wagnerová B et al. Časná diagnostika invazivních mykotických infekcí u hematoonkologických nemocných pomocí serologických metod. Vnitř Lék 2007; 53 : 990–999.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2012 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Kam se ubírá současný vývoj léků ovlivňujících krevní srážení?
- Vorapaxar v klinických studiích
- Čo je vernakalant a kde je jeho miesto v klinickej praxi?
- Eprosartan – duální blokátor AT1 receptorů
- Polypragmazie a oběhové selhání při maligních komorových arytmiích s postižením jaterních funkcí
- Pacientka po transplantaci srdce s plicní formou invazivní aspergilózy
- Galerie autorů
- Máme dnes k dispozici lepší antitrombotika?
- Antiagregační a antikoagulační léčba – základní principy
- Perorální protidestičková léčba u pacientů s akutním koronárním syndromem
- Současné doporučení k antiagregační léčbě v neurologii
- Antikoagulační terapie a fibrilace síní
- Nová perorální antitrombotika v prevenci a léčbě trombembolizmu
- Nová antitrombotika v prevenci pooperační tromboembolické nemoci
- Současné možnosti monitorování antitrombotické léčby – nová antitrombotika
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Antiagregační a antikoagulační léčba – základní principy
- Antikoagulační terapie a fibrilace síní
- Kam se ubírá současný vývoj léků ovlivňujících krevní srážení?
- Současné doporučení k antiagregační léčbě v neurologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání