-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Perorální protidestičková léčba u pacientů s akutním koronárním syndromem
Oral antiplatelet therapy in patients with acute coronary syndrome
Modern peroral antiplatelet agents, specifically prasugrel and ticagrelor, are more effective compared to clopidogrel both in patients with acute coronary syndrome without ST elevations and in patients with myocardial infarction with ST elevation. Clopidogrel is indicated when prasugrel or ticagrelor are not suitable or unavailable. Their wider use is currently prevented by the price of both the agents.
Keywords:
acute coronary syndrome – myocardial infarction – antiplatelet agents – protone pump inhibitors – clopidogrel – prasugrel – ticagrelor
Autoři: R. Štípal
Působiště autorů: I. interní klinika – kardiologická FN Olomouc
Vyšlo v časopise: Kardiol Rev Int Med 2012, 14(2): 68-71
Souhrn
Moderní perorální protidestičkové preparáty prasugrel a ticagrelor jsou ve srovnání s clopidogrelem účinnější jak u pacientů s akutním koronárním syndromem bez ST elevací, tak u infarktu myokardu s ST elevací. Clopidogrel je indikován při nevhodnosti nebo nedostupnosti prasugrelu nebo ticagreloru, jejich širšímu použití v současné době brání cena obou preparátů.
Klíčová slova:
akutní koronární syndrom – infarkt myokardu – protidestičkové léky – inhibitory protonové pumpy – clopidogrel – prasugrel – ticagrelorÚvod
Protidestičkové (antiagregační) preparáty (AA) tvoří základ medikamentózní léčby pacientů s akutním koronárním syndromem bez ST elevací (NSTE-AKS) i s akutním infarktem myokardu s ST elevacemi (STEMI). Kyselina acetylsalicylová (ASA) blokuje agregaci destiček inhibicí tromboxanu A, k efektivní léčbě a prevenci koronární trombózy je nutná další inhibice destičkových receptorů P2Y12 jinými preparáty. Cílem sdělení je shrnutí současné strategie v léčbě pacientů s AKS duální perorální AA léčbou.
Protidestičková léčba u pacientů s NSTE-AKS
ASA je historicky prověřeným preparátem snižujícím mortalitu nebo rekurentní infarkt myokardu (IM) u pacientů s AKS [1,2]. Doporučená saturační dávka je 150–300 mg [3], případně 250–500 mg bolus i. v., udržovací dávka 75–100 mg denně se stejnou účinností jako dávky vyšší s nižším rizikem gastrointestinální intolerance [4]. Nesteroidní antiflogistika (např. ibuprofen) mohou blokovat účinek ASA a zvyšovat riziko trombózy a neměla by být u AKS podávána [5].
Ticlopidin se u AKS prakticky nepoužívá a byl pro své vedlejší účinky nahrazen clopidogrelem.
Clopidogrel patří do skupiny inhibitorů P2Y12, jejichž charakteristika je uvedena v tab. 1. Clopidogrel přidaný k ASA ve studii CURE v saturační dávce 300 mg s následnou udržovací dávkou 75 mg denně po dobu 9–12 měsíců snížil výskyt kombinovaného primárního ukazatele – smrt z kardiovaskulární příčiny (KV smrt), nefatální IM a cévní mozková příhoda (CMP) u pacientů s NSTE-AKS ve srovnání s ASA samotnou o 20 % (9,3 % vs 11,4 %; RR 0,80; 95% CI 0,72–0,90; p < 0,001) [6]. U clopidogrelu může po předčasném vysazení dojít k rebound fenoménu především u pacientů léčených konzervativně [7], nejsou ale spolehlivé důkazy pro příznivý účinek při trvání léčby déle než 12 měsíců. Vyšší riziko krvácení je převáženo příznivým účinkem, a to včetně pacientů s revaskularizací pomocí koronární intervence (PCI) i aortokoronárního bypassu (CABG) [8]. Při saturační dávce clopidogrelu 600 mg byl prokázán rychlejší a silnější inhibiční efekt než při dávce 300 mg [9]. Ve studii CURRENT-OASIS 7 byla při saturační dávce 600 mg a udržovací 150 mg denně na sedm dnů s následnou dávkou 75 mg denně ve srovnání se standardní saturační dávkou 300 mg a následnou 75 mg denně u pacientů s PCI prokázána redukce rizika v kombinovaném ukazateli KV smrt/IM/CMP (3,9 % vs 4,5 %; HR 0,86; 95% CI 0,74–0,99; p = 0,039). Přestože u dvojité dávky clopidogrelu byla zaznamenána vyšší četnost krvácení, při srovnání závažného krvácení podle TIMI definice nebyl významný rozdíl a rovněž nebyl rozdíl v intrakraniálním krvácení [10]. Nevýhodou clopidogrelu je jeho výrazná variabilita účinnosti závislá mj. na polymorfizmu genotypu. Clopidogrel je konvertován na aktivní metabolit ve dvou krocích v játrech, které jsou závislé na cytochromu P450 (CYP). Z metabolizmu clopidogrelu vyplývá jeho nekonstantní účinek u části pacientů a dále interakce s různými preparáty [11].
Tab. 1. Perorální inhibitory receptoru P2Y12. 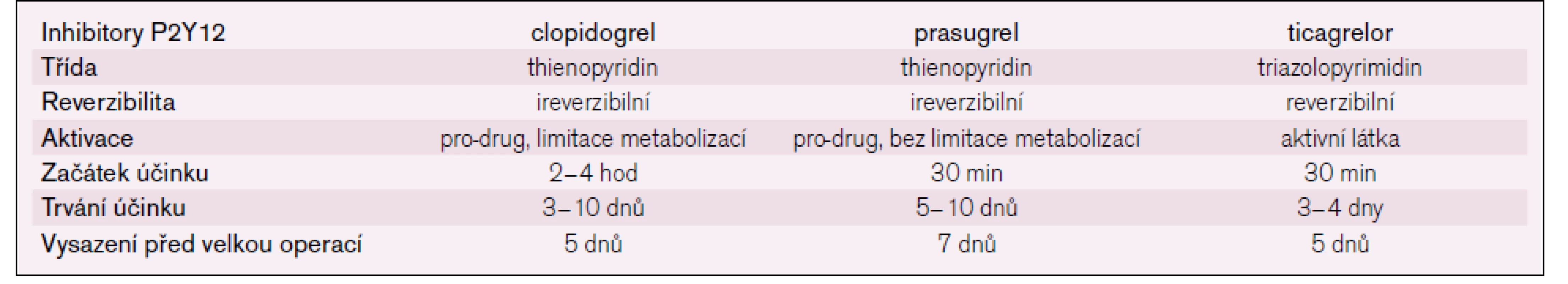
Prasugrel potřebuje rovněž dva metabolické kroky ke vzniku aktivního metabolitu. První krok probíhá cestou plazmatických esteráz, druhý krok v játrech je závislý na CYP. Ve srovnání s clopidogrelem má prasugrel rychlejší nástup a konzistentní inhibici destiček [12]. Ve studii TRITON-TIMI 38 byl srovnáván prasugrel v saturační dávce 60 mg následované udržovací dávkou 10 mg denně s clopidogrelem v 300 mg saturační a 75 mg udržovací dávce u nemocných s PCI pro STEMI nebo NSTE-AKS [13]. U NSTE-AKS byl kombinovaný ukazatel KV smrt/IM/CMP 11,2 % u clopidogrelové a 9,3 % u prasugrelové skupiny (HR 0,82; 95% CI 0,73–0,93; p = 0,002) s redukcí výskytu IM o 23,9 % (p < 0,001). V celém souboru byl v prasugrelové skupině o polovinu nižší výskyt trombózy ve stentu (1,1 % vs 2,4 %; p < 0,001), ale také vyšší riziko krvácení (2,4 % vs 1,8 %; HR 1,32; p = 0,03) včetně krvácení fatálního. Prasugrel byl škodlivější u nemocných po CMP/TIA a benefit nebyl prokázán u osob nad 75 let a u pacientů s hmotností pod 60 kg. Výrazné zlepšení prognózy bylo prokázáno u diabetiků bez zvýšení rizika krvácení.
Ticagrelor představuje novou chemickou skupinu s reverzibilní vazbou na P2Y12 receptory a poločasem 12 hod. Podobně jako prasugrel má rychlejší nástup účinku a konzistentnější efekt ve srovnání s clopidogrelem, ale navíc rychlejší odeznění účinku s úpravou funkce destiček [14]. Ve studii PLATO byli sledováni pacienti s NSTE-AKS se zvýšeným rizikem (plánovaní ke konzervativní nebo intervenční léčbě) nebo se STEMI plánovanými k primární PCI při podávání clopidogrelu v 300 mg saturační a 75 mg udržovací dávce ve srovnání s ticagrelorem v saturační dávce 180 mg a udržovací 2krát 90 mg denně [15]. U pacientů s PCI byla saturační dávka clopidogrelu zvýšena o dalších 300 mg a ticagreloru o 90 mg. V celém souboru byl kombinovaný ukazatel KV smrt//IM/CMP 11,7 % v clopidogrelové a 9,8 % v ticagrelorové skupině (HR 0,84; 95% CI 0,77–0,92; p < 0,001). V ticagrelorové skupině byla KV mortalita nižší o 21 % (5,1 % vs 4,0 %; p = 0,001), rovněž bylo méně trombóz ve stentu (1,9 % vs 1,3 %; p < 0,01) bez rozdílu ve výskytu CMP nebo závažného krvácení. U pacientů s následným CABG redukoval ticagrelor časnou i pozdní mortalitu bez zvýšeného rizika krvácení a je doporučeno jeho znovunasazení co nejdříve v bezpečném intervalu po operaci [16]. Výše uvedené závěry jsou podkladem pro doporučení Evropské kardiologické společnosti (European Society of Cardiology [ESC] guidelines) pro AA léčbu NSTE-AKS [17] (tab. 2).
Tab. 2. AA léčba u NSTE-AKS dle doporučení ESC. 
Protidestičková léčba u pacientů se STEMI
ASA tvoří základ léčby stejně jako u NSE-AKS.
Clopidogrel je preferován v saturační dávce 600 mg a udržovací 75 mg především u pacientů indikovaných k direktní PCI [18]. V současné době je primárně doporučován v případě, že účinnější destičkové inhibitory jsou kontraindikovány nebo jsou nedostupné.
Prasugrel ve studii TRITON-TIMI 38 prokazoval u pacientů se STEMI ještě výraznější benefit než u pacientů s NSTE-AKS [19]. Kombinovaný ukazatel KV smrt/IM/CMP byl 30. den v prasugrelové skupině 6,5 %, v clopidogrelové 9,5 % (HR 0,68; 95% CI 0,54–0,87; p = 0,0017), za 15 měsíců efekt přetrvával (10,0 % vs 12,4 %; HR 0,79; 95% CI 0,65–0,97; p = 0,0221). U pacientů bez CABG nebyl zaznamenán vyšší výskyt závažného nebo život ohrožujícího krvácení za 30 dní (p = 0,3359) ani za 15 měsíců (p = 0,6451).
Ticagrelor byl ve studii PLATO srovnáván s clopidogrelem u nemocných s plánovanou invazivní strategií (NSTE-AKS i STEMI). Kombinovaný ukazatel KV smrt/IM/CMP byl v jednom roce v clopidogrelové skupině 10,7 % a v ticagrelorové skupině 9,0 % (HR 0,84; 95% CI 0,75–0,94; p = 0,0025). Mezi oběma skupinami nebyl rozdíl v závažném krvácení [20].
Doporučená doba podávání duální AA je jeden rok u všech pacientů po PCI pro AKS (NSTE i STEMI) bez ohledu na použitý typ stentu [17,21]. Doporučení ESC a European Association for Cardio-Thoracic Surgery (EACTS) pro AA léčbu u pacientů s primární PCI pro STEMI rovněž vycházejí z výše uvedených studií [21] a jsou uvedeny v tab. 3.
Tab. 3. AA léčba u PCI při STEMI dle doporučení ESC/EACTS. 
Současné podávání inhibitorů protonové pumpy
Stále diskutovaným tématem je současné podávání destičkových inhibitorů a inhibitorů protonové pumpy (PPI), především omeprazolu. PPI inhibující CYP2C19 (hlavně omeprazol) snižují clopidogrelem indukovanou inhibici destiček in vitro. Randomizovaná studie testující omeprazol v kombinaci s clopidogrelem neprokázala zvýšenou četnost ischemických příhod při snížení výskytu krvácení z horního gastrointestinálního traktu, jednalo se ale o pacienty s nízkým rizikem [22]. Dle doporučení ESC je vhodnější omeprazol v kombinaci s clopidogrelem dle možností vynechat. Inhibitory PPI je doporučeno podat v kombinaci s duální AA léčbou u pacientů s anamnézou krvácení nebo vředu horního gastrointestinálního traktu, event. u rizikových faktorů, jako jsou např. Helicobacter pylori, věk ≥ 65 let, léčba antikoagulancii nebo steroidy (třída IA) [17]. Efekt prasugrelu není současným podáváním PPI ovlivněn [23]. Pochybnosti o negativním vlivu PPI na působení AA preparátů přináší studie PLATO [24]. Roční kombinovaný ukazatel byl horší u pacientů současně léčených PPI proti neléčeným jak ve skupině clopidogrelové (13,0 % vs 10,9 %), tak ticagrelorové (11,0 % vs 9,2 %). Pacienti léčení např. H2 blokátory měli stejné riziko jako pacienti léčení PPI. Vzhledem k tomu, že PPI neinterferují s metabolizmem ticagreloru, uzavírají autoři studie, že horší prognóza pacientů léčených PPI znamená, že se primárně jedná o pacienty s vysokým rizikem. Tito pacienti mají také vyšší riziko krvácení. Pokud by PPI interferovaly s metabolizmem clopidogrelu a ticagreloru, byl by očekáván nižší protidestičkový účinek a nižší četnost krvácení, ale skutečnost je opačná. Ve zdůvodněných případech je podle evropských i amerických doporučení současné podávání PPI a AA indikováno a prospěšné [17,25].
Plánovaný operační výkon
Většinu chirurgických výkonů je možno provést i při duální antiagregační terapii. U rizikovějších operací se doporučuje vysadit clopidogrel pět dnů, prasugrel sedm dnů a ticagrelor pět dnů před výkonem [17]. U vysoce rizikových pacientů s AKS, kde by vysazení duální AA léčby mohlo být nebezpečné, je jednou z možností převedení na nízkomolekulární heparin, dále je zvažováno podání inhibitorů destičkových receptorů IIb/IIIa s krátkým poločasem (tirofiban, eptifibatid). Další možností je překlenutí období do operace reverzibilním inhibitorem P2Y12 cangrelorem. Cangrelor je intravenózní, velmi krátce působící blokátor. Ve studii CHAMPION nebyl u AKS lepší v i. v. infuzi před PCI a 2 hod po PCI než nasycovací dávka clopidogrelu 600 mg [26] a jeho distribuce byla zastavena. U pacientů s AKS nebo po implantaci stentu, kteří čekali na CABG, prokázala studie BRIDGE výrazné snížení reaktivity destiček u cangreloru ve srovnání s placebem (98,9 % vs 19,0 %; RR 5,2; p = 0,001) při srovnatelném riziku krvácení při CABG (11,8 % vs 10,4 %; RR 1,1; p = 0,763) [27]. Cangrelor se v současné době jeví jako možný vhodný preparát k překlenutí období do operace (např. CABG), jeho dostupnost bude ujasněna na základně výsledku probíhající studie CHAMPION-PHOENIX srovnávající tento lék s clopidogrelem u pacientů s PCI jak u AKS, tak u výkonů elektivních.
Závěr
Prasugrel i ticagrelor vykazují rychlejší, účinnější a konstantnější efekt než clopidogrel a měly by jej u AKS nahradit. V současné době brání jejich širšímu použití podstatně vyšší cena. Současné podávání PPI je indikováno po zvážení poměru benefit/riziko. Cangrelor může být jednou z teoretických možností překlenutí intervalu mezi vysazením duální AA léčby a plánovanou operací po AKS.
Doručeno do redakce 20. 3. 2012
Přijato po recenzi 6. 4. 2012
MUDr. Roman Štípal, CSc.
I. interní klinika – kardiologická FN Olomouc
roman.stipal@fnol.cz
Zdroje
1. Théroux P, Ouimet H, McCans J et al. Aspirin, heparin, or both to treat acute unstable angina. N Engl J Med 1988; 319 : 1105–1111.
2. Théroux P, Waters D, Qui S et al. Aspirin versus heparin to prevent myocardial infarction during the acute phase of unstable angina. Circulation 1993; 88 : 2045–2048.
3. Antithrombotic Trialists‘ (ATT) Collaboration. Baigent C, Blackwell L, Collins R et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009; 373 : 1849–1860.
4. Mehta SR, Tanguay JF, Eikelboom JW et al. CURRENT-OASIS 7 trial investigators. Double--dose versus standard-dose clopidogrel and high--dose versus low-dose aspirin in individuals undergoing percutaneous coronary intervention for acute coronary syndromes (CURRENT-OASIS 7): a randomised factorial trial. Lancet 2010; 376 : 1233–1243.
5. Gislason GH, Jacobsen R, Rasmussen JN et al. Risk of death or reinfarction associated with the use of selective cyclooxygenase-2 inhibitors and non--selective nonsteroid antiinflamatory drugs after acute myocardial infarction. Circulation 2006; 113 : 2906–2913.
6. Yusuf S, Zhao F, Mehta SR et al. Clopidogrel in Unstable Angina to Prevent Recurrent Events Trial Investigators. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med 2001; 345 : 494–502.
7. Ho PM, Peterson ED, Wang L et al. Incidence of death and acute myocardial infarction associated with stopping clopidogrel after acute coronary syndrome. JAMA 2008; 299 : 532–539.
8. Fox KA, Mehta SR, Peters R et al. Clopidogrel in Unstable angina to prevent Recurrent ischemic Events Trial. Benefits and risks of the combination of clopidogrel and aspirin in patients undergoing surgical revascularization for non-ST-elevation acute coronary syndrome: the Clopidogrel in Unstable angina to prevent Recurrent ischemic Events (CURE) Trial. Circulation 2004; 110 : 1202–1208.
9. Snoep JD, Hovens MM, Eikenboom JC et al. Clopidogrel nonresponsiveness in patients undergoing percutaneous coronary intervention with stenting: a systematic review and meta-analysis. Am Heart J 2007; 154 : 221–231.
10. CURRENT-OASIS 7 Investigators. Mehta SR, Bassand JP, Chrolavicius S et al. Dose comparisons of clopidogrel and aspirin in acute coronary syndromes. N Engl J Med 2010; 363 : 930–942.
11. Taubert D, von Beckerath N, Grimberg G et al. Impact of P-glycoprotein on clopidogrel absorption. Clin Pharmacol Ther 2006; 80 : 486–501.
12. Wiviott SD, Trenk D, Frelinger AL et al. PRINCIPLE-TIMI 44 Investigators. Prasugrel compared with high loading - and maintenance-dose clopidogrel in patients with planned percutaneous coronary intervention: the Prasugrel in Comparison to Clopidogrel for Inhibition of Platelet Activation and Aggregation Thrombolysis in Myocardial Infarction 44 Trial. Circulation 2007; 116 : 2923–2932.
13. Wiviott SD, Braunwald E, McCabe C et al. TRITON-TIMI 38 Investigators. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357 : 2001–2015.
14. Gurbel PA, Blinden KP, Butler K et al. Randomized double-blind assessment of the ONSET and OFFSet of the antiplatelet effects of ticagrelor versus clopidogrel in patients with stable coronary artery disease: the ONSET/OFFSET Study. Circulation 2009; 120 : 2577–2585.
15. Wallentin L, Becker RC, Budaj A et al. PLATO Investigators. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361 : 1045–1057.
16. Held C, Asenblad N, Bassand JP et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes undergoing coronary artery bypass surgery results from the PLATO (Platelet Inhibition and Patient Outcomes) Trial. J Am Coll Cardiol 2011; 57 : 672–684.
17. Hamm CW, Bassand JP, Agewall S et al. ESC Committee for Practice Guidelines. ESC guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2011; 32 : 2999–3054.
18. Van de Werf F, Bax J, Betriu A et al. ESC Committee for Practice Guidelines (CPG). Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation: the Task Force on the Management of ST-Segment Elevation Acute Myocardial Infarction of the European Society of Cardiology. Eur Heart J 2008; 29 : 2909–2945.
19. Montalescot G, Wiviott SD, Braunwald E et al. TRITON-TIMI 38 investigators. Prasugrel compared with clopidogrel in patients undergoing percutaneous coronary intervention for ST-elevation myocardial infarction (TRITON-TIMI 38): double-blind, randomised controlled trial. Lancet 2009; 373 : 723–731.
20. Cannon CP, Harrington RA, James S et al. PLATelet inhibition and patient Outcomes Investigators. Comparison of ticagrelor with clopidogrel in patients with a planned invasive strategy for acute coronary syndromes (PLATO): a randomised double-blind study. Lancet 2010; 375 : 283–293.
21. Wijns W, Kolh P, Danchin N et al. Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS); European Association for Percutaneous Cardiovascular Interventions (EAPCI). Guidelines on myocardial revascularization. Eur Heart J 2010; 31 : 2501–2555.
22. Bhatt DL, Cryer BL, Contant CF et al. COGENT Investigators. Clopidogrel with or without omeprazole in coronary artery disease. N Engl J Med 2010; 363 : 1909–1917.
23. Small DS, Farid NA, Payne CD et al. Effects of the proton pump inhibitor lansoprazole on the pharmacokinetics and pharmacodynamics of the prasugrel and clopidogrel. J Clin Pharmacol 2008; 48 : 475–484.
24. Goodman SG, Clare R, Pieper KS et al. Platelet Inhibition and Patient Outcomes (PLATO) Trial Investigators. Association of proton pump inhibitor use on cardiovascular outcomes with clopidogrel and ticagrelor: insights from the platelet inhibition and patient outcomes trial. Circulation 2012; 125 : 978–986.
25. Abraham NS, Hlatky MA, Antman EM et al. ACCF/ACG/AHA. ACCF/ACG/AHA 2010 expert consensus document on the concomitant use of proton pump inhibitors and thienopyridines: a focused update of the ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use. A Report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents. J Am Coll Cardiol 2010; 56 : 2051–2066.
26. Harrington RA, Stone GW, McNulty S et al. Platelet inhibition with cangrelor in patients undergoing PCI. N Engl J Med 2009; 361 : 2318–2329.
27. Angiolillo DJ, Firstenberg MS, Price MJ et al. BRIDGE Investigators. Bridging antiplatelet therapy with cangrelor in patients undergiong cardiac surgery: a randomized controlled trial. JAMA 2012; 307 : 265–274.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2012 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Kam se ubírá současný vývoj léků ovlivňujících krevní srážení?
- Vorapaxar v klinických studiích
- Čo je vernakalant a kde je jeho miesto v klinickej praxi?
- Eprosartan – duální blokátor AT1 receptorů
- Polypragmazie a oběhové selhání při maligních komorových arytmiích s postižením jaterních funkcí
- Pacientka po transplantaci srdce s plicní formou invazivní aspergilózy
- Galerie autorů
- Máme dnes k dispozici lepší antitrombotika?
- Antiagregační a antikoagulační léčba – základní principy
- Perorální protidestičková léčba u pacientů s akutním koronárním syndromem
- Současné doporučení k antiagregační léčbě v neurologii
- Antikoagulační terapie a fibrilace síní
- Nová perorální antitrombotika v prevenci a léčbě trombembolizmu
- Nová antitrombotika v prevenci pooperační tromboembolické nemoci
- Současné možnosti monitorování antitrombotické léčby – nová antitrombotika
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Antiagregační a antikoagulační léčba – základní principy
- Antikoagulační terapie a fibrilace síní
- Kam se ubírá současný vývoj léků ovlivňujících krevní srážení?
- Současné doporučení k antiagregační léčbě v neurologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



