-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Antiagregační a antikoagulační léčba – základní principy
Antiaggregating and anticoagulant therapy – basic principles
Thrombosis and thrombembolism takes very important place in medicine, because they appears to the most important cause of morbidity and mortality of the patients at all. Thrombembolic events can be of different provenience and of different types and it is possible to meet them in all the regions of the medicine. It is not surprising, that new drugs are developing for long time to affect and prevent of thrombembolic complications more and more effectively. That is also because the concentrating effort is underline by this fact, that the problem is mainly the problem of developed part of the world, where the research has all the assumption to pay appropriate attention. New drugs are developed, new possibilities of their monitoring and new algorithms – all in context with lot of studies, which are to this problem dedicated.
Keywords:
thrombosis – antithrombotics – antiaggregating drugs
Autoři: M. Penka
Působiště autorů: OKH FN Brno
Vyšlo v časopise: Kardiol Rev Int Med 2012, 14(2): 63-67
Souhrn
Trombóza a embolie zaujímají v medicíně významné místo, protože patří k nejvýznamnějším příčinám morbidity a mortality nemocných. Mohou být různého původu a různého typu a setkáme se s nimi ve všech oblastech medicíny. Není proto divu, že se dlouhodobě vyvíjejí léky k jejich ovlivnění a předcházení. Je tomu tak i proto, že jsou ke zmíněnému úsilí předpoklady dány i okolností, že je tromboembolická nemoc problémem především vyspělejší části světa, kde je možné výzkumu věnovat patřičnou pozornost. Tak se vyvíjejí nové léky, nové možnosti podchycení jejich účinku, nové algoritmy a vše na základě řady studií, které jsou danému problému věnovány.
Klíčová slova:
trombóza – antitrombotika – antiagreganciaÚvod
Tromboembolická nemoc je stále jednou z nejvýznamnějších příčin morbidity a mortality vyspělejší části světa. Jedná se o klinickou problematiku vzniku cévních uzávěrů, ať již jde o tepenné nebo žilní příhody. Tepny a žíly mají odlišnou stavbu cévní stěny, odlišný způsob proudění krve i odlišnou strukturu trombů v nich vznikajících [1].
Zatímco v tepnách se u trombózy jedná především o poškození cévní stěny ateromatózním procesem, v němž se uplatňuje vedle dominantní role lipidů i složka zánětu a porucha primární hemostázy – tedy destičkového systému, v žilním systému jde především o jednotlivé procesy geniálně sumarizované a vyjádřené Virchowem v jeho postulované trias – o poruchu cévní stěny, stázu krve a poruchu koagulace či lépe plazmatické koagulace [2].
Zmíněné okolnosti jsou dnes velmi podrobně studovány a výsledkem využití těchto poznatků je i sofistikovaná a odpovídajícím způsobem stratifikovaná léčba [3].
Tam, kde se jedná o dominantní účast krevních destiček, přináleží přirozeně hlavní postavení v léčbě protidestičkovým (antiagregačním) lékům, ale tam, kde je dominantním procesem plazmatická koagulace, mají svoje místo antikoagulancia či antitrombotika. Tyto poslední dva názvy se užívají někdy jako synonyma, jindy vyjadřují odlišnost v tom smyslu, že antikoagulancia snižují koagulační potenciál a zamezují přeměně fibrinogenu na fibrin, zatímco antitrombotika tuto přeměnu jen omezují vlivem na množství vznikajícího trombinu. V některých pramenech jsou za antitrombotickou léčbu považována protidestičková opatření.
Protidestičková medikace – léčba a profylaxe tepenné trombózy
Mezi protidestičkové léky patří řada látek, které mohou ovlivňovat různé fáze procesu primární hemostázy – od adheze až po vytvoření agregátu krevních destiček i s jeho následnou retrakcí.
K základním lékům již historicky patří inhibitory cyklooxygenázy-1 (COX-1) a nejvýznamnějším lékem této skupiny je stále kyselina acetylsalicylová (acetylsalicylic acid – ASA) [4]. Inhibice COX-1 (ať ireverzibilní po podání ASA nebo reverzibilní po podání nesteroidních antiflogistik – např. indobufenu) ovlivňuje agregaci krevních destiček velmi výrazně regulací produkce především antiagregačních látek (tromboxan A2 – TXA2). Působením jiných látek se zase ovlivňuje množství cyklického adenozinmonofosfátu (cAMP), jehož zvýšená hladina vede k ovlivnění transmisní funkce kalciových iontů a tím i k antiagregačnímu efektu. K zamezení odbourávání cAMP vedou látky blokující fosfodiesterázu, k nimž patří např. dipyridamol. Později se prosadila také skupina thyenopyridinů, které vedou k blokádě ADP indukované agregace a tvoří a rozvíjejí novou generaci protidestičkových látek. K ní lze přiřadit ještě některé další látky specificky ovlivňující adhezivitu či agregabilitu destiček, jejichž přehled poskytuje tab. 1. Významnou je možnost jejich vzájemné kombinace (zejm. za specifických okolností užití např. stentů, plastických výkonů na cévách apod.). Výjimečné nejsou ani kombinace protidestičkových léků spolu s antikoagulancii. Vše se odvíjí od klinických studií, kterých právě v daném směru velmi přibývá a jsou podkladem zkušeností, o něž se opíráme v indikaci léčby či prevence trombózy.
Tab. 1. Přehled protidestičkových léků. 
Co je dosud ne zcela uspokojivě vyřešeným problémem, je absence možnosti běžného sledování léčby, resp. úprava jejího dávkování podle výsledků laboratorního nálezu. Existují sice testy odhalující poruchy krevních destiček a některé z nich dokonce byly koncipovány ke sledování antiagregační léčby, do rutinního použití se ale nedostaly. Jedná se zde především o vyšetření agregability, resp. agregace krevních destiček – spontánní nebo indukované (ADP, kolagenem, adrenalinem, trombinem, kyselinou arachidonovou) na agregometru metodou dle Borna. Tato metoda je značně choulostivá na manipulaci s destičkami. Naději poskytovala z hlediska sledování antiagregační léčby ASA indukce agregace kationickým propylgalátem, ale nakonec se neprojevila ani tato metoda k danému účelu jako příliš vhodná. Lepší by z hlediska zmíněného účelu mohla být PFA-100 analýza, při níž se jedná o sledování uzavření měřené štěrbiny po indukci ADP s kolagenem nebo ADP s adrenalinem v přístroji, který odráží zejména schopnost shlukování krevních destiček, a jedná se vlastně do laboratorních podmínek transponovanou dobu krvácení, která je v původní koncepci nestandardizované metody takřka opuštěná. Nyní se objevují nové metody – jako je např. Multiplate-analysis nebo Verify Now (Aspirin Test, P2Y12 Test, IIb/III Test) či VASP index (vasodilator-stimulated phosphoprotein phosphorylation analysis). Žádný ze zmíněných testů dosud nicméně nepřinesl možnost rutinního rozšíření ke shora zmíněnému účelu [5].
Podobně jako není jednoduché sledování účinnosti protidestičkových léků, není ani snadné zajistit léčbu krvácivých komplikací v souvislosti s jejich podáváním. Krvácení nemusí být vždy důsledkem podávaní antiagregancia, ale tato souvislost je při jeho podávání přinejmenším pravděpodobná. Krvácení z destičkových příčin obecně – tedy v důsledku poruchy primární hemostázy – mají většinou charakter povrchových – kožních či slizničních projevů, objevujících se časně po poranění, úrazu nebo intervenci. Jejich klinický charakter je tedy přinejmenším sugestivní, ale destičkový původ krvácení je třeba potvrdit i laboratorně.
V léčbě krvácivých komplikací lze použít látky zlepšující interakci cévní stěny a destičky, jako jsou např. etamsylát, dobesilát. Tyto léky mají svou účinnost v tišení povrchových krvácení a mají navíc tu výhodu, že nejsou trombogenní, ale ani přes tuto výhodu si nevysloužily větší pozornost studií a jejich podávání je spíše doplňkové. V případě větších krvácení v důsledku účinku antiagregancií je proto běžným způsobem jejich léčby podávání koncentrátů krevních destiček nebo nespecifická opatření – od možnosti podávání antifibrinolytik až po podání rekombinantního aktivovaného faktoru VII (rFVIIa).
Možnosti antiagregační terapie se stále rozrůstají a jak již bylo zmíněno, máme k dispozici další generace inhibitorů ADP P2Y12 [6] indukované agregace destiček (ze skupiny thienopyridinů prasugrel a non-thienopyridinů cangrelor, ticagrelor), antagonisty glykoproteinu IIb/IIIa (abciximab, eptifibatid, tirofiban) a objevují se nové možnosti ovlivnění primární hemostázy s pomocí inhibice trombinu v indukci destičkové agregace (PAR antagonisté – vorapaxar a atopaxar) [5]. I zde však poněkud v pozadí stojí možnosti laboratorní detekce účinku léku, jeho sledování a možnosti zvrácení jeho účinku v případě krvácivých projevů.
Protisrážlivá medikace – léčba a profylaxe žilní trombózy
V žilním systému dochází ke tvorbě trombů, jejichž hlavní strukturální součástí je fibrin, proto jsou také zásadní preventivní či léčebná opatření zaměřena na ovlivnění plazmatické koagulace [7]. Jedním z prvních léků, které byly v tomto směru k dispozici, byl heparin (viz vývojový diagram na obr. 1). Dalším významným krokem bylo z hlediska širší klinické praxe uvedení antivitaminů K – kumarinových preparátů, které v původní koncepci zůstávají stále dominantním způsobem ambulantní léčby, zatímco heparin se v původní – nefrakcionované podobě užívá dnes stále méně. Je nahrazován nízkomolekulárními hepariny (low molecular weight heparin – LMWH), které mimo jiné také umožňují přesun vybraných nemocných do domácí léčby [8]. Ale už i LMWH jsou v některých indikacích vytlačovány synteticky vyráběnými pentasacharidy, které jsou koncentrátem nejvýznamnější strukturální funkční součásti heparinů – pentasacharidové části molekuly. Právě v závislosti na odlišném počtu pentasacharidových struktur se od sebe liší nefrakcionované a nízkomolekulární hepariny ve svém účinku [9]. Zatímco k léčbě nefrakcionovaným heparinem použijeme k běžnému sledování terapeutické odpovědi APTT, ke sledování účinku nízkomolekulárních heparinů je nutno provádět vyšetření anti-Xa aktivity kalibrované pro daný typ LMWH.
Obr. 1. Vývoj antitrombotik. 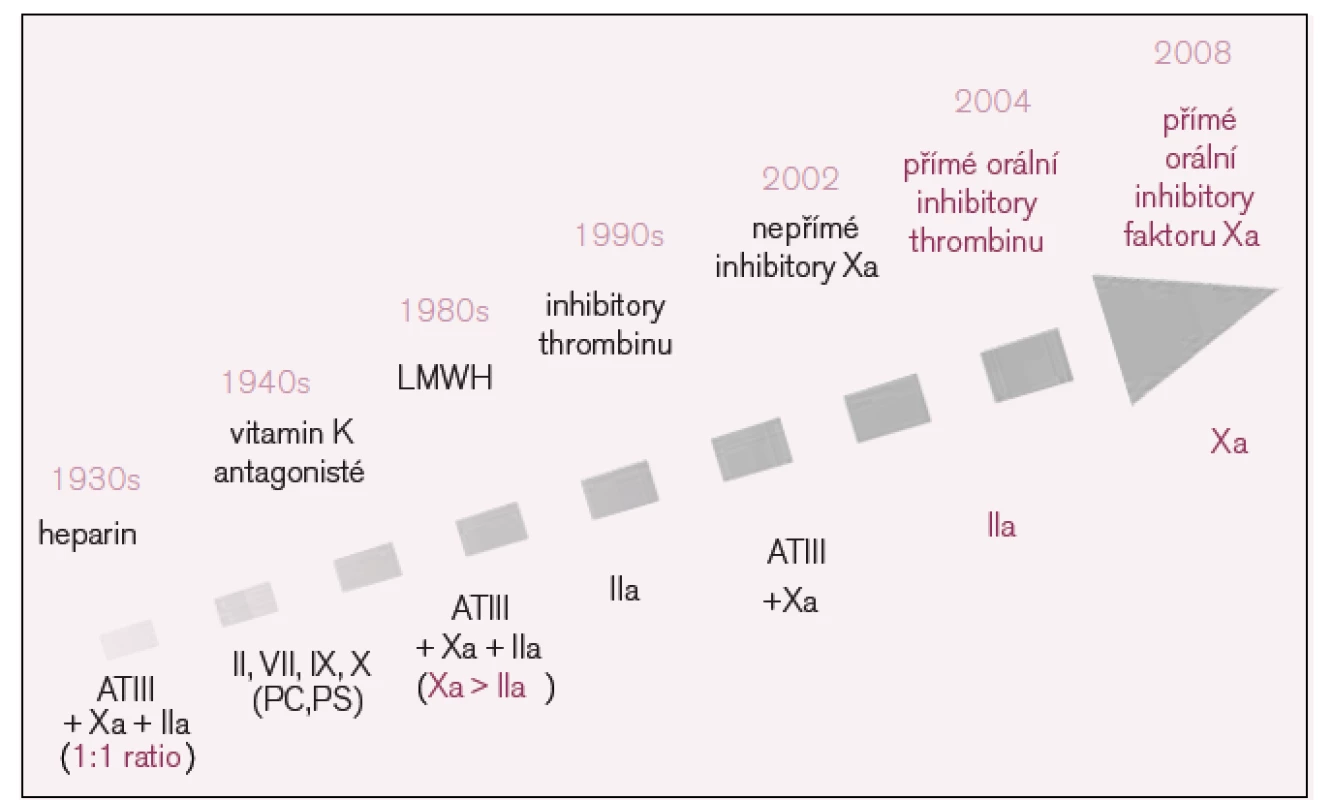
LMWH – low molecular weight heparin, AT – antitrombin, a – aktivovaný faktor X, PC – protein C, PS – protein S. Jako antidotum lze u nefrakcionovaného heparinu užít protamin (ekvivalentem 1 mg je 100 jednotek heparinu), pro neutralizaci účinku LMWH ideálním prostředkem protamin však není. Je přitom obtížněji nastavitelné odpovídající dávkování protaminu.
U kumarinových preparátů je pro sledování účinnosti vyvinut standardizovaný test, a to protrombinový čas dle Quicka vyjadřovaný v INR s rozpětím účinné hodnoty testu laboratorní kontroly mezi 2,0 a 3,0 [10]. INR je nejen standardizovaným způsobem vyjádření, ale standardizace je v daném případě adjustována přímo pro nemocné na antikoagulační léčbě kumariny. Antidotem kumarinů je vitamin K, ten se však namnoze nadužívá a tam, kde byl podán k neutralizaci účinku kumarinů (zvláště ve vysoké dávce) a je třeba následně obnovit jejich antikoagulační účinek, jej může časově dlouhodobě blokovat. Dnes se proto doporučuje tam, kde je jeho podání skutečně indikováno, nepřesahovat dávku 5 mg za 24 hod. Výjimkou vyžadující vysoké a dlouhodobé dávkování (nitrožilního) vitaminu K jsou otravy tzv. superkumariny – krysími jedy.
Nová antitrombotika
Z důvodu požadavku selektivního účinku, vyšší účinnosti, pohodlnějšího podávání a zároveň i v souvislosti s respektováním požadavku zvýšení bezpečnosti léčby se hledají stále další možnosti. V posledních letech asi největší pozornost přitahují perorální přímé inhibitory trombinu a faktoru Xa [11]. Jedná se o další skupiny léků, které přinášejí výhody, jež by měly naplňovat požadavky kladené na „ideální antitrombotikum“, a to: perorální podávání bez nutnosti monitorace, resp. úpravy dávky dle laboratorní kontroly při širokém farmakoterapeutickém oknu, bez interference s léky a potravinovými složkami. Vše navíc v únosné cenové kategorii.
V důsledku využití současných poznatků o procesech krevního srážení se ukazuje jako velmi účinné zasáhnout na úrovni klíčových míst plazmatické koagulace a k nim v každém případě patří přeměna protrombinu (FII) na trombin (FIIa) vlivem účinku tzv. protrombinázy, jejímž základním prvkem je aktivovaný faktor X plazmatického systému krevního srážení (FXa), a dále přímo při přeměně fibrinogenu na fibrin vlivem proteolytického účinku trombinu (viz obr. 2). Nepřekvapí proto, že je vývoj nových antitrombotik, jak již bylo řečeno, zaměřen především na faktory IIa a Xa.
Obr. 2. Schéma koagulace v s vyznačením místa účinku nových antitrombotik. 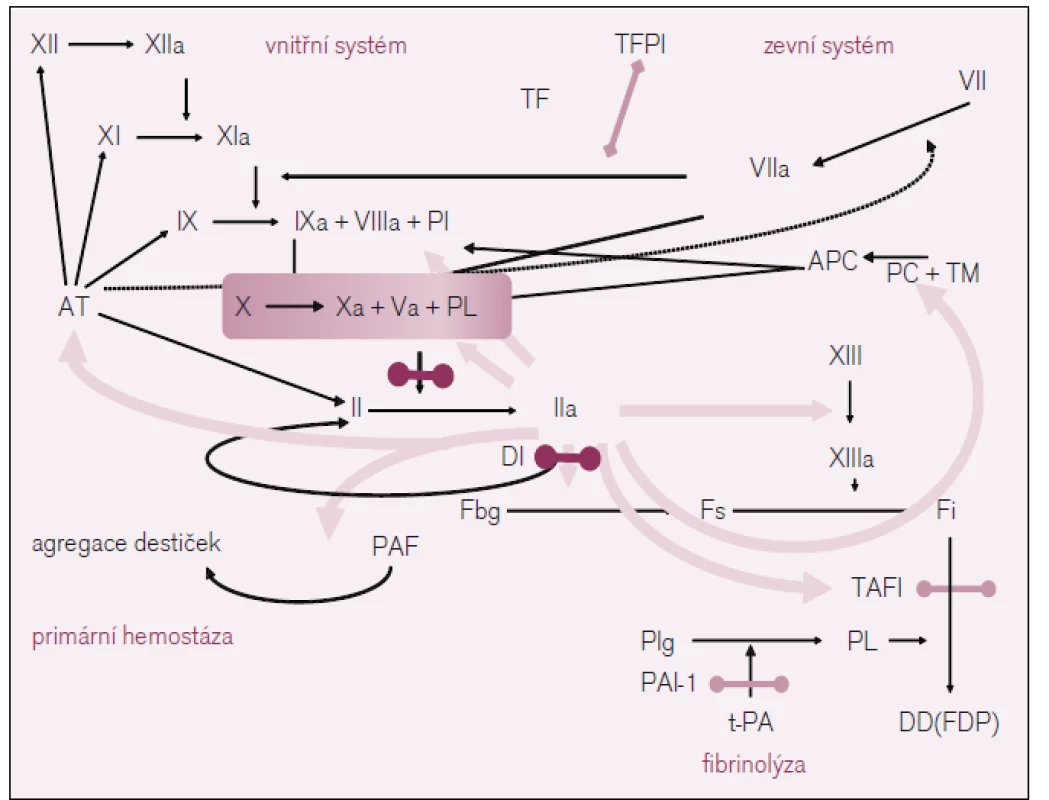
XII – faktor XII plazmatického systému krevního srážení, TF – tkáňový faktor, TFPI – inhibitor tkáňového faktoru, PC – protein C, APC – aktivovaný protein C, TM – trombomodulin, Fbg – fibrinogen, Fs – solubilní fibrin, Fi – insolubilní fibrin, PL – fosfolipid, Plg – plazminogen, Pl – plazmin, t-PA – tkáňový aktivátor plazminogenu, PAI – inhibitor aktivátoru plazminogenu, PAF – destičky aktivující faktor, TAFI – trombinem aktivovaná inhibice fibrinolýzy, DD – D-dimery. Z přímých inhibitorů trombinu je nejvýznamnějším preparátem dabigatran etexilát, který je registrován k prevenci tromboembolické nemoci (TEN) u pacientů po implantacích totální endoprotézy kyčle a kolenního kloubu a u vybraných nemocných s fibrilací síní v prevenci cévních mozkových příhod.
Ze skupiny inhibitorů aktivovaného faktoru X (anti-Xa) [12] jsou t. č. k dispozici dva preparáty – rivaroxaban a apixaban, které skýtají obdobné naděje, jež provázejí i přímé inhibitory trombinu; u rivaroxabanu je registrována i indikace k léčbě hluboké žilní trombózy [13]. Další léky probíhají studiemi fáze 2 (např. edoxaban) – viz tab. 2.
Tab. 2. Přehled nových antikoagulancií/antitrombotik. 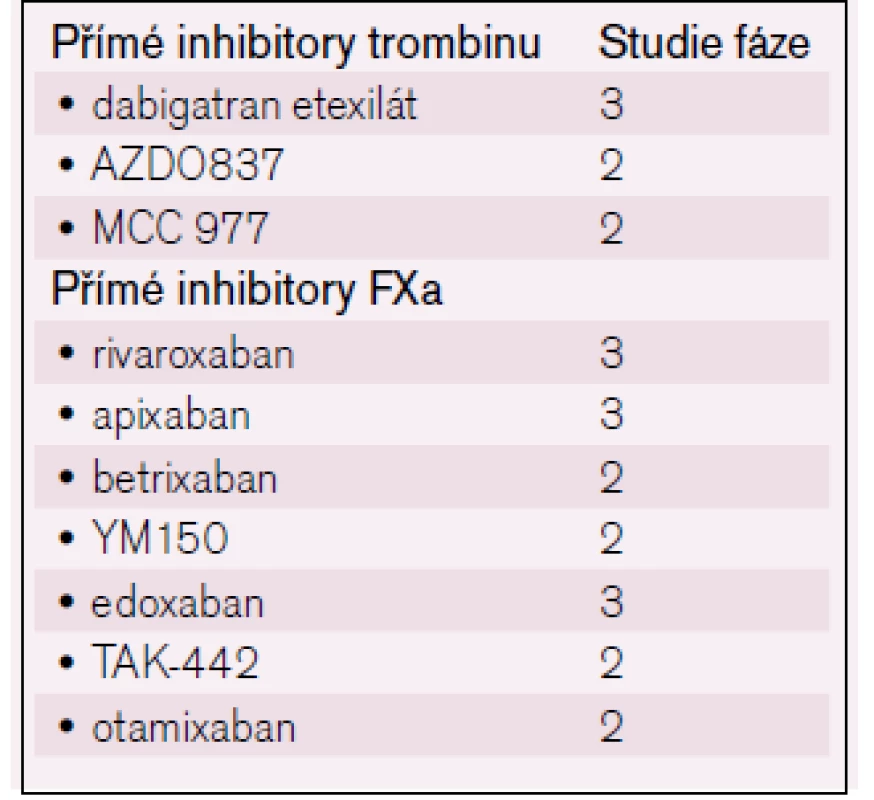
V případě nových antitrombotik řešíme (podobně jako bylo zmíněno výše v souvislosti s antitrombocytárními léky) problém laboratorního sledování, resp. možnosti úpravy dávky léku v závislosti na laboratorním ukazateli a také léčbu krvácivých projevů, pokud k nim dojde.
Sledování účinku nových antitrombotik
Přesto, že je postulovanou výhodou nových antitrombotik to, že nemusejí být monitorována [14], může být možnost sledování výhodou přispívající k řešení některých (méně obvyklých) situací; proto existuje snaha vyvinout pro případ potřeby systémy jejich kontroly.
Zatímco u nefrakcionovaného heparinu lze užít ke sledování jeho účinku APTT a u nízkomolekulárních heparinů a pentasacharidů anti-Xa aktivity, ke sledování účinku nových antitrombotik, i když dochází k prodlužování dosud běžně používaných koagulačních časů, se dle dosavadních poznatků soubor běžně dostupných testů příliš nehodí. Je přitom zaznamenáváno lineární prodlužování koagulačních časů v závislosti na dávce léku, ale testy nejsou v mnoha případech standardizované a neodrážejí skutečnou biologickou účinnost léčby. Některé z testů (jako např. ekarinový srážecí test) nejsou zase běžně dostupné [15]. Jistou výhodu přinášejí nově vyvíjené testovací soupravy (např. Hemoclot pro sledování účinku přímých inhibitorů trombinu a Rotachrom Heparin ke sledování účinku přímých inibitorů FXa), kde je zajištěna standardizace i odpovídající citlivost testovacího setu.
Léčba krvácení provázejících nová antitrombotika
Co se týče řešení krvácivých komplikací v souvislosti s podáváním nových antitrombotik, využívá se substituční léčby, která má zvýšit úroveň faktorů plazmatického systému, jež jsou inhibovány léčbou, nebo posílit alternativní mechanizmy koagulace a fibrinolýzy. Podáváme tedy plazmatické deriváty, antifibrinolytika (především kyselinu tranexamovou), u závažných krvácení případně i aktivované koncentráty protrombinového komplexu (APCC) nebo rekombinantní aktivovaný faktor VII (rFVIIa). Studovány jsou i možnosti podání aktivovaného faktoru X nebo mutované molekuly antitrombinu [16].
Kombinace protisrážlivých léků
Jak kombinovat léky podávané v rámci prevence, je vždy dáno především tím, zda se jedná o kombinaci protidestičkových léků samotných nebo spolu s antitrombotiky/antikoagulancii. Kombinace protidestičkových léků navzájem je využívána za účelem zvýšení účinnosti léčby s vědomím jejich rozdílného mechanizmu účinku. Tím se dosahuje zesílení nebo rozšíření účinku inhibice primární hemostázy a daný způsob léčby je zaměřen na řešení tepenných afekcí. Běžně je podávána kombinace kyseliny acetylsalicylové s thienopyridinovými nebo ne-thienopyridinovými blokátory ADP indukované agregace. Většinou se jedná o dva preparáty, a hovoříme tak o duální terapii.
U nemocných s fibrilací síní je kombinováno podávání warfarinu s protidestičkovou monoterapií nebo duální terapií. Součinnou terapií se v těchto případech snažíme zajistit prevenci tepenné i žilní trombózy, neboť trombus v oušku má vlastnosti žilního trombu, a tak prevenci tromboembolických mozkových příhod u nemocných s fibrilací síní zajišťujeme antikoagulační léčbou [17].
Manipulace s antitrombotiky v případě potřeby
U pacientů, kteří se mají podrobit chirurgickým výkonům a jsou dlouhodobě léčeni protidestičkovými léky, řešíme mnohdy problém, zda protidestičkovou léčbu vysadit nebo v ní pokračovat. Dalším dilematem je, zda k této léčbě je možné nebo vhodné přidat antitrombotikum z důvodu požadavku antitrombotické prevence žilního tromboembolizmu (venous thrombembolism – VTE) za přítomnosti rizikových faktorů VTE nebo zda antitrombotikem vůbec předchozí léčbu protidestičkovými léky nahradit.
V naprosté většině se nedoporučuje vysazovat protidestičkovou léčbu, zvláště pak tehdy, je-li primárně indikována ze závažných důvodů a může-li být třeba i jen přechodné vysazení provázeno vysokým rizikem vzniku či recidivy trombotických komplikací [18]. Ke snížení rizika krvácení můžeme u nemocných, u kterých protidestičkovou léčbu skutečně vysadit nezamýšlíme, snížit dávku protidestičkového léku (za event. kontroly vyšetření PFA-100). V některých případech je možno ordinovat ke snížení rizika kapilárního či kožního a slizničního krvácení provázejícího protidestičkovou léčbu etamsylát.
Z hlediska antitrombotické profylaxe VTE lze ordinovat u nemocných na protidestičkové léčbě jako souběžnou medikaci nízkomolekulární hepariny v profylaktické dávce odpovídající míře rizika žilního tromboembolizmu, méně často volíme jiné opatření, které by mohlo být adekvátní běžně zavedeným standardním režimům (např. namísto LMWH pentasacharidy, nová perorální antitrombotika). Případný převod na warfarin, je-li nutná další léčba – např. z důvodu pokračování profylaxe, provádíme skutečně velmi opatrně a se zabezpečením všech odpovídajících opatření.
Obecně se k zajištění antitrombotické profylaxe u nemocných v případě nutnosti provedení chirurgické intervence používají t. č. nejvíce nízkomolekulární hepariny, které mohou být dostatečným zajištěním profylaxe žilní tromboembolické příhody, méně již dostatečnou profylaxí vzniku tepenné trombotické komplikace. Ani zde tedy nejsou LMWH dostatečnou náhradou protidestičkové léčby.
Závěrečné poznámky
Za určitých specifických situací využíváme ještě četnější kombinace, než jak bylo zmíněno shora. Na tomto místě je nutno zmínit trombolytickou léčbu, u níž navazuje podávání heparinu a po nich warfarinu a/nebo protidestičkových léků s jejich překrýváním v určité fázi léčby.
Rozličných situací v souvislosti s podáváním protisrážlivých léků může být celá řada, je však nutné, aby byla léčba cílená a cílevědomá. Je důležité, abychom vždy byli schopni provést laboratorní kontrolu, která posoudí přinejmenším globální stav krevního srážení a zároveň poskytne případnou alternativu léčby krvácivých komplikací [19].
Z hlediska diagnostiky se dostávají do popředí opět globální metody sledování procesů krevního srážení – tromboelastografie (TEG) a trombin generační test (TGA) a z hlediska léčby nespecifická (antifibrinolytika – především kyselina tranexamová) nebo univerzální léčebná hemostyptická opatření (rFVIIa, koncentráty faktorů protrombinového komplexu).
Opatření zajišťující v současné době profylaxi a léčbu tromboembolických onemocnění získávají řadu nových směrů, možností a zdokonalení. V souvislosti s tím řešíme ovšem také mnoho nových a specifičtějších problémů.
Předchozí zmínky slouží především jako úvod pro následující články, které poskytují široké pojetí antitrombotických opatření, k nimž lze dnes sáhnout.
Doručeno do redakce 16. 4. 2012
Přijato po recenzi 23. 4. 2012
prof. MUDr. Miroslav Penka, CSc.
OKH FN Brno
m.penka@fnbrno.cz
Zdroje
1. Furie B, Furie BC. Mechanisms of trombus formation. N Engl J Med 2008; 359 : 938–949.
2. Turpie AG, Esmon C. Venous and arterial thrombosis – pathogenesis and the rationale for anticoagulation. Thromb Haemost 2011; 105 : 586–596.
3. Kvasnička J. Trombofilie a trombotické stavy v klinické praxi. Praha: Grada - Avicenum 2003 : 13–299.
4. Gross M, Greenberg LA. The Salicylates: a critical bibliographic review. New Heaven: Hillhouse Press 1948.
5. Ji X, Hou M. Novel agent for anti-platelet therapy. J Hematol Oncol 2011; 4 : 3–7.
6. Iyú D, Glenn JR, White AE et al. Mode of action of P2Y(12) antagonists as inhibitor of platelet function. Tromb Haemost 2011; 105 : 96–106.
7. López JA, Kearon C, Lee AY. Deep venous thrombosis. Hematology Am Soc Hematom Educ Program 2004 : 439–456.
8. Widimský J, Malý J. Akutní plicní embolie a žilní trombóza. Praha: Triton 2002; 7–303.
9. Mackman N. Triggers, targets and tretaments for thrombosis. Nature 2008; 451 : 914–918.
10. Kessler P. Léčba orálními antikoagulancii. Praha: Orion-Pharma Oyj 2002 : 1–64.
11. Gross PL, Weitz JI. New antithrombotic drugs. Clin Pharmacol Ther 2009; 86 : 139–146.
12. Perzborn E. Factor Xa inhibitors – new anticoagulants for secondary haemostasis. Hamostaseologie 2009; 29 : 260–267.
13. Gross PL, Weitz JI. New anticoagulants for treatment of venous thromboembolism. Aterioscler Thromb Vasc Biol 2008; 28 : 380–386.
14. Bounameaux H, Reber G. New oral antithrombotics: a need for laboratory monitoring. Against. J Thromb Haemost 2010; 8 : 627–630.
15. Penka M, Gumulec J, Buliková A et al. Monitorování perorální antikoaulační léčby v ambulantní praxi. Kardiol Rev 2007; 9 : 159–164.
16. Eerenberg ES, Kamphuisen PW, Sijpkens MK et al. Reversal of rivaroxaban and dabigatran by prothrombin complex concentrate: a randomized, placebo-controlled, crossover study in healthy subjects. Circulation 2011; 124 : 1573–1579.
17. Watson T, Shantsila E, Lip GY. Mechanisms of thrombogenesis in atrial fibrilation: Virchow’s triad revisited. Lancet 2009; 373 : 155–166.
18. Antithrombotic and thrombolytic therapy. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th ed). Chest 2008; 133 : 67–968.
19. Fukuda T, Honda Y, Kamisato C et al. Reversal of anticoagulant effects of edoxaban, an oral, direct factor Xa inhibitor, with haemostatic agents. Thromb Haemost 2012; 107 : 253–259.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2012 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Kam se ubírá současný vývoj léků ovlivňujících krevní srážení?
- Vorapaxar v klinických studiích
- Čo je vernakalant a kde je jeho miesto v klinickej praxi?
- Eprosartan – duální blokátor AT1 receptorů
- Polypragmazie a oběhové selhání při maligních komorových arytmiích s postižením jaterních funkcí
- Pacientka po transplantaci srdce s plicní formou invazivní aspergilózy
- Galerie autorů
- Máme dnes k dispozici lepší antitrombotika?
- Antiagregační a antikoagulační léčba – základní principy
- Perorální protidestičková léčba u pacientů s akutním koronárním syndromem
- Současné doporučení k antiagregační léčbě v neurologii
- Antikoagulační terapie a fibrilace síní
- Nová perorální antitrombotika v prevenci a léčbě trombembolizmu
- Nová antitrombotika v prevenci pooperační tromboembolické nemoci
- Současné možnosti monitorování antitrombotické léčby – nová antitrombotika
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Antiagregační a antikoagulační léčba – základní principy
- Antikoagulační terapie a fibrilace síní
- Kam se ubírá současný vývoj léků ovlivňujících krevní srážení?
- Současné doporučení k antiagregační léčbě v neurologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



